Ébauche d’évaluation préalable groupe des cétones
Titre officiel : Ébauche d’évaluation préalable groupe des cétones
Numéros de registre du Chemical Abstracts Service
78-93-3, 107-87-9, 108-10-1, 110-12-3, 123-42-2, 513-86-0, 123-54-6, 431-03-8, 600-14-6, 141-79-7
Environnement et Changement climatique Canada Santé Canada
Janvier 2019
Sommaire
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE), la ministre de l’Environnement et la ministre de la Santé ont réalisé l’évaluation préalable de dix substances formant le groupe des cétones. Les substances de ce groupe ont été jugées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou suscitent d’autres préoccupations pour la santé humaine. Le tableau ci-dessous énumère le numéro de registre du Chemical Abstracts ServiceNote de bas de page 1 (NR CAS) de ces substances, leur nom sur la Liste intérieure des substances (LIS) ainsi que leurs noms communs et abréviations.
NR CAS |
Sous-groupe |
Nom dans la Liste intérieure des substances |
Nom commun (acronyme) |
|---|---|---|---|
78-93-3 |
1 |
2-butanone |
éthyl méthyl cétone (MEK) |
107-87-9 |
1 |
pentan-2-one |
méthyl propyl cétone (MPK) |
108-10-1 |
2 |
4-méthylpentan-2-one |
méthyl isobutyl cétone (MIBK) |
110-12-3 |
2 |
5-méthylexan-2-one |
méthyl isoamyl cétone (MIAK) |
123-42-2 |
2 |
4-hydroxy-4-méthylpentan-2-one |
alcool de diacétone |
431-03-8 |
3 |
butanedione |
diacétyle |
513-86-0 |
3 |
acétoïne |
acétoïne |
600-14-6 a |
3 |
pentane-2,3-dione |
2,3-pentanedione (2,3‑PD) |
123-54-6 a |
séparé |
pentane-2,4-dione |
2,4-pentanedione (2,4‑PD) |
141-79-7 |
séparé |
4-méthylpent-3-én-2-one |
oxyde de mésityle |
a Cette substance n’a pas été désignée en vertu du paragraphe 73(1) de la LCPE, mais est visée par la présente évaluation, car elle est considérée d’intérêt prioritaire en raison d’autres inquiétudes pour la santé humaine.
Les dix substances du groupe des cétones sont produites commercialement et se retrouvent aussi naturellement dans l’environnement dans diverses plantes ou denrées alimentaires ou, encore, sont produites par des microbes ou d’autres organismes. Différentes cétones sont aussi produites de manière endogène par les humains, notamment la MEK, le diacétyle et acétoïne. On a détecté de la MEK, de la MPK et de la MIBK dans le lait maternel. Selon les renseignements recueillis lors d’enquêtes menées en vertu de l’article 71 de la LCPE, seuls l’alcool de diacétone (à raison de 23 000 kg) et la 2,3 PD (à raison 1200 kg) ont été synthétisés au Canada en 2011. Les importations déclarées de ces cétones au Canada se situaient entre 100 kg (pour l’acétoïne) et 6 000 000 kg (pour la MEK) en 2011. Pour la même année, au Canada, on n’a déclaré aucune activité de fabrication ou d’importation d’oxyde de mésityle dépassant le seuil de 100 kg.
En général, on utilise surtout les cétones comme solvants dans différents produits, dont des produits offerts aux consommateurs, comme les peintures, les revêtements et les adhésifs, ainsi que pour plusieurs applications industrielles, notamment comme produits intermédiaires et solvants. On peut aussi les utiliser comme agents aromatisants d’aliments dans les cosmetiques et formulants dans des produits antiparasitaires.
Les risques pour l’environnement posés par les substances du groupe des cétones ont été caractérisés à l’aide de la Classification du risque écologique des substances organiques (CRE). La CRE est une méthode de classification des risques qui tient compte de plusieurs paramètres liés au risque et à l’exposition et utilise une pondération des éléments de preuve pour catégoriser le risque. Les profils de danger sont principalement basés sur des paramètres comme le mode d’action toxique, la réactivité chimique, les seuils de toxicité internes dérivés du réseau trophique, la biodisponibilité et l’activité biologique et chimique. Les paramètres pris en compte pour dresser les profils d’exposition sont la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. À l’aide d’une matrice des risques, on assigne un niveau de préoccupation – faible, modéré ou élevé – aux substances en fonction de leur profil de danger et d’exposition. La CRE a permis d’établir que les dix substances visées par la présente évaluation présentent un risque faible d’être nocives pour l’environnement.
Compte tenu de tous les éléments de preuve avancés dans cette ébauche d’évaluation préalable, la MEK, la MPK, la MIBK, la MIAK, l’alcool de diacétone, le diacétyle, l’acétoïne, la 2,3 PD, la 2,4 PD et l’oxyde de mésityle présentent un faible risque d’être nocifs pour l’environnement. Nous proposons de conclure que la MEK, la MPK, la MIBK, la MIAK, l’alcool de diacétone, le diacétyle, l’acétoïne, la 2,3 PD, la 2,4 PD et l’oxyde de mésityle ne satisfont à aucun des critères énoncés aux alinéas 64a) ou 64b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ni dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement nécessaire à la vie.
Certaines de ces cétones ont fait l’objet d’examens par des organismes internationaux. Dans cette évaluation préalable, nous avons utilisé les résultats de ces examens et évaluations pour éclairer la caractérisation des effets sur la santé.
Pour estimer les risques pour la santé humaine, nous avons réparti huit des substances de ce groupe en trois sous-groupes et avons évalué séparément les deux dernières. Dans le cas des effets critiques sur la santé du sous-groupe 1, la MEK a des effets sur le développement, et la MEK et la MPK diminuent la prise de poids corporel. La population générale du Canada est exposée à la MEK et à la MPK présents dans l’air et des denrées alimentaires (présence surtout naturelle), et présents dans des produits offerts aux consommateurs, notamment dans le cas de la MEK, des cosmétiques, des peintures et des produits de bricolages et, dans le cas de la MPK, dans des produits de peinture. Une comparaison entre les concentrations de MEK et MPK auxquels les Canadiens pourraient être exposés dans les milieux environnementaux et les aliments et les concentrations associées à des effets nocifs dans les études de laboratoire produit des marges considérées comme adéquates pour compenser les incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques. Nous considérons toutefois que les marges entre l’exposition à la MEK dans certains produits offerts aux consommateurs (nommément des décapants de laques et d’adhésifs, des produits de peinture et des ciments ou apprêts à PVC) et les concentrations donnant des effets critiques sur la santé pourraient ne pas compenser les incertitudes des données sur l’exposition utilisées pour caractériser les risques. Considérant la faible toxicité aiguë de la MPK et l’absence d’effets de l’inhalation sur le développement, il n’existe pas d’inquiétude relative à la présence de la MPK dans des produits offerts aux consommateurs.
Dans le cas du sous-groupe 2 (la MIBK, la MIAK et l’alcool de diacétone), le Centre international de recherche sur le cancer (CIRC) considère que la MIBK se range dans le groupe 2B (cancérogène humain probable), étant donné les « données probantes suffisantes » de cancérogénicité chez les animaux de laboratoire. En ce qui concerne les effets non cancérogènes, des effets sur le foie et les reins, ainsi que des effets sur le développement, ont été observés lors d’études en laboratoire. La population générale du Canada pourrait être exposée à la MIBK, à la MIAK et à l’alcool de diacétone à partir des milieux environnementaux et les aliments (surtout à cause de leur présence naturelle) et par l’utilisation de produits offerts aux consommateurs, notamment les cosmétiques, les stylos-feutres, les peintures et les produits de bricolage. La comparaison entre les concentrations estimées de l’exposition à la MIAK et à l’alcool de diacétone et les concentrations associées à des effets critiques produisent des marges que l’on considère comme adéquates pour compenser les incertitudes des données sur l’exposition et la santé utilisées pour caractériser les risques. Toutefois, dans le cas de la MIBK, nous considérons que les marges résultantes associées à l’utilisation de divers produits de peinture et de laques pour bois pourraient être inadéquates.
Dans le cas du sous-groupe 3 (diacétyle, 2,3 PD et acétoïne), des études de laboratoire ont déterminé que le diacétyle était cancérigène. On a aussi observé des effets non cancéreux, notamment les effets du diacétyle sur les voies respiratoires. La population générale du Canada est principalement exposée au diacétyle, à la 2,3 PD et à l’acétoïne par les aliments (en raison de leur présence naturelle et de leur utilisation comme agent aromatisant), ainsi qu’au diacétyle et à la 2,3 PD à partir de l’utilisation d’un nombre réduit de produits offerts aux consommateurs, respectivement des cosmétiques et des assainisseurs d’air. La comparaison entre les concentrations estimées de l’exposition au diacétyle, à la 2,3 PD et à l’acétoïne et les concentrations associées à des effets critiques produit des marges considérées comme adéquates pour compenser les incertitudes des données sur les expositions de la santé utilisées pour caractériser les risques. Les informations disponibles sur les effets de la 2,4 PD sur la santé indiquent une toxicité systémique générale et des effets sur le développement. On a montré que la 2,4 PD avait un potentiel de génotoxicité, mais on ne s’attend pas à ce qu’il soit cancérogène. La population générale du Canada peut être exposée à la 2,4 PD par l’alimentation (présence naturelle) et l’utilisation d’un nombre réduit de produits offerts aux consommateurs, notamment des revêtements spéciaux. Les marges pour les concentrations de 2,4 PD dans les aliments sont considérées comme adéquates. La comparaison entre les concentrations estimées d’exposition à la 2,4 PD découlant de l’application d’un revêtement sur une grande surface (comme celle d’une remorque ou d’un bateau) et les concentrations associées à des effets critiques produit des marges considérées comme étant potentiellement inadéquates pour compenser les incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Les Canadiens pourraient être exposés à l’oxyde de mésityle présent dans l’air et les aliments. On ne s’attend pas à ce que l’oxyde de mésityle soit cancérigène ou génotoxique. Des études de laboratoire ont associé une toxicité systémique générale à l’exposition à l’oxyde de mésityle. La comparaison des concentrations estimées de l’exposition à l’oxyde de mésityle occasionnée par les milieux environnementaux et les aliments et les niveaux d’effets critiques produit des marges qui sont considérées comme étant adéquates pour compenser les incertitudes des données sur l’exposition et les effets sur la santé utilisées pour caractériser les risques.
Donc, à la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la MEK, la MIBK et la 2,4 PD satisfont au critère énoncé à l’alinéa 64c) de la LCPE, car ils pénètrent dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Toutefois, il est proposé de conclure que la MPK, la MIAK, l’alcool de diacétone, le diacétyle, la 2,3 PD, l’acétoïne et l’oxyde de mésityle ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est proposé de conclure que la MEK, la MIBK et la 2,4 PD satisfont à un ou à plusieurs des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que la MPK, la MIAK, l’alcool de diacétone, le diacétyle, la 2,3 PD, l’acétoïne et l’oxyde de mésityle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que la MEK et la 2,4 PD satisfont au critère de persistance, mais non à celui de la bioaccumulation, tels qu’énoncés dans le Règlement sur la persistance et la bioaccumulation en application de la LCPE.
Il est proposé de conclure que la MIBK ne répond pas aux critères de persistance et de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 et 74 de la Loi canadienne sur la protection de l’environnement, 1999 (LCPE) [Canada, 1999], la ministre de l’Environnement et la ministre de la Santé ont réalisé l’évaluation préalable de dix substances formant le groupe des cétones, afin de déterminer si lesdites substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Ces substances ont été désignées d’intérêt prioritaire pour une évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou ont été déclarées d’intérêt prioritaire en raison d’autres préoccupations pour la santé humaine (ECCC et SC [modifié en 2017]).
Les risques posés à l’environnement par les substances du groupe des cétones ont été caractérisés à l’aide de la Classification du risque écologique des substances organiques (CRE) [ECCC, 2016a]. La CRE décrit les dangers occasionnés par une substance à l’aide de paramètres clés, y compris le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne obtenus à partir du réseau trophique, la biodisponibilité, ainsi que l’activité chimique et biologique, et elle tient compte de l’exposition possible des organismes dans les milieux aquatique et terrestre, en fonction de facteurs comme les taux d’émission potentiels, la persistance globale et le potentiel de transport sur de grandes distances dans l’atmosphère. Les divers éléments de preuve sont combinés afin de déterminer quelles substances nécessitent une évaluation plus poussée de leur potentiel d’effets nocifs sur l’environnement ou présentant une faible probabilité de tels effets.
Certaines substances sont évaluées en sous-groupe, en raison des similitudes de leur structure chimique, de leurs propriétés ou de leur toxicité. Étant donné que ces substances ont potentiellement des utilisations et d’applications semblables, nous avons évalué les risques potentiels pour la santé humaine en posant des hypothèses d’exposition similaires pour l’ensemble du groupe.
Certaines des substances du groupe des cétones en cours d’évaluation ont été examinées au palier international dans le cadre du Programme coopératif d’évaluation des produits chimiques de l’Organisation pour la coopération et le développement économiques (OCDE). Les évaluations de l’OCDE sont soumises à un examen rigoureux (notamment par des pairs) et à des processus d’approbation par des autorités gouvernementales internationales. Santé Canada et Environnement et Changement climatique Canada participent activement à ces processus et considèrent que leurs résultats sont fiables. Certaines des substances ont également été étudiées par le Programme international sur la sécurité des substances chimiques (PISSS), l’Agence de protection environnementale des États-Unis (EPA des É.‑U.), le Centre international de recherche sur le cancer (CIRC) et le National Toxicology Program (NTP) des États-Unis. Les études effectuées par ces institutions servent à étayer la caractérisation des effets sur la santé de la présente évaluation préalable.
Dans la présente ébauche d’évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et l’exposition, ainsi que d’autres renseignements présentés par les parties intéressées. Nous avons retrouvé des données pertinentes publiées jusqu’en avril 2017. D’autres renseignements ont été reçus jusqu’en septembre 2017. Les données empiriques obtenues d’études clés tout comme certains résultats issus de modèles ont servi à formuler les conclusions proposées. Lorsqu’ils étaient disponibles et pertinents, nous avons utilisé les renseignements contenus dans les évaluations effectuées par d’autres instances.
Le diacétyle, la 2,3‑PD et l’acétoïne ont été détectés en quantités mesurables dans les produits de vapotage. Les produits de vapotage (également connus sous le nom de cigarettes électroniques) peuvent représenter une source d’exposition supplémentaire à ces substances. L’évaluation des risques pour la population générale découlant de cette utilisation, y compris le risque par rapport à celui associé aux cigarettes traditionnelles, et les options possibles pour atténuer les risques associés à ces produits, est prise en charge par un cadre législatif et réglementaire distinct.
La présente ébauche d’évaluation préalable a été rédigée par le personnel du Programme d’évaluation des risques de la LCPE travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle inclut des contributions d’autres programmes de ces deux ministères. Les parties de la présente évaluation portant sur la santé humaine ont fait l’objet d’un examen ou de consultations externes. Des commentaires sur les parties techniques traitant de la santé humaine ont été reçus de la part de Theresa Lopez, de Jennifer Flippin et de Joan Garey (TetraTech Inc.), et de D.L. Morgan (National Toxicology Program, National Institute of Environmental Health Sciences, États-Unis). Le volet de la présente évaluation portant sur l’environnement repose sur le document de la CRE (publié le 30 juillet 2016) qui a fait l’objet d’une évaluation externe par des pairs et d’une période de consultation publique de 60 jours. Santé Canada et Environnement et Changement climatique Canada ont tenu compte de ces observations externes, mais ces ministères assument l’entière responsabilité du contenu définitif et des conclusions de la présente évaluation préalable.
La présente ébauche d’évaluation préalable repose sur des informations essentielles pour déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des informations scientifiques ont été examinées et une approche basée sur une pondération des éléments de preuve et le principe de précaution a été adoptée.Note de bas de page 2 La présente ébauche d’évaluation préalable présente les données critiques et les considérations sur lesquelles reposent les conclusions proposées.
2. Identité des substances
Les dix substances étudiées dans la présente évaluation préalable sont des cétones, c’est-à-dire qu’elles ont la structure générale montrée à la figure 1. Dans cette évaluation nous avons réparti huit cétones en trois sous-groupes en fonction de leur formule chimique, de leurs propriétés ou de leurs toxicités. Les deux substances restantes ont été évaluées séparément.

Figure 1. Formule générale des cétones
Le tableau 2 énumère les numéros de registre du Chemical Abstracts Service (NR CASNote de bas de page 3 ), les noms inscrits sur la Liste intérieure des substances (LIS), ainsi que les noms communs ou les acronymes des substances individuelles du groupe des cétones sont présentés dans ta1. Une liste d’autres noms chimiques (p. ex. noms commerciaux) est disponible auprès du National Chemical Inventories (NCI 2015).
Sous-groupe |
NR CAS |
Nom sur la LIS (nom commun ou acronyme) |
Structure chimique et formule moléculaire |
Masse moléculaire (g/mol) |
|---|---|---|---|---|
1 |
78-93-3 |
2-butanone (éthyl méthyl cétone; MEK) |
 |
72,11 |
1 |
107-87-9 |
pentan-2-one (méthyl propyl cétone; MPK) |
 |
86,13 |
2 |
108-10-1 |
4-méthylpentan-2-one (méthyl isobutyl cétone; MIBK) |
 |
100,16 |
2 |
110-12-3 |
5-méthylexan-2-one (méthyl isoamyl cétone; MIAK) |
 |
114,19 |
2 |
123-42-2 |
4-hydroxy-4-méthylpentan-2-one (alcol de diacétone-alcoo) |
 |
116,16 |
3 |
431-03-8 |
butanedione (diacétyle) |
 |
86,09 |
3 |
600-14-6 |
pentane-2,3-dione (2,3‑PD) |
 |
100,12 |
3 |
513-86-0 |
acétoïne (acétoïne) |
 |
88,11 |
séparé |
123-54-6 |
Pentane-2,4-dione (2,4‑PD) |
 |
100,12 |
séparé |
141-79-7 |
4-méthylpent-3-én-2-one (oxyde de mésityle) |
 |
98,14 |
2.1 Sélection des analogues et utilisation des modèles (Q)SAR
Une démarche de lecture croisée fondée sur des substances analogues et les résultats de modèle de relations (quantitatives) structure-activité (QSAR), le cas échéant, Les analogues choisis ont une structure ou une fonctionnalité similaire aux substances de ce groupe (toxicocinétique et propriétés physico-chimiques similaires) et nous avons pour eux des données empiriques pertinentes utilisables pour une lecture croisée visant des substances pour lesquelles nous disposions de peu de données empiriques quant aux effets sur la santé. On trouvera dans les sections pertinentes du présent rapport de plus amples détails sur les données croisées utilisées pour étayer les évaluations des effets sur la santé humaine de chaque sous-groupe et substances séparées. Le tableau 2-2 donne des renseignements l’identité et la structure chimique des analogues utilisés pour éclairer la présente évaluation. L’applicabilité des modèles (Q)SAR a été déterminée au cas par cas.
Sous-groupe ou substance en cours d’évaluation |
NR CAS | Nom sur la LIS ou autre nom (nom commun ou acronyme) |
Structure chimique et formule moléculaire |
Masse moléculaire (g/mol) |
|---|---|---|---|---|
Sous-groupe 1 |
78-92-2 |
2‑butanol |  |
74,1 |
oxyde de mésityle |
110-93-0 |
6-méthyl-5-heptén-2-one (MHE) |
 |
126,2 |
3. Propriétés physiques et chimiques
Un résumé des propriétés physiques et chimiques des substances du groupe des cétones est présenté dans les tableaux 3‑1 à 3-4. ECCC (2016b) contient des renseignements supplémentaires sur les propriétés physiques et chimiques.
Propriété |
MEK |
MPK |
Référence |
|---|---|---|---|
État physique |
Liquide incolore |
Liquide incolore |
HSDB |
Point de fusion (°C) |
-85,9 |
-76,9 |
OCDE, 1997a; ChemIDplus, 1993- |
Pression de vapeur (Pa) |
10 332 |
4720 |
OCDE, 1997a; ChemIDplus, 1993- |
Constante de la loi d’Henry (Pa m3/mol) |
5,85 |
8,47 |
ATSDR, 1992; ChemIDplus, 1993- |
Hydrosolubilité (mg/L) |
276 000 |
43 000 |
OCDE, 1997a; ChemIDplus, 1993- |
log Koe (sans dimension) |
0,29 |
0,91 |
OCDE, 1997a; ChemIDplus, 1993- |
log Kco (sans dimension) |
0,55 |
1,87 [estimation] |
ATSDR 1992; HSDB, 1983- |
Abréviations : Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique–eau
Propriété |
MIBK |
MIAK |
alcool de diacétone |
Référence |
|---|---|---|---|---|
État physique |
Liquide incolore |
Liquide incolore, clair |
Liquide incolore |
OCDE, 1996; HSDB 1983- |
Point de fusion (°C) |
-84,7 |
-74 |
-44 |
OCDE, 1996; ChemIDplus, 1993- |
Pression de vapeur (Pa) |
2653 |
769 |
228 |
ChemIDplus, 1993- |
Constante de la loi d’Henry (Pa m3/mol) |
14,0 [estimation] |
16,2 [estimation] |
0,026 [estimation] |
ChemIDplus, 1993- |
Hydrosolubilité (mg/L) |
19 000 |
5400 |
1 000 000 |
ChemIDplus, 1993- |
log Koe (sans dimension) |
1,31 |
1,88 |
-0,34 [estimation] |
ChemIDplus, 1993- |
log Kco (sans dimension) |
2,08 [estimation] |
2,40 [estimation] |
1,32 [estimation] |
HSDB 1983- |
Abréviations : Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique–eau
Propriété |
Diacétyle |
2,3‑PD |
Acétoïne |
Référence |
|---|---|---|---|---|
État physique |
Liquide vert-jaune |
Liquide jaune foncé à jaune verdâtre |
Liquide jaunâtre ou cristaux |
HSDB, 1983-; CDC, 2016 |
Point de fusion (°C) |
-2,40 |
-29,38 [estimation] |
15,0 |
ChemIDplus 1993-; EPI Suite |
Pression de vapeur (Pa) |
7572 |
4146 [estimation] |
359 [estimation] |
ChemIDplus 1993-; EPI Suite |
Constante de la loi d’Henry (Pa m3/mol) |
1,35 |
0,674 [estimation] |
1,04 [estimation] |
ChemIDplus 1993-; EPI Suite |
Hydrosolubilité (mg/L) |
200 000 |
66 700 (à 15 oC) |
1 000 000 |
ChemIDplus1993- |
log Koe (sans dimension) |
-1,34 |
-0,85 [estimation] |
-0,36 [estimation] |
ChemIDplus, 1993- |
log Kco (sans dimension) |
-0,28 [estimation] |
-0,004 [estimation] |
0,3 [estimation] |
EPI Suite; HSDB 1983- |
Abréviations : Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique–eau
Propriété |
2,4‑PD |
oxyde de mésityle |
Référence |
|---|---|---|---|
État physique |
Liquide incolore ou jaunâtre |
Liquide huileux, incolore à jaune pâle |
HSDB, 1983- |
Point de fusion (°C) |
-23,0 |
-59,0 |
ChemIDplus, 1993- |
Pression de vapeur (Pa) |
395 |
1095 |
ChemIDplus, 1993- |
Constante de la loi d’Henry (Pa m3/mol) |
0,238 [estimation] |
3,72 [estimation] |
ChemIDplus, 1993- |
Hydrosolubilité (mg/L) |
166 000 |
28 900 |
ChemIDplus, 1993- |
log Koe (sans dimension) |
De 0,34 à 0,4 |
De 1,2 à 1,7 |
ChemIDplus 1993-; OCDE, 2001; OCDE, 1997b |
log Kco (sans dimension) |
1,54 [estimation] |
1,04 |
EPI Suite; OCDE 1997b |
Abréviations : Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique–eau
4. Sources et utilisations
Toutes les dix substances dans le groupe des cétones sont naturellement présentes dans l’environnement, dans différentes plantes ou produits alimentaires, ou sont produites par des microbes ou d’autres organismes, mais elles peuvent aussi être produites synthétiquement (Burdock, 2010; VCCEP, 2003; O’Donoghue, 2012a,b). La MEK, le diacétyle et l’acétoïne sont également produits par l’humain de manière endogène (VCCEP, 2003; OMS, 1999a; NTP, 2007a).
Hormis la MEK, toutes les substances dans le groupe des cétones ont été visées par une enquête récente réalisée en vertu de l’article 71 de la LCPE (Environnement Canada, 2012). En 2001, la méthyl éthyl cétone a été visé par une enquête en vertu de l’article 71 de la LCPE. Les quantités fabriquées de MEK déclarées pour 2000 tombent entre 1 million et 10 millions de kg; toutefois, la fabrication de cette substance a cessé au Canada en 2002 (Environnement Canada, 2001). Les quantités de MEK importées au Canada déclarées pour 2000 étaient supérieures à 10 millions de kg. Selon la base de données du Commerce international canadien de marchandises (CICM), entre 2011 et 2016, les importations moyennes annuelles de MEK au Canada étaient d’environ 4,9 millions de kg (CICM, 2017). Le tableau 4‑1 résume les quantités déclarées totales des substances du groupe des cétones fabriquées et importées au Canada.
Nom commun |
Quantité totale fabriquéea (kg) | Importations totalesa (kg) |
|---|---|---|
MEK |
- |
6 042 865 (en 2011; CICM) |
MPK |
- |
1 097 844 |
MIBK |
- |
1 241 783 |
MIAK |
- |
35 906 |
Alcool de diacétone |
23 000 |
265 529 |
Diacétyle |
- |
1430 |
2,3‑PD |
1200 |
- |
Acétoïne |
- |
De 100 à 1000 |
2,4‑PD |
- |
De 100 000 à 1 000 000 |
oxyde de mésityle |
- |
- |
a Les valeurs correspondent aux quantités divulguées en réponse aux enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada, 2012), à l’exception de la MEK. Référez-vous à l’enquête pour en connaître les inclusions et exclusions particulières (annexes 2 et 3).
Le tableau 4‑2 résume les principales utilisations des substances du groupe des cétones d’après l’information communiquée dans le cadre des enquêtes menées en vertu de l’article 71 de la LCPE (Environnement Canada, 2001 et 2013) Le tableau 4‑3 donne d’autres utilisations signalées au Canada.
Principales utilisations |
Sous-groupe 1a |
Sous-groupe 2 |
Sous-groupe 3 |
Individuel |
|---|---|---|---|---|
Peintures et revêtements |
MEK, MPK |
MIBK, MIAK, alcool de diacétone |
s.o. |
2,4‑PD |
Aliments et boissons |
s.o. |
s.o. |
2,3‑PD, acétoïne |
s.o. |
Produits manufacturés, mélanges ou produits pour l’agriculture (autres que les pesticides) |
MEK |
s.o. |
Diacétyle |
s.o. |
Adhésifs et produits d’étanchéité |
MEK, MPK |
(MIBK, alcool de diacétone) |
s.o. |
2,4‑PD |
Encre, toner et colorants |
MEK, MPK |
(MIBK, alcool de diacétone) |
s.o. |
s.o. |
Automobiles, aéronefs et transports |
MEK, MPK |
(MIBK, alcool de diacétone) |
s.o. |
s.o. |
Matériaux en plastique et en caoutchouc qui ne sont pas mentionnés ailleurs |
s.o. |
MIBK |
s.o. |
2,4‑PD |
Appareils électriques et électroniques |
s.o. |
(MIBK, alcool de diacétone) |
s.o. |
s.o. |
Revêtements de sol |
MEK |
MIBK |
s.o. |
s.o. |
Nettoyage et entretien de mobilier |
MEK |
alcool de diacétone |
s.o. |
s.o. |
Soins personnels |
s.o. |
alcool de diacétone |
2,3‑PD, acétoïne |
s.o. |
Jouets, terrains de jeux et équipements sportifs |
s.o. |
alcool de diacétone |
s.o. |
s.o. |
Autresb |
MEK, MPK |
(MIBK, alcool de diacétone) |
Diacétyle |
s.o. |
Abréviations : s.o. = sans objet.
a Les résultats concernant la MEK proviennent d’utilisations en 2000 et pourraient n’être plus pertinents.
b La catégorie « autres » fait référence aux utilisations mineures ou aux utilisations qui ne peuvent pas être divulguées en raison de demandes de confidentialité.
Utilisation |
Sous-groupe 1 |
Sous-groupe 2 |
Sous-groupe 3 |
Individuel |
|---|---|---|---|---|
Additif alimentairea |
MEK |
N |
N |
N |
Matériaux d’emballage alimentaire a |
MEK, MPK |
(MIBK, alcool de diacétone) |
N |
2,4‑PD |
Additif indirecta |
MEK |
N |
N |
N |
Base de données interne sur les produits pharmaceutiques, présents comme ingrédient médicinal ou non médicinal dans les désinfectants ou dans les médicaments destinés aux humains ou aux animaux au Canadab |
N |
N |
N |
N |
Base de données sur les ingrédients des produits de santé naturelsc |
MEK, MPK |
(MIBK, alcool de diacétone) |
Diacétyle, acétoïne, 2,3‑PD |
Oxyde de mésityle |
Base de données sur les produits de santé naturels homologués comme ingrédient médicinal ou non médicinal présent dans des produits de santé naturels au Canadad |
MEK |
MIBK |
N |
N |
Liste des ingrédients dont l’utilisation est restreinte ou interdite dans les cosmétiquese |
N |
N |
N |
N |
Présence signalée dans les cosmétiques selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiquesf |
MEK |
alcool de diacétone |
N |
N |
Produit de formulation dans des produits antiparasitaires homologués au Canadag |
MEK |
MIBK, MIAK, alcool de diacétone |
Diacétyle, acétoïne, 2,3‑PD |
N |
Abréviation : N = Non
a Communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyé le 18 août 2016; source non citée
b BDPP [modifié en 2016]; communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyé le 3 août 2016; source non citée
c BDIPSN [modifié en 2018]
d BDPSNH (modifiée en 2018)
e Santé Canada [modifié en 2015a]
f Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyés les 5 et 8 août 2016; source non citée
g Communication personnelle, courriel de l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyé le 28 juillet 2016; source non citée
En général, les cétones servent surtout de solvants dans divers produits, y compris des produits offerts aux consommateurs, et sont utilisées par dans un certain nombre d’applications industrielles à titre notamment d’intermédiaires chimiques et de solvants (O’Donoghue, 2012a,b, Kirk-Othmer). La MEK est inscrite comme additif alimentaire autorisé dans des extraits naturels et des extraits d’épices, comme l’indique la Liste des solvants de support ou d’extraction autorisés de Santé Canada, incorporé par renvoi dans son autorisation de mise en marché respective émise en vertu de la Loi sur les aliments et drogues. La MEK, la MPK, la MIBK, l’alcool de diacétone et la 2,4‑PD peuvent être intégrés aux matériaux d’emballage de produits alimentaires sans contact avec les aliments. La MEK est également utilisée comme solvant dans des nettoyants sans contact avec les aliments de l’industrie alimentaire. De plus, on a signalé que sept des cétones du groupe étaient possiblement utilisées comme agents aromatisants dans les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyé le 18 août 2016; source non citée).
La MEK et la MIBK figurent dans la ligne directrice du Conseil international pour l’harmonisation des exigences techniques relatives aux produits pharmaceutiques à usage humain à titre de solvants résiduels de classe 3 (solvants ayant un faible potentiel de toxicité) utilisés dans la fabrication de produits pharmaceutiques. Il est permis que le produit pharmaceutique final contienne jusqu’à 5000 ppm de solvants résiduels (communication personnelle, courriel de la Direction des produits biologiques et des thérapies géniques au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyé le 5 août 2016; source non citée).
La MEK est classée comme une substance de produit de santé naturel, ayant un rôle médicinal, elle est visée par l’article 2 (isolat) de l’annexe 1 du Règlement sur les produits de santé naturels. Elle a aussi un rôle non médicinal, pour une utilisation topique comme agent dénaturant, ou par voie orale comme rehausseur de saveur. La MPK, la 2,3‑PD et l’oxyde de mésityle sont également inscrits à titre de substances ayant un rôle non médicinal par voie orale comme rehausseurs de saveur; la MIBK est inscrite à titre de substance ayant un rôle non médicinal par voie orale comme rehausseur de saveur ou par voie topique, comme agent dénaturant; l’alcool de diacétone est inscrit à titre de substance ayant un rôle non médicinal par voie topique comme ingrédient en parfumerie ou solvant. L’acétoïne est inscrite comme ayant un rôle non médicinal par voie orale comme rehausseur de saveur ou par voie topique, comme ingrédient en parfumerie. Seules la MEK et la MIBK figurent dans la Base de données des produits de santé naturels homologués comme étant présentes dans un petit nombre de produits de santé naturels utilisés par voie topique actuellement homologués au Canada (BDIPSN [modifié en 2018]; BDPSNH [modifié en 2018]); communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation du risque des substances existantes de Santé Canada envoyé le 16 août 2016; source non citée.
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, la MEK et l’alcool de diacétone sont utilisés dans certains produits cosmétiques au Canada, principalement dans les produits de soins pour les ongles (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyés les 5 et 8 août 2016; source non citée). Selon des sources accessibles au public, le diacétyle est signalé comme substance utilisée dans des produits cosmétiques au Canada (FS, 2008a; Canada Beauty Supply, 2017), mais aucun produit contenant cet ingrédient n’a été déclaré.
La MEK, la MPK, la MIBK, la MIAK, l’alcool de diacétone et la 2,4‑PD sont présents dans des produits offerts aux consommateurs, y compris des peintures liquides, des peintures en aérosol et des revêtements, des produits d’entretien automobile, des produits de bricolage, p. ex. des décapants à peinture, des adhésifs et des scellants à tuyaux (Environnement Canada, 2012; Santé Canada, 2016; HPD, 1993-). Le Conseil national de recherches du Canada (Won et Lusztyk, 2011; Don et Yeng, 2012, Won et coll. 2014; Won, 2015) a détecté de la MEK, de la MPK et de la MIBK dans les émissions de différents matériaux de construction (p. ex. bois, tapis, isolants) et dans des produits offerts aux consommateurs (p. ex. peinture, nettoyants pour automobile, calfeutrage).
Au Danemark, on a détecté de la MEK dans plusieurs différents produits destinés aux enfants, dont des tentes et des tunnels (Hanson et coll., 2004), des jouets gluants (Svendsen et coll., 2005) et des figurines en caoutchouc et des jetons (Glensvig et Ports, 2006). Selon la Washington’s Children’s Product Safety Act (WSDE 2016), la MEK a été détectée dans différents produits destinés aux enfants de 12 ans et moins, y compris dans le matériel de bricolage pour enfants, les meubles pour bébés, les bavettes de bébé, les sucettes et les anneaux de dentition, les jouets et les jeux d’enfants, la literie et les vêtements de bébés et d’enfants, ainsi que dans les chaussures et le matériel de camping (WSDE, 2016). La MEK se trouvait principalement dans ces produits par contamination, mais elle était également présente comme adhésif, agent de liaison, colorant, pigment, colorant ou encre, composant d’un procédé de fabrication de plastique, de résine ou de polymère, comme agent de durcissement, additif de fabrication, agent de conservation, revêtements de protection, renfort ou renforçateur et solvant (WSDE, 2016). La MEK a également été mesurée dans des produits de soins pour animaux (Nylén et coll., 2004) ainsi que dans des accessoires sexuels (Nilsson et coll., 2006) au Danemark.
D’autres sources de ces cétones sont le gaz d’échappement des véhicules (MEK, diacétyle) [PISCC, 1993], la fumée de cigarette (MEK, diacétyle, 2,3‑PD), ainsi que les liquides à vapoter aromatisés (diacétyle, 2,3‑PD, acétoïne) [communication personnelle, courriels de la Direction de la lutte contre le tabagisme de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyés entre le 15 et le 18 août 2016 ainsi que le 16 novembre 2017; source non citée).
On n’a pas signalé l’oxyde de mésityle comme substance fabriquée ou importée au Canada en 2011 (Environnement Canada, 2013). Deux des dix cétones, la MEK et la MIBK, sont des substances à déclaration obligatoire selon l’Inventaire national des rejets de polluants (INRP). Le tableau 4‑4 résume les divers types de rejets de 2011 à 2015 (INRP 2011-2015a, b).
Substance |
Rejets sur place dans l’atmosphère |
Rejets sur place dans l’eau |
Rejets sur place dans le sol |
Élimination sur place |
Élimination hors site |
Recyclage hors site |
|---|---|---|---|---|---|---|
MEK |
De 1105 à 1362 |
De 5,4 à 20 |
De 0 à 0,149 |
De 0,802 à 46 |
De 863 à 1563 |
De 1441 à 2616 |
MIBK |
De 199 à 243 |
De 0,025 à 1,9 |
De 0 à 0,049 |
De 1,3 à 20 |
De 105 à 207 |
De 243 à 316 |
5. Devenir et comportement dans l’environnement
5.1 Persistance dans l’environnement
La MEK, l’alcool de diacétone, la 2,3‑PD et la 2,4‑PD peuvent être persistants dans l’air, mais ne devraient pas l’être dans l’eau, les sédiments ou le sol, selon des modèles utilisés dans l’approche de la CRE (ECCC, 2016b). La MPK, la MIBK, la MIAK, l’acétoïne et l’oxyde de mésityle ne devraient pas être persistants dans l’air, l’eau, les sédiments ou le sol, selon des modèles utilisés dans l’approche de la CRE (ECCC, 2016b).
5.2 Potentiel de bioaccumulation
En raison d’un faible Koe et de facteurs de bioconcentration faibles (ECCC, 2016b), la MPK, la MIBK, la MIAK, le diacétyle, l’acétoïne, la 2,3‑PD, la 2,4‑PD et l’oxyde de mésityle ne devraient pas se bioaccumuler de façon importante dans les organismes.
6. Potentiel d’effets nocifs sur l’environnement
6.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par les substances du groupe des cétones ont été caractérisés à l’aide de la Classification du risque écologique des substances organiques (CRE) [ECCC, 2016a]. La CRE est une démarche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération par plusieurs éléments de preuve. Elle combine les divers éléments de preuve de façon à différentier les substances plus ou moins dangereuses et les potentiels d’exposition plus ou moins grands dans divers milieux. Une telle démarche permet de réduire l’incertitude globale de la caractérisation des risques comparativement à une approche reposant sur un seul paramètre dans un seul milieu (p. ex., CL50). La démarche, qui est décrite en détail par ECCC (2016a), est résumée ci-dessous.
Des données sur les propriétés physico-chimiques, le devenir (demi-vie chimique dans divers milieux et biotes, coefficient de partition, bioconcentration dans les poissons), l’écotoxicité aiguë chez le poisson et les volumes des substances chimiques importées ou fabriquées au Canada ont été colligées à partir de publications scientifiques, des bases de données empiriques disponibles (p. ex. la boîte à outils QSAR de l’OCDE) et des réponses aux enquêtes menées en vertu de l’article 71 de la LCPE. Des données à partir de la relation quantitative structure-activité (QSAR) ou des modèles du devenir du bilan massique ou de la bioaccumulation ont été produites. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils d’exposition et de danger des substances.
Les profils de danger ont été principalement établis à partir de paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été établis à partir de plusieurs paramètres, dont la vitesse d’émission potentielle, la persistance globale et le transport potentiel à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de catégoriser le danger et le risque d’exposition de chaque substance comme étant faible, moyen ou élevé. D’autres règles ont été appliquées (p. ex. cohérence de la classification, marge d’exposition) pour améliorer les classifications préliminaires de danger ou d’exposition.
Une matrice des risques a été utilisée pour catégoriser en faible, modéré ou élevé le risque potentiel de chaque substance, en fonction du classement de leur danger et de leur exposition. Les classifications du risque obtenues à l’aide de la CRE ont subi une vérification en deux étapes. La première étape consistait à modifier à la baisse la classification du risque (qui passe de modéré ou élevé à faible) des substances présentant une estimation faible du taux d’émission dans l’eau après le traitement des eaux usées, ce qui représente un faible risque d’exposition. La deuxième étape consistait à revoir les résultats de classification faible à la lumière de scénarios de risque relativement prudents à l’échelle locale (c.-à-d. dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque devrait être reclassée à un niveau supérieur.
La CRE est basée sur une approche pondérée pour réduire au minimum toute sur‑classification ou sous-classification du danger et de l’exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en plus de détails dans le ECCC 2016a. Dans ce qui suit, nous décrivons deux des domaines d’incertitude les plus importants. Les erreurs dans les valeurs de toxicité aiguë empiriques ou modélisées pourraient conduire à des changements du classement du danger, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c.-à-d. mode d’action toxique), dont de nombreux sont des valeurs prédites à partir de modèles QSAR. Cependant, l’impact de ces erreurs est atténué par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) pour les résidus dans les tissus aux fins d’analyse des résidus corporels critiques (RCC). L’erreur de sous-estimation de la toxicité aiguë sera atténuée par l’utilisation d’autres paramètres de risque comme le profilage structural du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Comme la classification de l’exposition et du risque est très sensible au taux de rejet et à la quantité utilisée, les modifications ou les erreurs de quantité de composés chimiques pourraient se traduire par des classifications différentes de l’exposition. Les résultats de la CRE reflètent donc l’exposition et le risque au Canada d’après les quantités actuellement utilisées et pourraient ne pas refléter des tendances futures.
ECCC (2016b) présente les données essentielles et les facteurs à considérer, utilisés pour élaborer les profils spécifiques des substances du groupe des cétones, ainsi que les résultats de la classification du danger, de l’exposition et des risques.
Les classifications du danger et de l’exposition des substances du groupe des cétones sont résumées au tableau 6‑1.
Substance |
Classification du danger selon la CRE |
Classification de l’exposition selon la CRE |
Classification du risque selon la CRE |
|---|---|---|---|
MEK |
faible |
élevé |
faible |
MPK |
faible |
faible |
faible |
MIBK |
faible |
faible |
faible |
MIAK |
faible |
faible |
faible |
Alcool de diacétone |
faible |
élevé |
faible |
Diacétyle |
faible |
faible |
faible |
Acétoïne |
faible |
faible |
faible |
2,3‑PD |
faible |
faible |
faible |
2,4‑PD |
faible |
faible |
faible |
Oxyde de mésityle |
faible |
faible |
faible |
Comme ils présentent un danger et une exposition faibles selon les renseignements étudiés dans le cadre de la CRE, la MPK, la MIBK, la MIAK, le diacétyle, l’acétoïne, la 2,3‑PD, la 2,4‑PD et l’oxyde de mésityle ont été classés comme ayant un faible potentiel de risque pour l’environnement. Il est donc peu probable que ces substances soulèveront des préoccupations à l’égard de l’environnement au Canada.
Selon les renseignements étudiés, la CRE, la MEK et l’alcool de diacétone présentent un risque d’exposition élevé, car les quantités utilisées déclarées sont élevées et que leur demi-vie dans l’air est longue. La MEK et l’alcool de diacétone ont été classés comme ayant un faible potentiel de danger et un faible potentiel de risque pour l’environnement. Il est donc peu probable que ces substances soulèveront des préoccupations à l’égard de l’environnement au Canada.
7. Potentiel d’effets nocifs sur la santé humaine
7.1 Évaluation du sous-groupe 1 (MEK, MPK)
7.1.1 Évaluation de l’exposition au sous-groupe 1 (MEK, MPK)
Milieu naturel
La MEK a été ciblée par une surveillance dans le cadre du programme du Réseau national de surveillance de la pollution atmosphérique (RNSPA). Les concentrations moyennes mesurées entre 2006 et 2010 à divers lieux d’un bout à l’autre du Canada variaient de 0,20 à 5,7 µg/m3 et les concentrations au 95e centile variaient de 0,53 à 19,3 µg/m3 (ECCC 2017c). Les concentrations de MEK et de MPK dans l’air ambiant ont aussi été mesurées par cinq études canadiennes sur l’air menées à Windsor, Regina, Edmonton et Ottawa (Santé Canada, 2010a, b, 2012, 2013; Zhu et coll., 2005).
Les concentrations de MEK dans l’air ambiant relevées pendant ces études canadiennes variaient de moins de 0,03 à 39,06 µg/m3 alors que la moyenne géométrique et les concentrations au 95e centile variaient de 0,41 à 1,77 µg/m3 et de 0,78 à 5,53 µg/m3, respectivement (Zhu et coll., 2005; Santé Canada, 2010a, b, 2012, 2013). Les concentrations de MPK dans l’air ambiant relevées dans le cadre des cinq études canadiennes variaient de 0,002 à 14,38 µg/m3, alors que les moyennes géométriques et les concentrations au 95e centile variaient de 0,055 à 0,49 µg/m3 et de 0,22 à 1,25 (Santé Canada, 2010a, b, 2012, 2013). Les concentrations les plus élevées au 95e centile ont été utilisées pour estimer les expositions de la population générale (5,53 µg/m3 de MEK dans l’air de Windsor, et 1,25 µg/m3 de MPK dans l’air de Regina).
La MEK et la MPK ont été mesurées par l’étude nationale sur l’air intérieur du Canada menée de 2009 à 2011 dans le cadre du cycle 2 de l’Enquête canadienne sur les mesures de la santé. On a détecté de la MEK dans 99 % des échantillons avec une concentration moyenne géométrique de 1,14 µg/m3 (données pondérées pour toute la maison) et une concentration au 95e centile de 9,76 µg/m3. La MPK a été détectée dans 97 % des échantillons avec une concentration moyenne géométrique (données pondérées pour toute la maison) de 0,36 µg/m3 et une concentration au 95e centile de 1,58 µg/m3 (Zhu et coll., 2013).
Les concentrations de MEK et de MPK dans l’air intérieur ont également été mesurées à l’échelle des cinq mêmes études canadiennes mentionnées ci-dessus. Les concentrations moyennes géométriques de MEK dans l’air intérieur variaient de 1,51 à 9,81 µg/m3, et les valeurs au 95e centile variaient de 9,9 à 51,63 µg/m3 (Zhu et coll., 2005; Santé Canada, 2010a, b, 2012, 2013). Les concentrations moyennes géométriques de MPK dans l’air intérieur variaient de 0,089 à 2,77 µg/m3 et les valeurs au 95e centile variaient de 1,34 à 12,77 µg/m3 (Santé Canada, 2010a, b, 2012, 2013).
Par mesure de prudence, les concentrations au 95e centile les plus élevées de MEK et de MPK à l’échelle de toutes les études sur l’air intérieur ont été utilisées pour estimer les expositions de la population générale (51,63 µg/m3 pour la MEK dans l’étude de Windsor, et 12,77 µg/m3 pour la MPK dans l’étude de Regina).
La MEK et la MPK ont également été mesurées dans l’air personnel dans le cadre de l’étude sur l’air menée à Windsor, en Ontario (Santé Canada, 2010a). Les échantillons d’air personnel prennent en considération l’exposition à la MEK de l’air intérieur et de l’air extérieur à divers lieux, y compris le domicile, le bureau et pendant le transport. Pendant l’été, la moyenne géométrique et les concentrations au 95e centile pour la MEK étaient respectivement de 8,79 µg/m3 et de 28,22 µg/m3, ce qui est plus élevé que celles des échantillons prélevés pendant l’hiver (moyenne géométrique de 4,24 µg/m3 et concentrations au 95e centile de 11,44 µg/m3). La concentration moyenne géométrique de MPK dans l’air personnel pendant l’été et l’hiver étaient respectivement de 2,91 µg/m3 et de 1,44 µg/m3. Les concentrations au 95e centile de MPK étaient de 12,65 µg/m3 et de 6,30 µg/m3 pendant l’été et l’hiver, respectivement (Santé Canada, 2010a).
La MEK et la MPK sont très solubles dans l’eau. Par contre, à cause de leur pression de vapeur élevée et leur constante de la loi d’Henry modérée, elles devraient rapidement se volatiliser depuis l’eau (HSDB, 1983-). De plus, on s’attend à ce que la MEK et la MPK se biodégradent dans l’eau; par conséquent, il est peu probable que l’eau soit une source importante d’exposition humaine (VCCEP, 2003; HSDB, 1983-). En 2000, la MEK n’a pas été détectée au-dessus de la limite de détection de 0,99 µg/L dans de l’eau potable (taille de l’échantillon inconnue) de Montréal, au Québec (Bernier, 2000). Nous n’avons trouvé aucune autre donnée canadienne sur la présence de MEK dans l’eau. Un petit nombre d’études américaines a détecté de la MEK, à de faibles fréquences de détection (de 0,5 à 0,8 % des échantillons), et à des concentrations entre 0,6 et 340 µg/L (Grady et Casey, 2001; Delzer et Ivahnenko, 2003; Grady, 2003). Aucune donnée n’a été recensée sur la présence de MPK dans l’eau au Canada. La MPK a été détectée dans l’eau potable de Ottumwa, en Iowa à une concentration de 0,1 µg/L (0,1 ppb) et a été détectée, mais non quantifié dans l’eau potable de cinq autres villes américaines, et en Angleterre (HSDB 1983-). Pour estimer avec prudence les expositions potentielles à la MEK et à la MPK occasionnées par l’eau potable, nous avons utilisé la limite de détection de 0,99 µg/L de l’étude de Montréal pour la MEK et les données de l’Iowa (0,1 µg/L) pour la MPK.
En ce qui concerne le sol, nous avons retrouvé une étude canadienne par Golder Associates (1987) qui a analysé les niveaux de MEK dans deux zones de parc à proximité de raffineries de pétrole dans le sud de l’Ontario. Une concentration moyenne de 5,78 µg/g (maximum : 25 µg/g) a été calculée pour 19 des 30 échantillons de sol dans lesquels la MEK a été détectée. L’utilisation de la concentration maximale de MEK dans le sol a occasionné un taux d’exposition de la population générale inférieur à 1 ng/kg p.c./jour pour tous les groupes d’âge. Par conséquent, nous considérons que l’exposition à la MEK occasionnée par le sol est négligeable. Aucune donnée portant sur la présence de MPK dans le sol ou les sédiments n’a été relevée au Canada ni ailleurs. À l’aide du modèle ChemCAN, et des données sur les quantités fabriquées ou importées du tableau 4-1 (p. ex. 1 097 844 kg), nous avons calculé les concentrations potentielles de MPK dans le sol La concentration estimée de MPK dans le sol est de 1,1 ng/kg et donne lieu à des apports inférieurs à 1 ng/kg p.c./jour pour la population générale du Canada, une concentration considérée négligeable.
Les estimations de l’exposition à la MEK et à la MPK occasionnées par les milieux environnementaux varient entre 9,1 µg/kg p.c./jour pour les adultes (60 ans et plus) à 27,6 µg/kg p.c./jour pour les tout-petits (de six mois à quatre ans) et entre 2,3 µg/kg p.c./jour pour les adultes (60 ans et plus) et 6,8 µg/kg p.c./jour pour les tout-petits (de six mois à quatre ans), respectivement (Santé Canada, 2018).
Aliments
On a mesuré la MEK et la MPK directement dans les aliments ou comme composés volatils dérivés des aliments dans la plupart des groupes alimentaires. Elle provient principalement de leur présence naturelle dans les plantes ou de leur production par les microbes (p. ex. fermentation). De plus, on sait que la MEK et la MPK sont utilisées comme agents aromatisants dans les aliments, y compris dans les produits de boulangerie, les graisses et les huiles, les produits laitiers surgelés, les gélatines et les poudings, les boissons non alcoolisées et les bonbons mous (Burdock, 2010). Au Canada, la MEK est utilisée comme additif alimentaire dans les extraits naturels et dans les extraits d’épice, mais on s’attend à ce que les contributions occasionnées par cet usage soient mineures par rapport à la présence naturelle de la substance dans les aliments. On a détecté de la MEK (cinq échantillons sur douze) et de la MPK (quatre échantillons sur douze) dans le lait maternel, mais on n’en a pas quantifié de concentrations (Pellizari et coll., 1982).
Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a évalué un groupe de 39 alcools secondaires aliphatiques cycliques saturés, les cétones et les esters saturés et non saturés connexes utilisés comme aromatisants, y compris la MEK et la MPK (OMS, 1999b). Dans le cadre de cette évaluation, le Comité estimait que l’absorption de MEK et de MPK par une personne découlant de l’utilisation de ces substances comme aromatisant alimentaire était respectivement de 0,6 et de 0,7 µg/kg p.c./jour pour la population américaine, et de 2 µg/kg p.c./jour respectivement pour la population européenne (l’annexe A présente plus de détails).
Les estimations de l’exposition à la MEK et à la MPK selon leur présence naturelle dans les alimentsNote de bas de page 4 variaient de 66 µg/kg p.c./jour pour les adolescents de 14 à 18 ans à 185 µg/kg p.c./jour pour les tout-petits d’un an, et de 68 µg/kg p.c./jour pour les adolescents de 14 à 18 ans à 216 µg/kg p.c./jour pour les tout-petits d’un an, respectivement (l’annexe A présente plus de détails).
Produits offerts aux consommateurs
MEK
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, la MEK est utilisée dans certains produits cosmétiques au Canada, comme dans des hydratants pour le visage, et dans différents produits de soins pour les ongles, y compris les vernis de base, les vernis de finition, le vernis à ongles, les dissolvants pour vernis à ongles, les adhésifs pour ongles, les brosses à ongles, les fortifiants pour ongles, les crèmes à ongles, les produits pour accélérer le séchage, et les produits de réparation des ongles. (Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, envoyés en août 2016 et en avril 2017; source non citée.) Dans ces produits, la MEK sert de solvant ou de parfum (Commission européenne, 2017).
À l’aide du logiciel ConsExpo Web (2016), nous avons calculé les concentrations de l’exposition par inhalation de certains produits sentinelles (couche de finition, vernis à ongles et dissolvant pour vernis à ongles) qui causent les expositions les plus élevées par rapport à des produits semblables Le tableau 7‑1 présente la gamme de concentrations de MEK pour ces différents produits ainsi que les estimations de l’exposition par inhalation associée. Seules les estimations de l’exposition des adultes et des tout-petits y sont présentées; elles correspondent toutefois à la plage de valeurs d’exposition potentielle de tous les groupes d’âge.
Des précisions sur la méthode et les paramètres utilisés pour produire les estimations de l’exposition par inhalation et par voie cutanée à la MEK dans les produits cosmétiques sont présentées à l’annexe B.
Scénario pour le produit |
Concentration maximalea |
Concentration moyenne par événement (mg/m3) | Concentration moyenne le jour de l’exposition (mg/m3) | Exposition moyenne pondérée de 7 heuresb (mg/m3) |
|---|---|---|---|---|
Couche de finition |
55,7 % |
140 |
1,8 |
6,0 |
Vernis à ongles (adultes et adolescents) |
35 % |
190 |
4,6 |
15,8 |
Vernis à ongles (tout-petits) |
35 % |
65 |
1,6 |
5,4 |
Dissolvant pour vernis à ongles (adultes et adolescents) |
84 %c
|
280
|
1,6 |
5,3 |
Dissolvant pour vernis à ongles (tout-petits) |
76,4 % |
220 |
1,2 |
4,1 |
Abréviations : s. o. = sans objet.
a Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, en août 2016 et en avril 2017; source non citée.
b Les expositions moyennes pondérées de sept heures ont été dérivées pour tous les scénarios d’utilisation de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisée pour caractériser les risques. Exposition moyenne pondérée de 7 heures = concentration moyenne par événement (mg/m3) × durée d’exposition (min)/(7 × 60 min)
c Produit dont l’utilisation par des jeunes enfants n’est pas prévue (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada en avril 2017; source non citée).
Il est prévu que l’exposition par voie cutanée contribuerait à l’exposition globale pendant l’utilisation de produits offerts aux consommateurs, mais la voie principale est considérée comme étant l’inhalation. Wilkinson et Williams (2001) ont mesuré une absorption cutanée de moins de 1 % pour la MEK dans une étude in vitro non obstruée chez l’humain. En raison de la forte volatilité et de la faible absorption cutanée de MEK, l’exposition par voie cutanée est considérée être minime par rapport à l’exposition par inhalation; par conséquent, seules les estimations pour l’inhalation sont présentées.
Produits pour enfants
On a découvert de la MEK dans différents produits pour enfants aux États-Unis et au Danemark, y compris dans les sucettes et les anneaux de dentition (WSDE, 2016), ainsi que dans les jouets gluants (Svendsen et coll., 2005). Seules les estimations d’exposition par voie orale et par inhalation sont présentées, puisqu’elles occasionnaient les expositions les plus élevées et permettent de tenir compte de toute exposition possible par voie cutanée.
Nous avons estimé le potentiel d’exposition par voie orale occasionnée par des jouets de dentition ou des objets pour enfants contenant de la MEK en utilisant une sucette et un jouet de dentition dans un scénario d’exposition sentinelle. La WSDE (2016) a déterminé que la MEK était un contaminant des sucettes et des jouets de dentition, à des concentrations entre supérieures ou égales à 100 ppm et moins de 500 ppm. Les expositions orales estimées au moyen de la démarche présentée à l’annexe B variaient de 110 à 232 µg/kg p.c./jour pour les tout-petits (de six mois à quatre ans) et de 91 à 300 µg/kg p.c./jour pour les bébés (de zéro à six mois).
Il y avait peu de données sur la migration de la MEK depuis des produits. Selon Svendsen et coll. (2005), la MEK n’a pas migré vers de la sueur et de la salive artificielles à partir de jouets gluants ayant des concentrations de 2,3 % et de 9 %. Il a été estimé que la concentration de la zone respiratoire pour les jouets gluants était de 0,079 et de 0,098 µg/m3 (Svendsen et coll., 2005), une concentration inférieure à celles de l’air intérieur présentée dans la section sur les milieux environnementaux. Nilsson et coll. (2006) ont analysé la MEK dans les jouets pour adultes dans le cadre d’analyses de l’espace de tête et dans de la sueur artificielle (pH de 4,5 et de 6,5). Les concentrations de MEK variaient de 174 à 13 016 ng/180 min dans des analyses de l’espace de tête, de 12 à 49 µg/dm2 dans la sueur artificielle avec un pH de 4,5, et de 17 µg/dm2 dans la sueur artificielle avec un pH de 6,5.
Autres produits
La MEK se trouve dans un petit nombre de produits de santé naturels à application topique actuellement homologués au Canada ayant un rôle non médicinal, y compris dans des produits antiseptiques pour les mains, destinés principalement à une utilisation dans des installations médicales ainsi que dans un nettoyant pour le visage (BDPSNH, modifié en 2016). Nous considérons que les scénarios d’exposition sentinelle pour les produits cosmétiques tiennent compte de toutes les expositions à la MEK découlant de l’utilisation de produits de santé naturels.
La MEK est également présente dans de nombreux produits offerts aux consommateurs. Le tableau 7‑2 ne présente que les scénarios d’utilisation de produits qui occasionnent les valeurs les plus élevées d’exposition potentielle à la MEK par inhalation. Les expositions potentielles par inhalation ont été estimées à l’aide du logiciel ConsExpo Web (ConsExpo, 2016). L’annexe B résume les détails des paramètres utilisés dans chaque modèle.
Scénario de produit |
Concentration de MEK |
Concentration moyenne par événement (mg/m3) |
Concentration moyenne le jour de l’exposition (mg/m3) |
Exposition moyenne pondérée de 7 heuresa (mg/m3) |
|---|---|---|---|---|
Décapage de laque |
de 10 à 40 % |
de 920 à 3600 |
de 38 à 150 |
de 131 à 514 |
Élimination d’adhésifs |
100 % |
3600 |
530 |
1843 |
Diluant à peinture (revêtement de plancher) |
Entièrement dilué à 3 % dans le revêtement |
840 |
35 |
120 |
Peinture liquide (peinture riche en solvant) pour plate-forme de camion |
20 % |
210 |
20 |
176 |
Peinture en aérosol |
de 1 à 52 % |
de 56 à 2800 |
de 0,98 à 48 |
de 3 à 167 |
Ciment et apprêts au PVC |
de 5 à 100 % |
de 9,3 à 190 |
de 1,5 à 31 |
de 5 à 109 |
Adhésifs multiusages |
de 15 à 80 % |
de 44 à 230 |
de 2,4 à 13 |
de 8 à 44 |
Abréviation : conc., concentration.
a Les expositions moyennes pondérées de sept heures ont été calculées pour tous les scénarios d’utilisation de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisée pour caractériser les risques. Exposition moyenne pondérée de 7 heures = concentration moyenne par événement (mg/m3) × durée d’exposition (min)/(7 × 60 min).
MPK
On n’a pas relevé la présence de MPK dans les cosmétiques ni dans les produits pour enfants, mais la substance a été détectée dans de nombreux produits de peinture. Le tableau 7‑3 résume nos estimations de l’exposition par inhalation pour les produits offerts aux consommateurs qui contiennent de la MEK, obtenues avec le logiciel ConsExpo Web (ConsExpo, 2016). Comme pour la MEK, même si l’exposition par voie cutanée pourrait contribuer à l’exposition globale pendant l’utilisation de produits offerts aux consommateurs, la voie principale est considérée être l’inhalation; par conséquent, seules les estimations pour l’inhalation sont présentées.
Scénario pour le produit |
Concentration de MPK |
Concentration moyenne par événement (mg/m3) |
Concentration moyenne le jour de l’exposition (mg/m3) |
Exposition moyenne pondérée de 6 heuresa (mg/m3) |
|---|---|---|---|---|
Peinture liquide pour l’acier (peinture résistante) |
De 1 à 10 % |
De 87 à 870 |
De 8 à 80 |
De 32 à 319 |
Peinture en aérosol |
De 2 à 13 % |
De 90 à 570 |
De 1,2 à 8 |
De 8 à 49 |
Abréviation : conc., concentration.
a Les expositions moyennes pondérées de six heures ont été calculées pour tous les scénarios d’utilisation de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisée pour caractériser les risques. Exposition moyenne pondérée de 6 h = concentration moyenne par événement × durée d’exposition/6 × 60 min.
7.1.2 Évaluation des effets sur la santé du sous-groupe 1 (MEK et MPK)
La MEK et la MPK sont des monocétones dont la structure est similaire. Leur seule différence est que la chaîne carbonée de la deuxième est plus longue d’un atome de carbone. Étant donné la similitude des effets de l’exposition à la MEK et au 2‑butanol, ainsi que d’après la constatation selon laquelle le 2‑butanol est rapidement métabolisé en MEK chez les rats, le 2‑butanol est utilisé comme analogue pour éclairer l’évaluation de ce groupe. Les données sur la toxicité du 2‑butanol ont servi à déduire les données pour la MEK ou la MPK au besoin (voir le tableau 7-4).
7.1.2.1 MEK
La MEK a été étudiée par l’OCDE (1997a) et par le système intégré d’information sur les risques (IRIS) de l’EPA des É.-U (2003a). Ces études servent de base à la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Nous avons recensé les publications scientifiques à partir d’un an avant le rapport de l’IRIS de l’EPA des É.‑U. (2003A) jusqu’en avril 2017. Nous n’avons relevé aucune étude sur les effets sanitaires qui aurait pu avoir une incidence sur la caractérisation des risques (c’est-à-dire qui aboutirait à des paramètres critiques différents ou à des doses critiques plus faibles que ceux indiqués par le système intégré d’information sur les risques (IRIS) de l’EPA des É.-U [2003a]).
Toxicocinétique
Il a été trouvé que la MEK administrée par voie orale à des rongeurs était fortement absorbée dans la voie gastro-intestinale puis rapidement éliminée (Dietz et coll., 1981; revus dans l’IRIS de l’EPA, 2003a). En raison de la valeur élevée du rapport de solubilité sang/air, la substance est également bien absorbée chez les humains et les rats en cas d’exposition par inhalation. De plus, on a constaté que la substance était rapidement absorbée lors de l’exposition par voie cutanée (Munies et Wurster, 1965; étudié dans l’IRIS de l’EPA, 2003a). L’information disponible indique que le métabolisme de la MEK est semblable chez les humains et les animaux de laboratoire, et que le 2‑butanol et le 2,3-butanediol sont les métabolites importants (Perbellini et coll., 1984; Liira et coll., 1988, 1990a; étudié dans l’IRIS de l’EPA, 2003a). Chez les humains, la MEK se forme de manière endogène : la substance a été retrouvée comme constituant mineur, mais normal de l’urine, comme constituant du sérum et de l’urine des diabétiques, ainsi que dans l’air expiré (OMS, 1992; étudié dans l’IRIS de l’EPA, 2003a).
Cancérogénicité et génotoxicité
L’EPA des États-Unis (IRIS, 2003a) n’a pas relevé pour la MEK de préoccupations relatives à la cancérogénicité ou la génotoxicité.
Toxicité avec doses répétées
Les effets sur la santé déclarés pour la MEK étaient principalement liés à des augmentations du poids absolu ou relatif des organes (plus fréquemment le foie) aux concentrations élevées (Nilson et Toftgard, 1980; Cavender et coll., 1983; Toxigenics Inc., 1981; étude par l’IRIS de l’EPA, 2003a).
Toxicité pour la reproduction et le développement
Il n’y a aucune étude qui a évalué le potentiel de la MEK de toxicité pour la reproduction, quelle que soit la voie d’exposition (Cox et coll., 1975; étude par l’IRIS de l’EPA, 2003a; ECHA, c2007-2017f; AcToR de l’EPA des É.‑U., 2015).
Lors d’une étude de la toxicité par inhalation pour le développement, on a exposé par inhalation des groupes de 10 souris Swiss CD-1 vierges et de 33 femelles ayant un bouchon spermatique (JD 0), à de la MEK à des concentrations moyennes de 0, 398, 1010 et 3020 ppm (0, 1174, 2980 et 8909 mg/m3) pendant sept heures par jour aux JG 6 à 15 (Schwetz et coll., 1991, et étudié dans l’IRIS de l’EPA, 2003a). Une augmentation légère, mais statistiquement significative du poids absolu du foie lié à la dose a été observée chez les mères à 3020 ppm (augmentation d’environ 7 % par rapport au groupe témoin). On a constaté une diminution statistiquement significative du poids moyen du fœtus (5 %, par portée) à 3020 ppm chez les mâles et une diminution de 4 % pour tous les fœtus combinés. On a également constaté une tendance positive d’une incidence accrue de fœtus ayant des sternèbres mal alignées en fonction de l’exposition (à des incidences de 31/310, 27/260, 49/291 et 58/323 pour le groupe témoin jusqu’aux groupes exposés à 3020 ppm [8909 mg/m3] respectivement). D’autres effets non significatifs sur le développement (fente palatine, côtes fusionnées, vertèbres manquantes et syndactylie) ont été observés chez les groupes exposés à la substance, mais non chez les groupes témoins. On a considéré que la DSENO pour les effets nocifs sur la santé maternelle et le développement était de 1010 ppm (2980 mg/m3), alors que les CMENO pour le développement et la santé maternelle ont été établies à 3020 ppm (8909 mg/m3), d’après une diminution du poids fœtal chez les mâles, une incidence accrue de sternèbres mal alignées, et une hausse du poids relatif du foie chez les mères. De même, Deacon et coll. (1981, cité dans l’IRIS de l’EPA des É.‑U., 2003a) ont signalé une toxicité pour les fœtus (fréquence accrue de côtes excédentaires) et une toxicité pour la santé maternelle (diminution de la prise de poids corporel) à 3005 ppm (8865 mg/m3) [ce qui est considéré comme la CMENO] dans une étude de toxicité pour le développement, menée chez des rats, avec une CSENO de 1002 ppm (2955 mg/m3). Se fondant sur les sternèbres mal alignées, l’EPA des É.‑U. (2003) a calculé une dose efficace minimale (d’exposition) chronique DECM10Note de bas de page 5 (limite inférieure de confiance de 95 % de la concentration associée à un risque supplémentaire de 10 %) de 5202 mg/m3 pour l’exposition intermittente (sept heures par jour) et une DECMCEHNote de bas de page 6 (concentration équivalente chez l’humain) ajustée pour l’exposition continue) de 1517 mg/m3.
De même, une étude plus récente sur la toxicité par inhalation sur le développement, menée chez des rats a également montré une toxicité pour le développement avec une CSENO de 2949 mg/m3; une diminution du poids fœtal a été observée à 2000 ppm (5899 mg/m3), alors qu’une diminution du poids corporel des mères a également été notée à 11 797 mg/m3 et à des concentrations supérieures (Saillenfait et coll., 2006). Une autre étude sur le développement signalait des effets sur le développement en l’absence de toxicité maternelle à 7723 mg/m3, avec une CSENO de 1126 ppm (3322 mg/m3) [Schwetz et coll., 1974, cité dans l’IRIS de l’EPA des É.‑U., 2003a].
Puisqu’aucune étude sur la toxicité par voie orale pour le développement n’a été retrouvée pour la MEK; nous avons déduit pour la MEK les données par lecture croisée de l’étude de toxicité du 2‑butanol par voie orale sur la reproduction et le développement. Dans cette étude menée sur plusieurs générations de rats Wistar mâles et femelles, ces rongeurs ont été exposés à du 2‑butanol dans leur eau de consommation à des concentrations de de 0, de 0,3, de 1,0 ou de 3,0 % (doses équivalentes à des doses de 0, de 538, de 1644 et de 5089 mg/kg p.c./jour [rats mâles] et de 0, de 594, de 1771 et de 4571 mg/kg p.c./jour [rats femelles] pendant huit semaines avant l’accouplement. À cause de la hausse de mortalité accrue et de la diminution du poids corporel survenues dans les portées F1A à la dose de 3 %; on a donc diminué la dose la plus élevée à 2 % (apport quotidien moyen de 3 84 mg/kg p.c./jour chez les mâles et 3122 mg/kg p.c./jour chez les femelles) pour le reste de l’étude. Les femelles F0 ont été accouplées de nouveau, et les petits F1A se sont accouplés pour produire les portées F2. Une DSENO de 1771 mg/kg p.c./jour pour le 2‑butanol, tant pour les effets sur la santé maternelle que sur le développement, a été trouvée en raison de la diminution du poids fœtal de la portée F1B et de la diminution du poids corporel des petits des portées F1A et F2, ainsi qu’une diminution du gain de poids corporel chez les mères à 3122 mg/kg p.c./jour (Cox et coll., 1975; étudié dans l’IRIS de l’EPA des É.‑U., 2003a). L’EPA des É.‑U. (2003) a estimé la dose efficace minimale, DEM05, (limite inférieure de confiance de 95 % de la dose effective [DE]) de 639 mg/kg p.c./jour pour la MEK (ajustement basé sur les masses moléculaires de la DEM05 de 657 mg/kg p.c./jour pour le 2‑butanol).
Aucune étude de la toxicité par voie cutanée sur le développement n’a été relevée pour la MEK ou pour l’analogue 2‑butanol.
7.1.2.2 MPK
La MPK n’a pas été évaluée par d’autres organismes. L’évaluation qui suit sur la santé repose sur l’information trouvée dans le dossier d’inscription de l’ECHA (ECHA, c2007-2017c) et le HPVIS de l’EPA des É.‑U. (EPA des É.‑U., 2001a).
Toxicocinétique
Aucune information quantitative sur l’absorption de la MPK par n’importe quelle voie d’exposition n’a été relevée. La structure de la MPK est similaire à celle de la MEK et à son métabolite le 2‑butanol; par conséquent, l’absorption de la MPK devrait être tout aussi rapide et importante.
Cancérogénicité et génotoxicité
Aucune étude de cancérogénicité par voie orale, cutanée ou par inhalation, n’a été signalée pour la MPK. Aucune prévision positive n’est ressortie du modèle QSAR et nous n’avons pas relevé la présence d’alertes structurales associées à la génotoxicité ou à la cancérogénicité. De plus, la MPK ne s’est pas révélée génotoxique dans plusieurs essais in vitro (p. ex. essai d’Ames, essai d’aberrations chromosomiques et essai sur des cellules de lymphomes de souris; ECHA, c2007-2017c).
Toxicité avec doses répétées
Dans une étude sur la toxicité avec prise répétée de doses par voie orale, des rats CD mâles ont reçu de la MPK dans leur eau à des concentrations de 0 %, de 0,25 %, de 0,5 %, de 1,0 % (ce qui équivaut à des doses de 0, de 144, de 250 et de 454 mg/kg p.c./jour) pendant 13 mois. Le seul effet signalé était une légère diminution de la prise de poids corporel (9 %) à 1,0 %, à la plus haute dose administrée (454 mg/kg p.c./jour). On n’a pas relevé d’effets sur les signes cliniques, le poids des organes ou l’histologie. De plus, aucun changement pathologique n’a été observé dans les systèmes nerveux central et périphérique (Bingham et coll., 2001, cité dans HSDB, 1983-).
En ce qui concerne l’exposition par inhalation, les niveaux d’effet critique ont été dérivés d’études sur l’exposition par inhalation menées chez les rats, dans lesquelles des CSENO de 5000 et de 5300 mg/m3 ont été relevées après une exposition d’une durée de 21 à 35 jours et de 13 semaines, respectivement (anonyme, 1999a, Eastman Chemical Company, 1999; ECHA, c2007-2017c). Dans l’étude combinée sur la toxicité pour la reproduction et le développement par inhalation, les rats SD ont été exposés à des doses allant jusqu’à 5000 mg/m3 de MPK pendant six heures par jour, pour une période de 35 à 48 jours (femelles) jusqu’au JG 19, ou pour une période de 51 jours (mâles) [ECHA, c2007-2017c; EPA AcToR, 2015]. Une légère neurotoxicité a été observée chez les mères à une plus faible concentration (2500 mg/m3), mais cet effet semble être transitoire, et des effets semblables n’ont pas été observés à des concentrations semblables dans d’autres études. Aucun autre effet important n’a été signalé. L’autre étude à court terme a révélé seulement une légère hypertrophie des hépatocytes chez un animal après deux périodes de 16 heures et deux périodes de 20 heures sur quatre jours consécutifs à une dose de 1074 mg/m3 (Eastman Kodak Company, 1977, cité par l’EPA des É.‑U. 2001a).
Aucune étude convenable de la toxicité par voie cutanée n’a été relevée.
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour le développement prénatal, des rattes SD ont été exposées à des concentrations de 0, de 250, de 750 et de 1500 ppm (concentrations équivalentes à 0,880, à 2650, et à 5300 mg/m3) de MPK, pendant les JG 6 à 19 (ECHA, c2007-2017c). On n’a pas observé d’effet sur le poids corporel moyen, la prise de poids corporel, le poids corporel net, le gain de poids corporel net, le poids de l’utérus gravide ou la consommation alimentaire dans aucun des groupes exposés à la substance d’essai. On n’a pas observé d’effet nocif chez les mères ni par rapport à la croissance intra-utérine, à la survie et à la morphologie fœtale, peu importe le degré d’exposition. À la lumière de ces observations, les auteurs de l’étude ont publié une CSENO de 1500 ppm (5300 mg/m3) [le niveau d’exposition le plus élevé qui a été évalué] pour la toxicité maternelle et le développement de l’embryon ou du fœtus.
De même, aucune toxicité pour le développement n’a été signalée à la concentration la plus élevée administrée (c.-à-d. CSENO de 5000 mg/m3) dans l’étude combinée sur la toxicité pour la reproduction et le développement par inhalation décrite ci-dessus. Les résultats de ces études suggèrent que la MPK n’est pas toxique pour le développement. De plus, selon la boîte d’outil de l’OCDE pour la prévision in silico, il n’y a pas d’alerte structurale, ce qui indique que la MPK ne semble pas avoir de potentiel pour provoquer de la toxicité sur le plan du développement.
Aucune donnée n’était disponible sur la toxicité sur la reproduction ou le développement de la MPK administrée par voie orale ou cutanée.
Nom chimique |
2‑butanol |
MEK |
MPK |
|---|---|---|---|
Rôle |
Substance analogue |
Produit chimique cible |
Produit chimique cible |
NR CAS |
78-92-2 |
78-93-3 |
107-87-9 |
 MM : 74,12 log Koe : 0,61 |
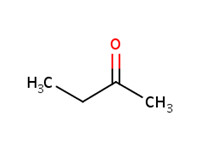 MM : 72,11 log Koe : 0,29 |
 MM : 86,13 log Koe : 0,91 |
|
Toxicocinétique et métabolisme |
Conversion rapide à la MEK |
Absorption rapide par voie orale |
N.D. |
Toxicité aiguë |
s.o. |
DL50 par voie orale = 3460 mg/kg p.c. DL50 par voie cutanée > 6400 à 8000 mg/kg p.c. |
DL50 par voie orale ≥ 1600 -<3200 mg/kg p.c. DL50 par voie cutanée= 8000 mg/kg p.c. |
Études sur l’exposition par inhalation à court terme |
s.o. |
CSENO = 590 mg/m3 (étude humaine)
DECM5= 5202 mg/m3 (exposition intermittente) /DECMCEH = 1517 mg/m3 (exposition continue) [de l’étude sur le développement]
|
CSENO = 1074 mg/m3 (Aucun effet après quatre expositions)
CSENO = 5300 mg/m3 (étude sur le développement au 14e jour) |
Toxicité à dose répétée (voie orale) |
DSENO = 1771 mg/kg p.c. par jour (huit semaines; baisse du gain de poids chez les mères) |
DSENO = 1723 mg/kg p.c. par jour (déduite à partir du 2‑butanola) |
DSENO/DMEO = 454 mg/kg p.c. par jour (13 mois; diminution de 9 % du gain en poids corporel) |
Toxicité à dose répétée (inhalation) |
s.o. |
CSENO = 14 870 mg/m3 (diminution de la prise de poids corporel, hausse du poids du foie et des reins, diminution du poids du cerveau; absence d’histopathologie neurale centrale ou périphérique) [90 jours] |
CSENO = 5300 mg/m3 (13 semaines)
CSENO = 5000 mg/m3 (de 35 à 51 jours) |
Toxicité à dose répétée (voie cutanée) |
N.D. |
N.D. |
DSENO = 454 mg/kg p.c./jour (étude sur l’exposition à la MPK par voie orale) |
Toxicité pour la reproduction ou le développement (voie orale) |
DEM05-dév = 657 mg/kg p.c./jour (étude de huit semaines sur plusieurs générations; DSENOdév-mat = 1771 mg/kg p.c./jour; diminution du poids fœtal, avec des preuves de maturation retardée du squelette; diminution du poids corporel chez les mères) |
DEM05 = 639 mg/kg p.c./jour (DSENO = 1723 mg/kg p.c./jour) (déduite à partir du 2‑butanola) |
DEM05 = 763 mg/kg p.c./jour (déduite à partir du 2‑butanol a)
|
Toxicité pour la reproduction ou le développement (par inhalation) |
s.o. |
DSENOdév-mat = 2955 mg/m3 (JG 6 à 15; diminution du poids fœtal chez les mâles, incidence accrue de sternèbres mal alignées et augmentation du poids relatif du foie chez les mères) DECM10= 5202 mg/m3 (exposition intermittente)/DECMCEH = 1517 mg/m3 (exposition continue) |
CSENOdév = 5000 mg/m3
CSENOmat = 5000 mg/m3 (de 35 à 51 jours jusqu’au JG19)
CSENOdév= 5300 mg/m3 (JG 6 à 19) |
Toxicité pour la reproduction ou le développement (voie cutanée) |
s.o. |
DEM05 = 639 mg/kg p.c./jour (déduite à partir de l’étude sur l’exposition par voie orale au 2‑butanol a) |
DEM05 = 763 mg/kg p.c./jour (déduite à partir de l’étude sur l’exposition par voie orale au 2‑butanola) |
Génotoxicité |
Non génotoxique |
Non génotoxique |
Non génotoxique |
Cancérogénicité |
s.o. |
Négatif/non concluant (EPA, 2003). Toutefois, peu probable selon les alertes structurales, QSAR. |
Ne devrait pas être cancérogène (lecture croisée à partir de la MEK) |
Abréviations : N.D., non déterminé; s. o. = sans objet; log Koe, coefficient de partage octanol-eau; MM, masse moléculaire (g/mol)
a Ajustement molaire calculé à partir de la valeur obtenue de données croisées. Les masses moléculaires sont 74,12 g/mol pour le 2‑butanol, 72,11 g/mol pour la MEK et 86,13 g/mol pour la MPK.
7.1.3 Caractérisation des risques posés par les substances du sous‑groupe 1 (MEK et MPK)
MEK
En ce qui concerne les effets nocifs observés chez les animaux découlant d’une exposition répétée par inhalation à la MEK, on relève des données cohérentes dans les études chez les rats et les souris selon lesquelles les effets sur le développement seraient les effets critiques pour la santé, et qu’ils surviendraient principalement en présence d’une légère toxicité pour la mère. Selon les études disponibles, l’EPA des É.‑U. (2003a) a sélectionné l’étude sur les souris de Schwetz et coll. (1991) avec une DECM10 pour une exposition intermittente (7 h/jour) de 5202 mg/m3 et une DECMCEH pour une exposition continue de 1517 mg/m3, en raison de l’incidence de sternèbres mal alignées (IRIS de l’EPA des É.‑U., 2003a). Par conséquent, ces valeurs étaient considérées comme étant les points de départ les plus appropriés aux fins d’utilisation pour la caractérisation des risques posés par la MEK.
Pour caractériser les risques par voie orale et par voie cutanée et à défaut de disposer d’études de toxicité de la MEK par voie orale à doses répétées, nous avons choisi l’étude de la toxicité du 2‑butanol dans l’eau à boire sur la reproduction et le développement chez le rat (Cox et coll., 1975, étude citée dans le système intégré d’information sur les risques, IRIS), de l’EPA des É.‑U., 2003a). L’EPA des É.‑U. (2003) a publié une estimation pour de la DEM05 (limite inférieure de confiance de 95 % de la dose effective, DE) de 639 mg/kg p.c./jour pour la MEK (ajustement basé sur les masses moléculaires de la DEM05 de 657 mg/kg p.c./jour pour le 2‑butanol) en raison d’une baisse de la survie des petits et d’un poids corporel néonatal réduit en présence d’une toxicité pour la mère.
La principale source d’exposition de l’ensemble de la population à la MEK par les milieux environnementaux et les aliments sont l’alimentation, et dans une moindre mesure, l’air intérieur. D’après les données disponibles, on s’attend à ce que la plus grande exposition par le régime alimentaire à la MEK provienne des aliments dans lesquels la substance serait naturellement présente.
La population générale du Canada peut également être exposée à la MEK, principalement par inhalation, lorsqu’elle utilise différents produits offerts aux consommateurs qui contiennent la substance, y compris les produits pour les ongles, les peintures et les produits de bricolage. Le tableau 7.5 présente les valeurs d’exposition et les effets critiques pertinents de la MEK sur la santé en, ainsi que les marges d’exposition obtenues pour la caractérisation du risque.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Effet critique |
ME |
|---|---|---|---|---|
Exposition totale dans les milieux environnementaux |
De 9,1 à 27,6 µg/kg p.c./jour |
DEM05 = 639b mg/kg p.c./jour |
Étude de l’effet du 2‑butanol sur le développement; diminution du poids fœtal et du poids des petits, et gain de poids corporel chez les mères |
> 22 986 |
Aromatisant alimentaire |
De 0,6 à 2,0 µg/kg p.c./jour |
DEM05 = 639b mg/kg p.c./jour |
Étude de l’effet du 2‑butanol sur le développement; diminution du poids fœtal et du poids des petits, et gain du poids corporel chez les mères |
> 319 500 |
Produits pour les ongles (inhalation) |
Exposition moyenne pondérée de 7 heuresa = De 4,1 à 15,8 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
De 329 à 1269 |
Sucettes et jouets de dentition (voie orale) |
De 0,09 à 0,30 mg/kg p.c./jour |
DEM05 = 639b mg/kg p.c./jour |
Étude de l’effet du 2‑butanol sur le développement; diminution du poids fœtal et du poids des petits, et gain du poids corporel chez les mères |
De 2130 à 7100 |
Décapant pour laque (par inhalation) |
Exposition moyenne pondérée de 7 heures = De 131 à 514 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
De 10 à 40 |
Dissolvant d’adhésif (par inhalation) |
Exposition moyenne pondérée de 7 heures = 1843 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
3 |
Diluant à peinture, revêtement de plancher (par inhalation) |
Exposition moyenne pondérée de 7 heures = 120 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
43 |
Peinture liquide (peinture riche en solvant) pour plate-forme de camion (par inhalation) |
Exposition moyenne pondérée de 7 heures = 176 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
30 |
Peinture en aérosol (par inhalation) |
Exposition moyenne pondérée de 7 heures = De 3 à 167 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
De 31 à 1743 |
Ciment/apprêts au PVC (par inhalation) |
Exposition moyenne pondérée de 7 heures = De 5 à 109 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
De 48 à 1040 |
Adhésifs multiusages |
Exposition moyenne pondérée de 7 heures = De 8 à 44 mg/m3 |
DECM10 = 5202 mg/m3 (exposition intermittente) |
Incidence accrue de sternèbres mal alignées chez les fœtus |
De 118 à 650 |
Abréviations : TWA, Exposition moyenne pondérée sur une période de temps.
a Les expositions moyennes pondérées de sept heures ont été dérivées pour tous les scénarios d’utilisation de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisées pour caractériser les risques.
b Ajustement molaire calculé à partir de la valeur obtenue de données croisées. Les masses moléculaires sont de 74,12 g/mol pour le 2‑butanol, de 72,11 g/mol pour la MEK et de 86,13 g/mol pour la MPK.
Les marges d’exposition à la MEK dans les milieux environnementaux et les aliments (aromatisant alimentaire) sont considérées comme adéquates pour compenser les incertitudes des bases de données sur les effets de l’exposition sur la santé. L’absorption alimentaire supplémentaire de MEK en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. De plus, le JECFA (OMS, 1999b) a conclu qu’il n’y avait aucun problème de sécurité estimations de quantités ingérées lorsque la MEK est utilisé comme agent aromatisant, d’après les estimations de l’exposition par le régime alimentaire à la substance.
Les marges d’exposition calculées pour les sucettes et les jouets de dentition, les produits pour les ongles et les adhésifs multiusages sont considérées être adéquates; par contre, les marges d’exposition à la MEK par inhalation provenant d’autres produits offerts aux consommateurs (p. ex. décapant pour laque, dissolvant d’adhésif, diluant à peinture, peinture liquide et peinture en aérosol) sont considérées comme étant potentiellement inadéquates pour tenir compte des incertitudes dans les bases de données.
MPK
Aucune étude de cancérogénicité concernant la MPK n’a été recensée. Toutefois, aucune prévision positive n’est ressortie du modèle QSAR et on n’a pas relevé la présence d’alertes structurales associées à la cancérogénicité. De plus, d’après les résultats de plusieurs essais in vitro, la substance n’était pas génotoxique. Dans la seule étude disponible sur la toxicité par voie orale, des effets minimes (une légère diminution de la prise de poids corporel) ont été signalés chez les rats à la dose la plus élevée de MPK administrée dans l’eau pendant 13 mois (Bingham et coll., 2001, HSDB, 2015b); la DSENO/DMEO est considérée comme étant de 454 mg/kg p.c./jour. En ce qui concerne l’exposition par inhalation, aucun effet nocif, à l’exception d’une légère neurotoxicité transitoire chez les mères pendant l’exposition, n’a été observé dans les études où des CSENO de 5000 et de 5300 mg/m3 ont été identifiées (ECHA, c2007-2017c).
La principale source d’exposition de l’ensemble de la population à la MPK par les milieux environnementaux et les aliments est l’alimentation. D’après les données disponibles, on s’attend à ce que la plus grande exposition par le régime alimentaire à la MPK provienne des aliments dans lesquels la substance est naturellement présente.
Les seules utilisations par les consommateurs, relevées par la MPK concernaient des produits de peinture. La comparaison des estimations d’exposition à la MPK dans les milieux environnementaux (de 2,3 à 6,8 µg/kg p.c./jour) et dans le cadre de son utilisation en tant qu’aromatisant alimentaire dans la nourriture (de 0,7 à 2,0 µg/kg p.c./jour) et des DSENO/DMEO de 454 mg/kg p.c./jour a donné des marges d’exposition supérieures à 66 765, ce qui est considéré comme des marges adéquates pour tenir compte des incertitudes des bases de données sur les effets sur la santé et l’exposition. L’absorption alimentaire supplémentaire de MPK en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. De plus, le JECFA (OMS, 1999b) a conclu qu’il n’y avait aucun problème de sécurité aux quantités ingérées estimées lorsque la MPK est utilisée comme agent aromatisant, d’après les estimations de l’exposition par le régime alimentaire à la substance. Comme la MPK présente un faible potentiel de danger par inhalation, le risque à la santé humaine se rapportant à la présence de MPK dans les produits offerts aux consommateurs est considéré comme étant faible.
7.1.4 Incertitudes dans l’évaluation des risques posés par la MEK et la MPK sur la santé humaine
Les sources principales d’incertitude sont présentées dans le tableau suivant. Il existe de l’incertitude sur les estimations de l’exposition par inhalation découlant de l’utilisation de produits offerts aux consommateurs, en ce qui a trait à la plage de concentrations dans les différents produits, à l’emplacement de l’activité et aux valeurs par défaut utilisées avec le logiciel ConsExpo Web (ConsExpo 2016). Il est fort probable que l’utilisation des concentrations maximales et à la borne supérieure des quantités de ces types de produits ne représente pas une sous-estimation des expositions potentielles de la population.
Il existe une certaine incertitude quant à la toxicité de la MEK à la suite d’une exposition sur le long terme, puisqu’il n’existe aucune donnée disponible; toutefois, on a jugé qu’il convenait d’utiliser le 2‑butanol, un métabolite principal de la MEK, comme substance analogue pour caractériser les risques.
Sources principales d’incertitude |
Incidence |
|---|---|
On pose que les expositions par voie cutanée sont minimales par rapport aux expositions par inhalation, étant donné la forte volatilité des substances; toutefois, |
- |
Manque d’études sur la toxicité de la MEK ou de la MPK par voie orale ou par inhalation. |
- |
Évaluation la toxicité du MEK à doses répétées et de sa toxicité pour la reproduction et le développement par lecture croisée des données sur le 2‑butanol |
+/- |
Sélection d’un niveau d’effet prudent d’une étude sur la reproduction et le développement pour la caractérisation des risques dans un scénario d’exposition aiguë par inhalation à la MPK (produits de peinture). |
+ |
+ : incertitude ayant le potentiel de causer une surestimation de l’exposition ou du risque
- : incertitude ayant le potentiel de causer une sous-estimation de l’exposition ou du risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque
7.2 Évaluation du sous-groupe 2 (MIBK, MIAK et alcool de diacétone)
7.2.1 Évaluation de l’exposition au sous-groupe 2 (MIBK, MIAK et alcool de diacétone)
Milieux environnementaux
La MIBK a été visée par programme du Réseau national de surveillance de la pollution atmosphérique (RNSPA). Les concentrations moyennes mesurées de MIBK entre 2006 et 2010, dans différents lieux d’un bout à l’autre du Canada variaient de 0,014 à 0,29 µg/m3 et des concentrations au 95e centile variaient de 0,08 à 1,05 µg/m3 (ECCC, 2017) variant de de 0,016 à 0,185 µg/m3, et les concentrations au 95e centile variant de 0,086 à 0,470 µg/m3 (Zhu et coll., 2005; Santé Canada, 2010a, b, 2012, 2013). La plus forte concentration au 95e centile (0,470 µg/m3 selon l’étude de 2005 à Windsor) a été utilisée pour estimer les expositions de la population générale. Il n’existe aucune information ou donnée sur la MIAK ou l’alcool de diacétone dans l’air ambiant au Canada ou ailleurs.
On a mesuré la MIBK dans l’étude sur l’air intérieur dans le cadre du cycle 2 de l’ECMS, et elle a été détectée dans environ 96 % des échantillons. Cette étude (Zhu et coll., 2013) a trouvé une concentration moyenne géométrique de MIBK de 0,235 µg/m3, avec une concentration au 95e centile de 1,62 µg/m3 (données pondérées dans la maison). Les concentrations moyennes géométriques de MIBK publiée par les cinq études canadiennes sur l’air variaient de 0,14 à 1,33 µg/m3, et les valeurs au 95e centile de 0,33 à 13,82 µg/m3 (Zhu et coll., 2005; Santé Canada, 2010a, b, 2012, 2013). Nous avons utilisé les concentrations les plus élevées au 95ecentile pour estimer les expositions de la population générale (13,82 µg/m3 pour la MEK de l’étude de Windsor de 2005). On a mesuré la MIAK dans l’étude sur l’air intérieur dans le cadre du cycle 2 de l’ECMS, mais elle a été détectée dans seulement 1,45 % des échantillons (limite de détection de 0,19 µg/m3). La moyenne géométrique et la concentration au 95e centile de MIAK dans l’air intérieur étaient respectivement de 0,10 µg/m3 et de 0,11 µg/m3 (données pondérées dans toute l’habitation) [Zhu et coll., 2013]. La concentration moyenne géométrique de MIAK dans 24 échantillons d’air intérieur prélevés dans le cadre de l’étude au champ menée au Québec était de 0,23 µg/m3, et la concentration maximale, de 1,51 µg/m3 (Won et Lusztyk, 2011). Nous avons utilisé la concentration maximale dans l’air intérieur pour estimer les expositions de la population générale. On n’a retrouvé aucune donnée empirique de l’alcool de diacétone dans l’air intérieur au Canada ou ailleurs. À en juger par sa très grande solubilité dans l’eau et sa faible constante de la loi d’Henry, on ne s’attend pas à ce que l’air soit une source importante d’exposition de la population à l’alcool de diacétone.
Des échantillons d’air personnel ont également été mesurés dans le cadre de l’étude de Santé Canada (2010a) à Windsor. La concentration moyenne géométrique de MIBK dans l’air personnel pendant l’été et l’hiver étaient respectivement de 1,04 µg/m3 et de 0,23 µg/m3. Les concentrations au 95e centile de MIBK étaient de 7,96 µg/m3 pendant l’été et de 0,99 µg/m3 l’hiver (Santé Canada, 2010a).
On n’a mesuré aucune concentration de MIBK, de MIAK et d’alcool de diacétone dans l’eau potable au Canada. On n’a trouvé aucune autre information sur la présence de MIAK dans l’eau ailleurs; toutefois, on a détecté de la MIBK dans 3 des 646 échantillons d’une étude menée aux États-Unis qui a signalé des concentrations mesurées entre 16 et 20 µg/L (Grady et Casey, 2001). Plusieurs études sur les eaux de surface ont mesuré la MIBK (Benfenati et coll., 1992; Hall, 1987; Sheldon et Hites, 1978, Bianchi et Varney, 1998; EPA des États-Unis, 2002). En outre, on a trouvé des concentrations élevées de MIBK dans les eaux souterraines, les effluents et le lixiviat à proximité des sites d’enfouissement, des installations de retraitement des huiles et des usines de traitement des eaux usées (Mutch et coll., 1983; Sawhney et Kozloski, 1984; Sabel et Clark, 1984; Canter et Sabatini, 1994; Paxeus, 1996; EPA des États-Unis, 1998). La valeur maximale de 20 µg/L mesurée aux États-Unis a été utilisée pour estimer les expositions à la MIBK occasionnées par la consommation d’eau potable de la population générale. Les résultats relatifs aux absorptions de la population générale variaient entre 0,1 µg/kg‑p.c. par jour (adultes de 60 ans et plus) à 2,1 µg/kg‑p.c. par jour (nourrissons de 0 à 6 mois nourris au lait maternisé). Le modèle ChemCan a été utilisé pour dériver les concentrations de MIAK et d’alcool de diacétone dans l’eau au moyen des données sur le volume du tableau 4-1. Les concentrations de MIAK et d’alcool de diacétone dans l’eau potable étaient de 0,15 ng/L et de 46,6 ng/L respectivement, d’où découlent des absorptions par la population générale.
Aucune information ou donnée sur la MIBK, la MIAK ou l’alcool de diacétone dans le sol n’a été recensée pour le Canada. On a détecté qualitativement de l’alcool de diacétone dans les sédiments d’un lac en Saskatchewan au Canada (HSDB, 1983). Nous avons utilisé le modèle ChemCan pour calculer les concentrations de MIBK, de MIAK et d’alcool de diacétone dans le sol au moyen des données sur le volume du tableau 4-1. Les concentrations dans le sol de MIBK, de MIAK et d’alcool de diacétone étaient de 1,9 ng/kg, de 0,3 ng/kg et de 7 pg/kg; ainsi, l’exposition à ces substances dans le sol est jugée négligeable (absorptions inférieures à 1 ng/kg‑p.c. par jour).
Les estimations de l’exposition à la MIBK, à la MIAK et à l’alcool de diacétone par les milieux environnementaux variaient entre 2,5 µg/kg p.c./jour pour les adultes (60 ans et plus) à 7,5 µg/kg p.c./jour pour les tout-petits (de six mois à quatre ans), de 0,3 µg/kg‑p.c. par jour pour les adultes (60 ans et plus) à 0,9 µg/kg‑p.c. par jour pour les tout-petits (de six mois à quatre ans et de 0,001 µg/kg‑p.c. par jour pour les adultes (60 ans et plus) à 0,005 µg/kg‑p.c. par jour pour les nourrissons nourris au lait maternisé (de 0 à 6 mois), respectivement (Santé Canada, 2018).
Aliments
On a détecté de la MIBK dans diverses denrées alimentaires qui en contiennent naturellement, dont la bière, le cognac, le poulet, les fruits, l’huile d’olive, les œufs, le café et le lait de vache (Nijssen et coll., 1963-2016; études, Burdock, 2010). On mentionne également l’utilisation de la MIBK comme aromatisant alimentaire dans les produits de boulangerie, les produits laitiers surgelés, les gélatines et les poudings, les produits laitiers, les boissons non alcoolisées et les bonbons mous (Burdock, 2010). On a détecté de la MIBK (dans deux échantillons sur douze), mais on ne l’a pas quantifié dans le lait maternel (Pellizari et coll., 1982).
Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a évalué un groupe de 39 alcools secondaires aliphatiques cycliques saturés, les cétones et les esters saturés et non saturés connexes utilisés comme aromatisants (OMS, 1999b). Dans le cadre de cette évaluation, le Comité estimait que l’absorption de MIBK par personne découlant de l’utilisation de ces substances en tant qu’aromatisant alimentaire était de 0,03 µg/kg‑p.c. par jour pour la population des États-Unis et de 0,12 µg/kg p.c. par jour pour la population européenne (l’annexe A présente plus de détails).
On a détecté de la MIAK dans quelques denrées alimentaires, dont le café (0,5 µg/g) et la papaye (0,001 µg/g) (Nijssen et coll., 1963-2016), dans les avelines rôties, le bacon frit, le bœuf cuit et le porc cuit (HSDB, 1983-). On a détecté de l’alcool de diacétone dans diverses denrées alimentaires, notamment fruits, légumes, produits laitiers, miel, noix, œufs, poulet et boissons alcoolisées (Nijssen et coll.,1963-2016, étude).
Les estimations quantitatives de l’exposition à la MIBK, à la MIAK et à l’alcool de diacétone du fait de leur présence naturelle dans les alimentsNote de bas de page 7 variaient de 0,4 µg/kg‑p.c. par jour pour les enfants âgés de quatre à huit ans à 32 µg/kg‑p.c. par jour pour les adultes de dix-neuf ans et plus pour la MIBK, de 0,001 µg/kg‑p.c. par jour pour les tout-petits d’un an à 3 µg/kg‑p.c. par jour pour les adultes de dix-neuf ans et plus pour la MIAK et de 0,04 µg/kg‑p.c. par jour pour les nourrissons de six à douze mois à 4 µg/kg‑p.c. par jour pour les tout-petits de deux à trois ans pour l’alcool de diacétone.
Produits offerts aux consommateurs
MIBK
On a signalé la présence de MIBK comme ingrédient non médicinal dans l’alcool à friction, homologué comme produit de santé naturel (PSN), à usage topique, avec une concentration de 0,98 % (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada de Santé Canada, daté du 16 août 2016; source non citée). À l’aide du logiciel ConsExpoWeb (2016), nous avons estimé les expositions par inhalation de MIBK liées à une utilisation de ce produit par les tout-petits et les adultes. Les paramètres employés dans le modèle sont présentés à l’annexe B. La concentration moyenne par événement, quel que soit le groupe d’âge de ce scénario d’exposition, a été estimée à 0,19 mg/m3 et la concentration moyenne le jour de l’exposition à 2,7 ×10-4 mg/m3. Même si l’exposition par voie cutanée pourrait contribuer à l’exposition globale lors de l’utilisation de produits offerts aux consommateurs, nous considérons que l’inhalation est la voie principale, compte tenu de la forte volatilité de la MIBK. C’est pourquoi nous présenterons seulement des estimations de l’exposition par l’inhalation.
Une variété de produits offerts aux consommateurs contiennt de la MIBK, ce qui peut entraîner une exposition de la population générale du Canada. Seuls les scénarios d’utilisation des produits qui entraînent les niveaux d’exposition potentielle les plus élevés à la MIBK par inhalation sont présentés au tableau 7‑7. Nous avons aussi estimé que les tout-petits et les enfants (qui constituent les groupes d’âge les plus exposés) étaient indirectement exposés par voie orale ou par inhalation quand ils utilisaient des marqueurs à essuyage à sec (tableau 7‑7). Les estimations de l’exposition indirecte par voie orale résultant de chaque utilisation de marqueurs à essuyage à sec se chiffraient à 0,48 et à 0,97 mg/kg‑p.c. pour les enfants et les tout-petits, respectivement. Les expositions potentielles ont été estimées au moyen du logiciel ConsExpo Web (2016) ou des algorithmes pertinents. L’annexe B présente plus de détails.
Scénario pour le produit |
Concentration de MIBK |
Concentration moyenne par événement (mg/m3) |
Concentration moyenne le jour de l’exposition (mg/m3) |
Concentration moyenne pondérée de 6 heuresa (mg/m3) |
|---|---|---|---|---|
Laque pour bois |
de 1 à 10 % |
de 270 à 2600 |
de 11 à 110 |
de 45 à 433 |
Peinture liquide (peinture riche en solvant) pour doublure de caisse, appareils |
13 % |
130 |
12 |
48 |
Peinture en aérosol |
de 0,1 à 30 % |
de 5,3 à 1200 |
de 0,09 à 21 |
de 0,4 à 83 |
Remplissage ou mastic en tube (automobile) |
de 1 à 8 % |
de 6,7 à 38 |
de 0,3 à 1,6 |
de 1 à 6 |
Marqueur à essuyage à sec |
30 % |
3,6 |
0,11 |
0,45 |
a Les expositions moyennes pondérées de six heures ont été dérivées pour tous les scénarios de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisées pour caractériser le risque. Concentration moyenne pondérée de 6 h = concentration moyenne par événement × durée d’exposition/6 × 60 min
MIAK
On a trouvé de la MIAK dans plusieurs marques de peinture en aérosol et dans un stylo de réparation du revêtement automobile (Santé Canada, 2016; Household Products Database [HPD]; 1993-). L’utilisation de peintures en aérosol contenant entre 1 % et 10 % de MIAK représente le scénario d’exposition sentinelle. La concentration moyenne par événement calculée par le logiciel ConsExpo Web (ConsExpo 2016) à laquelle un adulte utilisant de la peinture en aérosol contenant de la MIAK est exposé variait de 41 à 280 mg/m3, tandis que la concentration moyenne de l’exposition par événement le jour de l’exposition variait de 0,7 à 4,8 mg/m3. Les concentrations moyennes pondérées de six heures variaient de 3 à 19 mg/m3 (voir l’annexe B pour plus de détails). Même si l’exposition par voie cutanée pourrait contribuer à l’exposition globale pendant l’utilisation de produits offerts aux consommateurs, on considère que la voie principale est l’inhalation, compte tenu de la forte volatilité de la MIAK. C’est pourquoi nous présenterons seulement des estimations de l’exposition par l’inhalation.
Alcool de diacétone
Selon les déclarations faites à Santé Canada en vertu du Règlement sur les cosmétiques, l’alcool de diacétone est utilisé comme solvant ou agent masquant d’odeur dans certains produits cosmétiques au Canada tels que les traceurs d’yeux autocollants et divers produits de soins pour les ongles, dont les vernis de base, les vernis de finition, les vernis à ongles, les dissolvants de vernis à ongles et les fortifiants pour ongles (communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada datant d’août 2016 et d’avril 2017; source non citée).
Les estimations de l’exposition par inhalation ont été calculées pour certains produits sentinelles (couche de finition, vernis à ongles et dissolvant de vernis à ongles) dont les niveaux d’exposition sont les plus élevés par rapport à des produits semblables. Le tableau 7‑8 résume la plage de concentrations pour différents scénarios de produits ainsi que les estimations de l’exposition par inhalation associée. Seules les estimations de l’exposition des adultes et des tout-petits y sont présentées; elles correspondent toutefois à la plage de valeurs d’exposition potentielle de tous les groupes d’âge. Des précisions sur la méthode et les paramètres utilisés pour produire les estimations de l’exposition par inhalation aux cosmétiques sont présentées à l’annexe B.
L’exposition à l’alcool de diacétone par voie cutanée découlant de l’utilisation de ces produits est aussi possible et, contrairement aux autres cétones discutées jusqu’à maintenant, est plus probable étant donné sa plus faible pression de vapeur et sa plus grande hydrosolubilité. Nous avons retracé une étude d’absorption cutanée in vitro sur des tissus humains qui a révélé que les quantités d’alcool de diacétone pénétrant la peau après 10 minutes, 60 minutes et 24 heures se chiffraient respectivement à 0,04 %, à 0,15 % et à 5,71 % pour une dose de 25 cm/cm2 (Fasano et McDougal, 2008; ECHA, c2007-2017a). Le tableau 7‑8 présente les expositions systémiques par voie cutanée estimées en supposant une absorption de 6 % par la peau
Scénario pour le produit |
Concentration maximalea |
Concentration moyenne par événement (mg/m3) |
Concentration moyenne pondérée de 6 heures (mg/m3) |
Exposition systémique par voie cutanée (mg/kg p.c./évén.) |
|---|---|---|---|---|
Vernis à ongles (adultes et adolescents) |
10 % |
3,5 |
0,34 |
De 0,014 à 0,016 |
Vernis à ongles (tout-petits) |
10 % |
3,1 |
0,30 |
0,023 |
Traceurs d’yeux autocollants (adultes et adolescents) |
30 % |
0,67 |
1,3 |
De 0,007 à 0,008 |
a Communication personnelle, courriels de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau d’évaluation des risques des substances existantes de Santé Canada, en août 2016 et avril 2017; source non citée.
Autres produits
On a trouvé de l’alcool de diacétone dans des scellants pour filets de tuyau, des produits à pulvériser, dont des peintures, des agents de nettoyage et des produits automobiles, ainsi que des diluants à peinture (utilisés pour diluer les laques et nettoyer les brosses). Le tableau 7‑9 résume des scénarios calculés avec le logiciel ConsExpo Web de l’exposition par inhalation et par la peau à d’alcool de diacétone contenu dans des produits de bricolage offerts aux consommateurs, (ConsExpo, 2016).
Scénario pour le produit |
Concentration d’alcool de diacétone |
Concentration moyenne par événement (mg/m3) | Dose interne inhalée le jour de l’exposition (mg/kg‑p.c./jour) | Exposition systémique par voie cutanée (mg/kg p.c./jour) |
|---|---|---|---|---|
Scellant pour filets de tuyau |
de 20 à 30 % |
de 35 à 51 |
de 1,7 à 2,5 |
de 0,012 à 0,018 |
Nettoyant (à pulvériser) de voiture |
de 1 à 30 % |
de 13 à 110 |
de 0,04 à 0,32 |
de 0,013 à 0,38 |
Décapant (à pulvériser) à peinture ou à marqueur |
10 % |
81 |
0,32 |
0,13 |
Peinture en aérosol |
1 à 5 % |
de 21 à 72
|
de 0,11 à 0,36 |
de 0,007 à 0,066 |
Diluant à peinture époxy |
de 5 à 10 % |
de 55 à 71
|
de 0,46 à 0,60 |
de 0,09 à 0,17 |
On a également trouvé de l’alcool de diacétone dans des marqueurs permanents (Santé Canada, 2016; HPD, 1993-). Ces produits peuvent être utilisés par de jeunes enfants et donc, les expositions par voie orale et par voie cutanée ont été considérées. En raison du peu de données disponibles, nous avons supposé une concentration de 100 % d’alcool de diacétone dans les marqueurs (FS, 2008b; FS, 2012a; FS, 2014). Les estimations de l’exposition indirecte par voie orale résultant de chaque utilisation de marqueurs permanents se chiffraient à 1,6 et à 3,2 mg/kg‑p.c. pour les enfants et les tout-petits, respectivement. Les estimations de l’exposition systémique par voie cutanée quotidienne, en supposant une absorption cutanée de 6 %, variaient entre 0,002 mg/kg‑p.c./jour pour les adultes et 0,005 pour les enfants (il est présumé que les tout-petits n’utilisent pas de marqueurs permanents de façon quotidienne). Toute exposition à l’alcool de diacétone par inhalation résultant de l’utilisation de marqueurs permanents est considérée comme incluse dans les estimations prudentes des expositions par voie orale et par voie cutanée (détails à l’annexe B).
7.2.2 Évaluation de l’exposition au sous-groupe 2 (MIBK, MIAK et alcool de diacétone)
La MIBK et la MIAK sont des molécules dont la structure est similaire. Elles se distinguent l’une de l’autre par la présence d’un groupe méthyle supplémentaire sur la chaîne carbonée. Sur le plan biologique, elles interagissent et se métabolisent de manière semblable dans l’organisme. Nous avons inclus l’alcool de diacétone dans ce sous-groupe puisqu’il s’agit d’un métabolite principal de la MIBK. Sa clairance métabolique est probablement semblable, et pourrait être responsable de certains des effets biologiques observés après une exposition à la MIBK. Les effets communs aux trois produits chimiques comprennent une diminution du poids corporel, une hausse du poids des reins et du foie et une dépression du système nerveux central (SNC). Nous n’avons trouvé aucune donnée sur le métabolisme de la MIAK, toutefois les similitudes structurales avec la MIBK laissent à penser qu’elles ont des métabolites et des taux métaboliques analogues.
7.2.2.1 MIBK
La MIBK a fait l’objet d’un examen par l’OCDE (1996), le PISC (1996), le système intégré d’information sur les risques (IRIS) de l’EPA des É.‑U. (2003b), le Centre international de recherche sur le cancer (CIRC) (2013) et le National Industrial Chemicals Notification and Assessment Scheme (NICNAS) (2017). Ces études servent de base à la caractérisation des effets sur la santé de la présente ébauche d’évaluation préalable. Nous avons réalisé une recherche documentaire s’étendant depuis l’année précédant le rapport d’évaluation initiale de l’OCDE (1996) jusqu’en janvier 2017. D’après une étude de deux ans sur la cancérogénicité occasionnée par l’inhalation menée par le National Toxicology Program (NTP) (2007b) chez deux espèces mammifères (le rat et la souris), le CIRC a classifié la MIBK comme faisant partie du groupe 2B, « possiblement cancérogène pour les humains », étant donné les données probantes suffisantes de cancérogénicité chez les animaux de laboratoire (monographie du CIRC, vol. 101, 2013). Nous avons utilisé le rapport du CIRC pour fonder la caractérisation des effets cancérogènes, et le document du système intégré d’information sur les risques (IRIS) de l’EPA des É.‑U. comme base pour la caractérisation des effets non cancérogènes de la MIBK.
Toxicocinétique et métabolisme
La MIBK est rapidement absorbée après une exposition par voie orale, par inhalation ou par voie cutanée (Duguay et Plaa, 1995; Hjelm et coll., 1990; Hjelm et coll., 1991, cité dans IRIS de l’EPA, 2003b et NTP 2007b). Le principal métabolite détecté dans le plasma des rats qui ont reçu de la MIBK par gavage est l’alcool de diacétone, et, dans une moindre mesure, du 4-méthyl-2-pentanol, (DiVincenzo et coll., 1976; Duguay et Plaa, 1995, cité dans NTP 2007b et IRIS de l’EPA, 2003b). Toutefois, le 4-méthyl-2-pentanol a été le principal métabolite (environ deux fois la quantité d’alcool de diacétone) détecté dans les poumons des rats après une exposition par inhalation. Chez les humains, l’exposition par inhalation à des concentrations de 10, de 100 ou de 200 mg/m3 de MIBK pendant deux heures a entraîné une rétention pulmonaire d’environ 60 %, avec une clairance sanguine moyenne de 1,6 L/h/kg, et environ 0,04 % de la dose totale a été excrétée sous forme inchangée dans l’urine dans les trois heures suivant l’exposition (Hjelm et coll., 1990, cité dans NTP, 2007b). En ce qui concerne l’exposition par voie cutanée, le taux d’absorption percutanée de MIBK chez les cobayes exposés variait de 0,11 à 2,0 μmol/min/cm et avoisinait 1,1 μmol/min/cm (Hjelm et coll., 1991, cité dans IRIS de l’EPA, 2003b).
Cancérogénicité et génotoxicité
Lors d’une étude sur deux ans d’inhalation par des souris et des rats mâles et femelles, la MIBK a accru les incidences d’adénome hépatocellulaire et d’adénome hépatocellulaire et de carcinome combinés chez les souris mâles et femelles, ainsi que celles d’adénome des tubules rénaux et d’adénome des tubules rénaux et de carcinome combinés chez les rats mâles et a causé deux tumeurs rénales malignes rares de nature mésenchymateuse chez les rattes exposées à la dose élevée, soit une concentration de 7374 mg/m3 (NTP, 2007b; CIRC, 2013). Deux tumeurs rénales malignes rares de nature mésenchymateuse et une incidence accrue de leucémie à cellules mononucléées ont également été observées chez les rats ayant reçu la dose la plus élevée. Chez ceux-ci, l’incidence et la gravité des effets rénaux, y compris la néphropathie chronique, ont considérablement augmenté. Bien que les changements pathologiques chez les rats mâles correspondent au spectre de la néphropathie induite par l’α2u-globuline et qu’on ait rapporté la formation de gouttelettes hyalines chez les rats mâles exposés à la MIBK dans des études à plus court terme (p. ex., Phillips et coll., 1987 et Nemec et coll., 2004, cité dans NTP, 2007b), comme la néphropathie a également été observée chez les rats femelles, le NTP (2007b) a déclaré que des tumeurs rénales pouvaient se développer indépendamment d’un mécanisme de l’α2u‑globuline. De surcroît, le CIRC (2013) a déterminé que la pertinence des tumeurs rénales chez les rats pour les humains ne pouvait être exclue. La CMENO pour les effets non cancérogènes de l’inhalation chronique de MIBK a été établie à 1843 mg/m3, sur la base d’une néphropathie de minime à légère dans l’essai biologique sur deux ans (NTP, 2007b).
À la suite de la publication du rapport du NTP (2007b) et de la monographie du CIRC (2013), de récentes études ont indiqué que les tumeurs rénales et hépatiques induites par la MIBK apparaissaient chez les rongeurs par des mécanismes tels que la néphropathie de l’α2u‑globuline et le mode d’action médié par le récepteur constitutif des androstanes (RCA), respectivement, qui ne sont pas transposables chez les humains (Hughes et coll., 2016; Borghoff et coll., 2015). Dans un examen de ces données, le NICNAS (2017) a conclu que, bien que des éléments probants appuient la théorie selon laquelle les tumeurs hépatiques chez les souris résultent de l’activation du RCA, un mécanisme autre que celui mettant en cause l’α2u‑globuline pourrait être responsable des tumeurs rénales chez les rats; cette information, ainsi que l’observation de la leucémie mononucléée chez les rats mâles et les tumeurs rénales de nature mésenchymateuse chez les rats femelles, étayent la conclusion selon laquelle les tumeurs chez les rats sont transposables chez les humains et suffisantes pour classer la MIBK parmi les cancérogènes de catégorie 2 selon le Système général harmonisé de classification et d’étiquetage des produits chimiques (SGH).
De nombreuses études in vivo et in vitro ont conclu que la MIBK n’était pas génotoxique (NTP, 2007b; CIRC, 2013).
Toxicité à doses répétées
On a une exposition à la MIBK par inhalation répétée à des effets sur le poids du foie et des reins, les paramètres biochimiques ou le système nerveux central des rats et des souris, à partir de concentrations de 410 mg/m3 (Phillips et coll., 1987; MacEwen et coll., 1971; David et coll., 1999, le tout cité dans IRIS de l’EPA, 2003b). Toutefois, selon l’IRIS de l’EPA des É.‑U. (2003b), il n’y a pas de continuum toxicologique clair de la gravité ou de progression marquée de la réponse en fonction d’une concentration croissante ni de pathologie clinique ou de lésion histopathologique corroborante liée au traitement, et les effets observés n’ont pas été jugés clairement nocifs. On considère donc que leur pertinence pour les effets chez les humains après des expositions chroniques est incertaine.
Dans une étude de toxicité subchronique par voie orale, des rats mâles et femelles ont reçu une dose de 0, de 50, de 250 ou de 1000 mg/kg‑p.c./jour de MIBK par gavage pendant treize semaines (MAI, 1986, cité dans IRIS de l’EPA des É.‑U., 2003b et OMS, 1990). Des modifications dans une série de paramètres de chimie clinique indiquant des effets hépatiques et rénaux ont été observées chez les mâles et les femelles à la plus forte dose; une augmentation du poids absolu et relatif des reins a aussi été observée chez les deux sexes à 250 mg/kg‑p.c./jour et plus. Il y a eu une incidence accrue de néphropathie légère chez les mâles à 1000 mg/kg‑p.c./jour. On n’a noté aucun effet à 50 mg/kg‑p.c./jour, valeur que l’OMS (1990) et le CIRC (2013) ont déterminée comme étant la DSEO. Cependant, l’EPA des É.‑U. (IRIS de l’EPA des É.‑U., 2003b) considère 1000 mg/kg‑p.c./jour comme une DSENO, ce qui laisse entendre que les effets observés ont été difficiles à interpréter et pourraient ne pas être néfastes biologiquement compte tenu de l’absence de changements histopathologiques clairs. L’EPA des É.‑U. a également établi que la DSENO pour une étude de la toxicité par voie orale dans l’eau potable était d’environ 1000 mg/kg‑p.c./jour, d’après l’incertitude entourant la nocivité biologique des effets rénaux observés (Institut de recherche de l’Université Carnegie-Mellon, 1977a, b, cité dans IRIS de l’EPA des É.‑U., 2003b).
À la lumière des incertitudes entourant la nocivité des effets observés dans les études de toxicité subchronique par voie orale, pour la caractérisation du risque après une exposition par voie orale à plus long terme, la CMENO de 1843 mg/m3, déterminée lors de l’étude par inhalation plus récente et complète du NTP (2007b) est extrapolée à une dose de 101 mg/kg‑p.c./jour. En effet, l’extrapolation d’une voie à l’autre est jugée appropriée pour les effets internes critiques sur les reins des rats mâles et femelles. En outre, le NICNAS (2017) a récemment déterminé que les effets rénaux observés dans l’étude de deux ans sur les rats étaient transposables chez les humains.
Dans une étude d’exposition par voie cutanée sur quatre mois, on a appliqué de la MIBK sur la queue (les deux tiers inférieurs) d’un nombre indéfini de rats blancs mâles, chaque jour (à raison de 4 h/jour) à des doses de 300 ou 600 mg/kg. Ces doses ont provoqué des changements morphologiques de la peau, du cerveau, du foie, de la glande surrénale, de la rate et des testicules et une réduction du nombre de spermatocytes, de spermatides et de spermatozoïdes (Malysheva, 1988, cité dans NTP, 2007b).
Toxicité à court terme et aiguë
Lors d’es études d’inhalation à court terme réalisé sur des rats et des souris on a observé des effets limités au foie et aux reins. On a jugé que la plus faible DSENO était de 410 mg/m3, en se basant sur un poids relatif des reins accru et une néphrose tubulaire liée aux gouttelettes hyalines chez les mâles (Hazleton Laboratories, Inc. 1968, cité dans IRIS de l’EPA, 2003b; Dodd et coll., 1982; Phillips et coll., 1987, cité dans NTP, 2007b et PISC, 1990; MacEwen et coll., 1971; Vernot et coll., 1971, cité dans IRIS de l’EPA, 2003b). De la même manière que les études à plus long terme, les effets observés n’ont pas été jugés clairement nocifs. On a donc établi que leur pertinence pour les effets chez les humains était incertaine.
La MIBK s’est révélée peu toxique après une exposition aiguë par voie orale, par voie cutanée et par inhalation (Smyth et coll., 1951 et 1956; Batyrova, 1973; RTECS, 1987; Zakhari, 1977). Des effets neurologiques (surtout des changements comportementaux) ont été observés lors de plusieurs des études mentionnées plus haut. Toutefois, les effets ont généralement été transitoires ou se sont atténués avec une exposition prolongée et se sont produits à des concentrations plus élevées que celles associées aux paramètres critiques pour le foie et les reins. Dans plusieurs études auprès de volontaires humains exposés à une dose allant jusqu’à 200 ppm, la MIBK a causé une irritation réversible et des symptômes liés au SNC (IRIS de l’EPA des É.‑U., 2003b).
Toxicité pour la reproduction et le développement
Dans une étude sur la toxicité pour la reproduction et le développement occasionnée par l’inhalation, des groupes de 35 rates F344 et de 30 souris CD 1 gravides ont été exposées pendant les jours de gestation 6 à 15 à des concentrations de MIBK respirable de 0, de 300, de 1000 ou de 3000 ppm [0, 1229, 4106 et 12 292 mg/m3] (Tyl et coll., 1987, cité dans IRIS de l’EPA, 2003b et PICS, 1990). Chez les rats, on a observé des signes de toxicité maternelle à 12 292 mg/m3, dont une diminution du gain de poids corporel et de la consommation alimentaire (avec retour à la normale dès la cessation de l’exposition) et une augmentation du poids relatif des reins. Le poids corporel des mères est resté inchangé chez les souris, quoiqu’il y ait eu un accroissement de la mortalité et des poids relatif et absolu du foie chez les mères exposées à 12 292 mg/m3 de MIBK. D’autres effets chez les mères, dont l’hypoactivité, l’ataxie et le larmoiement, ont été observés à cette dose. Chez les rats, le poids corporel des fœtus a diminué à 1229 mg/m3 et à 12 292 mg/m3, mais pas à 4106 mg/m3; les auteurs de l’étude ont attribué cette observation aux différences dans la taille des portées, et non pas à l’exposition. Le poids corporel des fœtus a aussi diminué chez les souris, à la plus forte concentration. À 12 294 mg/m3, on a constaté des retards dans certains paramètres d’ossification du squelette, tant chez les rats que chez les souris. D’après cette étude, l’IRIS de l’EPA (2003b) a établi une CSENO de 4106 mg/m3 et une CMENO de 12 292 mg/m3 pour les effets chez les mères et une ossification fœtale du squelette retardée chez les rats et les souris. Une DSENOCEH de 1026 mg/m3 a également été dérivée pour l’exposition continue (DMENOCEH = 3073 mg/m3). Dans une étude sur deux générations de rats SD, on a observé des signes de dépression du SNC chez les petits et une diminution du poids corporel et de la consommation alimentaire chez les parents à 8200 mg/m3, avec une CSENO de 4100 mg/m3 (Nemec et coll., 2004, cité dans CIRC, 2013).
7.2.2.2 MIAK
La MIAK n’a pas été évaluée par d’autres organismes. L’évaluation suivante des dangers est basée sur l’information trouvée dans le dossier d’inscription de l’ECHA (ECHA, c2007-2017c) et le système High Production Volume Information System (HPVIS) de l’EPA des É.‑U. (EPA des É.‑U., 2001b).
Toxicocinétique
On a rapporté que la clairance de la MIAK après une administration par voie orale était plus lente qu’après une exposition par inhalation. Les résultats d’une étude d’absorption cutanée in vitro (LD 428 de l’OCDE) indiquent que l’absorption cutanée est modérée (ECHA, c2007-2017b).
Cancérogénicité et génotoxicité
Aucune étude chronique concernant la MIAK n’a été retrouvée. Une variété d’études in vitro n’ont pas trouvé que la MIAK était toxique.
Toxicité à doses répétées
Lors d’une étude sur l’exposition par inhalation subchronique, des rats SD ont été exposés à des vapeurs de MIAK à des concentrations de 0, de 200, de 1000 et de 2000 ppm (ce qui équivaut à 0, à 934, à 4670 et à 9340 mg3), pour un total de 69 expositions échelonnées sur 96 jours. On n’a pas observé de changements importants sur les plans du poids corporel, de l’hématologie, de la chimie clinique sérique ou de la pathologie clinique. Des augmentations statistiquement significatives du poids absolu et relatif du foie en fonction de la dose ont été observées chez les mâles et les femelles à des concentrations de 4670 et de 9340 mg/m3. On a aussi observé une hausse du poids absolu et relatif des reins chez les mâles à ces concentrations, et, à la dose la plus forte, le poids relatif des reins des femelles était élevé. L’histopathologie a révélé la formation de gouttelettes hyalines dans les reins des rats mâles, une hypertrophie des hépatocytes dans le foie et une régénération de l’épithélium tubulaire dans les reins des mâles et des femelles exposées à la MIAK aux deux concentrations les plus élevées. De manière globale, on a déterminé que la CSEO était de 200 ppm (934 mg/m3) en fonction des changements de poids des organes et des changements histopathologiques observés dans le foie et les reins des mâles et des femelles à 4670 mg/m3 ou plus (Katz et coll., 1986; ECHA, c-2007-2017b).
Au chapitre de l’exposition par voie orale, nous n’avons trouvé qu’une unique étude d’exposition par voie orale dans laquelle une très forte dose seulement a été testée (2000 mg/kg‑p.c./jour). On y a associé un large éventail d’effets, principalement rénaux et hépatiques (ECHA, c-2007-2017b).
À la lumière des limites de la seule étude sur la toxicité à doses répétées par voie orale, une DSEO par voie orale de 52 mg/kg‑p.c./jourNote de bas de page 8 a été obtenue en extrapolant d’une voie à l’autre à partir de l’étude d’inhalation, en se fondant sur les effets similaires sur le foie et les reins pour les deux voies d’exposition.
Nous n’avons retrouvé aucune étude sur la toxicité de MIAK à doses répétées par voie cutanée.
Toxicité à court terme et aiguë
L’exposition de rats SD mâles et femelles à 1000 ou à 2000 pm (4670 ou 9340 mg/m3) de MIAK par inhalation pour un total de 12 expositions sur 16 jours a provoqué une légère augmentation en fonction de la dose des poids absolu et relatif des rats sans effets correspondants sur les chimies cliniques sériques ou l’histopathologie. À 9340 mg/m3, la formation de gouttelettes hyalines a été notée chez les mâles, tout comme une minéralisation du cœur des femelles (anonyme, 1983; Katz et coll., 1986, cité dans ECHA, c-2007-2017b). Sur la base de ces observations, les auteurs ont déterminé une CSENO de 1000 ppm (4670 mg/m3).
Des effets systémiques ont également été observés dans l’étude sur le développement mentionnée ci-dessous à de plus faibles doses. Les mères exposées à la MIAK pendant 14 jours à 3503 mg/m3 et plus ont affiché des fluctuations pondérales et des effets neurologiques importants (c.-à-d. une moindre réactivité aux stimuli). La CSENO pour la toxicité systémique a été fixée à 380 ppm (1775 mg/m3) (ECHA, c-2007-2017b).
Toxicité pour la reproduction et le développement
Dans une étude de dépistage de la toxicité, la MIAK n’a eu aucune incidence sur un ensemble de paramètres étudiés chez les parents ou les petits; la substance n’a donc pas été jugée toxique sur le plan de la reproduction jusqu’à concurrence de la plus forte concentration analysée, soit 5000 mg/m3 (ECHA, c-2007-2017b).
Dans une étude sur la toxicité de la MIAK pour le développement prénatal, des rattes SD gestantes ont été exposées par inhalation sur tout le corps à des concentrations de 0, de 380, de 750 ou de 1500 ppm (concentrations équivalentes à 0, à 1775, à 3503 et à 7005 mg/m3) de MPK, pendant les JG 6 à 19. Dans le groupe exposé à 1500 ppm, des diminutions importantes du poids corporel moyen, du gain de poids corporel moyen et de la consommation alimentaire moyenne correspondante ont été observées chez les rattes tout au long de la période d’exposition, tandis qu’une réactivité réduite aux stimuli sonores a été constatée à des concentrations de 750 ou de 1500 ppm. La CSENO pour la toxicité maternelle a été fixée à 380 ppm (1775 mg/m3). Aucune malformation externe, viscérale ou squelettique ni variation du développement n’a été observée chez les fœtus jusqu’à concurrence de 1500 ppm (7005 mg/m3). Toutefois, on a noté une réduction considérable du poids des fœtus dans le groupe exposé à 1500 ppm comparativement au groupe témoin. Ainsi, la CSENO pour la toxicité maternelle a été fixée à 750 ppm (3503 mg/m3) (ECHA, c-2007-2017b).
7.2.2.3 Alcool de diacétone
L’alcool de diacétone a fait l’objet d’une étude par l’OCDE (2000). Cette étude a servi de base à la caractérisation des effets sur la santé dans la présente évaluation préalable. Nous avons réalisé une recherche documentaire s’étendant depuis l’année précédant le rapport d’évaluation initiale de l’OCDE (2000) jusqu’en janvier 2017.
Toxicocinétique et métabolisme
La faible masse moléculaire, la faible valeur du log Koe et l’état physique de l’alcool de diacétone favorisent son absorption par différentes voies d’exposition (orale, cutanée et inhalation). Les données disponibles portent à croire que l’absorption par voie cutanée et par inhalation est importante. Dans une étude d’absorption cutanée in vitro, la pénétration de la peau s’est chiffrée à 0,04, à 0,15 et à 5,71 % de la dose (25 mg/cm2) après 10 min, 60 min et 24 heures, respectivement (Fasano et McDougal, 2008).
Cancérogénicité et génotoxicité
Aucune étude sur la cancérogénicité de l’alcool de diacétone n’a été trouvée. L’alcool de diacétone s’est révélé non génotoxique dans divers essais in vitro : d’Ames, essais de mutation génétique sur des mammifères et essais d’aberration chromosomique sur des mammifères (OCDE, 2000; ECHA, c-2007-2017b).
Toxicité à doses répétées
Dans une étude combinée de toxicité à doses répétées et de toxicité pour la reproduction, on a administré par gavage de l’alcool de diacétone quotidiennement pendant 45 jours à des rats SD mâles et femelles à des doses de 0, de 30, de 100, de 300 ou de 1000 mg/kg‑p.c./jour (Ministère de la santé et du bien-être, 1997, cité dans OCDE, 2000). Une baisse de l’activité locomotrice et de la réponse aux stimulations a été observée à 300 et à 1000 mg/kg‑p.c./jour chez les deux sexes, alors qu’on a noté des modifications des paramètres de chimie hématologique et sanguine à 1000 mg/kg‑p.c./jour. Chez les mâles, on a observé des effets rénaux, dont la formation de gouttelettes hyalines à 100 mg/kg‑p.c./jour et plus, des tubules basophiles à 300 mg/kg‑p.c./jour et plus et une dilatation des tubules distaux à 1000 mg/kg‑p.c./jour. À 300 et à 1000 mg/kg‑p.c./jour, les femelles présentaient une dilatation des tubules distaux et une dégénérescence graisseuse de l’épithélium tubulaire proximal des reins. Selon l’OCDE, les DSENO pour la toxicité à doses répétées est de 30 mg/kg‑p.c./jour chez les mâles et de 100 mg/kg‑p.c./jour chez les femelles. Toutefois, comme la formation de gouttelettes hyalines est considérée propre aux rats mâles, la DSENO pour les rats mâles a été fixée à 100 mg/kg‑p.c./jour. Dans une étude d’inhalation, des rats Wistar ont été exposés à l’alcool de diacétone quotidiennement pendant six semaines à des concentrations de 0, de 233, de 1041 et de 4685 mg/m3 (Butterworth et coll., 1980 cité dans ECHA c2007-2017a). Les auteurs ont convenu d’une CSENO de 4685 mg//m3 et d’une CSEO de 1041 mg/m3. Seuls des changements dans le poids du foie, non associés aux modifications histopathologiques, ont été observés à 1041 mg/m3. À 4685 mg/m3, une augmentation du poids du foie et des reins ainsi que des gouttelettes hyalines éosinophiles dans les cellules tubulaires proximales ont été observées chez les mâles. L’OCDE a jugé que la concentration moyenne était une CSENO (1035 mg/m3 selon les rapports) (SHELL Research Ltd, cité dans OCDE 2000).
Aucune étude de toxicité à doses répétées par voie cutanée n’était disponible pour l’alcool de diacétone. Par conséquent, la DSENO par voie orale de 100 mg/kg‑p.c./jour servira à cerner le risque posé par l’exposition par voie cutanée.
Toxicité pour la reproduction et le développement
Les auteurs de l’étude de la toxicité à doses répétées combinée à l’étude de dépistage de la toxicité pour la reproduction et le développement décrite ci-dessus ont constaté une diminution importante quoique statistiquement non significative des paramètres de reproduction (indice de fertilité, nombre d’implantations et indice d’implantation) et dans les paramètres du développement (nombre de petits nés, indice de mise bas, indice de naissances vivantes, nombre de petits vivants et indice de viabilité) à la plus forte dose, soit 1000 mg/kg‑p.c./jour. Même si tous ces changements n’ont pas été statistiquement significatifs, on a considéré que l’alcool de diacétone pourrait causer des effets sur la reproduction et le développement à 1000 mg/kg‑p.c./jour. Sur cette base, les auteurs ont convenu d’une DSENO de 300 mg/kg‑p.c./jour pour les effets sur la reproduction et le développement, avec une DSENO de 100 mg/kg‑p.c./jour, conformément à la description ci-dessus (Ministère de la santé et du bien-être, 1997, cité dans OCDE, 2000). Aucun effet n’a été observé par une autre étude sur le développement des rats jusqu’à concurrence de 1000 mg/kg‑p.c./jour (ECHA, c2007-2017a).
En l’absence d’études de la toxicité de l’alcool de diacétone sur la reproduction et le développement par inhalation et par voie cutanée, nous avons utilisé une DSENO par voie orale de 300 mg/kg‑p.c./jour pour les effets sur la reproduction et le développement.
Nom chimique |
MIBK |
MIAK |
alcool de diacétone |
|---|---|---|---|
Rôle |
Produit chimique cible |
Produit chimique cible |
Produit chimique cible |
NR CAS |
108-10-1 |
110-12-3 |
123-42-2 |
 MM = 100,16 |
 MM = 114,18 |
 MM = 116,16 |
|
Toxicité aiguë Par voie orale |
DL50 rat = de 2080 à 4570 mg/kg‑p.c. DL50 souris = de 1900 à 2850 mg/kg‑p.c. |
DL50 rat = 5657 mg/kg‑p.c. |
DL50 rat = 3002 mg/kg‑p.c. |
Toxicité aiguë par inhalation |
DL50 rat = de 8200 à 16 400 mg/m3 DL50 souris (1,25 h) = de 20 500 à 74 200 mg/m3 |
DL50 rat (6 h) = 17 806 mg/m³ CSEO pour les effets non létaux = 7486 mg/m3 |
DL0 rat (4 h) = 7600 mg/m³ Rat (6 h) = 7230 mg/m³ dans l’air (aucun effet jusqu’à ce point) |
Toxicité cutanée aiguë |
DL50 lapin = >20 000 mg/kg‑p.c. |
N.D. |
DL50 (24 h) rat > 1875 mg/kg‑p.c. |
Par inhalation, à court terme (14 j) |
CSENO = 410 mg/m³ (Hausse du poids relatif des reins et néphrose tubulaire liée aux gouttelettes hyalines) |
CSENO = 1775 mg/m3 (toxicité maternelle selon l’étude de toxicité pour le développement) |
CSENO = 968 mg/m3 (étude sur le développement par voie orale de 15 jours) |
Par voie cutanée à court terme (14 jours) |
N.D. |
DSEO = 137 mg/kg p.c./jour (de l’étude de la toxicité pour le développement par inhalation) |
DSEO = 1000 mg/kg‑p.c./jour (de l’étude de la toxicité pour le développement par voie orale de 15 jours) |
Toxicité à doses répétées (voie orale) |
DMEO/DSENO = 250 mg/kg‑p.c./jour (13 semaines; effets hépatiques et rénaux à 1000 mg/kg‑p.c./j)
DMENO = 101 mg/kg‑p.c./jour (2 ans; néphropathie chronique chez les femelles) |
DSEO = 52 mg/kg‑p.c./jour de la CSENO par inhalation) |
DSENO = 100 mg/kg/jour (45 jours; changements aux reins et chimie hématologique et sanguine modifiée) |
Toxicité à dose répétée (inhalation) |
CMENO = 410 mg/m³ (Incidence accrue d’hyperplasie des tubules rénaux et de la néphropathie chronique (femelles) et de la minéralisation des papilles rénales (mâles)
CMENO = 1843 mg/m3 (2 ans; néphropathie chronique chez les femelles) |
CSENO = 934 mg/m3 (96 jours; hausse du poids du foie et des reins et hypertrophie des hépatocytes dans le foie et régénération de l’épithélium tubulaire dans les reins des mâles et des femelles à 4670 mg/m3) |
CSENO = 1035 mg/m3 (6 semaines; changements dans le poids du foie sans modifications histopathologiques à 4685 mg/m3) |
Toxicité à doses répétées (voie cutanée) |
DMENO = 300 mg/kg p.c. (4 mois; plus faible dose testée; changements morphologiques dans plusieurs tissus)
DMEO/DSENO = 250 mg/kg‑p.c./jour (À partir de la MIBK par voie orale) |
DSEO = 52 mg/kg‑p.c./jour (À partir de la CSENO par inhalation) |
DSENO = 100 mg/kg/jour (à partir de la DSENO par voie orale) |
Toxicité pour la reproduction ou le développement (voie orale) |
DSENO = 259 mg/kg‑p.c./jour (lecture croisée à partir de l’alcool de diacétone) |
CSENOdév= 271 mg/m3 (référence croisée de la CSENO par inhalation) CSENOdév= 137 mg/m3 (CSENO par inhalation) |
DSENOdevo = 300 mg/kg/jour (effets sur la reproduction et le développement à 1000 mg/kg‑p.c./j) DSENOmat = 100 mg/kg/jour (changements rénaux et chimie hématologique et sanguine modifiée) |
Toxicité pour la reproduction ou le développement (inhalation) |
CSENOdév/mat = 4106 mg/m3 (d’après la diminution transitoire du poids corporel et de la consommation alimentaire et changements dans le poids des organes reproducteurs chez les parents et effets dépresseurs aigus sur le SNC des petits) |
CSENOdév = 3503 mg/m3 (poids réduit des fœtus à 3503 mg/m3) CSENOmat= 1775 mg/m3 (diminution du gain de poids corporel et de la consommation alimentaire correspondante à 3505 mg/m3) |
CSENOdév = 968 mg/m3 (à partir de la DSENO de l’étude de toxicité par voie orale de 45 jours)
CSENOdév/mat = 3182 mg/m3 (JG 6 à 20 de l’étude de toxicité par voie orale) |
Toxicité pour la reproduction ou le développement (voie cutanée) |
DSENO = 259 mg/kg p.c./jour (déduite à partir de l’alcool de diacétone) |
CSENOdév= 271 mg/m3 (à partir de la CSENO par inhalation) CSENOdév= 137 mg/m3 (CSENO par inhalation) |
DSENOdevo = 300 mg/kg/jour DSENOmat = 100 mg/kg/jour |
Génotoxicité |
Négatif |
Négatif |
Négatif |
Cancérogénicité |
Positif |
Possible |
Possible |
Abréviations : MM : masse moléculaire (g/mol); N.D., non déterminé
7.2.3 Caractérisation des risques posés par les substances du sous‑groupe 2 (MBC, MIAK et alcool de diacétone)
MIBK
Selon le CIRC (2013), la MIBK est un cancérogène de catégorie 2B (possiblement cancérogène pour les humains) d’après les incidences accrues de tumeurs dans les études de deux ans sur des rats et des souris. Bien que des éléments probants aient indiqué que les tumeurs hépatiques et rénales puissent ne pas être transposables chez les humains, de récentes analyses du NICNAS (2017) ont permis de conclure que, même si des éléments probants étayent que les tumeurs hépatiques résultent de l’activation du récepteur constitutif des androstanes (RCA), un mécanisme autre que celui mettant en cause l’α2u-globuline pourrait être à l’origine des tumeurs rénales chez les rats. Cette information ainsi que l’observation de la leucémie mononucléée chez les rats mâles et des tumeurs rénales de nature mésenchymateuse chez les rats femelles étayent la conclusion selon laquelle les tumeurs chez le rat sont transposables chez l’humain et sont suffisantes pour classer la MIBK comme un cancérogène de catégorie 2 selon le Système général harmonisé de classification et d’étiquetage des produits chimiques (SGH) (NICNAS, 2017). Toutefois, on ne prévoit pas que la MIBK soit génotoxique (NTP, 2007b; CIRC, 2013).
La CMENO pour les effets non cancérogènes de l’inhalation chronique a été établie à 1843 mg/m3, sur la base d’une néphropathie de minime à légère dans l’essai biologique de deux ans (NTP, 2007b).
Les données disponibles des études d’inhalation de MIBK à court terme chez les animaux indiquent que les effets sur le développement ont été les effets critiques sur la santé. Une CSENO de 4106 mg/m3 a été déterminée pour les effets sur le développement des souris et des rats (Tyl et coll., 1987, cité dans IRIS de l’EPA des É.‑U., 2003b). On a calculé une CSENOCEH correspondante pour les effets sur le développement de 1026 mg/m3 pour l’exposition continue.
En ce qui concerne la voie orale, à la lumière des incertitudes entourant la nocivité des effets observés dans les études de toxicité subchronique par voie orale pour la caractérisation du risque après une exposition par voie orale à plus long terme, la CMENO établie lors de l’étude par inhalation plus récente et complète du NTP (2007b) est extrapolée à une dose de 101 mg/kg‑p.c./jour. L’extrapolation d’une voie à l’autre est jugée appropriée pour les effets internes critiques sur les reins des rats mâles et femelles. En outre, le NICNAS (2017) a récemment déterminé que les effets rénaux observés dans l’étude de deux ans sur les rats étaient transposables chez les humains.
Dans la seule étude par voie cutanée disponible, la MIBK a entraîné des changements morphologiques à la peau et à de multiples organes des rats qui ont reçu des doses de 300 mg/kg‑p.c./jour et plus pendant quatre mois (Malysheva, 1988, cité dans NTP, 2007b). Malgré le peu de détails disponibles pour cette étude, le niveau d’effet critique de 300 mg/kg-p.c/jour est appuyé par les effets observés chez les rats ayant reçu 250 mg/kg‑p.c./jour pendant l’étude de treize semaines par voie orale.
La principale source d’exposition de l’ensemble de la population à la MIBK par les milieux environnementaux et les aliments est l’alimentation. D’après les données disponibles, on s’attend à ce que la plus grande exposition par le régime alimentaire à la MIBK provienne des aliments dans lesquels la substance est naturellement présente.
La MIBK est utilisée dans un certain nombre de produits offerts aux consommateurs, dont l’alcool à friction, les marqueurs à essuyage à sec et divers produits de peinture et de bricolage. Le tableau 7-11 présente toutes les valeurs d’exposition et les effets critiques sur la santé, pertinents, ainsi que les marges d’exposition (ME), obtenues pour la caractérisation des risques pour la MIBK.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Paramètre d’effet critique pour la santé |
ME |
|---|---|---|---|---|
Milieux environnementaux |
de 2,5 à 7,5 µg/kg‑p.c./jour |
DMEO/DSENO = 101 mg/kg‑p.c./jour |
Effets rénaux chez les rats (hyperplasie, néphropathie, minéralisation) dans une étude de deux ans (référence croisée de l’étude par inhalation) |
de 13 467 à 40 400 |
Aromatisant alimentaire |
de 0,03 à 0,12 µg/kg‑p.c./jour |
DMEO/DSENO = 101 mg/kg‑p.c./jour |
Effets rénaux chez les rats (hyperplasie, néphropathie, minéralisation) dans une étude de deux ans (référence croisée de l’étude par inhalation) |
≥ 850 000 |
| Alcool à friction (par inhalation) | Concentration moyenne pondérée de 6 heuresa = 0,001 (mg/m3) |
CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
4 106 000 |
Laque pour bois (par inhalation) |
Concentration moyenne pondérée de 6 heuresa = de 45 à 433 mg/m3 |
CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
de 9 à 91 |
Peinture liquide (peinture riche en solvant) pour camions (par inhalation) |
Concentration moyenne pondérée de 6 heuresa = 48 mg/m3 |
CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
86 |
Peinture en aérosol (par inhalation) |
Concentration moyenne pondérée de 6 heuresa = se 0,4 à 83 mg/m3 |
CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
de 49 à 10 265 |
Remplissage ou mastic en tube (par inhalation) |
Concentration moyenne pondérée de 6 heuresa = de 1 à 6 mg/m3 |
CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
De 684 à 4106 |
Marqueurs à essuyage à sec (par événement) [par voie orale] |
0,48 mg/kg‑p.c. (enfants)
0,97 mg/kg-p.c (tout-petits) |
DMEO = 300 mg/kg/jour
DMEO/DSENO = 250 mg/kg‑p.c./jour |
Changements morphologiques dans plusieurs tissus à la plus faible dose analysée dans une étude par voie cutanée de quatre mois
Effets hépatiques et rénaux à 1000 mg/kg‑p.c./j dans une étude par voie orale de 13 semaines |
de 309 à 625
de 258 à 520 |
Marqueur à essuyage à sec [par inhalation] |
Concentration moyenne pondérée de 6 heuresa = 0,45 (mg/m3) | CSENO = 4106 mg/m3 |
Variations au niveau du squelette des souris et des rats et réduction du poids corporel des fœtus et mortalité fœtale accrue chez les souris |
9124 |
a Les concentrations moyennes pondérées de six heures ont été dérivées pour tous les scénarios de produit afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisées pour caractériser le risque.
Les marges d’exposition calculées pour la MIBK dans les milieux environnementaux et les aliments (aromatisant alimentaire) sont considérées comme adéquates pour compenser les incertitudes dans les bases de données sur les effets sur la santé et l’exposition. L’absorption alimentaire supplémentaire de MIBK en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. De plus, le JECFA (OMS, 1999b) a conclu qu’il n’y avait aucun problème de sécurité aux niveaux d’ingestion estimés lorsque la MIBK est utilisée comme agent aromatisant, principalement parce qu’il est « métabolisé en produits inoffensifs ». Les ME pour l’exposition par inhalation à la MIBK contenu dans certains produits offerts aux consommateurs, c’est-à-dire la laque pour bois, la peinture liquide et les peintures en aérosol, sont considérées potentiellement adéquates compte tenu de la gravité des effets observés (c.-à-d. la toxicité pour le développement) et l’incertitude entourant la gravité des effets observés à de plus faibles concentrations.
MIAK
Nous n’avons trouvé aucune étude sur la toxicité chronique de la MIAK. Plusieurs études ont trouvé que la MIAK n’était pas génotoxique.
L’exposition subchronique à la MIAK a produit des effets hépatiques et rénaux (changements dans le poids des organes et sur le plan histologique) chez les rats exposés à des concentrations de 4670 mg/m3 et plus. On a déterminé que la CSEO était de 934 mg/m3 (Katz et coll., 1986; ECHA, c-2007-2017b). Pour ce qui est de l’exposition par voie orale, il s’agit de la seule étude sur la toxicité à doses répétées par voie orale, et seule une très forte dose a été testée (2000 mg/kg‑p.c./jour), laquelle a été associée à un large éventail d’effets. Donc, une DSEO par voie orale de 52 mg/kg‑p.c./jour a été dérivée en extrapolant d’une voie à l’autre à partir d’une étude d’inhalation, en se fondant sur les effets similaires sur le foie et les reins pour les deux voies d’exposition.
En ce qui a trait à l’exposition par inhalation à court terme à la MIAK, une CSENO de 1775 mg/m3 a été utilisée pour caractériser le risque en fonction des effets systémiques sur les mères observés à 3503 mg/m3 et plus dans une étude sur la toxicité pour le développement (moindre réactivité aux concentrations de stimuli sonores, réduction du poids corporel, du gain de poids corporel et de la consommation alimentaire) (ECHA, c‑2007-2017b).
La principale source d’exposition de l’ensemble de la population à la MIAK par les milieux environnementaux et les aliments est sa présence naturelle dans certains aliments et, dans une moindre mesure, dans l’air intérieur.
La MIAK est également utilisée dans quelques produits offerts aux consommateurs. Le tableau 7‑12 présente toutes les estimations relatives à l’exposition et les valeurs des effets critiques pertinentes, ainsi que les ME obtenues.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Paramètre d’effet critique pour la santé |
ME |
|---|---|---|---|---|
Milieux environnementaux |
de 0,3 à 0,9 µg/kg p.c./jour |
DSEO = 52 mg/kg‑p.c./jour |
Extrapolation d’une voie à l’autre à partir de la CSEO = 934 mg/m3 |
≥ 57 778 |
Peinture en aérosol (par inhalation) |
Concentration moyenne pondérée de 6 heuresa = de 3 à 19 mg/m3 |
CSENO = 1775 mg/m3 |
Baisses importantes du poids corporel moyen, du gain de poids corporel moyen et de la consommation alimentaire moyenne correspondante chez les mères à 7005 mg/m3, par opposition à une moindre réactivité aux stimuli sonores à 3503 mg/m3 |
de 93 à 592 |
a Les concentrations moyennes pondérées de six heures ont été dérivées pour le scénario de peinture en aérosol afin de correspondre aux durées d’exposition de l’étude des effets critiques utilisée pour caractériser le risque.
Les marges d’exposition calculées pour la MIAK dans les milieux environnementaux sont jugées adéquates pour compenser les incertitudes dans les bases de données sur les effets sur la santé de l’exposition. L’absorption alimentaire additionnelle de MIAK en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. Les ME pour l’exposition par inhalation pour la MIAK contenue dans les peintures en aérosol sont considérées adéquates pour compenser les incertitudes des bases de données des effets sur la santé de l’exposition.
Alcool de diacétone
Aucune étude chronique sur l’alcool de diacétone n’a été recensée. Une DSENO par voie orale de 100 mg/kg‑p.c./jour pour la toxicité systémique (changements rénaux et chimie hématologique et sanguine modifiée chez les rats), déterminée dans le cadre de l’étude sur la reproduction et le développement est utilisée pour gérer le risque posé par l’exposition chronique à l’alcool de diacétone (Ministère de la santé et du bien-être, 1997, cité dans OCDE, 2000; ECHA, c-2007-2017a). En l’absence d’études par voie cutanée, l’extrapolation d’une voie à l’autre à partir de la DSENO par voie orale est utilisée pour caractériser le risque posé par l’exposition à l’alcool de diacétone par voie cutanée.
Dans la seule étude d’inhalation sur des animaux que l’on a trouvé, seuls des changements dans le poids du foie, non associés aux modifications histopathologiques, ont été observés à 1041 mg/m3 (1035 mg/m3 selon l’OECD [2000]) dans une étude d’inhalation de six semaines (Butterworth et coll., 1980, cité dans ECHA, c2007-2017a).
La DSENO pour la reproduction et le développement a été établie à 300 mg/kg‑p.c./jour sur la base des effets sur de nombreux paramètres de reproduction et de développement à 1000 mg/kg‑p.c./jour. Afin de protéger les fœtus en développement et les enfants, un niveau d’effet critique de 300 mg/kg‑p.c./jour est utilisé pour caractériser le risque lié à l’utilisation à court terme de produits offerts aux consommateurs. En l’absence d’études de la toxicité de l’alcool de diacétone pour la reproduction et le développement par inhalation et par voie cutanée, la DSENO par voie orale de 300 mg/kg‑p.c./jour a été utilisée.
La principale source d’exposition à l’alcool de diacétone par les milieux environnementaux et les aliments est sa présence naturelle dans diverses denrées alimentaires.
L’alcool de diacétone est employé dans divers produits offerts aux consommateurs, dont les produits de soins pour les ongles et les marqueurs permanents, les scellants pour filets de tuyau, les revêtements de plancher, le diluant et les produits à pulvériser, dont les décapants à peinture et les produits nettoyants pour automobile.
Le tableau 7‑13 présente toutes les estimations relatives à l’exposition et les valeurs des effets critiques pertinentes, ainsi que les marges d’exposition (ME) obtenues. Bien qu’elles soient limitées, les données disponibles sur l’absorption cutanée indiquent que l’alcool de diacétone n’est pas fortement absorbé par la peau (dans une proportion de moins de 1 % à environ 6 % chez les humains); donc, les estimations ci-dessous comportent une valeur d’absorption cutanée de 6 %. Étant donné que la même étude des effets sur la santé de l’exposition par voie orale sert à caractériser les risques liés aux expositions potentielles par voie cutanée et par inhalation à l’alcool de diacétone découlant de l’utilisation de produits offerts aux consommateurs, on a combiné ces estimations des expositions.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Paramètre d’effet critique pour la santé |
ME |
|---|---|---|---|---|
Cosmétiques (inhalation) |
Concentration moyenne pondérée de 6 heures = de 0,3 à 1,3 mg/m3 |
CSENO = 1035 mg/m3 |
Changements dans le poids du foie sans modifications histopathologiques à 4685 mg/m3 |
de 796 à 3450 |
Cosmétiques (voie cutanée) |
De 0,007 à 0,016 µg/kg‑p.c./jour |
DSENO = 100 mg/kg/jour |
Changements rénaux et chimie hématologique et sanguine modifiée |
de 6250 à 14 286 |
Produits de peinture et de bricolage (inhalation et voie cutanée) |
De 0,053 à 2,5 mg/kg‑p.c./jour |
DSENO = 300 mg/kg/jour |
Effets sur la reproduction et le développement |
de 120 à 5660 |
Marqueurs permanents (par événement) [voie orale] |
1,6 mg/kg‑p.c. (enfants) 3,23 mg/kg-p.c (tout-petits) |
DSENO = 300 mg/kg/jour |
Effets sur la reproduction et le développement à 1000 mg/kg‑p.c./jour |
de 93 à 188 |
Marqueurs permanents (utilisation quotidienne) [voie cutanée] |
De 0,00244 à 0,05 mg/kg p.c./jour |
DSENO = 100 mg/kg/jour |
Changements rénaux et chimie hématologique et sanguine modifiée |
de 1250 à 2500 |
Les ME calculées pour l’exposition à l’alcool de diacétone dans les milieux environnementaux et découlant de l’utilisation de produits offerts aux consommateurs, s’appuient sur l’hypothèse selon laquelle 100 % de l’alcool de diacétone contenue dans les marqueurs permanents et les changements non statistiquement significatifs dans les paramètres de reproduction et de développement utilisés pour caractériser le risque associé à l’utilisation de marqueurs et de produits de peinture et de bricolage et les marges d’exposition calculées sont considérées adéquates pour tenir compte des incertitudes dans les bases de données sur les effets sur la santé et l’exposition. L’absorption alimentaire supplémentaire d’alcool de diacétone en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine.
7.2.4 Incertitudes de l’évaluation des risques pour la santé humaine pour la MIBK, la MIAK et l’alcool de diacétone
Les sources clés d’incertitude sont présentées dans le tableau suivant. Il est fort probable que l’utilisation des concentrations maximales et à la borne supérieure des quantités de ces types de produits ne représente pas une sous-estimation des expositions potentielles de la population générale.
Pour la MIBK, bien que les ME pour les expositions chroniques soient basées sur des effets non cancérogènes, il est fort probable qu’elles protègent contre la cancérogénicité de la MIBK à la lumière d’un probable mode d’action non génotoxique.
Pour la MIAK, la ME pour l’utilisation de peintures en aérosol est considérée adéquate compte tenu des effets minimes sur les mères dans l’étude des effets toxiques critiques pour le développement et de la prudence de l’estimation des expositions.
Quant au risque posé par l’utilisation de produits offerts aux consommateurs pour l’alcool de diacétone, le degré de confiance est élevé à l’égard de l’adéquation des marges, étant donné la prudence associée à la valeur d’absorption cutanée et les effets non statistiquement significatifs sur les paramètres de reproduction et de développement au niveau d’effet critique.
Sources clés d’incertitude |
Incidence |
|---|---|
Nous présumons que les expositions par voie cutanée sont minimales pour la MIBK et la MIAK par rapport aux expositions par inhalation, vu la forte volatilité des substances; toutefois, il est fort probable que l’exposition soit surestimée compte tenu de la nature prudente des modèles d’exposition. |
+ |
Nous présumons que l’alcool de diacétone est présent dans les marqueurs permanents à une concentration de 100 %. |
+ |
Manque d’études chroniques pour la MIAK et l’alcool de diacétone |
- |
Des incertitudes sont associées au choix des niveaux d’effet pour la caractérisation du risque posé par la MIBK par inhalation et par voie orale. |
- |
Nous avons recouru à l’extrapolation d’une voie à l’autre à partir d’une étude d’inhalation sur 96 jours pour le scénario d’exposition par voie orale et cutanée pour la MIAK. |
+/- |
Aucune étude d’inhalation à court terme n’est disponible pour l’alcool de diacétone. On a appliqué l’extrapolation d’une voie à l’autre à partir d’une étude par voie orale. |
+/- |
+ : incertitude ayant le potentiel de causer une surestimation de l’exposition ou du risque
- : incertitude ayant le potentiel de causer une sous-estimation de l’exposition ou du risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque
7.3 Évaluation du sous-groupe 3 (diacétyle, 2-3-PD et acétoïne)
7.3.1 Évaluation de l’exposition au sous-groupe 3 (diacétyle, 2-3-PD et acétoïne)
Milieux environnementaux
On n’a recensé aucune donnée empirique relative au diacétyle, à la 2,3‑PD ou à l’acétoïne dans l’air, l’eau ou le sol au Canada.
On a déterminé que le diacétyle était un sous-produit de la désinfection à l’ozone, et on l’a détecté dans l’eau potable et les eaux de surface (HSDB, 1983-). On n’a trouvé aucune donnée sur la présence de diacétyle dans le sol ou les sédiments; toutefois, à en juger par son faible log Kco, le diacétyle ne devrait pas être présent dans ces milieux.
Une unique étude de l’air ambiant a révélé la présence de 2,3‑PD dans l’air à Roseville, en Californie, l’été et l’hiver, à des concentrations respectives de 11,1 et de 8,1 ng/cm3, (HSDB, 1983-). On n’a trouvé aucune autre donnée sur la concentration dans l’environnement dans un autre lieu.
D’après ses propriétés physiques et chimiques, l’acétoïne pourrait être présente dans l’air et dans l’eau, mais elle est peu susceptible de se retrouver dans le sol et les sédiments. D’après sa constante de la loi d’Henry modérée, on s’attend à ce qu’elle se volatilise depuis l’eau. Dans l’air, sa demi-vie est d’environ 37 h (HSBD, 1983-).
Nous avons exécuté le modèle ChemCAN pour calculer des concentrations potentielles de diacétyle, de 2,3‑PD et d’acétoïne dans l’environnement au Canada, en nous fondant sur la valeur la plus élevée des volumes énumérés au tableau 4‑1. Nous avons utilisé ces concentrations pour estimer l’exposition au diacétyle, au 2,3‑PD et à l’acétoïne par les milieux environnementaux pour l’ensemble de la population canadienne. Toutes les expositions résultantes étaient inférieures à 2,5 ng/kg‑p.c./jour. À partir des renseignements présentés ci-dessus, nous ne prédisons aucune exposition à ces substances par les milieux environnementaux.
Aliments
Le diacétyle, la 2,3‑PD et l’acétoïne sont naturellement présents dans diverses denrées alimentaires et peuvent également servir d’ingrédient aromatisant (Nijssen et coll., 1963-2016; Burdock, 2010). Le diacétyle est en voie d’être remplacé dans certains produits par la 2,3‑PD, l’acétoïne et d’autres dicétones ayant un arôme et un goût semblables de « beurre » (Gaffney et coll., 2015; Doepker et coll., 2012; CDC, 2016).
Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a évalué un groupe de d’α-dicétones aliphatiques acycliques et alicycliques et de composés connexes d’α-hydroxycétones, dont le diacétyle, la 2,3‑PD et l’acétoïne (OMS, 1999a). Dans le cadre de cette évaluation, le Comité a estimé l’absorption par une personne de diacétyle, de 2,3‑PD et d’acétoïne occasionnée par leur présence comme agents aromatisants alimentaires. Pour la population américaine, les estimations de l’absorption par une personne se chiffrent respectivement à 133 µg/kg‑p.c./jour, à 1 µg/kg‑p.c./jour et à 29 µg/kg‑p.c./jour. Pour la population européenne, les estimations de l’absorption par une personne se chiffrent à 56 µg/kg‑p.c./jour, à 4 µg/kg‑p.c./jour et à 46 µg/kg‑p.c./jour, respectivement (OMS, 1999a). (L’annexe A donne plus de détails.)
Les estimations quantitatives de l’exposition pour le diacétyle, la 2,3‑PD et l’acétoïne de par leur présence naturelle dans les alimentsNote de bas de page 9 variaient de 281 µg/kg‑p.c. par jour pour les adolescents âgés de 14 à 18 ans à 1625 µg/kg‑p.c. par jour pour les bébés d’un an et pour le diacétyle, de 6,5 µg/kg‑p.c. par jour pour les nourrissons de 6 à 12 mois à 208 µg/kg‑p.c. par jour de 19 ans et plus pour la 2,3‑PD et de 161 µg/kg‑p.c. par jour pour les adolescents de 14 à 18 ans à 369 µg/kg‑p.c. par jour pour les tout-petits de deux à trois ans pour l’acétoïne. (L’annexe A présente plus de détails).
Les estimations de l’absorption quotidienne de diacétyle étant donné sa présence naturelle dans la nourriture se fondent principalement sur sa teneur élevée (environ 30 µg/g) dans le lait pasteurisé d’après les publications scientifiques (De Leonardis et coll., 2013). On a signalé des concentrations élevées de diacétyle dans le lait cru et le lait à ultra haute température (UHT) (Macciola et coll., 2008; De Leonardis et coll., 2013). Or, d’autres études ont signalé les concentrations de diacétyle dans le lait entre 0,0002 et 0,024 µg/g (Nijssen et coll., 1963-2016, Toso et coll., 2002, Shimoda et coll., 2000; Valero et coll., 2001; Imhof et coll., 1995). En supposant que les concentrations de diacétyle dans le lait au Canada soient comparables à celles trouvées en Europe, on a sélectionné la valeur la plus élevée dans le lait pasteurisé (partiellement écrémé) de l’étude de De Leonardis et coll. (2013). Les auteurs expliquent que la méthode analytique utilisée dans cette étude consiste à extraire le diacétyle qui est principalement lié aux protéines et au lactose du lait. Les autres études ont employé des techniques d’espace de tête qui ne permettent de capturer que la portion volatile de la substance dans les aliments (De Leonardis et coll., 2013).
Outre les expositions par voie orale à ces substances, il est possible que, pour certains produits alimentaires tels que le maïs à éclater au four micro-ondes, les expositions par inhalation soient également importantes. Selon Rosati et coll., (2007), le diacétyle et l’acétoïne ont été mesurés dans une étude en chambre à air avec des concentrations dans celle-ci variant de 0,02 à 5,8 mg/m3 et de 0,01 à 4,2 mg/m3 pour le diacétyle et l’acétoïne, respectivement. La quantité moyenne de diacétyle émise par un sac de maïs éclaté aux micro-ondes était de 778,9 µg/sac (Rosati et coll., 2007). D’après les renseignements tirés de Rosati et coll., (2007) et une approche décrite dans Zhu et coll. (2001), pour le diacétyle, cela équivaut environ à 0,03 mg/m3 dans une pièce standard une heure après la préparation du maïs éclaté (maximum 0,04 mg/m3 durant la première heure suivant la cuisson) (voir l’annexe C). On a également mesuré le diacétyle et la 2,3‑PD dans des usines de torréfaction (McCoy et coll., 2017), et le diacétyle a été mesuré dans une étude visant à simuler des expositions qui pourraient survenir dans le local d’un petit café (Pierce et coll., 2015).
Produits offerts aux consommateurs
Le diacétyle n’est pas un ingrédient qui entre dans la composition des cosmétiques déclarés à Santé Canada; on a toutefois relevé sa présence dans un produit coiffant vendu au Canada, dans une concentration de 0,1-1 % (FS, 2008a). On a également trouvé de la 2,3‑PD dans certains assainisseurs d’air pour l’entretien de la maison et dans des huiles parfumées qui peuvent servir à assainir l’air (FS, 2016a, 2015, a, b). Le tableau 7‑15 résume les expositions estimées de l’inhalation de diacétyle ou de 2,3‑PD contenus dans des produits offerts aux consommateurs. Même si l’exposition par voie cutanée pouvait contribuer à l’exposition globale pendant l’utilisation de produits offerts aux consommateurs, nous considérons que la voie principale est l’inhalation et, par conséquent, seules les estimations pour l’inhalation sont présentées. On n’a retrouvé d’acétoïne dans aucun produit offert aux consommateurs au Canada.
Scénario pour le produit |
Plage de concentrations |
Concentration moyenne par événement (mg/m3) |
Concentration moyenne le jour de l’exposition (mg/m3) |
|---|---|---|---|
Produit coiffant (diacétyle) |
de 0,1 à 1 % |
de 0,24 à 2,4 |
de 0,002 à 0,016 |
Assainisseur d’aira (2,3‑PD) |
de 0,1 à 5 % |
de 0,0031 à 0,064 |
de 0,0011 à 0,035 |
a Comprend l’utilisation d’huiles essentielles comme assainisseurs d’air, ainsi que les assainisseurs d’air à brancher ou de type gel.
7.3.2 Évaluation des effets sur la santé du sous-groupe 3 (diacétyle, 2-3-PD et acétoïne)
Le diacétyle et la 2,3‑PD sont des alpha-dicétones et leur structure est identique, à l’exception d’un groupe méthyle supplémentaire dans la 2,3‑PD. Le diacétyle, la 2,3‑PD et l’acétoïne sont tous utilisés dans l’industrie de l’aromatisation alimentaire. La similitude des structures et des groupes fonctionnels dans le diacétyle et la 2,3‑PD se reflètent dans leurs propriétés physicochimiques comparables et le goût de beurre et l’expérience sensorielle similaires qu’ils offrent. On s’attend à ce que la 2,3‑PD soit facilement biodisponible par voie orale et cutanée et par inhalation, comme dans le cas du diacétyle, et à ce que l’incidence du groupe méthyle supplémentaire dans la 2,3‑PD soit minime. Les deux produits chimiques présentent des effets de voie d’entrée dans les voies respiratoires après une exposition par inhalation. À la suite d’une exposition par voie orale, le diacétyle se métabolise rapidement dans le foie en acétoïne et en 2,3‑butanediol. Pour la 2,3‑PD, le simulateur du métabolisme des rats in vivo et in vitro de la version 4 de boîte à outils QSAR de l’OCDE a prédit des métabolites 2-hydroxy-3-pentanone, 3-hydroxy-2-pentanone et 2,3-pentanediol (entre autres), dont la structure ressemblait aux métabolites du diacétyle. Étant donné ces informations, nous avons traité le diacétyle, l’acétoïne et la 2,3‑PD comme un groupe, et les données sur la toxicité de ces substances ont permis à faire des lectures croisées pour le groupe.
7.3.2.1 Diacétyle
L’acétoïne a fait l’objet d’un examen par le PISC (1999), l’EFSA (2004), le SCOEL (2014) et le CDC (2016). Ces études servent de base à la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Une recension des publications scientifiques a été menée à partir d’un an avant le rapport du CDC et du NIOSH (2016) jusqu’en juillet 2017, et de nouveaux renseignements pertinents sont inclus à l’appui de la caractérisation des risques.
Toxicocinétique
Le diacétyle peut être généré de manière endogène et il est un métabolite de l’acétaldéhyde chez les mammifères (PISC, 1999; SCOEL, 2014). Il est prévu que les méthylcétones se métabolisent principalement par l’oxydation du groupe méthyle terminal à de faibles concentrations. À des niveaux supérieurs, le diacétyle est réduit en acétoïne et en 2,3-butanediol, puis se conjugue à l’acide glucuronique avant d’être excrété. Un modèle pharmacocinétique physiologique et de dynamique numérique des fluides a été réalisé pour comparer l’absorption et la concentration tissulaire de diacétyle dans les voies respiratoires des rats et des humains (Gloede et coll., 2011). Le modèle a permis d’estimer que les concentrations de diacétyle dans les tissus bronchiolaires chez les humains pendant un exercice physique léger étaient de 20 à 40 fois plus élevées que chez les rats. Une modélisation plus poussée de la dosimétrie a indiqué que les études de toxicité par inhalation sur des rats sous-estimaient le risque de blessure bronchiolaire chez les humains (Cichocki et Morris, 2017).
Cancérogénicité et toxicité chronique
Le diacétyle n’a été classé par aucun organisme sur la base de sa cancérogénécité ou d’autres effets sur la santé. Toutefois, de récentes études du NTP (NTP, 2017a) ont démontré quelques preuves d’action cancérogène dans des études d’inhalation sur deux ans. Des groupes de rats Wistar Han et de souris B6C3F1/N ont été exposés à des vapeurs de diacétyle par inhalation de tout le corps à des concentrations de 0, de 12,5, de 25 ou de 50 ppm (0, 45, 90, 179 mg/m3) 6 h/jour, 5 jours/semaine, pendant 105 semaines. Chez les rats, on a constaté des augmentations de l’incidence de carcinomes des cellules squameuses dans la cavité nasale chez les mâles comme chez les femelles et de l’incidence combinée de carcinomes des cellules squameuses et des papillomes dans la cavité nasale des mâles à 179 mg/m3. Chez les souris, l’incidence d’adénocarcinomes du nez a augmenté chez les femelles à cette concentration. Le NTP a conclu qu’« il y avait certaines preuves de l’activité cancérogène du diacétyle chez les rats mâles et femelles. Il n’y a eu aucun signe d’activité cancérogène du diacétyle chez les souris B6C3F1/N mâles exposées à 12,5, à 25, ou à 50 ppm. Il y a eu des indications équivoques d’activité cancérogène du diacétyle chez les souris B6C3F1/N femelles sur la base des cas d’adénocarcinome du nez » (NTP, 2017a).
L’exposition au diacétyle a également entraîné des incidences accrues d’effets non cancérogènes dans le nez, le larynx, la trachée et les poumons des souris à toutes les concentrations analysées et chez les rats à 25 et à 50 ppm, des effets plus graves sur le système respiratoire se manifestant à des concentrations plus élevées chez les souris et les rats. Chez les rats, les lésions nasales considérablement plus fréquentes présentaient de l’inflammation purulente, une hyperplasie de l’épithélium respiratoire et une métaplasie pavimenteuse, une atrophie de l’épithélium olfactif, une métaplasie respiratoire et une nécrose (mâles), une hyperostose des fosses nasales et une fibrose de la lamina propria. Une incidence considérablement accrue de l’inflammation chronique active ou purulente et de l’hyperplasie de l’épithélium a également été observée dans le larynx, la trachée, les poumons et les yeux à 50 ppm. À 25 ppm, on a observé une incidence considérablement accrue d’hyperplasie de l’épithélium pavimenteux dans le larynx (mâles et femelles), de régénération de l’épithélium dans la trachée (mâles) et d’hyperplasie de l’épithélium dans les poumons (femelles). Des effets similaires ont été observés à 12,5 ppm chez les souris, comprenant également une métaplasie de l’épithélium respiratoire, une atrophie de l’épithélium olfactif et une atrophie des fosses nasales, ainsi qu’une hyperplasie de l’épithélium pavimenteux dans le larynx. Le taux de survie a modérément diminué chez les femelles à 25 ppm et considérablement diminué chez les femelles à 50 ppm. À la fin de l’étude, le poids corporel moyen a diminué pour les mâles et les femelles à 50 ppm, comparativement aux témoins. Ainsi, une CMENO de 12,5 ppm pour (45 mg/m3) pour l’inhalation chronique est envisagée à la lumière de ces observations d’effets non cancérogènes observés à 12,5 ppm chez les souris et à 25 ppm chez les rats (NTP, 2017a).
Les renseignements disponibles ont indiqué que le diacétyle s’était avéré mutagène dans divers essais in vitro (More et coll. 2012, Kato et coll. 1989, Bjeldanes et Chew, 1979, Marnett et coll. 1985. Shane et coll., 1988, Dorado et coll. 1992 et Aeschbacher et coll., 1989, recensés dans EFSA 2004 et NTP 2017a). Toutefois, les résultats du diacétyle au SOS Chromotest se sont révélés négatifs pour l’E. coli (Von der Hude et coll.,1988) et il n’a pas induit d’aberrations chromosomiques dans S. cerevisiae (Zimmermann et Mohr, 1992).
Toxicité à doses répétées
Un profil d’effets semblable à celui de l’essai biologique de toxicité chronique a été observé dans des études d’inhalation subchronique chez des rats Wistar Han et des souris B6C3F1. On a dérivé une concentration sans effet nocif observé (CSENO) de 12,5 ppm (45 mg/m3) sur la base d’une augmentation considérable de l’incidence de lésions non néoplasiques dans les voies respiratoires (nez, larynx, trachée et poumons) des souris et des rats, principalement dans le groupe de 50 ppm et de 100 ppm après 14 semaines. À 25 ppm, des incidences accrues de métaplasie pavimenteuse de l’épithélium respiratoire ont été observées chez les rats mâles et femelles ainsi qu’une dégénérescence accrue de l’épithélium olfactif chez les rats femelles. Chez les souris, on a observé des incidences accrues de nécrose dans l’épithélium chez les mâles et les femelles à 25 ppm, une hyperplasie et une inflammation active chronique accrues ont aussi été observées dans le larynx des femelles (NTP, 2017a). Des effets similaires ont été rapportés dans une étude antérieure chez des souris exposées au diacétyle pendant six à 12 semaines à 25 ppm ou plus; la plus faible concentration analysée (25 ppm ou 90 mg/m3) a été considérée comme la concentration minimale avec effet nocif observé (CMENO), à en juger par l’importante lésion à l’épithélium et à l’inflammation lymphoïde péribronchique (Morgan et coll., 2008).
Dans une étude sur la toxicité avec prises répétées de doses par voie orale, des rats CFE ont reçu 0, 10, 30, 90 ou 540 mg/kg‑p.c./jour de diacétyle dans de l’eau par intubation orale pendant 90 jours. À la dose la plus élevée, soit 540 mg/kg‑p.c./jour, les rats ont connu une diminution du gain de poids corporel et consommaient plus d’eau. Les effets observés comprennent l’anémie, une numération accrue des leucocytes et une augmentation du poids relatif du cerveau, du foie, des reins, des glandes surrénales et pituitaires (les augmentations du poids des organes ont été plus importantes que les changements attribuables à la diminution du gain pondéral). On a observé des ulcères dans les parties squameuses et glandulaires de la muqueuse gastrique. Aucun effet nocif n’a été remarqué chez les groupes exposés à une dose plus faible. Toutefois, une anémie légère, mais non statistiquement significative, ainsi qu’un accroissement du poids relatif de certains organes ont été observés à de plus faibles doses en l’absence de changements histopathologiques dans l’estomac. Les auteurs ont conclu que la dose sans effet nocif observé (DSENO) pour le diacétyle dans cette étude était de 90 mg/kg/p.c./jour, bien que l’on ne sache pas clairement si les effets observés à 540 mg/kg‑p.c./jour ont pu être secondaires à la formation d’ulcères (Colley et coll., 1969; examiné dans Programme international sur la sécurité chimique [PISC], 1999; Comité Scientifique en matière de limites d’exposition professionnelle [SCOEL], 2014).
Les résultats d’une autre étude sur la toxicité à doses répétées par voie orale indiquent que le diacétyle peut induire des effets neurologiques et sur la reproduction (Bawazir, 2016). L’administration quotidienne de 25 mg/kg/-p.c./jour de diacétyle à des rats par intubation orale durant une étude sur quatre semaines a entraîné des changements des niveaux de plusieurs neurotransmetteurs dans différentes régions du cerveau ainsi qu’une baisse des niveaux de sérum de testostérone. On a observé des changements histologiques dans les testicules, associés à une diminution importante du sperme mature et à un déficit tubulaire. Toutefois, le compte rendu publié de cette étude était plutôt mince et les essais limités à une seule dose.
Toxicité à court terme et aiguë
Les expositions aiguës et à court terme à la vapeur de diacétyle ont causé une vaste gamme de lésions nasales et olfactives (Morgan et coll., 2008, Hubbs et coll., 2002; Larsen et coll., 2009; Morris et Hubbs, 2009), atteint les neurones sensoriels (Goravanahally et coll., 2014) et mené à une hyporéactivité des voies respiratoires (Zaccone et coll., 2013).
Hubbs et coll., (2008), ont exposé des rats Hla :(SD)CVF (6/groupe d’exposition) au diacétyle à certaines concentrations : en régime continu pendant six heures à des concentrations moyennes pondérées dans le temps de 0, 99,3, 198,4 ou 294,6 ppm (0, 355, 710 ou 1055 mg/m3); à quatre expositions intenses mais brèves à des concentrations moyennes pondérées de 0, 122, 225 ou 365 ppm (0, 437, 806 ou 1307 mg/m3); et à une exposition pulsée unique de 15 min à une concentration moyenne pondérée dans le temps de 92,9 ppm (333 mg/m3). Les schémas d’exposition pulsée et continue ont causé des blessures à l’épithélium, y compris une nécrose épithéliale et une inflammation purulente ou fibrinopurulente au nez, au larynx, à la trachée et aux bronches. L’effet le plus grave a été constaté dans le nez. Le larynx et la trachée ont été affectés à des concentrations de diacétyle de 225 ppm ou plus, et les bronches, à des concentrations de 294,6 ppm ou plus. Ils ont constaté des changements histologiques importants (c.-à-d.. une nécrose) dans le nez des rats ayant subi l’exposition pulsée unique de 15 min (concentration moyenne pondérée dans le temps de 92,9 ppm). Les auteurs ont conclu que la CSENO pour le diacétyle aigu inhalé était inférieure à 93 ppm (333 mg/m3), ce qui est considéré ici comme la CMENO.
Toxicité pour la reproduction et le développement
On n’a constaté aucun effet sur la survie maternelle, le poids ou les paramètres de reproduction, ni sur la survie des fœtus ou sur l’apparence microscopique des tissus externes, squelettiques ou mous chez des groupes de souris CD-1 et de rats Winstar albinos qui, pendant les jours 6 à 15 de la gestation, avaient reçu du diacétyle par gavage à des doses allant jusqu’à 1600 mg/kg‑p.c./jour. De même, aucun effet sur les mères ou le développement n’a été observé chez les hamsters qui avaient reçu des doses allant jusqu’à 1600 mg/kg‑p.c./jour pendant les jours de gestation 6 à 10 (FDA américaine, 1973; examiné par Organisation mondiale de la Santé [OMS] 1999a; EFSA, 2004).
Études sur les humains
Plusieurs études épidémiologiques ont trouvé que l’inhalation de vapeurs de diacétyle et d’autres cétones par les travailleurs d’une usine de fabrication de maïs à éclater aux micro-ondes ou d’usines de fabrication d’aromatisants est toujours associée au développement de divers troubles respiratoires tels que la bronchiolite oblitérante (BO) — une maladie rare découlant d’une blessure des voies aériennes épithéliales — et la fibrose pulmonaire (Kreiss et coll., 2002; Parmet et Von Essen, 2002; van Rooy et coll., 2007; CDC, 2016). L’Union européenne a aussi examiné plusieurs rapports de cas, séries de cas et études transversales (SCOEL, 2014) et (CDC, 2016).
7.3.2.2 Pentane-2,3-dione
La pentane-2,3-dione (2,3‑PD) a fait l’objet d’un examen par l’OMS/PISC (1999), l’EFSA (2004) et le CDC/NIOSH (National Institute for Occupational Safety and Health) en 2016. Ces études servent de base à la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Une recherche des publications scientifiques a été menée à partir d’un an avant la publication du CDC/NIOSH (2016) jusqu’en juillet 2017, et de nouveaux renseignements pertinents ont été inclus pour appuyer la caractérisation des risques.
Toxicocinétique
Zaccone et coll. (2015) ont démontré que l’épithélium respiratoire humain pouvait métaboliser la 2,3‑PD en acétoïne et en 2,3-hydroxy-3-pentanone.
Cancérogénicité et génotoxicité
Aucune donnée sur la cancérogénité n’a été recensée pour la 2,3‑PD. Deux études ont démontré que la 2,3‑PD n’était pas mutagène pour la salmonelle (Kim et coll., 1987; Aeschbacher et coll., 1989; examiné dans OMS,1999 et EFSA, 2004, 2016). La 2,3‑PD n’a pas causé la formation de micronoyaux chez les rats ni les souris des deux sexes (NTP, 2017b).
Toxicité à doses répétées
Dans une étude de toxicité par inhalation à doses multiples, des rats Winstar Han et des souris B6C3F1 mâles et femelles ont été exposés à la 2,3‑PD par inhalation à des concentrations de 0, 6, 25, 12,5, 25, 50 ou 100 ppm (0, 26, 51, 102, 205 ou 409 mg/m3) 6 heures/jour, 5 jours/semaine pendant 14 semaines. Des résultats semblables à ceux de l’étude d’exposition subchronique au diacétyle ont été observés. À 50 et à 100 ppm, des observations cliniques ont été notées, dont une respiration anormale, des éternuements et des anomalies oculaires. Des incidences considérablement accrues de lésion non néoplasique sont survenues dans les voies respiratoires des rats mâles et femelles, dont une hyperplasie de l’épithélium dans le nez et une métaplasie dans le larynx. À 25 ppm et au-delà, les incidences d’hyperplasie de l’épithélium respiratoire dans le nez étaient considérablement accrues chez les mâles, tandis que les incidences de métaplasie de l’épithélium respiratoire dans le larynx étaient considérablement accrues chez les femelles. Chez les souris, on a constaté une diminution importante du gain de poids corporel et des changements dans le poids des organes internes chez les deux sexes (en l’absence de modifications histopathologiques) à 50 ppm (205 mg/m3) et plus, ainsi que des incidences accrues de lésions non néoplasiques des voies respiratoires. À 25 ppm, les incidences de métaplasie et de régénération de l’épithélium respiratoire étaient considérablement accrues chez les souris mâles. Le NTP a jugé que la CSENO pour les effets sur les voies respiratoires chez les rats et les souris étaient de 12,5 ppm (51 mg/m3) et que la CSENO pour les effets non liés aux voies respiratoires chez les souris était de 25 ppm (102 mg/m3) (NTP, 2017b).
Aucune étude sur la toxicité avec prises répétées de doses par voie orale n’a été rapportée pour la 2,3‑PD. Ainsi, l’extrapolation d’une voie d’exposition à l’autre de la CSENO pour les effets non liés aux voies respiratoires s’est faite à partir de l’étude d’inhalation subchronique sur la 2,3‑PD pour obtenir une DSENO de 24 mg/kg/p.c./jour (voir l’annexe D). La DSENO de l’étude orale subchronique avec le diacétyle a aussi été utilisée selon une méthode impliquant des données déduites à partir d’analogues pour estimer une DSENO de 105 mg/kg/p.c./jour pour la 2,3‑PD, à l’appui de la caractérisation des risques.
Toxicité aiguë et à doses répétées à court terme
L’exposition aiguë et à court terme à la 2,3‑PD pendant une période allant jusqu’à deux semaines a causé une variété de lésions histopathologiques (dont la rhinite nécrosante, la trachéite, l’inflammation des muqueuses, la métaplasie squameuse et des changements régénératifs, l’atrophie de l’épithélium, des dépôts d’exsudats et des lymphoïdes) dans le nez, le larynx, la trachée ou les poumons des souris et des rats à toutes les concentrations analysées. (Morgan et coll., 2012; Hubbs et coll., 2012; Zaccone et coll., 2013; NTP, 2017a).
7.3.2.3 Acétoïne
L’acétoïne a fait l’objet d’un examen par l’OMS/PISC (1999) et l’EFSA (2004, 2016). Ces études servent de base à la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Une recension des publications scientifiques a été menée à partir d’un an avant l’EFSA (2016) jusqu’en juillet 2017, et certains renseignements figurent dans l’ébauche de rapport technique du NTP sur la cancérogénicité du diacétyle (NTP, 2017a).
Toxicocinétique
L’acétoïne se métabolise principalement par oxydation à faible concentration in vivo, et par réduction en 2,3-butanediol à forte concentration (EFSA, 2004; NTP, 2007a).
Cancérogénicité et toxicité chronique
Dans un essai de dépistage pour la cancérogénicité pulmonaire des additifs alimentaires, dans lequel un nombre limité de tissus ont été évalués, Stoner et coll. (1973) n’ont pas observé d’augmentation du nombre de tumeurs pulmonaires chez les souris de souche A qui avaient reçu de l’acétoïne par injection intrapéritonéale trois fois par semaine pendant sept semaines
Génotoxicité
Plusieurs études ont indiqué que l’acétoïne n’était pas mutagène pour la salmonelle ou E. coli (EFSA 2004; OMS, 1999a; NTP, 2017b).
Toxicité à doses répétées
Dans une étude de la toxicité par voie orale, des rats CFE (15/groupe) ont reçu de l’acétoïne dans de l’eau potable à des concentrations de 0, 750, 3000 ou 12 000 ppm (ce qui équivaut à 0, 85, 330 ou 1300 mg/kg-p.-c./jour) pendant treize semaines (Gaunt et coll., 1972). Aux concentrations de 750 et 3000 ppm, aucun effet important n’a été observé en ce qui concerne le gain de poids corporel, les résultats des examens hématologiques, la chimie sérique, l’excrétion de cellules rénales, les analyses de concentration dans l’urine, le poids des organes ou l’histopathologie. À la plus forte concentration, le poids corporel a considérablement diminué chez les mâles à partir de la semaine 5, et le poids relatif du foie a considérablement augmenté aux semaines 2, 6 et 13. Cet effet s’est manifesté chez les femelles après 13 semaines. Ces effets n’étaient accompagnés d’aucun changement histopathologique et étaient probablement dus à la charge métabolique de l’absorption d’acétoïne. Des baisses légères, mais statistiquement significatives, de la concentration d’hémoglobine et des numérations d’érythrocytes ont également été observées à la dose élevée chez les deux sexes. Les auteurs ont conclu que la DSENO était de 3000 ppm dans l’eau potable (équivalente à 330 mg-kg‑p.c./jour), en fonction des effets de la diminution du gain de poids corporel et des effets hématologiques (Gaunt et coll., 1972, examiné dans PISC,1999).
Des rats Winstar Han et des souris B6C3F1/N mâles et femelles ont été exposés à de l’acétoïne par inhalation par tout le corps à des concentrations allant jusqu’à 800 ppm (2883 mg//m3) à raison de 6 h/j, 5 j/sem pendant 14 semaines. Aucun effet lié à l’exposition sur la survie, le poids corporel, le poids des organes, la pathologie clinique ou l’histopathologie n’a été observé chez l’une ou l’autre espèce après l’exposition à des concentrations d’acétoïne, jusqu’à concurrence de la plus forte concentration analysée (800 ppm ou 2883 mg/m3) (NTP, 2017b).
Nom chimique |
Diacétyle |
Acétoïne |
2,3‑PD |
|---|---|---|---|
Rôle |
Produit chimique cible |
Produit chimique cible |
Produit chimique cible |
CAS |
431-03-8 |
513-86-0 |
600-14-6 |
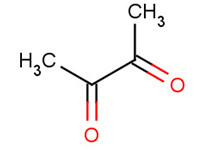 MM = 86,09 |
 MM = 88,10 |
 MM = 100,12 |
|
Toxicité aiguë (létalité) |
DL50 par voie orale = 3000 mg/kg chez les rats |
DL50 par voie orale = 5000 mg/kg chez les rats |
DL50 par voie orale = 3000 mg/kg chez les rats |
Toxicité à court terme (inhalation, 6 h, effets systémiques) |
CMENO = 92,9 ppm (333 mg/m3) |
N.D. |
CSENO = 112 ppm (459 mg/m3) (cytotoxicité respiratoire et olfactive) |
Toxicité à doses répétées (par inhalation, moins de deux semaines) |
CMENO = 100 ppm (358 mg/mm3), la plus faible concentration analysée chez les rats CMENO = 50 ppm (176 mg/m3) (lecture croisée à partir de la 2,3‑PD) |
N.D. |
CMENO = 50 ppm (205 mg/m3) (changements hispathologiques chez les rats et les souris, de 10 à 12 jours). |
Toxicité subchronique (par voie orale pendant 90 jours) |
DSENO = 90 mg/kg -p.c./j |
DSENO = 330 mg/kg- p.c./j (eau potable, diminution du poids corporel et anémie) |
DSENO = 105 mg/kg p.c./j (déduite à partir du diacétyle) DSENO = 24 mg/kg‑p.c./jour (à partir des effets non liés aux voies respiratoires dans l’étude de toxicité par inhalation sur 90 jours) |
Toxicité subchronique (par inhalation sur 90 jours) |
CSENO = 12,5 ppm (45 mg/m3) |
CSENO = 800 ppm (2883 mg/mm3), la plus forte concentration analysée (NTP 2017b) |
CSENO = 12,5 ppm (51 mg/m3) (changements hispathologiques dans le système respiratoire chez les rats et les souris; 14 semaines) |
Toxicité subchronique (par voie cutanée) |
DSENO = 90 mg/kg p.c./j (déduite de l’exposition orale) |
DSENO = 330 mg/kg p.c./j (extrapolation de l’exposition orale) |
DSENO = 105 mg/kg p.c./j (déduite à partir du diacétyle) |
Toxicité chronique (inhalation) |
CMENO = 12,5 ppm (45 mg/m3) (hyperplasie de l’épithélium pavimenteux dans le larynx, la trachée et les poumons) |
N.D. |
N.D. |
Toxicité pour le développement (par voie orale) |
DSENO = 1600 mg/kg p.c./j |
DSENO = 1640 mg/kg p.c./j (déduite à partir du diacétyle) |
N.D. |
Génotoxicité |
Probablement génotoxique |
Faible potentiel génotoxique |
Probablement génotoxique (lecture croisée à partir du diacétyle) |
Cancérogénicité |
Certaines études chroniques menées sur des animaux ont révélé des preuves de cancérogénicité. |
Faible potentiel |
Certaines études chroniques menées sur des animaux ont révélé des preuves de cancérogénicité (lecture croisée à partir du diacétyle). |
Abréviations : N.D., non déterminé; MM, masse moléculaire (g/mol)
7.3.3 Caractérisation des risques posés par les substances du sous‑groupe 3 (diacétyle, 2,3‑PD et acétoïne)
Diacétyle
Aucun organisme n’a « classé » le diacétyle sur la base de la cancérogénicité ou d’autres effets sur la santé, toutefois des récentes études par la NTP (2017a) sur l’inhalation sur une période de deux ans ont montré des preuves d’activité cancérogène chez les souris et les rats, ainsi que des augmentations marquées de l’incidence de tumeurs nasales à 179 mg/m3. Des éléments probants indiquent également que le diacétyle est génotoxique. Une exposition chronique au diacétyle a également haussé l’incidence d’effets non cancérogènes pour le nez, le larynx, la trachée et les poumons des souris à toutes les concentrations analysées (donnant une CMENO de 45 mg/m3), des effets plus graves sur le système respiratoire des souris et des rats se manifestant à des concentrations plus élevées. Un spectre d’effets sur le système respiratoire similaire a également été observé lors d’études sur la toxicité subchronique, à court terme et aiguë chez les rongeurs. L’exposition pulsée et continue au diacétyle pendant à peine 15 minutes a causé des blessures à l’épithélium. Hubbs et coll. (2008) considèrent que la CSENO d’une dose aiguë de diacétyle inhalé est inférieure à 333 mg/m3
La base des données disponibles sur la toxicité de l’exposition par voie orale au diacétyle est plus limitée. Dans une étude subchronique sur des rats, on a noté des effets sur les paramètres hématologiques et le poids de plusieurs chroniques à 540 mg/kg p.c./jour) (DSENO de 90 mg/kg p.c./jour), qui auraient pu être secondaires à l’ulcération observée de l’estomac (Colley et coll., 1969; examiné par PISC,1999; EFSA, 2004 et SCOEL, 2014). À la lumière des limites des autres études recensées sur la toxicité par voie orale (Bawarzi, 2016; FDA américaine, 1973; examinées par PISC,1999; EFSA, 2004), et la DSENO par voie orale systémique de 330 mg/kg‑p.c./jour signalée pour l’acétoïne (un métabolite du diacétyle qui s’est avéré moins puissant que le diacétyle dans des études selon des méthodes similaires), une étude sur l’eau potable (Gaunt et coll., 1972) laisse à penser que la véritable DSENO pour le diacétyle pourrait se situer entre 90 et 330 mg/kg‑p.c./jour.
Plusieurs éléments de preuve démontrent que les effets observés dans des études d’inhalation sur des animaux de laboratoire sont pertinents pour les humains et étayent la conclusion de l’évaluation épidémiologique quantitative des risques posés par le diacétyle (CDC, 2016), d’après des cas signalés de l’apparition de divers troubles respiratoires chez les travailleurs d’usines de fabrication de maïs à éclater aux micro-ondes ou d’aromatisantsNote de bas de page 10 (Kreiss et coll., 2002; Parmet et Von Essen, 2002; van Rooy et coll., 2007). Toutefois, les estimations de la modélisation de la dosimétrie laissent entendre que les concentrations de diacétyle dans les tissus des voies respiratoires humaines pourraient être de 20 à 40 fois supérieures à celles des rongeurs exposés (Gloede et coll., 2011) et que les données issues des essais biologiques sont à même de sous-estimer le risque pour les humains (Cichocki et Morris, 2017).
L’alimentation constitue la principale source d’exposition de l’ensemble de la population au diacétyle. L’absorption estimée liée à l’utilisation du diacétyle comme possible agent aromatisant dans les aliments (de 56 à 133 µg/kg‑p.c./jour) est inférieure à l’absorption estimée de cette substance présente à l’état naturel (-281- 1625 µg/kg‑p.c./jour). Le JEFCA (OMS, 1999a) conclut ce qui suit : « aucun problème de sécurité aux niveaux d’ingestion actuels lorsqu’il est utilisé comme agent aromatisant; les composants secondaires ne présentent pas de risque pour la sécurité », d’après les estimations de l’exposition par le régime alimentaire aux substances formant ce groupe d’aromatisants. Puisque la DSENO véritable pour le diacétyle se situe probablement entre 90 et 330 mg/kg‑p.c./jour et que les effets sont probablement dus à la formation d’ulcères dans l’estomac, les marges d’exposition calculées (54 et moins et 199 et plus) sont considérées adéquates pour compenser les incertitudes dans les bases de données.
Étant donné l’utilisation répandue du diacétyle comme agent aromatisant, entre autres dans le maïs à éclater aux micro-ondes, on a calculé les expositions par inhalation potentielles. On a également trouvé du diacétyle dans un produit coiffant vendu au Canada. Le tableau 7‑17 présente toutes les valeurs d’exposition et les effets critiques sur la santé pertinents en ce qui concerne le diacétyle ainsi que les marges d’exposition (ME) obtenues pour la caractérisation des risques.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Paramètre d’effet critique pour la santé |
ME |
|---|---|---|---|---|
Inhalation de maïs à éclater aux micro-ondes |
Concentration après 15 minutes = 0,04 mg/m3 |
CMENO = 333 mg/m3 |
Effets nasaux et laryngés (nécrose/inflammation dans l’épithélium) |
8325 |
Cosmétiques (inhalation) |
Concentration moyenne pondérée de 6 heures = 0,008 – 0,064 mg/m3 |
CMENO = 45 mg/m3 |
Effets nasaux (exsudat et atrophie de l’épithélium olfactif) |
703 – 5625 |
Les ME pour l’exposition par inhalation au diacétyle dans le maïs à éclater aux micro-ondes ou l’utilisation d’un produit coiffant offert aux consommateurs qui en contient, sont considérés adéquates pour compenser les incertitudes des bases de données.
2,3‑PD
Aucune donnée sur la cancérogénicité du 2,3‑PD n’a été recensée
D’après les résultats préliminaires d’une étude d’inhalation chronique chez les rats et les souris (NTP, 2017b), à l’instar de ce qui fut observé avec le diacétyle, les voies respiratoires (les voies nasales et le larynx en particulier) sont la cible de la toxicité induite par la 2,3‑PD. Les incidences des lésions non néoplasiques ont connu une augmentation considérable chez les rats et les souris à des concentrations de 102 mg/m3 et plus (CSENO = 51 mg/m3). Des études à plus court terme ont donné des résultats semblables, avec une CMENO de 205 mg/m3, la plus faible concentration analysée (Morgan et coll., 2012).
Les effets observés chez les souris et les rats exposés à la 2,3‑PD sont principalement localisés dans les voies respiratoires, mais des effets systémiques (diminution du gain moyen de poids corporel et du poids des organes) sont également observés à 205 mg/m3 et plus, en l’absence de modifications histopathologiques. En ce qui aux expositions par voie orale, pour caractériser le risque posé par l’ingestion de 2,3‑PD nous avons utilisé l’extrapolation d’une voie d’exposition à l’autre de l’étude d’inhalation subchronique, qui donne une DSENO de 24 mg/kg‑p.c./jour pour les effets non liés aux voies respiratoires, et le résultat de la lecture croisée à partir de l’étude de toxicité subchronique du diacétyle par voie orale, ce qui donne une DSENO de 105 mg/kg‑p.c./jour.
Les aliments dans lesquels la 2,3‑PD est naturellement présente sont la principale source d’exposition de l’ensemble de la population cette substance. L’absorption estimée liée à l’utilisation de la 2,3‑PD comme possible agent aromatisant dans les aliments (de 1 à 4 µg/kg‑p.c./jour) est moindre que les absorptions estimées de cette substance présentent à l’état naturel (de 6,5 à 208 µg/kg‑p.c./jour). La marge d’exposition associée à une DSENO par voie orale de 24 mg/kg-p.-c./jour basée sur l’extrapolation d’une voie à l’autre est faible toutefois, en l’absence de changements histopathologiques dans les organes internes et à la lumière des approches employées pour estimer l’exposition à la 2,3‑PD naturellement présent présente dans la nourriture, les marge d’exposition calculées, entre 115 et 16 154, sont considérées adéquates pour compenser les incertitudes des bases de données sur les effets de l’exposition sur la santé. Les marges d’exposition seraient légèrement inférieures, mais sont toujours considérées adéquates, si l’absorption estimée liée à l’utilisation de la 2,3‑PD comme possible agent aromatisant dans les aliments, si elles sont combinées à la présence naturelle dans les aliments. Qui plus est, le JEFCA (OMS, 1999a) a conclu ce qui suit : « aucun problème de sécurité aux niveaux d’ingestion actuels lorsqu’il est utilisé comme agent aromatisant; les composants secondaires ne présentent pas de risque pour la sécurité » d’après les estimations de l’exposition pour la 2,3‑PD.
On a également trouvé de la 2,3‑PD dans des produits offerts aux consommateurs, y compris certains assainisseurs d’air en continu pour l’entretien de la maison et dans des huiles parfumées qui peuvent servir à assainir l’air. Une comparaison des expositions moyennes pondérées estimées liées à l’utilisation d’assainisseurs d’air contenant de la 2,3‑PD (0,004 – 0,14 mg/m3) avec la CSENO de 51 mg/m3 a donné des marges d’exposition variant entre 364 et 12 750, jugées adéquates pour tenir compte des incertitudes dans les bases de données.
Acétoïne
Il existe peu d’études sur la toxicité de l’acétoïne. L’acétoïne n’a pas favorisé l’apparition de tumeurs pulmonaires dans un essai restreint de dépistage pour vérifier la cancérogénicité des additifs alimentaires chez la souris (Stoner et coll., 1973). On ne prévoit pas que l’acétoïne soit génotoxique.
Pour caractériser le risque associé à l’exposition à l’acétoïne par voie orale, nous utilisons une DSENO de 330 mg/kg‑p.c./jour, fondée sur des changements dans le poids corporel et les paramètres hématologiques déterminés dans une étude de treize semaines (Gaunt et coll. 1972, examiné dans PISC, 1999).
Selon un compte rendu préliminaire des résultats d’une étude d’inhalation, l’acétoïne n’a causé aucun effet chez les souris exposées à des concentrations allant jusqu’à 800 ppm (2833 mg/m3) pendant 14 semaines (NTP, 2017b), ce que nous considérons être la CSENO.
Les aliments dans lesquels elle est naturellement présente sont la principale source d’exposition à l’acétoïne de l’ensemble de la population. L’absorption estimée liée à l’utilisation de l’acétoïne comme possible agent aromatisant dans les aliments (de 29 à 46 µg/kg‑p.c./jour) est moindre que les absorptions estimées de cette substance présentent à l’état naturel (de 0,5 à 3,2 mg/kg‑p.c./jour). Sur la base des approches prudentes employées dans l’estimation de l’exposition à l’acétoïne dans la nourriture, les marges d’exposition calculées, variant de 102 à 11 379, sont jugées adéquates pour compenser les incertitudes des bases de données sur les effets de l’exposition sur la santé. Qui plus est, le JEFCA (OMS, 1999a) a conclu ce qui suit : « aucun problème de sécurité aux niveaux d’ingestion actuels lorsqu’elle est utilisée comme agent aromatisant; les composants secondaires ne présentent pas de risque pour la sécurité » d’après les estimations de l’exposition par le régime alimentaire pour les substances comprises dans ce groupe d’aromatisants. En outre, on a tenu compte des expositions potentielles par inhalation de l’acétoïne dans le maïs à éclater aux micro-ondes. Une comparaison des expositions prudentes des concentrations atmosphériques d’acétoïne contenue dans le maïs soufflé à éclater aux micro-ondes (de 10 à 4200 mg/m3) avec la CSENO de 2833 mg/m3 a donné des marges d’exposition variant entre 686 et 288 300, jugées adéquates pour compenser les incertitudes dans les bases de données.
7.3.4 Incertitudes dans l’évaluation des risques posés par le diacétyle, la 2,3‑PD et l’acétoïne sur la santé humaine
Le tableau suivant présente les principales sources d’incertitude. Pour le diacétyle et la 2,3‑PD, bien que l’on soit certain qu’ils induisent des effets sur la santé à la suite d’une exposition par inhalation, une plus grande incertitude entoure la toxicité de ces substances à la suite d’une exposition par voie orale à long terme, puisque l’ingestion dans la nourriture est une source importante d’exposition de la population à cause de la présence naturelle de ces dicétones dans la nourriture et leur utilisation comme agents aromatisants dans les aliments. Pour l’acétoïne, bien que la base de données sur les dangers soit limitée, suffisamment de preuves indiquent qu’elle est de plus faible toxicité que le diacétyle; nous sommes donc certains que les risques pour la santé humaine au Canada sont probablement faibles.
Il existe une incertitude sur présence naturelle de diacétyle dans le lait consommé par les Canadiens ainsi que l’absorption de diacétyle quotidienne, estimée et dérivée sur la base d’une concentration finale plus élevée, étant donné la vaste plage de concentrations de diacétyle dans le lait mentionnées dans les publications scientifiques.
Sources importantes d’incertitude |
Incidence |
|---|---|
Données de surveillance canadiennes des aliments absentes ou limitées |
+/- |
En ce qui concerne la présence naturelle de diacétyle, de la 2,3‑PD et de l’acétoïne dans la nourriture, lorsque la documentation scientifique présente une vaste plage de concentrations, les valeurs maximales ont été choisies, sauf dans le cas des valeurs aberrantes. |
+ |
Les expositions potentielles par inhalation au diacétyle en cuisinant avec des aliments qui contiennent la substance, tant sous sa forme naturelle que dans les aromatisants alimentaires. |
- |
On présume que les expositions au diacétyle par voie cutanée sont minimales par rapport aux expositions par inhalation, étant donné la forte volatilité de la substance. |
- |
Malgré des preuves directes limitées, il a été considéré que des produits coiffants contenant du diacétyle étaient peut-être accessibles à la population générale au Canada. |
+ |
Il n’existe pas d’études sur la toxicité chronique de l’acétoïne et la 2,3‑PD. De plus, la base de données générale sur l’acétoïne est restreinte. |
- |
La base de données sur la toxicité par voie orale du diacétyle, de la 2,3‑PD et de l’acétoïne est limitée. |
+/- |
Des incertitudes entourent la pertinence pour les humains de la cancérogénicité induite par le diacétyle et d’autres formes de toxicité par inhalation pour le système respiratoire des rats et des souris et la plus grande sensibilité potentielle des humains. |
- |
Aucune donnée sur l’absorption par voie cutanée ou par inhalation n’a été recensée. |
+/- |
Lecture croisée à partir du diacétyle pour évaluer la 2,3‑PD étant donné l’absence de données. |
+/- |
+ : incertitude ayant le potentiel de causer une surestimation de l’exposition ou du risque
- : incertitude ayant le potentiel de causer une sous-estimation de l’exposition ou du risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque
7.4 Évaluation individuelle de la 2,4‑PD
7.4.1 Évaluation de l’exposition
Milieux environnementaux
Aucune donnée n’a été retrouvée sur la présence de 2,4‑PD dans l’air intérieur et extérieur, dans l’eau potable ou dans le sol, au Canada comme ailleurs. À en juger par ses propriétés physiques et chimiques, si elle est rejetée dans l’environnement, la 2,4‑PD devrait se répartir principalement (environ 90 %) dans l’eau et dans une moindre mesure (environ 10 %) dans l’air; toutefois, sa constante de la loi d’Henry et sa pression de vapeur modérées indiquent que la substance est susceptible de se volatiliser depuis l’eau (HSDB, 1983-, OCDE, 2001). La 2,4‑PD est susceptible d’avoir une forte mobilité dans le sol et risque peu d’adhérer aux sédiments ou aux particules en suspension dans l’eau (HSDB, 1983-).
Nous avons exécuté le modèle de fugacité de niveau III, connu sous le nom de ChemCAN (2003), pour calculer des concentrations environnementales potentielles de 2,4‑PD pour le Canada à partir des valeurs les plus élevées du volume, présentées au tableau 4‑1 (c.-à-d. 1 000 000 kg). Les concentrations estimées dans l’air, l’eau, le sol et les sédiments étaient respectivement de 5,4 ng/m3, de 48,9 ng/L, de 0,007 ng/g et de 0,003 ng/g. Nous avons utilisé ces concentrations pour estimer l’exposition au 2,4‑PD par les milieux environnementaux pour l’ensemble de la population du Canada. Les concentrations de 2,4‑PD dérivées de ChemCAN pour le sol et les sédiments étaient toutes de l’ordre du nanogramme, ce qui se traduit par des expositions de moins de 1 ng/kg/jour, une valeur jugée négligeable.
Les estimations de l’exposition pour la 2,4‑PD par les milieux environnementaux variaient entre 0,002 µg/kg‑p.c. par jour pour les nourrissons allaités (de zéro à six mois) à 0,007 µg/kg‑p.c. par jour pour les nourrissons nourris au lait maternisé (de zéro à six mois) (Santé Canada, 2018).
Aliments
La 2,4‑PD est un composé volatil présent dans certains aliments, comme le bœuf, le poulet, le café, les champignons, la papaye et le fruit de la passion (Nijssen et coll., 1963-2016). Seules des données quantitatives sur le poulet rôti (0,004 ppm) et le jus de fruits de la passion (moins de 0,01 ppm) étaient disponibles. Elles ont servi à estimer les expositions potentielles à la 2,4‑PD contenue dans la nourriture pour l’ensemble de la population du Canada. Les estimations quantitatives de l’exposition à la 2,4‑PD présente à l’état naturel dans les alimentsNote de bas de page 11 variaient entre 0,02 µg/kg‑p.c. par jour pour les adultes de 19 ans et plus à 0,14 µg/kg‑p.c. par jour pour les tout-petits âgés de deux à trois ans (voir l’annexe A pour les détails).
Produits utilisés par les consommateurs
La 2,4‑PD est utilisée comme additif dans les peintures et les revêtements (OCDE, 2001; Environnement Canada, 2012; FS, 2012b). Nous avons trouvé que la plupart de ces produits sont exclusivement à usage commercial ou industriel, mais certains pourraient être utilisés par des consommateurs (Environnement Canada, 2012; FS, 2012b). À l’aide de la version Web de ConsExpo (ConsExpo, 2016), nous avons estimé l’exposition, par inhalation et par voie cutanée, occasionnée par l’application sur une grande surface comme la remorque d’un camion ou un bateau d’un revêtement contenant de 1 à 5 % de 2,4‑PD (FS, 2012b, 2016b). Les concentrations moyennes par événement variaient de 75 à 320 mg/m3, celles du jour de l’exposition, de 3 à 13 mg/m3, et la concentration moyenne pondérée sur six heures, de 13 à 53 mg/m3. Les estimations de l’exposition par voie cutanée se chiffraient entre 0,04 et 0,2 mg/kg‑p.c./jour.
7.4.2 Évaluation des effets sur la santé
L’OCDE (2001) et l’EFSA (2014) ont étudié la 2,4‑PD. Ces études servent de base à la caractérisation des effets sur la santé dans la présente ébauche d’évaluation préalable. Nous avons recensé les publications scientifiques à partir d’un an avant la publication du rapport d’évaluation initiale de l’OCDE (2001) jusqu’en juillet 2017, et les nouveaux renseignements pertinents ont été utilisés dans la caractérisation des risques.
Toxicocinétique
L’EFSA (2004) a noté qu’en raison de sa structure et de ses caractéristiques, la substance devrait être rapidement absorbée par le tractus gastro-intestinal et largement distribuée et métabolisée. Aucun renseignement sur la toxicocinétique de l’exposition par voie cutanée à la 2,4‑PD n’a été retrouvé.
Cancérogénicité/toxicité chronique
Dans le cadre d’une étude sur la cancérogénicité en cas d’inhalation, des rats F344 et des souris B6D2F1 ont été exposés à des vapeurs de 2,4‑PD à des concentrations cibles de 0, de 100, de 200 ou de 400 ppm (0, 417, 834 ou 1668 mg/m3) pendant 6 h/j, 5 j/sem, durant deux ans (JBRC, 2010a, b). Chez les rats, les lésions non néoplasiques étaient principalement localisées dans la cavité nasale chez les deux sexes à la concentration de 200 ppm et plus, y compris une métaplasie pavimenteuse de l’épithélium respiratoire, de l’inflammation, une hyperplasie de l’épithélium transitoire et une atrophie de l’épithélium olfactif. De même, les effets sur la cavité nasale observés chez les souris comprenaient une métaplasie pavimenteuse, des changements éosinophiles, des ulcères, de la nécrose et une hyperplasie des cellules transitionnelles dans l’épithélium respiratoire; une atrophie, une métaplasie respiratoire, des changements éosinophiles, de la nécrose dans l’épithélium olfactif et une métaplasie respiratoire dans la glande sous-muqueuse à 200 et à 400 ppm, tandis que l’exsudat et l’atrophie dans l’épithélium olfactif se sont produits à toutes les concentrations. On a également noté des modifications des paramètres biochimiques chez les mâles et les femelles à 200 et à 400 ppm. En se basant sur les lésions nasales, les auteurs de l’étude ont déterminé que 100 ppm (417 mg/m3) était la CSENO chez les rats et la CMENO chez les souris (JBRC, 2010a,b). On n’a pas observé d’incidences accrues des lésions néoplasiques dans le grand éventail de tissus des animaux exposés qui ont été examinés.
Génotoxicité
L’OCDE (2001) et l’EFSA (2004) ont étudié la toxicité potentielle de la 2,4‑PD. Dans l’ensemble, la 2,4‑PD ne s’est pas toujours avérée mutagène in vitro, mais présentait un potentiel clastogène (aberrations chromosomiques et échanges de chromatides sœurs), notamment en l’absence d’activation métabolique (Ballantyne et Cawley, 2001; OCDE, 2001). In vivo, un potentiel clastogène (micronoyaux) a été observé chez les souris exposées par administration intrapéritonéale, mais pas chez les rats ou les souris exposés par inhalation, ce qui indique une dépendance par rapport à la voie d’exposition (Ballantyne et Cawley, 2001; OCDE, 2001). L’administration de 2,4‑PD par voie orale n’a pas causé de dommages à l’ADN des tissus des rats (ECHA, c2007-2017d) ou d’aberrations chromosomiques dans les spermatogonies des souris (OCDE, 2001), bien que l’exposition par inhalation ait entraîné un léger effet à dominance létale réversible chez les rats (Tyl et coll., 1989). L’EFSA (2004) a toutefois conclu que l’utilisation de 2,4‑PD comme substance aromatisante n’était pas acceptable en raison de son potentiel génotoxique (clastogène).
Toxicité à doses répétées
Dans leur étude sur la toxicité par voie cutanée, Ballantyne (2001, cité dans OCDE, 2001) ont exposé par contact obstrué quotidiennement pendant neuf jours, des lapins blancs néo-zélandais, à des doses de 0, de 244, de 975 et de 1463 mg/kg‑p.c./jour à la 2,4‑PD. Environ 50 % des animaux de l’un ou de l’autre sexe du groupe ayant reçu une dose élevée (1463 mg/kg‑p.c./jour) sont morts. Aux doses moyennes et élevées, la 2,4‑PD a causé des signes d’hypoactivité, de prostration, de salivation, de tremblements, de halètement, de convulsions, de cyanose (indiquée par le bleuissement du derme de la région nasale), une diminution du gain de poids corporel et de la consommation alimentaire, des hémorragies et une dégénérescence neuronale. À partir des effets systémiques, l’auteur a trouvé une DSENO de 244 mg/kg‑p.c./jour et une DMENO de 975 mg/kg‑p.c./jour.
Les données sur l’exposition par voie orale sont limitées. Eastman Kodak (1979, cité par OCDE 2001) a administré par gavage des doses de 500 mg/kg‑p.c./jour à des rats pendant deux semaines, ce qui a causé un éventail d’effets systémiques sur la vessie, les poumons, les yeux, le thymus, le foie, les reins, le cœur et les ganglions et le décès de tous les animaux ayant reçu 1000 mg/kg‑p.c./jour; on considère que la DSENO est de 100 mg/kg‑p.c./jour (Eastman Kodak 1979). D’autres études par gavage menées par ces chercheurs sont citées dans EFSA (2004), dont une étude de 126 jours sur des rats (DSENO inférieure à 200 mg/kg‑p.c./jour) et une étude de 14 jours sur des lapins (DSENO = 250 mg/kg‑p.c./jour); toutefois, les détails publiés sont insuffisants pour permettre une évaluation.
L’exposition des rats par inhalation à 0, 100, 300 ou 650 ppm (0, 417, 1217 ou 2711 mg/m3) de 2,4‑PD pendant 14 semaines a induit une grande variété d’effets systémiques à 300 ppm et plus, et une mortalité élevée à 2711 mg/m3. D’après les effets sur la chimie hématologique, clinique et urinaire dans le groupe exposé à 1217 mg/m3 et les effets graves à 2711 mg/m, y compris des effets histopathologiques au cerveau et au thymus, les auteurs ont établi une CSENO de 417 mg/m3 pour cette étude (Dodd et coll., 1986, cité dans OCDE 2001). Dans une étude de deux semaines menée par les mêmes auteurs, la CSENO et la CMENO ont été fixées à 200 ppm (834 mg/m3) et à 400 ppm (1668 mg/m3), respectivement, en se basant sur le poids réduit des organes et la nécrose ou l’inflammation nasale à de plus fortes concentrations (OCDE, 2001).
Puisqu’aucune étude de la toxicité par voie orale n’était disponible, on a procédé à une extrapolation d’une voie à l’autre à partir de la CSENO par inhalation de 417 mg/m3 de l’étude susmentionnée pour obtenir une DSENO par voie orale de 23 mg/kg‑p.c./jour (voir l’annexe D).
Toxicité pour la reproduction et le développement
Dans l’étude par inhalation subchronique effectuée sur des rats F344 mâles et femelles exposés à la 2,4‑PD, à des concentrations allant jusqu’à 2711 mg/m3, on n’a noté aucun résultat significativement pathologique pour les testicules et l’épididyme des mâles ou pour l’utérus, le col et les ovaires des femelles (Dodd et coll.,1986, cité dans OCDE, 2001). On n’a recensé aucune étude se penchant sur les effets potentiels sur la performance reproductive de l’exposition à la 2,4‑PD.
Dans une étude de la toxicité par inhalation pour le développement, des rattes F344 gravides ont été exposées à des concentrations de 0, 53, 202 ou 398 ppm (0, 217, 827 ou 1629 mg/m3) de 2,4‑PD pendant 6 heures/jour les jours de gestation 6 à 15 (Tyl et coll., 1990). Aucun effet n’a été observé sur le nombre de corps jaunes, d’implants par portée, de pertes avant ou après l’implantation ou sur le rapport de masculinité des fœtus. On a rapporté une réduction importante du poids corporel des fœtus par portée (environ 10 %) chez les mâles, les femelles et tous les fœtus à 398 ppm (1629 mg/m3). À cette concentration, un schéma constant de diminution de l’ossification du fœtus, de variations au niveau du squelette et de poids réduit de la mère a aussi été rapporté. À 202 ppm (827 mg/m3), s’est produite une réduction légère, mais statistiquement significative (d’environ 3 %), du poids corporel des fœtus par portée, mais seulement chez les mâles. Les auteurs ont conclu que la concentration sans effet observé (CSEO) était de 53 ppm pour la toxicité maternelle et la toxicité pour le développement (Tyl et coll., 1990). De même, l’OCDE (2001) a conclu que la DSENO pour le développement était de 53 ppm (217 mg/m3). Toutefois, à la lumière de la diminution minime du poids corporel des fœtus mâles seulement, ce qui est peu susceptible d’être jugé nocif, on considère, aux fins de la présente évaluation, que la DSENO pour la toxicité pour le développement et la toxicité maternelle est de 202 ppm (827 mg/m3).
7.4.3 Caractérisation des risques posés par la 2,4‑PD
La 2,4‑PD ne s’est pas avérée cancérogène pour les rats et les souris exposés par inhalation. Des lésions non cancéreuses étaient principalement localisées dans la cavité nasale (JBRC, 2010a, b). On a toutefois signalé des effets clastogènes pour la 2,4‑PD, ce qui a amené l’EFSA à conclure que l’utilisation de la 2,4‑PD comme substance aromatisante n’était pas acceptable (2004).
Les toxicités systémiques et pour le développement sont jugées être des effets critiques sur la santé aux fins de la caractérisation des risques liés à l’exposition par inhalation à plus court terme à la 2,4‑PD. La CSENO pour la toxicité systémique et pour le développement chez les rats a été fixée à 827 mg/m3. Une CSENO de 200 ppm (834 mg/m3) établie dans le cadre d’une étude de 14 jours (Dodd et coll., 1986, cité dans OCDE, 2001) appuie la sélection de cette concentration entraînant un effet critique pour la caractérisation des risques. En ce qui touche l’exposition à plus long terme, divers effets systémiques ont été observés durant l’étude de 14 semaines, et la CSENO a été fixée à 417 mg/m3 (Dodd et coll., 1986, cité dans OCDE, 2001).
Pour ce qui est de l’exposition par voie orale, en fonction des données limitées, nous avons tenu compte de l’étude par gavage à court terme qui a produit une DSENO de 100 mg/kg‑p.c./jour (Eastman Kodak,1979, cité dans OCDE, 2001) et d’une extrapolation d’une voie à l’autre à partir de l’étude de la toxicité par inhalation pour le développement pour une exposition à plus long terme, ce qui a donné une DSENO de 23 mg/kg‑p.c./jour.
L’exposition par voie cutanée à la 2,4‑PD a aussi produit différents effets chez les lapins ayant reçu 500 mg/kg‑p.c./jour; ainsi, une DSENO de 244 mg/kg‑p.c./jour (Ballantyne, 2001, cité dans OCDE, 2001) a été utilisée pour caractériser le risque associé à l’exposition par voie cutanée à la 2,4‑PD.
L’ensemble de la population du Canada est exposé à de la 2,4‑PD en petites quantités par les milieux environnementaux et l’alimentation en raison de sa présence naturelle dans la nourriture.
La 2,4‑PD sert aussi d’additif dans les peintures et les revêtements, principalement à des fins commerciales ou industrielles; toutefois, certains sont des produits offerts aux consommateurs. Le tableau 7‑19 présente toutes les valeurs d’exposition et les effets critiques sur la santé, pertinents en ce qui concerne la 2,4‑PD ainsi que les marges d’exposition (ME) obtenues pour la caractérisation des risques.
Scénario d’exposition |
Exposition |
Niveau d’effet critique |
Effet critique pour la santé |
ME |
|---|---|---|---|---|
Milieux environnementaux |
de 0,002 à 0,007 µg/kg‑p.c./jour |
DSENO = 100 mg/kg‑p.c./jour DSENO = 23 mg/kg p.c./jour |
Toxicité systémique dans une étude de la toxicité par voie orale de deux semaines Extrapolation d’une voie à l’autre à partir d’une étude par inhalation de 14 semaines |
moins de 3 millions |
Application sur une grande surface d’un revêtement (inhalation) |
Concentration moyenne pondérée de 6 heures = de 13 à 53 mg/m3 |
CSENO = 827 mg/m3 |
Effets sur le développement (diminution du poids des fœtus et diminution de l’ossification des fœtus, variations au niveau du squelette) et poids réduit de la mère. |
de 16 à 64 |
Revêtement pour grande surface (voie cutanée) |
de 0,04 à 0,2 mg/kg p.c./jour |
DSENO = 244 mg/kg p.c./jour |
Vessie distendue, poumons congestionnés, cornée opaque, nécrose thymique, hépatocytes enflés et congestionnés, néphrose, lymphadénite des ganglions mésentériques et inflammation du cœur, selon une étude de la toxicité par voie cutanée de neuf jours |
de 1220 à 6100 |
Les marges d’exposition à la 2,4‑PD dans les milieux environnementaux sont jugées adéquates pour compenser les incertitudes des bases de données sur les effets de l’exposition sur la santé. L’absorption supplémentaire de 2,4‑PD en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. Toutefois, toutes les marges d’exposition à la 2,4‑PD dans les produits offerts aux consommateurs, à savoir le revêtement de plancher, sont jugées potentiellement inadéquates pour compenser les incertitudes des bases de données sur des effets sur la santé de l’exposition.
7.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les sources clés d’incertitude sont présentées dans le tableau suivant. À la lumière de la génotoxicité prouvée de la 2,4‑PD, il serait utile d’avoir d’autres données tirées d’études à plus long terme afin d’accroître la certitude que les risques potentiels liés aux expositions prolongées seraient faibles.
Principale source d’incertitude |
Incidence |
|---|---|
Données de surveillance canadiennes des aliments absentes ou limitées |
+/- |
Détails sur les types précis de produits offerts aux consommateurs qui contiennent de la 2,4‑PD; toutefois, l’utilisation des valeurs supérieures des concentrations maximales mène probablement à une sous-estimation des expositions aux produits offerts aux consommateurs. |
+ |
Il n’existe pas d’étude de la toxicité par voie orale ou cutanée chronique ou d’étude de la toxicité subchronique par voie orale pour la 2,4‑PD. |
+/- |
+ : incertitude ayant le potentiel de causer une surestimation de l’exposition ou du risque
- : incertitude ayant le potentiel de causer une sous-estimation de l’exposition ou du risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque
7.5 Évaluation de l’oxyde de mésityle
7.5.1 Évaluation de l’exposition
Milieux environnementaux
On a mesuré la quantité d’oxyde de mésityle dans l’étude sur l’air intérieur dans le cadre du cycle 2 de l’Enquête canadienne sur les mesures de la santé (ECMS) et lors d’une étude plus succincte sur l’air intérieur au Québec (communication personnelle, courriel du Bureau de la science et de la recherche en santé environnementale (BSRSE) au Bureau d’évaluation des risques des substances existantes (BERSE) de Santé Canada de Santé Canada, datant de décembre 2012, source non citée; Won et Lusztyk, 2011). On a détecté de l’oxyde de mésityle dans moins de 12 % des échantillons (limite de détection de 0,16 µg/m3) dans l’étude dans le cadre de l’ECMS, avec une concentration moyenne géométrique de 0,10 µg/m3 et une concentration au 95e rang percentile de 0,26 µg/m3 (données pondérées au niveau du ménage) (Zhu et coll., 2013). La concentration moyenne géométrique d’oxyde de mésityle dans douze échantillons prélevés dans le cadre de l’étude au champ menée au Québec était de 0,3 µg/m3, et le maximum de 4,15 µg/m3 (Won et Lusztyk, 2011).
Aucune donnée n’a été recensée sur la présence d’oxyde de mésityle dans l’eau. On a détecté qualitativement de l’oxyde de mésityle dans l’eau potable de Cincinnati en Ohio, ainsi que dans une rivière en Suisse (HSBD, 1983-). À en juger par la constante de la loi d’Henry modérée et la pression de vapeur élevée, l’oxyde de mésityle est susceptible de se volatiliser depuis l’eau (HSBD, 1983-). L’eau potable ne devrait donc pas être une source importante d’exposition de la population.
Aucune donnée n’a été recensée sur la présence d’oxyde de mésityle dans le sol au Canada ou ailleurs. D’après son faible log Kco, l’oxyde de mésityle est susceptible d’avoir une forte mobilité dans le sol et risque peu d’adhérer aux sédiments ou aux particules en suspension dans l’eau (HSDB, 1983-); le sol ne devrait donc pas être une source importante d’exposition.
Les estimations de l’exposition à l’oxyde de mésityle par les milieux environnementaux variaient entre 0,8 µg/kg‑p.c. par jour pour les adultes (de 60 ans et plus) à 2,5 µg/kg‑p.c. par jour pour les tout-petits (de six mois à quatre ans) (Santé Canada, 2018).
Aliments
L’oxyde de mésityle est naturellement présent dans divers aliments, comme la nectarine, le poivron, la tomate, le pain croustillant, le fromage parmesan, le lait, le café, le thé, les arachides, le basilic et les crevettes pour n’en nommer que quelques-uns (Nijssen et coll., 1963-2016; Burdock, 2010). Il peut également servir d’aromatisant alimentaire dans les produits de boulangerie, les produits laitiers surgelés, les gélatines et les poudings, les produits laitiers et les bonbons mous (Burdock, 2010). Les estimations quantitatives de l’exposition à l’oxyde de mésityle présent à l’état naturel dans les alimentsNote de bas de page 12 variaient entre 0,3 µg/kg‑p.c. par jour pour les bébés d’un an à 1,5 µg/kg‑p.c. par jour pour les tout-petits âgés de deux à trois ans (voir l’annexe A pour les détails).
Le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a évalué un groupe d’alcools aliphatiques secondaires, de cétones et d’esters apparentés utilisés comme substances aromatisantes, y compris l’oxyde de mésityle (OMS, 2003). Dans le cadre de cette évaluation, le Comité estimait que l’absorption d’oxyde de mésityle par une personne découlant de l’utilisation en tant qu’aromatisant alimentaire était de 0,0067 µg/kg p.c./jour pour la population européenne (aucune donnée d’ingestion rapportée pour les États-Unis) (voir l’annexe A pour les détails).
Produits offerts aux consommateurs
On n’a retrouvé d’oxyde de mésityle dans aucun produit offert aux consommateurs au Canada.
7.5.2 Évaluation des effets sur la santé des substances individuelles (oxyde de mésityle)
L’oxyde de mésityle a été étudié par l’OCDE (OECD, 1997b, mis à jour en 2010) et l’EFSA (EFSA, 2012). Ces études servent de base à la caractérisation des effets sur la santé dans la présente évaluation. Nous avons réalisé une recherche documentaire s’étendant depuis l’année précédant la publication de l’OCDE jusqu’en mai 2017. Nous n’avons recensé aucune nouvelle information sur les effets de l’exposition à l’oxyde de mésityle sur la santé.
Peu de renseignements toxicologiques sont disponibles pour l’oxyde de mésityle. L’extrapolation d’une voie à l’autre pour l’oxyde de mésityle s’appuie sur une lecture croisée à partir de l’analogue 6-méthyl-5-heptén-2-one ou MHE (NR CAS 110-93-0). Le MHE a été le seul analogue trouvé pour la référence croisée de l’oxyde de mésityle sur la base de la similitude de la structure et de la disponibilité des données (TERA, 2017). L’oxyde de mésityle et le MHE sont tous deux des cétones insaturées; l’oxyde de mésityle contient un groupe alcène et un groupe cétone sur des atomes de carbone adjacents, tandis que l’on trouve deux autres carbones dans la chaîne entre le groupe alcène et cétone du MHE. Cette différence structurale laisse à penser que l’oxyde de mésityle pourrait être plus réactif (et donc plus toxique) que le MHE en raison de la présence d’un carbonyle β-insaturé en α. Les données sur la toxicité du MHE ont servi à la lecture croisée pour l’oxyde de mésityle lorsque nécessaire.
Cancérogénicité et toxicité génétique
Aucune donnée sur la cancérogénicité n’a été recensée pour l’oxyde de mésityle. Le modèle prédictif OncoLogic® a permis de détecter une alerte structurale du groupe fonctionnel carbonyle insaturé en α-β dans la molécule d’oxyde de mésityle pour son potentiel cancérogène (TERA, 2017).
L’oxyde de mésityle ne s’est pas avéré mutagène pour la salmonelle, l’E. Coli ou dans l’essai sur les lymphomes de souris, ni n’a induit de micronoyaux dans les lymphocytes humains cultivés ou chez les souris qui ont reçu de l’oxyde de mésityle par injection intrapéritonéale (ECHA, c2007-2017e).
Toxicité à doses répétées
On a publié deux études sur la toxicité à doses répétées par inhalation de l’oxyde de mésityle et il n’y a pas de données disponibles sur la voie d’exposition orale ou cutanée.
Une étude combinée sur la toxicité à doses répétées et pour la reproduction et pour le développement a eu lieu dans des groupes de rats SD exposés à l’oxyde de mésityle à des concentrations de 0, de 31, de 103 et de 302 ppm (0, 124, 413 et 1211 mg/m3) pendant 6 h/j, 7 j/sem pour un total de 49 expositions pour les rats mâles et un total de 36 à 49 expositions pour les rats femelles. Il n’y a pas eu d’effets sur la mortalité, les paramètres hématologiques ou urinaires, ni de pathologie clinique chez les animaux parents. Toutefois, d’importantes réductions de la consommation alimentaire, du poids corporel et du gain de poids corporel ainsi que des anomalies cliniques et une pathologie des voies nasales ont été observées chez tous les groupes d’essai en fonction de la concentration. Les anomalies cliniques comprenaient une incidence accrue d’écoulement de porphyrine par le nez et de sialorrhée après l’exposition. Les observations histopathologiques comprenaient la présence d’exsudats sérocellulaires, une inflammation focale chronique et une métaplasie focale de l’épithélium respiratoire et olfactif des voies nasales. Ces changements sont considérés comme une réaction commune à une vapeur irritante (Bernard et Faber, 1992, examiné dans OCDE, 1997b). Ainsi, une CMENO par inhalation de 31 ppm (124 mg/m3) a été déterminée en fonction des effets sur la consommation alimentaire, le poids corporel, le gain de poids corporel et l’histopathologie des voies nasales (OCDE, 1997b; ECHA, c2007-2017e). Aucune CSENO par inhalation n’a été déterminée dans cette étude.
Des groupes de rats Wistar et de cobayes des deux sexes ont été exposés à l’oxyde de mésityle à des concentrations de 0, de 50, de 100, de 250 ou de 500 ppm (0, 200, 400, 1000 ou 2000 mg/m3) à raison de 8 h/j, 5 j/sem pendant six semaines. Des conjonctivites chroniques, une irritation nasale et une albuminurie légère ont été observées à 250 et à 500 ppm. Des augmentations importantes des effets pathologiques en lien avec les concentrations ont été observées dans les reins, les poumons et le foie à des doses égales ou supérieures à 100 ppm. Les changements pathologiques comprenaient les retards de croissance, la congestion du foie, la dilatation de la capsule de Bowman, l’enflure et des circonvolutions de l’épithélium tubulaire dans les reins et la congestion des poumons. On n’a observé aucun effet à 50 ppm. Les auteurs ont estimé que la CSENO était à 50 ppm (200 mg/m3) sur la base de changements pathologiques dans les poumons, le foie ou les reins (Smyth et coll., 1942; ECHA, c2007-2017e).
Toxicité pour la reproduction et le développement
L’étude citée plus haut sur la toxicité pour la reproduction et le développement de l’administration de doses répétées d’oxyde de mésityle à des groupes de rats SD pendant 49 jours dans le cas des mâles et de 36 à 49 jours dans le cas des femelles (jusqu’au 20e jour de gestation), n’a pas détecté d’effet notable sur les organes reproducteurs, le rendement de la reproduction ou la durée de la gestation, et ce, pour aucune des concentrations d’essais. Toutefois, ses auteurs ont constaté que pour des doses de 302 ppm (1211 mg/m3), une réduction du nombre de portées produites par les couples reproducteurs. Aucune malformation externe n’a été notée, mais les petits n’ont subi aucun examen histopathologique. La CSEO trouvée pour la toxicité pour la reproduction était de 103 ppm (413 mg/m3) (Bernard et Faber, 1992, examiné dans OCDE, 1997b; ECHA, c2007-2017e).
Nous n’avons pas retrouvé de renseignements sur une potentielle toxicité pour la reproduction et pour le développement occasionnés par l’exposition par voie orale ou cutanée à l’oxyde de mésityle.
Extrapolation d’une voie à l’autre et caractérisation des risques par lecture croisée
Étant donné le manque de données sur la toxicité de l’oxyde de mésityle administré par voie orale, nous avons utilisé les observations des études sur inhalation pour extrapoler d’une voie à l’autre. Dans l’étude combinée de toxicité sur la reproduction et le développement de doses répétées administrées à des rats, les effets critiques se sont manifestés principalement dans les voies nasales (c.-à-d. le point de contact) et l’OCDE (1997b) les a attribués aux propriétés irritantes de l’oxyde de mésityle. Pour dériver une DSENO par voie orale de l’oxyde de mésityle, nous avons donc jugé qu’il était plus approprié d’utiliser la CSENO de 50 ppm (200 mg/m3) de l’étude sur six semaines d’inhalation par des rats chez qui des effets systémiques dans les poumons, le foie et les reins ont été observés. La DSENO par voie orale ajustée pour la toxicité à doses répétées est de 15,0 mg/kg‑p.c./j (voir l’annexe D).
Nous avons déterminé que le MHE (NR CAS 110-93-0) était le seul analogue pouvant servir à la lecture croisée pour l’oxyde de mésityle, en raison de sa similitude structurale et de la disponibilité des données (TERA, 2017). Une DSENO de 39 mg/kg‑p.c./jour pour l’oxyde de mésityle peut être déduite de la DSENO par voie orale de 50 mg/kg‑p.c./jour du MHE (d’après les modifications dans les paramètres de chimie hématologique et clinique dans une étude de 90 jours auprès de rats (OCDE, 2003) en appliquant une correction pour tenir compte de la masse moléculaire (tableau 7‑21). La DSENO fondée sur la méthode de référence croisée pour l’oxyde de mésityle ressemble à la DSENO obtenue par extrapolation d’une voie à l’autre (c.-à-d. seulement deux fois et demie plus élevée, ce à quoi on peut s’y attendre, étant donné que la chaîne est plus longue).
Nom chimique : |
Oxyde de mésityle |
6-méthyl-5-heptén-2-one (MHE) |
|---|---|---|
Rôle |
Produit chimique cible |
Substance analogue |
NR CAS |
141-79-7 |
110-93-0 |
 MM = 98,1 log Koe = de 1,2 à 1,7 |
 MM = 126,2 log Koe : 2,06 |
|
Toxicité à doses répétées (inhalation, exposition de 49 jours) |
CMENO = 124 mg/m3 (réductions du poids corporel et du gain de poids corporel et histopathologie dans les voies nasales); aucune CSENO n’a été déterminée. |
N.D. |
Toxicité à doses répétées (inhalation, six semaines) |
CSENO = 200 mg/m3 (effets histopathologiques dans les reins, les poumons et le foie) |
N.D. |
Toxicité à doses répétées (par voie orale) |
DSENO = 15,0 mg/kg‑p.c./j (référence croisée de l’étude par inhalation de six semaines*) DSENO = 39 mg/kg p.c./j (déduite à partir du MHE en ajustant la masse moléculaire) |
DSENO = 50 mg/kg‑p.c./j (augmentations des numérations plaquettaires chez les rats femelles dans une étude de 90 jours) DSENO = 200 mg/kg p.c./j |
Toxicité pour le développement (par inhalation) |
On n’a observé aucune toxicité pour le développement jusqu’à concurrence de 1211 mg/m3 |
N.D. |
Toxicité pour le développement (par voie orale) |
On n’a observé aucune toxicité pour le développement jusqu’à concurrence de 95,2 mg/kg‑p.c./j (référence croisée de l’étude par inhalation*). DSENO = 165 mg/kg p.c./j (déduite à partir du MHE en ajustant la masse moléculaire) |
DSENO = 200 mg/kg‑p.c./j (toxicité pour le développement maternel et prénatal) DMENO = 1000 mg/kg p.c./j Aucune toxicité pour le développement jusqu’à concurrence de 1000 mg/kg‑p.c./j |
Génotoxicité |
Négatif |
Négatif |
Cancérogénicité |
N.D. |
N.D. |
Abréviations : N.D., non déterminé; MM, masse moléculaire (g/mol); log Koe, coefficient de partage octanol-eau
*Cette concentration a été convertie à la dose orale à l’aide de paramètres de Santé Canada (1994), avec un poids corporel moyen des rats de 0,35 kg et un taux d’inhalation de 0,11m3/jour, c’est-à-dire 200 mg/m3 × 0.11 m3/j × 8 h/24 h × 5 j/7 j /0,35 kg = 15,0 mg/kg‑p.c./j pour la toxicité à doses répétées; ou 413 mg/m3 × 0,11 m3/j × 6 h/24 h/0,35 kg = 32,5 mg/kg‑p.c./j pour la toxicité pour la reproduction.
7.5.3 Caractérisation des risques posés par l’oxyde de mésityle
Aucune étude sur la cancérogénicité de l’oxyde de mésityle n’a été retrouvée.
La CMENO de 124 mg/m3 pour la toxicité systémique chez les mères a servi à caractériser le risque associé à l’exposition par inhalation à l’oxyde de mésityle (OCDE, 1997b; European Chemicals Agency [ECHA], c2007-2017e). Même si on n’a retracé aucune étude de la toxicité par voie orale de l’oxyde de mésityle, l’extrapolation de la CSENO d’une voie à l’autre à partir d’une étude par inhalation de six semaines (Smyth et coll., 1942; ECHA, c2007-2017e) est jugée appropriée pour caractériser les dangers potentiels associés à l’ingestion de la substance. La DSENO par voie orale a été fixée à 15 mg/kg‑p.c./jour. Cette valeur est appuyée par déduction à partir des données sur la toxicité d’une substance analogue, le MHE.
Les aliments dans lesquels elle est naturellement présente sont la principale source d’exposition de l’ensemble de la population à l’oxyde de mésityle.
On n’a signalé la présence d’oxyde de mésityle dans aucun produit offert aux consommateurs au Canada.
La comparaison des estimations d’exposition à la MPK dans les milieux environnementaux (de 1,2 à 2,5 µg/kg p.c./jour) et de par son utilisation en tant qu’aromatisant alimentaire dans la nourriture (0,0067 µg/kg p.c./jour), avec la DSENO de 15 mg/kg p.c./jour a donné des marges d’exposition dépassant 6000, ce qui est jugé être adéquat pour compenser les incertitudes des bases de données sur les effets sur la santé de l’exposition. L’absorption alimentaire supplémentaire d’oxyde de mésityle en raison de sa présence naturelle dans les aliments n’a pas été jugée préoccupante pour la santé humaine. Qui plus est, le JEFCA (OMS, 2003) a conclu ce qui suit : « aucun problème de sécurité aux niveaux d’ingestion actuels lorsqu’il est utilisé comme agent aromatisant » d’après les estimations de l’exposition pour l’oxyde de mésityle.
7.5.4 Incertitudes de l’évaluation des risques pour la santé humaine
Le tableau suivant présente les sources clés d’incertitude. Bien que la base de données sur l’oxyde de mésityle soit limitée, à la lumière des grandes marges d’exposition, il est fort probable que le risque posé par cette substance pour la population générale du Canada soit faible.
Principale source d’incertitude |
Incidence |
|---|---|
Les données de surveillance environnementale sont limitées pour l’oxyde de mésityle. |
+ |
La base de données sur les dangers est limitée pour l’oxyde de mésityle (en particulier en ce qui concerne les données à long terme). |
- |
+ : incertitude ayant le potentiel de causer une surestimation de l’exposition ou du risque
- : incertitude ayant le potentiel de causer une sous-estimation de l’exposition ou du risque
+/- : potentiel inconnu de causer soit une surestimation soit une sous-estimation du risque
8. Conclusion
Compte tenu de tous les éléments de preuve présentés dans la présente ébauche d’évaluation préalable, la MEK, la MPK, la MIBK, la MIAK, l’alcool de diacétone, le diacétyle, la 2,3‑PD, l’acétoïne, la 2,4‑PD et l’oxyde de mésityle présentent un faible risque d’effets nocifs sur l’environnement. Il est proposé de conclure que ces dix substances ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE puisqu’ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur l’environnement ou sa diversité biologique ou qui constituent ou peuvent constituer un danger pour l’environnement dont la vie dépend.
À la lumière des renseignements présentés dans la présente version provisoire d’évaluation préalable, il est proposé de conclure que la MEK, la MIBK et la 2,4‑PD satisfont au critère du paragraphe 64c) de la LCPE, car ils pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions qui constituent ou peuvent constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la MPK, la MIAK, l’alcool de diacétone, le diacétyle, la 2,3‑PD, l’acétoïne et l’oxyde de mésityle ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est proposé de conclure que la MEK, la MIBK et la 2,4‑PD satisfont à un ou à plusieurs des critères énoncés à l’article 64 de la LCPE, mais que la MPK, la MIAK, l’alcool de diacétone, le diacétyle, la 2,3‑PD, l’acétoïne et l’oxyde de mésityle ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est proposé de conclure que la MEK et la 2,4‑PD répondent aux critères de persistance, mais pas à ceux de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Il est par ailleurs proposé de conclure que la MIBK ne satisfait pas aux critères de persistance et de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation pris en vertu de la LCPE.
Références
[AcToR de l’EPA des É.‑U.]. Aggregated Computational Toxicology Resource System de l’Environmental Protection Agency des États-Unis. 2015. 2-Pentanone. CAS RN. 107-87-9. [consulté le 1er février 2017]. (disponible en anglais seulement)
Aeschbacher, H.U., Wolleb, U., Löliger, J., Spadone, J.C., Liardon, R. 1989. Contribution of coffee aroma constituents to the mutagenicity of coffee. Food Chem. Toxicol. 27:227-232.
Alderson, M., Rattan, N. 1980. Mortality of workers on the isopropyl plant and two MEK dewaxing plants. Br. J. Ind. Med. 37:85-9.
[ATSDR] Agency for Toxic Substances and Disease Registry. 1992. Toxicological profile for 2-butatnone (PDF, 2.28 Mo). Atlanta (GA) : U.S. Department of Health and Human Services, Public Health Service. [consulté en novembre 2016]. (disponible en anglais seulement)
Ballantyne, B. 2001. Systemic toxicity from repeated cutaneous contact with 2,4-pentanedione. Vet. Hum. Toxicol. 43:14-18.
Ballantyne, B., Cawley, T.J. 2001. Toxicology update: 2,4-Pentanedione. J. Appl. Toxicol. 21(2):165-171.
Base de données sur le commerce international canadien de marchandises [base de données]. 2017. 291412 Butanone (méthyléthylcétone), 2011-2016. Ottawa (Ont.) : Statistique Canada. [consulté en mai 2017].
Bawazir, A.E. 2016. Evaluation of neurotoxicity and testicular toxicity of artificial Butter flavorings. Int. J. Pharm. Res. Allied Sci. 5(1):248-258.
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. Ottawa (Ont.) : Santé Canada. [modifié le 7 mai 2018; consulté le 23 octobre 2017].
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [modifié le 17 juillet 2015]. Ottawa (Ont.) : Santé Canada. [consulté le 13 octobre 2017].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [modifié le 6 février 2018]. Ottawa (Ont.) : Santé Canada. [consulté le 23 octobre 2017].
Benfenati, E., Di Toro, N., Fanelli, R., Lualdi, G., Tridico, R., Stella, G., Buscaini, P., Stimilli, L. 1992. Characterization of organic and inorganic pollutants in the Adige river (Italy). Chemosphere 25(11):1665-1674.
Bernier, A.M. 2000. Qualité de l’eau potable produite par la Ville de Montréal. Rapport annuel 2000.
Bianchi, A.P., Varney, M.S. 1998. Volatile organic compounds in the surface waters of a British estuary. Part 1: Occurrence, distribution and variation. Water Res. 32(2):352-370.
Bjeldanes, L.F., Chew, H. 1979. Mutagenicity of 1,2-dicarbonyl compounds: Maltol, kojic acid, diacetyl and related substances. Mutat. Res. 67:367-371.
Borghoff, S.J., Poet, T.S., Green, S., Davis, J., Hughes, B., Mensing, T., Sarang, S.S., Lynch, A.M., Hard, G.C. 2015. Methyl isobutyl ketone exposure-related increases in specific measures of a2u-globulin (a2u) nephropathy in male rats along with in vitro evidence of reversible protein binding. Toxicology 333:1-13.
Borkowski, L. 2007. Another microwave popcorn problem. The Pump Handle: A water cooler for the public health crowd. [consulté en septembre 2017]. (disponible en anglais seulement)
Burdock, G.A. 2010. Fenaroli’s handbook of flavor ingredients. 6e éd. Orlando (FL) : Burdock Group.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3.
Canter, L.W., Sabatini, D.A. 1994. Contamination of public ground water supplies by superfund sites. Int. J. Environ. Stud. 46:35-57.
Cardoso, D.R., Bettin, S.M., Reche, R.V., Lima-Neto, B.S., Franco, D.W. 2003. HPLC-DAD analysis of ketones as their 2,4-dinitrophenylhydrazones in Brazilian sugar-cane spirits and rum. J. Food Compos. Anal. 16:563-573.
Cavender, F.L., Casey, H.W., Salem, H., Swenberg, J.A., Gralla, E.J. 1983. A 90-day vapor inhalation toxicity study of methyl ethyl ketone. Fundam. Appl. Toxicol. 3(4):264-70.
[CCRIS] Chemical Carcinogenesis Research Information System [base de données]. 2012. Bethesda (MD) : U.S. National Library of Medicine. [mis à jour le 23 septembre 2010; consulté en octobre 2017]. (disponible en anglais seulement)
[CDC] Centers for Disease Control and Prevention (États-Unis). 2016. Criteria for a recommended standard: occupational exposure to diacetyl and 2,3-pentanedione. Cincinnati (OH) : U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2016-111. [consulté le 13 octobre 2017]. (disponible en anglais seulement)
[CIRC] Centre international de recherche sur le cancer. 2013. 4-methyl-2-pentanone. Some chemicals present in industrial and consumer products, food and drinking-water (PDF, 412 Ko). Lyon, France. IARC Monogr. Eval. Carcinog. Risks Hum. 101. (disponible en anglais seulement)
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. [cité le 19 octobre 2016]. (disponible en anglais seulement)
ChemIDplus [base de données]. 1993- . Bethesda (MD) : U.S. National Library of Medicine. [mis à jour le 26 novembre 2012; consulté en mars 2017]. (disponible en anglais seulement)
Cichocki, J.A., Morris, J.B. 2017. Inhalation dosimetry modeling provides insights into regional respiratory tract toxicity of inhaled diacetyl. Toxicology 388:30-39.
Colley, J., Gaunt, I.F., Lansdown, A.B., Grasso, P., Gangolli, S.D. 1969. Acute and short-term toxicity of diacetyl in rats. Food Cosmet. Toxicol. 7(6):571-580.
Commission canadienne du lait. 2017. L’industrie, Consommation. [modifié le 12 juillet 2017; consulté le 8 décembre 2017].
Commission européenne. 2014. Recommendation from the Scientific Committee on Occupational Exposure Limits for Diacetyl. SCOEL/SUM/149. Bruxelles (Belgique) : Employment, Social Affairs and Inclusion, Commission européenne. (disponible en anglais seulement)
Commission européenne. 2017. Cosmetic Ingredients and Substances (CosIng) Simple Search [base de données sur Internet]. [mis à jour le 20 octobre 2017; consulté en septembre 2017]. (disponible en anglais seulement)
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL) : Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment. (disponible en anglais seulement)
David, R.M., Bernard, L.G., Banton, M.I., Tyler, T.R., Topping, D.C., Gill, M.W., O’Donoghue, J.L. 1999. The effect of repeated methyl iso butyl ketone vapor exposure on schedule controlled operant behavior in rats. Neurotoxicology 20(4):583-594.
De Leonardis, A., Lopez, F., Nag, A., Macciola, V. 2013. Occurrence and persistence of diacetyl in unfermented and fermented milks. Eur. Food Res. Technol. 236:691-697.
Deacon, M.M., Pilny, M.D., John, J.A., Schwetz, B.A., Murray, F.J., Yakel, H.O., Kuna, R.A. 1981. Embryo and fetotoxicity of inhaled methyl ethyl ketone in rats. Toxicol. Appl. Pharmacol. 59:620-622.
Delzer, G.C., Ivahnenko, T. 2003. Occurrence and temporal variability of methyl tert-butyl ether (MTBE) and other volatile organic compounds in select sources of drinking water: Results of the focused survey. Water-Resources Investigations Report 02-4084 (PDF, 3.93 MB). Rapid City (ND) : U.S. Geological Survey. (disponible en anglais seulement)
Dietz, F.K., Rodriguez-Giaxola, M., Traiger, G.J., Stella, V.J., Himmelstein, K.J. 1981. Pharmacokinetics of 2-butanol and its metabolites in the rat. J. Pharmacokinet Biopharm. 9(5):553-576.
DiVincenzo, G.D., Kaplan, C.J., Dedinas, J. 1976. Characterization of the metabolites of methyl n-butyl ketone, methyl iso butyl ketone and methyl ethyl ketone in guinea pig serum and their clearance. Toxicol. Appl. Pharmacol. 36:511-522.
Dodd, D.E., Garman, R.H., Pritts, I.M., Troup, C.M., Snellings, W.M., Ballantyne, B. 1986. 2,4-Pentanedione: 9-Day and 14-Week Vapor Inhalation Studies in Fischer-344 Rats. Fundam. Appl. Toxicol. 7:329-339.
Doepker, C.L., Maier, A., Willis, A., Hermansky, S.J. 2012. Toxicology of Flavors in the Food Industry. Chapter Eighty. In E. Bingham et B. Cohhrssen, éd., Patty’s Toxicology, 6e éd., vol. 5. New York (NY) : Wiley. p. 133-168.
Dorado, L., Montoya, M.R., Rodriguez Mellado, J.M. 1992. A contribution to the study of the structure mutagenicity relationship for alpha dicarbonyl compounds using the Ames test. Mutat. Res. 269(2):301-306.
Duguay, A.B., Plaa, G.L. 1995. Tissue concentrations of methyl isobutyl ketone, methyl n-butyl ketone and their metabolites after oral or inhalation exposure. Toxicol. Lett. 75:51-58.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques. Gatineau (Qc) : ECCC.
[ECCC] Environnement et Changement climatique Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (Qc) : Accès : substances@ec.gc.ca
[ECCC] Environnement et Changement climatique Canada. 2017. RNSPA : données annuelles brutes pour 2006 à 2010 [Internet]. Gatineau (Qc) : Environnement Canada, Centre de technologie environnementale. [consulté en février 2017].
[ECCC et SC] Environnement et Changement climatique Canada, Santé Canada. 2015. Identification des priorités d’évaluation des risques : résultats de l’examen de 2015. Ottawa (Ont.) : ECCC et SC. [consulté le 13 octobre 2017].
[ECCC et SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 20 avril 2007]. Catégorisation de substances chimiques. Ottawa (Ont.) : gouvernement du Canada. [consulté le 13 octobre 2017].
[ECHA] Agence européenne des produits chimiques. c2007-2017a. Registered Substances [base de données]; résultats de recherche du NR CAS 123-42-2. Helsinki (Finlande) : ECHA. [mis à jour le 21 septembre 2017; consulté le 23 octobre 2017]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. c2007-2017b. Registered Substances [base de données]; résultats de recherche du NR CAS 110-12-3. Helsinki (Finlande) : ECHA. [mis à jour le 28 juin 2017; consulté le 13 octobre 2017]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. c2007-2017c. Registered Substances [base de données]; résultats de recherche du NR CAS 107-87-9. Helsinki (Finlande) : ECHA. [mis à jour le 25 août 2017; consulté le 13 octobre 2017]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. c2007-2017d. Registered Substances [base de données]; dossier enregistré du pentane-2,4-dione, NR CAS 123-54-6. Helsinki (Finlande) : ECHA. [mis à jour le 2 octobre 2017; [consulté le 13 octobre 2017]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. c2007-2017e. Registered Substances [base de données]; dossier enregistré de la 4-méthylpent-3-én-2-one, CAS RN 141-79-7. Helsinki (Finlande) : ECHA. [mis à jour le 14 avril 2017; consulté le 13 octobre 2017]. (disponible en anglais seulement)
[ECHA] Agence européenne des produits chimiques. c2007-2017f. Registered Substances [base de données]; dossier enregistré de la butanone, CAS RN 78-93-3. Helsinki (Finlande) : ECHA. [mis à jour le 10 avril 2017; consulté le 23 octobre 2017].
[EFSA] Autorité européenne de sécurité des aliments. 2004. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in contact with Food (AFC) on a request from the Commission related to Flavouring Group Evaluation 11 (FGE.11): Aliphatic dialcohols, diketones, and hydroxyketones from chemical group 10 (Commission Regulation (EC) No 1565/2000 of 18 July 2000) (PDF, 665 Ko). Parma (Italie) : EFSA. EFSA J. 166:1-44. (disponible en anglais seulement)
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific Opinion on Flavouring Group Evaluation 204 (FGE.204): Consideration of genotoxicity data on representatives for 18 mono-unsaturated, aliphatic, α,β-unsaturated ketones and precursors from chemical subgroup 1.2.1 of FGE.19 by EFSA (PDF, 214 Ko). Parma (Italie) : EFSA. EFSA J. 10(12):2992. (disponible en anglais seulement)
[EFSA] Autorité européenne de sécurité des aliments. 2015. Scientific Opinion on the risks to public health related to the presence of bisphenol A (BPA) in foodstuffs: Executive summary. EFSA J. 13(1):3978.
[EFSA] Autorité européenne de sécurité des aliments. 2016. Safety and efficacy of secondary aliphatic saturated or unsaturated alcohols, ketones, ketals and esters with a second secondary or tertiary oxygenated functional group belonging to chemical group 10 when used as flavourings for all animal species. EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP), Rychen et coll., 2016. Parma (Italie) : EFSA. EFSA J. 14(11):4618-4619. (disponible en anglais seulement)
Environnement Canada, Santé Canada. 2002. Canadian Environmental Protection Act: Priority Substances List Health Assessment Supporting Documentation report: 2-butoxyethanol. Ottawa (Ont.) : gouvernement du Canada. [consulté en septembre 2017]. Inédit.
Environnement Canada, Santé Canada. 2014. Approche d’identification des substances chimiques et des polymères jugés prioritaires pour l’évaluation des risques en vertu de la Partie 5 de la Loi canadienne sur la protection de l’environnement de 1999 [LCPE (1999)]. Ottawa (Ont.) : Environnement Canada, Santé Canada.
Environnement Canada. 2001. Données pour certaines substances recueillies en vertu de la Loi canadienne sur la protection de l’environnement (1999), article 71 : Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada, Programme des substances existantes.
Environnement Canada. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure. (PDF, 1.98 MB) Gazette du Canada, Partie I, vol. 146, no 48, Supplément.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement de 1999 : Avis modifiant l’Avis concernant certaines substances de la Liste intérieure. Données préparées par Environnement Canada, Santé Canada, Programme des substances existantes.
[EPA des États-Unis] Environmental Protection Agency des États-Unis. 2001a. High Production Volume Information System. Washington (DC) : EPA des États-Unis, Office of Pollution Prevention and toxics. 2-Pentanone. Submission ID 24977107. [consulté le 23 octobre 2017]. (disponible en anglais seulement)
[EPA des États-Unis] Environmental Protection Agency des États-Unis. 2001b. High Production Volume Information System. Washington (DC) : EPA des États-Unis, Office of Pollution Prevention and toxics. 2-Hexanonem 5-methyl-. Submission ID 24977542. [consulté le 23 octobre 2017]. (disponible en anglais seulement)
[EPA des États-Unis] Environmental Protection Agency des États-Unis. 1988. Kin-Buc landfill. EPA/ROD/R02-88/068.
[EPA des États-Unis] Environmental Protection Agency des États-Unis. 2005. PARAMS model. (disponible en anglais seulement)
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’évaluation]. c2000-2012. Version 4.11. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (disponible en anglais seulement)
Fasano, W.J., McDougal, J.N. 2008. In vitro dermal absorption rate testing of certain chemicals of interest to the Occupational Safety and Health Administration: summary and evaluation of US EPA’s mandated testing. Regul. Toxicol. Pharmacol. 51(2):181-194.
Ficheux, A., Morisset, T., Chevillotte, G., Postic, C., Roudot, A. 2014. Probabilistic assessment of exposure to nail cosmetics in French consumers. Food. Chem. Toxicol. 66:36.
Frantz, S.W., Ballantyne, B., Leung, H.W. 1998. Acute Intravenous and Inhalation Pharmacokinetics of 2,4-Pentanedione in the Fischer 344 Rat. Toxicol. Ind. Health 14(3):413-428.
[FS] Fiche signalétique. 2008a. La Bomba Gotas de Brillo [PDF, 88.5 Ko]. San Juan (Porto Rico) : Puerto Rico Merchandising. [consulté le 20 septembre 2017]. (disponible en anglais seulement)
[FS] Fiche signalétique. 2008b. Permanent markers. La Mirada (CA) : Kittrich Corporation. [consulté en juillet 2016]. (disponible en anglais seulement)
[FS] Fiche signalétique. 2012a. Sharpie Fine Point Marker, Shapie Ultra Fine Point Marker, etc. Oak Brook (IL) : Newell Rubbermaid. [consulté en juillet 2016].
[FS] Fiche signalétique. 2012b. R-Cure 800 PCS Sour Cherry Urethane. Cornwall (Ont.) : Valspar, Inc. [consulté en juillet 2016].
[FS] Fiche signalétique. 2014. Berol, Expo Low Odor, Expo Click, etc. Oak Brook (IL) : Newell Rubbermaid. [consulté en juillet 2016].
[FS] Fiche signalétique. 2015a. Febreze Set & Refresh – Cozy Vanilla Sugar. Cincinnati (OH) : Procter & Gamble, Fabric and Home Care Division. [consulté en juillet 2016].
[FS] Fiche signalétique. 2015b. Febreze Noticeables Air Freshener – Autumn Charm. Cincinnati (OH) : Procter & Gamble, Fabric and Home Care Division. [consulté en juillet 2016].
[FS] Fiche signalétique. 2016a. Vanilla Custard Flavor. Scotts Valley (CA) : Perfumer’s Apprentice. [consulté en juillet 2016].
[FS] Fiche signalétique. 2016b. Hardtop AX Comp A. Belle Chasse (LA) : Jotun Paints, Inc. [consulté en juillet 2016].
[FS] Fiche signalétique. 2017. Diluant Expoxy. Montréal (Qué.), Swing Paints Ltd. [consulté en nov. 2017].
Furihata, C., Matsushima, T. 1987. Use of in vivo/in vitro unscheduled DNA synthesis for identification of organ specific carcinogens. Crit. Rev. Toxicol. 17:245-277.
Furihata, C., Yoshida, S., Matsushima, T. 1985. Potential initiating and promoting activities of diacetyl and glyoxal in rat stomach mucosa. Jpn J. Cancer Res. 76(9):809-814.
Gabriel, M.A., Ilbawi, M., Al-Khalidi, U.A.S. 1972. The oxidation of acetoin to CO2 in intact animals and in liver mince preparation. Comp. Biochem. Physiol. B 41(3):493-502.Gaffney, S.H., Abelmann, A., Pierce, J.S., Glynn, M.E., Henshaw, J.L., McCarthy, L.A., Lotter, J.T., Liong, M., Finley, B.L. 2015. Naturally occurring diacetyl and 2,3-pentanedione concentrations associated with roasting and grinding unflavored coffee beans in a commercial setting. Toxicol. Rep. 2:1171-1181.
Gaunt, I.F., Brantom, P.G., Kiss, I.S., Grasso, P., Gangolli, S.D. 1972. Short-term toxicity of acetoin (acetyl methyl carbinol) in rats. Food Cosmet. Toxicol. 10:131-141.
Glensvig, D., Ports, J. 2006. Mapping of perfume in toys and children’s articles (PDF, 861 Ko). [consulté en mai 2017]. Danemark : Danish Ministry of Environment. (disponible en anglais seulement)
Gloede, E., Cichocki, J.A., Baldino, J.B., Morris, J.B. 2011. A Validated Hybrid Computational Fluid Dynamics Physiologically Based Pharmacokinetic Model for Respiratory Tract Vapor Absorption in the Human and Rat and Its Application to Inhalation Dosimetry of Diacetyl. Toxicol. Sci. 123(1):231-246.
Golder Associates. 1987. Testing of specific organic compounds in soils in background in urban areas. Draft working paper to Shell Canada Limited and Texaco Canada Limited.
Goravanahally, M.P., Hubbs, A.F., Fedan, J.S., Kashon, M.L., Battelli, L.A., Mercer, R.R., Goldsmith, W.T., Jackson, M.C., Cumpston, A., Frazer, D.G., Dey, R.D. 2014. Diacetyl Increases Sensory Innervation and Substance P Production in Rat Trachea. Toxicol. Pathol. 42:582-590.
Grady, S.J. 2003. A national survey of methyl tert-butyl ether and other volatile organic compounds in drinking-water sources: Results of the random survey. Water-Resources Investigations Report 02-4079. (PDF, 8.99 MB) East Hartford (CT) : U.S. Geological Survey. (disponible en anglais seulement)
Grady, S.J., Casey, G.D. 2001. Occurrence and distribution of methyl tert-butyl ether and other volatile organic compounds in drinking water in the northeast and mid-Atlantic regions of the United States, 1993-98. Water-Resources Investigations Report 00-4228. (PDF, 2.5 Mo) East Hartford (CT) : U.S. Geological Survey. (disponible en anglais seulement)
Hall Jr, L.W., Hall, W.S., Bushong, S.J., Herman, R.L. 1987. In situ striped bass (Morone saxatilis) contaminant and water quality studies in the Potomac River. Aquat. Toxicol. 10:73-99.
Hansen, J., Hansen, O.C., Pommer, K. 2004. Mapping of chemical substances in consumer products. Release of chemical substances from tents and tunnels for children (PDF, 360 Ko). [consulté en mai 2017]. Danemark : Danish Ministry of Environment. (disponible en anglais seulement)
Hansen, P.L., Tønning, K., Malmgren-Hansen, B., Jacobsen, E. 2008. Survey and health assessment of chemical substances in hobby products for children (PDF, 372 Ko). Survey of Chemical Substances in Consumer Products, No. 93. Danemark : Danish Ministry of the Environment. (disponible en anglais seulement)
Hjelm, E.W., Boman, A., Fernstrom, P., Hagberg, M., Johanson, G. 1991. Percutaneous uptake and kinetics of methyl isobutyl ketone (MIBK) in the guinea pig. Toxicol. Lett. 56:79-86.
Hjelm, E.W., Hagberg, M., Iregren, A., Lof, A. 1990. Exposure to methyl isobutyl ketone: Toxicokinetics and occurrence of irritative and CNS symptoms in man. Int. Arch. Occup. Environ. Health. 62:19-26.
[HPD] Household Products Database [base de données]. 1993- . Bethesda (MD) : U.S. National Library of Medicine. [consulté mars-octobre 2017]. (disponible en anglais seulement)
[HSDB] Hazardous Substances Data Bank [base de données]. 1983- . Bethesda (MD) : U.S. National Library of Medicine. [consulté le 23 octobre 2017]. (disponible en anglais seulement)
Hubbs, A.F., Battelli, L.A., Goldsmith, W.T., Porter, D.W., Frazer, D., Friend, S., Schwegler-Berry, D., Mercer, R.R., Reynolds, J.S., Grote, A., Castranova, V., Kullman, G., Fedan, J.S., Dowdy, J., Jones, W.G. 2002. Necrosis of nasal and airway epithelium in rats inhaling vapors of artificial butter flavouring. Toxicol. Appl. Pharmacol. 185(2):128-135.
Hubbs, A.F., Cumpston, A.M., Goldsmith, W.T., Battelli, L.A., Kashon, M.L., Jackson, M.C., Frazer, D.G., Fedan, J.S., Goravanahally, M.P., Castranova, V., Kreiss, K., Willard, P.A., Friend, S., Schwegler-Berry, D., Fluharty, K.L., Sriram, K. 2012. Respiratory and olfactory cytotoxicity of inhaled 2,3-pentanedione in Sprague-Dawley rats. Am. J. Pathol. 181(3):829-844.
Hubbs, A.F., Goldsmith, W.T., Kashon, M.L., Frazer, D., Mercer, R.R., Battelli, L.A., Kullman, G.J., Schwegler-Berry, D., Friend, S., Castranova, V. 2008. Respiratory toxicologic pathology of inhaled diacetyl in Sprague-Dawley rats. Toxicol. Pathol. 36:330-344.
Hughes, B.J., Thomas, J., Lynch, A.M., Borghoff, S.J., Green, S., Mensing, T., Sarang, S.S., LeBaron, M.J. 2016. Methyl isobutyl ketone induced hepatocellular carcinogenesis in B6C3F mice: A constitutive androstane receptor (CAR) mediated mode of action. Regul. Toxicol. Pharmacol. 81:421-429.
Imhof, R., Glattle, H., Bosset, J.O. 1995. Volatile organic compounds produced by thermophilic and mesophilic single strain dairy starter cultures. Lebensm.-Wiss. U. –Technol. 28:78-86.
[INRP] Inventaire national des rejets de polluants. 2011-2015a. Jeux de données de l’INRP : Méthyléthylcétone (78-93-3). Gatineau (Qc) : Environnement et Changement climatique Canada. Résultats de la recherche 78-93-3. [modifié le 29 septembre 2016; consulté le 20 février 2017].
[INRP] Inventaire national des rejets de polluants. 2011-2015b. Jeux de données de l’INRP : Méthylisobuthylcétone (108-10-1). Gatineau (Qc) : Environnement et Changement climatique Canada. Résultats de la recherche 8-10-1. [modifié le 29 septembre 2016; consulté le 20 février 2017].
Iregren, A., Tesarz, M., Wigaeus-Hjelm, E. 1993. Human experimental MIBK exposure: effects on heart rats, performance, and symptoms. Environ. Res. 63:101-108.
[IRIS] Integrated Risk Information System. 2003a. Toxicological review of methyl ethyl ketone in support of summary information on the Integrated Risk Information System (IRIS) (PDF, 1.07 Mo). Washington (DC) : National Center for Environmental Assessment. EPA 635/R-03/009. [consulté le 4 janvier 2017]. (disponible en anglais seulement)
[IRIS] Integrated Risk Information System. 2003b. Toxicological review of Methyl Isobutyl Ketone CAS NO. 108-10-1 in support of summary information on the Integrated Risk Information System (IRIS) (PDF, 586 Ko). Washington(DC) : National Center for Environmental Assessment. EPA EPA/635/R-03/002. [consulté le 18 août 2016]. (disponible en anglais seulement)
[JBRC] Japan Bioassay Research Center. 2010a. Summary of inhalation carcinogenicity study of 2,4-pentanedione in F344 rats (PDF, 1.24 MB). Japan Industrial Safety and Health Association. [consulté le 15 juin 2017]. (disponible en anglais seulement)
[JBRC] Japan Bioassay Research Center. 2010b. Summary of inhalation carcinogenicity study of 2,4-Pentanedione in B6D2F1 mice (PDF, 1.2 MB). Japan Industrial Safety and Health Association. [consulté le 15 juin 2017]. (disponible en anglais seulement)
Juberg, D., Alfano, K., Coughlin, R.J., Thomson, K.M. 2001. An observational study of object mouthing behavior by young children. Pediatrics 107:135-142.
Kato, F., Araki, A., Nozaki, K., Matsushima, T. 1989. Mutagenicity of aldehydes and diketones. Mutat. Res. 216:366-367.
Katz, G.V., Renner Jr, E.R., Terhaar, C.J. 1986. Subchronic Inhalation Toxicity of Methyl isoamyl Ketone in Rats. Fundam. Appl. Toxicol. 6:498-505.
Kim, S.B., Hayase, F., Kato, H. 1987. Desmutagenic effect of alpha-dicarbonyl and alpha-hydroxycarbonyl compounds against mutagenic heterocyclic amines. Mutat. Res. 177:9-15.
Krasavage, W.J., O’donoghue, J.L., Divincenzo, G.D. 1982. Methyl isobutyl ketone. In G.D. Clayton et F.E. Clayton, éd., Patty’s industrial hygiene and toxicology, vol. 2. New York : John Wiley and Sons. p. 4747-4751.
Kreiss, K., Gomaa, A., Kullman, G., Fedan, K., Simoes, E.J., Enright, P.L. 2002. Clinical bronchiolitis obliterans in workers at a microwave popcorn plant. New Eng. J. Med. 347(5):330-338.
LaBelle, C.W., Brieger, H. 1955. The vapor toxicity of a composite solvent and its principal components. Am. Med. Assoc. Arch. Ind. Health 12:623-627.
Larsen, S.T., Alarie, Y., Hammer, M., Nielsen, G.D. 2009. Acute airway effects of diacetyl in mice. Inhalation Toxicol. 21:1123-1128.
Lason, A.M., Speers, R.A., Zhu, J. 1995. Chemical and sensory detection of diacetyl in strawberry juice (short communication). Die Nahrung 39(4):323-327.
Liira, J., Riihimaki, V., Pfaffli, P. 1988. Kinetics of methyl ethyl ketone in man: absorption, distribution and elimination in inhalation exposure. Int. Arch. Occup. Environ. Health 60(3):195-200.
Lowengart, R.A., Peters, J.M., Cicioni, C., Buckley, J., Bernstein, L., Preston-Martin, S., Rappaport, E. 1987. Childhood leukemia and parents’ occupational and home exposures. J. Natl. Cancer Inst. 79(1):39-46.
Macciola, V., Candela, G., De Leonardis, A. 2008. Rapid gas-chromatographic method for the detemination of diacetyl in milk, fermented milk and butter. Food Contol. 19:873-878.
MacEwen, J.D., Vernot, E.H., Haun, C.C. 1971. Effect of 90-day continuous exposure to methyl isobutyl ketone on dogs, monkeys and rats. Aerospace Medical Research Laboratory Document No. AMRL-TR-71-65. NTIS No. AD Rep. 730291.
[MAI] Microbiological Associates, Inc. 1984a. Salmonella/mammalian-microsome preincubation mutagenicity assay (Ames test). Sponsored by Chemical Manufacturers Association. Submitted to EPA under TSCA section FYI. EPA Document No. FYI-OTS-1084-0355. Fiche No. OTS0000355-0.
[MAI] Microbiological Associates, Inc. 1984c. L5178Y TK+/- mouse lymphoma mutagenesis assay. Sponsored by Chemical Manufacturers Association. Submitted to EPA under TSCA section FYI. EPA Document No. FYI-OTS-1084-0355. Fiche No. OTS0000355-0.
[MAI] Microbiological Associates, Inc. 1984d. Unscheduled DNA synthesis in rat primary hepatocytes. Sponsored by Chemical Manufacturers Association. Submitted to EPA under TSCA section FYI. EPA Document No. FYI-OTS-1084-0355. Fiche No. OTS0000355-0.
[MAI] Microbiological Associates, Inc. 1984f. Activity of methyl isobutyl ketone (T1827) in the morphological transformation assay using BALB/3T3 mouse embryo cells. Sponsored by Chemical Manufacturers Association. Submitted to EPA under TSCA section FYI. EPA Document No. FYI-OTS-1084- 0355. Fiche No. OTS0000355-0.
[MAI] Microbiological Associates, Inc. 1986. Subchronic toxicity of methyl isobutyl ketone in Sprague Dawley rats. Final Report. Study No. 5221.04. Performed by Microbiological Associates, Inc. for Research Triangle Institute. Rapport inédit daté du 15 juillet 1986.
Malysheva, M.V. 1988. The effect of the methods of cutaneous administration of methyl isobutyl ketone on its toxicity. Gig. Sanit. 10:79-80.
Marnett, L.J., Hurd, H.K., Hollstein, M.C., Levin, D.E., Esterbauer, H., Ames, B.N. 1985. Naturally occurring carbonyl compounds are mutagens in Salmonella tester strain TA104. Mutat. Res. 148:24-34.
McCoy, M.J., Hoppe Parr, K.A., Anderson, K.E., Cornish, J., Haapala, M., Greivell, J. 2017. Diacetyl and 2,3-pentanedione in breathing zone and area air during large-scale commercial coffee roasting, blending and grinding processes. Toxicol. Rep. 4:113-122.
McCready, D., Fontaine, D. 2010. Refining ConsExpo evaporation and human exposure calculations for REACH. Hum. Ecol. Risk Assess.: An Int. J. 16(4):783-800.
[MHW] Ministry of Health and Welfare (Japon). 1997. Toxicity Testing Reports of Environmental Chemicals. Vol. 5, p. 475-498.
More, S.S., Raza, A., Vince, R. 2012. The butter flavorant, diacetyl, forms a covalent adduct with 2-deoxyguanosine, uncoils DNA, and leads to cell death. J. Agric. Food Chem. 60(12):3311-3317.
Morgan, D.L., Flake, G.P., Kirby, P.J., Palmer, S.M. 2008. Respiratory toxicity of diacetyl in C57BL/6 mice. Toxicol. Sci. 103(1):169-180.
Morgan, D.L., Jokinen, M.P., Price, H.C., Gwinn, W.M., Palmer, S.M., Flake, G.P. 2012. Bronchial and bronchiolar fibrosis in rats exposed to 2, 3-pentanedione vapors: implications for bronchiolitis obliterans in humans. Toxicol. Pathol. 40(3):448-465.
Morris, J.B., Hubbs, A.F. 2009. Inhalation dosimetry of diacetyl and butyric acid, two components of butter flavoring vapors. Toxicol. Sci. 108:173-183.
Munies, R., Wurster, D.E. 1965. Investigation of some factors influencing percutaneous absorption-III. Absorption of methyl ethyl ketone. J. Pharm. Sci. 54:1281-1284.
Mutch Jr, R.D., Daigler, J., Clarke, J.H. 1983. Clean-up of Shope’s landfill, Girard, PA. In National Conference on Management of Uncontrolled Hazardous Waste Sites. Washington, DC. p. 296-300.
Nelson, K.W., Ege, J.F., Ross, M., Woodman, L.E., Silverman, L. 1943. Sensory Response to Certain Industrial Solvent Vapor. J. Ind. Hyg. Toxicol. 25:282-285.
Nemec, M., Pitt, J., Topping, D., Gingell, R., Pavkov, K., Rauckman, E., Harris, S. 2004. Inhalation two-generation reproductive toxicity study of methyl isobutyl ketone in rats. Int. J. Toxicol. 23:127-143.
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2017. 2-Pentanone, 4-methyl-. Sydney (Australie) : Department of Health, National Industrial Chemicals Notification and Assessment Scheme. 2-Pentanone, 4-methyl-: Human health tier III assessment, CAS No. 108-10-1. [consulté le 13 octobre 2017]. (disponible en anglais seulement)
Nijssen, L.M., Ingen-Visscher, C.A. van, Donders, J.J.H., éd. 1963-2016. VCF Volatile Compounds in Food online database. Version 16.3. Zeist (Pays-Bas) : Triskelion B.V. [mis à jour en novembre 2016; consulté en avril 2017]. (disponible en anglais seulement)
Nilsson, N.H., Malmgren-Hansen, B., Bernth, N., Pedersen, E., Pommer, K. 2006. Survey of chemical substances in consumer products: Survey and health assessment of chemicals substances in sex toys. Report No. 77. [consulté en mai 2017] (PDF, 892 Ko). Danemark : Danish Ministry of Environment. (disponible en anglais seulement)
[NIOSH] National Institute for Occupational Safety and Health. 2006. Health Hazard Evaluation Report, HETA 2000-0401-2991, Gilster-Mary Lee Corporation, Jasper, MO. Cincinnati (OH) : U.S. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health.
[NTP] National Toxicology Program (États-Unis). 2007a. Chemical information review document for artificial butter flavoring and constituents. Diacetyl (CAS No. 431-03-8) and acetoin (CAS No. 513-86-0). Supporting nomination for toxicological evaluation by the National Toxicology Program, January 2007. Préparé par Integrated Laboratory Systems, Inc. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Contract No.: N01-ES-35515.
[NTP] National Toxicology Program (États-Unis). 2007b. NTP toxicology and carcinogenesis studies of Methyl Isobutyl Ketone (CAS No. 108-10-1) in F344/N rats and B6C3F1 mice (inhalation studies). Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Report No. 538. p. 1-236.
[NTP] National Toxicology Program. 2017a. Draft toxicology and carcinogenesis studies of 2,3-butanedione (CAS No. 431-03-8) in wistar han [Crl:WI (Han)] rats and B6C3F1/N mice (inhalation studies) (PDF, 21.9 MB). Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. Report No.: NTP TR 593. Résultats seulement. (disponible en anglais seulement)
[NTP] National Toxicology Program. 2017b. Tox-99: Acetoin and 2,3-pentanedione, Toxicity Report Tables & Curves. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. [consulté le 13 octobre 2017]. Résultats seulement. (disponible en anglais seulement)
Nylén, D., Borling, P., Sørensen, H. 2004. Survey of chemical substances in consumer products: Mapping of chemical substances in animal care products. Report No. 44 (PDF, 976 KO). [consulté en mai 2017]. Danemark : Danishm Ministry of Environment. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1996. SIDS initial assessment report: Methyl Isobutyl Ketone: CAS No. 108-10-1. SIAM [SIDS Initial Assessment Meeting] 5: 1996 October. [consulté en avril 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1997b. SIDS initial assessment report: Mesityl oxide: CAS No. 141-79-7. SIAM [SIDS Initial Assessment Meeting] 6: 1997 June. Paris, France. [mis à jour en novembre 2010; consulté le 5 mai 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2000. SIDS initial assessment report: Diacetone alcohol, CAS No. 123-42-2. SIAM [SIDS Initial Assessment Meeting] 10: 2000 March. Japon. [consulté en avril 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2001. SIDS initial assessment report: 2,4-Pentanedione (PDF, 465 KO), CAS No. 123-54-6. SIAM [SIDS Initial Assessment Meeting] 13: 2001 September. Bern, Suisse. [consulté le 13 octobre 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 2003. SIDS initial assessment report: 6-methylhept-5-en-2-one: CAS No. 110-93-0. SIAM [SIDS Initial Assessment Meeting] 17: 2003 November. Paris, France. [consulté le 17 mai 2017]. (disponible en anglais seulement)
[OCDE] Organisation de coopération et de développement économiques. 1997a. SIDS initial assessment report: Methyl ethyl ketone: CAS No. 78-93-3. SIAM [SIDS Initial Assessment Meeting] 6: 1997 June. Paris, France. [consulté le 5 mai 2017]. (disponible en anglais seulement)
O’Donoghue, J.L. 2012a. Ketones of four or five carbons. In E. Bingham et B. Cohrssen, éd., Patty’s Toxicology, 6e éd., vol. 1. John Wiley & Sons. p. 753-806.
O’Donoghue, J.L. 2012b. Ketones of six to thirteen carbons. In E. Bingham et B. Cohrssen, éd., Patty’s Toxicology, 6e éd., vol. 1. John Wiley & Sons. p. 807-914.
O’Donoghue, J.L., Haworth, S.R., Curren, R.D., Kirby, P.E., Lawlor, T., Moran, E.J., Phillips, R.D., Putnam, D.L., Rogers-Back, A.M., Slesinski, R.S., Thilagar, A. 1988. Mutagenicity studies on ketone solvents: methyl ethyl ketone, methyl isobutyl ketone, and isophorone. Mutat. Res. 206:149-161.
[OMS] Organisation mondiale de la Santé. 1999a. Safety evaluation of certain food additives: Aliphatic acyclic and alicyclic alpha-diketones and related alpha-hydroxyketones. Genève (Suisse) : Organisation mondiale de la Santé, Programme international sur la sécurité des substances chimiques. (Série Additifs alimentaires de l’OMS no 42). Préparé par la cinquante-et-unième session du Comité mixte FAO/OMS d’experts des additifs alimentaires. (disponible en anglais seulement)
[OMS] Organisation mondiale de la Santé. 1999b. Safety evaluation of certain food additives: Saturated aliphatic acyclic secondary alcohols, ketones, and related saturated and unsaturated esters. Genève (Suisse) : Organisation mondiale de la Santé, Programme international sur la sécurité des substances chimiques. (Série Additifs alimentaires de l’OMS no 42). Préparé par la cinquante-et-unième session du Comité mixte FAO/OMS d’experts des additifs alimentaires. (disponible en anglais seulement)
[OMS] Organisation mondiale de la Santé. 2003. Safety evaluation of certain food additives: Aliphatic secondary alcohols, ketones and related esters. Genève (Suisse) : Organisation mondiale de la Santé, Programme international sur la sécurité des substances chimiques. (Série Additifs alimentaires de l’OMS no 50). Préparé par la cinquante-neuvième session du comité mixte FAO/OMS d’experts des additifs alimentaires. (disponible en anglais seulement)
Parmet, A.J., von Essen, S. 2002. Rapidly progressive, fixed airway obstructive disease in popcorn workers: a new occupational pulmonary illness. J. Occup. Environ. Med. 44:216-218.
Paxeus, N. 1996. Organic pollutants in the effluents of large wastewater treatment plants in Sweden. Water Res. 30(5):1115-1122.
Pellizzari, E.D., Hartwell, T.D., Harris III, B.S.H., Waddell, R.D., Whitaker, D.A., Erickson, M.D. 1982. Purgeable organic compunds in mother’s milk. Bull. Environm. Contam. Toxicol. 28:322-328.
Perbellini, L., Brugnone, F., Mozzo, P., Cocheo, V., Caretta, D. 1984. Methyl ethyl ketone exposure in industrial workers. Uptake and kinetics. Int. Arch. Occup. Environ. Health 54:73-81.
Phillips, R.D., Moran, E.J., Dodd, D.E., Fowler, E., Kary, C.D., O’Donoghue, J. 1987. A 14-week vapor inhalation toxicity study of methyl isobutyl ketone. Fundam. Appl. Toxicol. 9:380-388.
Pierce, J.S., Abelmann, A., Lotter, J.T., Comerford, C., Keeton, K., Finley, B.L. 2015. Characterization of naturally occurring airborne diacetyl concentrations associated with the preparation and consumption of unflavoured coffee. Toxicol. Rep. 2:1200-1208.
[PISSS] Programme international sur la sécurité des substances chimiques. 1990. Environmental Health Criteria 117: Methyl isobutyl ketone. Genève (Suisse) : Programme des Nations Unies pour l’environnement, Organisation internationale du Travail, Organisation mondiale de la Santé. [consulté le 23 octobre 2017]. (disponible en anglais seulement)
[PISSS] Programme international sur la sécurité des substances chimiques. 1993. Environmental Health Criteria 143: Methyl ethyl ketone. Genève (Suisse) : Programme des Nations Unies pour l’environnement, Organisation internationale du Travail, Organisation mondiale de la Santé. [consulté le 23 octobre 2017]. Sur la couverture : First draft prepared by Dr Williams R.B., United States Environmental Protection Agency. (disponible en anglais seulement)
[PISSS] Programme international sur la sécurité des substances chimiques. 1999. Safety evaluation of aliphatic acyclic and alicyclic alpha -diketones and related alpha-hydroxy ketones. Préparé par la cinquante-et-unième session du Comité mixte FAO/OMS, Organisation mondiale de la Santé, Genève, Programme international sur la sécurité des substances chimiques. (Série Additifs alimentaires de l’OMS no 42). [consulté le 20 janvier 2017]. (disponible en anglais seulement)
[PISSS] Programme international sur la sécurité des substances chimiques. 1997. Méthylisobutylcétone. Fiches internationales de sécurité chimique, Programme international sur la sécurité des substances chimiques. Genève : OMS.
[P&G] Procter & Gamble. c2017a. Febreze® PLUG. [consulté en octobre 2017]. (disponible en anglais seulement)
[P&G] Procter & Gamble. c2017b. Febreze Set & Refresh Rain Air Freshener 5.5 ml. [consulté en octobre 2017]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2002. Children’s toys fact sheet: to assess the risks for the consumer [PDF, 303 Ko]. Bilthoven (NL): RIVM. Report No.: 612810012/2002. [consulté avril-octobre 2017]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment (NL)]. 2006. Cosmetics fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4 [PDF, 330 Ko]. Bilthoven (NL): RIVM. Report No.: 320104001/2006. [consulté avril-octobre 2017]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007a. Do-it-yourself products fact sheet: to assess the risks for the consumer [PDF, 417 Ko]. Bilthoven (NL): RIVM. Report No.: 320104007/2007. [consulté avril-octobre 2017]. (disponible en anglais seulement)
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2007b. Paint products fact sheet: to assess the risks for the consumer: updated version for ConsExpo 4 [PDF, 264 Ko]. Bilthoven (NL): RIVM. Report No.: 320104008/2007. [consulté avril-octobre 2017]. (disponible en anglais seulement)
Rosati, J.A., Krebs, K.A., Liu, X. 2007. Emissions from cooking microwave popcorn. Crit. Rev. Food Sci. Nutr. 47(8):701-709.
Sabel, G.V., Clark, T.P. 1984. Volatile organic compounds as indicators of municipal solid waste leachate contamination. Waste Manage. Res. 2:119-130.
Saillenfait, A.M., Gallissot, F., Sabate, J.P., Bourges-Abella, N., Cadot, R., Morel, G., Lambert, A.M. 2006. Developmental toxicity of combined ethylbenzene and methylethylketone administered by inhalation to rats. Food Chem. Toxicol. 44:1287-1298.
Sánchez-Peña CM, Luna G, García-González, Aparicio R. 2005. Characterization of French and Spanish dry-cured hams : influence of the volatiles from the muscles and the subcutaneous fat quantified by SPME-GC. Meat Science. 69:635-645.
Santé Canada. 1994. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : ministère des Approvisionnements et Services Canada. No de cat. En40-215/41F. [consulté le 25 mai 2017].
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu.
Santé Canada. 2010a. Étude d’évaluation de l’exposition à Windsor (2005-2006) : sommaire des données d’échantillonnage des composés organiques volatils. Ottawa (Ont.) : Santé Canada. 85 p.
Santé Canada. 2010b. Étude de la qualité de l’air intérieur à Regina (2007) : sommaire des données d’échantillonnage des composés organiques volatils. Ottawa (Ont.) : Santé Canada. 164 p.
Santé Canada. 2012. Étude de la qualité de l’air intérieur à Halifax (2009) : sommaire des données d’échantillonnage des composés organiques volatils (ébauche). Ottawa (Ont.) : Santé Canada. 37 p.
Santé Canada. 2013. Étude de la qualité de l’air intérieur à Edmonton (2010) : sommaire des données des composés organiques volatils (VOC). Ottawa (Ont.) : Santé Canada. 51 p.
Santé Canada. 2015a. Liste critique des ingrédients de cosmétiques : Liste des ingrédients dont l’usage est interdit dans les cosmétiques. Ottawa (Ont.) : Santé Canada, Direction de la sécurité des produits de consommation. [modifié le 14 décembre 2015; consulté le 23 octobre 2017].
Santé Canada. 2015b. Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004), réalisée par Statistique Canada, fichier partagé.
Santé Canada. 2015c. Keep calm and use hand sanitizer – how much and how often. Inédit. Bureau de l’évaluation des risques des substances existantes et Bureau d’évaluation et du contrôle des substances, Santé Canada. Présenté au Forum scientifique de Santé Canada de 2015.
Santé Canada. 2016. Outil de recherche FDS [base de données interne]. [mis à jour le 15 septembre 2016; consulté en juillet 2016].
Santé Canada. 2018. Supporting documentation: intake tables for Ketones Group. Ottawa (Ont.) : Santé Canada. Information in support of the screening assessment for the Ketones Grouping. Accès : substances@ec.gc.ca.
Sawhney, B.L., Kozloski, R.P. 1984. Organic pollutants in leachates from landfill sites. J. Environ. Qual. 13(3):349-352.
Schwetz, B.A., Leong, B.K.J., Gehring, P.J. 1974. Embryo and fetotoxicity of inhaled carbon tetrachloride, 1,1-dichloroethane and methyl ethyl ketone in rats. Toxicol. Appl. Pharmacol. 28:452-464.
Schwetz, B.A., Mast, T.J., Weigel, R.J., Dill, J.A., Morrissey, R.E. 1991. Developmental toxicity of inhaled methyl ethyl ketone in Swiss mice. Fundam. Appl. Toxicol. 16:742-748.
[SCOEL] Commission européenne, Scientific Committee on Occupational Exposure Limits. 2014. Recommendation from the Scientific Committee on Occupational Exposure Limits for Diacetyl. [PDF, 506.16 Ko] SCOEL/SUM/149. [consulté le 13 octobre 2017]. (En anglais seulement.)
Shane, B.S., Troxclair, A.M., McMillin, D.J., Henry, C.B. 1988. Comparative mutagenicity of nine brands of coffee to Salmonella typhimurium TA100, TA102, and TA104. Environ. Mol. Mutag. 11:195-206.
Sheldon, L.S., Hites, R.A. 1978. Organic compounds in the Delaware River. Environ. Sci. Technol. 12(10):1188-1194.
Shimoda, M., Yoshimura, T., Ishikawa, H., Hayakawa, I., Osajima, Y. 2000. Volatile compounds of human milk. J. Fac. Agr., Kyushu Univ. 45(1):199-206.
Silverman, L., Schulte, H.F., First, M.W. 1946. Further studies on sensory response to certain industrial solvent vapors. J. Ind. Hyg. Toxicol. 28:262-266.
Smyth Jr, H.F., Seaton, J., Fischer, L. 1942. Response of guinea pigs and rats to repeated Inhalation of vapors of mesityl oxide and isophorone. J. Ind. Hyg. Toxicol. 24(3):46-50.
Smyth, H.F. 1956. Hygienic standards for daily inhalation. Am. Ind. Hyg. Assoc. J. 17:129-266.
Sparks, L.E., Tichenor, B.A., Chang, J., Guo, Z. 1996. Gas-phase mass transfer model for predicting volatile organic compound (VOC) emission rates from indoor pollutant sources. Indoor Air 6:31-40.
Spirtas, R., Stewart, P.A., Lee, J.S., Marano, D.E., Forbes, C.D., Grauman, D.J., Pettigrew, H.M., Blair, A., Hoover, R.N., Cohen, J.L. 1991. Retrospective cohort mortality study of workers at an aircraft maintenance facility: I. Epidemiological results. II. Exposures and their assessment. Br. J. Ind. Med. 48(8):515-537.
Stoner, G.D., Shimkin, M.B., Kniazeff, A.J., Weisburger, J.H., Weisburger, E.K., Gori, G.B. 1973. Test for carcinogenicity of food additives and chemotherapeutic agents by the pulmonary tumor response in strain A mice. Cancer Res. 33(12):3069-3085.
Svendsen, N., Pedersen, S.F., Hansen, O.C., Pedersen, E., Bernth, N. 2005. Survey and release of chemical substances in “slimy” toys (PDF, 892 KO). [consulté en mai 2017]. Danemark : Danish Ministry of Environment. (disponible en anglais seulement)
[TDS] Technical Data Sheet. 2015. Klenk’s Epoxy Thinner. Montréal (Qc) : Wing Paints. [modifié le 11 août 2015; consulté en novembre 2017]. (disponible en anglais seulement)
TERA. 2017. Read across approach for 4-Methylpent-3-en-2-one. Toxicology Excellence for Risk Assessment (TERA) Center, Department of Environmental Health, College of Medicine, University of Cincinnati. Document interne de Santé Canada.
Tønning, K., Jacobsen, E., Pedersen, E., Pedersen, P.B. 2010. Survey of chemical substances in consumer products: Survey and health assessment of products for interior car care. Report No. 105. [consulté en mai 2017]. Danemark : Danish Ministry of Environment. (disponible en anglais seulement)
Toso, B., Procida, G., Stefanon, B. 2002. Determination of volatile compounds in cows’ milk using headspace GC-MS. J. Dairy Res. 69:569-577.
Toxigenics. 1981. 90-Day vapor inhalation toxicity study of methyl ethyl ketone in albino rats. Submitted to Chemical Industry Institute of Toxicology, Research Triangle Park, NC. Doc. ID 878212064. Microfiche No. 205953. (Study 420-0305).
Tyl, R.W., Ballantyne, B., Fisher, L.C., Tarasi, D.J., Dodd, D.E. 1989. Dominant lethal assay of 2,4-pentanedione vapour in Fischer 344 rats. Toxicol. Ind. Health 5:463-477.
Tyl, R.W., Ballantyne, B., Pritts, I.M., Garman, R.H., Fisher, L.C., France, K.A., McNeil, D.J. 1990. An evaluation of the developmental toxicity of 2, 4-pentanedione in the Fischer 344 rat by vapor exposure. Toxicol. Ind. Health 6(3-4):461-474.
Tyl, R.W., France, K.A., Fisher, L.C., Pritts, I.M., Tyler, T.R., Phillips, R.D., Moran, E.J. 1987. Developmental toxicity evaluation of inhaled methyl isobutyl ketone in Fischer 344 rats and CD-1 mice. Fundam. Appl. Toxicol. 8:310-327.
Valero, E., Villamiel, M., Miralles, B., Sanz, J., Martinez-Castro, I. 2001. Changes in flavour and volatile components during storage of whole and skimmed UHT milk. Food Chem. 72:51-58.
Van Engelen, J.G.M., Park, M.V.D.Z., Janssen, P.J.C.M., Omen, A.G., Brandon, E.F.A., Bouma, K., Sips, A.J.A.M., Van Raaij, M.T.M. 2008. Chemicals in toys. A general methodology for assessment of chemical safety of toys with a focus on elements. RIVM report 320003001/2008. (disponible en anglais seulement)
Van Rooy, F.G., Rooyackers, J.M., Prokop, M., Houba, R., Smit, L.A., Heederik, D.J. 2007. Bronchiolitis obliterans syndrome in chemical workers producing diacetyl for food flavorings. Am. J. Respir. Crit. Care Med. 176(5):498-504.
[VCCEP] Voluntary Children’s Chemical Evaluation Program. 2003. Methyl ethyl ketone (CAS No. 78-93-3). VCCEP Submission. Préparé par le American Chemistry Council’s Ketones Panel. [consulté en novembre 2016]. (disponible en anglais seulement)
Von der Hude, W., Behm, C., Gurtler, R., Basler, A. 1988. Evaluation of the SOS chromotest. Mutat. Res. 203(2):81-94.
Wen, C.P., Tsai, S.P., Weiss, N.S., Gibson, R.L., Wong, O., McClellan, W.A. 1985. Long-term mortality study of oil refinery workers. IV. Exposure to the lubricating dewaxing process. J. Natl. Cancer Inst. 74:11-18.
Wilkinson, S.C., Williams, F.M. 2001. In vitro dermal absorption of liquids. Contract Research Report 350/2001. Newcastle-upon-Tyne (Royaume-Uni) : University of Newcastle, Department of Environmental and Occupational Medicine, Skin Research Group. (disponible en anglais seulement)
Won, D. 2015. VOC Emissions from evaporative sources in residential garages. Ottawa (Ont.) : Conseil national de recherches du Canada. 235 p. Contract No.: A1-000342.
Won, D., Lusztyk, E. 2011. Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Final Report. Ottawa (Ont.) : NRC. 158 p. Report No.: B3332.2.
Won, D., Nong, G., Yang, W., Collins, P. 2014. Material emissions testing: VOCs from wood, paint, and insulation materials. Ottawa (Ont.) : Conseil national de recherches du Canada. Report No.: A1-000342.2.
Won, D., Nong, G., Yang, W., Schleibinger, H. 2013. Material Emissions Data: 52 Building Materials Tested for 124 Compounds. Ottawa (Ont.) : Conseil national de recherches du Canada. 300 p. Report No.: A1-000342.
[WSDE] Washington State Department of Ecology. 2012-2017. [base de données]. Search results for CAS RN [78-93-3]. Lacey (WA) : Department of Ecology State of Washington. [consulté le 4 juillet 2016].
Wurster, D.E., Munies, R. 1965. Factors influencing percutaneous absorption II: Absorption of methyl ethyl ketone. J. Pharm. Sci. 54(4):554-556.
Yue, J., Zheng, Y., Liu, Z., Deng, Y., Jing, Y., Luo, Y., Yu, W., Zhao, Y. 2015. Characterization of volatile compounds in microfiltered pasteurized milk using solid-phase microextraction and GCxGC-TOFMS. Int. J. Food Prop. 18:2193-2212.
Zaccone, E.J., Goldsmith, W.T., Shimko, M.J., Wells, J.R., Schwegler-Berry, D., Willard, P.A., Case, S.C., Thompson, J.A., Fedan, J.S. 2015. Diacetyl and 2,3-pentanedione exposure of human cultured airway epithelial cells: Ion transport effects and metabolism of butter flavoring agents. Toxicol. Appl. Pharmacol. 289:542-549.
Zaccone, E.J., Thompson, J.A., Ponnoth, D.S., Cumpston, A.M., Goldsmith, W.T., Jackson, M.C., Kashon, M.L., Frazer, D.G., Hubbs, A.F., Shimko, M.J., Fedan, J.S. 2013. Popcorn flavoring effects on reactivity of rat airways in vivo and in vitro. J. Toxicol. Environ. Health A 76(11):669-689.
Zakhari, S. 1977. Acute oral, intraperitoneal, and inhalation toxicity of methyl isobutyl ketone in the mouse. In L. Goldberg, éd., Isopropanol and ketones in the environment. Cleveland (OH) : CRC Press. p. 101-104. (Chapitre 11).
Zhu, J., Cao, X.L., Beauchamp, R. 2001. Determination of 2-butoxyethanol emissions from selected consumer products and its application in assessment of inhalation exposure associated with cleaning tasks. Environ. Int. 26:589-597.
Zhu, J., Newhook, R., Marro, L., Chan, C. 2005. Selected volatile organic compounds in residential air in the City of Ottawa, Canada. Environ. Sci. Technol. 39:3964-3971.
Zhu, J., Wong, S.L., Cakmak, S. 2013. Nationally representative levels of selected volatile organic compounds in Canadian residential indoor air: Population-based survey. Environ. Sci. Technol. 47:13276-13283.
Zimmermann, F.K., Mohr, A. 1992. Formaldehyde, glyoxal, urethane, methyl carbamate, 2,3-butanedione, 2,3-hexanedione, ethyl actylate, dibromoacetonitrile, 2-hydroxypropionitrile induce chromosome loss in saccharomyces cerevisiae. Mutat. Res. 270:151-166.
Annexes
Annexe A. Cétones dans les aliments
Nom de la substance |
Absorption par personne aux États-Unis (µg/j) | Absorption par personne aux États-Unis (µg/kg‑p.c./j) | Absorption par personne en Europe (µg/j) | Absorption par personne en Europe (µg/kg‑p.c./j) |
|---|---|---|---|---|
MEK |
36 |
0,6 |
110 |
2 |
MPK |
42 |
0,7 |
140 |
2 |
MIBK |
2 |
0,03 |
7 |
0,12 |
Diacétyle |
8000 |
133 |
3300 |
56 |
2,3‑PD |
1800 |
1 |
2800 |
4 |
Acétoïne |
80 |
29 |
220 |
46 |
Oxyde de mésityle |
N.D. |
N.D. |
0,40 |
0,0067 |
Abréviations : ND = non disponible
Ces estimations de l’absorption (µg/j) ont été obtenues en estimant l’absorption quotidienne maximisée calculée à partir de données d’enquête et en présumant que la production annuelle des diverses substances déclarées aux États-Unis et en Europe était consommée par seulement 10 % de la population (« consommateurs uniquement »), et que seulement 60 % de la production annuelle avait été déclarée dans les collectes de données menées sur les quantités. Nous avons postulé un poids corporel de 60 kg pour dériver les estimations de l’absorption en µg/kg‑p.c./jour (Organization of the Flavor Industry, 1995; US National Academy of Sciences, 1989, tous deux cités dans OMS, 1999b).
Nous avons dérivé les estimations quantitatives de l’exposition pour les dix substances en fonction des données sur la consommation pour les catégories d’aliments comparables du tableau de la consommation des aliments du cycle 2.2 de l’Enquête sur la santé dans les collectivités canadiennes (ESCC) (Santé Canada, 2015b). Un résumé des données recensées pour chacune des substances contenues dans les aliments dans la documentation scientifique et la base de données des composés volatils contenus dans les aliments (Nijssen et coll., 1963-2016) se trouve aux tableaux A ‑2, A‑3, A‑4 et A‑5. En l’absence de données quantitatives pour tous les aliments, nous avons utilisé les valeurs maximales prises dans la base de données des composés volatils contenus dans les aliments et la documentation scientifique pour divers aliments afin d’estimer les expositions à la borne supérieure à toutes les substances dans les aliments pour la population générale du Canada. Le tableau A‑6 présente les expositions estimées pour les dix substances en raison de leur présence naturelle dans les aliments.
Catégorie d’aliments |
MEK (µg/g) |
MEK (µg/g) |
|---|---|---|
Bières et panachés |
0,06 |
0,02 |
Spiritueux et liqueurs |
2,00 |
1,20 |
Jus de fruits |
0,20 |
0,10 |
Café (Les produits en poudre sont reconstitués.) |
N.D. |
4,70 |
Thé, dont le thé glacé |
8,00 |
N.D. |
Laits |
N.D. |
0,10b |
Crèmes |
0,07 |
0,05 |
Fromages |
67,10 |
14,71 |
Yogourts |
7,00 |
0,01 |
Bananes |
N.D. |
27,00 |
Cerises |
N.D. |
0,01 |
Poires |
1,00 |
2,40 |
Ananas |
N.D. |
0,01 |
Prunes et pruneaux |
N.D. |
2,00 |
Fraises |
N.D. |
3,10 |
Autres fruits (bleuets, dattes, kiwis, salades de fruits) |
0,02 |
3,30 |
Légumes, à l’exclusion des pommes de terre |
6,00 |
20,00 |
Pommes de terre, frites |
0,13 |
0,07 |
Poulet, dinde et autres volailles |
0,10 |
0,23 |
Porc frais et jambon |
0,72c |
N.D. |
Poisson |
0,60 |
N.D. |
Mollusques |
N.D. |
0,12 |
Œufs |
0,01 |
N.D. |
Noix, graines et beurre d’arachides |
0,10 |
7,60 |
Légumineuses |
0,05 |
N.D. |
Beurre |
0,16 |
0,95 |
Autres graisses et tartinades |
1,51 |
0,03 |
Sucres, sirops et conserves |
0,08 |
0,03 |
Collations salées |
0,13 |
N.D. |
Abréviations : n.d. = non disponible
a Données tirées de la base de données des composés volatils dans les aliments (Nijssen et coll., 1963-2016) sauf indication contraire.
b Yue et coll., 2015
c Sánchez-Pena et coll., 2005
Catégorie d’aliments |
MIBK (µg/g) |
MIAK (µg/g) |
alcool de diacétone (µg/g) |
|---|---|---|---|
Bières et panachés |
0,12 |
N.D. |
N.D. |
Café; les produits en poudre sont reconstitués |
6,50 |
0,50 |
N.D. |
Laits |
0,016b |
N.D. |
0,00015c |
Prunes et pruneaux |
0,01 |
N.D. |
N.D. |
Autres fruits (bleuets, dattes, kiwis, salades de fruits) |
0,02 |
0,001 |
0,408 |
Poulet, dinde et autres volailles |
0,0004 |
N.D. |
0,07 |
Œufs |
0,003 |
N.D. |
N.D. |
Autres graisses et tartinades |
0,38 |
N.D. |
N.D. |
Sucres, sirops et conserves |
N.D. |
N.D. |
2,70 |
Autres ingrédients figurant dans les recettes (p. ex., épices, ingrédients de cuisson) |
N.D. |
N.D. |
28,50 |
Abréviations : N.D. = non disponible
a Données tirées de la base de données des composés volatils dans les aliments (Nijssen et coll., 1963-2016) sauf indication contraire.
b Yue et coll., 2015
c Toso et coll., 2002
Catégorie d’aliments |
Diacétyle (µg/g) |
2,3‑PD (µg/g) |
Acétoïne (µg/g) |
|---|---|---|---|
Bières et panachés |
0,20 |
0,30 |
9,00 |
Spiritueux et liqueurs |
9,77b |
0,60 |
335,00 |
Vins |
4,10 |
N.D. |
234,00l |
Jus de fruits |
3,15c |
N.D. |
0,35 |
Café; les produits en poudre sont reconstitués |
58,70 |
39,60 |
4,90 |
Thé, dont le thé glacé |
1,00 |
2,00 |
N.D. |
Laits |
29,3d |
0,20j |
N.D. |
Crèmes |
30,00 |
N.D. |
N.D. |
Fromages |
4,20 |
N.D. |
40,00 |
Yogourts |
43,00e |
N.D. |
28,00 |
Pâtes, riz, grains céréaliers et farines |
0,19 |
0,25 |
0,75 |
Pains blancs |
0,92 |
0,14 |
N.D. |
Pains complets |
1,52 |
0,14k |
1,22m |
Autres pains |
0,33 |
0,04 |
N.D. |
Pommes |
0,40 |
N.D. |
3,50 |
Cerises |
N.D. |
N.D. |
4,70 |
Poires |
N.D. |
N.D. |
0,11 |
Fraises |
0,20 |
N.D. |
0,49 |
Autres fruits (bleuets, dattes, kiwis, salades de fruits) |
0,60f |
N.D. |
22,63 |
Légumes, à l’exclusion des pommes de terre |
0,79g |
N.D. |
6,40 |
Pommes de terre, frites |
0,31 |
N.D. |
N.D. |
Bœuf |
23,00 |
6,50 |
8,40 |
Veau |
23,00 |
6,50 |
8,40 |
Poulet, dinde et autres volailles |
0,90 |
N.D. |
2,40 |
Foies et foies gras |
27,81 |
N.D. |
N.D. |
Viandes froides (viandes en conserve ou froides) |
27,81 |
N.D. |
N.D. |
Porc frais et jambon |
0,36 |
N.D. |
N.D. |
Poisson |
0,0017 |
0,69 |
0,31 |
Mollusques |
0,10h |
N.D. |
0,16 |
Noix, graines et beurre d’arachides |
0,09 |
0,23 |
N.D. |
Beurre |
21,00e |
0,05e |
2,00 |
Margarines, en contenant |
N.D. |
0,01 |
N.D. |
Margarines, en barquette |
N.D. |
0,01 |
N.D. |
Autres graisses et tartinades |
0,60 |
0,01 |
0,04 |
Confiseries, barres de chocolat |
0,40 |
N.D. |
17,00 |
Sucres, sirops et conserves |
2,60 |
N.D. |
26,00 |
Collations salées |
N.D. |
0,20 |
N.D. |
Soupes sans légumes |
0,00056i |
0,42i |
N.D. |
Sauces |
0,09 |
N.D. |
N.D. |
Assaisonnements, sel, poivre, vinaigre |
197,00 |
N.D. |
1020 |
Autres ingrédients figurant dans les recettes (p. ex., épices, ingrédients de cuisson) |
238,00 |
109,00 |
951,00 |
Abréviations : N.D. = non disponible
a Données tirées de la base de données des composés volatils dans les aliments (Nijssen et coll., 1963-2016) sauf indication contraire.
b Cardoso et coll., 2003
c Lawson et coll., 1995
d De Leonardis et coll., 2013
e Macciola et coll., 2008
Houghton et coll., 2014
g Annan et coll., 2005
h Yu et Chen, 2010
i Giri et coll., 2010
j Imhof et coll., 1994
k Rychlick et Grosch, 1996
l Garcia-Martinez et coll., 2013
m Birch et coll., 2013
Catégorie d’aliments |
2,4‑PD (µg/g) |
Oxyde de mésityle (µg/g) |
|---|---|---|
Vins |
N.D. |
0,00005 |
Jus de fruits |
0,01 |
N.D. |
Autres fruits (bleuets, dattes, kiwis, salades de fruits) |
N.D. |
0,01 |
Légumes, à l’exclusion des pommes de terre |
N.D. |
0,04 |
Poulet, dinde et autres volailles |
0,004 |
N.D. |
Autres graisses et tartinades |
N.D. |
3,00 |
Autres ingrédients figurant dans les recettes (p. ex., épices, ingrédients de cuisson) |
N.D. |
2,40 |
Abréviations : N.D. = non disponible
a Données tirées de la base de données des composés volatils dans les aliments (Nijssen et coll., 1963-2016) sauf indication contraire.
Substance |
De 0 à 6 moisa |
De 6 à 12 mois |
1 an |
De 2 à 3 ans |
De 4 à 8 ans |
De 9 à 13 ans |
De 14 à 18 ans |
19 ans et plus |
|---|---|---|---|---|---|---|---|---|
MEK |
0 |
112 |
185 |
174 |
130 |
82 |
66 |
67 |
MPK |
0 |
146 |
216 |
192 |
137 |
86 |
68 |
98 |
MIBK |
0 |
0,5 |
0,9 |
0,7 |
0,4 |
0,8 |
5 |
32 |
MIAK |
0 |
0 |
0,001 |
0,001 |
0,0004 |
0,04 |
0,4 |
3 |
alcool de diacétone |
0 |
0,04 |
3 |
4 |
4 |
3 |
2 |
2 |
Diacétyle |
0 |
996 |
1625 |
1118 |
671 |
370 |
281 |
445 |
2,3‑PD |
0 |
6,5 |
22 |
22 |
20 |
16 |
40 |
208 |
Acétoïne |
0 |
173 |
346 |
369 |
293 |
189 |
161 |
308 |
2,4‑PD |
0 |
0,04 |
0,1 |
0,1 |
0,08 |
0,04 |
0,03 |
0,02 |
Oxyde de mésityle |
0 |
0,3 |
1 |
2 |
1 |
0,9 |
0,7 |
0,6 |
a Nous présumons que les nourrissons de zéro à six mois sont exclusivement allaités ou nourris au lait maternisé.
Annexe B. Paramètres utilisés pour estimer l’exposition
Nous avons estimé l’exposition occasionnée par les cosmétiques à l’aide du logiciel ConsExpo Web (2016). Les estimations de l’exposition ont été calculées en fonction de poids corporels de 70,9 kg pour un adulte (20 ans et plus), de 59,4 kg pour un adolescent (de 12 à 19 ans), de 15,5 kg pour un tout-petit (de 6 mois à 4 ans) et de 7,5 kg pour un nourrisson (de 0 à 6 mois) (Santé Canada, 1998). Les paramètres de l’exposition aux cosmétiques estimée par inhalation et par voie cutanée sont donnés au tableau B‑1. Seules les absorptions par voie cutanée de l’alcool de diacétone et de la 2,4‑PD sont données. Sauf avis contraire, les valeurs par défaut sont tirées du feuillet d’information ConsExpo pertinent pour le scénario en cause.
Produits (substance) |
Hypothèsesa |
|---|---|
Couche de finition (que l’on présume appliquée sur les ongles de main et de pied) (MEK) |
Concentration de 2-butanone (MEK) : 55,7 %
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 18 min Quantité de produit : 0,33 g (Ficheux et coll., 2014) Volume de la pièce : 1 m3 (près du visage) Taux de ventilation : Un renouvellement d’air à l’heure Coefficient de transfert de masse : 6,401 m/h (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 26,2 cm2 (d’après les données extraites de Ficheux et coll., 2014 et l’hypothèse selon laquelle les ongles des mains et des pieds sont peints) Matrice de la masse moléculaire : 124 g/mol |
Vernis à ongles (deux couches sur les ongles des mains et des pieds) (MEK) |
Concentration de 2-butanone : 35 %
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 35 min Quantité de produit : 0,8 g pour les adultes et les adolescents et 0,27 g sur les tout-petits (Ficheux et coll. 2014) Volume de la pièce : 1 m3 (près du visage) Taux de ventilation : Un renouvellement d’air à l’heure Coefficient de transfert de masse : 6,401 m/h (adultes), 9,082 m/h (tout-petits) (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 26,2 cm2 (adultes et adolescents), 8,8 cm2 (tout-petits) (d’après les données extraites de Ficheux et coll., 2014 et l’hypothèse selon laquelle les ongles des mains et des pieds sont peints) Matrice de la masse moléculaire : 124 g/mol |
Vernis à ongles (deux couches sur les ongles des mains et des pieds) (Alcool de diacétone) |
Concentration d’alcool de diacétone : 10 %
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 35 min Quantité de produit : 0,8 g pour les adultes et les adolescents et 0,27 g pour les tout-petits (Ficheux et coll., 2014) Volume de la pièce : 1 m3 (près du visage) Taux de ventilation : Un renouvellement d’air à l’heure Coefficient de transfert de masse : 5,043 m/h (adultes), 7,029 m/h (tout-petits) (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 26,2 cm2 (adultes et adolescents), 8,8 cm2 (tout-petits) (d’après les données extraites de Ficheux et coll., 2014 et l’hypothèse selon laquelle les ongles des mains et des pieds sont peints) Matrice de la masse moléculaire : 124 g/mol
Par voie cutanée Quantité de produit (g/utilisation) : 0,16 pour les adultes et les adolescents et 0,06 pour les tout-petits (Ficheux et coll., 2014) Fréquence (utilisation/jour) : 0,18 pour les adultes, 0,2 pour les adolescents et 0,13 pour les tout-petits (Ficheux et coll., 2014) Superficie : zone autour des ongles = 2,7 cm2 (adultes), 0,9 cm2 (tout-petits) (Ficheux et coll., 2014) |
Dissolvant pour vernis à ongles (MEK) |
Concentration de MEK : 84 % (adultes), 76,4 % (tout‑petits)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 8 min Quantité de produit : 5,36 g (adultes et adolescents) et 1,82 g (tout-petits) Volume de la pièce : 1 m3 (près du visage) Taux de ventilation : Un renouvellement d’air à l’heure Coefficient de transfert de masse : 5,080 m/h (adultes), 7,209 m/h (tout-petits) (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 34 cm2 (adultes et adolescents) et 11,6 (tout-petits) (d’après les données extraites de Ficheux et coll., 2014 et l’hypothèse selon laquelle les ongles des mains et des pieds sont peints) Matrice de la masse moléculaire : 124 g/mol
|
Alcool à friction (MIBK) |
Concentration de méthyl isobutyl cétone (MIBK) : 0,98 %
Aucun scénario défini dans ConsExpo, on s’en est remis au jugement professionnel
Inhalation : exposition à la vapeur, modèle de libération instantanée Durée d’exposition : 5 min Quantité de produit : 0,02 g Volume de la pièce : 1 m3 (près du visage) Taux de ventilation : Un renouvellement d’air à l’heure
Par voie cutanée Superficie : superficie présumée de 5 cm × 5 cm = couverture de 25 cm2 Quantité sur la peau (g/utilisation) : ajuster la quantité du produit désinfectant pour les mains de 0,7 g (Santé Canada, 2015c) pour une superficie de 910 cm2 proportionnellement à une superficie de 25 cm2 = 0,02 g |
Traceurs d’yeux autocollants (Alcool de diacétone) |
Concentration d’alcool de diacétone : 30 %
Par voie cutanée Quantité de produit (g/utilisation) : 27 mg (P95 de Ficheux et coll., 2016) Superficie : 5 cm2 (jugement professionnel, d’après la superficie de 3,2 cm2 indiquée dans ConsExpo et étant donné que les traceur d’yeux autocollants semblent couvrir une plus grande surface)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 12 min Quantité de produit : 27 mg/utilisation (Loretz et coll., 2005) Volume de la pièce : 1 m3 (près du visage) Coefficient de transfert de masse : 6,844 m/h (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 5 cm2 (jugement professionnel) Taux de ventilation : Un renouvellement d’air à l’heure Matrice de la masse moléculaire : 124 g/mol |
Produit coiffant (diacétyle) |
Concentration de diacétyle : de 0,1 à 1 %
Fréquence d’utilisation : 1/jour (jugement professionnel)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 10 min Quantité de produit : 0,25 g (selon le mode d’emploi figurant sur l’étiquette, appliquer deux gouttes ou plus. On présume qu’une goutte équivaut à 0,05 mL (référence) et qu’une densité de 1 g/mL donne 0,05 g/goutte. On a présumé que cinq gouttes seraient utilisées, donc 0,25 g.) Volume de la pièce : 1 m3 Taux de ventilation : 0,6/h Coefficient de transfert de masse : 5,421 m/h (méthode de Sparks) Mode de la zone d’application : constant Zone d’application : 637,5 cm2 (la moitié de la surface de la tête) Durée d’émission : 10 min Matrice de la masse moléculaire : 330 g/mol |
a À moins d’avis contraire, un facteur de rétention de 1 a été utilisé.
Produits (substance) |
Hypothèsesa |
|---|---|
Sucette ou jouet de dentition |
Concentration résiduelle de MEK : 500 µg/g (WSDE, 2016) Par voie orale : Ejouet = [qproduit x ftemps x fsurface] / p.c. où, Ejouet = exposition venant du jouet de dentition (µg/kg‑p.c. par jour) Sucette qproduit = quantité de substance lixiviée du produit en 24 heures (µg) = 22 500 µg (500 ug/g × 45 g)b ftemps = fraction de la journée que le produit passe dans la bouche (temps de succion) = 0,2 (nourrissons) et 0,32 (tout-petit) (Juberg et coll., 2001, cité dans Autorité européenne de sécurité des aliments, EFSA, 2015) fsurface = fraction de la surface du produit qui est portée à la bouche = 0,5 (Lassen et coll., 2011, cité dans EFSA, 2015) Jouet-dentition qproduit = quantité de substance lixiviée du produit en 24 heures (µg) = 68000 µg (500 µg/g × 136 g)b ftemps = fraction de la journée que le produit passe dans la bouche (temps de succion) = de 0,02 (Juberg et coll., 2001) à 0,05 (Van Engelen et coll., 2008 (nourrissons et tout-petits) fsurface = fraction de la surface du produit qui est portée à la bouche = 0,5 (Rijksinstituut voor Volksgezondheid en Milieu [RIVM], 2002) |
a Approche de l’EFSA (2015), poids corporels de 7,5 kg et de 15,5 kg pour les nourrissons (de 0 à 6 mois) et les tout-petits (de 6 mois à quatre ans), respectivement (Santé Canada, 1998).
b On présume que toute la MEK (500 ug/g) pourrait être libérée. On a trouvé le poids de la sucette et du jouet de dentition en examinant le poids des produits sur les étiquettes de fabrication des produits.
Autres produits
Des scénarios d’exposition sentinelle ont servi à estimer l’exposition potentielle aux substances du groupe des cétones. Les expositions ont été estimées en fonction du poids hypothétique de 70,9 kg d’un adulte (Santé Canada, 1998), dont les comportements d’utilisation sont ceux d’adultes. Les expositions ont été estimées au moyen du logiciel ConsExpo (2016) ou des algorithmes du modèle (voir ci-dessous pour plus de détails). Le tableau B-3 présente les hypothèses sous-tendant les différents scénarios. Le modèle PARAMs a servi à estimer les coefficients de transfert de masse (méthode de Sparks) (EPA des États-Unis, 2005). Se reporter au tableau B-4 pour connaître les valeurs par défaut utilisées dans le modèle PARAMs.
Scénario d’exposition |
Hypothèses |
|---|---|
Décapant pour laque (MEK) |
Concentration de MEK : de 10 % à 40 %
Scénario : décapant pour peinture dans le DIY Fact Sheet (RIVM, 2007a). Nous présumons que le travail sera fait dans un garage.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 60 min Quantité de produit : 1000 g Volume de la pièce : 34 m3 (garage) Taux de ventilation : 1,5 renouvellement d’air à l’heure Coefficient de transfert de masse : 2,758 m/h (méthode de Sparks) Mode de la zone d’application : croissant Zone d’application : 2 m2 Matrice de la masse moléculaire : 3000 g/mol |
Élimination d’adhésifs (MEK) |
Concentration de MEK : 100 %
Scénario : dissolvant d’adhésif utilisé dans les valeurs par défaut du DIY Fact Sheet pour les produits de bricolage pour la maison (RIVM, 2007a) et l’EPA des États-Unis, 2011
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 215 min (durée de la demande + durée d’exposition après la durée d’utilisation d’environ 94 min, selon l’EPA des États-Unis, 2011) Durée de l’application : 121 min (valeur moyenne pour les dissolvants d’adhésif de l’EPA des États-Unis, 2011) Quantité de produit : 200 g [d’après la quantité moyenne de produit utilisée par année, 34,46 oz/an (environ 1019 mL/an) × densité de MEK 0,8 g/mL divisé par utilisations moyennes/an (4,22) = 193 g] (EPA des États-Unis, 2011) Volume de la pièce : 30 m3 Taux de ventilation : 1,5 renouvellement d’air à l’heure Coefficient de transfert de masse : 3,743 m/h (méthode de Sparks) Mode de la zone d’application : croissant Zone d’application : 5 m2 Matrice de la masse moléculaire : 3000 g/mol |
Diluant à peinture (pour diluer la laque ou un autre revêtement) (MEK) |
Concentration : MEK = 100 % (dilué à 3 % dans le produit)
Scénario : revêtement pour usage général (plancher) dans le Do-It-Yourself Fact Sheet (RIVM, 2007a). On présume que le travail est fait dans un garage.
La concentration finale de MEK dans le produit se fonde sur les renseignements du produit, selon lesquels les laques devraient être diluées avec de la MEK pure à 4 oz par gallon tout au plus (3 %) 4 oz = 118 mL 1 gallon = 3785 mL
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 60 min Quantité de produit : 3000 g Volume de la pièce : 34 m3 Taux de ventilation : 1,5 renouvellement d’air à l’heure Coefficient de transfert de masse : MEK = 2,595 m/h (méthode de Sparks) Mode de la zone d’application : croissant Zone d’application : 15 m2 Matrice de la masse moléculaire : 3000 g/mol |
Peinture liquide (peinture riche en solvant pour plate-forme de camion) (MEK, MIBK) |
Concentration : MEK = 20 %, MIBK = 13 %
Scénario : peinture à la brosse ou au rouleau avec peinture riche en solvant (peinture pour plate-forme de camion) dans le Paint Fact Sheet (RIVM, 2007b). On présume que le travail a eu lieu dans un garage.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 132 min Quantité de produit : 420 g (quantité de produit ajustée en fonction de la superficie couverte. 1000 g pour 12 à 15 m2 à 420 g pour 5 m2) Volume de la pièce : 90 m3 (garage, un garage de plus grande taille serait nécessaire si on peignait un camion) (EPA des États-Unis, 2017)
Taux de ventilation : 1,5 renouvellement d’air à l’heure Coefficient de transfert de masse : MEK = 2,595 m/h, MIBK = 2,115 m/h (méthode de Sparks) Mode de la zone d’application : croissant Zone d’application : 5 m2 Durée de l’application : 120 min Matrice de la masse moléculaire : 300 g/mol |
Peinture liquide pour l’acier (peinture très solide) (MEK) |
Concentration de méthyl propyl cétone (MPK) : de 1 à 10 %
Scénario : peinture à la brosse ou au rouleau avec peinture très solide dans le Paint Fact Sheet (RIVM, 2007b). On présume que le travail a eu lieu dans un garage.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 132 min Quantité de produit : 1300 g Volume de la pièce : 34 m3 (garage) Taux de ventilation : 1,5 renouvellement d’air à l’heure Coefficient de transfert de masse : Thibodeaux (l’utilisation de la méthode de Sparks n’entraîne qu’un léger changement) Mode de la zone d’application : croissant Zone d’application : 10 m2 Durée de l’application : 120 min Matrice de la masse moléculaire : 550 g/mol |
Peinture en aérosol (MEK, MPK, MIBK, MIAK, alcool de diacétone) |
Concentration : MEK = de 1 à 52 %, MPK = de 2 à 13%, MIBK = de 0,1 à 30 %, MIAK = de 1 à 10 %, alcool de diacétone = de 1 à 5 %
Scénario : scénario d’aérosol dans le Paint Fact Sheet (RIVM, 2007b), mais on a utilisé l’exposition à la vapeur – modèle d’évaporation puisque les substances sont volatiles. On présume que le travail a eu lieu dans un garage. Certaines bombes aérosol pèsent environ 400 grammes : on a donc ajusté la quantité de produit à 400 g et prolongé la durée d’application et d’exposition de cinq minutes chacune.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 25 min Quantité de produit : 400 g Volume de la pièce : 34 m3 (garage) Taux de ventilation : 1,5 renouvellement d’air à l’heure Mode de la zone d’application : croissant Zone d’application : 2 m2 Durée de l’application : 20 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : MEK = 3,743 m/h, MPK = 3,346, MIBK = 3,051 m/h, MIAK = 2,820, alcool de diacétone = 2,949 (méthode de Sparks) |
Ciment/apprêts au PVC (MEK, alcool de diacétone) |
Concentration : MEK = de 10 à 100 %, alcool de diacétone = de 20 à 30 %
Scénario : colle universelle ou à bois conformément au DIY Fact Sheet (RIVM, 2007a)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 240 min Quantité de produit : 10 g Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Mode de la zone d’application : croissant Zone d’application : 0,04 m2 Durée de l’application : 20 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : MEK = 8,064 m/h, alcool de diacétone = 5,043 (méthode de Sparks) |
Adhésifs multiusages (MEK) |
Concentration de MEK : 70 %
Scénario : colle en tube (colle de contact) dans le Do-It-Yourself Fact Sheet (RIVM, 2007a)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 80 min (en fonction du nombre moyen de min d’exposition après la durée d’utilisation, soit environ 70 min, selon l’EPA des États-Unis, 2011) Quantité de produit : 9 g Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Mode de la zone d’application : croissant Zone d’application : 200 cm2 Durée de l’application : 10 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : MEK = 8,064 m/h (méthode de Sparks) |
Laque pour bois (MIBK) |
Concentration de MIBK : de 1 à 10 %
Scénario : revêtement pour usage général sur un plancher (dans un garage) dans le DIYFact Sheet (RIVM, 2007a)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 60 min Quantité de produit : 3000 g Volume de la pièce : 34 m3 Taux de ventilation : 1,5 renouvellement d’air à l’heure Mode de la zone d’application : croissant Zone d’application : 15 m2 Durée de l’application : 60 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : MIBK = 2,115 m/h (méthode de Sparks) |
Remplissage ou mastic en tube (automobile) (MIBK) |
Concentration de (MIBK) : de 1 à 8 %
Modèle : remplissage ou mastic en tube (dans un garage) dans le DIY Fact Sheet (RIVM, 2007a) On présume que le travail a eu lieu dans un garage.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 60 min Quantité de produit : 100 g (ajustement de 40 g en fonction de la dimension de produit et de renseignements additionnels de l’EPA des États-Unis, 2017) Volume de la pièce : 34 m3 (garage) Taux de ventilation : 1,5 renouvellement d’air à l’heure Mode de la zone d’application : croissant Zone d’application : 200 cm2 Durée de l’application : 60 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : MIBK = 8,28 m/h (méthode de Sparks) |
Nettoyant à volet d’automobile (alcool de diacétone) |
Concentration d’alcool de diacétone : 30 %
Modèle : peinture à pulvériser (dans un garage) dans le Paint Fact Sheet (RIVM, 2007b) On présume que le travail a eu lieu dans un garage.
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 15 min (13,67 min arrondies à 15 min, EPA des États-Unis, 2011) Quantité de produit : 165 g (EPA des États-Unis, 2011) Volume de la pièce : 34 m3 (garage) Taux de ventilation : 1,5 renouvellement d’air à l’heure Mode de la zone d’application : croissant Zone d’application : 1 m2 Durée d’application : 15 min (EPA des États-Unis, 2011) Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : alcool de diacétone = 10 m/h (nouvelle valeur par défaut tirée du RIVM) |
Décapant à peinture ou à marqueur, bombe (alcool de diacétone) |
Concentration d’amino bis-éthanol (alcool de diacétone) : 10 %
Modèle : peinture à pulvériser (dans une pièce indéterminée) dans le Paint Fact Sheet (RIVM, 2007b)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 20 min Quantité de produit : 300 g Volume de la pièce : 20 m3 (garage) Taux de ventilation : 0,6/h Mode de la zone d’application : croissant Zone d’application : 1 m2 Durée d’application : 15 min (EPA des États-Unis, 2011) Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : alcool de diacétone = 2,95 m/h (méthode de Sparks) |
Diluant à peinture (pour les peintures époxy) |
Concentration : alcool de diacétone = de 5 à 10 % (FS, 2017)
Scénario : diluant pour époxy, afin de nettoyer les brosses ou les surfaces On présume que cela pourrait se faire lorsque de l’epoxy est utilisé dans la maison (pièce non précisée)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 30 min (Versar, 1986) Quantité de produit : 400 g (500 mL) (TDS, 2015)/contenant × 0,8 g/mL, densité de diluant à peinture (Versar, 1986) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h Coefficient de transfert de masse : 10 m/h (nouvelle valeur par défaut tirée du RIVM) Mode de la zone d’application : constant Zone d’application : 0,078 m2 Matrice de la masse moléculaire : 3000 g/mol
Par voie cutanée : application instantanée Quantité de produit sur la peau : 2,07 g (Versar, 1986) |
Marqueurs (MIBK, alcool de diacétone) |
Concentration : MIBK = de 10 à 30 % dans les marqueurs à essuyage à sec, alcool de diacétone = de 60 à 100 % dans les marqueurs permanents
Scénario : marqueurs (à essuyage à sec ou permanents)
Par inhalation : on a utilisé le scénario dans le Children’s Products Fact Sheet (RIVM, 2002) – pour la MIBK seulement Quantité de produit : 300 mg Durée : 45 min Volume de la pièce : 20 cm3 Taux de ventilation : 0,6/h Zone d’application : 450 cm2 Matrice de la masse moléculaire : 450 g/mol Coefficient de transfert de masse : MIBK = 4,843 m/h (méthode de Sparks)
Par voie cutanée ou orale (scénario relatif à l’encre tiré de l’approchea de l’Arts & Creative Materials Institute [ACMI])
Scénario d’exposition aiguë ou par événement
Absorption (mg/kg‑p.c./événement = (concentration de la substance dans le marqueur (p/p) × quantité estimée d’encre par exposition (50 mg) × fraction absorbée) / poids corporel (kg)
Quantité d’encre par exposition = 50 mg (Hansel et coll., 2008)
Scénario d’exposition chronique
Absorption (mg/kg‑p.c./jour) : (concentration de la substance dans le marqueur (p/p) × taux de dépôt d’encre (µg/cm) × ligne d’encre de 25 cm/jour)/1000 µg/mg) / poids corporel (kg)
Taux de dépôt d’encre = 100 µg/cm (90e percentile pour le dépôt d’encre des outils d’écritureb) |
Revêtement spécial (2,4‑PD) |
Concentration : 2,4‑PD = de 1 à 5 %
Scénario : revêtement pour usage général sur un camion ou un bateau (appliqué dans un garage double) du DIY Fact Sheet (RIVM, 2007a)
Inhalation : exposition à la vapeur, modèle d’évaporation Durée d’exposition : 60 min Quantité de produit : 3000 g Volume de la pièce : 90 m3 Taux de ventilation : 1,5 renouvellement d’air à l’heure Mode de la zone d’application : croissant Zone d’application : 15 m2 Durée de l’application : 60 min Matrice de la masse moléculaire : 3000 g/mol Coefficient de transfert de masse : 2,4‑PD = 2266 (méthode de Sparks) |
Huile essentielle comme assainisseur d’air (par inhalation) (2,3‑PD) |
Concentration de 2,3 PD : de 0,1 à 1 %
Scénario : huile essentielle comme assainisseur d’air (dans un salon) dans le Cosmetics Fact Sheet (RIVM, 2006)
Par inhalation : exposition à la vapeur, modèle de libération instantanée, modèle à taux constant Durée d’exposition : 240 min Quantité de produit : 1,08 g Volume de la pièce : 58 m3 Taux de ventilation : 0,5 renouvellement d’air à l’heure Durée d’émission : 180 min |
Assainisseur d’air à brancher (par inhalation) (2,3‑PD) |
Concentration de 2,3‑PD : de 0,1 à 1 %
Scénario : assainisseur d’air à brancher
Par inhalation : exposition à la vapeur, modèle de libération instantanée
Fréquence : à longueur de journée, tous les jours Durée d’exposition : 24 heures/jour Quantité de produit : une unité à brancher contient environ 26 mL de produit et peut durer jusqu’à 30 jours (P&G, c2017a; Walmart.ca, c2017) On présume que la quantité émise est la même chaque jour (26 mL/30 jours = environ 0,9 mL ou 0,9 g par jour) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h |
Assainisseur d’air en gel (par inhalation) (2,3‑PD) |
Concentration de 2,3‑PD = de 1 à 5 %
Scénario : assainisseur d’air en gel
Par inhalation : exposition à la vapeur, scénario de libération instantanée
Fréquence : à longueur de journée, tous les jours Durée d’exposition : 24 heures/jour Quantité de produit : une unité en gel contient environ 5,5 mL de produit et peut durer jusqu’à 30 jours (P&G, c2017b) On présume que la quantité émise est la même chaque jour (5,5 mL/30 jours = environ 0,2 mL ou 0,2 g par jour) Volume de la pièce : 20 m3 Taux de ventilation : 0,6/h |
a Approche de l’ACMI (communication personnelle, 2009 de l’ACMI au Bureau d’évaluation des risques des substances existantes de Santé Canada; source non citée)
b communication personnelle, 2009 du Duke Medical Centre au Bureau d’évaluation des risques des substances existantes de Santé Canada; source non citée)
Paramètre |
Valeur |
Renseignements supplémentaires |
|---|---|---|
Densité de l’air (g/cm3) |
0,0011774 |
À 25 °C, une pression atmosphérique de 760 mm/Hg et une humidité relative de 50 % |
Viscosité de l’air (g/cm/s) |
1,86 × 10-4 |
À 25 °C |
Vélocité de l’air (cm/s) |
10 |
(McGready and Fontaine, 2010 et Sparks et coll., 1996) |
Diffusivité dans l’air (cm2/s) |
MEK : 9,19 × 10-2 MPK : 8,22 × 10-2 MIBK : 7,49 × 10-2 MIAK : 6,92 × 10-2 Alcool de diacétone : 7,24 × 10-2 Diacétyle : 8,91 × 10-2 2,3‑PD : 8,02 × 10-2 2,4‑PD : 8,02 × 10-2 |
À 25°C |
Longueur de surface dans divers scénarios |
Vernis à ongles : 20 cm (adulte), 7 cm (tout-petit) Dissolvant pour vernis à ongles : 40 cm (adulte), 14 cm (tout-petit) Décapant pour laque : 2,5 cm Dissolvant d’adhésif : de 1 à 5 m Diluant à peinture (revêtement de plancher) : de 3 à 5 m Peinture pour plate-forme de camion : de 3 à 5 m Peinture en aérosol : de 1 à 2 m Adhésif polyvalent : de 10 à 20 cm Finition de bois (plancher) : de 3 à 5 m Marqueurs : 25 cm Dissolvant pour graffiti (en aérosol) : de 1 à 2 m Traceurs d’yeux autocollants : 8 cm Revêtement pour usage général : de 3 à 5 m Remplissage ou mastic : de 2 à 5 cm |
Les valeurs estimées compte tenu de la zone d’application indiquée dans les feuillets d’information de ConsExpo pour chaque scénario particulier (si le scénario ne figure pas dans ConsExpo, on s’en est remis au jugement professionnel) |
Annexe C. Expositions par inhalation au diacétyle contenu dans le mais à éclater aux micro-ondes
L’approche employée dans Zhu et coll. (2001) et l’évaluation de la Liste des substances d’intérêt prioritaire pour le 2-butoxyéthanol (Environnement Canada, Santé Canada, 2002) a été utilisée pour convertir les données de Rosati et coll. (2007) sur les émissions de diacétyle provenant d’un sac de maïs à éclater aux micro-ondes d’après des études en chambre à une certaine concentration dans l’air dans une pièce standard. Des détails sur les hypothèses prises en compte figurent ci-dessous.
On a supposé que les émissions de diacétyle provenant du maïs à éclater aux micro-ondes suivaient une décomposition de premier ordre et qu’il n’y avait pas d’effet de dissipation dans la chambre. Étant donné ces hypothèses, la concentration de la substance dans une chambre d’émissions (ou une pièce) est liée au facteur d’émission comme suit :
C = [(FE0 x S) / (V x (N - k))] x [exp(-kt) - exp(-Nt)] (équation 1)
où : C = la concentration de diacétyle dans la chambre à tout moment en mg/m3
FE0 = le facteur d’émission initial pour le diacétyle contenu dans l’échantillon de produit en mg/m2/h
S = la superficie émettrice de l’échantillon de produit en [m2
N = le nombre de renouvellements d’air à l’heure dans la chambre en h-1
V = le volume dans la chambre en m3
t = la durée d’émission en h
k = constante de décomposition des émissions en h-1.
Pour une source d’émissions qui s’épuise lentement ou de manière quasi constante, la valeur (constante de décomposition) avoisine zéro. Lorsque (période d’essai) devient infinie ou qu’un état d’équilibre est atteint, l’équation 1 peut être reformulée comme suit :
C = [FE0 x S] / [V x N] (équation 2)
On a présumé qu’un état d’équilibre avait été atteint durant l’essai sur les produits. Pour le calcul des facteurs d’émission initiaux, nous avons remanié l’équation 2 comme suit :
FE0 = (C x N x V) / S [mg/m2/h] = [mg/m3][h-1][m3]/[m2] (équation 3)
où est le nombre de renouvellements d’air à l’heure dans la chambre, est le volume de la cellule et est la superficie émettrice et les concentrations moyennes de diacétyle émises par le sac de 778,9 µg/sac (Rosati et coll., 2007).
Étape1 : Calculer le facteur d’émission initial à l’aide de l’équation 3 (données extraites de Rosati et coll., 2007).
Plage de concentrations (mg/m3) |
N = ACH (h-1) |
V = volume dans la chambre (m3) |
S = superficie émettrice (m2) |
FE0 (mg/m2/h) |
|---|---|---|---|---|
5,8 |
2,3 |
0,515 |
0,1 |
68,70 |
0,02 |
2,3 |
0,515 |
0,1 |
0,237 |
a Nous présumons que la superficie émettrice correspond à celle d’un sac de maïs, soit 1000 cm2 (Borkowski, 2007).
Étape 2 : Calculer la constante de décomposition des émissions selon la formule k = FE0 × S ⁄ M, où M est la quantité évaporable totale de la substance dans la source (M = quantité moyenne émise par un sac de maïs à éclater aux micro-ondes, soit 0,779 mg)
FE0 (mg/m2/h) |
S (m2) |
M (mg) |
k (h-1) |
68,7 |
0,1 |
0,779 |
8,82 |
0,237 |
0,1 |
0,779 |
0,03 |
Étape 3 : Calculer la concentration dans une pièce standard selon l’équation 1.
FE0 (mg/m2/h) |
S (m2) |
V (m3) |
N (h-1) |
k (h-1) |
t (h) |
Concentration (mg/m3) |
|---|---|---|---|---|---|---|
68,7 |
0,1 |
17,4 |
0,5 |
8,82 |
1 |
0,0288 |
0,237 |
0,1 |
17,4 |
0,5 |
8,82 |
1 |
0,0001 |
Pour 5,8 mg/m3 de diacétyle
Temps (min) |
Concentration (mg/m3) |
|---|---|
0 |
0 |
10 |
0,0328 |
20 |
0,0377 |
30 |
0,0364 |
40 |
0,0339 |
50 |
0,0313 |
60 |
0,0288 |
120 |
0,0175 |
180 |
0,0106 |
240 |
0,0064 |
300 |
0,0039 |
360 |
0,0024 |
Moyenne après 6 heures |
0,02 |
Pour 0,02 mg/m3 de diacétyle
Temps (min) |
Concentration (mg/m3) |
|---|---|
0 |
0 |
10 |
0,00011 |
20 |
0,00013 |
30 |
0,00013 |
40 |
0,00012 |
50 |
0,00011 |
60 |
0,00010 |
120 |
0,00006 |
180 |
0,00004 |
240 |
0,00002 |
300 |
0,00001 |
360 |
0,00001 |
Moyenne après 6 heures |
0,00007 |
Annexe D. Paramètres pour l’extrapolation
Substance |
Paramètres d’étude |
Dose initiale |
Dose convertie |
Formule |
|---|---|---|---|---|
MIBK |
2 ans; 6 h/jour; 5 jours/semaine |
1843 mg/m3 |
101 mg/kg‑p.c./j |
1843 × 0,31a × (6 h/24 h)b × (5 j/7 j)c |
MIAK |
69 expositions étalées sur 96 jours civils; 6 h/jour |
934 mg/m3 |
52 mg/kg‑p.c./j |
934 × 0,31a × (6 h/24 h)b × (69 j/96 j)d |
2,3‑PD |
Évaluation des risques dans le cadre de l’étude de 90 jours sur le diacétyle |
90 mg/kg‑p.c./j |
105 mg/kg‑p.c./j |
90 × (100,12/86,09)e |
2,3‑PD |
14 semaines; 6h/jour; 5 jours/semaine |
51 mg/m3 |
12 mg/kg‑p.c./j |
51 × 1,33f × (6 h/24 h)b × (5 j/7 j)c |
2,3‑PD |
14 semaines; 6h/jour; 5 jours/semaine |
102 mg/m3 |
24 mg/kg‑p.c./j |
102 × 1,33f × (6 h/24 h)b × (5 j/7 j)c |
2,4‑PD |
6 h/jour; JG 6 à 15 |
827 mg/m3 |
64 mg/kg‑p.c./j |
827 × 0,31a × (6 h/24 h)b |
2,4‑PD |
6 h/jour; 5 jours/semaine; 14 semaines |
417 mg/m3 |
23 mg/kg‑p.c./j |
417 × 0,31a × (6 h/24 h)b × (5 j/7 j)c |
Oxyde de mésityle |
6 semaines; 8 h/jour; 5 jours/semaine |
200 mg/m3 |
15 mg/kg‑p.c./j |
200 × 0,31a × (8 h/24 h)b × (5 j/7 j)c |
a Compte tenu du poids corporel d’un rat standard de 0,35 kg et d’un volume d’inhalation de 0,11 m3/jour, ce qui donne une constante de 0,31 (selon Santé Canada,1994)
b durée d’exposition dans une journée
c durée de l’étude
d nombre d’expositions
e masse moléculaire (substance/analogue)
f Compte tenu du poids corporel d’une souris standard de 0,03 kg et d’un volume d’inhalation de 0,04 m3/jour, ce qui donne une constante de 1,33 (selon Santé Canada,1994).
Détails de la page
- Date de modification :
