Effets secondaires suivant l’immunisation (ESSI) Rapport trimestriel pour 2015 – T4
Résumé de l’évaluation de l’innocuité pour le quatrième trimestre :
- Aucun signe de problème concernant l’innocuité des vaccins n’a été observé au cours du quatrième trimestre (T4) de 2015.
- Ce rapport présente les 659 déclarations d’ESSI rapportées par les provinces et territoires durant le quatrième trimestre.
Contexte
Les vaccins sont étroitement surveillés au Canada à toutes les phases du « cycle de vie » du produit vaccinal, depuis sa découverte jusqu’à l’autorisation de mise en marché (avant commercialisation) et au-delà, à mesure que les gens commencent à les utiliser (après commercialisation). De nombreux intervenants participent à diverses activités liées à l’évaluation et à la surveillance de l’innocuité des vaccins, y compris le gouvernement fédéral, les autorités de santé publique provinciales, territoriales et locales, les professionels de soins de la santé, l’industrie des vaccins et le public. L’Agence de la santé publique du Canada (l’Agence) assure une surveillance étroite de l’innocuité après commercialisation par l’intermédiaire d’un système national de déclaration, soit le Système canadien de surveillance des effets secondaires suivant l’immunisation (SCSESSI).
Un effet secondaire suivant l’immunisation (ESSI) est défini comme étant tout événement médical fâcheux qui se produit à la suite de l’administration d’un vaccin et qui n’a pas nécessairement de lien causal avec celle-ci. Un effet indésirable suivant l’immunisation peut donc correspondre à un signe défavorable ou non intentionnel, à un résultat de laboratoire anormal, à un symptôme ou à une maladie. Les ESSI graves sont les effets qui menacent le pronostic vital, qui entraînent l’hospitalisation, la prolongation de l’hospitalisation, une invalidité permanente ou marquée, une malformation congénitale ou la mort. Les rapports ne répondant pas à la définition d’événement grave sont classifiés comme non graves.
L’objectif principal de la surveillance après commercialisation des vaccins est de déceler les préoccupations concernant leur innocuité. Ces préoccupations comprennent une possible augmentation de la gravité ou de la fréquence des ESSI attendus, ou encore, la survenue d’un ou de plusieurs événements inattendus (c.-à-d. un effet secondaire qui ne correspond pas aux renseignements ou à l’étiquette sur le produit canadien). Cela permet aux vaccinateurs et aux fournisseurs de programme d’immunisation de santé publique de prendre des mesures dans le domaine de la santé publique :
- au niveau de la personne (p. ex. une enquête plus poussée afin de confirmer un diagnostic et de déterminer les causes possibles, une consultation en vue d’écarter la possibilité d’une allergie à une ou à plusieurs composantes du vaccin, ou une décision d’administrer ou non des doses subséquentes du vaccin), ou
- au niveau du programme d’immunisation (p. ex. une enquête menée sur un ensemble d’effets secondaires, un examen des procédures pour s’assurer que les exigences relatives à l’entreposage des vaccins ont été rigoureusement suivies, ou encore un changement de politique permettant d’adopter un vaccin moins réactogène).
L’Agence partage aussi les données sur les ESSI avec la Direction générale des produits de santé et des aliments de Santé Canada, l’organisme de réglementation national pour les vaccins au Canada. Des mesures plus officielles liées aux vaccins commercialisés au Canada peuvent ainsi être prises, au besoin. Il peut s’agir de diffuser des communications aux vaccinateurs ou au public par rapport à la préoccupation en matière d’innocuité, d’exiger de l’information ou une enquête supplémentaire de la part du distributeur du vaccin, ou encore d’apporter des changements à l'étiquette du produit.
L’Agence publie systématiquement les résultats des rapports de surveillance de l’innocuité des vaccins résumant les données du SCSESSI. Les rapports trimestriels présentent un sommaire de toutes les déclarations d’ESSI reçues par l’Agence de janvier à mars (premier trimestre), d’avril à juin (deuxième trimestre), de juillet à septembre (troisième trimestre) et d’octobre à décembre (quatrième trimestre), indépendamment de la date à laquelle le vaccin a été administré.
Afin de donner une idée générale de la façon dont les données peuvent varier d’une année à l’autre, les données de chaque trimestre sont comparées avec une moyenne des données trimestrielles des années précédentes (en d’autres termes, les données de ce trimestre, le quatrième trimestre, sont comparées avec la moyenne des données du quatrième trimestre des quatre années précédentes). Toutefois, étant donné que ces données reflètent les déclarations reçues au cours du trimestre en question et ne reflètent pas nécessairement la date à laquelle le vaccin a été administré, elles peuvent faire l’objet d’écarts importants selon le moment et la façon dont les déclarations sont reçues, traitées et envoyées par les autorités provinciales et territoriales de santé publique. L’objectif du présent rapport étant de fournir un aperçu des données seulement, les tendances observées devraient être interprétées avec précautions.
Remarques sur l’interprétation : Les déclarations d’ESSI à l’Agence représentent un soupçon, une opinion ou une observation par le déclarant plutôt qu’une affirmation ou une preuve que le vaccin a pu causer l’événement. D’autres limites des données sur les déclarations d’effets secondaires suivant l’immunisation comprennent des normes de déclaration variées et la sous-déclaration, un manque de certitude quant à la validité du diagnostic d’un événement signalé, un manque de renseignements en ce qui concerne d’autres causes potentielles et d’autres biais de déclaration.
Résultats mis en évidence pour le quatrième trimestre de 2015
Le présent rapport trimestriel (T4) comprend les déclarations reçues entre le 1er octobre et le 31 décembre 2015, et des comparaisons par rapport à la moyenne du nombre de déclarations reçues au cours du même trimestre lors des quatre années civiles précédentes (2011-2014). Les déclarations analysées ont été extraites de la base de données du SCSESSI le 7 mars 2016 par l’Agence.
Tous les rapports sont codés avec une raison de déclaration principale, ce qui signifie que si plus d’un événement est décrit, celui qui a mené à la déclaration est codé à titre de principal ESSI. En outre, toutes les déclarations d’ESSI décrivant un effet grave ont été examinées et, à moins d’une indication contraire dans le présent rapport, il a été établi que la plupart étaient soit prévisibles (en fonction des effets indésirables connus associés au vaccin) ou, pouvaient s’expliquer par d’autres raisons non liées à la vaccination.
Nombre de déclarations d’ESSI et d’ESSI graves
Au total, 659 déclarations d’ESSI ont été reçues par l’Agence au T4 de 2015. Au cours du quatrième trimestre de 2011, 2012, 2013 et 2014, l’Agence a reçu en moyenne 902 déclarations (plage : 609-1287) [Figure 1].
Au total, 65 déclarations d’ESSI reçues par l’Agence au T4 de 2015 ont été classifiées graves (10 % de l’ensemble des déclarations). Au cours du quatrième trimestre de 2011, 2012, 2013 et 2014, l’Agence a reçu en moyenne 60 déclarations (plage : 37-74) d’ESSI graves (de 6 à 10 % de l’ensemble des déclarations).

Équivalent textuel
Il s'agit d'un graphique en barres empilées. Les barres représentent le nombre total de déclarations d'effets secondaires suivant l'immunisation (ESSI) reçues chaque trimestre (T); le premier trimestre (T1) comprend les mois de janvier, février et mars, le deuxième trimestre (T2) inclut les mois d'avril, mai et juin, le troisième trimestre (T3) comprend les mois de juillet, août et septembre et le quatrième trimestre (T4) inclut les mois d'octobre, novembre et décembre. L'axe des y sur le côté gauche du graphique présente le nombre total de déclarations reçues pour chaque trimestre, qui est compris entre 0 et 1 200. L'axe des x correspond au trimestre et va du premier trimestre au quatrième trimestre. Deux périodes sont représentées sur le graphique. Le premier ensemble de barres représente le nombre total de déclarations reçues durant chaque trimestre de 2015 : non graves en bleu et graves en rouge : non graves : 673 durant le T1, 448 durant le T2, 365 durant le T3 et 594 durant le T4, graves : 67 durant le T1, 45 durant le T2, 36 durant le T3 et 65 durant le T4. Le deuxième ensemble de barres représente la moyenne du nombre total de déclarations pour chaque trimestre de 2011 à 2014; non graves en bleu et graves en rouge : non graves : 917 durant le T1, 695 durant le T2, 568 durant le T3 et 842 durant le T4, graves : 59 durant le T1, 50 durant le T2, 51 durant le T3 et 60 durant le T4.
Notes de bas de page
Fréquence des déclarations d’ESSI graves et non graves suivant l’immunisation, par groupe d’âge
Le Tableau 1 - présente le nombre de déclarations d’ESSI graves et non graves par groupe d’âge au cours du T4 de 2015, comparativement à la moyenne de 2011 à 2014.
| Groupe d’âge | Déclarations d’ESSI graves | Déclarations d’ESSI non graves | ||
|---|---|---|---|---|
| T4 2015 | Moyenne du T4 2011-2014 | T4 2015 | Moyenne du T4 2011-2014 | |
| de 0 à < 1 an | 14 | 17 | 53 | 90 |
| de 1 à < 2 ans | 19 | 16 | 65 | 103 |
| de 2 à < 7 ans | 10 | 8 | 41 | 101 |
| de 7 à < 18 ans | < 5 | < 5 | 99 | 117 |
| de 18 à < 65 ans | 12 | 9 | 245 | 310 |
| 65 ans et plus | 6 | < 5 | 88 | 105 |
| Inconnu | < 5 | < 5 | < 5 | 19 |
| Total | 65 | 60 | 594 | 842 |
Moins de déclarations d’ESSI non graves ont été reçues au T4 de 2015 par rapport à la moyenne de 2011 à 2014. Cela peut s’expliquer par un problème technique qui a empêché une des autorités de santé provinciales/territoriales de transmettre ses données à l’échelle nationale en 2015. Toutefois, le nombre de déclarations d’effets secondaires graves reçues était semblable ou supérieur au quatrième trimestre de l’année 2015, par rapport à 2011-2014, sauf pour les nourrissons âgés de moins d’un an pour qui un moins grand nombre de rapports ont été soumis mais ces différences, minimes, peuvent être fortuites.
Classification des principaux ESSI déclarés
La Figure 2 - présente les principaux types d’ESSI (graves et non graves) déclarés au cours du T4.
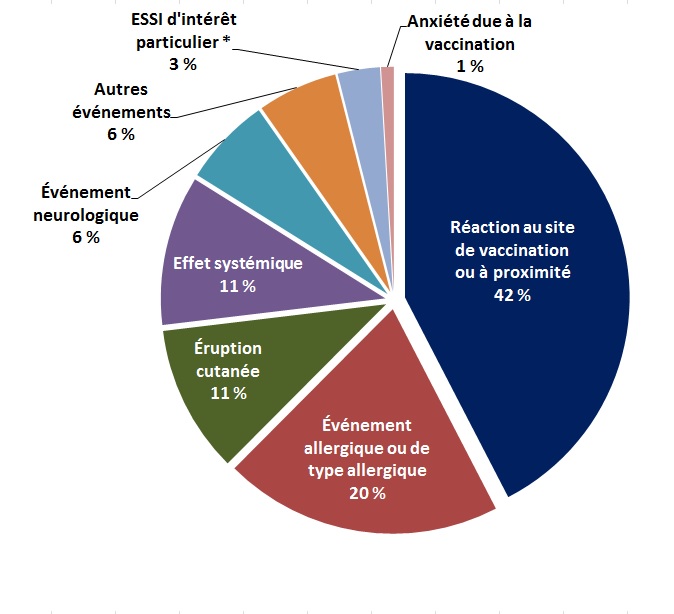
* ESSI d'intérêt particulier : arthrite, épisode hypotonique-hyporéactif, intussusception, paresthésie/anesthésie, parotidite, pleurs persistants ou thrombocytopénie.
Équivalent textuel
Il s'agit d'un diagramme circulaire présentant les principales raisons d'effectuer une déclaration d'effet secondaire suivant la vaccination durant le quatrième trimestre de 2015. En ordre décroissant de fréquence, les principales raisons sont: réaction au ou près du site de vaccination (42 %), événement allergique ou de type allergique (20 %), éruption cutanée (11 %), effet systémique (11 %), événement neurologique (6 %), autres événements (6 %), arthrite, épisode hypotonique-hyporéactif, intussusception, paresthésie/anesthésie, parotidite, pleurs persistents ou thrombocytopénie (3 %)Note de bas de page * et anxiété due à la vaccination (1 %).
Les principaux ESSI déclarés durant le quatrième trimestre de 2015 sont présentés en fonction de la sévérité et comparés à la moyenne de 2011-2014 dans le tableau 2. Au cours du quatrième trimestre de 2015 et des quatre dernières années, les réactions au site de vaccination ou à proximité et les événements allergiques ou de type allergique ont été les ESSI non graves les plus souvent déclarés, alors que les événements neurologiques (le plus souvent des convulsions déclenchées par une fièvre), suivis des effets systémiques (événements qui touchent de nombreux systèmes de l’organisme, souvent accompagnés de fièvre), ont été les ESSI graves les plus souvent déclarés.
| Principaux ESSI déclarésNote de tableau 1 | Déclarations d’ESSI graves | Déclarations d’ESSI non graves | ||
|---|---|---|---|---|
| 2015 | Moyenne 2011-2014 | 2015 | Moyenne 2011-2014 | |
| Réaction au site de vaccination ou à proximité | < 5 | 7 | 276 | 214 |
| Événement allergique ou de type allergique | 7 | < 5 | 125 | 137 |
| Éruption cutanée | < 5 | < 5 | 69 | 157 |
| Événement systémique | 18 | 13 | 53 | 72 |
| Autres événementsNote de tableau 2 | 9 | 10 | 33 | 59 |
| Événement neurologique | 23 | 18 | 15 | 22 |
| ESSI présentant un intérêt particulierNote de tableau 3 | < 5 | 8 | 16 | 35 |
| Anxiété due à la vaccination | 0 | 0 | 6 | 13 |
| Erreur de vaccination sans ESSI associé | 0 | 0 | < 5 | 17 |
| Total | 65 | 60 | 594 | 842 |
Vaccins administrés mentionnés dans les déclarations d’ESSI
Le Tableau 3 énumère les vaccins administrés les plus couramment mentionnés dans les déclarations d’ESSI reçues au cours du quatrième trimestre de 2015. La plupart des déclarations sur les ESSI graves ont suivi l’administration du vaccin contre le pneumocoque, ce qui correspond aussi à la moyenne des quatre dernières années. De même, le vaccin contre la grippe était le vaccin le plus fréquemment rapporté parmi les ESSI non graves, ce qui correspond aussi à la moyenne historique des quatre derniers T4. Le vaccin contre la rougeole, les oreillons et la rubéole, avec ou sans varicelle, a également été fréquemment rapporté pour des ESSI graves et non graves.
| Vaccins administrés | Déclarations d’ESSI graves | Déclarations d’ESSI non graves | ||
|---|---|---|---|---|
| 2015 | Moyenne 2011-2014 | 2015 | Moyenne 2011-2014 | |
| 1. Dose de rappel du vaccin DCaT | 1 | 2 | 7 | 25 |
| 2. Vaccins de série DCaT pour les nourrissons | 18 | 20 | 70 | 116 |
| 3. Hépatite B | 2 | 4 | 45 | 48 |
| 4. Virus du papillome humain (VPH) | 1 | 3 | 34 | 43 |
| 5. Grippe | 22 | 17 | 227 | 353 |
| 6. Rougeole, rubéole, oreillons, varicelle (RRO-Var et RRO+Var) |
22 | 18 | 99 | 163 |
| 7. Méningocoque | 18 | 17 | 83 | 104 |
| 8. Autres vaccins | 0 | 0 | 11 | 24 |
| 9. Pneumocoque | 29 | 25 | 145 | 190 |
| 10. Rotavirus | 9 | 8 | 26 | 29 |
| 11. Dose de rappel du vaccin dcaT | 4 | 1 | 77 | 17 |
| 12. Vaccins pour les voyageurs | 0 | 2 | 31 | 51 |
| 13. Virus varicelle-zona | 0 | 1 | 28 | 19 |
| Total | 126 | 118 | 883 | 1 240 |
Résumé
Le rapport du quatrième trimestre de 2015 est fondé sur les déclarations d’effets indésirables transmises à l’Agence par les autorités provinciales et territoriales de santé publique et le système de surveillance active dans les hôpitaux pédiatriques. L’évaluation détaillée des déclarations et des tendances de déclaration effectuée en collaboration avec les centres de liaison provinciaux et territoriaux pour l’innocuité des vaccins du Groupe de travail sur la vaccinovigilance (GTVV) et à Santé Canada, ne présente pas de signal préoccupant concernant l’innocuité des vaccins. Les tableaux et les chiffres du présent rapport fournissent un aperçu des données examinées et des déclarations d’événements indésirables au Canada.
Détails de la page
- Date de modification :