Directives supplémentaires sur la vaccination antigrippale chez les adultes de 65 ans et plus
Télécharger en format PDF
(1,32 Mo, 79 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 2024-07-25
Cat. : HP40-363/1-2024F-PDF
ISBN : 978-0-660-71466-0
Pub. : 240049
Sur cette page
- Préambule
- Résumé des informations contenues dans la présente déclaration du CCNI
- Introduction
- Méthodologie
- Épidémiologie
- Vaccin
- Données économiques
- Analyse
- Recommandations
- Priorités de recherche
- Enjeux de surveillance
- Tableaux
- Liste des abréviations
- Remerciements
- Annexe A : Terminologie clé pour comprendre les données d'évaluation économique
- Annexe B : Méthodes d'évaluation de la qualité et de la généralisabilité
- Annexe C : Résultats des autres études d'évaluation économique incluses jugées moins généralisables dans le contexte canadien
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ci-après appelée l'ASPC) des conseils continus et à jour liés à la vaccination dans le domaine de la médecine, des sciences et de la santé publique.
Outre le fardeau d'une maladie et les caractéristiques du vaccin, l'ASPC a élargi le mandat du CCNI pour inclure la prise en compte de facteurs programmatiques dans l'élaboration de recommandations fondées sur des données probantes afin de faciliter la prise de décisions opportunes concernant les programmes de vaccination financés par l'État à l'échelle provinciale et territoriale.
Les autres facteurs que le CCNI doit prendre en compte sont l'économie, l'éthique, l'équité, la faisabilité et l'acceptabilité. Au cours des prochaines années, le CCNI peaufinera ses approches méthodologiques afin d'inclure ces facteurs. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Alors que le CCNI travaille à la mise en œuvre complète de son mandat élargi, certaines déclarations incluront des analyses programmatiques à des degrés divers pour les programmes de santé publique.
L'ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont montré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Résumé des informations contenues dans la présente déclaration du CCNI
Les renseignements suivants sont destinés aux vaccinateurs. Veuillez consulter le reste de la déclaration pour plus de détails.
Quoi
Les recommandations suivantes concernant la vaccination antigrippale des adultes de 65 ans et plus complètent les recommandations générales du Comité consultatif national de l'immunisation (CCNI) en matière de vaccination antigrippale, qui figurent dans la Déclaration sur la vaccination antigrippale pour la saison. Le CCNI recommande que le vaccin inactivé contre l'influenza à haute dose (VII-HD), le vaccin inactivé contre l'influenza avec adjuvant (VII-Adj) ou le vaccin antigrippal recombinant (VAR) soient proposés, lorsqu'ils sont disponibles, avant d'autres vaccins antigrippaux pour les adultes de 65 ans et plus. Si le produit privilégié n'est pas disponible, il convient d'utiliser n'importe quel vaccin antigrippal disponible adapté à l'âge.
Qui
Les adultes de 65 ans et plus sont prioritaires pour recevoir des vaccins antigrippaux en raison des risques accrus de maladie sévère dans cette population. La présente déclaration complémentaire fournit un résumé des données probantes sur l'utilisation préférentielle de 1 ou plusieurs vaccins antigrippaux adaptés à l'âge chez les adultes de 65 ans et plus, par rapport à d'autres vaccins antigrippaux adaptés à l'âge.
Comment
Les vaccins inactivés contre l'influenza à haute dose, avec adjuvant ou recombinants devraient être proposés, lorsqu'ils sont disponibles, avant les autres vaccins antigrippaux pour les adultes de 65 ans et plus. Si le produit privilégié n'est pas disponible, il convient d'utiliser n'importe quel vaccin antigrippal disponible adapté à l'âge. La vaccination antigrippale peut être administrée en même temps qu'un autre vaccin, ou à tout moment avant ou après, y compris le vaccin contre la COVID-19.
Pourquoi
La vaccination annuelle contre la grippe est sûre et constitue le meilleur moyen de prévenir la grippe et ses complications. Les adultes de 65 ans et plus présentent un risque plus élevé de complications graves attribuables à la grippe. Le CCNI a donc entrepris une analyse des données probantes afin de déterminer si l'un ou l'autre des vaccins antigrippaux adaptés à l'âge devrait être utilisé de préférence pour ce groupe d'âge. Une analyse systématique de la littérature économique a également été entreprise afin d'éclairer la prise de décision en matière de programmes de santé publique. Dans l'ensemble, les données probantes confirment que le VII-HD, le VII-Adj et le VAR présentent des avantages accrus par rapport au VII-DS, sans différence en fait d'innocuité.
Introduction
La grippe est une infection respiratoire principalement causée par les virus de la grippe A et B. Les personnes âgées sont touchées de manière disproportionnée par les conséquences graves de l'infection grippale et peuvent présenter des symptômes typiques ou atypiques, car la grippe provoque des maladies respiratoires et systémiques. Avant la pandémie de COVID-19, on estimait que la grippe était à l'origine de 12 200 hospitalisationsNote de bas de page 1 et de 3 500 décèsNote de bas de page 2 par an au Canada, la majorité des décès survenant chez les adultes de 65 ans et plusNote de bas de page 3. Compte tenu du fardeau de la grippe dans cette population, le Comité consultatif national de l'immunisation (CCNI) a identifié les adultes de 65 ans et plus comme l'un des groupes les plus exposés aux complications de la grippe et pour lesquels la vaccination antigrippale est particulièrement importante (recommandation forte du CCNI)Note de bas de page 4.
Le CCNI a mené plusieurs études au fil des ans pour évaluer les meilleures données scientifiques et cliniques disponibles en vue de recommandations sur l'utilisation des vaccins antigrippaux, en mettant l'accent sur l'optimisation de la protection contre la grippe chez les personnes âgées au CanadaNote de bas de page 5Note de bas de page 6. Ces recommandations ont évolué au fil du temps en raison de nouveaux vaccins, dont certains sont conçus pour renforcer l'immunogénicité dans des groupes d'âge particuliers, ainsi que de l'élargissement et de l'accumulation des données sur les vaccins antigrippaux. A été publiée en mai 2018Note de bas de page 7 la dernière mise à jour de l'examen de la littérature du CCNI sur l'efficacité potentielle (EP) et l'efficacité réelle (ER) des vaccins inactivés contre l'influenza trivalents à haute dose (FluzoneMD Haute Dose) et avec l'adjuvant MF59 (FluadMD) chez les adultes de 65 ans et plus.
Les résultats de cette étude confirment les conclusions d'études précédentes et conduisent à une recommandation renforcée du CCNI en faveur de l'utilisation du vaccin antigrippal trivalent inactivé à haute dose à base d'œufs (VII3-HD) comme vaccin privilégié pour les Canadiens de 65 ans et plus. Par conséquent, au niveau individuel, le CCNI a recommandé que, pour les adultes plus âgés, le vaccin VII-HD soit utilisé plutôt que les vaccins antigrippaux inactivés à dose standard (VII-DS), compte tenu du fardeau de morbidité liée à la grippe A(H3N2) et des données probantes indiquant que le vaccin VII3-HD offre une meilleure protection que le vaccin VII3-DS chez les adultes de 65 ans et plus.
Hormis la recommandation d'utiliser les formulations VII-HD plutôt que VII-DS, le CCNI n'a pas auparavant formulé de recommandations comparatives au niveau individuel pour ce qui est de l'utilisation des autres vaccins disponibles dans ce groupe d'âge. Si le produit privilégié n'est pas disponible, il a recommandé d'utiliser n'importe lequel des vaccins antigrippaux disponibles adaptés à l'âge. Au niveau des programmes de santé publique, il a recommandé d'utiliser n'importe lequel des vaccins antigrippaux autorisés pour cette tranche d'âge, car il n'y avait pas suffisamment de données sur la valeur ajoutée des différents vaccins antigrippaux pour formuler des recommandations comparatives à ce niveau sur l'utilisation des vaccins disponibles.
Les données relatives à l'ER des vaccins chez les adultes de 65 ans et plus montrent qu'il est nécessaire de mettre au point des vaccins plus efficaces pour ce groupe d'âge. Par exemple, les personnes de 17 à 59 ans ont présenté une réponse immunitaire au vaccin antigrippal 2 à 4 fois plus élevée, mesurée par les taux de séroconversion et de séroprotection, que les personnes de 65 ans et plusNote de bas de page 8. En outre, une méta-analyse menée chez les adultes de 65 ans et plus a révélé une estimation ponctuelle plus faible de l'ER vaccinale contre la grippe confirmée en laboratoire (GCL) [ER groupée de 49 %, intervalle de confiance (IC) à 95 % : 33 à 62 %]Note de bas de page 9 par rapport à une méta-analyse chez des adultes en bonne santé de 18 à 64 ans (ER groupée de 59 %, IC à 95 % : 51 à 67 %)Note de bas de page 10.
La présente déclaration complémentaire du CCNI sur l'utilisation des vaccins antigrippaux chez les adultes de 65 ans et plus a été motivée par le souhait exprimé par les programmes provinciaux et territoriaux d'obtenir des conseils sur les choix optimaux de produits pour les personnes âgées. Compte tenu des facteurs susmentionnés, le CCNI a entrepris une analyse des données probantes afin de déterminer si 1 ou plusieurs vaccins antigrippaux adaptés à l'âge des adultes de 65 ans et plus devraient être privilégiés à d'autres vaccins antigrippaux adaptés à l'âge. Un examen systématique de la littérature économique a également été entrepris afin d'éclairer la prise de décision en matière de programmes de santé publique.
Objectif des directives
La déclaration suivante du comité consultatif sur la vaccination antigrippale chez les adultes de 65 ans et plus complète les recommandations générales du CCNI sur la vaccination antigrippale, qui figurent dans sa déclaration sur le vaccin contre la grippe saisonnière. L'objectif de cette déclaration complémentaire est de fournir des conseils actualisés sur l'utilisation du vaccin antigrippal chez les adultes de 65 ans et plus. Cette déclaration décrit le risque disproportionné de morbidité et de mortalité chez les adultes de 65 ans et plus qui contractent la grippe par rapport aux groupes d'âge plus jeunes; elle passe en revue les données disponibles sur l'EP, l'ER et l'innocuité de la vaccination antigrippale dans ce groupe d'âge; et elle explore les considérations économiques, éthiques, d'équité, de faisabilité et d'acceptabilité de la vaccination des adultes de 65 ans et plus contre la grippe.
Méthodologie
En résumé, voici les grandes étapes de la préparation d'une déclaration du comité consultatif du CCNI :
- Synthèse des connaissances : recherche et synthèse de la littérature, évaluation de la qualité des données (résumée dans le Tableau 5: Résumé des données probantes)
- Synthèse de l'ensemble des données probantes : avantages (EP et ER) et inconvénients potentiels (innocuité), en tenant compte de la qualité des données synthétisées et, le cas échéant, de l'ampleur des effets observés dans l'ensemble des études
- Utilisation d'un cadre publié, examiné par des pairs, et d'outils fondés sur des données probantes pour garantir que les questions liées à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité (EEFA) sont systématiquement évaluées et intégrées dans les directives
- Utilisation des données probantes pour formuler des recommandations
On trouvera ailleurs de plus amples renseignements sur le processus et les procédures du CCNI.
Pour la présente déclaration complémentaire, le CCNI a examiné les questions clés de l'analyse documentaire proposées par le Groupe de travail sur l'influenza, y compris des considérations telles que le fardeau du grippe à prévenir et la ou les populations cibles; l'innocuité, l'EP, l'ER, les évaluations économiques des vaccins antigrippaux; et d'autres aspects de la stratégie globale d'immunisation. Pour préparer la déclaration, le processus GRADE-ADOLOPMENT a été utilisé pour adapter les recommandations du groupe d'experts américains de l'Advisory Committee on Immunization Practices (ACIP), qui a évalué les avantages et les inconvénients relatifs du VII-HD, du VII-Adj et du VAR par rapport à un autre et par rapport au VII-DS chez les adultes de 65 ans et plusNote de bas de page 11.
L'ACIP a appliqué l'approche GRADE (Grading of Recommendations Assessment, Development, and Evaluation) pour évaluer la force et la certitude des données probantes pour les résultats critiques inclus dans son examen. Les données sur l'EP et le rapport coût/efficacité des vaccins antigrippaux chez les adultes de 65 ans et plus ont été étoffées par 2 examens systématiques supplémentaires, élaborés en collaboration avec l'équipe Methods and Applications Group for Indirect Comparisons (MAGIC) par l'intermédiaire du Réseau sur l'innocuité et l'efficacité des médicaments (RIEM) et supervisés par le Groupe de travail sur l'influenza du CCNI. Un (1) examen a porté sur l'EP des vaccins antigrippaux chez les personnes âgées, tandis que le second s'est penché sur le rapport coût/efficacité des vaccins antigrippaux saisonniers chez les personnes âgées.
L'ACIP a effectué une recherche documentaire couvrant les années de 1990 au 7 septembre 2022, afin de cibler les études admissibles sur l'EP, l'ER et l'innocuité des vaccins antigrippaux chez les personnes âgées. En outre, l'examen MAGIC du RIEM a effectué une première recherche documentaire sur l'EP du vaccin antigrippal chez les personnes âgées, couvrant la période allant de la création au 31 mars 2022, et a ensuite effectué une deuxième recherche actualisée le 20 juin 2022.
Des détails supplémentaires concernant les méthodologies employées dans les 2 examens du RIEM sont disponibles dans les protocoles écrits précitésNote de bas de page 12Note de bas de page 13.
Les données probantes et les recommandations proposées ont été présentées au CCNI pour délibération le 27 septembre 2023, puis approuvées après examen approfondi. Les considérations pertinentes, la justification des décisions particulières et les lacunes en matière de connaissances sont décrites plus avant dans les sections suivantes.
Pour une description complète de la méthodologie et des résultats des examens portant sur l'innocuité, l'EP et l'ER des vaccins antigrippaux, voir Grohskopf et al. (2022)Note de bas de page 14 et Veroniki et al. (2023)Note de bas de page 15. Les données en question sont résumées dans les sections IV.3 et IV.4 de la présente déclaration. Pour plus de détails sur la méthodologie et les résultats de l'évaluation économique des vaccins antigrippaux chez les personnes âgées, voir la section V de la déclaration.
La question politique globale abordée dans cette déclaration est : Les vaccins antigrippaux adaptés à l'âge devraient-ils être utilisés de préférence chez les adultes de 65 ans et plus? En outre, les sous-questions suivantes ont été posées :
- Les avantages et les inconvénients relatifs aux vaccins VII-HD, VII-Adj, VII-cc et VAR, comparés entre eux et avec le vaccin VII-DS, favorisent-ils l'utilisation préférentielle de l'un ou l'autre de ces vaccins par rapport à d'autres vaccins antigrippaux adaptés à l'âge chez les adultes de 65 ans et plus?
- Cette recommandation varie-t-elle en fonction des caractéristiques du vaccin (p. ex., haute dose/dose standard, trivalent/quadrivalent, avec ou sans adjuvant, fabrication à base d'œuf/sans œuf)?
- Cette recommandation varie-t-elle en fonction des groupes à risque (p. ex., les populations présentant des comorbidités, le sexe, les vaccinations antérieures, adultes de 80 ans et plus)?
La recherche documentaire et l'extraction des données ont été effectuées selon le cadre PICO (Population, Intervention, Comparateurs et Résultats) que voici :
P (Population) :
- Adultes de 65 ans et plus
I (Intervention) :
- Vaccin inactivé contre l'influenza (VII) – dose non standard (non DS) et vaccins antigrippaux recombinants :
- Vaccin inactivé contre l'influenza à haute dose (VII-HD)
- vaccin inactivé contre l'influenza avec adjuvant MF-59 (VII-Adj)
- Vaccin antigrippal recombinant (VAR)
- Vaccin à base de culture de cellules de mammifères (VII-cc)
C (comparateur) :
- Vaccins inactivés contre l'influenza à dose standard (VII-DS)
- Vaccin inactivé contre l'influenza (VII) – non DS et vaccins antigrippaux recombinants
O (Résultats) :
- EP/ER des vaccins :
- Grippe confirmée en laboratoire (GCL)
- Consultations externes/visites aux urgences (VU) associées à la grippe ou (GCL, syndrome grippal [SG])
- Hospitalisation associée à la grippe (GCL, SG)
- Évènements vasculaires associés à la grippe
- Innocuité des vaccins :
- Toute réaction indésirable systémique sollicitée de grade 3 ou plus
- Syndrome de Guillain-Barré (SGB)
- Tout évènement indésirable grave (ÉIG)
- Tout évènement indésirable (ÉI) sollicité au point d'injection de grade 3 ou plus
- Données économiques :
- Coût/efficacité du vaccin (coût par année de vie sauvée, coût par cas de grippe évité)
- Coût/utilité (coût par année de vie ajustée sur la qualité [AVAQ])
Remarque : O (Résultats) sont les résultats critiques/importants pour la prise de décision.
Abréviations : VU, visites aux urgences; SGB, syndrome de Guillain-Barré; VII, vaccin inactivé contre l'influenza; VII-Adj, vaccin inactivé contre l'influenza avec adjuvant; VII-cc, vaccin inactivé contre l'influenza à base de culture de cellules de mammifères; VII-HD, vaccin inactivé contre l'influenza à haute dose; VII-DS, vaccin inactivé contre l'influenza à dose standard; SG, syndrome grippal; GCL, grippe confirmée en laboratoire; AVAQ, année de vie ajustée sur la qualité; VAR, vaccin antigrippal recombinant; ÉIG, évènement indésirable grave.
Pour atteindre l'objectif de cette déclaration, des analyses documentaires informelles supplémentaires ont été effectuées selon le besoin, notamment :
- L'épidémiologie et le fardeau estimé de la grippe chez les adultes de 65 ans et plus
- L'EP, l'ER et l'innocuité des vaccins antigrippaux chez les personnes fragiles de 65 ans et plus
- Les lignes directrices et les considérations relatives à l'utilisation des vaccins antigrippaux chez les personnes âgées dans les provinces et territoires du Canada et dans le monde entier
Pour de plus amples informations et les recommandations actuelles du CCNI sur l'utilisation des vaccins antigrippaux chez les adultes de 65 ans et plus, voir la déclaration actuelle du CCNI sur le vaccin contre la grippe saisonnière et le chapitre sur le vaccin contre la grippe dans le Guide canadien d'immunisation (GCI).
Épidémiologie
Estimation du fardeau de la morbidité attribuable à la grippe chez les adultes de 65 ans et plus
Les adultes de 65 ans et plus représentent environ 19 % de la population canadienne, mais cette population est surreprésentée parmi les cas de GCL, en particulier au cours des saisons où la souche grippale A(H3N2) prédominait (p. ex., 2014-2015, 2016-2017, 2017-2018) avant la pandémie de COVID-19Note de bas de page 16. Bien que la morbidité et la mortalité associées à la grippe varient d'une saison à l'autre, on observe en général une augmentation des maladies sévères telles que les hospitalisations liées à la grippe, les admissions en unité de soins intensifs (USI) et les décès chez les adultes de 65 ans et plus, en particulier au cours des saisons où la grippe A(H3N2) prédomineNote de bas de page 16. Les données tirées de la base nationale d'hospitalisation du Canada ont révélé que les taux d'hospitalisation pour troubles respiratoires liés à la grippe étaient les plus élevés chez les adultes de 65 ans et plus (144,9 pour 100 000), contre 25,8 pour 100 000 chez les adultes de 45 à 64 ansNote de bas de page 17. En ce qui concerne les décès imputables à la grippe, le taux de mortalité annuel moyen pour les adultes de 65 ans et plus a été estimé à 108,8 pour 100 000, ce qui est nettement plus élevé que le taux de mortalité estimé à 4,0 pour 100 000 pour les adultes de 50 à 64 ansNote de bas de page 18.
En outre, chez les adultes de 65 ans et plus, le risque de complications liées à la grippe est significativement plus élevé avec l'augmentation de l'âge, la présence et la sévérité de maladies chroniques et un niveau de fragilisation plus élevéNote de bas de page 19Note de bas de page 20. Comme pour les cas de GCL, les adultes de 65 ans et plus avaient des taux d'hospitalisation liés à la grippe plus élevés que les groupes d'âge plus jeunes dans la plupart des années précédant la pandémie de COVID-19Note de bas de page 21. Au cours de la saison grippale 2022-2023, les adultes de 65 ans et plus présentaient le taux d'hospitalisation cumulé le plus élevé (136 pour 100 000 habitants), suivis par les enfants de moins de 5 ans (130 pour 100 000 habitants)Note de bas de page 21. Pour la saison grippale 2021-2022, relativement brève et inhabituellement tardive, le taux d'hospitalisation saisonnier était également le plus élevé chez les adultes de 65 ansNote de bas de page 22; les admissions en USI et les décès étaient les plus fréquents chez les adultes de 65 ans et plus (30 % et 59 %, respectivement)Note de bas de page 22. Les années où le virus A(H3N2) était dominant, plus de 80 % des décès associés à la grippe concernaient des adultes de 65 ans et plus (p. ex., saisons 2014-2015 et 2016-2018)Note de bas de page 23.
Couverture vaccinale contre la grippe chez les adultes de 65 ans et plus
La couverture vaccinale contre la grippe chez les adultes de 65 ans et plus au Canada est relativement élevée en général, soit environ 70 % au cours des dernières années. Durant la saison 2022-2023, la couverture dans ce groupe d'âge était de 74 %. Cependant, la couverture vaccinale n'atteint toujours pas l'objectif national de 80 % pour les personnes à haut risque de complications liées à la grippe, telles que les personnes âgéesNote de bas de page 24.
Vaccin
Préparation(s) dont l'utilisation est approuvée au Canada
Cinq (5) vaccins antigrippaux sont autorisés et disponibles au Canada pour les adultes de 65 ans et plus : VII– Adj, VII-DS, VII-HD, VAR et VII-cc.
Deux (2) vaccins inactivés contre l'influenza (VII) sont conçus spécifiquement pour améliorer l'immunogénicité chez les adultes de 65 ans et plus : VII4-HD, un vaccin à virion fragmenté inactivé quadrivalent à haute dose (FluzoneMD Haute Dose Quadrivalent, Sanofi Pasteur) et VII3-Adj, un vaccin trivalent à sous-unité inactivé avec adjuvant MF59 (FluadMD, Seqirus).
FluzoneMD Haute Dose contient 60 µg d'hémagglutinine (HA) par souche (contre 15 µg HA par souche dans une dose standard)Note de bas de page 25. FluzoneMD Haute Dose Quadrivalent, dont l'utilisation sera autorisée au Canada en 2020, est actuellement le seul vaccin antigrippal inactivé à virion fragmenté à haute dose disponible au CanadaNote de bas de page 4Note de bas de page 26. Un examen de la littérature sur l'EP, l'ER, l'immunogénicité et l'innocuité des vaccins contre la grippe saisonnière à haute dose, y compris FluzoneMD Haute Dose, pour les adultes de 65 ans et plus a été réalisée en 2016Note de bas de page 6 dans le cadre du processus du CCNI basé sur les données probantesNote de bas de page 27 pour contribuer à l'inclusion de FluzoneMD Haute Dose dans la déclaration sur le vaccin contre la grippe saisonnière pour 2016-2017Note de bas de page 25.
FluadMD est un vaccin à sous-unité inactivé à dose standard contenant l'adjuvant MF59, qui est une émulsion huile dans l'eau composée de squalène comme phase huileuse et stabilisée avec les agents de surface polysorbate 80 et triolate de sorbitan dans un tampon au citrateNote de bas de page 28. FluadMD et sa formulation pédiatrique (Fluad PediatricMD, Seqirus) sont les seuls vaccins contre la grippe saisonnière disponibles au Canada avec un adjuvant. Les données probantes sur l'EP, l'ER, l'immunogénicité et l'innocuité de FluadMD ont été examinées pour la première fois en 2011Note de bas de page 5 afin de contribuer à l'inclusion de FluadMD dans la déclaration sur la grippe saisonnière pour 2011-2012Note de bas de page 29, et ont ensuite été complétées par des données probantes supplémentaires sur l'ER dans la déclaration sur la grippe saisonnière pour 2014-2015Note de bas de page 30.
Tous les vaccins inactivés contre l'influenza (VII) disponibles au Canada sont produits dans des œufs, à l'exception de Flucelvax Quad (VII4-cc), qui est un vaccin grippal quadrivalent à sous-unité inactivé à base de cc de mammifères, préparé à partir de virus propagés dans des lignées cellulaires de mammifères [lignées cellulaires exclusives 33016-PF Madin-Darby Canine Kidney (MDCK)] adaptées pour se développer librement en suspension dans un milieu de culture.
Il n'y a actuellement qu'un (1) seul VAR dont l'utilisation est autorisée au Canada : Supemtek (VAR4), un vaccin quadrivalent contre la grippe saisonnière, sans adjuvant, exprimé par un baculovirus, qui contient 45 µg d'HA par souche (contre 15 µg d'HA par souche dans une dose standard) et qui est autorisé pour les adultes de 18 ans et plus. Le VAR contient des HA recombinantes produites dans une lignée cellulaire d'insecte à l'aide de séquences génétiques provenant de virus grippaux dérivés de cellules. La production de VAR ne dépend pas de l'approvisionnement en œufs.
Pour une description complète des vaccins disponibles au Canada, voir la déclaration annuelle du CCNI sur le vaccin contre la grippe saisonnière.
Administration concomitante avec d'autres vaccins
La déclaration annuelle du CCNI sur le vaccin contre la grippe saisonnière contient une description complète de l'administration concomitante de vaccins antigrippaux avec d'autres vaccins. En bref, tous les vaccins contre la grippe saisonnière peuvent être administrés en même temps que l'administration d'autres vaccins, ou à tout moment avant ou après, y compris un vaccin contre la COVID-19 et les vaccins antipneumococciques.
Les données sont limitées en ce qui concerne l'administration concomitante de nouveaux vaccins antigrippaux avec adjuvant et d'autres vaccins (avec ou sans adjuvant) recombinants contre le zona (VRZ) [ShingrixMD, GlaxoSmithKline] dont l'utilisation est autorisée au Canada chez les adultes de 50 ans et plus. Il en est de même chez les adultes de 18 ans et plus qui sont ou seront exposés à un risque accru de zona en raison d'une immunodéficience ou d'une immunosuppression causée par une maladie ou un traitement connus. Le VRZ s'est avéré sûr et efficace lorsqu'il est administré en même temps que des vaccins antigrippaux sans adjuvant à dose standardNote de bas de page 31. Aucune étude n'a évalué l'administration concomitante du VRZ avec un vaccin antigrippal adjuvanté ou à haute doseNote de bas de page 32; le VRZ et le VII-Adj contiennent respectivement les adjuvants AS01B et MF59. On ne sait pas comment ces adjuvants peuvent interagir lorsque le VRZ et le VII-Adj sont administrés simultanément.
Les données sont limitées en ce qui concerne l'administration concomitante de nouveaux vaccins antigrippaux avec adjuvant et d'autres vaccins (avec ou sans adjuvant) recombinants contre le zona (VRZ) [ShingrixMD, GlaxoSmithKline] dont l'utilisation est autorisée au Canada chez les adultes de 50 ans et plus. Il en est de même chez les adultes de 18 ans et plus qui sont ou seront exposés à un risque accru de zona en raison d'une immunodéficience ou d'une immunosuppression causée par une maladie ou un traitement connus. Le VRZ s'est avéré sûr et efficace lorsqu'il est administré en même temps que des vaccins antigrippaux sans adjuvant à dose standardNote de bas de page 31. Aucune étude n'a évalué l'administration concomitante du VRZ avec un vaccin antigrippal adjuvanté ou à haute doseNote de bas de page 32; le VRZ et le VII-Adj contiennent respectivement les adjuvants AS01B et MF59. On ne sait pas comment ces adjuvants peuvent interagir lorsque le VRZ et le VII-Adj sont administrés simultanément.
Le CCNI continuera à examiner les données probantes et à mettre à jour ses directives en conséquence.
Efficacité potentielle et efficacité réelle
Pour répondre à la question liée à la politique posée dans cette déclaration, ont été présentés dans le résumé les résultats des examens MAGIC de l'ACIP et du RIEM évaluant les avantages et les inconvénients relatifs du VII-HD, du VII-Adj, du VII-cc et du VAR, comparés les uns aux autres et au VII-DS. Fait à noter, l'équipe MAGIC du RIEM a réalisé une méta-analyse en réseau (MAR) pour évaluer l'EP des vaccins antigrippaux chez les adultes de 65 ans et plus. Toutefois, en raison des difficultés d'interprétation des résultats de la MAR dues à la présence de réseaux épars et déconnectés, et des défis posés par la comparaison de l'EP contre la grippe au cours de différentes saisons, seuls les résultats de la méta-analyse par paire et de l'étude unique ont été présentés dans le résumé narratif. Pour de plus amples renseignements, voir la publication originale de Veroniki et al. (2023)Note de bas de page 15.
Les examens MAGIC de l'ACIP et du RIEM ont évalué les articles en utilisant les outils de risque de biais de Cochrane. Les limites des études des articles inclus dans la synthèse des données sont indiquées dans le Tableau 6.
De façon générale, dans l'examen de l'ACIP, la certitude des données concernant les résultats relatifs à l'EP et l'ER des vaccins a été jugée de faible à très faible, principalement en raison d'études randomisées limitées. Pour plus de détails concernant le résumé des résultats et les évaluations de la qualité des données, se référer à GRADE : Vaccins antigrippaux à plus haute dose et avec adjuvant pour personnes de 65 ans et plus (en anglais seulement) et au Cadre des données probantes pour les recommandations : Vaccins antigrippaux à plus haute dose et avec adjuvant pour personnes de 65 ans et plus (en anglais seulement).
Dans l'examen MAGIC du RIEM, la certitude des données des estimations de la MAR a été évaluée à l'aide de l'approche CINeMA (Confiance dans la méta-analyse en réseau), et la confiance dans les estimations par paire pour lesquelles une MAR n'a pas pu être réalisée a été évaluée à l'aide de l'approche GRADE (c.-à-d. VII-HD contre VII-DS). Le degré de certitude des données GRADE concernant les résultats relatifs à l'EP vaccinale du VII-HD par rapport au VII-DS a été jugé de faible à élevé, principalement en raison de l'imprécision et du risque de biais. Pour plus de détails concernant l'évaluation GRADE et de documents supplémentaires pour les évaluations de la qualité des données qui ont été réalisées, voir la publication originale de Veroniki et al. (2023)Note de bas de page 15 et la page Web du cadre (en anglais seulement).
À noter que les analyses sur l'EP et l'ER des vaccins ont été menées sur l'ensemble de la population des adultes de 65 ans et plus, et non par groupe de risque (p. ex., la population présentant des comorbidités, le sexe, les vaccinations antérieures et les adultes de 80 ans et plus) en raison de la limitation des données, y compris le nombre d'études rapportant chaque résultat.
Efficacité potentielle et efficacité réelle des vaccins antigrippaux recombinants et adjuvantés à haute dose par rapport aux vaccins antigrippaux inactivés à dose standard
Résumé des caractéristiques des études
Dans l'ensemble, l'examen de l'ACIP a répertorié 31 études [9 ECRNote de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 36Note de bas de page 37Note de bas de page 38Note de bas de page 39Note de bas de page 40Note de bas de page 41, dont 2 en grappesNote de bas de page 40Note de bas de page 41, et 22 études d'observationNote de bas de page 42Note de bas de page 43Note de bas de page 44Note de bas de page 45Note de bas de page 46Note de bas de page 47Note de bas de page 48Note de bas de page 49Note de bas de page 50Note de bas de page 51Note de bas de page 52Note de bas de page 53Note de bas de page 54Note de bas de page 55Note de bas de page 56Note de bas de page 57Note de bas de page 58Note de bas de page 59Note de bas de page 60Note de bas de page 61Note de bas de page 62Note de bas de page 63] rapportant des données sur l'EP et l'ER du vaccin antigrippal chez les adultes de 65 ans et plus. L'examen systémique qui en a découlé a fourni des données sur la grippe (n=4) définie comme une GCL ou un SG sans confirmation en laboratoire de l'étiologie virale, sur les consultations externes et/ou les VU associées à la grippe (n=8), sur les hospitalisations associées à la grippe (n=21) et sur les décès associés à la grippe (n=2).
L'examen systématique MAGIC du RIEM n'a pris en compte que les essais contrôlés randomisés (ECR), mais a repéré 10 études rapportant des données sur l'EP du vaccin antigrippal comparant le VII-HD, le VII-Adj et le VAR au VII-DS chez les adultes de 65 ans et plusNote de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 64Note de bas de page 65Note de bas de page 66Note de bas de page 67Note de bas de page 68Note de bas de page 69Note de bas de page 70. Il a fourni des données sur la GCL (n=5), le SG sans confirmation en laboratoire de l'étiologie virale (n=5), les consultations externes liées à la grippe (n=1), les hospitalisations liées à la grippe (n=4), les décès liés à la grippe (n=1) et les évènements vasculaires liés à la grippe (n=7).
Résumé de l'efficacité potentielle/réelle contre la grippe
Dans l'ensemble, l'examen de l'ACIP comprenait 4 ECR portant sur la grippe chez les adultes de 65 ans et plus. Parmi ceux-ci, 1 ECR a comparé le VII3-HD au VII3-DS contre la GCLNote de bas de page 33, 1 autre a comparé le VII3-Adj au VII3-DS contre le SGNote de bas de page 35 et 2 ECR ont comparé le VAR au VII-DS par rapport à la GCLNote de bas de page 34Note de bas de page 36. L'examen MAGIC du RIEM comprenait 4 ECR présentant des données comparant le VII-HD au VII-DS par rapport à la GCL (n=3)Note de bas de page 33Note de bas de page 64Note de bas de page 65 et au SG (n=3)Note de bas de page 33Note de bas de page 65Note de bas de page 66, ainsi que 2 ECR comparant le VAR4 au VII-DS par rapport à la GCL et au SGNote de bas de page 34Note de bas de page 71 chez les adultes de 65 ans et plus.
Les examens MAGIC de l'ACIP et du RIEM ont tous 2 montré que le VII-HD était associé à une EP vaccinale relative d'environ 25 % par rapport au VII-DS contre la GCL. Celui de l'ACIP a utilisé les données de 1 ECR de DiazGranados 2014Note de bas de page 33, tandis que l'examen MAGIC du RIEM a regroupé les estimations de 3 ECR, y compris l'ECR de DiazGranados 2014Note de bas de page 33Note de bas de page 64Note de bas de page 65, les 2 groupes ayant démontré les effets bénéfiques du VII-HD par rapport au VII-DS. L'ACIP a rapporté une EP vaccinale relative de 18 % (IC à 95 % : -17 à 43 %) par rapport à la GCL en combinant 2 ECRNote de bas de page 34Note de bas de page 36 comparant le VAR au VII-DS. L'examen MAGIC du RIEM a observé un effet protecteur bénéfique potentiel du VAR4 par rapport au VII-DS par rapport à la GCL, en combinant 2 ECR, bien que l'estimation manque de précision (EP vaccinale relative regroupée de 30 %, IC à 95 % : -18 à 58 %)Note de bas de page 34Note de bas de page 71.
L'ACIP n'a signalé aucune différence d'EP entre le VII3-Adj et le VII-DS par rapport au SG à partir de 1 ECR (EP vaccinale relative de -3 %, IC à 95 % : -19 à 11 %)Note de bas de page 35. Enfin, l'examen MAGIC du RIEM n'a pas décelé de différence entre le VII3-HD (EP vaccinale relative regroupée de 2 %, IC à 95 % : -2 à 7 %)Note de bas de page 33Note de bas de page 64Note de bas de page 66, le VAR (EP vaccinale relative de 1 %, IC à 95 % : -9 à 11 %, et 4 %, IC à 95 % : -65 à 45 %)Note de bas de page 34Note de bas de page 71, et le VII-Adj (EP vaccinale relative de -3 %, IC à 95 % : -21 à 13 %)Note de bas de page 35 par rapport au VII-DS pour la prévention du SG sans confirmation en laboratoire d'une étiologie virale.
Résumé de l'efficacité potentielle/réelle du vaccin par rapport aux consultations externes et/ou aux visites aux urgences associées à la grippe
Dans l'ensemble, l'examen de l'ACIP comprenait 8 études d'observation rapportant des données sur les consultations externes et/ou les VU associées à la grippe, définies par un diagnostic clinique. Parmi celles-ci, 5 comparaient le VII3-HD au VII-DSNote de bas de page 43Note de bas de page 44Note de bas de page 45Note de bas de page 46Note de bas de page 47, et 4 comparaient le VII3-Adj au VII-DSNote de bas de page 42Note de bas de page 45Note de bas de page 48Note de bas de page 49. L'examen MAGIC du RIEM comprenait 1 ECR comparant le VII-HD au VII-DS contre les consultations externes associées à la grippe et définies par un diagnostic cliniqueNote de bas de page 64.
D'après l'examen de l'ACIP, les résultats regroupés de 4 études de cohortes rétrospectives ont démontré un effet bénéfique du VII-HD par rapport au VII-DS, avec une efficacité vaccinale relative (EVR) de 13 % (IC à 95 % : 1 à 24 %)Note de bas de page 44Note de bas de page 45Note de bas de page 46Note de bas de page 47. Ils ont également repéré 1 étude de cas-témoins test-négative comparant le VII-HD au VII-DS, qui a révélé 1 EVR de 9 % (IC à 95 % : -12 à 27 %)Note de bas de page 43. L'examen MAGIC du RIEM n'a pas trouvé de différence entre le VII3-HD et le VII3-DS pour la prévention des consultations externes visant le SG dans 1 ECR (EVR de 3 %, IC à 95 % : -14 à 18 %)Note de bas de page 64.
Les preuves comparant le VII-Adj au VII-DS par rapport aux consultations externes et/ou aux VU pour le SG de l'examen de l'ACIP n'étaient pas cohérentes. Les données issues de 2 études d'observation ont indiqué un effet protecteur bénéfique du VII-Adj par rapport au VII-DS (EVR groupée de 36 %, IC à 95 % : 21 à 48 %)Note de bas de page 42Note de bas de page 48. Cependant, les données issues de 2 études de cohortes rétrospectives n'ont pas permis de trouver une différence entre le VII-Adj et le VII-DS pour la prévention des consultations externes et/ou des VU en raison du SG (EVR groupée de 0 %, IC à 95 % : -3 à 3 %)Note de bas de page 45Note de bas de page 49.
Résumé de l'efficacité potentielle/réelle contre la grippe par rapport aux hospitalisations liées à la grippe
Dans l'ensemble, l'examen de l'ACIP a inclus 4 ECRNote de bas de page 38Note de bas de page 39Note de bas de page 40Note de bas de page 72 et 15 études d'observationNote de bas de page 45Note de bas de page 47Note de bas de page 50Note de bas de page 51Note de bas de page 52Note de bas de page 53Note de bas de page 54Note de bas de page 55Note de bas de page 56Note de bas de page 57Note de bas de page 58Note de bas de page 59Note de bas de page 60Note de bas de page 61Note de bas de page 62 rapportant des données sur l'hospitalisation associée à la grippe, y compris des définitions de cas confirmés en laboratoire, de cas basés sur des codes et de cas cliniques. Parmi ceux-ci, 13 ont comparé le VII3-HD au VII-DSNote de bas de page 38Note de bas de page 39Note de bas de page 40Note de bas de page 45Note de bas de page 47Note de bas de page 50Note de bas de page 51Note de bas de page 52Note de bas de page 53Note de bas de page 54Note de bas de page 55Note de bas de page 56Note de bas de page 57, 7 ont comparé le VII3-Adj au VII-DSNote de bas de page 45Note de bas de page 51Note de bas de page 58Note de bas de page 59Note de bas de page 60Note de bas de page 61Note de bas de page 72, et 1 a comparé le VAR au VII-DSNote de bas de page 51. L'examen MAGIC du RIEM comprenait 3 ECRNote de bas de page 33Note de bas de page 64Note de bas de page 66 comparant le VII-HD au VII-DS et 1 comparant le VAR au VII-DSNote de bas de page 34 par rapport à l'hospitalisation pour le SG (n=2) et la GCL (n=3).
Dans l'étude de l'ACIP, la plupart des données étaient disponibles pour les hospitalisations dues à la grippe parmi tous les résultats examinés. Ces données ont mis en évidence des effets protecteurs bénéfiques pour le VII-HD, le VII-Adj et le VAR par rapport au VII-DS, bien que la profondeur des données ait varié : la plupart des données concernaient le VII-HD (n=13), moins pour le VII-Adj (n=7), et le moins pour le VAR (n=1). L'examen MAGIC du RIEM a également démontré un effet protecteur bénéfique du VII-HD par rapport au VII-DS contre l'hospitalisation pour le SG (EVR regroupée de 28 %, IC à 95 % : 8 à 43 %)Note de bas de page 33Note de bas de page 64. Données en faveur du VII-HD (EVR de 40 %, IC à 95 % : -65 à 78 %, et 0 %, IC à 95 % : -1 570 à 94 %)Note de bas de page 33Note de bas de page 66 et le VAR (EVR de 67 %, IC à 95 % : -221 à 96 %)Note de bas de page 34 par rapport au VII-DS contre l'hospitalisation pour la GCL n'était disponible que dans une (1) seule étude de l'examen MAGIC du RIEM et n'a pas démontré d'effets protecteurs car les estimations étaient imprécises avec un large IC.
Résumé de l'efficacité potentielle/efficacité réelle du vaccin par rapport aux décès associés à la grippe
Globalement, l'examen de l'ACIP comportait 2 études de cohortes rétrospectivesNote de bas de page 46Note de bas de page 59 comparant le VII3-HD au VII-DS, et l'examen MAGIC du RIEM comportait 1 ECR comparant le VII-Adj au VII-DS par rapport aux décès associés à la grippe définis par les codes de diagnostic cliniqueNote de bas de page 35.
L'ACIP a mis en évidence un effet protecteur bénéfique du VII3-HD par rapport au VII-DS pour ce qui est des décès associés à la grippe (EVR groupée de 31 %, IC à 95 % : 16 à 43 %)Note de bas de page 46Note de bas de page 59. L'examen MAGIC du RIEM a repéré une (1) étude faisant état d'une estimation ponctuelle de la diminution du nombre de décès liés à la grippe pour le VII3-Adj par rapport au VII3-DS, bien que l'effet soit très imprécis et que les IC soient larges (EP vaccinale de 25 %, IC à 95 % : -236 à 83 %)Note de bas de page 35.
Résumé de l'efficacité potentielle/réelle contre la grippe par rapport aux évènements vasculaires
Les données sur les évènements vasculaires associés à la grippe, qui comprennent diverses conséquences cardiovasculaires associées à l'infection grippale, telles que définies par l'étude individuelle (p. ex., infarctus du myocarde, insuffisance cardiaque, accident vasculaire cérébral, etc.) n'était disponible que dans l'examen MAGIC du RIEM. Dans l'ensemble, les chercheurs ont inclus 7 ECR rapportant des données sur les évènements vasculairesNote de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 64Note de bas de page 67Note de bas de page 68Note de bas de page 73. Parmi ces études, 4 ont comparé le VII3-HD au VII-DSNote de bas de page 33Note de bas de page 64Note de bas de page 68Note de bas de page 73, 2 ont comparé le VII3-Adj au VII-DSNote de bas de page 35Note de bas de page 67, et 1 a comparé le VAR au VII-DSNote de bas de page 34. Les 3 VII-HD (ratio des taux [RT] groupé de 0,75; IC à 95 % : 0,43 à 1,29 %), le VII-Adj (RT groupé de 0,83, IC à 95 % : 0,54 à 1,27 %) et le VAR (rapport de cotes [RC] de 0,89, IC à 95 % : 0,30 à 2,60 %) ont été associés à un nombre inférieur d'évènements vasculaires par rapport au VII-DS, bien que les associations n'aient pas été statistiquement significatives avec des IC larges.
Efficacité potentielle/réelle des vaccins antigrippaux recombinants et adjuvantés à haute dose comparés les uns aux autres
Résumé des caractéristiques des études
L'examen systématique de l'ACIP a recensé 7 études (1 ECR et 6 études d'observation) qui ont évalué l'EP et l'ER du VII-HD, du VII-Adj et du VAR l'un par rapport à l'autre. Parmi ces études, 2 ont rapporté des données comparant le VII3-Adj au VAR4Note de bas de page 37Note de bas de page 51, 7 ont rapporté des données comparant le VII3-HD au VII3-AdjNote de bas de page 37Note de bas de page 45Note de bas de page 49Note de bas de page 50Note de bas de page 51Note de bas de page 62Note de bas de page 63 et 2 ont rapporté des données comparant le VII3-HD au VAR4Note de bas de page 37Note de bas de page 51. L'examen systémique a fourni des données sur la GCL (n=1), les consultations externes et/ou les VU associées à la grippe (n=3) et les hospitalisations associées à la grippe (n=4).
L'examen MAGIC du RIEM a recensé 2 ECR portant sur l'EP du VII-HD, du VII-Adj et du VAR l'un par rapport à l'autre par rapport à la GCL. Parmi ces études, une (1) a rapporté des données comparant le VII3-HD au VII3-Adj et au VAR4Note de bas de page 37, et une (1) autre a rapporté des données comparant le VII3-HD au VII3-AdjNote de bas de page 74.
Aucune étude n'a été recensée pour comparer l'EP et l'ER de ces vaccins les uns aux autres par rapport aux décès et aux évènements vasculaires associés à la grippe. Peu d'études ont rapporté des données comparant l'EP et l'ER du VII-HD, du VII-Adj et du VAR les uns par rapport aux autres, ce qui limite la généralisation des résultats à toutes les saisons grippales ou à la plupart d'entre elles.
Résumé de l'efficacité potentielle/réelle du vaccin par rapport à la grippe confirmée en laboratoire
L'examen systématique de l'ACIP a recensé 1 seul ECR comparant l'EP du VII-HD à celle du VII-Adj (EVR de 66 %, IC à 95 % : -213 à 96 %), le VII-HD par rapport au VAR (EVR de 74 %, IC 95 % : -118 à 97 %) et le VII-Adj par rapport au VAR (EVR de 25 %, IC 95 % : -207 à 82 %) contre la GCLNote de bas de page 37. Néanmoins, l'étude n'a pas démontré d'effet protecteur bénéfique associé au VII-HD, au VII-Adj ou au VAR par rapport à l'un ou l'autre, en raison de l'imprécision importante associée à ces estimations d'EP potentielle.
L'examen MAGIC du RIEM a recensé 2 ECR comparant le VII-HD au VII-Adj (EVR de -210 %, IC à 95 % : -3 080 à 70 %), le VAR à VII-Adj (EVR de 28 %, IC 95 % : -254 à 85 %), et le VAR au VII-HD (EVR de 77 %, IC à 95 % : -121 à 98 %) par rapport à la GCLNote de bas de page 37Note de bas de page 74. Comme dans l'examen de l'ACIP, les études n'ont pas démontré d'effet protecteur bénéfique par rapport à la GCL associé au VII-HD, au VII-Adj ou au VAR, en raison des larges IC associés aux estimations de l'EP vaccinale.
Résumé de l'efficacité potentielle/réelle du vaccin par rapport aux consultations externes et/ou aux visites aux urgences associées à la grippe
L'examen de l'ACIP a porté sur 3 études de cohortes rétrospectives comparant le VII3-HD au VII3-Adj contre les consultations externes et/ou les VU associées à la grippe, définies à l'aide des codes de diagnostic et de procédure associés à une prescription d'un agent antiviral (c.-à-d. oseltamivir)Note de bas de page 45Note de bas de page 49Note de bas de page 63. La méta-analyse portant sur ces études n'a pas mis en évidence d'effet protecteur bénéfique contre les consultations externes et/ou les VU associées à la grippe avec le VII-HD par rapport au VII-Adj (EVR groupée de -6 %, IC à 95 % : -23 à 8 %).
L'examen MAGIC du RIEM n'a pas recensé d'ECR rapportant des données sur les consultations externes associées à la grippe et comparant le VII-HD, le VII-Adj et le VAR entre eux.
Résumé de l'efficacité potentielle/réelle contre la grippe par rapport aux hospitalisations liées à la grippe
L'examen de l'ACIP a permis d'identifier 4 études de cohortes rétrospectives présentant des données sur les hospitalisations associées à la grippe, définies par des codes de diagnostic clinique, comparant le VII3-HD au VII3-Adj (n=4)Note de bas de page 45Note de bas de page 50Note de bas de page 51Note de bas de page 62, le VII3-HD au VAR4 (n=1)Note de bas de page 51 et le VII3-Adj au VAR4 (n=1)Note de bas de page 51. Toutes ces études ont évalué les hospitalisations liées à la grippe à l'aide de codes de diagnostic. L'examen MAGIC du RIEM n'a pas recensé d'ECR rapportant des données sur les hospitalisations associées à la grippe et comparant le VII-HD, le VII-Adj et le VAR entre eux.
Une (1) étude de cohorte rétrospective a démontré un bénéfice relatif du VAR par rapport au VII-HD et au VII-Adj contre les hospitalisations associées à la grippe pendant la saison grippale 2019-20Note de bas de page 51. Une méta-analyse de 4 études d'observation menées sur 4 saisons grippales n'a pas trouvé de différence entre le VII3-HD et le VII3-Adj contre l'hospitalisation associée à la grippe (EVR de 4 %, IC à 95 % : -1 à 10 %)Note de bas de page 45Note de bas de page 50Note de bas de page 51Note de bas de page 62.
Innocuité des vaccins
Les résultats en matière d'innocuité évalués dans l'examen systématique menée par l'ACIP ont été jugés faibles à très faibles et la plupart ont été déclassés pour cause d'imprécision en raison du faible nombre d'évènements, de la petite taille de l'échantillon et des larges IC autour de l'estimation de l'effetNote de bas de page 14. Pour plus de détails concernant le résumé des résultats et les évaluations de la qualité des données, se référer à GRADE :Vaccins antigrippaux à dose plus élevée et avec adjuvant pour les personnes âgées de 65 ans et plus (en anglais seulement) et au Cadre des données probantes pour les recommandations :Vaccins antigrippaux à dose plus élevée et avec adjuvant pour les personnes de 65 ans et plus (en anglais seulement).
À noter que les analyses de sous-groupes sur l'innocuité des vaccins ont été menées sur l'ensemble de la population des adultes de 65 ans et plus, et non par groupes de risque (p. ex., la population présentant des comorbidités, le sexe, les vaccinations antérieures, et les adultes de 80 ans et plus) en raison des limitations des données, y compris le nombre d'études rapportant chaque résultat.
Innocuité des vaccins antigrippaux recombinants et adjuvantés à haute dose par rapport aux vaccins antigrippaux inactivés à dose standard
Résumé des caractéristiques des études
L'examen systématique de l'ACIP a porté sur 23 ECRNote de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 36Note de bas de page 39Note de bas de page 67Note de bas de page 68Note de bas de page 71Note de bas de page 73Note de bas de page 75Note de bas de page 76Note de bas de page 77Note de bas de page 78Note de bas de page 79Note de bas de page 80Note de bas de page 81Note de bas de page 82Note de bas de page 83Note de bas de page 84Note de bas de page 85Note de bas de page 86Note de bas de page 87Note de bas de page 88 et une (1) étude de cohorte rétrospectiveNote de bas de page 89 qui ont fait état de données d'innocuité comparant le VII-HD, le VII-Adj et le VAR au VII-DS chez des adultes de 65 ans et plus. Parmi ces études, 8 ont comparé le VII-HD au VII-DSNote de bas de page 33Note de bas de page 36Note de bas de page 39Note de bas de page 68Note de bas de page 73Note de bas de page 78Note de bas de page 86Note de bas de page 87, 12 ont comparé le VII-Adj au VII-DSNote de bas de page 35Note de bas de page 67Note de bas de page 71Note de bas de page 75Note de bas de page 79Note de bas de page 80Note de bas de page 81Note de bas de page 82Note de bas de page 85Note de bas de page 87Note de bas de page 88Note de bas de page 89, et 7 ont comparé le VAR au VII-DSNote de bas de page 34Note de bas de page 71Note de bas de page 76Note de bas de page 77Note de bas de page 83Note de bas de page 84Note de bas de page 87. L'examen a fourni des données sur tout évènement systémique sollicité de grade 3 ou plus (n=7), le SGB (n=4), tout ÉIG (n=18) et tout évènement sollicité au point d'injection de grade 3 ou plus (n=6).
Résumé de l'innocuité des vaccins
Tout évènement systémique sollicité de grade 3 ou plus après l'immunisation
L'examen de l'ACIP a recensé 7 ECR ayant fourni des données sur les ÉI systémiques sollicités de grade 3 ou plus comparant le VII3-HD (n=3)Note de bas de page 36Note de bas de page 86Note de bas de page 87, le VII3-Adj (n=5)Note de bas de page 67Note de bas de page 71Note de bas de page 75Note de bas de page 87Note de bas de page 88 ou le VAR3 (n=1)Note de bas de page 87 au VII-DS chez des adultes de 65 ans et plus. Ensemble, ces études ont montré que le VII3-HD, le VII3-Adj et le VAR3 peuvent conduire à une diminution des ÉI systémiques sollicités de grade 3 ou plus par rapport au VII-DS, bien que toutes les estimations manquent de précision (ratio de risque [RR] regroupé de 0,95, IC à 95 % : 0,20 à 4,53 %; RR de 0,77, IC à 95 % : 0,34 à 1,76 %; et RR de 0,28, IC à 95 % : 0,05 à 1,67 %, respectivement).
Syndrome de Guillain-Barré
L'examen de l'ACIP comportait 2 ECRNote de bas de page 35Note de bas de page 39 et 2 études observationnellesNote de bas de page 77Note de bas de page 89 rapportant des données sur le SGB comparant le VII3-HD, le VII3-Adj ou le VAR3 au VII-DS. Un (1) ECR comparant le VII3-HD (n=2 606) au VII-DS (n=2 604) n'a recensé aucun cas de SGB parmi les 5 210 personnes vaccinéesNote de bas de page 39. Un (1) ECR a mis en évidence une diminution non significative du risque de SGB avec le VII3-Adj par rapport au VII-DS (RR de 0,33, IC à 95 % : 0,01 à 8,16 %)Note de bas de page 35. Une (1) étude observationnelle comparant le VII3-Adj (n=88 449) au VII-DS (n=82 539) n'a recensé aucun cas de SGB parmi les 170 988 personnes vaccinéesNote de bas de page 89. Une autre étude d'observation comparant le VAR3 au VII3-DS a recensé 4 cas de SGB parmi les 283 683 receveurs du VII3-DS et aucun parmi les 21 976 receveurs du VAR3Note de bas de page 77. Il convient de noter que le SGB étant très rare dans la population générale, on ne s'attend pas à ce que des études de cette taille soient suffisamment puissantes pour détecter une différence dans le risque de SGB entre les groupes.
Tout évènement indésirable grave survenu après la vaccination
L'examen de l'ACIP a recensé 18 ECR ayant fourni des données sur tout ÉIG et comparant le VII3-HD (n=7)Note de bas de page 33Note de bas de page 36Note de bas de page 39Note de bas de page 68Note de bas de page 73Note de bas de page 78Note de bas de page 87, le VII3-Adj (n=8)Note de bas de page 35Note de bas de page 67Note de bas de page 79Note de bas de page 80Note de bas de page 81Note de bas de page 82Note de bas de page 85Note de bas de page 87 ou le VAR3 (n=5)Note de bas de page 34Note de bas de page 71Note de bas de page 83Note de bas de page 84Note de bas de page 87 au VII-DS chez des adultes de 65 ans et plus. Une méta-analyse de 7 ECR a montré que le VII-HD était associé à un risque plus faible d'ÉIG que le VII-DS (RR groupé de 0,91; IC à 95 % : 0,85 à 0,97 %). Aucune différence n'a été observée dans les ÉIG avec le VII-Adj et le VAR par rapport au VII-DS, bien que les estimations manquent de précision (RR groupé de 1,07; IC à 95 % : 0,92 à 1,26 % et 1,03; IC à 95 % : 0,84 à 1,26 %, respectivement).
Tout évènement sollicité au point d'injection de grade 3 ou plus après la vaccination
L'examen de l'ACIP a porté sur 6 ECR faisant état d'évènements sollicités au point d'injection de grade 3 ou plus, comparant le VII3-HD, le VII3-Adj ou le VAR au VII-DS chez des adultes de 65 ans et plusNote de bas de page 36Note de bas de page 67Note de bas de page 71Note de bas de page 85Note de bas de page 87Note de bas de page 88. Une méta-analyse de 4 ECR a montré que le VII3-Adj entraînait une augmentation d'évènements de réactogénicité par rapport au VII-DS (RR groupé de 3,39; IC à 95 % : 1,32 à 8,72 %)Note de bas de page 67Note de bas de page 85Note de bas de page 87Note de bas de page 88. De même, une méta-analyse de 2 ECR a montré que le VII3-HD pouvait entraîner une augmentation d'évènements de réactogénicité par rapport au VII-DS, bien que l'estimation manque de précision (RR regroupé de 5,03; IC à 95 % : 0,88 à 28,74 %)Note de bas de page 36Note de bas de page 87. Inversement, les résultats suggèrent que le VAR peut conduire à une diminution d'évènements sollicités au niveau des points d'injection de grade 3 ou plus par rapport au VII-DS, mais les estimations manquent également de précision (RR regroupé de 0,67; IC à 95 % : 0,27 à 1,69 %)Note de bas de page 71Note de bas de page 87.
Innocuité des vaccins antigrippaux recombinants et avec adjuvant à haute dose comparés les uns aux autres
Résumé des caractéristiques des études
L'examen de l'ACIP a porté sur trois ECR présentant des données d'innocuité comparant le VII3-HD, le VII3-Adj et le VAR4 l'un à l'autreNote de bas de page 76Note de bas de page 87Note de bas de page 90. Deux (2) d'entre eux ont comparé le VII3-HD au VII3-AdjNote de bas de page 76Note de bas de page 87, 2 ont comparé le VII3-HD au VAR4Note de bas de page 87Note de bas de page 90 et 1 a comparé le VAR4 au VII3-AdjNote de bas de page 87. L'examen systématique a fourni des données sur tout ÉI sollicité de grade 3 ou plus (n=3), tout ÉIG (n=3) et tout évènement sollicité au point d'injection de grade 3 ou plus (n=3). Aucune étude comparant le VII3-HD, le VII3-Adj et le VAR4 entre eux avec des données sur le SGB n'a été recensée dans cet examen.
Résumé des données d'innocuité des vaccins
Tout ÉI systémique sollicité de grade 3 ou plus après l'immunisation
L'examen de l'ACIP a porté sur 3 ECR présentant des données sur les ÉI systémiques sollicités de grade 3 ou plus, comparant le VII3-HD, le VII3-Adj et le VAR4 l'un à l'autreNote de bas de page 76Note de bas de page 87Note de bas de page 90. Deux (2) méta-analyses ont montré que le VII3-HD était moins susceptible de provoquer des ÉI systémiques sollicités que le VII3-Adj (n=2)Note de bas de page 76Note de bas de page 87 et le VAR4 (n=2)Note de bas de page 87Note de bas de page 90, mais les 2 estimations étaient imprécises (RR regroupé de 0,73, IC à 95 % : 0.29 à 1,80 %, et un RR groupé de 0,86, IC à 95 % : 0,22 à 3,32 %, respectivement). En outre, 1 ECR a signalé que le VII3-Adj pouvait entraîner un risque accru d'ÉI systémiques sollicités par rapport au VAR3, bien que l'estimation ait manqué de précision (RR de 4,62, IC à 95 % : 0,24 à 89,17 %)Note de bas de page 87.
Tout évènement indésirable grave survenu après la vaccination
L'examen de l'ACIP a porté sur 3 ECR faisant état d'ÉIG et comparant le VII3-HD au VII3-Adj (n=2)Note de bas de page 76Note de bas de page 87, le VII3-HD au VAR4 (n=2)Note de bas de page 87Note de bas de page 90 et le VII3-Adj au VAR4 (n=1)Note de bas de page 87. Une (1) méta-analyse et une (1) étude unique ont montré que le VII3-HD et le VII3-Adj étaient associés à des risques plus élevés d'ÉIG que le VAR4, mais les estimations manquaient de précision (RR regroupé de 1,77, IC à 95 % : 0,73 à 4,27 % et RR de 1,81, IC à 95 % : 0,58 à 5,65 %, respectivement). En outre, une (1) méta-analyse a rapporté que le VII3-HD pourrait être associé à un risque plus faible d'ÉIG par rapport au VII3-Adj, bien que l'estimation groupée ait également manqué de précision (RR groupé de 0,65, IC à 95 % : 0,32 à 1,30 %).
Tout évènement sollicité au point d'injection de grade 3 ou plus après la vaccination
L'examen de l'ACIP a porté sur 3 ECR qui ont fourni des données sur les évènements sollicités au point d'injection de grade 3 ou plus en comparant le VII3-HD au VII3-Adj (n=2)Note de bas de page 76Note de bas de page 87, le VII3-HD au VAR4 (n=2)Note de bas de page 87Note de bas de page 90 et le VII3-Adj au VAR4 (n=1)Note de bas de page 87. Une (1) méta-analyse et 1 ECR ont montré que le VII3-HD et le VII3-Adj pouvaient être associés à une plus grande réactogénicité que le VAR4, mais les estimations manquaient de précision (RR regroupé de 5,92, IC à 95 % : 0,32 à 109,56 %, et RR de 4,62, IC à 95 % : 0,24 à 89,17 %, respectivement). En outre, une (1) méta-analyse a indiqué que le VII3-HD pourrait être associé à une réactogénicité moindre par rapport au VII3-Adj, bien que l'estimation ait également manqué de précision (RR regroupé de 0,88, IC à 95 % : 0,45 à 1,75 %).
Données économiques
Deux (2) analyses économiques sont résumées ci-dessous. La première est un examen systématique publié sur le rapport coût/efficacité de la vaccination antigrippale chez les adultes de 65 ans et plusNote de bas de page 91. Y ont été prises en compte les études sur les vaccins antigrippaux dont l'utilisation a été approuvée aux États-Unis (É.-U.) ou au Canada et qui ont été publiées en texte intégral dans des articles examinés par des pairs jusqu'au 29 octobre 2020. Toutes les études incluses ont comparé le rapport coût/efficacité de stratégies vaccinales quadrivalentes ou à haute dose/avec adjuvant à celui d'une stratégie VII3-DS. La seconde est une évaluation économique publiée par le Comité sur l'immunisation du Québec (CIQ)Note de bas de page 92.
Examen systématique des évaluations économiques
Une vue d'ensemble de l'examen systématique publiéNote de bas de page 91 est présentée ici avec des commentaires supplémentaires du CCNI. Tous les coûts sont exprimés en dollars canadiens de 2019. Pour une introduction à l'interprétation des résultats des évaluations économiques et des seuils de coût/efficacité, voir le Guide d'interprétation du CCNI sur l'économie de la santé pour les décideursNote de bas de page 93. Un aperçu de la terminologie clé est présenté à l'Annexe A.
Résumé des études incluses
Au total, 19 études, comprenant 16 analyses coût/utilitéNote de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 98Note de bas de page 99Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109, 2 analyses coût/avantageNote de bas de page 110Note de bas de page 111 et une (1) analyse coût/efficacitéNote de bas de page 112, ont été incluses. Parmi les études incluses, 8 ont été menées en Amérique du NordNote de bas de page 91Note de bas de page 92Note de bas de page 96Note de bas de page 97Note de bas de page 101Note de bas de page 103Note de bas de page 106Note de bas de page 107, 5 en EuropeNote de bas de page 97Note de bas de page 98Note de bas de page 99Note de bas de page 108Note de bas de page 112, 5 en AsieNote de bas de page 94Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 106 et une (1) en Amérique du SudNote de bas de page 109. Toutes les études sauf une (1)Note de bas de page 112 ont été publiées entre 2014 et 2020. Toutes les études incluses ont été évaluées comme étant de qualité élevée (n=13)Note de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 107Note de bas de page 108Note de bas de page 109 ou moyenne (n=6)Note de bas de page 98Note de bas de page 99Note de bas de page 106Note de bas de page 110Note de bas de page 111Note de bas de page 112.
La Figure 1 présente les comparaisons de produits vaccinaux effectuées (il est à noter que des comparaisons multiples étaient possibles au sein d'une (1) même étude).
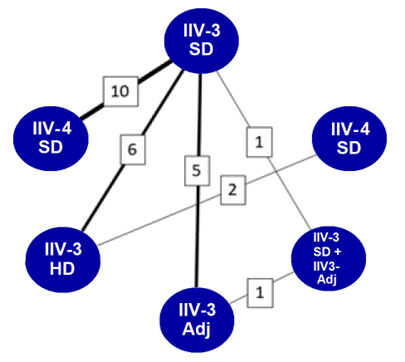
Figure 1 : Texte descriptif
| Comparaisons de vaccins par paires (n=6Note de bas de page a) | Nombre d'études rapportant sur chaque comparaisonNote de bas de page b |
|---|---|
| IIV4-DS et IIV3-DS | 10 |
| IIV3-DS et IIV3-HD | 6 |
| IIV3-DS et IIV3-Adj | 5 |
| IIV3-HD et IIV4-DS | 2 |
| IIV3-DS et IIV3-DS + IIV3-Adj | 1 |
| IIV3-Adj et IIV3-DS + IIV3-Adj | 1 |
| Nombre total de comparaisons de vaccins par paires | 6 |
| Nombre total d'études incluses | 19 |
|
|
Remarque : « VII3-DS + VII3-Adj » désigne le VII3-DS pour les personnes de 65 à 74 ans et le VII3-Adj pour les adultes de 75 ans et plusNote de bas de page 98; VII4-DS par rapport au VII3-DSNote de bas de page 94Note de bas de page 97Note de bas de page 99Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 108; VII3-HD par rapport au VII3-DSNote de bas de page 95Note de bas de page 96Note de bas de page 100Note de bas de page 107Note de bas de page 110Note de bas de page 111; VII3-Adj par rapport au VII3-DSNote de bas de page 99Note de bas de page 104Note de bas de page 108Note de bas de page 109Note de bas de page 112; VII3-HD par rapport au VII4-DSNote de bas de page 96Note de bas de page 107. L'épaisseur de la ligne représente le nombre d'études rapportant des données pour une comparaison donnée, également indiqué dans les encadrés.
Les perspectives suivantes ont été adoptées pour les analyses :
- Perspective sociétale : n=13 étudesNote de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 99Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107
- Point de vue du payeur de soins de santé : n=12 études
- Point de vue du prestataire de soins de santé : étude n=1Note de bas de page 102
L'horizon temporel utilisé pour l'analyse dans les études incluses variait d'une saison grippaleNote de bas de page 110 à la durée de vieNote de bas de page 97Note de bas de page 99Note de bas de page 104, 6 étudesNote de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 100Note de bas de page 107Note de bas de page 112 appliquant des horizons temporels différents pour les coûts et les effets (p. ex., un horizon temporel d'une saison grippale pour le coût et un horizon temporel de la durée de vie pour l'effet). Quatre (4) études n'ont pas indiqué l'horizon temporel utilisé pour l'analyseNote de bas de page 98Note de bas de page 101Note de bas de page 102Note de bas de page 111.
La plupart des études ont été financées par l'industrie (n=13)Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 99Note de bas de page 100Note de bas de page 101Note de bas de page 103Note de bas de page 105Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112. Trois (3)Note de bas de page 98Note de bas de page 104Note de bas de page 107 ont été soutenues par des sources de financement publiques et une (1) a fait état d'un mix de financement de l'industrie et de financement publicNote de bas de page 94. Deux (2) études n'ont pas précisé les sources de financementNote de bas de page 102Note de bas de page 106.
Évaluation propre au modèle
Les paramètres clés du modèle comprenaient la couverture vaccinale contre la grippe, le taux d'attaque de la grippe, les complications liées à la grippe (pneumonie, bronchite, maladies cardiovasculaires, complications du système nerveux central), la nécessité de prescrire des médicaments pour traiter les complications liées à la grippe, les consultations médicales, les VU, les hospitalisations et la mortalité associée à la grippe. La couverture vaccinale contre la grippe variait de 27 %Note de bas de page 94 à 82 %Note de bas de page 103Note de bas de page 104 dans les études incluses.
Une minorité d'études ont pris en compte la protection croisée (n=5)Note de bas de page 97Note de bas de page 99Note de bas de page 101Note de bas de page 104Note de bas de page 105 et l'immunité communautaire (n=1)Note de bas de page 105 (ou immunité collective). Aucune étude n'a pris en compte la fragilisation, le gaspillage de vaccins, la disponibilité de formats multidoses et monodoses, et la disponibilité de divers vaccins antigrippaux sur le marché.
Synthèse des résultats
Un résumé des résultats des études coût/utilité incluses est présenté dans le Tableau 1 (n=16)Note de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 98Note de bas de page 99Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109. En général, le VII4-DS, le VII3-Adj et le VII3-HD se sont avérés des options rentables par rapport au VII3-DS selon la perspective sociétale et des soins de santé. Les analyses coût/efficacité (n=1)Note de bas de page 112 et coût/bénéfice (n=2)Note de bas de page 110Note de bas de page 111 incluses ont abouti à des conclusions similaires, à savoir que le VII3-HD et le VII3-Adj étaient rentables par rapport au VII3-DS.
Résultats d'études considérées comme hautement généralisables dans le contexte canadien
Quatre (4) études ont été jugées hautement généralisables dans le contexte canadien : 2 ont été menées au CanadaNote de bas de page 95Note de bas de page 101 et 2 au Royaume-Uni (R.-U.)Note de bas de page 97Note de bas de page 98, dont une (1) seule n'était pas financée par l'industrieNote de bas de page 98. Des détails sur la manière dont la généralisation a été évaluée figurent à l'Annexe B. Les résultats des 4 études sont présentés ci-dessous.
Perspective du payeur de soins de santé : Les 4 études ont analysé la situation de la perspective du payeur de soins de santé (Tableau 2)Note de bas de page 95Note de bas de page 97Note de bas de page 98Note de bas de page 101. Si l'on compare une stratégie VII4-DS à une stratégie VII3-DS, les estimations du rapport coût/efficacité différentiel (RCED) allaient de 28 524 $Note de bas de page 97 à 39 599 $Note de bas de page 101 par AVAQ gagnée. Ces estimations peuvent être considérées comme rentables selon les seuils couramment utilisés (Annexe A). Si l'on compare la stratégie VII3-HD à la stratégie VII3-DS au Canada, la stratégie VII3-HD s'est révélée moins coûteuse et plus efficace chez les adultes (1) de 65 ans et plus (2) souffrant d'une affection cardiorespiratoire et (3) souffrant d'une (1) ou plusieurs comorbiditésNote de bas de page 95. En outre, la stratégie VII3-HD s'est avérée rentable chez les adultes de 75 ans et plus par rapport à la stratégie VII3-DSNote de bas de page 95. Si l'on compare une approche d'intervention mixte (VII3-DS pour personnes de 65 à 74 ans et VII3-Adj pour adultes de 75 ans et plus) au VII3-Adj et au VII3-DS, l'approche mixte s'est avérée rentable selon les seuils couramment utilisés (9 771 $ par AVAQNote de bas de page 99 à 13 084 $ par AVAQ)Note de bas de page 98.
Perspective sociétale : Trois (3) études ont analysé la situation de la perspective sociétale (Tableau 2)Note de bas de page 95Note de bas de page 97Note de bas de page 101. Si l'on compare une stratégie VII4-DS à une stratégie VII3-DS, les estimations du RCED allaient de 26 288 $Note de bas de page 101 à 36 115 $Note de bas de page 97 par AVAQ gagnée. Si l'on compare une stratégie VII3-HD à une stratégie VII3-DS au Canada, la stratégie VII3-HD était moins coûteuse et plus efficace chez les adultes (1) de 65 ans et plus (2) de 75 ans et plus (3) vivant avec une affection cardiorespiratoire, et (4) vivant avec une (1) ou plusieurs comorbiditésNote de bas de page 95.
Les valeurs estimées du RCED étaient systématiquement plus faibles de la perspective sociétale que de la perspective du payeur de soins de santé. Dans le premier cas, il s'agit souvent d'une perte de productivité pour les patients et/ou les soignants.
| Auteur, année, pays | Financement | Population | Horizon temporel | Résultats : Perspective des payeurs de soins de santé | Résultats : Perspective sociétale |
|---|---|---|---|---|---|
| VII4-DS (intervention) par rapport à VII3-DS (comparateur) | |||||
| Chit et al., 2015aNote de bas de page 101, Canada | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Non déclaré | 39 599 $/AVAQ gagnée | 36 115 $/AVAQ gagnée |
| Meier et al., 2015Note de bas de page 97, R.-U. | GlaxoSmithKline Biologicals SA (Industrie) | Adultes de 65 ans et plus | À vie | 28 524 $/AVAQ gagnée | 26 288 $/AVAQ gagnée |
| VII3-HD (intervention) par rapport à VII3-DS (comparateur) | |||||
| Becker et al., 2016Note de bas de page 95, Canada | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Une (1) saison grippale pour le coût et la durée de vie pour l'effet | Tous les participants de 65 ans et plus : VII3-HD a dominé VII3-DS Analyses de sous-groupes Participants de 75 ans et plus : 87 $/AVAQ gagnée Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS |
Tous les participants de 65 ans et plus : VII3-HD a dominé VII3-DS Analyses de sous-groupes Participants de 75 ans et plus : VII3-HD a dominé VII3-DS Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS |
| VII3-DS + VII3-Adj (Intervention)Note de bas de page a par rapport à VII3-DS (Comparateur) | |||||
| Thorrington et al., 2019Note de bas de page 98, R.-U. | Sources multiples (financement public) | Adultes de 65 ans et plus | Non déclaré | 9 771 $/AVAQ gagnée | Analyse non réalisée |
| VII3-Adj (intervention) par rapport à VII3-DS + VII3-Adj (comparateur)Note de bas de page a | |||||
| Thorrington et al., 2019Note de bas de page 98, R.-U. | Sources multiples (financement public) | Adultes de 65 ans et plus | Non déclaré | 13 084 $/AVAQ gagnée | Analyse non réalisée |
Notes de bas de page :
|
|||||
| Remarque : « ;L'intervention A a dominé l'intervention B; » signifie que l'intervention A est moins coûteuse et plus efficace que l'intervention B. | |||||
Résultats d'études considérés comme moins généralisables dans le contexte canadien
Un résumé des 15 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112 jugées peu généralisables dans le contexte canadien figure à l'Annexe C. Les résultats de ces 15 études étaient largement similaires à ceux des 4 études susmentionnées. Ces études ont également montré que les stratégies VII4-DS, VII3-Adj et VII3-HD étaient rentables par rapport à la stratégie VII3-DS.
Résultats des études sur les personnes âgées à haut risque
Le Tableau 3 présente les 5 études qui ont évalué les personnes âgées présentant un risque plus élevé d'infection grippale et/ou de complications, telles que les personnes présentant des comorbidités ou vivant en collectivitéNote de bas de page 95Note de bas de page 100Note de bas de page 104Note de bas de page 110Note de bas de page 112. Les stratégies VII3-HD et VII3-Adj étaient soit rentables, soit moins coûteuses et plus efficaces que la stratégie VII3-DS, en fonction de la population. Une stratégie VII4-DS s'est avérée rentable par rapport à une stratégie VII3-DS en fonction des seuils couramment utilisés.
| Auteur, année, pays | Financement | Type d'étude | Horizon temporel | Résultats : Perspective des payeurs de soins de santé | Conclusions : Perspective sociétale |
|---|---|---|---|---|---|
| VII4-DS (intervention) par rapport à VII3-DS (comparateur) | |||||
| Yun et al., 2019Note de bas de page 104, Corée du Sud | Korea Centers for Disease Control and Prevention (Public) | Coût/utilité | Durée de vie pour le coût et l'effet | Analyse non réalisée | Participants présentant un risque élevé d'infection par la grippe saisonnière et/ou de complications ou d'hospitalisations liées à la grippe : 1 327 $/AVAQ gagnée |
| VII3-Adj (intervention) par rapport à VII3-DS (comparateur) | |||||
| Yun et al., 2019Note de bas de page 104, Corée du Sud | Korea Centers for Disease Control and Prevention (Public) | Coût/utilité | Durée de vie pour le coût et l'effet | Analyse non réalisée | Participants présentant un risque élevé d'infection par la grippe saisonnière et/ou de complications ou d'hospitalisations liées à la grippe : VII3-Adj a dominé VII3-DS |
| Piercy et al., 2004Note de bas de page 112, France | Chiron Vaccines (Industrie) | Rapport coût/efficacité | Un (1) an pour le coût et la durée de vie pour l'effet | Les participants souffrant d'une maladie cardiaque ou pulmonaire : 44 492 $ par décès évité 8 943 $ par année de vie gagnée |
Analyse non réalisée |
VII3-HD (Intervention) par rapport à VII3-DS (Comparateur)Note de bas de page 96 Becker et al., 2016Note de bas de page 95, Canada |
Sanofi Pasteur (Industrie) | Coût/utilité | Une (1) saison grippale pour le coût et la durée de vie pour l'effet | Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS |
Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS |
| Chit et al., 2015bNote de bas de page 100, É.-U. | Sanofi Pasteur (Industrie) | Coût/utilité | Un (1) an pour le coût et la durée de vie pour l'effet | Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS |
Participants vivant avec une ou plusieurs comorbidités : VII3-HD a dominé VII3-DS Participants souffrant d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS |
| Shireman et al., 2019Note de bas de page 110, É.-U. | Sanofi Pasteur (Industrie) | Analyse coûts/avantages | Une (1) saison grippale pour le coût et l'effet | Résidents des maisons de retraite : Avantage monétaire net positif | Analyse non réalisée |
Facteurs influençant le rapport coût/efficacité
La plupart des études incluses, à l'exception de 2 d'entre ellesNote de bas de page 105Note de bas de page 106, ont effectué des analyses de sensibilité pour tester les hypothèses du modèle et la robustesse des résultats des études. Dans la plupart des cas, les résultats des analyses de sensibilité ont confirmé les conclusions du scénario de référence (c.-à-d. que les interventions qui étaient rentables dans l'analyse du scénario de référence le sont restées dans les analyses de sensibilité). Toutefois, le rapport coût/efficacité s'est avéré sensible à un certain nombre de variables, notamment la non-concordance entre les vaccins contre la grippe saisonnière et les souches en circulationNote de bas de page 97Note de bas de page 99Note de bas de page 102Note de bas de page 103Note de bas de page 104, l'EVR (p. ex., contre la maladie symptomatique, les hospitalisations, la mortalité)Note de bas de page 94Note de bas de page 103Note de bas de page 104, le coût des vaccinsNote de bas de page 102Note de bas de page 104, le niveau de protection croisée des vaccins en cas de non-concordance des lignées de type B et le taux de mortalité attribuable à la grippeNote de bas de page 99.
Analyse
La présente analyse des études d'évaluation économique résume le rapport coût/efficacité des vaccins contre la grippe saisonnière chez les adultes de 65 ans et plus. Les études sur l'impact budgétaire (c.-à-d. les analyses sur la modification probable des dépenses pour un titulaire de budget précis lorsqu'un programme de vaccination est mis en œuvre) n'ont pas été incluses. Au total, 19 études de qualité moyenne à élevée ont été incluses dans cette analyse. La direction des résultats du rapport coût/efficacité est restée cohérente dans toutes les études. Les stratégies VII4-DS, VII3-HD et VII3-Adj étaient rentables par rapport à la stratégie VII3-DS selon les seuils couramment utilisés. Les résultats de la présente analyse sont étayés par 2 études récentes de la littérature concernant les personnes âgées, menées par Sugishita et Sugiwara (2021)Note de bas de page 113, et Postma et al. (2023)Note de bas de page 114.
Une tendance s'est dégagée de 2 études montrant que le VII4-DS devenait de plus en plus rentable (c.-à-d. avec un RCED plus faible) par rapport au VII3-DS dans des groupes d'âge de plus en plus âgésNote de bas de page 102Note de bas de page 104. En général, la fonction immunitaire diminue avec l'âge, ce qui augmente le risque d'infection grippale et d'hospitalisation et/ou de complications liées à la grippe chez les personnes âgéesNote de bas de page 115Note de bas de page 116Note de bas de page 117Note de bas de page 118. En outre, le nombre moyen de comorbidités et le niveau de fragilisation par personne tendent à augmenter avec l'âgeNote de bas de page 119Note de bas de page 120Note de bas de page 121Note de bas de page 122. Les personnes souffrant d'au moins une comorbidité et/ou d'un niveau de fragilisation plus élevé courent un risque accru de conséquences plus sévères liées à la grippe, notamment d'hospitalisations, de déclin fonctionnel et de décès à la suite d'une infectionNote de bas de page 20Note de bas de page 123Note de bas de page 124Note de bas de page 125. Des vaccins plus efficaces administrés aux personnes âgées peuvent entraîner moins d'hospitalisations et de complications liées à la grippe, réduisant ainsi les coûts d'utilisation des soins de santé associés et donnant des résultats coût/efficacité plus favorables avec l'augmentation de l'âge.
Treize (13) des 19 études incluses ont été menées dans une perspective sociétale, intégrant souvent la perte de productivité de la personne âgée et de ses aidants. D'autres études ont supposé que la perte de revenu était minime chez les personnes âgées qui peuvent être retraitéesNote de bas de page 127 à l'âge de 65 ansNote de bas de page 126. La perspective sociétale a permis de réaliser des économies supplémentaires et de réduire les estimations du RCED.
Plusieurs études ont effectué leurs analyses à partir d'un horizon temporel court basé sur la durée de la saison grippaleNote de bas de page 103Note de bas de page 108Note de bas de page 109Note de bas de page 110. Un horizon temporel court peut être approprié dans de nombreux cas, étant donné que les conséquences et les coûts de la grippe surviennent souvent au cours d'une seule annéeNote de bas de page 127. Toutefois, les conséquences et les coûts à long terme associés à l'infection grippale ne seraient pas bien pris en compte dans ces études, comme l'invalidité à long terme, la perte d'autonomie, la réduction de la qualité de vie liée à la santé, la nécessité d'un placement en maison de retraite ou de soins à domicile, et le décès après l'infectionNote de bas de page 128Note de bas de page 129.
Aucune étude n'a pris en compte la fragilisation dans les analyses. La fragilisation est un syndrome complexe, dynamique et multifactoriel caractérisé par un risque accru de résultats défavorables par rapport à d'autres personnes de la même tranche d'âgeNote de bas de page 129Note de bas de page 130Note de bas de page 131Note de bas de page 132. Alors que l'ER des vaccins et les chances de guérison d'une infection grippale diminuent avec l'augmentation de la fragilisation, les adultes plus fragiles ont tendance à tirer profit d'une couverture vaccinale plus importanteNote de bas de page 133. Une précédente étude canadienne menée auprès de personnes âgées a montré que la vaccination antigrippale offrait une bonne protection contre l'hospitalisation pour cause de grippe chez les personnes âgées non fragiles et chez celles qui se situent à l'extrémité la plus légère du spectre de la fragilisationNote de bas de page 133. Le fait de ne pas tenir compte de la fragilisation tend à sous-estimer l'ER des vaccins chez les personnes âgéesNote de bas de page 133. La sous-estimation de cette efficacité peut ensuite influer sur les résultats du rapport coût/efficacité, en particulier lorsque le biais d'indication est pris en compte.
Par exemple, pour améliorer la réponse immunitaire, les personnes âgées fragiles peuvent être plus susceptibles de recevoir des vaccins antigrippaux conçus spécifiquement pour renforcer l'immunogénicité que les personnes âgées non fragiles, et ce biais d'indication est difficile à pleinement prendre en compte, en particulier en l'absence d'ajustement des modèles en fonction de la fragilisation. La différence de type de vaccin antigrippal reçu entre les adultes fragiles et non fragiles (c.-à-d. si les adultes âgés fragiles qui sont le plus à risque d'ÉI sont également plus susceptibles d'avoir reçu les vaccins renforcés) peut sous-estimer le bénéfice de ces vaccins par rapport aux produits vaccinaux standard, ce qui pourrait sous-estimer leur rapport coût/efficacité par rapport aux stratégies vaccinales standard.
Quatre (4) des 19 études incluses (de l'OntarioNote de bas de page 95Note de bas de page 101 et du R.-U.Note de bas de page 97Note de bas de page 98) ont été considérées comme hautement généralisables dans le contexte canadien sur la base des données démographiques des participants, de la disponibilité des vaccins, des ressources de santé utilisées et des coûts associés, entre autres critères d'évaluation de la généralisabilité (Annexe B)Note de bas de page 95Note de bas de page 97Note de bas de page 98Note de bas de page 101. Plusieurs études ont été menées dans des pays non membres de l'Organisation de coopération et de développement économiques (n=4)Note de bas de page 94Note de bas de page 102Note de bas de page 106Note de bas de page 109, dont une dans l'hémisphère sudNote de bas de page 109, et leur généralisation peut être limitée en raison des différentes formulations des produits vaccinaux, des coûts des soins de santé et de la saisonnalité différente de la grippe. Bien que les É.-U. aient une démographie et une épidémiologie de la grippe similaires à celles du Canada, il existe des différences dans les systèmes de santé (p. ex., les payeurs) et des écarts dans le coût des vaccins et des services de santé. Pour les évaluations économiques menées dans une perspective sociétale, les coûts directs et la perte de productivité peuvent également varier d'un pays à l'autre et d'une région à l'autre.
Le RCED comparant les stratégies VII4-DS et VII3-DS pourrait être peu généralisable à la période et au contexte actuels, compte tenu de l'absence de détections confirmées de B/Yamagata depuis mars 2020. L'analyse a porté sur des études réalisées jusqu'en 2020, lorsque les lignées B/Victoria et B/Yamagata étaient encore en circulation. La pertinence du rapport coût/efficacité du VII4-DS pour l'avenir n'est pas claire. En outre, les autorisations de Santé Canada et l'industrie déterminent quels produits sont disponibles sur le marché canadien. Ainsi, à l'heure actuelle, les provinces et les territoires n'ont pas le choix entre VII4 et VII3 pour les vaccins à dose standard.
La faible variation des estimations du RCED peut être attribuable aux hypothèses et aux sources de données utilisées pour les variables influentes telles que l'inadéquation des vaccins, l'ER des vaccins, le coût des vaccins, le niveau de protection croisée des vaccins, la couverture vaccinale et le taux de mortalité attribuable à la grippe. En particulier, l'ER du vaccin, la saisonnalité et la correspondance entre le vaccin et les souches grippales en circulation dans un pays ou une région varient d'une saison grippale à l'autre et selon le type de produit vaccinal, de sorte que les estimations des résultats peuvent varier en fonction de l'année ou des années de données utilisées et des produits vaccinaux comparés.
Notamment, une (1) seule des 19 études incluses a pris en compte dans son analyse les bénéfices potentiels de l'immunité communautaire (ou immunité collective) résultant de la vaccination des personnes âgéesNote de bas de page 105. L'immunité communautaire fait référence au concept selon lequel, lorsqu'une certaine proportion de la population est vaccinée contre une maladie précise, les autres membres de la population qui ne sont pas immunisés bénéficient d'une protection indirecte contre la maladie, car l'organisme infectieux est moins apte à circuler. Son inclusion peut s'avérer particulièrement importante dans les évaluations économiques des structures collectives proches (p. ex., les maisons de retraite, les centres de soins de longue durée) où les résidents sont en contact étroit avec des soignants et du personnel communsNote de bas de page 134Note de bas de page 135. Un résumé de conférence publié précédemment par Yang et Tan (2014) a révélé que le VII4-DS coûtait 35 851 USD de plus que le VII3-DS pour chaque AVAQ gagnée lorsque l'immunité communautaire n'était pas prise en compte lors de l'analyse des donnéesNote de bas de page 136. Cette estimation du RCED est tombée à 32 660 USD par AVAQ gagnée lorsque l'immunité communautaire a été prise en compte dans l'analyseNote de bas de page 136. Si l'immunité communautaire n'est pas prise en compte, les études peuvent sous-évaluer l'ER du vaccin et le bénéfice différentiel associé à la vaccination, et par conséquent sous-évaluer le rapport coût/efficacité du vaccin.
D'autres facteurs, tels que le gaspillage des vaccins (qui peut réduire la disponibilité et l'approvisionnement en vaccins) et la disponibilité de divers vaccins antigrippaux chaque saison, n'ont été pris en compte dans aucune des études incluses. Le gaspillage de vaccins correspond à la sous-utilisation des vaccins achetés ou à l'achat excessif d'un produit vaccinal, qui expire généralement après chaque saison grippale. Par exemple, au Canada, les vaccins contre la grippe saisonnière sont disponibles en formats multidoses et en formats monodosesNote de bas de page 137. Par rapport aux formats monodoses, les formats multidoses ont été associés à des préoccupations accrues en matière d'innocuité, à un risque accru de contamination et à des coûts potentiellement plus élevés liés à l'élimination et au stockage des déchets, ainsi qu'au gaspillage de vaccinsNote de bas de page 138. La prise en compte de facteurs programmatiques tels que la perte de vaccins, la disponibilité et l'utilisation de formats multidoses et monodoses, et la disponibilité de différents produits de vaccination contre la grippe saisonnière peut influé sur les coûts, entraînant des changements dans les estimations du rapport coût/efficacité.
L'étude actuelle présente plusieurs limites. Premièrement, la plupart des évaluations économiques recensées sur l'utilisation des vaccins contre la grippe saisonnière chez les personnes âgées ont utilisé le VII3-DS comme comparateur. Il est nécessaire que les futures analyses économiques comparent les nouveaux vaccins avec les produits de comparaison actuellement disponibles au Canada pour les adultes plus âgés. Par exemple, des provinces canadiennes telles que l'Alberta, l'Ontario, l'Île-du-Prince-Édouard, la Saskatchewan, la Nouvelle-Écosse, le Yukon et le Nouveau-Brunswick fournissent le VII4-HD à tous les adultes de 65 ans et plus dans le cadre de leurs programmes publics de vaccination contre la grippe saisonnièreNote de bas de page 139Note de bas de page 140Note de bas de page 141Note de bas de page 142Note de bas de page 143Note de bas de page 144. D'autres interventions vaccinales intéressantes aux fins de comparaison, telles que VII4-cc, VAR4, VII3-Adj, VII4-DS et VII4-Adj, sont nécessaires. Deuxièmement, la majorité des études incluses ont été financées par l'industrie. Dans cet examen, les résultats des études financées par l'industrie (n=13, 68 %) étaient similaires à ceux des études non financées par l'industrie. On manque également d'estimations du rapport coût/efficacité en fonction des sous-groupes d'âge, de la présence de comorbidités et de la fragilisation au sein de la population âgée. Enfin, les prix des vaccins varient en fonction du produit et du territoire de compétence. Ainsi, les prix des vaccins utilisés dans les études menées à l'étranger peuvent ne pas être applicables au Canada.
Évaluation économique par le Comité sur l'immunisation du Québec
Une vue d'ensemble de l'évaluation économique du Comité sur l'immunisation du Québec (CIQ) [analyse coût/utilité] est présentée ci-dessous. L'exercice économique a été l'une des composantes du processus décisionnel du CIQ. Une analyse de la littérature portant sur l'ER du vaccin a également été réalisée. Elle n'a révélé aucun ECR comparant le VII3-Adj et le VII-DS par rapport à la GCL et a montré que la littérature d'observation concernant le VII3-Adj n'était pas d'une grande qualité. Le CIQ a conclu qu'il n'y avait pas suffisamment d'éléments probants pour étayer la supériorité du VII3-Adj par rapport au VII-DS ou la similarité de l'EVR du VII3-Adj par rapport à celle du VII-HD.
Problème de décision et méthodes
L'analyse a évalué le rapport coût/efficacité de la vaccination de la population adulte plus âgée (65 ans et plus) au Québec à l'aide de vaccins renforcés par rapport aux vaccins à dose standard pour la prévention de la morbidité et de la mortalité attribuables à la grippe. Dans les analyses du CIQ, la terminologie « ;vaccins améliorés; » a été utilisée, sans spécifier s'il s'agissait de vaccins à haute dose ou de vaccins avec adjuvant. Il s'agit plutôt de vaccins conçus pour améliorer l'immunogénicité. C'est pourquoi la même terminologie est utilisée ici dans la présentation des résultats du CIQ. Les vaccins renforcés présentaient les caractéristiques hypothétiques suivantes : EVR par rapport à la dose standard comprise entre 0 % et 100 % (scénario de référence 25 %); différence de prix par rapport à la dose standard comprise entre 0 $ et 50 $ (scénario de référence 30 $); durée de protection d'un (1) an. Les vaccins à dose standard avaient une ER de 40 % (scénario de référence). Le programme de vaccination a eu une couverture de 100 %. La population étudiée a été stratifiée en fonction de l'âge (65 à 74 ans par rapport à 75 ans et plus) et de la présence d'au moins une maladie chronique augmentant le risque de complications de la grippe (maladies chroniques précises non répertoriées; proportion de la population présentant au moins une maladie : 52 % chez les 65 à 74 ans, et 58 % chez les 75 ans et plus).
L'analyse a été réalisée selon la perspective d'un système de santé publique, qui incluait les coûts d'hospitalisation, de soins intensifs, de médicaments et du programme de vaccination. Les coûts et les conséquences pour les soignants et la perte de productivité de la population étudiée n'ont pas été pris en compte. L'analyse a utilisé des données sur le fardeau de morbidité et d'autres paramètres basés sur un rapport du CIQ sur la grippe de 2018Note de bas de page 145.
Synthèse des résultats
Les résultats sont présentés sous forme de RCED en utilisant les AVAQ ainsi que le nombre de consultations, d'hospitalisations et de décès évités. Tous les coûts sont exprimés en dollars canadiens de 2022. Les résultats présentés sont actualisés à 3 % (ce qui s'écarte des recommandations du CCNI et d'autres organismes canadiens de 1,5 % pour l'analyse du scénario de référence), mais ils sont également présentés à 0 % (conformément aux recommandations du CCNI et d'autres organismes canadiens pour l'analyse de sensibilité)Note de bas de page 93Note de bas de page 146. L'actualisation permet à l'analyse de tenir compte des préférences temporelles (c.-à-d. que les coûts et les conséquences dans le futur sont généralement moins valorisés que dans le présent).
Les résultats du scénario de référence ont montré que chez les personnes de 65 à 74 ans, les vaccins renforcés ont permis d'éviter 571 consultations, 155 hospitalisations et 4 décès par rapport aux vaccins à dose standard. Chez les personnes de 75 ans et plus, les vaccins renforcés ont permis d'éviter 541 consultations, 533 hospitalisations et 28 décès. Le Tableau 4 présente le RCED des vaccins renforcés par rapport à la dose standard chez les personnes âgées du Québec, stratifié par âge et par présence de maladie chronique. Les RCED des analyses hors scénario de référence n'ont pas été rapportés.
| Démographique | RCED ($ par AVAQ), actualisé à 3 % | RCED ($ par AVAQ), non actualisé |
|---|---|---|
| Tous les âges (65 ans et plus) | NR | NR |
| 65 à 74 ans, tous | 609 927 | 480 604 |
| 65 à 74 ans, tous, souffrant d'une (de) maladie(s) chronique(s) | 345 297 | 270 784 |
| 65 à 74 ans, tous, sans maladie(s) chronique(s) | 2 648 381 | 2 166 967 |
| 75 ans et plus, tous | 100 618 | 84 805 |
| 75 ans et plus, tous, souffrant d'une (de) maladie(s) chronique(s) | 56 173 | 47 308 |
| 75 ans et plus, tous, sans maladie(s) chronique(s) | 496 177 | 421 085 |
Abréviations : RCED, rapport coût/efficacité différentiel; NR, non rapporté; AVAQ, année de vie ajustée sur la qualité. Remarque : Le scénario de référence a utilisé une ER relative de 25 % pour les vaccins renforcés, une ER de 40 % pour la dose standard, une différence de prix de 30 $, une durée de protection d'un an et une couverture vaccinale de 100 %. |
||
Les personnes de 75 ans et plus souffrant d'une maladie chronique présentaient le RCED le plus bas (c.-à-d. le meilleur rapport qualité-prix) [actualisé : 56 173 $ par AVAQ] parmi les populations stratifiées de l'étude. Les autres groupes stratifiés présentaient des RCED plus de 6 fois supérieurs à ce RCED (fourchette actualisée : 345 297 $ par AVAQ à 2 648 381 $ par AVAQ).
Analyse
Sur la base des seuils de coût/efficacité couramment utilisés, l'utilisation de vaccins renforcés (ER relative de 25 %) au Québec ne semble pas être rentable par rapport à la dose standard. Parmi les 4 groupes stratifiés, l'utilisation de vaccins renforcés chez les personnes de 75 ans et plus souffrant d'une maladie chronique était la stratégie la plus rentable par rapport à la dose standard (56 173 $ par AVAQ).
La présence d'une maladie chronique semble faire baisser les RCED (c.-à-d. le rapport qualité-prix), davantage que l'âge avancé. Toutefois, la mise en œuvre d'une stratégie de vaccination visant à identifier les personnes en fonction de leur maladie chronique n'est peut-être pas réalisable. À l'inverse, la mise en œuvre d'une stratégie de vaccination basée sur l'âge ne semble pas rentable (les RCED pour les personnes de 65 à 74 ans par rapport à celles de 75 ans et plus étaient respectivement de 609 927 $ par AVAQ et de 100 618 $ par AVAQ) dans le cadre de cette analyse.
Bien que l'analyse ait utilisé un taux d'actualisation précédemment recommandé de 3 % au lieu des recommandations actuelles de 1,5 % (en 2017 et 2023)Note de bas de page 93Note de bas de page 146, le taux d'actualisation ne semble pas être un paramètre influent puisqu'il n'a pas modifié les résultats des vaccins renforcés de façon à ce qu'un rapport coût/efficacité nul passe à un rapport coût/efficacité élevé.
Les résultats de l'évaluation économique du Québec peuvent être généralisés à d'autres provinces et territoires, sauf si le décideur estime que l'épidémiologie ou les coûts du système de santé sont marqués différemment selon les administrations. Les auteurs de l'analyse ont noté que la majorité des entrées du modèle étaient basées sur les paramètres du rapport du CIQ sur la grippe de 2018Note de bas de page 145; il est donc possible qu'il y ait des changements dans le fardeau de morbidité ou dans la gestion du système de santé qui ne soient pas pris en compte dans l'analyse.
Comme nous l'avons indiqué, le rapport coût/efficacité est l'un des éléments pris en compte dans le processus décisionnel du CIQ. Sur la base de l'analyse de la littérature clinique, le CIQ a estimé qu'il n'y avait pas suffisamment de données pour étayer la supériorité de l'EP du vaccin avec adjuvant par rapport à celle de la dose standard. Sur la base de l'ensemble des données, le CIQ recommande préférentiellement le vaccin à haute dose au vaccin avec adjuvant et au vaccin à dose standard pour les personnes de 75 ans et plus souffrant de maladies chroniques. Compte tenu des considérations de mise en œuvre, le CIQ recommande que le vaccin à haute dose puisse être proposé à toutes les personnes de 75 ans et plus, malgré les coûts beaucoup plus élevés et l'absence de rapport coût/efficacité.
Analyse
La présente déclaration examine de manière exhaustive les données disponibles sur l'EP, l'ER et l'innocuité des vaccins antigrippaux conçus pour renforcer la protection des personnes âgées (c.-à-d. VII-HD et VII-Adj), ainsi que de ceux qui tirent parti de la technologie et de concentrations accrues d'antigènes pour augmenter les réponses immunitaires (c.-à-d. VAR). L'analyse a mis l'accent sur les comparaisons et les données probantes issues d'études menées au cours des saisons grippales normales. Seuls les vaccins antigrippaux approuvés pour les personnes âgées ont été retenus. La principale question de recherche consistait à comparer les vaccins VII-HD, VII-Adj, VAR et VII-cc aux vaccins VII-DS, ainsi qu'entre eux, afin de déterminer leur rendement relatif chez les adultes de 65 ans et plus. Il convient de noter qu'aucune étude incluse dans cette analyse n'a comparé le VII-cc à d'autres vaccins antigrippaux. Les ECR recensés dans l'examen MAGIC du RIEM qui portaient sur le VII-cc n'ont pas fait état de résultats critiques ou de comparaisons de vaccins significatives impliquant les vaccins souhaités dans les groupes d'étude correspondantsNote de bas de page 147Note de bas de page 148Note de bas de page 149. En outre, l'examen effectué par l'ACIP n'a pas évalué les données concernant le VII-cc. Par conséquent, il n'a pas été possible de formuler une recommandation sur l'utilisation préférentielle du VII-cc chez les adultes de 65 ans et plus.
Dans l'ensemble, les résultats présentés suggèrent une tendance générale en faveur des vaccins antigrippaux visant à renforcer la protection des personnes âgées; ils soulignent les avantages potentiels associés aux VII-HD, VII-Adj et VAR par rapport aux VII-DS, et la plupart des données disponibles concernent les VII-HD. Toutefois, les données comparant le VII-HD, le VII-Adj et le VAR entre eux sont limitées. Les examens MAGIC de l'ACIP et du RIEM ont toutes 2 montré que le VII-HD était environ 25 % plus efficace que le VII-DS par rapport à la GCL (EVR de 24 %, IC à 95 % : 10 à 36 %; et une EVR groupée de 25 %, IC à 95 % : 12 à 37 %, respectivement). Pour ce qui est du VAR, les examens en question ont rapporté une EVR groupée pour le VAR par rapport au VII-DS de 30 % (IC à 95 % : -18 à 58 %) et de18 % (IC à 95 % : -17 à 43 %) par rapport à la GCL, respectivement.
Cependant, aucune étude ne fait état de l'EP ou de l'ER du VII-Adj par rapport au VII-DS par rapport à la GCL. L'ACIP a fait état de 2 méta-analyses d'études d'observation comparant le VII-Adj au VII-DS contre les consultations externes/VU associées à la grippe et définies par un diagnostic clinique. Une (1) méta-analyse de 2 études a démontré un effet protecteur bénéfique du VII-Adj par rapport au VII-DS contre les consultations externes/VU associées à la grippe (EVR groupée de 36 %, IC à 95 % : 21 à 48 %). Cependant, une (1) autre méta-analyse de 2 études de cohortes rétrospectives n'a pas décelé de différence entre le VII-Adj et le VII-DS par rapport à ce résultat (EVR groupée de 0 %, IC à 95 % : -9 à 3 %).
Néanmoins, le VII-Adj a démontré son ER dans la réduction des hospitalisations liées à la grippe par rapport à VII-DS dans 2 méta-analyses d'études d'observation (EVR groupée de 12 %, IC à 95 % : 3 à 20 % et 25 %, IC à 95 % : 3 à 42 %). Il existe peu d'ECR comparant le VII-HD, le VII-Adj et le VAR l'un à l'autre par rapport à la GCL. Notamment, les 2 examens systématiques n'ont pas démontré d'effet protecteur bénéfique par rapport à la GCL associé au VII-HD, au VII-Adj et au VAR, en raison des larges IC liés aux estimations de l'EP vaccinale. Bien que les résultats des 2 études suggèrent des avantages potentiels associés aux VII-HD, VII-Adj et VAR par rapport au VII-DS, les données actuellement disponibles comparant directement ces vaccins les uns aux autres sont insuffisantes pour établir avec certitude qu'un vaccin est systématiquement plus performant que les autres.
Cette étude a également examiné l'innocuité comparative des vaccins contre la grippe saisonnière. Les données concernant le VII-HD, le VII-Adj et le VAR par rapport au VII-DS ont montré un profil d'innocuité comparable en ce qui concerne les ÉIG. Toutefois, les personnes ayant reçu le VII-HD et le VII-Adj ont présenté une fréquence plus élevée d'évènements systémiques et au point d'injection que celles ayant reçu le VII-DS. En revanche, les données concernant le VAR n'ont pas indiqué d'augmentation de tels évènements par rapport au VII-DS.
Le secrétariat du CCNI a appliqué le cadre EEFA du Comité pour évaluer les implications relatives à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité de sa recommandation sur la vaccination antigrippale des adultes de 65 ans et plus au Canada. Il n'a pas été décelé d'inégalités potentielles ou de considérations éthiques pouvant découler de la recommandation d'une utilisation préférentielle, en fonction de l'âge, de vaccins antigrippaux recombinants et adjuvantés à haute dose. En fait, l'acceptabilité peut être accrue pour certains sous-groupes (fragilisation) qui bénéficient de l'efficacité accrue, réelle ou perçue, du vaccin préférentiel. Les problèmes de faisabilité potentiels pour les prestataires et les décideurs se limitent à l'augmentation des coûts des vaccins préférés, mais comme ces vaccins sont déjà utilisés dans certains territoires de compétence, il est peu probable que ce problème soit généralisé.
Outre les facteurs de EEFA, des considérations économiques ont été évaluées pour compléter la base de données probantes liée aux facteurs programmatiques. L'évaluation économique publiée a déterminé que tant le VII3-HD que le VII3-Adj sont rentables par rapport au VII3-DS. Aucune donnée économique n'existait pour le VAR, d'où l'absence de données sur le rapport coût/efficacité du VAR par rapport au VII-DS. En outre, aucune donnée économique recensée dans cette étude n'a directement comparé le VII-HD, le VII-Adj et le VAR l'un à l'autre.
Une limite notable dans les 2 examens systématiques est l'absence de données sur les personnes âgées fragiles, un facteur important pour comprendre l'impact de la vaccination antigrippale chez les adultes de 65 ans et plus qui présentent un risque plus élevé d'effets et de complications sévères liés à la grippe. L'EP et l'ER des vaccins antigrippaux chez les personnes âgées peut varier en raison de multiples facteurs, qui peuvent être plus prononcés chez celles qui sont fragiles. Avec l'âge, la fonction immunitaire diminue, ce qui accroît la vulnérabilité à l'infection grippale et aux complications qui y sont liéesNote de bas de page 115Note de bas de page 116Note de bas de page 117Note de bas de page 118.
En outre, dans les groupes plus âgés, on observe une augmentation du nombre moyen de comorbidités et du niveau de fragilisation. Les personnes présentant des niveaux élevés de fragilisation, ou une (1) ou plusieurs comorbidités, courent un risque accru de conséquences sévères liées à la grippe, notamment d'hospitalisations, de déclin fonctionnel et de décès à la suite d'une infection. Néanmoins, en raison de la complexité du spectre de la fragilisation, la morbidité liée à la grippe chez les personnes âgées fragiles pourrait être sous-estiméeNote de bas de page 20Note de bas de page 123Note de bas de page 124Note de bas de page 125. Il existe peu d'études sur l'impact des vaccins antigrippaux chez les personnes âgées fragiles. Notamment, 2 ECR menés aux É.-U. et au Canada ont fait état d'une diminution de l'EP du vaccin avec l'augmentation de la fragilisation, ce qui indique une association entre la fragilisation et une protection moindre contre l'infection grippale et ses complicationsNote de bas de page 133Note de bas de page 150.
Une tendance similaire a été observée dans une étude cas-témoins comparant l'ER des vaccins chez les patients présentant des résultats de fragilisation faibles ou élevés, montrant que cette efficacité était plus faible chez les patients présentant des résultats élevésNote de bas de page 151. En outre, malgré l'EP réduite du vaccin signalée précédemment chez les personnes âgées fragiles, DiazGranados et al. ont signalé une EP relative favorable du VII-HD par rapport au VII-DS dans cette populationNote de bas de page 150. Une récente étude à test négatif menée au Canada a révélé, dans une analyse exploratoire, une EVR plus élevée en comparant le VII-Adj au VII-DS contre l'hospitalisation liée à la GCL chez les adultes de 65 ans et plus après la prise en compte de la fragilisation (EVR de 25 %, IC à 95 % : 8 à 39 %)Note de bas de page 152. De même, Nace et al. ont rapporté des titres moyens géométriques et des taux de séroconversion plus élevés avec le VII-HD qu'avec le VII-DS chez des résidents fragiles d'établissements de soins de longue duréeNote de bas de page 78. Ces résultats rassurent sur le fait que la plus grande EP du VII-HD et du VII-Adj observée dans la littérature dans la population âgée générale reste constante chez les personnes âgées fragiles. Il s'ensuit que les études mentionnées offrent un aperçu précieux de la relation entre la fragilisation et l'EP/ER du vaccin antigrippal. Plus la fragilisation augmente, plus l'ER du vaccin antigrippal et la probabilité de se remettre d'une infection grippale tendent à diminuer.
Toutefois, les études citées montrent une tendance à l'amélioration de la protection vaccinale associée aux VII-HD et VII-Adj par rapport au VII-DS chez les personnes âgées fragiles. Dans l'ensemble, ces résultats soulignent les avantages potentiels de l'administration de vaccins antigrippaux conçus pour renforcer la protection des personnes âgées afin de réduire le fardeau de morbidité attribuable à la grippe dans cette population. Dans la mesure où des recherches supplémentaires sont nécessaires, certaines des considérations méthodologiques suivantes peuvent être pertinentes pour la population adulte plus âgée. Par exemple, la présence d'un « ;biais de fragilisation; » dans les études sur l'EP/ER des vaccins – c.-à-d. la susceptibilité différentielle à des résultats de santé défavorables en raison de fragilisations – souligne l'importance de la prise en compte de la fragilisation comme facteur de confusion dans les futures recherches sur les vaccins antigrippaux chez les adultes plus âgés. Les personnes âgées fragiles sont généralement sous-représentées dans les essais, en particulier les ECR; par conséquent, les examens de la littérature et les méta-analyses qui se concentrent uniquement sur les ECR tendent à ne pas représenter pleinement les populations fragiles – même si elles tentent d'inclure une mesure de la fragilisation. C'est pourquoi les études d'observation bien conçues et rigoureusement menées continuent de jouer un rôle important.
Parmi les autres limitations, citons le peu d'études portant sur le vaccin en question, le nombre restreint de saisons grippales représentées dans chaque comparaison, la variabilité des formulations de vaccins entre les saisons grippales, les différences dans la définition des résultats dans les 2 examens, la diminution de la certitude en raison du plan des études et l'imprécision des estimations de l'effet. La plupart des études disponibles se sont concentrées sur le VII-HD et moins sur le VII-Adj, tandis que les données sur le VAR étaient limitées. Le peu d'études disponibles par comparaison a entraîné l'inclusion d'un faible nombre de saisons grippales pour chacune d'entre elles, en particulier pour les estimations d'effets groupés impliquant des données d'ECR, ce qui peut influer sur la généralisation des résultats.
La variabilité de l'ER des vaccins au cours de chaque saison grippale est un autre facteur qui influe sur la généralisation des résultats. Les différences dans les définitions des résultats entre les examens sont principalement attribuées à l'inclusion des résultats de la grippe définis par la GCL, le diagnostic clinique ou le SG dans les 2 examens, ce qui pose des problèmes de synthèse et d'interprétation des résultats en raison des différences de sensibilité, de spécificité et de susceptibilité à un biais de classification erronée des différentes définitions des cas de grippe. Une autre différence entre les examens MAGIC de l'ACIP et du RIEM est que celui du RIEM n'a inclus que des ECR, qui tendent généralement à exclure les adultes plus âgés et plus fragiles. En tant que telle, la diminution de la certitude en raison du plan des études observationnelles et de l'imprécision des estimations de l'effet présente une limitation, car elle peut rendre l'interprétation des résultats moins solide.
Bien que les ECR offrent généralement la plus grande certitude en matière de données probantes, étant moins susceptibles de biais, ils ne sont généralement menés que sur quelques saisons grippales. Par conséquent, on ne peut pas supposer que les résultats d'une ou de quelques saisons seront généralisables à toutes les saisons ou à la plupart d'entre elles, en raison de l'évolution constante des virus de la grippe. Par ailleurs, les études d'observation sont plus nombreuses et présentent d'autres avantages, notamment la représentation de populations plus nombreuses et plus diversifiées et des résultats portant sur un plus grand nombre de saisons grippales que les ECR. Il est donc important de reconnaître la valeur des études d'observation, qui permettent de mieux comprendre les avantages relatifs du VII-HD, du VII-Adj et du VAR entre eux et par rapport au VII-DS dans le monde réel, même si la certitude des données probantes est plus faible.
Recommandations
À la suite de l'examen approfondi des données disponibles résumé ci-dessus, ainsi que de l'évaluation des considérations d'éthique, d'équité, de faisabilité et d'acceptabilité à l'aide du cadre EEFA, la section suivante présente la recommandation fondée sur des données probantes formulée par le CCNI concernant l'utilisation des vaccins antigrippaux chez les adultes de 65 ans et plus. Le CCNI continuera à suivre de près les développements scientifiques liés aux vaccins antigrippaux, ainsi que la pharmacovigilance des vaccins, et mettra à jour ses recommandations en fonction de l'évolution des données.
À noter :
Voir le Tableau 8 pour une explication plus détaillée de la force des recommandations du CCNI et du niveau de l'ensemble des données probantes.
La recommandation suivante concernant les décisions de vaccination aux niveaux individuel et de la population en ce qui a trait à la vaccination antigrippale annuelle pour adultes de 65 ans et plus vient compléter la recommandation générale du CCNI concernant cette vaccination (voir, à cet égard, la déclaration du CCNI sur le vaccin contre la grippe saisonnière), recommandation selon laquelle un vaccin antigrippal adapté à l'âge devrait être proposé chaque année à toute personne âgée de 6 mois et plus (recommandation forte du CCNI), sous réserve des contre-indications propres au produit.
Le CCNI recommande que les VII-HD, VII-Adj ou VAR soient proposés de préférence aux autres vaccins antigrippaux pour les adultes de 65 ans et plus. Si le produit préféré n'est pas disponible, il convient d'utiliser n'importe quel vaccin antigrippal disponible adapté à l'âge. (Forte recommandation du CCNI)
- Lorsque l'approvisionnement en VII-HD, VII-Adj ou VAR est limité, on peut envisager de donner la priorité aux groupes les plus exposés aux conséquences sévères de la grippe chez les adultes de 65 ans et plus, tels que les personnes passablement âgées (p. ex., 75 ans et plus), ceux qui présentent une (1) ou plusieurs comorbidités, les adultes âgés fragiles et les résidents de maisons de retraite et d'autres établissements de soins chroniques.
Résumé des données probantes et de la justification :
- Les vaccins VII-HD, VII-Adj et VAR semblent avoir une EP et une ER accrues par rapport au vaccin VII-DS.
- Aucune conclusion définitive ne peut être tirée quant à la supériorité de l'un ou l'autre de ces vaccins, car il n'existe que peu d'études comparant directement le VII-HD, le VII-Adj et le VAR les uns aux autres. Cela étant, c'est le VII-HD qui bénéficie du plus grand nombre de données probantes, suivi du VII-Adj, puis du VAR.
- Les VII-HD, VII-Adj et VAR sont des solutions de rechange efficaces au VII-DS, sans différence établie en matière d'innocuité, compte tenu de données probantes directes chez les adultes de 65 ans et plus.
- Le VII-HD et le VII-Adj sont rentables par rapport au VII-DS.
Priorités de recherche
La recherche a tout intérêt à porter sur les lacunes de connaissances suivantes :
- Données supplémentaires sur l'innocuité, l'EP et l'ER des nouvelles technologies vaccinales, y compris les vaccins antigrippaux issus de la culture cellulaire et les vaccins recombinants chez les adultes de 65 ans et plus.
- Comparaisons vaccinales (par paire ou entre plusieurs vaccins) de l'innocuité, de l'EP et de l'ER des nouveaux vaccins antigrippaux approuvés pour les adultes de 65 ans et plus et actuellement disponibles sur le marché canadien (p. ex., VII-cc, VAR, VII-Adj, VII-DS et VII-HD).
- Données sur l'EP/ER des vaccins antigrippaux dans les sous-populations d'adultes de 65 ans et plus présentant un risque plus élevé d'issues et de complications sévères liées à la grippe, telles que les personnes âgées, celles souffrant d'une (1) ou de plusieurs maladies chroniques, et données qui tiennent compte du rôle de la fragilisation chez les personnes âgées.
- Prise en compte de la fragilisation dans les estimations de l'ER et de l'impact des issues fonctionnelles à long terme chez les adultes de 65 ans et plus.
- Des données de surveillance de la grippe au niveau national chez les adultes de 65 ans et plus au Canada, qui aideront à mieux définir le fardeau de la maladie pour les personnes âgées, en particulier celles présentant un risque plus élevé d'issues sévères liées à la grippe, comme les personnes vivant avec un (1) ou plusieurs problèmes médicaux chroniques, et les adultes plus âgés fragiles.
- Calendrier de vaccination antigrippale chez les adultes de 65 ans et plus en ce qui concerne la durée ou l'affaiblissement de la protection contre l'infection et les maladies sévères.
- Incorporation et étude de l'impact de l'immunité communautaire sur le rapport coût/efficacité des vaccins contre la grippe saisonnière chez les adultes de 65 ans et plus.
- Prise en compte de la fragilisation dans le rapport coût/efficacité et l'impact des issues fonctionnelles à long terme.
- Confiance dans les vaccins et leur acceptabilité chez les adultes de 65 ans et plus au Canada, en particulier dans les groupes racisés.
- L'éventail et l'interaction complexe des facteurs qui influencent l'acceptabilité de la vaccination antigrippale en général et pour les groupes à haut risque chez les adultes de 65 ans et plus.
Enjeux de surveillance
La collecte, l'analyse et l'interprétation continues et systématiques des données, ainsi que leur diffusion en temps utile, sont essentielles à la planification, à la mise en œuvre, à l'évaluation et à la prise de décisions fondée sur des données probantes. Pour soutenir ces efforts, le CCNI encourage la surveillance permanente et l'expansion continue des détails de la surveillance de l'épidémiologie de la grippe au Canada.
Au Canada, ÉpiGrippe, le système national de surveillance, suit la propagation de la grippe et des SG par province/territoire et par groupe d'âge, y compris les adultes de 65 ans et plus. On dispose de peu de données de surveillance renforcées et robustes, notamment en ce qui concerne l'état de santé et la granularité chez les groupes plus âgés, qui pourraient être plus exposés à des issues sévères liées à la grippe en raison du déclin de la fonction immunitaire. C'est pourquoi des initiatives sont nécessaires pour recueillir des données sur l'infection grippale (p. ex., l'incidence des SG et de la GCL, la souche virale, l'hospitalisation, l'état de santé détaillé, y compris la fragilisation, et l'évaluation des issues à court et à long terme) chez les adultes de 65 ans et plus qui présentent un risque plus élevé d'issues sévères liées à la grippe, afin de déterminer l'ER vaccinale dans ces groupes et d'éclairer les efforts de santé publique appropriés, tels que la sensibilisation et les campagnes de vaccination ciblées. Il est important de noter que l'utilisation accrue de vaccins antigrippaux améliorés soulignera la nécessité d'une surveillance et d'une recherche continues sur l'ER spécifique des produits, ainsi que d'un suivi rigoureux et continu de leur innocuité. Il sera donc d'autant plus important de mettre en place des moyens réalisables et solides pour vérifier quel produit une personne a reçu, par exemple, au moyen de registres de vaccination qui peuvent être facilement reliés aux données cliniques et administratives.
Tableaux
| Étude | Issues | Vaccin | Plan de l'étude | Participants (n/N) | Résumé des principales conclusions |
|---|---|---|---|---|---|
| Efficacité potentielle | |||||
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Grippe confirmée en laboratoire (GCL) | VII3-HD c. VII-DS | ECR (n=1) | VII3-HD : n=228/15 990 (1,4 %) VII–DS : n=301/15 993 (1,9 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 0,76 (0,64 à 0,90 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Syndrome grippal (SG) | VII3-Adj c. VII-DS | ECR (n=1) | VII3-Adj : n=322/3 479 (9,3 %) VII–DS : n=314/3 482 (9,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 1,03 (0,89 à 1,19 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
GCL | VAR3 c. VII-DS | ECR (n=2) | VAR3 : n=53/2 168 (2,4 %) VII–DS : n=64/2 143 (3,0 %) |
L'estimation groupée de l'effet relatif (IC à 95 %) était un RR : 0,82 (0,57 à 1,17 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
GCL | VII3-HD c. VII3-Adj | ECR (n=1) | VII3-HD : n=1/29 (3,4 %) VII3-Adj : n=3/30 (10,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 0,34 (0,04 à 3,13 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
GCL | VII3-HD c. VAR4 | RCT (n=1) | VII3-HD : n=1/29 (3,4 %) VAR4 : n=4/30 (13,3 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 0,26 (0,03 à 2,18 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
GCL | VII–Adj c. VAR4 | RCT (n=1) | VII–Adj : n=3/30 (10,0 %) VAR4 : n=4/30 (13,3 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 0,75 (0,18 à 3,07 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VII-DS | RCT (n=2) | VII3-HD : n=14/18 596 (0,1 %) VII–DS : n=14/18 597 (0,1 %) |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RR : 1,00 (0,48 à 2,09 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VII-DS | ECR en grappes (n=1) | VII3-HD : n=247/19 127 VII–DS : n=309/19 129 |
L'estimation de l'effet relatif (IC à 95 %) était un RT de 0,79 (0,66 à 0,95 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-Adj c. VII-DS | RCT (n=1) | VII3-Adj : n=242/24 926 VII–DS : n=309/25 806 |
L'estimation de l'effet relatif (IC à 95 %) était un RT de 0,79 (0,65 à 0,96 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
GCL | VII3-HD c. VII3-DS | ECR (n=3) | VII3-HD : n=252/22 394 VII3-DS : n=329/19 359 |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RC : 0,75 (0,63 à 0,88 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
GCL | VAR c. VII-DS | ECR (n=2) | VAR : n=– / – VII–DS : n=– / – |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RC : 0,70 (0,42 à 1,18 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
SG | VII–HD c. VII-DS | ECR (n=3) | VII–HD : n=– /41 209 VII–DS : n=– /41 209 |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RC : 0,98 (0,93 à 1,02 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
SG | VAR c. VII-DS | ECR (n=1) | VAR4 : n=– /9 003 VII4-DS : n=– /9 003 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,99 (0,89 à 1,09 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
SG | VAR c. VII-DS | ECR (n=1) | VAR3 : n=– /870 VII3-DS : n=– /870 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,96 (0,55 à 1,65 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
SG | VII3-Adj c. VII3-DS | ECR (n=1) | VII3-Adj : n=– /6 961 VII3-DS : n=-/6 961 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 1,03 (0,87 à 1,21 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Hospitalisation pour GCL | VII3-HD c. VII4-DS | ECR (n=1) | VII3-HD : n=– /68 VII4-DS : n=– /68 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 1 (0,06 à 16,7 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Hospitalisation pour GCL | VII3-HD c. VII3-DS | ECR (n=1) | VII3-HD : n=– /31 983 VII3-DS : n=– /31 983 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,6 (0,22 à 1,65 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Hospitalisation pour GCL | VAR4 c. VII4-DS | ECR (n=1) | VAR4 : n=– /9 003 VII4-DS : n=– /9 003 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,33 (0,04 à 3,21 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Hospitalisation pour SG | VII3-HD c. VII3-DS | ECR (n=2) | VII3-HD : n=127/22 098 VII3-DS : n=155/19 043 |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RC : 0,72 (0,57 à 0,92 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Consultation externe | VII3-HD c. VII3-DS | ECR (n=1) | VII3-HD : n=439/6 108 VII3-DS : n=226/3 050 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,97 (0,82 à 1,14 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Nombre d'évènements vasculaires | VII3-HD c. VII3-DS | ECR (n=4) | VII3-HD : n=166/23 551Note de bas de page a VII3-DS : n= 169/19 847Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,75 (0,43 à 1,29 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Nombre d'évènements vasculaires | VII3-Adj c. VII3-DS | ECR (n=2) | VII3-Adj : n=39/3 422Note de bas de page a VII3-DS : n= 47/3 427Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,83 (0,54 à 1,27 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Nombre d'évènements vasculaires | VAR4 c. VII4-DS | ECR (n=1) | VAR4 : n=–/9 003 VII4-DS : n=–/9 003 Total N=9 003 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,89 (0,30 à 2,60 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
Décès liés à la grippe | VII3-Adj c. VII3-DS | ECR (n=1) | VII3-Adj : n=–/6 961 VII3-DS : n=–/6 961 Total N=6 961 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,75 (0,17 à 3,36 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
GCL | VII–HD c. VII-Adj | ECR (n=1) | VII–HD : n=– /152 VII–Adj : n=– /152 Total N=152 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 3,1 (0,30 à 31,8 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
GCL | VAR c. VII-Adj | ECR (n=1) | VAR : n=– /89 VII–Adj : n=– /89 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,72 (0,15 à 3,54 %). |
Veroniki/Tricco et al. (2023)Note de bas de page 15 Efficacité des vaccins trivalents et quadrivalents contre la grippe par rapport aux autres vaccins chez les adultes de 60 ans et plus : Une revue systématique et une méta-analyse en réseau. Soumis. |
GCL | VAR c. VII-HD | ECR (n=1) | VAR : n=-/89 Total N=89 |
L'estimation de l'effet relatif (IC à 95 %) était un RC : 0,23 (0,02 à 2,20 %). |
| Efficacité réelle | |||||
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VII-DS | Observation(n= 8) | VII3-HD : n=– /43 519 865Note de bas de page a VII–DS : n=– /20 193 377Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,92 (0,90 à 0,94 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VII-DS | Observation(n= 2) | VII3-HD : n=177/24 334 (0,7 %) VII–DS : n=201/24 197 (0,8 %) |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RR : 0,71 (0,57 à 0,88 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-Adj c. VII-DS | Observation (n=4) | VII3-Adj : n=/6 133 023Note de bas de page a VII–DS : n=– /4 861 653Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,88 (0,80 à 0,97 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-Adj c. VII-DS | Observation(n=2) | VII3-Adj : n=230/85 483 VII–DS : n=35/79 610 |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,75 (0,58 à 0,97 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VAR3 c. VII-DS | Observation(n=1) | VAR3 : n=640/608 433 VII–DS : n=2 309/158 4451 |
L'estimation de l'effet relatif (IC à 95 %) était un RT de 0,83 (0,76 à 0,91 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VII-Adj | Observation(n=4) | VII3-HD : n=– /25 467 741Note de bas de page a VII–Adj : n=– /6 356 816Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,96 (0,90 à 1,01 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII3-HD c. VAR | Observation(n=1) | VII3-HD : n=81 492/7 173 433 VAR : n=640/608 433 |
L'estimation de l'effet relatif (IC à 95 %) était un RT de 1,12 (1,03 à 1,21 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Hospitalisation pour grippe | VII–Adj c. VAR | Observation(n=1) | VII–Adj : n=2 783/2 565 513 VAR : n=640/608 433 |
L'estimation de l'effet relatif (IC à 95 %) était un RT de 1,12 (1,03 à 1,22 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Consultations externes et/ou visites aux urgences (VU) pour la grippe | VII3-Adj c. VII-DS | Observation(n=2) | VII3-Adj : n=– /1 701 231Note de bas de page a VII–DS : n=– /2 035 149Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) indique un RT de 1,00 (0,97 à 1,03 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Consultations externes et/ou VU pour la grippe | VII3-Adj c. VII-DS | Observation(n=2) | VII3-Adj : n=344/1 333 VII–DS : n=197/988 |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RR : 0,64 (0,52 à 0,79 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Consultations externes et/ou VU pour la grippe | VII3-HD c. VII-DS | Observation(n=1) | VII3-HD : n=593/3 141 (18,9%) VII–DS : n=580/2 840 (20,4%) |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RR de 0,91 (0,73 à 1,12 %). |
Grohskopf et al. (2022)Note de bas de page 16 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Consultations externes et/ou VU pour la grippe | VII3-HD c. VII-DS | Observation(n=4) | VII3-HD : n=– /11 001 581Note de bas de page a VII–DS : n=– /5 658 869Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,87 (0,76 à 0,99 %). |
Grohskopf et al. (2022)Note de bas de page 16 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Consultations externes et/ou VU pour la grippe | VII3-HD c. VII3-Adj | Observation(n=3) | VII3-HD : n=– /11 430 788Note de bas de page a VII–Adj : n=– /2 262 474Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 1,06 (0,92 à 1,23 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Décès liés à la grippe | VII3-HD c. VII-DS | Observation(n=2) | VII3-HD : n=166/2 755 395Note de bas de page a VII–DS : n= – /3 922 569Note de bas de page a |
L'estimation de l'effet relatif groupé (IC à 95 %) était un RT de 0,69 (0,57 à 0,84 %). |
| Innocuité | |||||
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout évènement indésirable grave (EIG) | VII3-HD c. VII-DS | ECR (n=7) | VII3-HD : n=1518/22 109 (6,7 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR : 0,91 (0,85 à 0,97 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout EIG | VII3-Adj c. VII-DS | ECR (n=8) | VII3-Adj : n=300/5 266 (5,7 %) VII-DS : n=277/5 055 (5,5 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 1,07 (0,92 à 1,26 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout EIG | VAR3 c. VII-DS | ECR (n=5) | VAR3 : n=191/6 513 (2,9 %) VII–DS : n=190/6 697 (2,8 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 1,03 (0,84 à 1,26 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout EIG | VII3-HD c. VII3-Adj | ECR (n=2) | VII3-HD : n=13/887 (1,5 %) VII3-Adj : n=20/886 (2,3 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,65 (0,32 à 1,30 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout EIG | VII3-HD c. VAR | ECR (n=2) | VII3-HD : n=16/663 (2,4 %) VAR : n=7/486 (1,4 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 1,77 (0,73 à 4,27 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Tout EIG | VII–Adj c. VAR | ECR (n=1) | VII–Adj : n=11/508 (2,2 %) VAR : n=4/335 (1,2 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 1,81 (0,58 à 5,65 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Syndrome de Guillain-Barré | VII3-Adj c. VII-DS | RCT (n=1) | VII3-Adj : n=0/3 545 (0,0 %) VII–DS : n=1/3 537 (0,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,33 (0,01 à 8,16 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Syndrome de Guillain-Barré | VII3-Adj c. VII-DS | Observation(n=1) | VII3-Adj : n=0/88 449 (0,0 %) VII–DS : n=0/82 539 (0,0 %) |
L'estimation de l'effet relatif n'était pas estimable. |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VII3-HD c. VII-DS | ECR (n=2) | VII3-HD : n=7/560 (1,3 %) VII–DS : n=1/559 (0,2 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 5,03 (0,88 à 28,74 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VII3-Adj c. VII-DS | ECR (n=4) | VII3-Adj : n=18/952 (1,9 %) VII–DS : n=5/957 (0,5 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 3,39 (1,32 à 8,72 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VAR3 c. VII-DS | ECR (n=2) | VAR3 : n=7/771 (0,9 %) VII–DS : n=11/941 (1,2 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,67 (0,27 à 1,69 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VII3-HD c. VII3-Adj | ECR (n=2) | VII3-HD : n=15/887 (1,7 %) VII3-Adj : n=17/886 (1,9 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,88 (0,45 à 1,75 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VII3-HD c. VAR | ECR (n=2) | VII3-HD : n=4/663 (0,6 %) VAR : n=0/486 (0,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 5,92 (0,32 à 109,56 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements sollicités au point d'injection de grade 3 ou plus | VII–Adj c. VAR | ECR (n=1) | VII–Adj : n=3/508 (0,6 %) VAR : n=0/335 (0,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 4,62 (0,24 à 89,17 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VII3-HD c. VII-DS | ECR (n=2) | VII3-HD : n=3/766 (0,4 %) VII–DS : n=3/767 (0,4 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,95 (0,20 à 4,53 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VII3-Adj c. VII-DS | ECR (n=4) | VII3-Adj : n=10/1 016 (1,0 %) VII–DS : n=13/1 026 (1, 3%) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,77 (0,34 à 1,76 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VAR3 c. VII-DS | ECR (n=2) | VAR3 : n=1/771 (0,1 %) VII–DS : n=6/941 (0,6 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,28 (0,05 à 1,67 %). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VII3-HD c. VII3-Adj | ECR (n=2) | VII3-HD : n=8/887 (0,9 %) VII3-Adj : n=11/886 (1,2 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,73 (0,29 à 1,80). |
Grohskopf et al. (2022)Note de bas de page 14 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VII3-HD c. VAR4 | ECR (n=2) | VII3-HD : n=4/663 (0,6 %) VAR4 : n=4/486 (0,8 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 0,86 (0,22 à 3,32 %). |
Grohskopf et al. (2022)Note de bas de page 16 Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices — United States, 2022-23 Influenza Season. MMWR Recomm Rep 2022 |
Évènements systémiques sollicités de grade 3 ou plus | VII–Adj c. VAR | ECR (n=1) | VII–Adj : n=3/508 (0,6 %) VAR : n=0/335 (0,0 %) |
L'estimation de l'effet relatif (IC à 95 %) était un RR de 4,62 (0,24 à 89,17 %). |
Notes de bas de page :
|
|||||
Abréviations : c., contre; EIG, évènement indésirable grave; IC, intervalle de confiance; VII3-Adj, vaccin trivalent inactivé contre l'influenza avec adjuvant (à base d'œufs); VII3-HD, vaccin trivalent inactivé contre l'influenza avec adjuvant à haute dose (à base d'œufs); VII3-DS, vaccin trivalent inactivé contre l'influenza avec adjuvant à dose standard (à base d'œufs); VII–Adj, vaccin inactivé contre l'influenza avec adjuvant (à base d'œufs); VII–HD, vaccin inactivé contre l'influenza à haute dose (à base d'œufs); VII–DS, vaccin inactivé contre l'influenza à dose standard (à base d'œufs); SG, syndrome grippal; GCL, grippe confirmée en laboratoire; RC, rapport de cotes; ECR, essai contrôlé randomisé; VAR, vaccin antigrippal recombinant; VAR3, vaccin antigrippal recombinant trivalent; VAR4, vaccin antigrippal recombinant quadrivalent; VU, visites aux urgences; RR, ratio de risque; RT, ratio des taux. |
|||||
| Auteur, année | Financement | Plan de l'étude | Pays | Intervention | Comparaison | Issues | Limites de l'étude (risque de biais)Note de bas de page aNote de bas de page b |
|---|---|---|---|---|---|---|---|
| Balasubrama-ni 2020Note de bas de page 43 | Gouvernement américain | Observation Cas-témoins à test-négatif (CTTN) | É.-U. | VII3-HD | VII3-DS VII4-DS |
Consultations externes / urgences | ModéréNote de bas de page a |
| Belongia 2020Note de bas de page 37 | Gouvernement américain | ECR | É.-U. | VII3-HD VII3-Adj VAR4 |
VII3-Adj VAR4 | GCL | ÉlevéNote de bas de page a |
| Cocchio 2020Note de bas de page 58 | Pas de financement externe | Observation (cohorte rétroactive) | Italie | VII3-Adj | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Couch 2007Note de bas de page 86 | Gouvernement américain | ECR | É.-U. | VII3-HD | VII3-DS | Tout EI systémique sollicité de grade ≥3 | Manque de clartéNote de bas de page a |
| Cowling 2020Note de bas de page 87 | Gouvernement américain | ECR | Hong Kong | VII3-HD VII3-Adj VAR4 | VII4-DS VII3-Adj VAR4 |
Tout EI systémique sollicité de grade ≥3 | FaibleNote de bas de page a |
| Tout EI sollicité au point d'injection de grade ≥3 | FaibleNote de bas de page a | ||||||
| Tout EIG | FaibleNote de bas de page a | ||||||
| DiazGranados 2014Note de bas de page 33 | Sanofi Pasteur | ECR | É.-U./Canada | VII3-HD | VII3-DS | GCL | FaibleNote de bas de page a |
| Tout EIG VU pour SG GCL SG |
FaibleNote de bas de page aNote de bas de page b | ||||||
| Hospitalisations pour SG Consultation externe | Quelques préoccupationsNote de bas de page b | ||||||
| DiazGranados 2015Note de bas de page 38 | Sanofi Pasteur | ECR | É.-U./Canada | VII3-HD | VII3-DS | Hospitalisation | Manque de clartéNote de bas de page a |
| De Bruijn 2007Note de bas de page 79 | Manque de clarté; auteurs de Solvay | ECR | Allemagne, Suède, Lituanie, Bulgarie | VII3-Adj | VII3-DS | Tout EIG | ÉlevéNote de bas de page a |
| De Donato 1999Note de bas de page 80 | Manque de clarté; auteurs de Chiron | ECR | Italie | VII3-Adj | VII3-DS | Tout EIG | ÉlevéNote de bas de page a |
| Della Cioppa 2012Note de bas de page 85 | Novartis | ECR | Pologne, Belgique, Allemagne | VII3-Adj | VII3-DS | Tout EIG | ÉlevéNote de bas de page a |
| Doyle 2021Note de bas de page 52 | Gouvernement américain | Observation (CTTN) | É.-U. | VII3-HD | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Dunkle 2017Note de bas de page 34 | BARDA; auteurs de Protein Sciences | ECR | É.-U. | VAR4 | VII4-DS | Cas de GCL | FaibleNote de bas de page a – ÉlevéNote de bas de page b |
| Cas de SG | ÉlevéNote de bas de page b | ||||||
| Tout EIG | FaibleNote de bas de page a | ||||||
| Falsey 2009Note de bas de page 68 | Sanofi Pasteur | ECR | É.-U. | VII3-HD | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Nombre d'évènements vasculaires | Quelques préoccupationsNote de bas de page b | ||||||
| Frey 2014Note de bas de page 35 | Novartis | ECR | É.-U., Colombie, Panama, Philippines |
VII3-Adj | VII3-DS | Cas de SG | FaibleNote de bas de page a Quelques préoccupationsNote de bas de page b |
| Tout EIG | FaibleNote de bas de page a | ||||||
| SGB | FaibleNote de bas de page a | ||||||
| Gravenstein 2017Note de bas de page 40 | Sanofi Pasteur | ECR en grappes | É.-U. | VII3-HD | VII3-DS | Hospitalisation | Manque de clartéNote de bas de page a |
| Hansen 2020Note de bas de page 77 | Protein Sciences | Observation (cohorte rétroactive) | É.-U. | VAR3 | VII3-DS | SGB | ModéréNote de bas de page a |
| Iob 2005Note de bas de page 48 | Non indiqué | Observation (Cohorte) | Italie | VII3-Adj | VII3-DS | Consultations externes/VU | GraveNote de bas de page a |
| Izikson 2015Note de bas de page 83 | BARDA; auteurs de Protein Sciences | ECR | É.-U. | VAR3 | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Izurieta 2015Note de bas de page 44 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-DS | Consultations externes/VU | GraveNote de bas de page a |
| Izurieta 2019Note de bas de page 45 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII4-DS | Consultations externes/VU, hospitalisation | GraveNote de bas de page a |
| VII3-Adj | VII4-DS | Hospitalisation | GraveNote de bas de page a | ||||
| VII3-HD | VII3-Adj | Hospitalisation | GraveNote de bas de page a | ||||
| Izurieta 2020Note de bas de page 50 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD VII3-Adj RAV4 |
VII4-DS | Hospitalisation | GraveNote de bas de page a |
| VII3-HD | VII3-Adj | Hospitalisation | GraveNote de bas de page a | ||||
| VII3-Adj | VII–DS | Hospitalisation | GraveNote de bas de page a | ||||
| Izurieta 2021Note de bas de page 51 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VAR4 | VII4-DS | Hospitalisation | GraveNote de bas de page a |
| VII3-HD | VII3-Adj | Hospitalisation | GraveNote de bas de page a | ||||
| VII3-HD | VAR4 | Hospitalisation | GraveNote de bas de page a | ||||
| VII3-Adj | VAR4 | Hospitalisation | GraveNote de bas de page a | ||||
| Keitel 2006Note de bas de page 36 | Gouvernement américain | ECR | É.-U. | VII3-HD | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Tout EI systémique sollicité de grade ≥3 | Manque de clartéNote de bas de page a | ||||||
| Tout EI sollicité au point d'injection Grade ≥3 | Manque de clartéNote de bas de page a | ||||||
| Keitel 2010Note de bas de page 71 | Manque de clarté; auteur de Protein Sciences | ECR | É.-U. | VAR3 | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Tout EI systémique sollicité de grade ≥3 | Manque de clartéNote de bas de page a | ||||||
| Tout EI sollicité au point d'injection Grade ≥3 | Manque de clartéNote de bas de page a | ||||||
| Cas de GCL | Manque de clartéNote de bas de page a Quelques préoccupationsNote de bas de page b | ||||||
| Cas de SG | Quelques préoccupationsNote de bas de page b | ||||||
| Li 2008Note de bas de page 81 | Novartis | ECR | Chine | VII3-Adj | VII3-DS | Tout EIG | ÉlevéNote de bas de page a |
| Loeb 2020Note de bas de page 65 | National Institute on Aging, Instituts de recherche en santé du Canada | ECR | É.-U./Canada | VII3-HD | VII3-DS | Cas de GCL | Quelques préoccupationsNote de bas de page aNote de bas de page b |
| Nombre d'évènements vasculaires | FaibleNote de bas de page b | ||||||
| Lu 2019Note de bas de page 53 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Mannino 2012Note de bas de page 60 | Novartis | Observation (cohorte prospective) | Italie | VII3-Adj | VII–DS | Hospitalisation | GraveNote de bas de page a |
| McConeghy 2020Note de bas de page 72 | Seqirus | ECR en grappes | É.-U. | VII3-Adj | VII3-DS | Hospitalisation | Manque de clartéNote de bas de page a |
| McLean 2021Note de bas de page 74 | Centers for Disease Control and Prevention, Marshfield Clinic Research Institute | ECR | É.-U. | VII3-HD | VII3-Adj | Cas de GCL | Manque de clartéNote de bas de page b |
| Menegon 1999Note de bas de page 88 | Subvention du ministère | ECR | Italie | VII3-Adj | VII3-HD | Tout EI sollicité au point d'injection Grade ≥3 | Manque de clartéNote de bas de page a |
| Nace 2015Note de bas de page 78 | Sanofi Pasteur | ECR | É.-U. | VII3-HD | VII3-DS | Tout EIG | ÉlevéNote de bas de page a |
| Paudel 2020Note de bas de page 54 | Sanofi Pasteur | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Pebody 2020Note de bas de page 61 | Gouvernement du Royaume-Uni | Observation (CTTN) | Royaume-Uni | VII3-Adj | VII–DS | Hospitalisation | ModéréNote de bas de page a |
| Pelton 2020Note de bas de page 49 | Seqirus | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-Adj | Consultations externes/VU | GraveNote de bas de page a |
| VII3-Adj | VII4-DS | Consultations externes/VU | GraveNote de bas de page a | ||||
| Pelton 2021Note de bas de page 63 | Le financement n'est pas indiqué. Auteurs de Seqirus | Observation (cohorte rétroactive) | É.-U. | VII3-HD c. VII3-Adj | VII3-Adj | Consultations externes/VU | GraveNote de bas de page a |
| Richardson 2015Note de bas de page 55 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Robison 2018Note de bas de page 56 | Le financement n'est pas indiqué. Aucun auteur de l'industrie | Observation (cohorte appariée) | É.-U. | VII3-HD | VII–DS | Hospitalisation | GraveNote de bas de page a |
| Shay 2017Note de bas de page 46 | Gouvernement américain | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-DS | Consultations externes/VU Décès | GraveNote de bas de page a |
| Scheifele 2013Note de bas de page 67 | Gouvernement canadien | ECR | Canada | VII3-Adj | VII3-DS | Tout EIG | FaibleNote de bas de page a |
| Tout EI systémique sollicité de grade ≥3 | FaibleNote de bas de page a | ||||||
| Tout EI sollicite au point d'injection Grade ≥3 | FaibleNote de bas de page a | ||||||
| Schmader 2021Note de bas de page 76 | Gouvernement américain | ECR | É.-U. | VII3-HD | VII3-Adj | Tout EIG | FaibleNote de bas de page a |
| VII3-HD | VII3-Adj | - | - | ||||
| VII3-HD | VII3-Adj | SGB | FaibleNote de bas de page a | ||||
| VII3-HD | VII3-Adj | Tout EI sollicité au point d'injection Grade ≥3 | FaibleNote de bas de page a | ||||
| Seo 2014Note de bas de page 75 | Gouvernement sud-coréen | ECR | Corée du Sud | VII3-Adj | VII3-DS | Tout EI systémique sollicité de grade ≥3 | Manque de clartéNote de bas de page a |
| Sindoni 2009Note de bas de page 82 | Non indiqué. Aucun auteur de l'industrie | ECR | Italie | VII3-Adj | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Shinde 2022Note de bas de page 90 | Novavax | ECR | É.-U. | VII3-HD | VAR4 | Tout EIG SGB |
FaibleNote de bas de page a |
| Tout EI systémique sollicité de grade ≥3 | FaibleNote de bas de page a | ||||||
| Teh 2021Note de bas de page 66 | Sanofi Pasteur | ECR | Australie | VII3-HD | VII4-DS | Hospitalisation pour GCL Cas de SG Cas de GCI |
FaibleNote de bas de page b |
| Treanor 2006Note de bas de page 84 | Gouvernement américain; auteur de Protein Sciences | ECR | É.-U. | VAR3 | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Tsang 2014Note de bas de page 73 | Sanofi Pasteur | ECR | É.-U. | VII3-HD | VII3-DS | Tout EIG | Manque de clartéNote de bas de page a |
| Nombre d'évènements vasculaires | Quelques préoccupationsNote de bas de page b | ||||||
| Van Aalst 2020Note de bas de page 62 | Sanofi Pasteur | Observation (cohorte rétroactive) | É.-U. | VII3-HD VII3-Adj | VII3-Adj | Hospitalisation | GraveNote de bas de page a |
| Van Buynder 2013Note de bas de page 42 | Subvention sans restriction, Novartis; Fraser Health Authority | Observation (CTTN) | Canada | VII3-Adj | VII3-DS | Consultations externes/urgences | GraveNote de bas de page a |
| Vardeny 2021Note de bas de page 39 | Gouvernement américain, Sanofi Pasteur | ECR | É.-U., Canada | VII3-HD | VII4-DS | Hospitalisation | Manque de clartéNote de bas de page a |
| Villa 2013Note de bas de page 89 | Manque de clarté; auteurs de Novartis | Observation (cohorte rétroactive) | Italie | VII3-Adj | VII3-DS | SGB | GraveNote de bas de page a |
| Young-Xu 2018Note de bas de page 47 | Sanofi Pasteur; auteurs de Sanofi | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-DS | Consultations externes/VU Hospitalisations |
GraveNote de bas de page a |
| Young-Xu 2019Note de bas de page 57 | Subvention sans restriction, Sanofi Pasteur; auteurs de Sanofi | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-DS | Hospitalisation | GraveNote de bas de page a |
| Young-Xu 2020Note de bas de page 59 | Subvention sans restriction, Sanofi Pasteur; auteurs de Sanofi | Observation (cohorte rétroactive) | É.-U. | VII3-HD | VII3-DS | Décès | ModéréNote de bas de page a |
Notes de bas de page :
|
|||||||
Abréviations : c., contre; VII3-Adj, vaccin trivalent inactivé contre l'influenza avec adjuvant (à base d'œufs); VII3-HD, vaccin trivalent inactivé contre l'influenza avec adjuvant à haute dose (à base d'œufs); VII3-DS, vaccin trivalent inactivé contre l'influenza avec adjuvant à dose standard (à base d'œufs); VII–Adj, vaccin inactivé contre l'influenza avec adjuvant (à base d'œufs); VII–HD, vaccin inactivé contre l'influenza à haute dose (à base d'œufs); VII–DS, vaccin inactivé contre l'influenza à dose standard (à base d'œufs); SG, syndrome grippal; GCL, grippe confirmée en laboratoire; ECR, essai contrôlé randomisé; EIG, évènement indésirable grave; VAR, vaccin antigrippal recombinant; VAR3, vaccin antigrippal recombinant trivalent; VAR4, vaccin antigrippal recombinant quadrivalent; VU, visites aux urgences; Cohorte rétro., cohorte rétrospective; CTTN, cas-témoins à test-négatif. |
|||||||
| Cote GRADE | Description |
|---|---|
| Élevé | Très confiant dans le fait que l'effet réel est proche de l'estimation de l'effet. |
| Modéré | Moyennement confiant : l'effet réel est probablement proche de l'estimation de l'effet, mais il est possible qu'il soit substantiellement différent. |
| Faible | Confiance limitée : l'effet réel peut être substantiellement différent de l'estimation de l'effet. |
| Très faible | Très peu de confiance : l'effet réel est susceptible d'être substantiellement différent de l'estimation de l'effet. |
| Abréviation : GRADE (Grading of Recommendations Assessment, Development and Evaluation). | |
| Importance de la recommandation du CCNI basée sur des facteurs non isolés de la validité des preuves (p. ex., besoin de santé publique) | Forte | Discrétionnaire |
|---|---|---|
| Libellé | « ;doit/ne doit pas être proposé; » | « ;peut/peut ne pas être proposé; » |
| Justification | Les avantages connus/anticipés l'emportent sur les inconvénients connus/anticipés (« ;doit; »), OU les inconvénients connus/anticipés l'emportent sur les avantages connus/anticipés (« ;ne doit pas; ») | Les avantages connus/prévus sont étroitement équilibrés par rapport aux inconvénients connus/prévus, OU il existe une incertitude quant à la preuve des avantages et des inconvénients. |
| Implication | Une recommandation importante s'applique à la plupart des populations/personnes et doit être suivie à moins qu'il n'existe une justification claire et convaincante pour une autre approche | Une recommandation discrétionnaire peut être envisagée pour certaines populations/personnes dans certaines circonstances. Des solutions de rechange peuvent être raisonnables |
Liste des abréviations
- ACIP
- Advisory Committee on Immunization Practices
- ASPC
- Agence de la santé publique du Canada
- AVAQ
- Année de vie ajustée sur la qualité
- cc
- Culture de cellules de mammifères
- CCNI
- Comité consultatif national de l'immunisation
- CE
- Coût/efficacité
- CINeMA
- Confiance dans la méta-analyse en réseau
- CIQ
- Comité sur l'immunisation du Québec
- É.-U.
- États-Unis
- ECR
- Essai contrôlé randomisé
- EEFA
- Éthique, équité, faisabilité et acceptabilité
- ÉI
- Évènement indésirable
- ÉIG
- Évènement indésirable grave
- EP
- Efficacité potentielle
- ER
- Efficacité réelle
- EVR
- Efficacité vaccinale relative
- GCI
- Guide canadien d'immunisation
- GCL
- Grippe confirmée en laboratoire
- GRADE
- Grading of Recommendations, Assessment, Development, and Evaluation
- HA
- Hémagglutinine
- IC
- intervalle de confiance
- IM
- Intramusculaire
- MAGIC
- Methods and Applications Group for Indirect Comparisons
- MAR
- Méta-analyse en réseau
- MDCK
- Cellule rénale de chien de la lignée Madin-Darby
- R.-U.
- Royaume-Uni
- RC
- Rapport de cotes
- RCED
- Rapport coût/efficacité différentiel
- RIEM
- Réseau sur l'innocuité et l'efficacité des médicaments
- RR
- Ratio de risque
- RT
- Ratio des taux
- RT-PCR
- Réaction en chaîne par polymérase à transcription inverse
- SG
- Syndrome grippal
- SGB
- Syndrome de Guillain-Barré
- USI
- Unité de soins intensifs
- VAR
- Vaccin antigrippal recombinant
- VAR3
- Vaccin antigrippal trivalent recombinant
- VAR4
- Vaccin antigrippal recombinant quadrivalent
- VII
- Vaccin inactivé contre l'influenza
- VII3
- Vaccin inactivé contre l'influenza trivalent
- VII3-Adj
- Vaccin trivalent inactivé contre l'influenza avec adjuvant (à base d'œufs)
- VII3-DS
- Vaccin trivalent inactivé contre l'influenza à dose standard (à base d'œufs)
- VII3-HD
- Vaccin trivalent inactivé contre l'influenza à haute dose (à base d'œufs)
- VII4
- Vaccin inactivé contre l'influenza quadrivalent
- VII4-Adj
- Vaccin quadrivalent inactivé contre l'influenza avec adjuvant (à base d'œufs)
- VII4-cc
- Vaccin quadrivalent inactivé contre l'influenza à base de culture de cellules de mammifères
- VII4-HD
- Vaccin quadrivalent inactivé contre l'influenza à haute dose (à base d'œufs)
- VII4-DS
- Vaccin quadrivalent inactivé contre l'influenza à dose standard (à base d'œufs)
- VII-Adj
- Vaccin inactivé contre l'influenza avec adjuvant (à base d'œufs)
- VII-cc
- Vaccin inactivé contre l'influenza à base de culture de cellules de mammifères
- VII-DS
- Vaccin inactivé contre l'influenza à dose standard (à base d'œufs)
- VII-HD
- Vaccin inactivé contre l'influenza à haute dose
- VRZ
- Vaccin recombinant contre le zona
- VU
- Visites aux urgences
Remerciements
Cette déclaration a été préparée par : P. Doyon-Plourde, A. Sinilaite, W. Siu et J. Papenburg, au nom du Groupe de travail sur l'influenza du CCNI et approuvé par le CCNI
Le CCNI tient à remercier les personnes suivantes pour leur contribution : M. Hersi, A. Howarth, K. Gusic, N. Moqueet, B. Pe Benito, A. Stevens, C. Tremblay, N. Sicard, M. Tunis, A. Tuite, M. W. Yeung, K. Young, R. Yorke et M. Xi.
Groupe de travail sur l'influenza du CCNI
Membres : J Papenburg (Chair), P De Wals, I Gemmill, R Harrison, J Langley, A McGeer, and D Moore
Anciens membres : D Fell
Représentante de liaison : L Grohskopf (Centers for Disease Control and Prevention [CDC], États-Unis)
Représentants d'office : L Lee (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), K Daly (Direction générale de la santé des Premières Nations et des Inuits [DGSPNI], Services aux Autochtones Canada [SAC]), B Warshawsky (bureau du vice-président, Direction générale de la prévention et du contrôle des maladies infectieuses [DGPCMI]), and M Russell (Direction des produits biologiques et des thérapies génétiques [DPBTG], Santé Canada [SC]).
CCNI
Membres : S Deeks (Chair), R Harrison (Vice-Chair), M Andrew, J Bettinger, N Brousseau, H Decaluwe, P De Wals, E Dubé, V Dubey, K Hildebrand, K Klein, M O'Driscoll, J Papenburg, A Pham-Huy, B Sander, and S Wilson.
Représentants de liaison : L Bill/M Nowgesic (Association canadienne des infirmières et infirmiers autochtones), LM Bucci (Association canadienne de santé publique), S Buchan (Association canadienne pour la recherche et l'évaluation en immunisation), E Castillo (Société des obstétriciens et gynécologues du Canada), J Comeau (Association pour la microbiologie médicale et l'infectiologie Canada), M Lavoie (Conseil des médecins hygiénistes en chef), J MacNeil (Centers for Disease Control and Prevention, États-Unis), D Moore (Société canadienne de pédiatrie), M Naus (Comité canadien d'immunisation), M Osmack (Association des médecins autochtones du Canada), J Potter (Collège des médecins de famille du Canada), and A Ung (Association des pharmaciens du Canada).
Anciens représentants de liaison : N Dayneka, and J Emili
Représentants d'office : V Beswick-Escanlar Défense nationale et Forces armées canadiennes), E Henry (CIMRI, ASPC), M Lacroix (Groupe consultatif en matière d'éthique en santé publique, ASPC), P Fandja (Direction des produits de santé commercialisés, Santé Canada), M Su (COVID-19 Épidémiologie et surveillance, ASPC), S Ogunnaike-Cooke (CIMRI, ASPC), C Pham (Direction des médicaments biologiques et radiopharmaceutiques, SC), M Routledge (Laboratoire national de microbiologie, ASPC) and T Wong (Direction générale de la santé des Premières nations et des Inuits, Services aux Autochtones Canada).
Annexe A : Terminologie clé pour comprendre les données probantes de l'évaluation économique
| Durée | Description |
|---|---|
| Analyse coûts/avantages | « ;Dans le domaine de l'évaluation des soins de santé, l'analyse coûts/avantages (ACA) est une comparaison des interventions et de leurs conséquences dans laquelle les coûts et les avantages qui en résultent (résultats sanitaires et autres) sont exprimés en termes monétaires. Cela permet de comparer 2 solutions de traitement ou plus à l'aide de la mesure sommaire du bénéfice monétaire net, qui est la différence entre le bénéfice de chaque traitement (exprimé en unités monétaires) moins le coût de chacun d'entre eux. Les évaluations monétaires des avantages sont généralement obtenues par le biais d'enquêtes sur la disposition à payer (DAP) ou d'expériences avec choix discrets (EACD). Bien qu'elle soit populaire dans d'autres domaines, l'ACA n'est pas couramment utilisée dans l'évaluation des technologies de la santé en raison de la difficulté d'associer des valeurs monétaires à des résultats de santé tels que la survie (accrue). Le plus souvent, les ACA ont été utilisées pour évaluer de grands projets d'investissement (nouvelles installations hospitalières) ou des interventions visant à améliorer les temps d'attente ou l'emplacement/l'accès aux servicesNote de bas de page 153; ». Le résultat d'une ACA est exprimé sous forme d'un avantage monétaire net (AMN) différentiel. « ;L'AMN est une statistique sommaire qui représente la valeur d'une intervention en termes monétaires lorsqu'un seuil de DAP pour une unité de bénéfice (p. ex., une mesure de résultats de santé ou AVAQ) est connu. L'AMN est calculé comme suit : (avantage différentiel x seuil) – coût différentiel. L'AMN différentiel mesure la différence d'AMN entre les interventions alternatives, un AMN différentiel positif indiquant que l'intervention est rentable par rapport à l'alternative au seuil de DAP donnée. Dans ce cas, le coût de l'obtention de l'avantage est inférieur au montant maximum que le décideur serait prêt à payer pour cet avantageNote de bas de page 153; ». |
| Analyse coût/efficacité | « ;L'analyse coût/efficacité (ACE) évalue l'efficacité de 2 traitements ou plus par rapport à leur coûtNote de bas de page 153; ». L'ACE est une évaluation économique dans laquelle les résultats en matière de santé sont exprimés en unités naturelles (p. ex., les infections évitées). Le résultat d'une ACE est exprimé sous forme d'un rapport coût/efficacité différentiel (RCED). Le RCED est un ratio calculé en divisant la différence des coûts moyens attendus par la différence des résultats ou effets moyens attendus sur la santé entre 2 solutions de rechange comparées dans le cadre d'une évaluation économique. |
| Analyse coût/utilité | L'analyse coût/utilité est une évaluation économique dans laquelle les résultats en matière de santé sont exprimés en AVAQ, ou toute autre mesure générique de l'utilité liée à la santé. On parle parfois d'ACE ou d'ACE avec AVAQ. Il s'agit de la forme d'évaluation économique privilégiée par les décideurs en matière de santé publique au Canada. Le résultat d'une ACU est exprimé sous forme d'un RCED (parfois appelé rapport coût/utilité différentiel [RCUD] dans le cadre d'une ACU en particulier). Le RCED est un ratio calculé en divisant la différence des coûts moyens attendus par la différence des AVAQ moyennes attendues entre 2 solutions de rechange comparées dans le cadre d'une évaluation économique. Les RCED peuvent être comparés aux seuils de coût/efficacité (voir ci-dessous) afin d'établir si la nouvelle intervention constitue une utilisation efficace des ressources. |
| Dominant | Une intervention est dominante si elle est moins coûteuse et plus efficace (c.-à-d. qu'elle apporte relativement plus d'avantages) que le comparateur. Inversement, une intervention qui est à la fois plus coûteuse et moins efficace est dite « ;dominée; ». |
| Perspective | Le point de vue à partir duquel une évaluation économique sera menée. La perspective détermine les résultats et les coûts qui seront inclus dans l'analyse. Le projet de lignes directrices du CCNI pour l'évaluation économique des programmes de vaccination au Canada (2022) recommande l'adoption de 2 analyses de scénario de référence : 1 a été réalisée du point de vue du système de santé public et l'autre du point de vue sociétal. Dans ces lignes directrices, le système de santé fait référence à la fois aux services de traitement des soins de santé et à la santé publique. L'objectif de ces scénarios de référence est d'encourager l'utilisation d'un ensemble standard de méthodes lors des évaluations économiques des programmes de vaccination et de s'assurer que les décideurs sont en mesure de comparer les résultats entre différents programmes de vaccination. Le point de vue du système de santé comprend toutes les ressources du système de santé public qui sont consommées par la mise en œuvre du programme de vaccination, ainsi que les ressources qui sont consommées ou économisées à la suite de sa mise en œuvre (p. ex., les coûts des soins de santé, les coûts de santé publique). La perspective du fournisseur est une perspective plus étroite qui inclut les ressources et les résultats associés aux professionnels de la santé (p. ex., l'hôpital). Le point de vue sociétal est plus large et tient compte de l'ensemble des avantages associés aux programmes de vaccination, y compris ceux dont bénéficient les secteurs autres que celui de la santé. Il comprend des éléments tels que les coûts à la charge des patients, la perte de productivité (individuelle, soignante, macroéconomique) et la consommation non médicale. |
| Horizon temporel | « ;L'horizon temporel utilisé pour une évaluation économique est la durée sur laquelle les résultats de santé et les coûts sont calculés. Le choix de l'horizon temporel est une décision importante pour la modélisation économique et dépend de la nature de la maladie et de l'intervention envisagées, ainsi que de l'objectif de l'analyse. Les horizons temporels plus longs s'appliquent aux maladies chroniques associées à une prise en charge médicale continue, plutôt qu'à une guérison. Un horizon temporel plus court peut être approprié pour certaines affections aiguës, pour lesquelles les conséquences à long terme sont moins importantesNote de bas de page 153; ». |
| Seuil de coût/efficacité | Les seuils de coût/efficacité peuvent être utilisés pour évaluer si une intervention présente un rapport qualité-prix suffisant pour mériter d'être adoptée dans le système de santé. Certains organismes préconisent leur utilisation parce qu'ils sont pratiques, tandis que d'autres les rejettent en soulignant leur caractère arbitraire. Il existe plusieurs approches pour estimer un seuil de coût/efficacité, en se basant sur : (1) la volonté de payer pour une unité de résultat; (2) la valeur des interventions déjà financées par le système; et (3) les coûts d'opportunité en termes de renoncement à d'avantages pour la santé (p. ex., le coût par AVAQ gagnée). Au Canada, aucun seuil explicite de coût/efficacité n'a été officiellement adopté par les organismes fédéraux ou provinciaux/territoriaux. Dans la littérature, les seuils de coût/efficacité courants se situent entre 20 000 et 100 000 dollars canadiens par AVAQ gagnée 40, 50 000 dollars canadiens par AVAQ étant couramment citésNote de bas de page 154. |
Annexe B : Méthodes d'évaluation de la qualité et de la généralisabilité
Les sections suivantes contiennent des renseignements supplémentaires sur les méthodes et les résultats de l'évaluation de la qualité et de la généralisation des études incluses.
La méthodologie de l'examen systématique a été élaborée en collaboration avec l'équipe MAGIC (Methods and Applications Group for Indirect Comparisons) dans le cadre du Réseau sur l'innocuité et l'efficacité des médicaments (RIEM). L'examen systématique a suivi les lignes directrices du CCNI pour les examens systématiques des évaluations économiques des programmes de vaccination. Les méthodes ont été spécifiées a priori dans un protocole écrit comprenant la question de recherche, la stratégie de recherche, les critères d'inclusion et d'exclusion et l'évaluation de la qualité (enregistré dans PROSPERO, CRD42020177337).
Évaluation de la qualité
La qualité des études incluses a été évaluée à l'aide de la liste de contrôle en 11 points du Joanna Briggs Institute (JBI) pour les évaluations économiquesNote de bas de page 155. Toutes les études incluses étaient de qualité élevée ou moyenne. Treize (13) études ont été considérées comme étant de haute qualité, rapportant au moins 10 des 11 éléments (plus de 90 %) de la liste de contrôle d'évaluation économique du JBINote de bas de page 94Note de bas de page 95Note de bas de page 97Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 107Note de bas de page 108Note de bas de page 109. Les 6 autres études étaient de qualité moyenne et présentaient 7 à 9 des 11 points (64 à 82 %) de la liste de contrôle pour les évaluations économiques du JBINote de bas de page 98Note de bas de page 99Note de bas de page 106Note de bas de page 110Note de bas de page 111Note de bas de page 112. Les principaux problèmes liés à l'évaluation de la qualité comprenaient des renseignements peu clairs ou insuffisants pour confirmer que tous les coûts et résultats importants et pertinents pour chaque intervention et comparateur étaient définis (n=4)Note de bas de page 98Note de bas de page 106Note de bas de page 111Note de bas de page 112 et que l'horizon temporel et le taux d'actualisation étaient définis et justifiés (n=4)Note de bas de page 98Note de bas de page 99Note de bas de page 106Note de bas de page 111.
Généralisabilité des études dans un contexte canadien
À l'aide de l'évaluation de la généralisation de HeylandNote de bas de page 156, 4 études, dont 2 menées au CanadaNote de bas de page 95Note de bas de page 101 et 2 menées au R.-U.Note de bas de page 97Note de bas de page 98, ont montré une applicabilité élevée dans un contexte canadien. Les autres études ont été jugées peu généralisables dans le contexte canadien. La plupart des autres études ont satisfait à moins de la moitié des critères de l'évaluation de la généralisation de Heyland. Les éléments suivants de l'évaluation de la généralisabilité de Heyland ont été mal notés lorsque l'on compare l'article évalué et le contexte d'intérêt (c.-à-d. le Canada) :
- Préférences similaires des patients : n=19 étudesNote de bas de page 94Note de bas de page 95Note de bas de page 96Note de bas de page 97Note de bas de page 98Note de bas de page 99Note de bas de page 100Note de bas de page 101Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112
- Les taux de change ont pu être convertis de manière appropriée : n=17 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 97Note de bas de page 98Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112
- Coût moyen par patient similaire : n=16 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 98Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112
- Consommation de ressources similaire : n=15 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112
- Prix unitaire similaire des ressources pertinentes : n=15 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111Note de bas de page 112
- Perspective d'analyse similaire : n=14 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107Note de bas de page 108Note de bas de page 109Note de bas de page 110Note de bas de page 111
Annexe C : Résultats des autres études d'évaluation économique incluses jugées moins généralisables dans un contexte canadien
Les résultats des études coût/utilité, coût/avantage et coût/efficacité jugées moins généralisables dans un contexte canadien sont décrits ci-dessous.
Résultats des études d'analyse coût/utilité sont considérés comme étant moins généralisables dans un contexte canadien
Parmi les 12 autres études coût/utilité, menées dans des contextes où la généralisabilité est limitée à un contexte canadien, les perspectives suivantes ont été retenues. Il convient de noter qu'une même étude peut comporter plusieurs analyses sous différents angles.
- Payeur de soins de santé : n=5 étudesNote de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 108Note de bas de page 109
- Sociétal : n=10 étudesNote de bas de page 94Note de bas de page 96Note de bas de page 99Note de bas de page 100Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106Note de bas de page 107
- Professionnels de la santé : n=1 étudeNote de bas de page 102
Les résultats sont décrits ci-dessous. Les résultats étaient similaires à ceux des études susmentionnées jugées généralisables dans le contexte canadien.
Résultats d'études d'analyse coût/utilité dont la généralisabilité est limitée à un contexte canadien : Perspective du payeur de soins de santé
Les 2 études italiennes comparant une stratégie VII4-DS à une stratégie VII3-DS ont donné des résultats différents, avec des estimations du RCED allant de 32 617 $ par AVAQ gagnée sur un horizon temporel de vieNote de bas de page 99 à 224 000 $ par AVAQ gagnée sur un horizon temporel d'un anNote de bas de page 108 (Tableau A2).
Les valeurs du RCED pour une stratégie VII3-Adj par rapport à une stratégie VII3-DS variaient de 3 406 $Note de bas de page 109 et 7 692 $Note de bas de page 108 par AVAQ gagnée (Tableau A2). Ces estimations peuvent être considérées comme rentables selon les seuils fréquemment utilisés.
Parmi les 2 études comparant une stratégie VII3-HD à une stratégie VII3-DS, l'une (100) a conclu que la stratégie VII3-HD était moins coûteuse et plus efficace que la stratégie VII3-DS et l'autre étude (96) a estimé une valeur de RCED de 13 537 $ par AVAQ gagnée (Tableau A2).
Une (1) étude comparant une stratégie VII3-HD à une stratégie VII4-DS a estimé une valeur de RCED de 5 709 $ par AVAQ gagnée (Tableau A2)Note de bas de page 96.
| Auteur, année, pays | Financement | Population | Horizon temporel | Conclusions |
|---|---|---|---|---|
| VII4-DS (intervention) par rapport à VII3-DS (comparateur) | ||||
| Mennini et al., 2018Note de bas de page 99, Italie | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | À vie | 32 617 $/AVAQ gagnée |
| Capri et al., 2018Note de bas de page 108, Italie | Seqirus SRL (Industrie) | Adultes de 65 ans et plus | Un (1) an | 224 000 $/AVAQ gagnée |
| VII3-Adj (intervention) par rapport à VII3-DS (comparateur) | ||||
| Capri et al., 2018Note de bas de page 108, Italie | Seqirus SRL (Industrie) | Adultes de 65 ans et plus | Un (1) an | 7 692 $/AVAQ gagnée |
| Nguyen et al., 2020Note de bas de page 109, Argentine | Seqirus USA Inc (Industrie) | Adultes de 65 ans et plus | Un (1) an | 3 406 $/AVAQ gagnée |
| VII3-HD (intervention) par rapport à VII3-DS (comparateur) | ||||
| Chit et al., 2015bNote de bas de page 100, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | VII3-HD a dominé VII3-DS Participants vivant avec une comorbidité ou plus : VII3-HD a dominé VII3-DS Participants atteints d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS |
| Chit et al., 2015cNote de bas de page 96, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Une (1) saison grippale pour le coût et la durée de vie pour l'effet | 13 537 $/AVAQ gagnée |
| VII3-HD (intervention) par rapport à VII4-DS (comparateur) | ||||
| Chit et al., 2015cNote de bas de page 96, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Une (1) saison grippale pour le coût et la durée de vie pour l'effet | 5 709 $/AVAQ gagnée |
| Remarque : « ;L'intervention A a dominé l'intervention B; » signifie que l'intervention A est moins coûteuse et plus efficace que l'intervention B. | ||||
Résultats d'études d'analyse coût/utilité dont la généralisation est limitée à un contexte canadien : Point de vue sociétal
Les comparaisons suivantes ont été analysées à partir d'études qui ont effectué des analyses d'un point de vue sociétal :
- VII4-DS par rapport à VII3-DS : n=7 étudesNote de bas de page 94Note de bas de page 99Note de bas de page 102Note de bas de page 103Note de bas de page 104Note de bas de page 105Note de bas de page 106
- VII3-Adj par rapport à VII3-DS : n=2 étudesNote de bas de page 99Note de bas de page 104
- VII3-HD par rapport à VII3-DS : n=3 étudesNote de bas de page 96Note de bas de page 100Note de bas de page 107
- VII3-HD par rapport à VII4-DS : n=2 étudesNote de bas de page 96Note de bas de page 107
Parmi les 7 études comparant une stratégie VII4-DS à une stratégie VII3-DS, 2 ont conclu qu'une stratégie VII4-DS était moins coûteuse et plus efficace qu'une stratégie VII3-DS (Tableau A3)Note de bas de page 103Note de bas de page 105. Les estimations du RCED pour les 6 autres études variaient de 8 087 $Note de bas de page 94 à 55 865 $Note de bas de page 106 par AVAQ gagnée sur des horizons temporels allant d'un an à la durée de vie. Notamment, les 2 études qui ont effectué des analyses de sous-groupes par groupe d'âge ont révélé qu'une stratégie VII4-DS était de plus en plus rentable qu'une stratégie VII3-DS pour les groupes plus âgés.Note de bas de page 102Note de bas de page 104
Les 2 études comparant une stratégie VII3-Adj à une stratégie VII3-DS ont révélé qu'une stratégie VII3-Adj était moins coûteuse et plus efficace qu'une stratégie VII3-DS sur un horizon de vie chez les adultes de 65 ans et plus (Tableau A3)Note de bas de page 99Note de bas de page 104. Ces résultats ont été confirmés dans l'étude qui a effectué des analyses de sous-groupes par groupe d'âge (65 à 74 ans, 75 à 84 ans et 85 ans et plus) et pour les personnes présentant un risque élevé d'infection grippale saisonnière et/ou de complications ou d'hospitalisation liées à la grippeNote de bas de page 104.
Sur les 3 études comparant une stratégie VII3-HD à une stratégie VII3-DS, l'une d'entre elles a conclu qu'une stratégie VII3-HD était moins coûteuse et plus efficace qu'une stratégie VII3-DS (Tableau A3)Note de bas de page 100. Les 2 autres études ont montré qu'une stratégie VII3-HD coûtait 6 930 $Note de bas de page 96 à 36 967 $Note de bas de page 107 pour chaque AVAQ gagnée par rapport à une stratégie VII3-DS.
Deux (2) études ont comparé une stratégie VII3-HD à une stratégie VII4-DS (Tableau A3). Une (1) étude a montré qu'une stratégie VII3-HD était moins coûteuse et plus efficace qu'une stratégie VII4-DSNote de bas de page 96, tandis que la deuxième étude a révélé qu'une stratégie VII3-HD coûtait 40 824 $Note de bas de page 107 de plus qu'une stratégie VII4-DS pour chaque AVAQ gagnée.
| Auteur, année, pays | Financement | Population | Horizon temporel | Conclusions |
|---|---|---|---|---|
| VII4-DS (intervention) par rapport à VII3-DS (comparateur) | ||||
| Jiang et al., 2020Note de bas de page 94, Chine | China Postdoctoral Science Foundation China (fonds publics et industrie) | Adultes de 69 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | 8 087 $/AVAQ gagnée |
| You et al., 2015Note de bas de page 102, Hong Kong | Non déclaré | Adultes de 65 ans et plus | Non déclaré | Tous les participants de 65 ans et plus : 16 424 $/AVAQ gagnée Analyses de sous-groupes Participants de 65 à 79 ans : 40 221 $/AVAQ gagnée Participants de 80 ans et plus : VII4-DS a dominé VII3-DS |
| Kim et al., 2018Note de bas de page 103, Corée du Sud | GlaxoSmith-Kline Biologicals SA (Industrie) | Adultes de 65 ans et plus | Un (1) an pour les coûts et les effets | Large éventail de codes CIM-10 utilisés pour identifier l'infection grippale : VII4-DS a dominé VII3-DS Ensemble restreint de codes CIM-10 utilisés pour identifier l'infection grippale : VII4-DS a dominé VII3-DS |
| Yun et al., 2019Note de bas de page 104, Corée du Sud | Korea Centers for Disease Control and Prevention (Public) | Adultes de 65 ans et plus | Durée de vie pour le coût et l'effet | Tous les participants de 65 ans et plus : 22 656 $/AVAQ gagnée Analyses de sous-groupes Participants de 65 à 74 ans : 31 869 $/AVAQ gagnée Participants de 75 à 84 ans : 13 304 $/AVAQ gagnée Participants de 85 ans et plus : 4 392 $/AVAQ gagnée |
| Brogan et al., 2017Note de bas de page 105, États-Unis | GlaxoSmith-Kline Biologicals SA (Industrie) | Adultes de 65 ans et plus | 10 ans pour les coûts et les effets | VII4-DS a dominé VII3-DS |
| You et al., 2014Note de bas de page 106, Hong Kong | Aucun | Adultes de 65 ans et plus | 9 ans pour les coûts et les effets | En supposant que le VII4-DS coûte 1 USD de plus que le VII3-DS en 2010, le RCED était de 55 865 $/AVAQ gagnée pour les adultes de 65 à 79 ans et le VII4-DS dominait le VII3-DS pour les adultes de 85 ans et plus. |
| Mennini et al., 2018Note de bas de page 99, Italie | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Durée de vie pour le coût et l'effet | 32 617 $/AVAQ gagnée |
| VII3-Adj (intervention) par rapport à VII3-DS (comparateur) | ||||
| Yun et al., 2019Note de bas de page 104, Corée du Sud | Korea Centers for Disease Control and Prevention (Public) | Adultes de 65 ans et plus | Durée de vie pour le coût et l'effet | Tous les participants de 65 ans et plus : VII3-Adj a dominé VII3-DS Analyses de sous-groupes Participants de 65 à 74 ans : VII3-Adj a dominé VII3-DS Participants de 75 à 84 ans : VII3-Adj a dominé VII3-DS Participants de 85 ans et plus : VII3-Adj a dominé VII3-DS Participants présentant un risque élevé d'infection grippale saisonnière et/ou de complications ou d'hospitalisations liées à la grippe : VII3-Adj a dominé VII3-DS |
| Mennini et al., 2018Note de bas de page 99, Italie | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Durée de vie pour le coût et l'effet | VII3-Adj a dominé VII3-DS |
| VII3-HD (intervention) par rapport à VII3-DS (comparateur) | ||||
| Chit et al., 2015bNote de bas de page 100, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | VII3-HD a dominé VII3-DS Participants vivant avec une comorbidité ou plus : VII3-HD a dominé VII3-DS Participants atteints d'une affection cardiorespiratoire : VII3-HD a dominé VII3-DS |
| Chit et al,, 2015cNote de bas de page 96, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | 6 930 $/AVAQ gagnée |
| Raviotta et al., 2016Note de bas de page 107, É.-U. | National Institute of General Medical Sciences of the National Institutes of Health Award (industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | 36 967 $/AVAQ gagnée |
| VII3-HD (intervention) par rapport à VII4-DS (comparateur) | ||||
| Chit et al., 2015cNote de bas de page 96, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | VII3-HD a dominé VII4-DS |
| Raviotta et al., 2016Note de bas de page 107, É.-U. | National Institute of General Medical Sciences of the National Institutes of Health Award (industrie) | Adultes de 65 ans et plus | Un (1) an pour le coût et la durée de vie pour l'effet | 40 824 $/AVAQ gagnée |
| Remarque : « ;L'intervention A a dominé l'intervention B; » signifie que l'intervention A est moins coûteuse et plus efficace que l'intervention B. | ||||
Résultats d'études d'analyse coût/utilité dont la généralisation est limitée à un contexte canadien : Perspective des professionnels de la santé
Une (1) étude a été menée de la perspective des professionnels de la santé et n'a pas indiqué l'horizon temporel utilisé pour l'analyseNote de bas de page 102. L'étude a montré qu'une stratégie VII4-DS coûtait 29 562 dollars de plus qu'une stratégie VII3-DS pour chaque AVAQ gagnéeNote de bas de page 102. L'étude a révélé qu'une stratégie VII4-DS était de plus en plus rentable (c.-à-d. avec un RCED plus faible) par rapport à une stratégie VII3-DS à mesure que l'âge augmentaitNote de bas de page 102.
Résultats des études d'analyse coût/avantage
Les 2 analyses coût/avantage ont conclu qu'une stratégie VII3-HD était rentable (c.-à-d. qu'elle présentait un avantage monétaire net positif) par rapport à une stratégie VII3-DS aux É.-U.(Tableau A4)Note de bas de page 110Note de bas de page 111.
| Auteur, année, pays | Financement | Population | Perspective | Horizon temporel | Conclusions |
|---|---|---|---|---|---|
| VII3-HD (intervention) par rapport à VII3-DS (comparateur) | |||||
| Shireman et al., 2019Note de bas de page 110, É.-U. | Sanofi Pasteur (Industrie) | Adultes de 65 ans et plus, résidents de maisons de retraite | Payeur de soins de santé | Une (1) saison grippale pour le coût et l'effet | Avantage monétaire net positif |
| van Aalst et al., 2019Note de bas de page 111, É.-U. | Sources multiples (industrie) | Adultes de 65 ans et plus, anciens combattants | Payeur de soins de santé | Non précisé | Avantage monétaire net positif |
Résultats des études d'analyse coût/efficacité
Une (1) étude coût/efficacité comparant une stratégie VII3-Adj à une stratégie VII3-DS a été recenséeNote de bas de page 112. L'étude a été menée de la perspective d'un payeur de soins de santé français sur un horizon d'un an pour le coût et sur l'horizon temporel à vie pour l'effetNote de bas de page 112. L'étude a estimé les RCED à 44 492 dollars par décès évité et à 8 943 dollars par année de vie gagnée pour une stratégie VII3-Adj par rapport à une stratégie VII3-DSNote de bas de page 112.
Références
- Note de bas de page 1
-
Schanzer DL, McGeer A, Morris K. Statistical estimates of respiratory admissions attributable to seasonal and pandemic influenza for Canada. Influenza Other Respir Viruses. Sept. 2013;7(5):799-808. https://doi.org/10.1111/irv.12011
- Note de bas de page 2
-
Schanzer DL, Sevenhuysen C, Winchester B, Mersereau T. Estimating influenza deaths in Canada, 1992-2009. PLoS One. 27 nov. 2013;8(11):e80481. https://doi.org/10.1371/journal.pone.0080481
- Note de bas de page 3
-
Mitchell R, Taylor G, McGeer A, Frenette C, Suh KN, Wong A, et al. Understanding the burden of influenza infection among adults in Canadian hospitals: A comparison of the 2009-2010 pandemic season with the prepandemic and postpandemic seasons. Am J Infect Control. Nov. 2013;41(11):1032-7. https://doi.org/10.1016/j.ajic.2013.06.008
- Note de bas de page 4
-
Comité consultatif national de l'immunisation (CCNI). Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2022-2023 [Internet]. Ottawa (ON) : Agence de la santé publique du Canada; 8 juin 2023 [cité le 14 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/publications/vaccines-immunization/canadian-immunization-guide-statement-seasonal-influenza-vaccine-2022-2023.html
- Note de bas de page 5
-
Comité consultatif national de l'immunisation (CCNI). Recommandations relatives au vaccin antigrippal trivalent contenant l'adjuvant MF59 (FluadMD). Relevé des maladies transmissibles au Canada 21 oct. 2011;37(ACS-6):1-68. https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/publicat/ccdr-rmtc/11vol37/acs-dcc-6/assets/pdf/acs-dcc-6-fra.pdf. https://doi.org/10.14745/ccdr.v37i00a06
- Note de bas de page 6
-
Comité consultatif national de l'immunisation (CCNI). Examen de la littérature sur le vaccin contre la grippe saisonnière à haute dose chez les adultes de 65 ans et plus [Internet]. Ottawa (ON) : Gouvernement du Canada; 2016 [cité le 15 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/immunization/national-advisory-committee-on-immunization-naci/a-review-literature-high-dose-seasonal-influenza-vaccine-adults-65-years-older.html
- Note de bas de page 7
-
Comité consultatif national de l’immunisation (CCNI). Mise à jour sur la revue de la littérature portant sur l’efficacité potentielle et réelle des vaccins antigrippaux trivalents inactivés à forte dose (FluzoneMD Haute dose) et contenant l’adjuvant MF59 (FluadMD) chez les adultes âgés de 65 ans et plus ®®[Internet]. Ottawa (ON) : Gouvernement du Canada; mai 2018 [cité le 18 octobre 2023]. Disponible à : https://publications.gc.ca/site/eng/9.852907/publication.html
- Note de bas de page 8
-
Goodwin K, Viboud C, Simonsen L. Antibody response to influenza vaccination in the elderly: a quantitative review. Vaccine. 2006 fév 20;24(8):1159-69. https://doi.org/10.1016/j.vaccine.2005.08.105.
- Note de bas de page 9
-
Beyer WEP, McElhaney J, Smith DJ, Monto AS, Nguyen-Van-Tam JS, Osterhaus ADME. Cochrane re-arranged: support for policies to vaccinate elderly people against influenza. Vaccine. 5 déc. 2013;31(50):6030-3. https://doi.org/10.1016/j.vaccine.2013.09.063
- Note de bas de page 10
-
Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy, and effectiveness of influenza vaccines: a systematic review and meta-analysis. Lancet Infect Dis. Janv. 2012;12(1):36-44. https://doi.org/10.1016/S1473-3099(11)70295-X
- Note de bas de page 11
-
Schünemann HJ, Wiercioch W, Brozek J, Etxeandia-Ikobaltzeta I, Mustafa RA, Manja V, et al. GRADE Evidence to Decision (EtD) frameworks for adoption, adaptation, and de novo development of trustworthy recommendations: GRADE-ADOLOPMENT. J Clin Epidemiol. Janv. 2017;81:101-10. https://doi.org/10.1016/j.jclinepi.2016.09.009
- Note de bas de page 12
-
Tricco A, Straus S, Hutton B, Corry M, Veroniki AA, Muller M, et al. Comparative effectiveness of influenza vaccines in adults 65 years of age and older: a systematic review and network meta-analysis. PROSPERO. 2020.
- Note de bas de page 13
-
Isaranuwatchai W, Loong D, Masucci L, Deena D, Tricco A, Radhakrishnan A, et al. Systematic Review on the Cost-Effectiveness of Seasonal Influenza Vaccines in Older Adults. PROSPERO. 2020. https://doi.org/https://www.crd.york.ac.uk/prospero/display_record.php?ID=CRD42020177337
- Note de bas de page 14
-
Grohskopf LA, Blanton LH, Ferdinands JM, Chung JR, Broder KR, Talbot HK, et al. Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices - United States, 2022-23 Influenza Season. MMWR Recomm Rep. 26 août 2022;71(1):1-28. https://doi.org/10.15585/mmwr.rr7101a1
- Note de bas de page 15
-
Veroniki AA, Thirugnanasampanthar SS, Konstantinidis M, Dourka J, Ghassemi M, Neupane D, et al. Comparing trivalent and quadrivalent seasonal influenza vaccine efficacy in persons 60 years of age and older: A systematic review and network meta-analysis. medRxiv. 29 nov. 2023. https://doi.org/10.1101/2023.11.29.23299123
- Note de bas de page 16
-
Groves HE, Piché-Renaud P, Peci A, Farrar DS, Buckrell S, Bancej C, et al. The impact of the COVID-19 pandemic on influenza, respiratory syncytial virus, and other seasonal respiratory virus circulation in Canada: A population-based study. Lancet Reg Health Am. Sept. 2021;1:100015. https://doi.org/10.1016/j.lana.2021.100015
- Note de bas de page 17
-
Schanzer DL, Saboui M, Lee L, Nwosu A, Bancej C. Burden of influenza, respiratory syncytial virus, and other respiratory viruses and the completeness of respiratory viral identification among respiratory inpatients, Canada, 2003-2014. Influenza Other Respir Viruses. Janv. 2018;12(1):113-21. https://doi.org/10.1111/irv.12497
- Note de bas de page 18
-
Schanzer DL, Tam TWS, Langley JM, Winchester BT. Influenza-attributable deaths, Canada 1990-1999. Epidemiol Infect. Oct. 2007;135(7):1109-16. https://doi.org/10.1017/S0950268807007923
- Note de bas de page 19
-
Hamilton MA, Liu Y, Calzavara A, Sundaram ME, Djebli M, Darvin D, et al. Predictors of all-cause mortality among patients hospitalized with influenza, respiratory syncytial virus, or SARS-CoV-2. Influenza Other Respir Viruses. Nov. 2022;16(6):1072-81. https://doi.org/10.1111/irv.13004
- Note de bas de page 20
-
Lees C, Godin J, McElhaney JE, McNeil SA, Loeb M, Hatchette TF, et al. Frailty Hinders Recovery from Influenza and Acute Respiratory Illness in Older Adults. J Infect Dis. 6 juill. 2020;222(3):428-37. https://doi.org/10.1093/infdis/jiaa092
- Note de bas de page 21
-
Agence de la santé publique du Canada (ASPC). FluWatch report: April 30 to May 20, 2023 (weeks 18-20) [Internet]. Ottawa (ON): Government of Canada; 2023 May 26 [cité le 17 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/publications/diseases-conditions/fluwatch/2022-2023/weeks-18-20-april-30-may-20-2023.html
- Note de bas de page 22
-
Buckrell S, Moussa MB, Bui T, Rahal A, Schmidt K, Lee L, et al. National Influenza Annual Report, Canada, 2021–2022: A brief, late influenza epidemic. CCDR. 26 oct. 2022;48(10):473-83. https://doi.org/10.14745/ccdr.v48i10a07
- Note de bas de page 23
-
Lee L. Personal Communication. Feedback on epi burden for NACI Influenza Working Group ppt for adults age 65+. 14 juin 2023.
- Note de bas de page 24
-
Agence de la santé publique du Canada (ASPC). Points saillants de l'Enquête sur la couverture vaccinale contre la grippe saisonnière de 2021–2022 [Internet]. Ottawa (ON) : Gouvernement du Canada; 21 nov. 2022 [cité le 17 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/immunization-vaccines/vaccination-coverage/seasonal-influenza-survey-results-2021-2022.html
- Note de bas de page 25
-
Comité consultatif national de l'immunisation (CCNI). Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2016-2017 [Internet]. Ottawa (ON) : Agence de la santé publique du Canada; 18 oct. 2016 [cité le 15 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/immunization/national-advisory-committee-on-immunization-naci/canadian-immunization-guide-chapter-on-influenza-statement-on-seasonal-influenza-vaccine-2016-2017-advisory-committee-statement.html
- Note de bas de page 26
-
Comité consultatif national de l'immunisation (CCNI). Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2021-2022 [Internet]. Ottawa (ON) : Agence de la santé publique du Canada; 31 mai 2021 [cité le 7 sept. 2023]. Disponible à : https://www.canada.ca/en/public-health/services/publications/vaccines-immunization/canadian-immunization-guide-statement-seasonal-influenza-vaccine-2021-2022.html
- Note de bas de page 27
-
Evidence-based recommendations for immunization-methods of the National Advisory Committee on Immunization. An Advisory Committee Statement (ACS). Can Commun Dis Rep. Janv. 2009;35(ACS-1):1-10.
- Note de bas de page 28
-
Product monograph: FLUAD Pediatric™ and FLUAD®(Influenza Vaccine, Surface Antigen, Inactivated, Adjuvanted with MF59C.1) [Internet]. Maidenhead (UK): Seqirus; 28 avril 2017 [cité le 15 août 2023]. Disponible à : https://pdf.hres.ca/dpd_pm/00070120.PDF
- Note de bas de page 29
-
Comité consultatif national de l'immunisation (CCNI). Déclaration sur la vaccination antigrippale pour la saison 2011-2012 : Une déclaration d'un comité consultatif (DCC) Comité consultatif national de l'immunisation (CCNI)†. Relevé des maladies transmissibles au Canada 14 oct. 2011;37(ACS-5):1-55. https://www.canada.ca/content/dam/phac-aspc/migration/phac-aspc/publicat/ccdr-rmtc/11vol37/acs-dcc-5/assets/pdf/acs-dcc-5-fra.pdf. https://doi.org/10.14745/ccdr.v37i00a05
- Note de bas de page 30
-
Comité consultatif national de l'immunisation (CCNI). Déclaration sur la vaccination antigrippale pour la saison 2014-2015 [Internet]. Ottawa (ON) : Gouvernement du Canada; 2021 [cité le 15 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/immunization/national-advisory-committee-on-immunization-naci/statement-on-seasonal-influenza-vaccine-2014-2015.html
- Note de bas de page 31
-
Schwarz TF, Aggarwal N, Moeckesch B, Schenkenberger I, Claeys C, Douha M, et al. Immunogenicity and Safety of an Adjuvanted Herpes Zoster Subunit Vaccine Coadministered With Seasonal Influenza Vaccine in Adults Aged 50 Years or Older. J Infect Dis. 12 déc. 2017;216(11):1352-61. https://doi.org/10.1093/infdis/jix481
- Note de bas de page 32
-
Comité consultatif national de l'immunisation (CCNI). Recommandations à jour sur l'utilisation des vaccins contre l'herpès zoster [Internet]. Ottawa (ON) : Gouvernement du Canada; 27 août 2018 [cité le 17 août 2023]. Disponible à : https://www.canada.ca/en/services/health/publications/healthy-living/updated-recommendations-use-herpes-zoster-vaccines.html
- Note de bas de page 33
-
DiazGranados CA, Dunning AJ, Kimmel M, Kirby D, Treanor J, Collins A, et al. Efficacy of high-dose versus standard-dose influenza vaccine in older adults. N Engl J Med. 14 août 2014;371(7):635-45. https://doi.org/10.1056/NEJMoa1315727
- Note de bas de page 34
-
Dunkle LM, Izikson R, Patriarca P, Goldenthal KL, Muse D, Callahan J, et al. Efficacy of Recombinant Influenza Vaccine in Adults 50 Years of Age or Older. N Engl J Med. 22 juin 2017;376(25):2427-36. https://doi.org/10.1056/NEJMoa1608862
- Note de bas de page 35
-
Frey SE, Reyes MRAL, Reynales H, Bermal NN, Nicolay U, Narasimhan V, et al. Comparison of the safety and immunogenicity of an MF59®-adjuvanted with a non-adjuvanted seasonal influenza vaccine in elderly subjects. Vaccine. 3 sept. 2014;32(39):5027-34. https://doi.org/10.1016/j.vaccine.2014.07.013
- Note de bas de page 36
-
Keitel WA, Atmar RL, Cate TR, Petersen NJ, Greenberg SB, Ruben F, et al. Safety of high doses of influenza vaccine and effect on antibody responses in elderly persons. Arch Intern Med. 22 mai 2006;166(10):1121-7. https://doi.org/10.1001/archinte.166.10.1121
- Note de bas de page 37
-
Belongia EA, Levine MZ, Olaiya O, Gross FL, King JP, Flannery B, et al. Clinical trial to assess immunogenicity of high-dose, adjuvanted, and recombinant influenza vaccines against cell-grown A(H3N2) viruses in adults 65 to 74 years, 2017-2018. Vaccine. 30 mars 2020;38(15):3121-8. https://doi.org/10.1016/j.vaccine.2020.02.055
- Note de bas de page 38
-
DiazGranados CA, Robertson CA, Talbot HK, Landolfi V, Dunning AJ, Greenberg DP. Prevention of serious events in adults 65 years of age or older: A comparison between high-dose and standard-dose inactivated influenza vaccines. Vaccine. 11 sept. 2015;33(38):4988-93. https://doi.org/10.1016/j.vaccine.2015.07.006
- Note de bas de page 39
-
Vardeny O, Kim K, Udell JA, Joseph J, Desai AS, Farkouh ME, et al. Effect of High-Dose Trivalent vs Standard-Dose Quadrivalent Influenza Vaccine on Mortality or Cardiopulmonary Hospitalization in Patients With High-risk Cardiovascular Disease: A Randomized Clinical Trial. JAMA. 5 janv. 2021;325(1):39-49. https://doi.org/10.1001/jama.2020.23649
- Note de bas de page 40
-
Gravenstein S, Davidson HE, Taljaard M, Ogarek J, Gozalo P, Han L, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccination on numbers of US nursing home residents admitted to hospital: a cluster-randomised trial. Lancet Respir Med. Sept. 2017;5(9):738-46. https://doi.org/10.1016/S2213-2600(17)30235-7
- Note de bas de page 41
-
McConeghy KW, Davidson HE, Canaday DH, Han L, Saade E, Mor V, et al. Cluster-randomized Trial of Adjuvanted Versus Nonadjuvanted Trivalent Influenza Vaccine in 823 US Nursing Homes. Clin Infect Dis. 6 déc. 2021;73(11):e4237-43. https://doi.org/10.1093/cid/ciaa1233
- Note de bas de page 42
-
Van Buynder PG, Konrad S, Van Buynder JL, Brodkin E, Krajden M, Ramler G, et al. The comparative effectiveness of adjuvanted and unadjuvanted trivalent inactivated influenza vaccine (TIV) in the elderly. Vaccine. 9 déc. 2013;31(51):6122-8. https://doi.org/10.1016/j.vaccine.2013.07.059
- Note de bas de page 43
-
Balasubramani GK, Choi WS, Nowalk MP, Zimmerman RK, Monto AS, Martin ET, et al. Relative effectiveness of high dose versus standard dose influenza vaccines in older adult outpatients over 4 seasons, 2015-16 to 2018-19. Vaccine. 29 sept. 2020;38(42):6562-9. https://doi.org/10.1016/j.vaccine.2020.08.011
- Note de bas de page 44
-
Izurieta HS, Thadani N, Shay DK, Lu Y, Maurer A, Foppa IM, et al. Comparative effectiveness of high-dose versus standard-dose influenza vaccines in US residents aged 65 years and older from 2012 to 2013 using Medicare data: a retrospective cohort analysis. Lancet Infect Dis. Mars 2015;15(3):293-300. https://doi.org/10.1016/S1473-3099(14)71087-4
- Note de bas de page 45
-
Izurieta HS, Chillarige Y, Kelman J, Wei Y, Lu Y, Xu W, et al. Relative Effectiveness of Cell-Cultured and Egg-Based Influenza Vaccines Among Elderly Persons in the United States, 2017-2018. J Infect Dis. 13 sept. 2019;220(8):1255-64. https://doi.org/10.1093/infdis/jiy716
- Note de bas de page 46
-
Shay DK, Chillarige Y, Kelman J, Forshee RA, Foppa IM, Wernecke M, et al. Comparative Effectiveness of High-Dose Versus Standard-Dose Influenza Vaccines Among US Medicare Beneficiaries in Preventing Postinfluenza Deaths During 2012-2013 and 2013-2014. J Infect Dis. 15 févr. 2017;215(4):510-7. https://doi.org/10.1093/infdis/jiw641
- Note de bas de page 47
-
Young-Xu Y, Van Aalst R, Mahmud SM, Rothman KJ, Snider JT, Westreich D, et al. Relative Vaccine Effectiveness of High-Dose Versus Standard-Dose Influenza Vaccines Among Veterans Health Administration Patients. J Infect Dis. 5 mai 2018;217(11):1718-27. https://doi.org/10.1093/infdis/jiy088
- Note de bas de page 48
-
Iob A, Brianti G, Zamparo E, Gallo T. Evidence of increased clinical protection of an MF59-adjuvant influenza vaccine compared to a non-adjuvant vaccine among elderly residents of long-term care facilities in Italy. Epidemiol Infect. Août 2005;133(4):687-93. https://doi.org/10.1017/s0950268805003936
- Note de bas de page 49
-
Pelton SI, Divino V, Shah D, Mould-Quevedo J, DeKoven M, Krishnarajah G, et al. Evaluating the Relative Vaccine Effectiveness of Adjuvanted Trivalent Influenza Vaccine Compared to High-Dose Trivalent and Other Egg-Based Influenza Vaccines among Older Adults in the US during the 2017-2018 Influenza Season. Vaccines (Basel). 7 août 2020;8(3):446. https://doi.org/10.3390/vaccines8030446
- Note de bas de page 50
-
Izurieta HS, Chillarige Y, Kelman J, Wei Y, Lu Y, Xu W, et al. Relative Effectiveness of Influenza Vaccines Among the United States Elderly, 2018-2019. J Infect Dis. 29 juin 2020;222(2):278-87. https://doi.org/10.1093/infdis/jiaa080
- Note de bas de page 51
-
Izurieta HS, Lu M, Kelman J, Lu Y, Lindaas A, Loc J, et al. Comparative Effectiveness of Influenza Vaccines Among US Medicare Beneficiaries Ages 65 Years and Older During the 2019-2020 Season. Clin Infect Dis. 6 déc. 2021;73(11):e4251-9. https://doi.org/10.1093/cid/ciaa1727
- Note de bas de page 52
-
Doyle JD, Beacham L, Martin ET, Talbot HK, Monto A, Gaglani M, et al. Relative and Absolute Effectiveness of High-Dose and Standard-Dose Influenza Vaccine Against Influenza-Related Hospitalization Among Older Adults-United States, 2015-2017. Clin Infect Dis. 15 mars 2021;72(6):995-1003. https://doi.org/10.1093/cid/ciaa160
- Note de bas de page 53
-
Lu Y, Chillarige Y, Izurieta HS, Wei Y, Xu W, Lu M, et al. Effect of Age on Relative Effectiveness of High-Dose Versus Standard-Dose Influenza Vaccines Among US Medicare Beneficiaries Aged ≥65 Years. J Infect Dis. 26 sept. 2019;220(9):1511-20. https://doi.org/10.1093/infdis/jiz360
- Note de bas de page 54
-
Paudel M, Mahmud S, Buikema A, Korrer S, Van Voorhis D, Brekke L, et al. Relative vaccine efficacy of high-dose versus standard-dose influenza vaccines in preventing probable influenza in a Medicare Fee-for-Service population. Vaccine. 15 juin 2020;38(29):4548-56. https://doi.org/10.1016/j.vaccine.2020.05.020
- Note de bas de page 55
-
Richardson DM, Medvedeva EL, Roberts CB, Linkin DR. Comparative effectiveness of high-dose versus standard-dose influenza vaccination in community-dwelling veterans. Clin Infect Dis. 15 juill. 2015;61(2):171-6. https://doi.org/10.1093/cid/civ261
- Note de bas de page 56
-
Robison SG, Thomas AR. Assessing the effectiveness of high-dose influenza vaccine in preventing hospitalization among seniors, and observations on the limitations of effectiveness study design. Vaccine. 29 oct. 2018;36(45):6683-7. https://doi.org/10.1016/j.vaccine.2018.09.050
- Note de bas de page 57
-
Young-Xu Y, Snider JT, van Aalst R, Mahmud SM, Thommes EW, Lee JKH, et al. Analysis of relative effectiveness of high-dose versus standard-dose influenza vaccines using an instrumental variable method. Vaccine. 7 mars 2019;37(11):1484-90. https://doi.org/10.1016/j.vaccine.2019.01.063
- Note de bas de page 58
-
Cocchio S, Gallo T, Del Zotto S, Clagnan E, Iob A, Furlan P, et al. Preventing the Risk of Hospitalization for Respiratory Complications of Influenza among the Elderly: Is There a Better Influenza Vaccination Strategy? A Retrospective Population Study. Vaccines (Basel). 28 juin 2020;8(3):344. https://doi.org/10.3390/vaccines8030344
- Note de bas de page 59
-
Young-Xu Y, Thornton Snider J, Mahmud SM, Russo EM, Van Aalst R, Thommes EW, et al. High-dose influenza vaccination and mortality among predominantly male, white, senior veterans, United States, 2012/13 to 2014/15. Euro Surveill. Mai 2020;25(19):1900401. https://doi.org/10.2807/1560-7917.ES.2020.25.19.1900401
- Note de bas de page 60
-
Mannino S, Villa M, Apolone G, Weiss NS, Groth N, Aquino I, et al. Effectiveness of adjuvanted influenza vaccination in elderly subjects in northern Italy. Am J Epidemiol. 15 sept. 2012;176(6):527-33. https://doi.org/10.1093/aje/kws313
- Note de bas de page 61
-
Pebody R, Whitaker H, Zhao H, Andrews N, Ellis J, Donati M, et al. Protection provided by influenza vaccine against influenza-related hospitalisation in ≥65 year olds: Early experience of introduction of a newly licensed adjuvanted vaccine in England in 2018/19. Vaccine. 10 janv. 2020;38(2):173-9. https://doi.org/10.1016/j.vaccine.2019.10.032
- Note de bas de page 62
-
van Aalst R, Gravenstein S, Mor V, Mahmud SM, Wilschut J, Postma M, et al. Comparative effectiveness of high dose versus adjuvanted influenza vaccine: A retrospective cohort study. Vaccine. 10 janv. 2020;38(2):372-9. https://doi.org/10.1016/j.vaccine.2019.09.105
- Note de bas de page 63
-
Pelton SI, Divino V, Postma MJ, Shah D, Mould-Quevedo J, DeKoven M, et al. A retrospective cohort study assessing relative effectiveness of adjuvanted versus high-dose trivalent influenza vaccines among older adults in the United States during the 2018-19 influenza season. Vaccine. 22 avril 2021;39(17):2396-407. https://doi.org/10.1016/j.vaccine.2021.03.054
- Note de bas de page 64
-
DiazGranados CA, Dunning AJ, Jordanov E, Landolfi V, Denis M, Talbot HK. High-dose trivalent influenza vaccine compared to standard dose vaccine in elderly adults: safety, immunogenicity, and relative efficacy during the 2009-2010 season. Vaccine. 30 janv. 2013;31(6):861-6. https://doi.org/10.1016/j.vaccine.2012.12.013
- Note de bas de page 65
-
Loeb N, Andrew MK, Loeb M, Kuchel GA, Haynes L, McElhaney JE, et al. Frailty Is Associated With Increased Hemagglutination-Inhibition Titers in a 4-Year Randomized Trial Comparing Standard- and High-Dose Influenza Vaccination. Open Forum Infect Dis. Mai 2020;7(5):ofaa148. https://doi.org/10.1093/ofid/ofaa148
- Note de bas de page 66
-
Teh BW, Leung VKY, Mordant FL, Sullivan SG, Joyce T, Harrison SJ, et al. A Randomized Trial of Two (2) 2-Dose Influenza Vaccination Strategies for Patients Following Autologous Hematopoietic Stem Cell Transplantation. Clin Infect Dis. 6 déc. 2021;73(11):e4269-77. https://doi.org/10.1093/cid/ciaa1711
- Note de bas de page 67
-
Scheifele DW, McNeil SA, Ward BJ, Dionne M, Cooper C, Coleman B, et al. Safety, immunogenicity, and tolerability of 3 influenza vaccines in older adults: results of a randomized, controlled comparison. Hum Vaccin Immunother. Nov. 2013;9(11):2460-73. https://doi.org/10.4161/hv.25580
- Note de bas de page 68
-
Falsey AR, Treanor JJ, Tornieporth N, Capellan J, Gorse GJ. Randomized, double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. J Infect Dis. 15 juill. 2009;200(2):172-80. https://doi.org/10.1086/599790
- Note de bas de page 69
-
Keitel WA, Treanor JJ, El Sahly HM, Gilbert A, Meyer AL, Patriarca PA, Cox,M.M. Comparative immunogenicity of recombinant influenza hemagglutinin (rHA) and trivalent inactivated vaccine (TIV) among persons > or =65 years old. Vaccine. 2009;28(2):379.
- Note de bas de page 70
-
Tsang P, Gorse GJ, Strout CB, Sperling M, Greenberg DP, Ozol-Godfrey A, et al. Immunogenicity and safety of Fluzone® intradermal and high-dose influenza vaccines in older adults ≥65 years of age: a randomized, controlled, phase II trial. Vaccine. 1 mai 2014;32(21):2507-17. https://doi.org/10.1016/j.vaccine.2013.09.074
- Note de bas de page 71
-
Keitel WA, Treanor JJ, El Sahly HM, Gilbert A, Meyer AL, Patriarca PA, et al. Comparative immunogenicity of recombinant influenza hemagglutinin (rHA) and trivalent inactivated vaccine (TIV) among persons > or =65 years old. Vaccine. 11 déc. 2009;28(2):379-85. https://doi.org/10.1016/j.vaccine.2009.10.037
- Note de bas de page 72
-
McConeghy KW, Huang SS, Miller LG, McKinnell JA, Shireman TI, Mor V, et al. Hospital Influenza Admissions as a Harbinger for Nursing Home Influenza Cases. J Am Med Dir Assoc. Janv. 2020;21(1):121-6. https://doi.org/10.1016/j.jamda.2019.06.025
- Note de bas de page 73
-
Tsang P, Gorse GJ, Strout CB, Sperling M, Greenberg DP, Ozol-Godfrey A, et al. Immunogenicity and safety of Fluzone® intradermal and high-dose influenza vaccines in older adults ≥65 years of age: a randomized, controlled, phase II trial. Vaccine. 1 mai 2014;32(21):2507-17. https://doi.org/10.1016/j.vaccine.2013.09.074
- Note de bas de page 74
-
McLean HQ, Levine MZ, King JP, Flannery B, Belongia EA. Serologic response to sequential vaccination with enhanced influenza vaccines: Open label randomized trial among adults aged 65-74 years. Vaccine. 3 déc. 2021;39(49):7146-52. https://doi.org/10.1016/j.vaccine.2021.10.072
- Note de bas de page 75
-
Seo YB, Choi WS, Lee J, Song JY, Cheong HJ, Kim WJ. Comparison of the immunogenicity and safety of the conventional subunit, MF59-adjuvanted, and intradermal influenza vaccines in the elderly. Clin Vaccine Immunol. Juillet 2014;21(7):989-96. https://doi.org/10.1128/CVI.00615-13
- Note de bas de page 76
-
Schmader KE, Liu CK, Harrington T, Rountree W, Auerbach H, Walter EB, et al. Safety, Reactogenicity, and Health-Related Quality of Life After Trivalent Adjuvanted vs Trivalent High-Dose Inactivated Influenza Vaccines in Older Adults: A Randomized Clinical Trial. JAMA Netw Open. 4 janv. 2021;4(1):e2031266. https://doi.org/10.1001/jamanetworkopen.2020.31266
- Note de bas de page 77
-
Hansen J, Goddard K, Timbol J, Zhang L, Lewis N, Dunkle L, et al. Safety of Recombinant Influenza Vaccine Compared to Inactivated Influenza Vaccine in Adults: An Observational Study. Open Forum Infect Dis. 20 mai 2020;7(6):ofaa179. https://doi.org/10.1093/ofid/ofaa179
- Note de bas de page 78
-
Nace DA, Lin CJ, Ross TM, Saracco S, Churilla RM, Zimmerman RK. Randomized, controlled trial of high-dose influenza vaccine among frail residents of long-term care facilities. J Infect Dis. 15 juin 2015;211(12):1915-24. https://doi.org/10.1093/infdis/jiu622
- Note de bas de page 79
-
de Bruijn I, Meyer I, Gerez L, Nauta J, Giezeman K, Palache B. Antibody induction by virosomal, MF59-adjuvanted, or conventional influenza vaccines in the elderly. Vaccine. 21 déc. 2007;26(1):119-27. https://doi.org/10.1016/j.vaccine.2007.10.051
- Note de bas de page 80
-
De Donato S, Granoff D, Minutello M, Lecchi G, Faccini M, Agnello M, et al. Safety and immunogenicity of MF59-adjuvanted influenza vaccine in the elderly. Vaccine. 6 août 1999;17(23-24):3094-101. https://doi.org/10.1016/s0264-410x(99)00138-3
- Note de bas de page 81
-
Li R, Fang H, Li Y, Liu Y, Pellegrini M, Podda A. Safety, and immunogenicity of an MF59-adjuvanted subunit influenza vaccine in elderly Chinese subjects. Immun Ageing. 20 févr. 2008;5:2. https://doi.org/10.1186/1742-4933-5-2
- Note de bas de page 82
-
Sindoni D, La Fauci V, Squeri R, Cannavò G, Bacilieri S, Panatto D, et al. Comparison between a conventional subunit vaccine and the MF59-adjuvanted subunit influenza vaccine in the elderly: an evaluation of the safety, tolerability, and immunogenicity. J Prev Med Hyg. Juin 2009;50(2):121-6
- Note de bas de page 83
-
Izikson R, Leffell DJ, Bock SA, Patriarca PA, Post P, Dunkle LM, et al. Randomized comparison of the safety of Flublok® versus licensed inactivated influenza vaccine in healthy, medically stable adults ≥ 50 years of age. Vaccine. 27 nov. 2015;33(48):6622-8. https://doi.org/10.1016/j.vaccine.2015.10.097
- Note de bas de page 84
-
Treanor JJ, Schiff GM, Couch RB, Cate TR, Brady RC, Hay CM, et al. Dose-related safety, and immunogenicity of a trivalent baculovirus-expressed influenza-virus hemagglutinin vaccine in elderly adults. J Infect Dis. 1 mai 2006;193(9):1223-8. https://doi.org/10.1086/503050
- Note de bas de page 85
-
Della Cioppa G, Nicolay U, Lindert K, Leroux-Roels G, Clement F, Castellino F, et al. Superior immunogenicity of seasonal influenza vaccines containing full dose of MF59® adjuvant: results from a dose-finding clinical trial in older adults. Hum Vaccin Immunother. Févr. 2012;8(2):216-27. https://doi.org/10.4161/hv.18445
- Note de bas de page 86
-
Couch RB, Winokur P, Brady R, Belshe R, Chen WH, Cate TR, et al. Safety and immunogenicity of a high dosage trivalent influenza vaccine among elderly subjects. Vaccine. 1 nov. 2007;25(44):7656-63. https://doi.org/10.1016/j.vaccine.2007.08.042
- Note de bas de page 87
-
Cowling BJ, Thompson MG, Ng TWY, Fang VJ, Perera RAPM, Leung NHL, et al. Comparative reactogenicity of enhanced influenza vaccines in older adults; 32407535. J Infect Dis. 2020;222(8):1383-91.
- Note de bas de page 88
-
Menegon T, Baldo V, Bonello C, Dalla Costa D, Dfi Tommaso A, Trivello R. Influenza vaccines: antibody responses to split virus and MF59-adjuvanted subunit virus in an adult population. Eur J Epidemiol. Juil. 1999;15(6):573-6. https://doi.org/10.1023/a:1007594911541
- Note de bas de page 89
-
Villa M, Black S, Groth N, Rothman KJ, Apolone G, Weiss NS, et al. Safety of MF59-adjuvanted influenza vaccination in the elderly: results of a comparative study of MF59-adjuvanted vaccine versus nonadjuvanted influenza vaccine in northern Italy. Am J Epidemiol. 1 oct. 2013;178(7):1139-45. https://doi.org/10.1093/aje/kwt078
- Note de bas de page 90
-
Shinde V, Cho I, Plested JS, Agrawal S, Fiske J, Cai R, et al. Comparison of the safety and immunogenicity of a novel Matrix-M-adjuvanted nanoparticle influenza vaccine with a quadrivalent seasonal influenza vaccine in older adults: a phase 3 randomised controlled trial. Lancet Infect Dis. Janv. 2022;22(1):73-84. https://doi.org/10.1016/S1473-3099(21)00192-4
- Note de bas de page 91
-
Loong D, Pham B, Amiri M, Saunders H, Mishra S, Radhakrishnan A, et al. Systematic Review on the Cost-Effectiveness of Seasonal Influenza Vaccines in Older Adults. Value Health. Août 2022;25(8):1439-58. https://doi.org/10.1016/j.jval.2022.03.011
- Note de bas de page 92
-
Comité sur l'immunisation du Québec. Utilisation des vaccins à haute dose ou adjuvantés dans le Programme d'immunisation contre l'influenza [Internet]. Québec (CA): Institut national de santé publique du Québec (INSPQ); 17 août 2023 [cité le 3 sept. 2023]. Disponible à : https://www.inspq.qc.ca/publications/3370
- Note de bas de page 93
-
Comité consultatif national de l'immunisation. Comité consultatif national de l'immunisation (CCNI) : Méthodes et processus [Internet]. Ottawa (ON) : Gouvernement du Canada; 12 avril 2023 [cité le 26 juin 2023]. Disponible à : https://www.canada.ca/en/public-health/services/immunization/national-advisory-committee-on-immunization-naci/methods-process.html
- Note de bas de page 94
-
Jiang M, Li P, Wang W, Zhao M, Atif N, Zhu S, et al. Cost-effectiveness of quadrivalent versus trivalent influenza vaccine for elderly population in China. Vaccine. 29 janv. 2020;38(5):1057-64. https://doi.org/10.1016/j.vaccine.2019.11.045
- Note de bas de page 95
-
Becker DL, Chit A, DiazGranados CA, Maschio M, Yau E, Drummond M. High-dose inactivated influenza vaccine is associated with cost savings and better outcomes compared to standard-dose inactivated influenza vaccine in Canadian seniors. Hum Vaccin Immunother. déc. 2016;12(12):3036-42. https://doi.org/10.1080/21645515.2016.1215395
- Note de bas de page 96
-
Chit A, Roiz J, Briquet B, Greenberg DP. Expected cost effectiveness of high-dose trivalent influenza vaccine in US seniors. Vaccine. 29 jan. 2015;33(5):734-41. https://doi.org/10.1016/j.vaccine.2014.10.079
- Note de bas de page 97
-
Meier G, Gregg M, Poulsen Nautrup B. Cost-effectiveness analysis of quadrivalent influenza vaccination in at-risk adults and the elderly: an updated analysis in the U.K. J Med Econ. 2015;18(9):746-61. https://doi.org/10.3111/13696998.2015.1044456
- Note de bas de page 98
-
Thorrington D, van Leeuwen E, Ramsay M, Pebody R, Baguelin M. Assessing optimal use of the standard dose adjuvanted trivalent seasonal influenza vaccine in the elderly. Vaccine. 3 avr. 2019;37(15):2051-6. https://doi.org/10.1016/j.vaccine.2019.03.002
- Note de bas de page 99
-
Mennini FS, Bini C, Marcellusi A, Rinaldi A, Franco E. Cost-effectiveness of switching from trivalent to quadrivalent inactivated influenza vaccines for the at-risk population in Italy. Hum Vaccin Immunother. 2018;14(8):1867-73. https://doi.org/10.1080/21645515.2018.1469368
- Note de bas de page 100
-
Chit A, Becker DL, DiazGranados CA, Maschio M, Yau E, Drummond M. Cost-effectiveness of high-dose versus standard-dose inactivated influenza vaccine in adults aged 65 years and older: an economic evaluation of data from a randomised controlled trial. Lancet Infect Dis. déc. 2015;15(12):1459-66. https://doi.org/10.1016/S1473-3099(15)00249-2
- Note de bas de page 101
-
Chit A, Roiz J, Aballea S. An Assessment of the Expected Cost-Effectiveness of Quadrivalent Influenza Vaccines in Ontario, Canada Using a Static Model. PLoS One. 29 juill. 2015;10(7):e0133606. https://doi.org/10.1371/journal.pone.0133606
- Note de bas de page 102
-
You JHS, Ming W, Chan PKS. Cost-effectiveness of quadrivalent influenza vaccine in Hong Kong - A decision analysis. Hum Vaccin Immunother. 2015;11(3):564-71. https://doi.org/10.1080/21645515.2015.1011016
- Note de bas de page 103
-
Kim Y, Song JY, Jang H, Kim TH, Koo H, Varghese L, et al. Cost Effectiveness of Quadrivalent Influenza Vaccines Compared with Trivalent Influenza Vaccines in Young Children and Older Adults in Korea. Pharmacoeconomics. Déc. 2018;36(12):1475-90. https://doi.org/10.1007/s40273-018-0715-5
- Note de bas de page 104
-
Yun J, Choi MJ, Shin G, Lim J, Noh JY, Kim Y, et al. Cost-effectiveness of influenza vaccine strategies for the elderly in South Korea. PLoS One. 25 janv. 2019;14(1):e0209643. https://doi.org/10.1371/journal.pone.0209643
- Note de bas de page 105
-
Brogan AJ, Talbird SE, Davis AE, Thommes EW, Meier G. Cost-effectiveness of seasonal quadrivalent versus trivalent influenza vaccination in the United States: A dynamic transmission modeling approach. Hum Vaccin Immunother. 4 mars 2017;13(3):533-42. https://doi.org/10.1080/21645515.2016.1242541
- Note de bas de page 106
-
You JHS, Ming W, Chan PKS. Cost-effectiveness analysis of quadrivalent influenza vaccine versus trivalent influenza vaccine for elderly in Hong Kong. BMC Infect Dis. 25 nov. 2014;14:618. https://doi.org/10.1186/s12879-014-0618-9
- Note de bas de page 107
-
Raviotta JM, Smith KJ, DePasse J, Brown ST, Shim E, Nowalk MP, et al. Cost-Effectiveness and Public Health Effect of Influenza Vaccine Strategies for U.S. Elderly Adults. J Am Geriatr Soc. Oct. 2016;64(10):2126-31. https://doi.org/10.1111/jgs.14323
- Note de bas de page 108
-
Capri S, Barbieri M, de Waure C, Boccalini S, Panatto D. Cost-effectiveness analysis of different seasonal influenza vaccines in the elderly Italian population. Hum Vaccin Immunother. 3 juin 2018;14(6):1331-41. https://doi.org/10.1080/21645515.2018.1438792
- Note de bas de page 109
-
Nguyen VH, Vizzotti C, Uruena A, Giglio N, Magneres C, Richmond H. Cost-effectiveness of introducing an MF59-adjuvanted trivalent influenza vaccine for older adults in Argentina. Vaccine. 29 avr. 2020;38(20):3682-9. https://doi.org/10.1016/j.vaccine.2020.02.081
- Note de bas de page 110
-
Shireman TI, Ogarek J, Gozalo P, Zhang T, Mor V, Davidson HE, et al. Cost Benefit of High-Dose vs Standard-Dose Influenza Vaccine in a Long-Term Care Population During an A/H1N1-Predominant Influenza Season. J Am Med Dir Assoc. Juill. 2019;20(7):874-8. https://doi.org/10.1016/j.jamda.2018.12.003
- Note de bas de page 111
-
van Aalst R, Russo EM, Neupane N, Mahmud SM, Mor V, Wilschut J, et al. Economic assessment of a high-dose versus a standard-dose influenza vaccine in the US Veteran population: Estimating the impact on hospitalization cost for cardio-respiratory disease. Vaccine. 26 juill. 2019;37(32):4499-503. https://doi.org/10.1016/j.vaccine.2019.06.066
- Note de bas de page 112
-
Piercy J, Ryan J, Megas F. Economic evaluation of MF59 adjuvanted vaccine against influenza in the high-risk elderly population in France. Journal of Medical Economics. Janv. 2004;7(1-4):1-18. https://doi.org/10.3111/200407001018
- Note de bas de page 113
-
Sugishita Y, Sugawara T. Effectiveness, and cost-effectiveness of influenza vaccination for elderly people. Vaccine. 20 déc. 2021;39(52):7531-40. https://doi.org/10.1016/j.vaccine.2021.09.054
- Note de bas de page 114
-
Postma M, Fisman D, Giglio N, Márquez-Peláez S, Nguyen VH, Pugliese A, et al. Real-World Evidence in Cost-Effectiveness Analysis of Enhanced Influenza Vaccines in Adults ≥ 65 Years of Age: Literature Review and Expert Opinion. Vaccines (Basel). 11 juin 2023;11(6):1089. https://doi.org/10.3390/vaccines11061089
- Note de bas de page 115
-
Iuliano AD, Roguski KM, Chang HH, Muscatello DJ, Palekar R, Tempia S, et al. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study. Lancet. 31 mars 2018;391(10127):1285-300. https://doi.org/10.1016/S0140-6736(17)33293-2
- Note de bas de page 116
-
Nichols MK, Andrew MK, Hatchette TF, Ambrose A, Boivin G, Bowie W, et al. Influenza vaccine effectiveness to prevent influenza-related hospitalizations and serious outcomes in Canadian adults over the 2011/12 through 2013/14 influenza seasons: A pooled analysis from the Canadian Immunization Research Network (CIRN) Serious Outcomes Surveillance (SOS Network). Vaccine. 12 avr. 2018;36(16):2166-75. https://doi.org/10.1016/j.vaccine.2018.02.093
- Note de bas de page 117
-
McElhaney JE, Zhou X, Talbot HK, Soethout E, Bleackley RC, Granville DJ, et al. The unmet need in the elderly: how immunosenescence, CMV infection, co-morbidities and frailty are a challenge for the development of more effective influenza vaccines. Vaccine. 9 mars 2012;30(12):2060-7. https://doi.org/10.1016/j.vaccine.2012.01.015
- Note de bas de page 118
-
Czaja CA, Miller L, Alden N, Wald HL, Cummings CN, Rolfes MA, et al. Age-Related Differences in Hospitalization Rates, Clinical Presentation, and Outcomes Among Older Adults Hospitalized With Influenza-U.S. Influenza Hospitalization Surveillance Network (FluSurv-NET). Open Forum Infect Dis. 1 juill. 2019;6(7):ofz225. https://doi.org/10.1093/ofid/ofz225
- Note de bas de page 119
-
Divo MJ, Martinez CH, Mannino DM. Ageing, and the epidemiology of multimorbidity. Eur Respir J. Oct. 2014;44(4):1055-68. https://doi.org/10.1183/09031936.00059814
- Note de bas de page 120
-
Rockwood K, Song X, Mitnitski A. Changes in relative fitness and frailty across the adult lifespan: evidence from the Canadian National Population Health Survey. CMAJ. 17 mai 2011;183(8):487. https://doi.org/10.1503/cmaj.101271
- Note de bas de page 121
-
Theou O, Brothers TD, Rockwood MR, Haardt D, Mitnitski A, Rockwood K. Exploring the relationship between national economic indicators and relative fitness and frailty in middle-aged and older Europeans. Age Ageing. Sept. 2013;42(5):614-9. https://doi.org/10.1093/ageing/aft010
- Note de bas de page 122
-
Rohrmann S. Epidemiology of Frailty in Older People. In: Veronese N, editor. Frailty and Cardiovascular Diseases : Research into an Elderly Population. Cham: Springer International Publishing; 2020. p. 21-7.
- Note de bas de page 123
-
Walker TA, Waite B, Thompson MG, McArthur C, Wong C, Baker MG, et al. Risk of Severe Influenza Among Adults With Chronic Medical Conditions. J Infect Dis. 02 janv. 2020;221(2):183-90. https://doi.org/10.1093/infdis/jiz570
- Note de bas de page 124
-
Andrew MK, MacDonald S, Godin J, McElhaney JE, LeBlanc J, Hatchette TF, et al. Persistent Functional Decline Following Hospitalization with Influenza or Acute Respiratory Illness. J Am Geriatr Soc. Mars 2021;69(3):696-703. https://doi.org/10.1111/jgs.16950
- Note de bas de page 125
-
Iwai-Saito K, Sato K, Aida J, Kondo K. Association of frailty with influenza and hospitalization due to influenza among independent older adults: a longitudinal study of Japan Gerontological Evaluation Study (JAGES). BMC Geriatr. 26 avr. 2023;23(1):249. https://doi.org/10.1186/s12877-023-03979-y
- Note de bas de page 126
-
Earle A, Heymann J. The cost of caregiving: wage loss among caregivers of elderly and disabled adults and children with special needs. Community, Work et Family. 1 août 2012;15(3):357-75. https://doi.org/10.1080/13668803.2012.674408
- Note de bas de page 127
-
Newall AT, Chaiyakunapruk N, Lambach P, Hutubessy RCW. WHO guide on the economic evaluation of influenza vaccination. Influenza Other Respir Viruses. Mars 2018;12(2):211-9. https://doi.org/10.1111/irv.12510
- Note de bas de page 128
-
Andrew MK, MacDonald S, Ye L, Ambrose A, Boivin G, Diaz-Mitoma F, et al. Impact of Frailty on Influenza Vaccine Effectiveness and Clinical Outcomes: Experience From the Canadian Immunization Research Network (CIRN) Serious Outcomes Surveillance (SOS) Network 2011/12 Season. Open Forum Infect Dis. 24 oct. 2016;3:710. https://doi.org/10.1093/ofid/ofw172.573
- Note de bas de page 129
-
McElhaney JE, Andrew MK, McNeil SA. Estimating influenza vaccine effectiveness: Evolution of methods to better understand effects of confounding in older adults. Vaccine. 1 nov. 2017;35(46):6269-74. https://doi.org/10.1016/j.vaccine.2017.09.084
- Note de bas de page 130
-
Hogan DB. Chapter 3 - Models, Definitions, and Criteria for Frailty. In: Ram JL, Conn PM, editors. Conn's Handbook of Models for Human Aging (Second Edition). Academic Press; 2018. p. 35-44.
- Note de bas de page 131
-
Strandberg TE, Pitkälä KH. Frailty in elderly people. Lancet. 21 avril 2007;369(9570):1328-9. https://doi.org/10.1016/S0140-6736(07)60613-8
- Note de bas de page 132
-
Bergman H, Ferrucci L, Guralnik J, Hogan DB, Hummel S, Karunananthan S, et al. Frailty: an emerging research and clinical paradigm--issues and controversies. J Gerontol A Biol Sci Med Sci. Juill. 2007;62(7):731-7. https://doi.org/10.1093/gerona/62.7.731
- Note de bas de page 133
-
Andrew MK, Shinde V, Ye L, Hatchette T, Haguinet F, Dos Santos G, et al. The Importance of Frailty in the Assessment of Influenza Vaccine Effectiveness Against Influenza-Related Hospitalization in Elderly People. J Infect Dis. 15 août 2017;216(4):405-14. https://doi.org/10.1093/infdis/jix282
- Note de bas de page 134
-
Strausbaugh LJ, Sukumar SR, Joseph CL. Infectious disease outbreaks in nursing homes: an unappreciated hazard for frail elderly persons. Clin Infect Dis. 1 avr. 2003;36(7):870-6. https://doi.org/10.1086/368197
- Note de bas de page 135
-
Lansbury LE, Brown CS, Nguyen-Van-Tam JS. Influenza in long-term care facilities. Influenza Other Respir Viruses. Sept. 2017;11(5):356-66. https://doi.org/10.1111/irv.12464
- Note de bas de page 136
-
Yang MC, Tan CH. Cost-Effectiveness Of Quadrivalent Influenza Vaccination Program For The Elderly Aged 65 Years Or Older In Taiwan. Value in Health. Mai 2014;17(3):A276. https://doi.org/10.1016/j.jval.2014.03.1606
- Note de bas de page 137
-
Comité consultatif national de l'immunisation (CCNI). Déclaration sur la vaccination antigrippale pour la saison 2023-2024 [Internet]. Ottawa (ON) : Agence de la santé publique du Canada; 31 mai 2023 [cité le 16 août 2023]. Disponible à : https://www.canada.ca/en/public-health/services/publications/vaccines-immunization/national-advisory-committee-immunization-statement-seasonal-influenza-vaccine-2023-2024.html
- Note de bas de page 138
-
Lee BY, Norman BA, Assi T, Chen S, Bailey RR, Rajgopal J, et al. Single versus multi-dose vaccine vials: an economic computational model. Vaccine. 19 juill. 2010;28(32):5292-300. https://doi.org/10.1016/j.vaccine.2010.05.048
- Note de bas de page 139
-
BC Centre for Disease Control. Fluzone®High-Dose Quadrivalent Influenza Vaccine Question and Answer Document Updated – August 2021 [Internet]. Vancouver (BC): BCCDC; août 2021 [cité le 16 mars 2022 Mar]. Disponible à : http://www.bccdc.ca/resource-gallery/Documents/Guidelines%20and%20Forms/Guidelines%20and%20Manuals/Immunization/Vaccine%20Info/Archived_Fluzone_HD_Q_A_August_2021.pdf
- Note de bas de page 140
-
Publicly funded seasonal inactivated influenza vaccine information for health care providers 2023-24 [Internet]. Halifax (NS): Province of Nova Scotia; 26 sept. 2023 [cité le 23 oct. 2023]. Disponible à : https://novascotia.ca/dhw/cdpc/documents/Publicly-Funded-Seasonal-Inactivated-Influenza-Vaccine-Information.pdf
- Note de bas de page 141
-
Ontario Agency for Health Protection and Promotion (Public Health Ontario). Focus On: Influenza vaccines for the 2023-24 Influenza season [Internet]. Toronto (ON): King's Printer for Ontario; sept. 2023 [cité le 23 oct. 2023]. Disponible à : https://www.publichealthontario.ca/-/media/Documents/V/2023/vaccines-influenza-season.pdf?rev=fc6a30901525496c9cb2656e7362069cetsc_lang=en
- Note de bas de page 142
-
Saskatchewan influenza immunization policy 2023-2024 [Internet]. Regina (SK): Government of Saskatchewan; sept. 2023 [cité le 23 oct. 2023]. Disponible à : https://www.ehealthsask.ca/services/Manuals/Documents/2023-24%20Saskatchewan%20Influenza%20Immunization%20Policy.pdf
- Note de bas de page 143
-
Yukon Immunization Program Manual: Section 8 - Biological Products - Influenza [Internet]. Whitehorse (YT): Government of Yukon; juill. 2023 [cité le 23 oct. 2023]. Disponible à : https://yukon.ca/sites/yukon.ca/files/hss/hss-section-8-influenza-vaccine_0.pdf
- Note de bas de page 144
-
Public Health Plan – Publicly Funded Seasonal Influenza Vaccine (2023-2024) [Internet]. Fredericton (NB): Government of New Brunswick; 30 août 2023 [cité le 23 oct. 2023]. Disponible à : https://www2.gnb.ca/content/gnb/en/departments/health/MedicarePrescriptionDrugPlan/TheNewBrunswickPrescriptionDrugProgram/Public-Health-Plan-Publicly-Funded-Seasonal-Influenza-Vaccine-2022-2023.html
- Note de bas de page 145
-
Comité sur l'immunisation du Québec. Révision du Programme d'immunisation contre l'influenza au Québec [Internet]. Québec (CA): Institut national de santé publique du Québec (INSPQ); 20 juin 2018 [cité le 5 septembre 2023]. Disponible à : https://www.inspq.qc.ca/publications/2415
- Note de bas de page 146
-
Canadian Agency for Drugs and Technologies in Health. Guidelines for the Economic Evaluation of Health Technologies: Canada — 4th Edition [Internet]. Ottawa (ON): Canadian Agency for Drugs and Technologies in Health; 15 août 2023 [cité le 5 sept. 2023]. Disponible à : https://www.cadth.ca/guidelines-economic-evaluation-health-technologies-canada-4th-edition
- Note de bas de page 147
-
Bart S, Cannon K, Herrington D, Mills R, Forleo-Neto E, Lindert K, et al. Immunogenicity and safety of a cell culture-based quadrivalent influenza vaccine in adults: A Phase III, double-blind, multicenter, randomized, non-inferiority study. Hum Vaccin Immunother. Sept. 2016;12(9):2278-88. https://doi.org/10.1080/21645515.2016.1182270
- Note de bas de page 148
-
Szymczakiewicz-Multanowska A, Groth N, Bugarini R, Lattanzi M, Casula D, Hilbert A, et al. Safety and immunogenicity of a novel influenza subunit vaccine produced in mammalian cell culture. J Infect Dis. 15 sept. 2009;200(6):841-8. https://doi.org/10.1086/605505
- Note de bas de page 149
-
Szymczakiewicz-Multanowska A, Lattanzi M, Izu A, Casula D, Sparacio M, Kovacs C, et al. Safety assessment and immunogenicity of a cell-culture-derived influenza vaccine in adults and elderly subjects over 3 successive influenza seasons. Hum Vaccin Immunother. Mai 2012;8(5):645-52. https://doi.org/10.4161/hv.19493
- Note de bas de page 150
-
DiazGranados CA, Dunning AJ, Robertson CA, Talbot HK, Landolfi V, Greenberg DP. Efficacy and immunogenicity of high-dose influenza vaccine in older adults by age, comorbidities, and frailty. Vaccine. 26 août 2015;33(36):4565-71. https://doi.org/10.1016/j.vaccine.2015.07.003
- Note de bas de page 151
-
Petrie JG, Ohmit SE, Cheng CK, Martin ET, Malosh RE, Lauring AS, et al. Influenza Vaccine Effectiveness Against Antigenically Drifted Influenza Higher Than Expected in Hospitalized Adults: 2014-2015. Clin Infect Dis. 15 oct. 2016;63(8):1017-25. https://doi.org/10.1093/cid/ciw432
- Note de bas de page 152
-
Pott H, Andrew MK, Shaffelburg Z, Nichols MK, Ye L, ElSherif M, et al. Vaccine Effectiveness of non-adjuvanted and adjuvanted trivalent inactivated influenza vaccines in the prevention of influenza-related hospitalization in older adults: A pooled analysis from the Serious Outcomes Surveillance (SOS) Network of the Canadian Immunization Research Network (CIRN). Vaccine. 9 sept. 2023:S0264-5. https://doi.org/10.1016/j.vaccine.2023.08.070
- Note de bas de page 153
-
York Health Economics Consortium. Glossary: Health Economic Terms [Internet]. York (UK): YHEC; 2023 [cité le 16 août 2023]. Disponible à : https://yhec.co.uk/resources/glossary/
- Note de bas de page 154
-
Laupacis A, Feeny D, Detsky AS, Tugwell PX. How attractive does a new technology have to be to warrant adoption and utilization? Tentative guidelines for using clinical and economic evaluations. CMAJ. 15 févr. 1992;146(4):473-81.
- Note de bas de page 155
-
Gomersall JS, Jadotte YT, Xue Y, Lockwood S, Riddle D, Preda A. Conducting systematic reviews of economic evaluations. Int J Evid Based Healthc. Sept. 2015;13(3):170-8. https://doi.org/10.1097/XEB.0000000000000063
- Note de bas de page 156
-
Heyland DK, Kernerman P, Gafni A, Cook DJ. Economic evaluations in the critical care literature: do they help us improve the efficiency of our unit? Crit Care Med. Sept. 1996;24(9):1591-8. https://doi.org/10.1097/00003246-199609000-00025
Détails de la page
- Date de modification :
