Guide canadien sur la biosécurité, Deuxième édition
À partir du 1er avril 2023, la Norme canadienne sur la biosécurité, Deuxième édition (NCB2), auquel ce document fait référence, est désuète. Le Guide canadien sur la biosécurité est en cours de mise à jour afin de refléter la Norme canadienne sur la biosécurité, Troisième édition (NCB3). Nous communiquerons la publication de cette mise à jour dans le bulletin de Nouvelles sur la biosécurité et la biosûreté des agents pathogènes et des toxines.
Deuxième édition
26 mai 2016
Table des matières
- PRÉFACE
- ABRÉVIATIONS ET SIGLES
- CHAPITRE 1 - INTRODUCTION
- CHAPITRE 2 - MATIÈRES BIOLOGIQUES
- CHAPITRE 3 - NIVEAUX DE CONFINEMENT ET ZONES DE CONFINEMENT
- CHAPITRE 4 - FACTEURS DE RISQUE, GROUPES DE RISQUE ET ÉVALUATIONS DES RISQUES
- 4.1 Évaluations des risques associés aux agents pathogènes et groupes de risque
- 4.1.1 Réalisation des évaluations des risques associés à l'agent pathogène ou la toxine
- 4.1.2 Groupes de risque
- 4.1.2.1 Groupe de risque 1 (GR1; risque faible pour la personne; faible pour la communauté)
- 4.1.2.2 Groupe de risque 2 (GR2; risque modéré pour la personne; faible pour la communauté)
- 4.1.2.3 Groupe de risque 3 (GR3; risque élevé pour la personne; faible pour la communauté)
- 4.1.2.4 Groupe de risque 4 (GR4; risque élevé pour la personne; élevé pour la communauté)
- 4.2 Évaluations des niveaux de confinement
- 4.3 Éléments spéciaux à prendre en compte
- 4.3.1 Toxines
- 4.3.2 Prions
- 4.3.3 Agents biologiques à cote de sécurité élevée (ABCSE)
- 4.3.4 Agents zoopathogènes non indigènes
- 4.3.5 Parasites
- 4.3.6 Travail à grande échelle
- 4.3.7 Travail avec des animaux
- 4.3.8 Biotechnologie
- 4.3.9 ARN infectieux
- 4.3.10 Lignées cellulaires
- 4.3.11 Échantillons primaires
- 4.3.12 Échantillons, tissus et cellules autologues
- 4.3.13 Manipulation de matières biologiques du groupe de risque 1
- 4.4 Gestion du risque
- 4.1 Évaluations des risques associés aux agents pathogènes et groupes de risque
- CHAPITRE 5 - GESTION DU PROGRAMME DE BIOSÉCURITÉ
- CHAPITRE 6 - BIOSÛRETÉ
- CHAPITRE 7 - PROGRAMME DE SURVEILLANCE MÉDICALE
- 7.1 Expositions en laboratoire et infections (ou intoxications) contractées en laboratoire
- 7.2 Évaluation médicale préalable à l'affectation
- 7.3 Vaccination
- 7.4 Surveillance médicale continue
- 7.5 Plan d'intervention post-exposition
- 7.6 Points additionnels à prendre en considération au sujet du confinement élevé
- 7.7 Carte de contact en cas d'urgence médicale
- CHAPITRE 8 - PROGRAMME DE FORMATION
- CHAPITRE 9 - ÉQUIPEMENT DE PROTECTION INDIVIDUEL
- 9.1 Types et choix d'équipement de protection individuel
- 9.2 Éléments clés à prendre en considération lors du choix de l'équipement de protection individuel
- 9.3 Utilisation de l'équipement de protection individuel
- CHAPITRE 10 - TRAITEMENT DE L'AIR
- CHAPITRE 11 - ENCEINTES DE SÉCURITÉ BIOLOGIQUE
- CHAPITRE 12 - CONSIDÉRATIONS RELATIVES À LA SÉCURITÉ APPLICABLES AUX APPAREILS UTILISÉS POUR LE TRAVAIL AVEC DES MATIÈRES BIOLOGIQUES
- 12.1 Centrifugeuses
- 12.2 Microtomes
- 12.3 Mélangeurs, sonicateurs, homogénéisateurs, incubateurs-agitateurs et agitateurs
- 12.4 Becs Bunsen
- 12.5 Micro-incinérateurs
- 12.6 Anses jetables
- 12.7 Appareils de pipetage
- 12.8 Pompes et systèmes à vide
- 12.9 Hottes chimiques
- 12.10 Passe-plats
- 12.11 Trieurs de cellules
- 12.12 Bouteilles de gaz comprimé
- 12.13 Autres considérations relatives aux appareils utilisés pour la manipulation de prions
- 12.14 Autres considérations relatives aux appareils utilisés pour la manipulation de toxines
- CHAPITRE 13 - CONSIDÉRATIONS LIÉES AU TRAVAIL AVEC DES ANIMAUX
- 13.1 Caractéristiques des animaux
- 13.2 Conception des zones de confinement d'animaux
- 13.3 Matériel
- 13.4 Formation du personnel
- 13.5 Méthodes de manipulation et de contention
- 13.6 Décontamination et gestion des déchets
- 13.7 Isolement
- 13.8 Considérations liées au travail avec des animaux infectés par des prions
- 13.9 Travail avec des primates non humains
- CHAPITRE 14 - TRAVAIL À GRANDE ÉCHELLE
- CHAPITRE 15 - DÉCONTAMINATION
- 15.1 Principes de stérilisation, de désinfection et de décontamination
- 15.2 Validation et vérification des technologies et des procédés de décontamination
- 15.3 Désinfectants chimiques
- 15.4 Autoclaves
- 15.5 Décontamination gazeuse
- 15.6 Systèmes de décontamination des effluents
- 15.7 Irradiation
- 15.8 Incinération
- 15.9 Cuves d'immersion
- 15.10 Carcasses d'animaux et déchets anatomiques
- 15.11 Décontamination thermique et chimique des toxines biologiques
- 15.12 Autres considérations relatives à la destruction des prions
- CHAPITRE 16 - GESTION DES DÉCHETS
- CHAPITRE 17 - PLAN D'INTERVENTION D'URGENCE
- CHAPITRE 18 - DÉCLARATION DES INCIDENTS ET ENQUÊTES SUR LES INCIDENTS
- CHAPITRE 19 - RESPONSABILITÉ À L'ÉGARD DES MATIÈRES INFECTIEUSES ET DES TOXINES ET GESTION DE L'INVENTAIRE
- CHAPITRE 20 - DÉPLACEMENT ET TRANSPORT DES MATIÈRES INFECTIEUSES OU DES TOXINES
- CHAPITRE 21 - TRAVAIL AVEC DES MATIÈRES BIOLOGIQUES DU GROUPE DE RISQUE 1
- CHAPITRE 22 - CONCEPTION DES NOUVELLES ZONES DE CONFINEMENT
- CHAPITRE 23 - SURVEILLANCE RÉGLEMENTAIRE DES AGENTS PATHOGÈNES HUMAINS, DES AGENTS ZOOPATHOGÈNES ET DES TOXINES AU CANADA
- 23.1 Autorités de réglementation
- 23.2 Activités réglementées liées à des agents pathogènes humains et à des toxines
- 23.3 Importation d'agents zoopathogènes au Canada
- 23.4 Activités comprenant des agents pathogènes zoonotiques
- 23.5 Considérations réglementaires supplémentaires concernant les agents pathogènes et les toxines
- CHAPITRE 24 - GLOSSAIRE
- CHAPITRE 25 - SOURCES
- ANNEXE A - PLAN DE SURVEILLANCE ADMINISTRATIVE À L'ÉGARD DES AGENTS PATHOGÈNES ET DES TOXINES DANS UN CONTEXTE DE RECHERCHE
- ANNEXE B - TECHNIQUE EFFICACE DE LAVAGE DES MAINS
Liste de figures
- Figure 3-1 : Schéma représentant une installation à usage mixte qui comprend des zones de niveau de confinement 2 (NC2) et de niveau de confinement 3 (NC3)
- Figure 3-2 : Schéma représentant une zone de niveau de confinement 4 (NC4) où l'on porte des combinaisons à pression positive
- Figure 3-3 : Schéma représentant différentes configurations des zones de niveau de confinement 2 (NC2) dans un même espace physique
- Figure 3-4 : Avertissement de danger biologique représentatif
- Figure 3-5 : Schéma représentant l'emplacement des bureaux par rapport à la zone de niveau de confinement 2 (NC2) adjacente
- Figure 3-6 : Schéma représentant la barrière de confinement et le périmètre d'une zone de confinement de petits animaux (zone PA) de niveau de confinement 3 (NC3)
- Figure 3-7 : Schéma représentant une zone de confinement de gros animaux (zone GA) de niveau de confinement 3 (NC3) qui comprend de multiples barrières de confinement
- Figure 3-8 : Schéma représentant les différents espaces du sas dans une zone de niveau de confinement 3 (NC3) avec la porte critique indiquée
- Figure 4-1 : Matrice d'évaluation des risques
- Figure 7-1 : Exemple de carte de contact en cas d'urgence médicale
- Figure 10-1 : Diagramme représentatif d'un boîtier de filtre à haute efficacité pour les particules de l'air (HEPA) et vue en coupe dévoilant les filtres HEPA situés dans le boîtier
- Figure 11-1 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie I
- Figure 11-2 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type A1 (munie d'un plénum contaminé en surpression)
- Figure 11-3 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type A2
- Figure 11-4 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type B1
- Figure 11-5 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie II et de type B2
- Figure 11-6 : Illustration d'une enceinte de sécurité biologique (ESB) de catégorie III
- Figure 11-7 : Diagramme illustrant des considérations à prendre en compte en choisissant le lieu d'installation d'une enceinte de sécurité biologique (ESB)
- Figure 11-8 : Diagramme représentatif de la disposition recommandée des articles utilisés pour les manipulations dans une enceinte de sécurité biologique (ESB)
- Figure 12-1 : Diagramme représentatif d'un système à vide installé pour l'aspiration de liquides infectieux
- Figure 13-1 : Diagramme représentatif d'une salle animalière de base
- Figure 13-2 : Diagrammes représentatifs de cages de confinement primaire
- Figure 13-3 : Diagramme représentatif d'un système de cage ouverte
- Figure 13-4 : Diagramme représentatif d'un box
- Figure 13-5 : Diagrammes représentatifs de zones de confinement d'animaux munies d'un seul corridor ou de deux corridors
- Figure 18-1 : Incidents, expositions, et intoxications et infections contractées en laboratoire (ICL)
- Figure 18-2 : Organigramme décisionnel pour l'évaluation d'un incident
Liste de tableaux
- Tableau 4-1 : Aperçu des différentes toxines précisées et de leur quantité seuil
- Tableau 9-1 : Compatibilité des gants de caoutchouc naturel, de caoutchouc synthétique et de polymère de plastique avec les désinfectants chimiques communs
- Tableau 11-1 : Résumé des caractéristiques clés des différents types d'enceintes de sécurité (ESB) de catégorie II
- Tableau 15-1 : Agents pathogènes classés en fonction de leur sensibilité relative aux désinfectants chimiques
- Tableau 15-2 : Sensibilité des microorganisme à des désinfectants chimiques
- Tableau 15-3 : Inconvénients des désinfectants chimiques
Préface
Le Guide canadien sur la biosécurité (GCB), 2e édition, 2016, du gouvernement du Canada, est un guide national sur la manipulation ou l'entreposage des agents pathogènes touchant les humains, des agents pathogènes touchant les animaux terrestres et des toxines au Canada. Le GCB est complémentaire à la Norme canadienne sur la biosécurité (NCB), 2e édition, 2015, dans laquelle sont énoncées les exigences physiques en matière de confinement, les exigences opérationnelles et les exigences relatives aux essais de vérification et de performance nécessaires pour qu'il soit possible de manipuler ou d'entreposer en toute sécurité les agents pathogènes humains, les agents pathogènes d'animaux terrestres et les toxines. Au Canada, les activités qui comportent la manipulation d'agents pathogènes humains, d'agents zoopathogènes et de toxines sont réglementées par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA), conformément aux termes de la Loi sur les agents pathogènes humains et les toxines, du Règlement sur les agents pathogènes humains et les toxines, de la Loi sur la santé des animaux et du Règlement sur la santé des animaux.
La deuxième édition du GCB est une mise à jour des lignes directrices publiées à l'origine dans la partie II des Normes et lignes directrices canadiennes sur la biosécurité (NLDCB), 1re édition, 2013. Les NLDCB ont été élaborées pour mettre à jour et harmoniser trois documents de normes et lignes directrices canadiennes en matière de biosécurité pour la conception, la construction et l'exploitation des installations où sont manipulés ou entreposés des agents pathogènes ou des toxines :
- Agents pathogènes humains et toxines : Lignes directrices en matière de biosécurité en laboratoire, 3e édition, 2004 (ASPC);
- Agents pathogènes affectant les animaux terrestres : Normes sur le confinement des installations vétérinaires, 1re édition, 1996 (ACIA);
- Prions : Normes de confinement pour les laboratoires, les installations vétérinaires et les salles de nécropsie qui manipulent des prions, 1re édition, 2005 (ACIA).
Le GCB présente de l'information et des directives clés sur les moyens de satisfaire aux exigences en matière de biosécurité et de biosûreté énoncées dans la NCB. Le GCB traite de tous les concepts qui sont requis pour l'élaboration et le maintien d'un programme de gestion de la biosécurité exhaustif et axé sur les risques.
Dans le but d'assurer l'amélioration continue du GCB, l'ASPC et l'ACIA invitent les parties intéressées à leur transmettre leurs commentaires, leurs demandes d'éclaircissements ou leurs suggestions d'éléments à considérer dans la prochaine édition du GCB. Pour ce faire, ces parties sont priées d'utiliser les adresses électroniques suivantes, en prenant soin de joindre des références (le cas échéant) pour appuyer leurs informations :
- Courriel de l'ASPC : pathogens.pathogenes@phac-aspc.gc.ca
- Courriel de l'ACIA : standardsnormes@inspection.gc.ca
Abréviations et sigles
- ABCSE
- Agent biologique à cote de sécurité élevée
- ACIA
- Agence canadienne d'inspection des aliments
- ADN
- Acide désoxyribonucléique
- ADNr
- Acide désoxyribonucléique recombiné
- ADNs
- Acide désoxyribonucléique de synthèse
- Ag
- Agriculture (c.-à-d. NC2-Ag, NC3-Ag)
- AMC
- Affaires mondiales Canada
- ANSI
- American National Standards Institute
- ARN
- Acide ribonucléique
- ASB
- Agent de la sécurité biologique
- ASFC
- Agence des services frontaliers du Canada
- ASHRAE
- American Society of Heating, Refrigerating and Air-Conditioning Engineers
- ASME
- American Society of Mechanical Engineers
- ASPC
- Agence de la santé publique du Canada
- ASTM
- American Society for Testing and Materials
- CAC
- Convention sur les armes chimiques
- CAN
- Norme nationale du Canada
- CAQ
- Composés d'ammonium quaternaire
- CAVI
- Courant d'air vers l'intérieur
- CCHST
- Centre canadien d'hygiène et de sécurité au travail
- CCME
- Conseil canadien des ministres de l'environnement
- CCNI
- Comité consultatif national de l'immunisation
- CCPA
- Conseil canadien de protection des animaux
- CDC
- Centers for Disease Control and Prevention (É.-U.)
- CIB
- Comité institutionnel de biosécurité
- ClO 2
- Dioxyde de chlore
- CPC
- Catégories de produits canadiennes
- CSA
- Association canadienne de normalisation
- CUP
- Codes d'utilisation prévue
- CVAC
- Chauffage, ventilation et air climatisé
- DE 50
- Dose efficace médiane
- DGR
- Réglementation pour le transport des marchandises dangereuses
- DL 50
- Dose létale médiane (taux de mortalité de 50 % dans le groupe d'essai)
- ECET
- Escherichia coli entérotoxinogène
- ELISA
- Essai immuno-enzymatique
- ELR
- Évaluation locale des risques
- EPI
- Équipement de protection individuel
- ESB
- Enceinte de sécurité biologique
- EST
- Encéphalopathie spongiforme transmissible
- FTSSP
- Fiche technique santé-sécurité : agents pathogènes
- GCB
- Guide canadien sur la biosécurité
- GR
- Groupe de risque (c.-à-d. GR1, GR2, GR3, GR4)
- GRC
- Gendarmerie royale du Canada
- H2O2
- Peroxyde d'hydrogène
- HEPA
- Haute efficacité pour les particules de l'air
- IATA
- Association du transport aérien international
- ICL
- Intoxication ou infection contractée en laboratoire
- IEST
- Institute of Environmental Sciences and Technology
- ISO
- Organisation internationale de normalisation
- LAPHT
- Loi sur les agents pathogènes humains et les toxines
- LSA
- Loi sur la santé des animaux
- LTMD
- Loi de 1992 sur le transport des marchandises dangereuses
- MCJ
- Maladie de Creutzfeldt-Jakob
- MDC
- Maladie débilitante chronique
- NaOCl
- Hypochlorite de sodium
- NaOH
- Hydroxyde de sodium
- NC
- Niveau de confinement (c.-à-d. NC1, NC2, NC3, NC4)
- NCB
- Norme canadienne sur la biosécurité
- NIH
- National Institutes of Health (É.-U.)
- NLDCB
- Normes et lignes directrices canadiennes sur la biosécurité
- NSF
- National Sanitation Foundation
- OACI
- Organisation de l'aviation civile internationale
- OCDE
- Organisation de Coopération et de Développement Économiques
- OIE
- Organisation mondiale de la santé animale
- ONU
- Organisation des Nations Unies
- PHV
- Peroxyde d'hydrogène vaporisé
- PIU
- Plan d'intervention d'urgence
- PNH
- Primate non humain
- po C.E.
- pouce de colonne d'eau
- PON
- Procédures opératoires normalisées
- PVC
- Polychlorure de vinyle
- RAPHT
- Règlement sur les agents pathogènes humains et les toxines
- RSA
- Règlement sur la santé des animaux
- RTMD
- Règlement sur le transport des marchandises dangereuses
- SARI
- Système automatisé de référence à l'importation
- SCRS
- Service canadien du renseignement de sécurité
- SIMDUT
- Système d'information sur les matières dangereuses utilisées au travail
- SMACNA
- Sheet Metal and Air Conditioning Contractors' National Association
- spp.
- Espèces (au pluriel)
- UPS
- Source d'alimentation continue
- UV
- Ultraviolet
- VIH
- Virus de l'immunodéficience humaine
- vMCJ
- Variante de la maladie de Creutzfeldt-Jakob
- Zone GA
- Zone de confinement de gros animaux
- Zone PA
- Zone de confinement de petits animaux
Chapitre 1 - Introduction
Les termes qui figurent en caractères gras sont définis dans le glossaire complet qui se trouve au chapitre 24.
1.1 Portée
Au Canada, les installations qui manipulent ou entreposent des agents pathogènes humains ou des toxines sont réglementées en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) et du Règlement sur les agents pathogènes humains et les toxines (RAPHT)Note de bas de page 1Note de bas de page 2. Ces installations comprennent les suivantes : les laboratoires de santé publique, d'enseignement ou de recherche; les laboratoires hospitaliers de diagnostic; et les usines spécialisées en production de vaccins. Les installations canadiennes qui importent des agents zoopathogènes, des animaux infectés, des produits ou des sous-produits d'origine animale, ou toute autre substance susceptible d'être porteuse d'un agent pathogène, d'une toxine ou d'une partie de ceux-ci sont réglementées en vertu de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA)Note de bas de page 3Note de bas de page 4. L'Agence de la santé publique du Canada (ASPC) réglemente les agents pathogènes humains et les toxines en vertu de la LAPHT et du RAPHT. L'ASPC et l'Agence canadienne d'inspection des aliments (ACIA) sont conjointement responsables pour l'importation et le transfert d'agents zoopathogènes et de toxines en vertu de la LSA et le RSA.
Le Guide canadien sur la biosécurité (GCB), 2e édition, 2016, se veut un complément à la Norme canadienne sur la biosécurité (NCB), 2e édition, 2015Note de bas de page 5. Publié à l'origine comme étant la partie II des Normes et lignes directrices canadiennes sur la biosécurité (NLDCB), 1re édition, 2013, le GCB est un document d'orientation destiné aux installations canadiennes où l'on manipule des agents pathogènes humains et des agents pathogènes pour les animaux terrestresNote de bas de page 6. Le GCB fournit aux installations réglementées des directives générales sur la façon de satisfaire aux exigences physiques en matière de confinement, aux exigences opérationnelles, et aux exigences relatives aux essais de vérification et de performance énoncées dans la NCB. Il définit des concepts essentiels à l'élaboration et au maintien d'un programme de gestion de la biosécurité complet et axé sur les risques; toutefois, il ne fournit pas d'orientation précise ni de procédures opératoires normalisées (PON) portant sur des agents pathogènes donnés.
1.2 Aperçu
La biosécurité nécessite l'application constante des mesures de sécurité visant à réduire au minimum ou à protéger le personnel de laboratoire, les occupants du bâtiment, la communauté en général, la population animale et l'environnement du mal causé par l'exposition aux matières infectieuses, aux animaux infectés ou aux toxines manipulés dans une zone de confinement. Le programme de biosécurité comprend les politiques et les plans de l'établissement qui visent non seulement à rendre sécuritaire la manipulation et l'entreposage des matières infectieuses et des toxines, mais aussi à prévenir la libération de matières infectieuses ou de toxines hors de la zone de confinement. Parmi les principaux éléments d'un programme de biosécurité, on trouve les suivants : un programme de formation détaillé, un programme de surveillance médicale, un plan d'intervention d'urgence (PIU), des PON conformes aux pratiques de travail sécuritaires et un plan de biosûreté. Un programme de biosécurité fonctionnel et pratique englobe tous les éléments qui s'appliquent à un espace de travail en laboratoire, à une aire de production à grande échelle ou à un espace de travail avec des animaux. Certaines installations ne comportent qu'un seul laboratoire dans lequel on manipule des matières infectieuses ou des toxines; d'autres programmes peuvent comprendre plusieurs installations du même campus, sur lequel on mène diverses activités comportant des matières infectieuses ou des toxines. Dans un programme de biosécurité, l'adoption de bonnes pratiques microbiologiques, l'utilisation d'équipement de confinement primaire approprié ainsi que la conception matérielle adéquate de la zone de confinement sont des mesures de sécurité couramment utilisées. La sensibilisation grandissante du public à la question a permis de diriger l'attention sur la prévention de l'utilisation malveillante des agents pathogènes et des toxines. Ce phénomène a entraîné l'évolution rapide du domaine de la biosûreté en lui-même, en plus de permettre de souligner sa valeur et l'importance d'intégrer la biosûreté à chaque programme de biosécurité.
Tous les éléments d'un programme de biosécurité reposent sur les évaluations des risques, lesquelles sont essentielles à la détermination des dangers associés à des tâches ou à des activités précises comportant des matières infectieuses ou des toxines et à la mise en œuvre de stratégies d'atténuation appropriées. L'élaboration d'un programme de biosécurité fonctionnel exige une évaluation globale des risques pour toutes les tâches comportant des matières infectieuses ou des toxines. De plus, des évaluations locales des risques (ELR) propres à l'espace de travail sont réalisées afin de repérer, selon les activités menées et la nature des matières infectieuses ou des toxines utilisées, les dangers présents. Les Fiches techniques santé-sécurité : agents pathogènes (FTSSP) sont des documents techniques élaborés à partir des évaluations des risques qui décrivent les propriétés dangereuses des agents pathogènes humains et des toxines bien caractérisés et qui fournissent des recommandations sur la façon de les manipuler en toute sécurité. Ces fiches sont mises à la disposition du public sur le site Web de l'ASPC (www.santepublique.gc.ca/pathogenes). L'ACIA, pour sa part, a élaboré des Fiches de renseignements sur les maladies à déclaration obligatoire présentes au Canada et qui touchent les animaux terrestres, lesquelles sont accessibles sur son site Web (www.inspection.gc.ca/francais/sci/bio/biof.shtml).
Un programme de biosécurité peut être intégré à un programme de sécurité déjà en place ou à tout autre programme national ou international d'assurance de la qualité, de manière à améliorer et à rationaliser les mesures de sécurité globales et à favoriser la compréhension et le respect du programme de biosécurité de l'installation. Il existe un grand nombre de sources et de documents utiles pour simplifier l'élaboration et la mise en œuvre d'un programme de biosécurité. En plus des FTSSP et des fiches de renseignements décrites ci-dessus, l'ASPC et l'ACIA offrent, sur un portail d'apprentissage en ligne, de nombreuses ressources, comme des documents de formation sur la biosécurité, des modèles, des boîtes à outils, des affiches, des vidéos d'instruction, et plus encore (www.santepublique.gc.ca/formation). Le GCB fait souvent référence à ces documents et à ces ressources complémentaires, qui peuvent aider à l'élaboration des meilleurs programmes possible, et ce, dans le but de prévenir la libération d'agents pathogènes et de toxines et de protéger le personnel.
1.3 Norme canadienne sur la biosécurité
La NCB, 2e édition, 2015, constitue, à l'échelle nationale, une norme uniforme sur la manipulation et l'entreposage des agents pathogènes humains, des agents pathogènes pour les animaux terrestres et des toxines au Canada. La NCB énonce les exigences qui sont liées au confinement physique, aux pratiques opérationnelles et aux essais de vérification et de performance et qui visent la manipulation et l'entreposage sécuritaires des agents pathogènes humains, des agents pathogènes pour les animaux terrestres et des toxines. L'ASPC et l'ACIA utilisent la NCB pour vérifier la conformité continue des installations réglementées par la LAPHT, le RAPHT, la LSA et le RSA.
1.4 Comment utiliser le Guide canadien sur la biosécurité
Les renseignements contenus dans le GCB sont en fait des lignes directrices sur la meilleure façon de satisfaire aux exigences en matière de biosécurité énoncées dans la NCB. Ces renseignements ne devraient pas être considérés comme des exigences. Aux endroits où les lignes directrices renvoient à une exigence de la NCB, la ou les matrices liées à cette exigence sont citées en référence (p. ex. matrice 4.1 de la NCB) et les termes utilisés indiquent une obligation (p. ex. « doit être », « est exigé »). De la même façon, aux endroits où les lignes directrices renvoient à une exigence provenant de la loi (c.-à-d. de la LAPHT, du RAPHT, de la LSA ou du RSA), l'article concerné, ainsi que le ou les paragraphes concernés, le cas échéant, seront cités en référence (p. ex. LAPHT 33). Parfois, les renseignements du GCB évoquent les « meilleures pratiques » pour les mesures qui sont seulement exigées pour les zones de confinement élevé, et non les zones de confinement inférieures. En pareil cas, les termes utilisés suggèrent une recommandation (p. ex. « devrait être »).
Au tout début du présent guide se trouve une liste détaillée de toutes les abréviations et de tous les sigles utilisés dans le GCB. À leur première apparition dans un chapitre, les abréviations et les sigles sont épelés au long et suivis de leur abréviation, laquelle est placée entre parenthèses; pour le reste du chapitre, c'est l'utilisation de cette abréviation qui prévaut.
Le GCB comprend aussi, au chapitre 24, un glossaire complet des termes techniques; à leur première occurrence dans un chapitre, les termes qui y figurent sont en caractères gras. Le chapitre 25 contient la liste des ressources qui ont été utilisées pour élaborer le GCB. Les sources des citations indiquées dans le texte sont fournies à la fin de chaque chapitre, dans les références.
Une liste complète des normes externes et des documents cités dans les chapitres du GCB se trouve au chapitre 25.
Références
- Note de bas de page 1
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note de bas de page 2
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note de bas de page 3
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note de bas de page 4
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Note de bas de page 5
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2 e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 6
- Gouvernement du Canada. (2013). Normes et lignes directrices canadiennes sur la biosécurité, 1 re éd., Ottawa, ON, Canada : Gouvernement du Canada.
Chaptire 2 - Matières biologiques
Le terme « matière biologique » réfère aux microorganismes, aux protéines ou aux acides nucléiques, ou à toute autre matière pouvant contenir ces trois éléments (p. ex. les tissus), qu'ils soient ou non infectieux ou toxiques. Un agent pathogène est un sous-ensemble de matières biologiques qui a la capacité de causer des maladies chez l'humain ou l'animal. Les annexes 2, 3, 4 et 5 de la Loi sur les agents pathogènes humains et les toxines (LAPHT) présentent des exemples d'agents pathogènes humainsNote de bas de page 1. Des exemples d'agents zoopathogènes se trouvent sur le site web de l'Agence canadienne d'inspection des aliments (ACIA). Dans le cadre du Guide canadien sur la biosécurité (GCB), le terme « matière infectieuse » désigne des cultures pures ou des isolats d'agents pathogènes dans leur ensemble, ainsi que toute matière qui pourrait contenir un agent pathogène (p. ex. échantillon de tissu infecté) ou une partie d'un tel agent qui retient sa pathogénicité. Une toxine microbienne isolée de son organisme parental ou produite par synthèse n'est pas intrinsèquement infectieuse; par conséquent, le terme « matière infectieuse » ne comprend pas les toxines. Le présent chapitre offre un aperçu des caractéristiques de base des nombreux types de matières biologiques à prendre en considération dans le contexte du GCB.Note de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5
2.1 Bactéries
Les bactéries sont des organismes procaryotes unicellulaires sans noyau et d'autres organites intracytoplasmiquesNote de bas de page 2Note de bas de page 3. D'une taille variant de 0,5 à 5,0 µm, les bactéries peuvent être de forme sphérique (coques ou cocci) ou en forme de bâtonnet (bacilles) droit, incurvé, spiroïdal ou étroitement enroulé. Selon le résultat de la coloration de Gram et leur morphologie, les milliers de bactéries sont classées dans l'un des trois phénotypes suivants : Gram négatif, Gram positif ou mycoplasme (les bactéries qui ne possèdent pas de paroi cellulaire). La paroi cellulaire des bactéries Gram négatif se distingue considérablement de celle des bactéries Gram positif. Elle se compose d'une membrane plasmique, d'une couche de peptidoglycane qui constitue environ 10 % de la paroi, ainsi que d'une membrane externe à base de lipopolysaccharides et de lipoprotéines. À l'opposé, la paroi cellulaire des microorganismes Gram positif se compose d'une membrane plasmique et d'une couche de peptidoglycane qui forme jusqu'à 90 % de la paroi, mais elle ne possède pas de membrane lipidique externe. Les bactéries se distinguent également par leur besoin d'oxygène et sont généralement désignées comme aérobies, microaérophiles ou anaérobies.
Certaines bactéries peuvent aussi induire une réponse immunitaire extrême (p. ex. une inflammation) dans un organisme hôte, sécréter des exotoxines, produire des endotoxines liées à la membrane externe des bactéries ou former des spores qui leur permettent d'être transmises et de survivre hors de l'hôte pendant de longues périodes. Les bactéries qui peuvent causer une infection ou une maladie chez l'humain ou l'animal s'appellent des bactéries pathogènes. Certaines bactéries sont des agents pathogènes opportunistes qui peuvent coloniser le corps d'un hôte humain ou animal et ne pas causer de maladie, à moins d'une perturbation du système immunitaire de l'hôte ou de ses barrières naturelles contre les infections, ou d'une exposition de l'hôte à une dose de l'agent pathogène excessivement élevée. Les bactéries pathogènes obligatoires, quant à elles, ne peuvent pas survivre à l'extérieur d'un hôte et doivent provoquer des maladies pour assurer leur survie ainsi que leur transmission d'un hôte à l'autreNote de bas de page 6. Les bactéries pathogènes comprennent Bacillus anthracis, certaines souches d'Escherichia coli, Mycobacterium tuberculosis et les espèces (spp.) de Salmonella.
2.2 Virus
Les virus sont les plus petits organismes capables de réplicationNote de bas de page 2Note de bas de page 3Note de bas de page 5. Leur petite taille (20 à 300 nm) leur permet de traverser les filtres qui retiennent généralement les plus petites bactéries. Les virus n'ont pas de métabolisme : ils utilisent l'appareil de biosynthèse de l'hôte pour procéder à leur réplication. Sur le plan structurel, les virus les plus simples sont constitués d'acides nucléiques enfermés dans une capside de protéines (nucléocapside). Les virus enveloppés présentent une structure plus complexe, dans laquelle la nucléocapside est entourée d'une bicouche lipidique qui facilite l'interaction du virus avec les cellules hôtes.
Les virus sont classés selon leur stratégie de réplication et l'organisation de leur génome (c.-à-d. acide désoxyribonucléique [ADN] double brin, ADN simple brin, acide ribonucléique [ARN] double brin à transcription inverse, ARN simple brin de polarité négative, ARN simple brin de polarité positive et agents subviraux). Plusieurs familles de virus ont la capacité d'infecter des hôtes humains ou animaux. Certains virus sont propres à des espèces en particulier, tandis que d'autres peuvent infecter une vaste gamme d'espèces hôtes. Certains virus peuvent provoquer une infection persistante (c.-à-d. que la cellule hôte demeure vivante et continue à produire des particules virales pendant une longue période), une infection latente (c.-à-d. qu'il s'écoule plusieurs mois ou années entre l'infection et l'apparition de symptômes) ou une modification du génome hôte par intégration (p. ex. intégration d'un rétrovirus dans le génome hôte). Le virus de la grippe, le virus de l'immunodéficience humaine (VIH), le virus de l'herpès, le virus rabique et le virus Ebola sont des exemples de virus pathogènes.
2.3 Mycètes (champignons)
Les mycètes sont des microorganismes eucaryotes qui se distinguent facilement des bactéries et d'autres procaryotes par leur grande taille et la présence d'organites, notamment un noyau, des vacuoles et des mitochondriesNote de bas de page 2Note de bas de page 3. Les levures se développent habituellement sous la forme de cellules uniques tandis que les moisissures se développent en se ramifiant. Plus de 500 espèces de mycètes, sur un nombre estimé à 1,5 million, sont reconnues comme étant pathogènes chez l'hôte humain ou animal, ce qui comprend plusieurs espèces de levures et de moisissuresNote de bas de page 7.
Selon leur espèce, les spores fongiques peuvent se transmettre dans l'air, par inoculation ou par des contacts étroits. De plus, certaines espèces fongiques peuvent produire et libérer des mycotoxines (voir la section 2.7 pour de plus amples renseignements sur les toxines). En général, les tissus humains et animaux ainsi que les échantillons de sang ne constituent pas un risque de dissémination de spores fongiques dans l'air. La majorité des espèces de mycètes sont des agents pathogènes opportunistes qui, en général, ne causent une maladie que chez les individus immunodéprimés. Voici des exemples de mycètes pathogènes : Aspergillus fumigatus, Candida albicans; Blastomyces dermatitidis et Histoplasma capsulatum.
2.4 Parasites
Les protozoaires et les helminthes sont des parasites qui vivent à la surface ou dans le corps d'un hôte aux dépens de ce dernierNote de bas de page 8. Pour ce qui est des protozoaires, ce sont des microorganismes eucaryotes unicellulaires qui ne possèdent pas de paroi cellulaire et sont généralement mobiles. Les helminthes, pour leur part, sont des vers eucaryotes qui peuvent se développer au point d'être visibles à l'œil nu. Les parasites qui vivent dans les tissus ou les cellules de leur hôte se nomment « endoparasites » et causent des infections qui peuvent généralement être traitées. Certains endoparasites peuvent demeurer dans un corps humain pendant de nombreuses années, en dépit d'un traitement, et ils ressurgiront pour causer des symptômes dans la mesure où l'hôte deviendrait immunodéprimé. Les ectoparasites vivent à la surface de leur hôte ou dans la peau de celui-ci, causant une infestation. Le type de lésions infligées à l'hôte et le degré auquel cet hôte est atteint varient en fonction du nombre de parasites présents.
Au stade adulte, la plupart des helminthes sont grands et facilement visibles à l'œil nu; pourtant, en règle générale, c'est seulement lorsqu'ils sont très petits (stade d'œuf ou stade larvaire) qu'ils sont infectieux. Puisqu'au stade infectieux, les helminthes peuvent être transmis par ingestion, contact direct, injection et inhalation, les risques qu'ils présentent, en ce qui a trait à l'exposition non délibérée ou accidentelle, sont semblables à ceux d'autres microorganismes. Les microorganismes suivants sont des protozoaires pathogènes : Plasmodium falciparum, Leishmania donovani, Cryptosporidium parvum, Giardia lamblia et Trypanosoma cruzi. Parmi les helminthes pathogènes figurent Trichinella spiralis (nématode), Enterobius vermicularis (oxyure) et Hymenolepis nana (ténia).
2.5 Prions
Les prions sont de petites particules infectieuses de nature protéique généralement considérées comme étant à l'origine d'un groupe de maladies neurodégénératives évolutives chez l'humain et l'animal connues sous le nom d'encéphalopathies spongiformes transmissibles (EST)Note de bas de page 2Note de bas de page 3Note de bas de page 4. Lorsqu'un prion infectieux pénètre dans un organisme, il amène les protéines prions normalement repliées à se transformer en des isoformes de prions mal repliés associés à la maladie. L'isoforme pathogène sert de « modèle » pour le repliement d'autres protéines prions, ce qui entraînera alors l'accumulation d'une grande quantité de protéines mal repliées extrêmement stables dans le tissu infecté, et cette accumulation provoquera des lésions tissulaires et la mort des cellules.
Les protéines prions sont hautement thermostables, ont la capacité de se fixer avec une haute affinité aux surfaces métalliques, et peuvent survivre dans l'environnement pendant de longues périodesNote de bas de page 9. La voie de transmission la plus probable pour les personnes travaillant avec des prions infectieux est l'inoculation ou l'ingestion accidentelle de tissus infectés. Le caractère unique des EST s'explique par la longue période d'incubation (jusqu'à 30 ans) qui précède l'apparition des premiers symptômesNote de bas de page 10. L'encéphalopathie spongiforme bovine, la tremblante du mouton et la maladie débilitante chronique (MDC) des cervidés sont des exemples d'EST chez les animaux. La maladie de Creutzfeldt-Jakob (MCJ), la variante de la maladie de Creutzfeldt-Jakob (vMCJ), le syndrome de Gerstmann-Straussler-Scheinker, l'insomnie fatale familiale et le kuru sont des exemples d'EST qui touchent les humains. Certains prions, tels que les encéphalopathies spongiformes bovines, sont des agents pathogènes zoonotiques.
2.6 Agents pathogènes zoonotiques
Le terme « zoonose » désigne les maladies pouvant être transmises entre des animaux et des humains; il englobe les anthropozoonoses (c.-à-d. les maladies transmises des animaux aux humains) et les zooanthroponoses, aussi nommées « zoonoses inversées » (c.-à-d. les maladies transmises des humains aux animaux)Note de bas de page 8Note de bas de page 11Note de bas de page 12Note de bas de page 13. Plusieurs cas ont été consignés au sujet d'infection contractée en laboratoire (ICL) où un humain a été infecté par un agent pathogène zoonotique d'un animal infecté ou porteur. Le risque de contracter une zoonose est présent lors d'activités avec des animaux infectés avec un agent pathogène zoonotique de façon expérimentale, ainsi qu'au cours d'activités comportant la manipulation d'une première génération d'animaux sauvages capturés, lesquels peuvent être infectés ou porteurs d'un agent pathogène indigène à leur milieu naturel. Par exemple, Macacine herpesvirus 1 (autrefois nommé « virus de l'herpès B » ou « virus de l'herpès du cercopithèque de type 1 ») est un virus enzootique présent chez près de 70 % de la population des macaques gardés en captivité, notamment les macaques rhésus et les singes cynomolgus. De plus, ce virus a été associé à 50 cas au moins d'ICL consignésNote de bas de page 14Note de bas de page 15. Les cas consignés de zoonoses chez l'humain sont attribuables à des bactéries (p. ex. Salmonella spp., à l'origine de la salmonellose; Yersinia pestis, à l'origine de la peste), à des virus (p. ex. le virus rabique, à l'origine de la rage), à des parasites (p. ex. Toxoplasma gondii, à l'origine de la toxoplasmose) et à des prions (p. ex. l'agent de l'encéphalopathie spongiforme transmissible [EST], à l'origine de la vMCJ)Note de bas de page 16.
2.7 Toxines
Les toxines microbiennes sont des substances toxiques qui consistent en un produit naturel de l'activité métabolique de certains microorganismes (p. ex. bactéries, mycètes)Note de bas de page 2Note de bas de page 3. Elles peuvent causer des effets néfastes sur la santé (c.-à-d. intoxication), comme des changements physiologiques symptomatiques ou asymptomatiques, de graves effets invalidants ou le décès chez l'humain ou l'animal après avoir été exposé (c.-à-d. ingestion, inhalation, inoculation ou absorption) à une toxine, et ce, même pour les expositions où la dose de toxines était relativement petite. Les toxines ne sont ni réplicatives ni transmissibles de façon interhumaine. Lorsqu'on manipule des toxines, les voies de transmission les plus probables sont l'inoculation accidentelle ou l'exposition des muqueuses aux toxines aérosolisées. Certaines toxines peuvent être produites artificiellement au moyen d'une synthèse chimique ou des techniques de l'ADN recombiné (ADNr) (voir la section 2.8.1 pour de plus amples renseignements sur les techniques de l'ADNr). Les toxines microbiennes sont classées en fonction de l'organisme qui les fabrique (p. ex. bactérie, mycète). Les intoxications microbiennes sont généralement associées aux bactéries.
Il existe deux types de toxines bactériennes : les exotoxines et les endotoxines. Les exotoxines sont souvent des polypeptides et des protéines thermolabiles produites et sécrétées par diverses espèces, y compris les bactéries Gram négatif et Gram positif. Les exotoxines bactériennes produisent leurs effets toxiques sur l'hôte au moyen des cinq mécanismes suivants : lésions aux membranes cellulaires, inhibition de la synthèse protéique, inhibition de la libération de neurotransmetteurs, activation de voies de messagers secondaires ou activation de réponses immunitaires chez l'hôte. La toxine tétanique, produite par la bactérie Gram positif Clostridium tetani, et la toxine du choléra, produite par la bactérie Gram négatif Vibrio choleræ sont des exemples d'exotoxines. Il existe également une famille d'exotoxines thermostables, nommées entérotoxines, dont l'action touche principalement le système digestif. Ces exotoxines comprennent l'entérotoxine B staphylococcique produite par Staphylococcus aureus, les entérotoxines thermostables produites par Escherichia coli entérotoxinogène (ECET) et le céréulide produit par Bacillus cereus. Les endotoxines, quant à elles, sont des molécules structurales (lipopolysaccharides ou lipo-oligosaccharides) intégrées dans la membrane externe de la paroi cellulaire de certaines bactéries Gram négatif, comme Escherichia coli et Shigella dysenteriæ. Les endotoxines sont relativement thermostables et généralement moins toxiques que les exotoxines.
Un sous-ensemble de toxines microbiennes est réglementé par l'Agence de la santé publique du Canada (ASPC) et l'ACIA en vertu de la LAPHT, du Règlement sur les agents pathogènes humains et les toxines (RAPHT), de la Loi sur la santé des animaux (LSA), et du Règlement sur la santé des animaux (RSA). Une liste exhaustive des toxines réglementées touchant les humains se trouve aux annexes 1 et 5 de la LAPHTNote de bas de page 17Note de bas de page 18Note de bas de page 19.
2.8 Biotechnologie
Le terme « biotechnologie » se définit comme l'application de la science ou de l'ingénierie à l'utilisation directe ou indirecte des organismes vivants ou de leurs parties ou produits, sous leur forme naturelle ou modifiée. On peut avoir recours à diverses méthodes pour modifier le matériel génétique d'un organisme en vue d'en créer un autre, nouveau ou différent. Dans la nature, les mutations spontanées, le croisement et la sélection naturelle produisent des organismes et des hybrides présentant des traits ou des caractères nouveaux ou avantageux. Les méthodes moléculaires, comme la conjugaison, la transformation et la transduction bactériennes, ont traditionnellement servi à introduire de nouvelles informations génétiques dans des organismes ou des cellules hôtes en réponse à diverses visées scientifiques ou industrielles. Les avancées en biotechnologie se sont traduites par de nouvelles techniques plus efficaces pour créer des organismes génétiquement modifiés (OGM) par l'insertion, la délétion, le remplacement ou l'altération de gènes ou de segments de gènes. La biotechnologie a de nombreuses applications, notamment la production d'antibiotiques, d'hormones, d'enzymes et d'anticorps. Les méthodes modernes de biotechnologie souvent employées pour créer des organismes nouveaux ou modifiés sont décrites ci-dessous.
2.8.1 ADN recombiné
Il est possible de combiner du matériel génétique naturel ou synthétique, afin de produire un nouvel ADNr. De nos jours, les techniques de l'ADNr sont largement utilisées par les secteurs de recherche et d'industrie. Ces techniques comportent de nombreuses applications, comme la production d'animaux transgéniques; le clonage de gènes de toxines microbiennes, de gènes de pharmacorésistance ou d'autres gènes de virulence dans des vecteurs d'expression; et la production de clones viraux infectieux de pleine longueur.
Bien que les techniques de l'ADNr offrent de nombreux avantages, elles comportent le risque d'être utilisées pour la création de nouveaux organismes pathogènes ou l'augmentation de la pathogénicité d'un organisme existant, délibérément ou non.
2.8.2 Organismes génétiquement modifiés
Les OGM sont des organismes (c.-à.-d. des plantes, des animaux ou des microorganismes) créés par l'altération du matériel génétique d'une manière qui ne survient pas naturellement par la reproduction ou la recombinaison naturelle. La méthode de création d'OGM la plus connue repose sur les techniques de l'ADNr. Un OGM peut tout simplement être une souche bactérienne de mutation ponctuelle (p. ex. souche DH5-alpha d'E. coli) ou un hôte viral dans lequel un ADNr a été cloné (p. ex. vaccins contre le virus de la vaccine) dans le but de surexprimer un gène particulier à des fins d'étudesNote de bas de page 20Note de bas de page 21. Les animaux transgéniques et ceux créés par invalidation génique (knock-out) [p. ex. souris atteintes d'immunodéficience combinée grave] dont le génome a été respectivement modifié par l'insertion, le retrait, ou la modification de segments d'ADN sont des exemples d'OGM complexesNote de bas de page 22.
2.8.3 Vecteurs viraux
Les vecteurs viraux sont des véhicules utilisés pour introduire du matériel génétique dans des cellules hôtes et ainsi obtenir l'expression d'un gène. Ils sont employés aussi bien dans des travaux de recherche que dans le cadre de thérapies géniques. Les vecteurs viraux servant au transfert de gènes recombinés font habituellement appel à des virus présents dans la population humaine, par exemple les adénovirus, les virus de l'herpès ou les rétrovirus. Des modifications génétiques sont habituellement apportées à ces vecteurs pour en rehausser l'innocuité et pour assurer une meilleure diffusion du gène.
Les vecteurs rétroviraux, y compris les vecteurs lentiviraux dérivés du VIH-1, sont des véhicules de transfert de gènes compétents largement employés en raison de leur stabilité après leur intégration dans les chromosomes des cellules en division ou non, et de leur expression transgénique à long terme.
2.8.4 Organismes de synthèse
La biologie de synthèse est un domaine de recherche interdisciplinaire en constante évolution qui combine la biologie et le génie. Elle se penche sur la conception, le remodelage ou la fabrication de systèmes et de composants biologiques existants ou nouveauxNote de bas de page 23. L'utilisation d'ADN de synthèse (ADNs) pour concevoir et créer de nouveaux constituants, dispositifs et systèmes biologiques fait partie, entre autres, des activités liées à la biologie de synthèse. Cette discipline montre les effets, dont la portée pourrait être considérable, des progrès rapides dans le domaine des sciences de la vie sur le développement d'applications, dans des sphères telles que les soins de santé, l'agriculture, la chimie industrielle et la production d'énergieNote de bas de page 24. On s'attend à ce que la biologie de synthèse permette d'élaborer plusieurs technologies révolutionnaires importantes, comme de nouveaux vaccins et des médicaments améliorés, des outils de diagnostic et de surveillance des infections, des aliments de bétail, des biocarburants propres et des procédés industriels perfectionnés.
Tout comme les technologies de l'ADNr, la biologie de synthèse est associée au risque de servir à la création de nouveaux organismes pathogènes ou à l'augmentation de la pathogénicité d'organismes existants, délibérément ou non.
2.9 Lignées cellulaires et cultures cellulaires
Les lignées cellulaires et les cultures cellulaires sont généralement utilisées dans les laboratoires de diagnostic ou de recherche et dans les laboratoires industriels. L'ASPC et l'ACIA ne règlementent pas les lignées cellulaires, mais ils règlementent les agents pathogènes ou les parties de ces agents qu'elles peuvent contenir. De nombreuses lignées cellulaires ne posent en soi aucun risque pour les personnes qui les manipulent en laboratoire; cependant, elles peuvent contenir des organismes pathogènes comme des bactéries (p. ex. des mycoplasmes), des mycètes, des virus ou des prions. La pathogénicité peut survenir naturellement, le résultat d'une contamination par des organismes adventices (p. ex. mycoplasmes et moisissures), ou expérimentalement (p. ex. d'une transduction, d'une transfection, ou d'une infection). Les lignées de cellules provenant d'un fournisseur commercial sont généralement très bien caractérisées, et la présence de contaminants infectieux est consignée. Certaines lignées et cultures cellulaires établies et commercialisées peuvent contenir des parties d'agents pathogènes humains ou d'agents zoopathogènes en raison d'une infection antérieure (p. ex. virus latent ou présence d'un virus assistant) ou de manipulations de génie génétique visant à insérer l'information génétique d'un agent pathogène qui conserve sa pathogénicité. De telles lignées ou cultures cellulaires peuvent être assujetties à la réglementation de l'ASPC, de l'ACIA ou des deux. Les lignées cellulaires fraîchement préparées et qui proviennent d'une culture primaire peuvent présenter un risque accru de contamination, en particulier si la source de la lignée cellulaire est infectée ou présumée infectée par un agent pathogène. Des cas d'infection contractée en laboratoire associée à la manipulation de lignées cellulaires en culture primaire ont été consignésNote de bas de page 25Note de bas de page 26.
On peut facilement déceler la contamination des lignées cellulaires par des bactéries ou des mycètes; cependant, la contamination par des virus n'est pas aussi évidente et peut présenter un grave danger. Les conditions de culture (p. ex. pH, température, ajout de suppléments dans le milieu) peuvent entraîner une altération de l'expression d'oncogènes, l'expression de virus latents, des interactions entre des segments de gènes recombinés ou une altération de l'expression protéique à la surface de la cellule. En raison de plusieurs facteurs, soit la présence de produits de mycoplasme biologiquement actifs, la stabilité des antigènes de mycoplasme et au fait que plusieurs mycoplasmes sont des agents pathogènes zoonotiques, les mycoplasmes sont considérés comme un danger supplémentaire que doivent prendre en compte les personnes qui manipulent des lignées cellulaires.
Références
- Note de bas de page 1
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note de bas de page 2
- Madigan, M. T., Martinko, J. M., Stahl, D. A. et Clark, D. P. (2010). Brock Biology of Microorganisms, 13e éd., San Francisco, CA, États-Unis : Benjamin Cummings Publishing Company.
- Note de bas de page 3
- Lim, D. (2003). Microbiology, 3e éd., Dubuque, IA, États-Unis : Kendall/Hunt Publishing Company.
- Note de bas de page 4
- Hornlimann, B., Riesner, D. et Kretzschmar, H. A. (2007). Prions in Humans and Animals, Berlin, Allemagne : Walter de Gruyter inc.
- Note de bas de page 5
- Wagner, E. K., Hewlett, M. J., Bloom, D. C. et Camerin, D. (éds). (2008). Basic Virology, 3e éd., Malden, MA, États-Unis : Blackwell Publishing.
- Note de bas de page 6
- Fields, K. A., R. A. Hinzen et R. Carabeo. (2011). The obligate intracellular lifestyle. Frontiers in Microbiology . 2:1-2.
- Note de bas de page 7
- deHoog G. C., Guarro J., Gené J. et Figueras M. J. (2014). Atlas of Clinical Fungi, Consulté le 3 novembre 2015 à l'adresse http://www.clinicalfungi.org/
- Note de bas de page 8
- Bowman, D. D. et Georgi, J. R. (2008). Georgis' Parasitology for Veterinarians, 9e éd., Amsterdam, Pays-Bas : Elsevier Health Sciences.
- Note de bas de page 9
- Wiggins, R.C. (2009). Prion Stability and Infectivity in the Environment. Neurochemical Research. 34(1):158-168.
- Note de bas de page 10
- Prusiner, S.B. (2004). Prion Biology and Diseases, 2e éd., Cold Spring Harbor, NY, États-Unis : Cold Spring Harbor Laboratory Press.
- Note de bas de page 11
- Hubalek, Z. (2003). Letter: Emerging Human Infectious Diseases: Anthroponoses, Zoonosis, and Sapronoses. Emerging Infectious Diseases. 9(3):403-404.
- Note de bas de page 12
- Organisation mondiale de la Santé. (1967). Joint WHO/FAO Expert Committee on Zoonoses, 3rd Report, WHO Technical Report Series, no. 378, Genève, Suisse: Organisation mondiale de la Santé.
- Note de bas de page 13
- Acha, P. N., Szyfres, B. et le Pan American Sanitary Bureau. (2003). Zoonoses and Communicable Diseases Common to Man and Animals, 3e éd., Washington, DC, États-Unis: Pan American Health Organization.
- Note de bas de page 14
- Centers for Disease Control and Prevention des États-Unis. (1998). Fatal Cercopithecine Herpesvirus 1 (B Virus) Infection Following a Mucocutaneous Exposure and Interim Recommendations for Worker Protection. MMWR. Morbidity and Mortality Weekly Report. 47(49):1073-6, 1083.
- Note de bas de page 15
- Cohen, J., Davenport, D. S., Stewart, J. A., Deitchman, S., Hilliard, J. K., Chapman, L. E. et le B Virus Working Group. (2002). Recommendations for Prevention of and Therapy for Exposure to B Virus (Cercopithecine Herpesvirus 1). Clinical Infectious Diseases. 35:1191-1203.
- Note de bas de page 16
- Krauss, H., Weber, A., Appel, M., Enders, B., Isenberg, H. D., Schiefer, H. G., Slenczka, W. et al. (éds). (2003). Zoonoses: Infectious Diseases Transmissible from Animals to Humans, 3e éd., Washington, DC, États-Unis : ASM Press.
- Note de bas de page 17
- Règlements sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note de bas de page 18
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note de bas de page 19
- Règlement sur la santé des animaux (C.R.C., ch 296). (2015).
- Note de bas de page 20
- Invitrogen Life Technologies. (2015). Competent cell selection guide. Consulté le 3 novembre 2015 à l'adresse http://www.thermofisher.com/content/dam/LifeTech/global/life-sciences/Cloning/pdfs/CompetentCellSelectionGuide2015-Update-Global-FHR.pdf
- Note de bas de page 21
- Henderson, D. A. et Moss., B. (1999). Recombinant Vaccinia Virus Vaccines. Dans Plotkin, S. A. et Orenstein, W. A. (éds), Vaccines, 3e éd., Philadelphie, États-Unis : Saunders.
- Note de bas de page 22
- Custer, R. P., Bosma, G. C. et Bosma, M. J. (1985). Severe combined immunodeficiency (SCID) in the mouse. Pathology, reconstitution, neoplasms. American Journal of Pathology. 120(3):464-77.
- Note de bas de page 23
- Royal Society du Royaume-Uni. (2007). Call for views: Synthetic Biology. Consulté le 3 novembre 2015 à l'adresse https://royalsociety.org/~/media/Royal_Society_Content/policy/projects/synthetic-biology/CallForViews.pdf
- Note de bas de page 24
- International Risk Governance Council. (2010). Guidelines for the Appropriate Risk Governance of Synthetic Biology. Consulté le 3 novembre 2015 à l'adresse http://www.irgc.org/IMG/pdf/irgc_SB_final_07jan_web.pdf.
- Note de bas de page 25
- Davidson,W. L. et Hummeler, K. (1960). B Virus Infection in Man. Annals of the New York Academy of Sciences. 85:970-979.
- Note de bas de page 26
- Gandsman, E. J., Aaslestad, H. G., Ouimet, T. C. et Rupp, W. D. (1997). Sabia Virus Incident at Yale University. American Industrial Hygiene Association Journal. 58(1):51-53.
Chapitre 3 - Niveaux de confinement et zones de confinement
Le terme « confinement » (ou « bioconfinement ») réfère à l'ensemble des paramètres de conception physique et de pratiques opérationnelles visant à protéger le personnel, le milieu de travail immédiat, la communauté et l'environnement externe contre toute exposition à des matières biologiques potentiellement dangereuses. La Norme canadienne sur la biosécurité (NCB), 2e édition, décrit les différents niveaux de confinement applicables aux installations qui manipulent ou entreposent des agents pathogènes humains, des agents zoopathogènes ou des toxines réglementées par l'Agence de la santé publique du Canada (ASPC), l'Agence canadienne d'inspection des aliments (ACIA), ou les deuxNote de bas de page 1. Les exigences physiques en matière de confinement et les exigences opérationnelles propres à chaque niveau de confinement sont énoncées respectivement aux chapitres 3 et 4 de la NCB. Le présent chapitre décrit les différents niveaux de confinement et les types d'aires de travail qu'on peut trouver à l'intérieur d'une zone de confinement, en plus d'offrir aux parties réglementées des directives pour les aider à déterminer des zones de confinement à l'intérieur de leurs installations et à y accéder. Veuillez noter que tous les diagrammes inclus dans ce chapitre sont présentés à titre indicatif seulement et qu'ils ne sont pas à l'échelle. La configuration optimale des zones de confinement et la taille des salles et des entrées de porte varieront selon le type d'installation.
3.1 Niveaux de confinement
Le niveau de confinement détermine les pratiques de confinement physique et les pratiques opérationnelles minimales qu'une zone de confinement (c.-à-d. un espace physique déterminé qui satisfait aux exigences liées à un niveau de confinement donné) exige pour la manipulation sécuritaire de matières infectieuses ou de toxines. Il existe quatre niveaux de confinement, allant du niveau d'un laboratoire de base pour le travail avec des matières biologiques (niveau de confinement 1 [NC1]) aux installations hautement sophistiquées pour les travaux avec les agents pathogènes du plus haut risque (niveau de confinement 4 [NC4]). La NCB présente les exigences minimales liées au confinement physique et aux pratiques opérationnelles propres aux installations de niveau de confinement 2 (NC2), de niveau de confinement 3 (NC3) et de NC4 réglementées par l'ASPC ou l'ACIA et autorisées à manipuler ou entreposer des agents pathogènes humains, des agents zoopathogènes ou des toxines. En raison du faible risque que les matières biologiques du groupe de risque 1 (GR1) posent pour la santé publique et la population animale, il n'y a pas d'exigence physique en matière de confinement ou d'exigence opérationnelle qui s'applique aux installations de NC1.
3.1.1 Catégories de niveaux de confinement
Les définitions suivantes fournissent une description sommaire des différents niveaux de confinement qui s'appliquent aux activités comportant des agents pathogènes humains, des agents zoopathogènes ou des toxines. Les exigences particulières des NC2, des NC3 et des NC4 et de plus amples renseignements sur ceux-ci se trouvent dans la NCB.
3.1.1.1 Niveau de confinement 1
Le travail comportant des matières biologiques du GR1 peut être réalisé en toute sécurité dans des espaces de travail en laboratoire, des aires de production à grande échelle ou des espaces de travail avec des animaux de base, tous des endroits communément nommés NC1. Les NC1 possèdent certaines caractéristiques qui servent de fondement à la biosécurité et sur lesquelles sont basées les exigences des zones de niveau de confinement supérieur. La biosécurité est principalement assurée grâce aux bonnes pratiques microbiologiques et aux éléments de base du confinement physique, telles que des lavabos destinés au lavage des mains, lesquels protègent le personnel et l'environnement des matières biologiques manipulées.
En raison du faible risque à la santé publique et la population animale posé par les matières biologiques du GR1, il n'y a pas d'exigences physiques ou opérationnelles qui s'appliquent au NC1. Les recommandations générales en ce qui concerne la manipulation sécuritaire des matières biologiques du GR1 sont décrites au chapitre 21.
3.1.1.2 Niveau de confinement 2
Le NC2 est fondé sur les caractéristiques fondamentales des laboratoires de base établies pour le NC1. Dans les installations de NC2, la biosécurité et la biosûreté sont assurées grâce à des pratiques opérationnelles et à un sous-ensemble de base d'exigences en matière de confinement physique dont la rigueur est proportionnelle aux risques associés aux agents pathogènes et aux toxines manipulés dans l'installation. Les pratiques opérationnelles pour le NC2 réfèrent aux mesures administratives (p. ex. gestion du programme de biosécurité, formation) ainsi qu'aux procédures (p. ex. pratiques de travail, utilisation d'équipement de protection individuel [EPI], décontamination) qui réduisent les risques associés aux activités menées dans la zone. Les caractéristiques liées au confinement physique comprennent la conception de l'installation (p. ex. emplacement du laboratoire, revêtement des surfaces, contrôle de l'accès) et l'offre d'équipement de biosécurité, comme les dispositifs de confinement primaire (p. ex. les enceintes de sécurité biologique [ESB]), utilisé pour certaines activités.
Un schéma représentant deux zones de NC2 est présenté à la figure 3-1. Il illustre un espace de travail en laboratoire de NC2 et une zone de confinement de petits animaux (zone PA) de NC2 distincte; les lignes rouges autour des zones de NC2 délimitent le périmètre de la zone de confinement (décrite à la section 3.3.1). La figure illustre certaines des caractéristiques physiques de base des zones du NC2, notamment la séparation des aires publiques des zones de confinement par des portes, la présence de dispositifs de confinement primaire (p. ex. des ESB) à distance des portes et des zones de grande circulation, et la disposition de lavabos (pour faciliter le lavage des mains) en sortant de la zone.
3.1.1.3 Niveau de confinement 3
Dans les installations de NC3, la biosécurité et la biosûreté sont assurées grâce à des exigences complètes portant sur les pratiques opérationnelles et le confinement physique. Le NC3 exige des normes liées à la conception de l'installation et des mesures d'ingénierie rigoureuses (p. ex. courant d'air vers l'intérieur, filtres à haute efficacité pour les particules de l'air [HEPA] pour traiter l'air évacué), ainsi que de l'équipement de biosécurité spécialisé (p. ex. ESB, centrifugeuses à rotors étanches) afin de réduire le plus possible la libération de matière infectieuse dans les pièces avoisinantes à l'intérieur et à l'extérieur de la zone de confinement et dans l'environnement. Des mesures d'ingénierie supplémentaires, telles que l'emploi de systèmes de décontamination des effluents, sont nécessaires dans certaines situations (p. ex. la manipulation d'agents zoopathogènes non indigènes du groupe de risque 3 [GR3]) pour contenir les risques associés à la libération d'agents pathogènes dans l'environnement. Au NC3, les exigences liées aux pratiques opérationnelles s'appuient sur celles du NC2, en plus de tenir compte des risques accrus associés aux agents pathogènes et aux activités de laboratoire comportant des agents pathogènes du GR3.
Un schéma représentant une zone PA de NC3 est présenté à la figure 3-1. Les lignes rouges entourant la zone de NC3 délimitent le périmètre de la zone de NC3 dans l'exemple. La figure illustre certaines des caractéristiques physiques de base, notamment la séparation des aires publiques de la zone de confinement par une porte, la disposition d'un lavabo pour le lavage des mains (dans cet exemple, il est situé dans le vestiaire « sale »), et la présence de dispositifs de confinement primaire (p. ex. des ESB) à distance des portes et des espaces achalandés, d'un sas ou d'un vestiaire muni d'une installation de douche corporelle, de cages de confinement primaire et d'un passe-plat (optionnel).
3.1.1.4 Niveau de confinement 4
Le NC4 est le niveau de confinement le plus élevé. Les installations de NC4 demandent une conception d'installation très complexe qui est un espace autonome à l'intérieur de l'édifice, ou un édifice séparé si nécessaire. Il comprend des mesures d'ingénierie améliorées (p. ex. filtres HEPA pour traiter l'évacuation et l'arrivée d'air) et l'utilisation de l'équipement de biosécurité spécialisé (p. ex. ESB, systèmes de décontamination des effluents) et de dispositifs de biosécurité redondants (p. ex. système de filtration HEPA à deux étapes pour traiter l'air évacué). Le NC4 requiert des pratiques opérationnelles de niveau maximal (p. ex. utilisation d'EPI, pratiques de travail, surveillance médicale), qui se fondent sur celles exigées au NC3 et les dépassent. Les zones de NC4 exigent l'utilisation de combinaisons à pression positive pour le personnel ou, sinon, l'utilisation d'ESB de catégorie III à l'intérieur d'un espace de travail en laboratoire qui satisfait aux exigences du NC4.
Un schéma représentant une zone de NC4 où l'on porte des combinaisons à pression positive (y compris un espace de travail en laboratoire, une salle animalière, un box et une salle de nécropsie) est présenté à la figure 3-2. Cette zone comprend des ESB, des autoclaves à deux portes et des sas munis d'installations de douches corporelles qui séparent les vestiaires « propres » des vestiaires « sales ».
3.2 Zones de confinement
Une zone de confinement est un espace physique qui satisfait aux exigences liées à un niveau de confinement donné. Il peut s'agir d'une salle unique (p. ex. un laboratoire), d'une série de salles situées dans un même endroit (p. ex. plusieurs espaces de travail en laboratoire de NC2 non adjacents, mais verrouillables) ou il peut s'agir d'une série de salles adjacentes de même niveau de confinement (p. ex. salles de NC3 comprenant des espaces réservés au travail en laboratoire ainsi que des salles animalières ou des box séparés). Les zones réservées au soutien, notamment les sas (y compris les douches et les vestiaires « propres » et « sales », le cas échéant), font partie de la zone de confinement, et ce, même si le vestiaire « propre » est situé à l'extérieur de la barrière de confinement (voir la section 3.3.2). Une zone de confinement peut se définir comme une seule ou plusieurs aires de travail de différents types (c.-à-d. espaces de travail en laboratoire, aires de production à grande échelle, espaces de travail avec des animaux), à condition qu'elles soient toutes du même niveau de confinement. Pour les installations réglementées par l'ASPC et l'ACIA, les exigences propres à chaque zone de confinement sont énoncées dans la NCB.
3.2.1 Espaces de travail situés à l'intérieur de la zone de confinement
Les sections ci-dessous portent sur les différents types d'espaces de travail et décrivent, d'une manière générale, l'endroit où l'on manipule des matières infectieuses ou des toxines dans une zone de confinement. Chaque espace est un endroit désigné à l'intérieur de la zone de confinement.
3.2.1.1 Espace de travail en laboratoire
Un espace de travail en laboratoire est conçu et équipé pour y mener des activités in vitro comportant des matières infectieuses ou des toxines, notamment la recherche scientifique, les activités commerciales ainsi que les activités de diagnostic et d'enseignement. Seuls les échantillons de matières infectieuses ou de toxines d'un volume considérés comme étant à « l'échelle laboratoire » sont utilisés pour les activités in vitro (c.-à-d. généralement moins de 10 litres). La propagation d'un virus dans les œufs peut se faire dans un espace de travail en laboratoire.
3.2.1.2 Aire de production à grande échelle
Une aire de production à grande échelle est conçue spécialement pour la production (c.-à-d. la fabrication) de volumes importants de matières infectieuses ou de toxines pour le commerce, la recherche scientifique ou l'enseignement. Les activités comportant des toxines ou la culture in vitro d'agents pathogènes à un volume égal ou supérieur à 10 litres, par exemple les activités menées dans les installations de production de vaccins, sont considérées comme du travail à grande échelle. Le chapitre 14 fournit de plus amples renseignements sur le travail à grande échelle.
3.2.1.3 Espace de travail avec des animaux
Un espace de travail avec des animaux est conçu spécifiquement pour mener des activités in vivo comportant la manipulation de matières infectieuses ou de toxines (c.-à-d. des activités avec des animaux entiers vivants) à des fins de recherche, d'activités de diagnostic ou d'enseignement et d'activités commerciales. Les espaces de travail avec des animaux comprennent des pièces spécialement conçues pour héberger et manipuler des animaux vivants; ces espaces peuvent aussi comprendre des zones désignées pour la manipulation et l'entreposage de carcasses animales, comme les salles de nécropsie. Les zones de confinement d'animaux sont des zones de confinement qui englobent plusieurs espaces de travail avec des animaux (c.-à-d. une zone de confinement qui comporte au moins une salle animalière ou au moins un box). La section 3.2.2 présente de plus amples renseignements sur les zones de confinement d'animaux.
3.2.2 Zones de confinement d'animaux
Une zone de confinement d'animaux est une zone de confinement spécialement conçue pour le travail in vivo avec des agents pathogènes et des toxines (c.-à-d. impliquant des animaux vivants). Une « salle animalière » est une salle conçue pour héberger des animaux dans des cages de confinement primaire (c.-à-d. des cages de confinement munies de filtres dont la conception vise à prévenir la libération de matières infectieuses et de toxines). Un « box » est une salle ou un espace conçus pour héberger un animal (ou des animaux) où la salle même assure le confinement primaire. En général, une zone de confinement d'animaux désigne un ensemble de salles animalières ou de box juxtaposés, ainsi que les sas, les corridors qui les relient et les zones de soutien (p. ex. aires d'entreposage et aires de préparation) d'un niveau de confinement égal.
Une « zone de confinement de petits animaux » (ou zone PA) désigne une zone où les animaux sont hébergés dans des cages de confinement primaire à l'intérieur de salles animalières; une « zone de confinement de gros animaux » (ou zone GA) désigne une zone où les animaux sont hébergés dans des box (c.-à-d. que la salle assure elle-même le confinement primaire). Les zones GA peuvent également comprendre des salles particulières situées à l'intérieur de la zone de confinement et dans lesquelles sont effectuées des nécropsies et des dissections d'animaux : ce sont les « salles de nécropsie ». Comme de nombreuses autres exigences physiques et opérationnelles s'appliquent aux zones de confinement d'animaux dont la salle elle-même assure le confinement primaire (c.-à-d. les zones GA), la NCB marque une distinction entre les zones GA de NC2 et de NC3 et les autres aires de travail et zones de confinement en les désignant comme NC2-Ag ou NC3-Ag (c.-à-d. NC2- ou NC3-Agriculture, respectivement) dans les exigences énoncées aux chapitres 3,4 et5 de la NCB.
On désigne les zones PA et les zones GA en fonction du mode d'hébergement des animaux (cages de confinement primaire ou salle assurant elle-même le confinement primaire), et non selon leur taille. En général, les « gros animaux » et les « petits animaux » sont respectivement hébergés dans des zones GA et des zones PA. Toutefois, dans certains cas il est possible d'héberger de petits animaux dans une zone GA. Par exemple, dans le cas d'une pièce où des petits animaux, comme des poulets, sont hébergés dans un espace ouvert à l'intérieur de la salle ou d'une pièce où des petits animaux, comme des rongeurs, sont hébergés dans des cages ouvertes uniquement destinées à limiter le déplacement des animaux dans un espace (c.-à-d. qu'elles ne sont pas munies de filtres pour prévenir la libération de matières infectieuses ou de toxines), la salle assure elle-même le confinement primaire; elle est donc considérée comme un box (c.-à-d. une zone GA), peu importe la taille réelle des animaux. Le chapitre 13 décrit en détail le travail avec des animaux.
3.3 Déterminer une zone de confinement et y accéder
Pour évaluer la conformité aux normes correspondantes présentées dans la NCB, il est primordial de déterminer clairement une zone de confinement. Par exemple, il est impossible de déterminer les points d'entrée et de sortie, les portes critiques et les espaces appropriés pour enfiler et retirer l'EPI sans avoir préalablement établi la barrière de confinement et le périmètre de la zone de confinement. Pour satisfaire à toutes les exigences physiques en matière de confinement et assurer un confinement physique et un degré de sécurité appropriés dans l'installation, le périmètre des zones de confinement élevé (NC3 et NC4) est généralement déterminé au cours de l'étape de conception de l'installation. En ce qui concerne les zones de NC2, plus particulièrement les vieux bâtiments qui n'ont pas été récemment rénovés ou modernisés, la flexibilité en ce qui a trait à la délimitation du périmètre de la zone de confinement est plus grande. Dans les zones de NC2 et les zones GA de NC2 (c.-à-d. NC2-Ag) qui ne sont pas dotées de courant d'air vers l'intérieur (CAVI), une barrière de confinement supplémentaire n'est pas créée par le courant d'air; et, par le fait même, le périmètre de la zone de confinement (les portes et les murs) sert aussi de barrière de confinement physique. La section 3.3.1 offre de plus amples renseignements sur les périmètres des zones de confinement et les barrières de confinement. Il est recommandé d'inclure dans le Manuel de biosécurité les plans d'étage de la zone de confinement et des salles attenantes aux fins de référence, et de délimiter clairement le périmètre de la zone de confinement pour aider le personnel et d'autres intervenants à reconnaître la disposition physique de cette zone. Finalement, les niveaux supérieurs de la structure organisationnelle (p. ex. haute direction, comité de biosécurité de l'établissement) sont chargés de déterminer la méthode d'établissement des zones de confinement au sein d'une installation en tenant compte des besoins et des enjeux en matière de sécurité et d'accès, ainsi que de la circulation et du débit des matières et du personnel, en s'assurant de la conformité aux exigences applicables de la NCB. Il sera question ci-dessous des concepts et des facteurs à prendre en considération en ce qui concerne le périmètre des zones de confinement et les barrières de confinement.
3.3.1 Périmètre de la zone de confinement
Le périmètre de la zone de confinement correspond à la limite physique la plus externe d'une zone de confinement (c.-à-d. les murs, les portes, les fenêtres, les planchers et les plafonds qui entourent une zone de confinement donnée). On dispose d'une certaine flexibilité en ce qui concerne la définition du périmètre de la zone de confinement, en particulier pour les zones de confinement individuelles de NC2, comme le montre la figure 3-3. Quant à la figure 3-3(a), elle représente plusieurs laboratoires adjacents regroupés dans une même zone de NC2, dans laquelle l'ensemble des salles et des corridors attenants sont considérés de niveau de confinement égal (c.-à-d. de NC2). Dans ce cas, le périmètre de la zone de confinement est délimité par le mur extérieur de l'aile de laboratoire. Il n'y a que deux points d'entrée ou de sortie de la zone de confinement, lesquels doivent être accompagnés d'un panneau d'avertissement de danger biologique et munis de portes verrouillables qui doivent demeurer fermées, conformément aux exigences physiques liées à l'accès énoncées dans la matrice 3.3 de la NCB. Dans le présent exemple, l'espace de bureau attenant (adjacent à la salle d'autoclavage) se trouve à l'intérieur de la zone de confinement définie. Par conséquent, pour que l'ensemble de la zone soit conforme, toutes les exigences liées au confinement physique et aux pratiques opérationnelles du NC2 s'appliquent à cet espace de bureau. La figure 3-3(b) montre la même disposition des espaces de laboratoire, mais dans une configuration où chaque salle fait aussi office de zone de confinement. Dans ce cas, on trouve sept zones de NC2 distinctes. Chacune d'entre elles comporte un seul point d'entrée et de sortie (lequel doit être muni d'une porte verrouillable et d'un panneau d'avertissement de danger biologique, etc.). À la figure 3-3(b), l'espace de bureau adjacent à la salle d'autoclavage ne fait pas partie de la zone de confinement; ainsi, il n'est pas nécessaire de satisfaire aux exigences physiques ou opérationnelles de la NCB dans cet espace. Autre point à souligner : à la figure 3-3(b), les congélateurs situés dans le corridor se trouvent à l'extérieur de la zone de confinement et devraient donc être verrouillés en tout temps s'ils contiennent des agents pathogènes ou des toxines, parfois même fixés au mur (p. ex. si des agents biologiques à cote de sécurité élevée [ABCSE] sont présents), pour respecter les exigences énoncées dans la NCB. À l'inverse, à la figure 3-3(a), il n'est pas nécessaire que les congélateurs aient des serrures, car, même s'ils sont disposés de la même façon, ils sont situés à l'intérieur de la zone de confinement de NC2.
La figure 3-4 présente un exemple de panneau d'avertissement de danger biologique où figurent tous les éléments exigés au point d'entrée d'une zone de confinement (c.-à-d. le symbole international de danger biologique, le niveau de confinement, le nom et le numéro de téléphone d'une personne-ressource et les conditions d'accès à la zone de confinement [matrice 3.3 de la NCB]).
La figure 3-5 illustre aussi la flexibilité du périmètre de la zone de confinement au NC2, ce qui démontre la nécessité de définir de façon officielle la zone de confinement. Aux figures 3-5(a) et(b), on trouve un espace de bureau qui, adjacent à un espace de travail en laboratoire, n'est accessible qu'en traversant ce laboratoire. À la figure 3-5(a), l'espace de travail en laboratoire et celui de bureau se trouvent à l'intérieur du périmètre de la zone de confinement et font donc partie de la zone de NC2. Dans ce cas, toutes les exigences pour les NC2 liées au confinement physique et aux pratiques opérationnelles énoncées dans la NCB s'appliquent autant à l'espace de travail en laboratoire qu'à celui de bureau (p. ex. les exigences d'EPI s'appliquent tant au bureau qu'à l'espace de travail en laboratoire de NC2). La figure 3-5(b), quant à elle, affiche la même disposition des salles; toutefois, dans ce cas, le périmètre de la zone de confinement n'englobe pas l'espace de bureau. Ce dernier est ainsi physiquement séparé de la zone de confinement définie; les exigences de la NCB pour les laboratoires de NC2 ne s'appliquent donc pas à cet espace de bureau.
Les portes verrouillables et les autres exigences physiques concernant l'accès précisées dans la NCB pour les zones de NC2 doivent se trouver à l'entrée du bureau. En outre, les exigences en matière de pratiques opérationnelles appropriées (p. ex. les procédures de sortie, l'enlèvement de l'EPI et le lavage des mains) doivent être respectées au moment d'entrer dans le bureau conformément aux exigences de la NCB. De plus, les procédures d'entrée et les exigences liées à l'EPI doivent être respectées au moment de passer du bureau à la zone de NC2. Il est aussi recommandé que le périmètre des zones de confinement soit indiqué de façon visuelle sur le plancher (p. ex. en utilisant un ruban en couleurs) afin de rappeler aux employés là où commence la zone de confinement et là où elle finit. Il peut être impossible de mettre en place cette configuration dans des zones de travail de NC2 dotées d'un courant d'air vers l'intérieur (CAVI).
Il est généralement recommandé de mettre à la disposition du personnel les plans d'étage de la zone de confinement et des espaces adjacents, où les barrières et le périmètre de la zone de confinement sont clairement indiqués. Ces plans peuvent servir à la formation du personnel ou d'autres personnes en ce qui concerne la disposition physique de la zone de confinement et les exigences opérationnelles qui y sont associées. Afin d'en faciliter la consultation, les plans devraient être inclus dans le Manuel de biosécurité.
3.3.2 Barrière de confinement
La barrière de confinement, laquelle réfère plutôt à la barrière délimitant les aires « propres » et les aires « sales » situées à l'intérieur d'une zone de confinement, ne correspond pas toujours au périmètre de la zone de confinement. Dans plusieurs zones, notamment dans les zones de confinement élevé, on parvient à établir une barrière de confinement physique par le maintien du courant d'air vers l'intérieur (CAVI) induit par des différences de pression. Ce courant d'air crée une barrière physique qui prévient la libération par la porte de matière infectieuse ou de toxines aéroportées ou aérosolisées.
La barrière de confinement est toujours située le long du périmètre de la zone de confinement ou à l'intérieur de celui-ci. Dans les zones de NC2 en l'absence de courant d'air vers l'intérieur (CAVI) ou de sas, la barrière de confinement chevauche souvent le périmètre de la zone de confinement (c.-à-d. qu'on ne peut les distinguer). Toutefois, dans le cas des zones de confinement élevé, la barrière de confinement se trouve à l'intérieur de la zone de confinement de NC3 ou de NC4 à la limite entre le vestiaire « propre » du sas et l'installation de douche corporelle. Ce principe est illustré à la figure 3-6 pour une zone de NC3.
Dans certains cas, il est possible de trouver plusieurs barrières de confinement à l'intérieur d'une même zone de confinement. Par exemple, dans une grande zone GA de NC3 (c.-à-d. NC3-Ag) qui, pour permettre des activités comportant la manipulation de différents agents pathogènes, englobe plusieurs box, une barrière de confinement sera probablement établie à chaque box et à chaque salle de nécropsie. Cette mesure permet de prévenir la propagation de la contamination en provenance de ces salles et la contamination croisée, et de protéger le personnel, en plus d'établir une barrière de confinement aux points d'entrée et de sortie de l'ensemble de la zone GA de NC3 (figure 3-7). Dans cette situation, les employés à l'extérieur de la zone de confinement doivent franchir un minimum de deux barrières de confinement pour entrer dans un box.
Au contraire, la barrière de confinement des zones de NC2 qui ne nécessitent pas de courant d'air vers l'intérieur (CAVI) (p. ex. les aires de travail en laboratoire et les zones PA) peut être indiquée par une ligne sur le sol qui sépare la zone « propre » de la zone « sale ». À moins d'indication contraire, la barrière de confinement de la plupart des aires de travail en laboratoire de NC2 correspond au périmètre de la zone de confinement.
3.3.3 Accès à la zone de confinement : sas
Un sas est une salle ou un ensemble de salles situé à l'intérieur de la zone de confinement. Il permet de séparer les zones « propres » des zones « sales » (c.-à-d. séparer les zones à faible risque de contamination de celles à risque élevé). On l'utilise pour franchir la barrière de confinement dans les deux sens (entrée et sortie du personnel et des animaux), et pour entrer dans les salles animalières, les box et les salles de nécropsie et en ressortir. La présence d'un sas à un point d'entrée ou de sortie d'une barrière de confinement crée un espace tampon additionnel qui protège l'environnement extérieur des matières infectieuses et des toxines manipulées à l'intérieur de la barrière. Le sas peut également servir d'espace additionnel aux points d'entrée ou de sortie où les vêtements réservés exclusivement à la zone de confinement et l'EPI additionnel peuvent être enfilés ou retirés ainsi qu'entreposés, au besoinNote de bas de page 2Note de bas de page 3.
3.3.3.1 Configuration du sas
La taille et la complexité du ou des sas dépendent de la conception de la zone de confinement et des activités qui s'y déroulent. Sous sa forme la plus simple, le sas consiste en une salle unique située entre une zone « propre » (c.-à-d. non contaminée), qui ne sert pas aux activités comprenant des matières infectieuses ou des toxines (p. ex. endroit public, bureau), et une zone « sale » (c.-à-d. contaminée), où sont manipulés ou entreposés des matières infectieuses ou des toxines. Le ou les sas peuvent servir de points d'accès à l'espace de travail pour le personnel, les animaux, les matières et l'équipement. On peut trouver la configuration comportant un seul sas dans certaines zones de NC2, comme les aires de production à grande échelle et les zones PA et zones GA. Toutefois, il convient de noter que pour certaines zones de confinement de NC2, la présence d'un sas au point d'accès n'est pas nécessaire. On peut consulter la NCB pour connaître les espaces de travail et les zones de confinement pour lesquelles la présence d'un sas est exigée.
Les sas des zones de NC3, des zones GA de NC3 (c.-à-d. NC3-Ag) et des zones de NC4 se présentent sous des formes plus complexes. Ils désignent des ensembles d'espaces ou de salles qui servent à prévenir la propagation de la contamination par l'EPI réservé à la zone et la migration de l'air possiblement contaminé de l'espace de travail hors de la barrière de confinement par le maintien d'un courant d'air vers l'intérieur (CAVI). Dans les sas, la séparation du vestiaire « propre » et du vestiaire « sale » par une installation de douche corporelle permet au personnel de se doucher à la sortie de la barrière de confinement pour réduire le risque de libération des matières infectieuses ou des toxines qui se trouvent dans les cheveux ou sur la peau. Dans les zones de NC3 où des agents zoopathogènes non indigènes ne sont pas manipulés ou entreposés, une évaluation locale des risques (ELR) pourrait être réalisée pour déterminer, en fonction des activités quotidiennes, s'il est nécessaire ou non de se doucher dans le sas en sortant. Par exemple, il faut se doucher en sortant lorsqu'il y a un risque d'exposition à des agents pathogènes aéroportés ou aérosolisés (p. ex. déversement biologique) ou en cas de contact considérable avec des animaux infectés. Il est toujours essentiel de se doucher à la sortie d'une zone de confinement où des agents zoopathogènes non indigènes sont activement manipulés.
De même, les sas des zones de NC4 où des combinaisons à pression positive sont portées peuvent être très complexes. Ils peuvent comprendre, en plus des vestiaires « propre » et « sale » et de l'installation de douche corporelle, un vestiaire pour enfiler et retirer les combinaisons (distinct ou non du vestiaire « sale ») et une installation de douche de décontamination chimique.
La disposition de ces espaces à l'intérieur des sas revêt une grande importance : elle dépend de la séquence de sortie de la zone de confinement exigée pour le personnel. Les sas de conception adéquate préviennent la propagation de la contamination hors de la barrière de confinement et l'exposition potentielle aux décontaminants chimiques utilisés, en plus de protéger la sécurité du personnel.
3.3.3.2 Dispositifs d'interverrouillage et courant d'air vers l'intérieur
Le courant d'air vers l'intérieur (CAVI) est une composante essentielle du bioconfinement dans les zones de confinement où il est exigé (matrice 3.5 de la NCB). L'attention portée à la conception et à l'utilisation d'un sas à la barrière de confinement est la meilleure façon de protéger les différences de pressions négatives à l'origine du courant d'air vers l'intérieur (CAVI) et ainsi protéger l'intégrité de la barrière de confinement. On entend par porte critique, toute porte située à la barrière de confinement d'une zone de confinement, d'un box ou d'une salle de nécropsie où un courant d'air vers l'intérieur (CAVI) est maintenu. Afin de maintenir le bioconfinement et de prévenir l'inversion du courant d'air vers l'intérieur (CAVI) (c.-à-d. le déplacement de l'air de l'espace de travail « sale » vers les espaces « propres » ou à l'extérieur de la zone de confinement), il faut prévenir l'ouverture simultanée d'une porte critique et d'autres portes, en particulier de la porte menant au sas à partir de l'extérieur de la zone de confinement ou de la ou des portes menant du sas aux zones de travail (c.-à-d. aux espaces de travail en laboratoire, aux salles animalières, aux box, aux salles de nécropsie ou aux aires de production à grande échelle). Dans les zones GA de NC3 (c.-à-d. NC3-Ag) et les zones de NC4, des dispositifs d'interverrouillage mécaniques ou électroniques sont exigés afin d'empêcher l'ouverture simultanée des portes critiques et des autres portes du sas qui pourrait entraîner un bris de confinement (matrice 3.3 de la NCB). Dans les zones GA de NC2 (c.-à-d. NC2-Ag) et les zones de NC3, on peut avoir recours à des mesures administratives et opérationnelles (p. ex. procédures opératoires normalisées [PON] et affichage approprié) plutôt qu'aux dispositifs d'interverrouillage mécaniques ou électroniques afin de prévenir efficacement la libération de la contamination causée par l'ouverture simultanée de portes critiques et d'autres portes principales. Une zone de confinement peut disposer de plusieurs portes critiques selon sa conception.
La figure 3-8 illustre les différents espaces qui font partie d'un sas et qui permettent l'accès à un espace de travail en laboratoire de NC3 par un corridor d'accès général et trois portes. Les combinaisons de portes qui ne doivent pas être ouvertes simultanément afin de maintenir la barrière de confinement y sont également indiquées.
Figure 3-1 : Schéma représentant une installation à usage mixte qui comprend des zones de niveau de confinement 2 (NC2) et de niveau de confinement 3 (NC3)
Les traits rouges entourant les zones de NC2 et de NC3 démontrent le périmètre de chaque zone de confinement individuelle. L'ombrage gris indique les salles et les aires qui sont à l'extérieur des zones de confinement (p. ex. les aires publiques et administratives, les bureaux et les toilettes) pour lesquelles il n'y a aucune exigence physique.
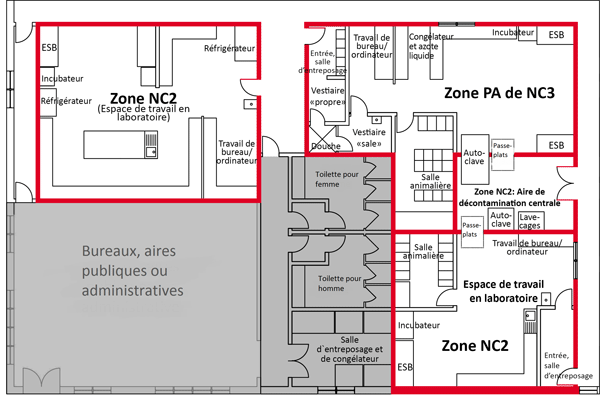
Équivalent textuel - Figure 3-1
Figure 3‑1 : Schéma représentant une installation à usage mixte qui comprend de multiples zones de niveau de confinement 2 (NC2) et de niveau de confinement 3 (NC3)
Un schéma représentant des zones de NC2 et de NC3 illustre un espace de travail en laboratoire de NC2 (partie supérieure gauche), une zone PA de NC2 (partie inférieure droite) et une zone PA de NC3 (partie supérieure droite). Des caractéristiques physiques de base communes à toutes les zones sont illustrées dans le schéma, à savoir : une porte qui sépare les aires publiques, les bureaux et les aires administratives (partie inférieure gauche) de la zone de confinement; des dispositifs de confinement primaire (p. ex. ESB) à distance des zones de grande circulation et des portes; et des lavabos pour le lavage des mains installés à proximité du point de sortie. Les autres caractéristiques illustrées dans les zones PA de NC2 et de NC3 sont les sas ou vestiaires aux points d’entrée et de sortie. Le sas dans la zone PA de NC3 est muni d’une installation de douche corporelle. Les salles animalières des zones PA, où les animaux sont hébergés dans des cages de confinement primaire, sont séparées de l’espace de travail en laboratoire par une porte. Les passe‑plats (optionnels) des zones de NC2 et de NC3 donnent accès à une zone de décontamination centralisée (partie centrale droite), qui est une zone de NC2 distincte. Les zones de confinement se partagent une aire de soutien commune pour les congélateurs et l’entreposage (partie centrale inférieure).
Le périmètre de chaque zone de confinement correspond à la paroi la plus externe ou à la porte. Des portes séparent les aires publiques, les bureaux et les aires administratives, qui se situent à l’extérieur de la zone de confinement et ne font l’objet d’aucune d’exigence physique en matière de confinement, de même que les corridors donnant accès aux zones de confinement.
Figure 3-2 : Schéma représentant une zone de niveau de confinement 4 (NC4) où l'on porte des combinaisons à pression positive
Le trait rouge entourant la zone de NC4 représente le périmètre de la zone de confinement. Les flèches qui traversent les portes et les sas indiquent la direction dans laquelle on circule pour entrer et sortir.

Équivalent textuel - Figure 3-2
Figure 3‑2 : Schéma représentant une zone de niveau de confinement 4 (NC4) où l’on porte des combinaisons à pression positive
Un schéma d’une zone de NC4 est illustré. La zone contient un espace de travail en laboratoire dans la partie supérieure de l’image, une salle animalière (zone PA) dans la partie inférieure droite et un box et une salle de nécropsie (zone GA) dans la partie inférieure gauche de l’espace de travail en laboratoire. Des sas à usage réservé pour l’entrée et la sortie du personnel sont situés à la gauche de l’espace de travail en laboratoire et à la gauche de la zone GA. Les deux sas sont munis d’un vestiaire « propre », d’une douche corporelle, d’un vestiaire « sale » et d’une douche chimique. La zone GA comporte également un sas distinct (partie inférieure du schéma) qui est destiné à l’entrée des animaux et de l’équipement dans la zone, ainsi qu’un sas distinct réservé pour l’entrée du personnel depuis l’espace de travail en laboratoire. Une zone fermée (stalle) dans la zone GA permet de séparer le personnel et les animaux, et la salle de nécropsie est directement accessible depuis la zone GA. Le périmètre de la zone de NC4 correspond à la paroi la plus externe ou à la porte, et les sas sont inclus dans la zone.
Figure 3-3 : Schéma représentant différentes configurations des zones de niveau de confinement 2 (NC2) dans un même espace physique
Les zones de confinement comprenant des espaces de travail en laboratoire et des zones de soutien figurent en orange; les barrières de confinement, quant à elles, sont illustrées à l'aide d'un trait hachuré noir. Les rectangles gris représentent des congélateurs réservés à l'entreposage d'agents pathogènes et de toxines. La configuration (a) illustre une aile ou une unité de NC2. La configuration (b) illustre le même endroit physique, mais chaque espace de travail forme une zone de NC2 distincte. Notez qu'une salle de culture cellulaire partagée est considérée comme un espace de travail en laboratoire (ETL).

Équivalent textuel - Figure 3-3a
Cette figure illustre une aile formée de salles distinctes (c.‑à‑d. espaces de travail en laboratoire, chambre froide, salle de culture cellulaire, salle d’autoclavage et bureau) accessibles depuis un corridor commun dans lequel sont installés des congélateurs. Dans la figure 3‑3(a), les portes du corridor limitent l’accès à l’ensemble de l’aile, de sorte que l’aile entière soit une zone de NC2. La figure 3‑3(b) illustre le même espace physique, mais sans portes pour limiter l’accès au corridor de l’aile. Dans cette configuration, chaque pièce (c.‑à‑d. espaces de travail en laboratoire, chambre froide, salle de culture cellulaire et salle d’autoclavage) est considérée comme une zone de NC2 distincte, et le corridor et le bureau se situent à l’extérieur de la zone de NC2.

Équivalent textuel - Figure 3-3b
Cette figure illustre une aile formée de salles distinctes (c.‑à‑d. espaces de travail en laboratoire, chambre froide, salle de culture cellulaire, salle d’autoclavage et bureau) accessibles depuis un corridor commun dans lequel sont installés des congélateurs. Dans la figure 3‑3(a), les portes du corridor limitent l’accès à l’ensemble de l’aile, de sorte que l’aile entière soit une zone de NC2. La figure 3‑3(b) illustre le même espace physique, mais sans portes pour limiter l’accès au corridor de l’aile. Dans cette configuration, chaque pièce (c.‑à‑d. espaces de travail en laboratoire, chambre froide, salle de culture cellulaire et salle d’autoclavage) est considérée comme une zone de NC2 distincte, et le corridor et le bureau se situent à l’extérieur de la zone de NC2.
Figure 3-4 : Avertissement de danger biologique représentatif
Exemple d'un avertissement de danger biologique à afficher aux points d'entrée d'une zone de confinement. L'avertissement de danger biologique doit comprendre le symbole international de danger biologique et indiquer le niveau de confinement, le nom et les numéros de téléphone d'une personne-ressource, ainsi que les conditions d'entrée (matrice 3.3 de la NCB). L'affiche peut préciser d'autres exigences relatives à l'entrée, une liste des procédés pertinents et des dispositifs de confinement primaire utilisés dans les aires de production à grande échelle, ou des renseignements sur d'autres dangers (p. ex. produit chimique, radioactivité) présents dans la zone de confinement.

Équivalent textuel - Figure 3-4
Figure 3‑4 : Avertissement de danger biologique représentatif
Cette figure est un exemple d’avertissement de danger biologique. Ce panneau d’avertissement, qui porte le symbole international de danger biologique, indique le niveau de confinement, le nom et les numéros de téléphone d’une personne‑ressource, ainsi que les conditions d’entrée (matrice 3.3 de la NCB). Le panneau peut préciser d’autres exigences relatives à l’entrée, une liste des procédés pertinents et des dispositifs de confinement primaire utilisés dans les aires de production à grande échelle, ou des renseignements sur d’autres dangers (p. ex. produit chimique ou radioactif) présents dans la zone de confinement.
Figure 3-5 : Schéma représentant l'emplacement des bureaux par rapport à la zone de niveau de confinement 2 (NC2) adjacente
La configuration a) illustre une zone de NC2 qui englobe l'aire de travail en laboratoire et le bureau. La configuration b) représente le même espace physique, mais le bureau est exclu de la zone de confinement. Cette configuration nécessite des mesures additionnelles, comme maintenir la porte du bureau fermée et respecter les protocoles appropriés relatifs à l'EPI pour l'entrée et la sortie du bureau pour être conforme aux exigences de la NCB.

Équivalent textuel - Figure 3-5a
Figure 3‑5 : Schéma représentant l’emplacement des bureaux par rapport à la zone de niveau de confinement 2 (NC2) adjacente
Cette figure illustre la même zone de confinement de NC2 dans laquelle un bureau n’est accessible que depuis l’espace de travail en laboratoire. La configuration a) illustre une zone de NC2 qui englobe l’espace de travail en laboratoire et le bureau. La configuration b) représente le même espace physique, à la différence que le bureau est exclu de la zone de confinement. Cette configuration nécessite des mesures additionnelles, comme l’affichage d’un panneau d’avertissement de danger biologique, le maintien de la porte du bureau fermée et le respect des protocoles appropriés relatifs à l’EPI pour l’entrée et la sortie du bureau, pour être conforme aux exigences de la NCB.

Équivalent textuel - Figure 3-5b
Figure 3‑5 : Schéma représentant l’emplacement des bureaux par rapport à la zone de niveau de confinement 2 (NC2) adjacente
Cette figure illustre la même zone de confinement de NC2 dans laquelle un bureau n’est accessible que depuis l’espace de travail en laboratoire. La configuration a) illustre une zone de NC2 qui englobe l’espace de travail en laboratoire et le bureau. La configuration b) représente le même espace physique, à la différence que le bureau est exclu de la zone de confinement. Cette configuration nécessite des mesures additionnelles, comme l’affichage d’un panneau d’avertissement de danger biologique, le maintien de la porte du bureau fermée et le respect des protocoles appropriés relatifs à l’EPI pour l’entrée et la sortie du bureau, pour être conforme aux exigences de la NCB.
Figure 3-6 : Schéma représentant la barrière de confinement et le périmètre d'une zone de confinement de petits animaux (zone PA) de niveau de confinement 3 (NC3)
La barrière de confinement est indiquée par un trait hachuré noir et le périmètre de la zone de confinement par un trait rouge.

Équivalent textuel - Figure 3-6
Figure 3‑6 : Schéma représentant la barrière de confinement et le périmètre d’une zone de confinement de petits animaux (zone PA) de niveau de confinement 3 (NC3)
Cette figure illustre une zone PA de NC3. La zone est accessible par un sas situé dans la partie supérieure gauche, qui comprend une aire d’entreposage, un vestiaire « propre », une installation de douche corporelle et un vestiaire « sale ». L’espace de travail en laboratoire, accessible depuis le sas, comprend une aire d’entreposage au froid où se trouvent des congélateurs et de l’azote liquide, une aire réservée pour le travail administratif et le travail à l’ordinateur, des ESB, ainsi qu’un autoclave à deux portes et un passe‑plat qui traversent la barrière de confinement. La salle animalière dans la partie inférieure gauche est accessible depuis l’espace de travail en laboratoire. Le périmètre de la zone de confinement correspond à la paroi la plus externe de la zone et il inclut le sas. La barrière de confinement correspond au périmètre de la zone de confinement, sauf dans le cas du sas, où elle correspond à la paroi interne (du côté de la zone de confinement) du vestiaire « propre » et de l’aire d’entreposage, et de la porte de douche donnant accès au vestiaire « propre ».
Figure 3-7 : Schéma représentant une zone de confinement de gros animaux (zone GA) de niveau de confinement 3 (NC3) qui comprend de multiples barrières de confinement
La barrière de confinement de la zone de confinement est indiquée par un trait hachuré noir. La barrière de confinement intérieur (box) est indiquée par un trait pointillé bleu et le périmètre de la zone de confinement par un trait rouge.
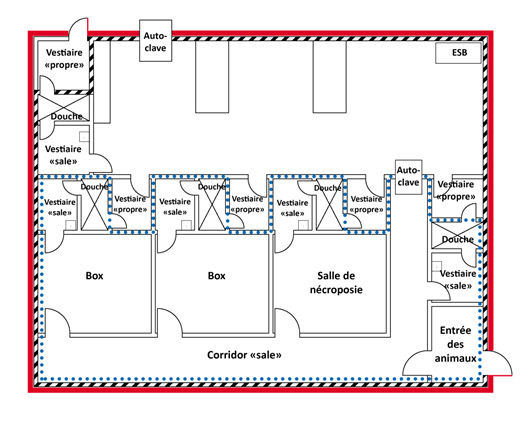
Équivalent textuel - Figure 3-7
Figure 3‑7 : Schéma représentant une zone de confinement de gros animaux (zone GA) de niveau de confinement 3 (NC3) qui comprend de multiples barrières de confinement
La figure montre une zone GA de NC3 comprenant un espace de travail en laboratoire (partie supérieure), deux box (partie inférieure gauche) et une salle de nécropsie (partie centrale inférieure). La zone de confinement est accessible par un sas situé dans la partie supérieure gauche; celui‑ci est muni d’un vestiaire « propre », d’une installation de douche corporelle et d’un vestiaire « sale », et il mène à l’espace de travail en laboratoire. Les deux box et la salle de nécropsie sont accessibles depuis l’espace de travail en laboratoire par leurs sas respectifs, qui sont chacun munis d’un vestiaire « propre », d’une installation de douche corporelle et d’un vestiaire « sale ». Les box et la salle de nécropsie sont aussi accessibles par le corridor « sale » (partie inférieure), qui est séparé de l’espace de travail en laboratoire par un autre sas. Le coin inférieur droit comporte aussi un sas servant à faire entrer les animaux de l’extérieur dans le corridor « sale ». Le périmètre de la zone de confinement correspond à la paroi la plus externe de l’ensemble de la zone, qui inclut les sas donnant accès à la zone. La barrière de confinement de la zone de confinement correspond au périmètre, sauf dans le cas du sas, où elle correspond à la paroi interne (du côté de la zone de confinement) du vestiaire « propre » et de l’aire d’entreposage, et de la porte de douche donnant accès au vestiaire « propre ». Une autre barrière de confinement (interne) entoure le corridor « sale », la paroi externe du sas d’entrée des animaux, les box et la salle de nécropsie, ainsi que les sas des espaces de travail avec les animaux, sauf dans les cas où le sas correspond à la paroi interne (côté des box, de la salle de nécropsie ou du corridor « sale ») du vestiaire « propre » et de la porte de douche donnant accès au vestiaire « propre ».
Figure 3-8 : Schéma représentant les différents espaces du sas dans une zone de niveau de confinement 3 (NC3) avec la porte critique indiquée
La barrière de confinement est indiquée par le trait hachuré noir. La porte A mène au vestiaire « propre » du sas à partir de l'extérieur de la zone de confinement. La porte B, indiquée en jaune, correspond à la porte critique qui sépare le vestiaire « propre » du vestiaire « sale ». Le « X » indique l'emplacement d'une douche dans le vestiaire « sale ». La porte C mène à l'espace de travail de NC3 (c.-à-d. l'espace de travail en laboratoire, la salle animalière, le box, la salle de nécropsie ou l'aire de production à grande échelle). Pour limiter la migration éventuelle de l'air du vestiaire « sale » vers le vestiaire « propre » ou l'extérieur de la zone de confinement dans le corridor d'accès, la porte critique « B » et la porte « A » doivent être munies d'un dispositif d'interverrouillage ou une autre mesure doit empêcher leur ouverture simultanée(c.-à-d. « A+B » ou « B+A »). Pour limiter la migration de l'air de l'espace de travail en laboratoire de NC3 par le vestiaire « sale » en direction du vestiaire « propre », la porte critique « B » et la porte « C » doivent être munies d'un dispositif d'interverrouillage ou une autre mesure doit empêcher leur ouverture simultanée (c.-à-d. « B+C » ou « C+B »).

Équivalent textuel - Figure 3-8
Figure 3‑8 : Schéma représentant les différents espaces du sas dans une zone de niveau de confinement 3 (NC3) avec la porte critique indiquée
L’image, qui montre un sas comprenant un vestiaire « propre », une installation de douche corporelle, un vestiaire « sale » et un espace de travail de NC3, indique où se trouve la porte critique de la barrière de confinement de même que les combinaisons de portes qui doivent être munies d’un dispositif d’interverrouillage.
La porte « A » dans la partie gauche de l’image donne accès au vestiaire « propre » du sas depuis l’extérieur de la zone de confinement. La porte « B », qui s’ouvre à partir du vestiaire « propre » et donne accès à l’installation de douche corporelle, est la porte critique qui sépare les vestiaires « propre » et « sale ». La porte « C » dans la partie droite donne accès à l’espace de travail de NC3 (c.‑à‑d. un espace de travail en laboratoire, une salle animalière, un box, une salle de nécropsie ou une zone de production à grande échelle). Pour limiter la migration éventuelle de l’air du vestiaire « sale » vers le vestiaire « propre » ou l’extérieur de la zone de confinement, la porte critique « B » et la porte « A » doivent être munies d’un dispositif d’interverrouillage ou une autre mesure doit empêcher leur ouverture simultanée (c.‑à‑d. « A+B » ou « B+A »). Pour limiter la migration de l’air de l’espace de travail en laboratoire de NC3 par le vestiaire « sale » en direction du vestiaire « propre », la porte critique « B » et la porte « C » doivent être munies d’un dispositif d’interverrouillage ou une autre mesure doit empêcher leur ouverture simultanée (c.‑à‑d. « B+C » ou « C+B »).
Références
- Note de bas de page 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 2
- Conseil canadien de protection des animaux. (2003). Lignes directrices sur : les animaleries - les caractéristiques, la conception et le développement, Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 3
- Subhash, S. S., Baracco, G., Fennelly, K. P., Hodgson, M. et Radonovich, L. J. Jr. (2013). Isolation anterooms: Important components of airborne infection control. American Journal of Infection Control . 41:452-455.
Chapitre 4 - Facteurs de risque, groupes de risque et évaluations des risques
Le terme « risque » est une fonction de l'éventualité qu'un événement indésirable survienne et les conséquences de cet événement. Pour assurer la sécurité de la communauté, il est primordial de réduire les risques par divers moyens tels que des mesures administratives, des mesures d'ingénierie, des pratiques et des procédures. Des évaluations des risques sont effectuées à l'égard d'un grand nombre d'éléments du programme de biosécurité, notamment la sécurité du personnel, de la communauté et de l'environnement, les exigences en matière de biosûreté, les besoins en matière de formation et la conformité réglementaire. Le présent chapitre aborde les évaluations locales des risques (ELR) et les évaluations des risques associés à l'agent pathogène ou la toxine; l'évaluation globale des risques et l'évaluation des risques liés à la biosûreté sont abordées aux chapitres 5 et 6, respectivement. Les exigences particulières aux évaluations des risques réalisées dans des installations réglementées par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA) sont énoncées à la matrice 4.1 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1.
4.1 Évaluations des risques associés aux agents pathogènes et groupes de risque
L'ASPC et l'ACIA réalisent des évaluations des risques associés aux agents pathogènes et aux toxines afin de déterminer le groupe de risque d'un agent pathogène ou d'une toxine, qui servira ensuite à déterminer le niveau de confinement approprié pour assurer que le travail en laboratoire et les autres activités comportant l'agent pathogène ou la toxine sont sécuritaires. Les évaluations des risques associés aux agents pathogènes très bien caractérisés permettent à l'ASPC d'élaborer des documents techniques, les Fiches techniques santé-sécurité : agents pathogènes (FTSSP), lesquelles sont mises à la disposition des parties réglementées et intéressées. L'ACIA a élaboré des fiches techniques sur les maladies à déclaration obligatoire au Canada qui touchent les animaux terrestres. On peut obtenir ces fiches sur le site Web de l'ACIA. Les parties réglementées sont encouragées à réaliser des évaluations des risques associés à l'agent pathogène ou la toxine, particulièrement sur des agents non caractérisés ou modifiés. L'ASPC et l'ACIA peuvent, au besoin, venir en aide aux personnes qui procèdent aux évaluations des risques associés aux agents pathogènes et aux toxines.
4.1.1 Réalisation des évaluations des risques associés à l'agent pathogène ou la toxine
Les évaluations des risques associés à l'agent pathogène ou la toxine sont basées sur trois éléments clés : les données scientifiques, les politiques et les jugements d'experts. Ce type d'évaluations comporte un aspect qualitatif, donc une approche cohérente devrait être utilisée pour déterminer les groupes de risque, et les incertitudes et les hypothèses devraient être clairement consignées. Afin de traiter suffisamment de tous les éléments, des personnes dont le niveau d'expertise et les responsabilités diffèrent (p. ex. directeur de l'installation, chercheur principal, microbiologiste en chef, agent de la sécurité biologique [ASB], et membres du comité institutionnel de biosécurité [CIB]) devraient faire partie du processus d'évaluation des risques associés à l'agent pathogène ou la toxine, lequel devrait aussi être revu régulièrement et révisé au besoin afin de prendre en considération les derniers renseignements pertinents.
L'évaluation des risques associés à l'agent pathogène caractérise les risques liés à cet agent en se fondant sur un examen approfondi de ses caractéristiques inhérentes qui contribuent au risque qu'il pose pour les humains et les différentes espèces animales, soit les facteurs de risque suivants (les facteurs de risque pour l'évaluation des risques associés aux toxines sont discutés dans la section 4.3.1) :
- Pathogénicité et virulence : L'agent pathogène peut-il provoquer une infection ou une maladie chez l'humain ou l'animal (pathogénicité)? Quelle est la sévérité de la maladie chez la personne infectée ou dans différentes espèces animales (c.-à-d. la virulence, la gravité de la maladie)?
- Voie d'infection : De quelle façon l'agent pathogène pénètre-t-il dans l'hôte (p. ex. ingestion, inhalation, inoculation, contact avec la peau ou les muqueuses, ou voie génito-urinaire)?
- Mode de transmission : De quelle façon l'agent pathogène atteint-il l'hôte? Se transmet-il par contact direct (p. ex. contact intime, simple contact) ou par contact indirect (p. ex. vecteurs passifs, microgouttelettes aérosolisées ou transmises dans l'air)? Peut-il être transmis par des vecteurs ou par des animaux infectés (zoonoses)?
- Survie dans l'environnement : Quel est le degré de stabilité de l'agent pathogène à l'extérieur de l'hôte? Dans quelles conditions environnementales peut-il survivre et pendant combien de temps?
- Dose infectieuse : Quelle quantité de l'agent pathogène est requise pour causer une infection chez l'hôte (mesurée en nombre de microorganismes)?
- Accès à des traitements prophylactiques et thérapeutiques efficaces : Dispose-t-on de mesures de prévention efficaces (p. ex. vaccins)? Dispose-t-on de traitements efficaces (p. ex. antibiotiques, antiviraux)?
- Gamme d'hôtes : Quels sont les hôtes primaires, intermédiaires et finaux? L'agent pathogène cause-t-il une infection chez un vaste éventail d'espèces, ou la gamme d'hôtes est-elle restreinte?
- Aire de répartition naturelle : L'agent pathogène est-il présent au Canada ou est-il allogène (c.-à-d. non indigène)? Est-il prévalent dans un endroit, une région, une population humaine ou une population animale en particulier?
- Effets de l'introduction ou de la libération dans l'environnement ou dans la population canadienne : Si l'agent pathogène était introduit dans la population humaine ou animale, ou libéré dans l'environnement (au Canada), quelles seraient les conséquences économique et clinique, et sur les plans de la biosûreté?
Dans la plupart des cas, les matières infectieuses pourront être classées d'emblée dans l'un des quatre groupes de risque définis ci-dessous, mais il arrive que le niveau de risque associé aux différents facteurs précités varie considérablement lors d'une évaluation des risques. Certains facteurs de risque peuvent donc être prépondérants dans la détermination du groupe de risque final. Par exemple, s'il est peu probable qu'un agent pathogène cause une maladie chez les humains ou les animaux, le fait que cet agent puisse survivre dans l'environnement pendant une longue période ou qu'on ne dispose d'aucun traitement peut être sans importance.
4.1.2 Groupes de risque
Il est très difficile de dresser une liste complète des agents pathogènes humains et des agents zoopathogènes en raison de l'émergence de nouveaux agents pathogènes et des recherches continues sur les caractéristiques des agents pathogènes existants. Les annexes 2 à 4 de la Loi sur les agents pathogènes humains et les toxines (LAPHT) fournissent des exemples d'agents pathogènes humains pour chaque groupe de risque, parmi lesquels se trouvent des agents pathogènes zoonotiquesNote de bas de page 2. L'annexe 5 contient une liste exhaustive des agents pathogènes humains interdits au Canada. Des exemples d'agents pathogènes d'animaux terrestres se trouvent sur le site Web de l'ACIA. Les définitions qui suivent décrivent les groupes de risque dans lesquels on classe les agents pathogènes humains et les agents zoopathogènes en fonction du risque qu'ils posent pour une personne ou un animal et du risque qu'ils posent pour la santé de la communauté.
4.1.2.1 Groupe de risque 1 (GR1; risque faible pour la personne; faible pour la communauté)
Le groupe de risque 1 englobe les microorganismes, les acides nucléiques et les protéines a) qui n'ont pas la capacité de causer une maladie chez l'humain ou l'animal, ou b) qui ont la capacité de causer une maladie chez l'humain ou l'animal, mais sont peu susceptibles de le faire. Les matières ayant la capacité de causer une maladie sont considérées comme des agents pathogènes qui présentent un risque faible pour la santé des personnes ou des animaux, et un risque faible pour la santé publique et la population animale. Les agents pathogènes du GR1 peuvent être des agents pathogènes opportunistes et menacer la santé de sujets immunodéprimés. En raison du risque faible qu'ils présentent pour la santé publique et la population animale, il n'y a pas d'exigences physiques ou opérationnelles qui s'appliquent à ces agents. Toutefois, la prudence reste de mise, et des pratiques de travail sécuritaires (p. ex. bonnes pratiques microbiologiques) devraient être adoptées lors de la manipulation de ces matières.
4.1.2.2 Groupe de risque 2 (GR2; risque modéré pour la personne; faible pour la communauté)
Le groupe de risque 2 englobe les agents pathogènes présentant un risque modéré pour la santé des personnes ou des animaux, et un risque faible pour la santé publique et la population animale. Ces agents pathogènes ont la capacité, mais sont peu susceptibles, de causer, chez l'humain ou l'animal, des maladies graves. On dispose de mesures prophylactiques et de traitements efficaces contre ces agents, et leur risque de propagation est faible. L'annexe 2 de la LAPHT fournit des exemples d'agents pathogènes humains du GR2.
4.1.2.3 Groupe de risque 3 (GR3; risque élevé pour la personne; faible pour la communauté)
Le groupe de risque 3 englobe les agents pathogènes présentant un risque élevé pour la santé des personnes ou des animaux, et un risque faible pour la santé publique. Ces agents pathogènes ont la capacité de causer, chez l'humain ou l'animal, des maladies graves. On dispose habituellement de mesures prophylactiques et de traitements efficaces contre ces agents, et leur risque de propagation dans la communauté est faible. Le risque de propagation dans la population animale, quant à lui, varie de faible à élevé en fonction de la nature de l'agent pathogène. L'annexe 3 de la LAPHT fournit des exemples d'agents pathogènes humains du GR3.
4.1.2.4 Groupe de risque 4 (GR4; risque élevé pour la personne; élevé pour la communauté)
Le groupe de risque 4 englobe les agents pathogènes présentant un risque élevé pour la santé des personnes ou des animaux, et un risque élevé pour la santé publique. Les agents pathogènes de ce groupe de risque ont la capacité de causer des maladies graves chez l'humain ou l'animal et, dans bien des cas, d'entraîner la mort. On ne dispose habituellement pas de mesures prophylactiques ni de traitements efficaces contre ces maladies dont le risque de propagation dans la communauté est élevé. Le risque de propagation de la maladie chez la population animale, quant à lui, varie de faible à élevé en fonction de la nature de l'agent pathogène. L'annexe 4 de la LAPHT fournit des exemples d'agents pathogènes humains du GR4.
4.2 Évaluations des niveaux de confinement
Une fois qu'on a déterminé le groupe de risque à l'aide d'une évaluation des risques associés à l'agent pathogène ou la toxine, il existe plusieurs facteurs clés pour déterminer le niveau de confinement approprié dans lequel on peut manipuler de façon sécuritaire l'agent pathogène ou la toxine identifié. Les agents pathogènes bien caractérisés pour lesquels l'ASPC ou l'ACIA a réalisé une évaluation des risques associés à l'agent pathogène ou la toxine se sont vu assigner un groupe de risque et un niveau de confinement appropriés. Le chapitre 3 décrit les différents niveaux de confinement; les exigences propres aux installations réglementées par l'ASPC et l'ACIA, du niveau de confinement 2 (NC2) au NC4, sont énoncées dans la NCB. Le niveau de confinement correspond normalement au groupe de risque de l'agent pathogène (p. ex. les agents pathogènes du GR2 sont manipulés dans des installations de NC2); cependant, il y a quelques exceptions. En effet, si l'agent pathogène a été modifié, les exigences en matière de confinement peuvent devoir être révisées en conséquence. La modification du niveau de confinement fait écho aux stratégies d'atténuation des risques mises en œuvre pour répondre à la modification de l'agent pathogène ou aux conditions d'utilisation.
Toute modification ou ajout aux activités réglementées spécifiées sur un permis délivré en vertu du Règlement sur les agents pathogènes humains et les toxines (RAPHT) nécessite la présentation d'un amendement à l'ASPC avant d'effectuer le changementNote de bas de page 3. Aussi, toute modification aux conditions d'utilisation spécifiées sur le permis d'importation d'agents zoopathogènes nécessite l'autorisation préalable de l'organisme qui a délivré le permis (c.-à-d. l'ACIA ou l'ASPC). Consultez le chapitre 23 pour plus d'information sur les permis et les permis d'importation d'agents zoopathogènes.
Les facteurs suivants sont pris en considération lors de l'évaluation du niveau de confinement (c.-à-d. la détermination des exigences physiques en matière de confinement, des exigences opérationnelles, et des exigences relatives aux essais de vérification et de performance) exigé pour un agent pathogène :
- Production d'aérosols : Utilise-t-on de l'équipement ou des procédés pouvant produire des aérosols (p. ex. pipetage, centrifugation, homogénéisation)? Le personnel peut être exposé à des aérosols infectieux ou à des toxines aérosolisées par inhalation de gouttelettes aérosolisées ou par ingestion de gouttelettes qui se déposent sur les surfaces ou les mains.
- Quantité : Dans quelle quantité l'agent pathogène est-il manipulé? Comment cette quantité est-elle répartie (p. ex. un gros contenant, plusieurs petits contenants)? Les procédés de production à grande échelle (p. ex. fermentation industrielle, production de vaccins) et le travail de laboratoire peuvent ne pas être soumis aux mêmes exigences en matière de confinement, même s'ils comportent le même agent pathogène.
- Concentration de l'agent pathogène : La concentration de l'agent pathogène peut varier selon le travail effectué (p. ex. la concentration de l'agent pathogène dans les échantillons diagnostiques peut être plus faible que celle dans les cultures pures).
- Type de travail proposé : Quelle est la nature du travail (p. ex. activités de diagnostic, recherche scientifique, in vitro, in vivo, à grande échelle)? Par exemple, dans le cas du travail in vivo, le type d'animal et les risques inhérents associés à cet animal ont besoin d'être pris en compte au moment de déterminer le niveau de confinement approprié.
- Excrétion (propre aux animaux) : L'excrétion d'agents pathogènes devrait être prise en compte lorsqu'on travaille avec des animaux infectés. Des agents pathogènes peuvent être présents dans la salive, l'urine ou les fèces et peuvent être exhalés par les animaux. En raison de la nature des agents pathogènes zoonotiques, des précautions supplémentaires peuvent être nécessaires lors de la manipulation d'animaux infectés ou pouvant l'être.
Certains facteurs pris en considération pour déterminer le groupe de risque peuvent aussi être examinés lors de l'évaluation du niveau de confinement. Par exemple, si la dose infectieuse d'un agent pathogène est très élevée, sa concentration peut être moins déterminante. Néanmoins, le facteur « production d'aérosols » prend de l'ampleur dans l'évaluation du niveau de risque des agents pathogènes transmis par inhalation.
4.3 Éléments spéciaux à prendre en compte
L'évaluation des risques ne permet pas toujours de déterminer parfaitement le groupe de risque ou le niveau de confinement des matières biologiques, par exemple dans le cas où les matières biologiques (p. ex. tissus, échantillons primaires) sont susceptibles d'être porteuses d'agents pathogènes, de toxines, de prions, ou d'agents pathogènes modifiés ou de synthèses. Il importe de rappeler que la réalisation d'une ELR est cruciale pour déterminer les précautions appropriées à la manipulation de matières infectieuses dans une zone de confinement donnée. L'évaluation des risques associés aux activités comportant la manipulation des matières mentionnées ci-dessus devrait tenir compte de certains facteurs, lesquels sont énumérés ci-dessous.
4.3.1 Toxines
Les toxines microbiennes ne sont pas considérées comme des matières infectieuses et ne peuvent pas être classées comme des substances chimiques toxiques classiques. Par conséquent, il faut tenir compte de facteurs particuliers au moment d'évaluer les risques associés à ce type de matière. Comparativement aux autres agents pathogènes microbiens, il est relativement facile de limiter la dissémination des toxines. Les toxines ne sont ni réplicatives ni transmissibles d'un hôte à l'autre. Lorsqu'on manipule des toxines, les voies de transmission les plus probables sont l'inoculation accidentelle ou l'exposition des muqueuses aux aérosols. On court des risques supplémentaires liés notamment à la présence d'électricité statique lors de la manipulation de toxines séchées (lyophilisées) et, pour certaines toxines, au fait qu'une dose minime puisse être létale.
Un nombre limité de toxines microbiennes, qu'elles soient dérivées naturellement d'un microorganisme ou produites par synthèse, sont réglementées par l'ASPC et l'ACIA en vertu de la LAPHT, du RAPHT, de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA)Note de bas de page 4Note de bas de page 5. Une liste exhaustive des toxines réglementées par l'ASPC en vertu de la LAPHT se trouve aux annexes 1 et 5 de la LAPHT. L'importation des toxines microbiennes dérivées d'agents zoopathogènes est réglementée en vertu du RSA; l'importation des toxines dérivées d'agents zoopathogènes non indigènes est uniquement réglementée par l'ACIA.
Certaines toxines, lorsqu'elles sont présentes en quantité supérieure à la quantité seuil (voir le tableau 4-1), sont identifiées dans le RAPHT comme « toxines précisées », en raison de la possibilité de double usage qu'elles présentent [RAPHT 10(2)]. Parce qu'elles font l'objet d'éléments additionnels à prendre en compte en matière de biosûreté, les « toxines précisées » du RAPHT sont aussi qualifiées d'agents biologiques à cote de sécurité élevée (ABCSE). Si dans une partie d'une installation, une toxine est présente en quantité supérieure à la quantité seuil, elle est considérée comme un ABCSE et des mesures de sécurité renforcées sont exigées (p. ex. Habilitations de sécurité en vertu de la LAPHT). Une toxine présente en quantité égale ou inférieure à la quantité seuil n'est pas considérée comme un ABCSE; toutefois, il s'agit tout de même d'une toxine et elle est par conséquent assujettie à la NCB (c.-à-d. que le niveau de confinement minimum pour manipuler une toxine réglementée est le NC2). Les ABCSE sont abordés plus en détail à la section 4.3.3 et au chapitre 6.
| Toxine | Quantité seuil |
|---|---|
| Entérotoxine de staphylocoques de type B | 1 mg |
| Entérotoxine de staphylocoques, excepté le type B | 10 mg |
| Hémolysine | 10 mg |
| Shigatoxine | 1 mg |
| Toxine alpha | 5 mg |
| Toxine botulique | 0,5 mg |
| Toxine du choléra | 20 mg |
| Toxine du syndrome de choc toxique : Staphylococcus aureus | 5 mg |
| Toxine Epsilon de Clostridium perfringens | 5 mg |
| Toxine Shiga-like (vérotoxine) | 1 mg |
| Toxines C2 et C3 de Clostridium botulinum | 5 mg |
Les principes de sécurité chimique et de biosécurité s'appliquent pendant la manipulation de toxines biologiques pouvant causer des maladies chez l'humain ou les animaux. En général, ces toxines sont manipulées en toute sécurité dans le NC2. Par conséquent, le NC2 est le niveau de confinement minimum pour les installations, telles qu'un laboratoire de biochimie, où seulement des activités avec des toxines réglementées purifiées ou synthétisées chimiquement sont réalisées, et ce en absence du microorganisme parental ou de tout autre agent pathogène.
4.3.1.1 Évaluations des risques liés aux toxines : facteurs de risque
Dans les cas où sont manipulées des toxines dérivées de microorganismes, une évaluation des risques détaillée devrait comprendre les éléments suivants :
- une évaluation de l'exposition afin de relever les risques inhérents au procédé utilisé (p. ex. risque d'inoculation, production d'aérosols, accumulation d'électricité statique lors de la manipulation de toxines en poudre);
- les voies d'exposition (c.-à-d. ingestion, inhalation, absorption [cutanée ou oculaire] ou inoculation);
- la concentration et la quantité de la toxine manipulée, ainsi que les unités d'activité;
- les indicateurs de toxicité :
- DL50 (dose létale médiane, soit la quantité de toxine entraînant la mort de 50 % d'un groupe expérimental);
- DE50 (dose efficace médiane, soit la quantité de toxine qui aura un effet particulier chez 50 % d'un groupe expérimental);
- la rapidité d'action (c.-à-d. le délai entre l'exposition et l'expression des premiers effets) :
- les effets de la plupart des neurotoxines sont généralement observés dans les minutes ou les heures qui suivent l'expositionNote de bas de page 6;
- les effets de la plupart des cytotoxines sont généralement observés dans les heures ou les jours qui suivent l'expositionNote de bas de page 6;
- la gravité et la durée des maladies potentielles (effets aigus versus effets chroniques);
- la disponibilité de vaccins ou d'antitoxines;
- l'utilisation de pratiques de sécurité chimique adaptées aux techniques employées (p. ex. solvants, acides);
- l'utilisation d'une « toxine précisée », comme mentionné à l'article 10(2) du RAPHT, et sa quantité seuil (voir le tableau 4-1).
4.3.2 Prions
Les principales voies d'exposition des prions sont l'ingestion et l'inoculation (semblables à celles des agents pathogènes du GR2). Réaliser des évaluations des risques associés aux prions est difficile en raison de la longue période d'incubation (jusqu'à 30 ans) qui précède l'apparition des premiers symptômes chez les hôtes humains et les animauxNote de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12. Les principales voies de transmission des prions consignées sont l'ingestion et l'inoculation; cependant, il y a des preuves limitées indiquant la possibilité de transmission par des voies alternativesNote de bas de page 7Note de bas de page 13Note de bas de page 14Note de bas de page 15. Jusqu'à maintenant, il n'est survenu aucune infection contractée en laboratoire (ICL) résultant des activités impliquant les prionsNote de bas de page 16. Pour l'instant, on ne dispose d'aucun traitement ni vaccin contre les maladies d'encéphalopathie spongiforme transmissible (EST). Les structures protéiques des prions restent très stables, même dans des conditions extrêmes et il a été démontré que les prions demeurent infectieux même après avoir subi les traitements classiques visant l'inactivation d'autres agents pathogènes (c.-à-d. l'autoclavage)Note de bas de page 17Note de bas de page 18. Les activités comportant des prions peuvent habituellement être menées de façon sécuritaire au NC2 si elles satisfont aux exigences en matière de confinement physique et aux pratiques opérationnelles supplémentaires, lesquelles sont énoncées dans la NCB. Le chapitre 15 présente les recommandations et les points à examiner en ce qui a trait à la décontamination des prions.
4.3.3 Agents biologiques à cote de sécurité élevée (ABCSE)
Les ABCSE comprennent les agents pathogènes humains et les toxines qui présentent un risque accru en matière de biosûreté en raison de la possibilité de double usage qu'ils comportent. En effet, ils peuvent être manipulés dans le cadre d'activités scientifiques légitimes, mais la possibilité qu'ils soient utilisés pour créer une arme biologique accroît les risques en matière de biosûreté. Les agents pathogènes et les toxines qui sont dits « précisés » dans la LAPHT et le RAPHT sont en fait des ABCSE. Les agents pathogènes précisés sont tous les agents du GR3 et du GR4 qui se retrouvent sur la Liste des agents pathogènes humains et animaux et des toxines réglementés à l'exportation, publiée par le Groupe d'Australie et sujette aux modifications, à l'exception du virus Duvenhage, du virus rabique et de tous les autres du genre Lyssavirus, le virus de la stomatite vésiculaire ainsi que du virus de la chorioméningite lymphocytaireNote de bas de page 19. Les toxines précisées, quant à elles, sont toutes les toxines qui se trouvent à la fois à l'annexe 1 de la LAPHT et sur la Liste des agents pathogènes humains et animaux et des toxines réglementés à l'exportation, publiée par le Groupe d'Australie et sujette aux modifications, lorsque ces toxines sont présentes en quantités supérieures aux quantités seuils énoncées à l'article 10(2) du RAPHT dans une partie de l'établissement où des activités contrôlés avec des ABCSE sont autorisés. Par conséquent, les exigences en matière de biosûreté énoncées dans la NCB et applicables aux ABCSE sont accrues. Par souci de commodité, les toxines précisées et les quantités seuils sont résumées autableau 4-1 et l'ASPC offre sur son site Web une liste exhaustive et à jour des ABCSE (modifiée de temps à autre) où la quantité seuil est indiquée (http://phac-aspc.gc.ca/lab-bio/regul/ssba-abcse-fra.php). Les éléments de biosûreté supplémentaires, pour le travail avec les ABCSE, sont abordés au chapitre 6.
4.3.4 Agents zoopathogènes non indigènes
Les agents zoopathogènes non indigènes sont des agents pathogènes allogènes au Canada (c.-à-d. des agents zoopathogènes exotiques qu'on ne retrouve pas au Canada) qui figurent sur la liste intitulée Maladies, infections et infestations de la Liste de l'OIE (et ses modifications successives) établie par l'Organisation mondiale de la santé animale (OIE)Note de bas de page 20. Les agents pathogènes qui causent des maladies animales émergentes causent soit une nouvelle maladie infectieuse résultant de l'évolution ou de la modification d'un agent pathogène existant; soit une maladie infectieuse connue se propageant à une nouvelle zone géographique ou à une nouvelle population; soit une maladie ayant un effet important sur la santé animale diagnostiquée pour la toute première fois ou causée par un agent pathogène inconnu. Les agents zoopathogènes non indigènes et les agents pathogènes qui causent des maladies animales émergentes peuvent être importés au Canada uniquement en vertu d'un permis d'importation d'agents zoopathogènes délivré par l'ACIA.
Le niveau de confinement approprié ainsi que toute exigence supplémentaire pour travailler avec certains agents zoopathogènes (p. ex. agents zoopathogènes non indigènes et agents pathogènes qui causent des maladies animales émergentes) sont déterminés par l'ACIA à l'aide d'une évaluation des risques associés à l'agent pathogène et d'une évaluation du niveau de confinement. Lors de l'examen d'une demande de travail avec des agents pathogènes non indigènes, l'ACIA évalue les facteurs suivants :
- Le contrôle des maladies, et les répercussions possibles d'un bris de confinement sur la santé des animaux du pays (y compris le bétail et la volaille);
- La prise en compte des pratiques internationales.
La libération d'agents zoopathogènes non indigènes ou d'agents pathogènes qui causent des maladies animales émergentes dans l'environnement pourrait avoir des répercussions très néfastes sur la population animale canadienne; conséquemment, lors de la manipulation de ce type d'agents pathogènes, les exigences liées au confinement physique et aux pratiques opérationnelles sont plus rigoureuses que celles qui s'appliquent au NC3 (ou aux zones de confinement de gros animaux [zone GA] de NC3 [NC3-Ag]). Par exemple, selon la matrice 3.8 de la NCB, les zones de confinement où sont manipulés des agents zoopathogènes non indigènes doivent comprendre un système de décontamination des effluents, et ce, pour que les déchets liquides soient convenablement décontaminés avant d'être libérés à l'extérieur de la zone de confinement.
Les demandeurs de permis d'importation d'agents zoopathogènes non indigènes ou d'agents pathogènes qui causent des maladies animales émergentes feront l'objet d'une certification des installations par l'ACIA avant qu'un permis d'importation soit délivré. Les activités comportant la manipulation d'agents zoopathogènes non indigènes et d'agents pathogènes qui causent des maladies animales émergentes qui sont également des agents pathogènes zoonotiques (c.-à-d. qui peuvent causer des maladies chez l'humain et l'animal) requièrent également un permis délivré par l'ASPC en vertu de la LAPHT. La certification des installations par l'ACIA et la surveillance réglementaire pour l'importation des agents zoopathogènes sont abordées plus en profondeur au chapitre 23.
4.3.5 Parasites
Les parasites ont un grand nombre de modes de transmission, lesquels sont semblables à ceux des autres agents pathogènes humains et zoopathogènes. Pour déterminer le niveau de confinement approprié aux parasites, l'ELR devrait tenir compte du mode de transmission et des stades du cycle de vie de ces parasites, car ils ne sont pas infectieux ou pathogènes à tous les stades.
4.3.6 Travail à grande échelle
En général, selon l'ASPC et l'ACIA, les activités comportant des toxines ou la culture in vitro de matières infectieuses à un volume égal ou supérieur à 10 litres sont considérées comme du travail à grande échelle; ce volume peut être contenu dans un seul récipient ou, dans certains cas, dans plusieurs récipients dont le volume total atteint ou excède 10 litres. Les installations de production à grande échelle comme les usines spécialisées en fermentation industrielle et en production de vaccins présentent un risque accru pour le personnel et l'environnement en raison des grandes quantités de matières infectieuses ou de toxines manipulées. C'est pourquoi les exigences et les éléments à prendre en considération mentionnés dans la NCB pour le travail à grande échelle sont parfois plus stricts que ceux se rapportant aux espaces de travail en laboratoire où l'on manipule le même agent pathogène à des volumes d'échelle laboratoire au même niveau de confinement. La consultation de l'ASPC et de l'ACIA permettra de déterminer, au cas par cas, si les activités particulières menées à l'intérieur d'une zone de confinement sont considérées comme du travail à grande échelle ou non. Le cas échéant, ces activités doivent satisfaire aux exigences supplémentaires propres aux aires de production à grande échelle énoncées dans la NCB. Le chapitre 14 décrit les différents points à considérer pour le travail à grande échelle.
4.3.7 Travail avec des animaux
En raison du caractère imprévisible des animaux et de la possibilité qu'ils excrètent des agents pathogènes, les risques associés au travail comportant des agents pathogènes effectué sur des animaux vivants peuvent considérablement augmenter, et ce, peu importe la procédure utilisée. Le chapitre 13 décrit les éléments à prendre en considération propres au travail avec des animaux.
4.3.8 Biotechnologie
4.3.8.1 Modifications susceptibles d'augmenter les risques associés à un agent pathogène
Il est primordial que les chercheurs puissent cerner les risques inhérents à leurs activités afin de prendre les mesures appropriées pour les réduire. Même si le groupe de risque et le niveau de confinement ont été établis en fonction d'un agent pathogène précis, les modifications apportées à un agent et qui en accroissent le risque peuvent entraîner des changements par rapport à la NCB en ce qui a trait aux exigences liées au confinement physique et aux pratiques opérationnelles. Les modifications peuvent être intentionnelles (p. ex. utilisation des techniques de l'acide désoxyribonucléique [ADN] recombiné [ADNr]) ou accidentelles (p. ex. résultat de l'évolution d'un agent pathogène après son passage dans un modèle in vivo).
Il pourrait être acceptable de mener des expériences qui réduisent le niveau de risque lié à un agent pathogène (c.-à-d. il a été atténué) avec des exigences en matière de confinement physique et des pratiques opérationnelles réduites. Dans de telles circonstances, une évaluation des risques associés à l'agent pathogène est réalisée afin de lui assigner un groupe de risque et un niveau de confinement appropriés. Par exemple, il pourrait être déterminé par une évaluation des risques associés à l'agent pathogène qu'une souche atténuée d'un agent pathogène de GR3 rencontre le profil de risque d'un agent pathogène de GR2. Dans les installations visées par un permis où sont autorisées des activités contrôlées comportant des agents pathogènes humains et des toxines, le titulaire de permis et l'ASB doivent être informés là où le groupe de risque d'un agent pathogène ou d'une toxine est modifié. Ceci a pour but d'entamer une discussion sur la nouvelle catégorie de risques de la souche modifiée, et si nécessaire, de faire une demande de nouveau permis ou de modification d'un permis existant (LAPHT 12[2], RAPHT 9[1][c][ii]).
Les expériences qui augmentent le risque présenté par un agent pathogène peuvent avoir des conséquences sur le chercheur et la communauté. Par exemple, le fait de modifier un agent pathogène pour qu'il devienne transmissible dans l'air accroît les risques inhérents à certains procédés de laboratoire produisant des aérosols et les effets sur la santé publique et animale en cas de libération hors du laboratoire.
Conformément à l'article 5 du RAPHT, quiconque travaillant sous un permis autorisant des activités contrôlées avec des agents pathogènes humains et des toxines en vertu de la LAPHT et du RAPHT désirant augmenter la virulence ou la pathogénicité d'un agent pathogène humain, ou la toxicité d'une toxine, doit en aviser l'ASB et le titulaire de permis. Si telle modification change le groupe de risque de l'agent pathogènes ou de la toxine, l'ASPC doit être avisé (RAPHT 26). Cette information peut être fournie électroniquement à l'ASPC par l'intermédiaire du Portail de biosûreté, accessible à parti du site Web de l'ASPC (www.santepublique.gc.ca/pathogenes), par téléphone ou par télécopieur.
4.3.8.2 Organismes génétiquement modifiés
L'utilisation des techniques de l'ADNr pour créer des organismes génétiquement modifiés (OGM) peut contribuer à faire monter ou à abaisser le groupe de risque et le niveau de confinement de l'OGM par rapport à ceux de l'organisme parent. Ce changement s'effectue selon divers facteurs, tels que le ou les gènes transférés, la modification des gènes déjà présents dans l'organisme (p. ex. mutations ponctuelles, délétions), l'expression du ou des gènes dans l'organisme recombiné, le bioconfinement exigé pour manipuler l'organisme hôte, les interactions entre le ou les gènes transférés et les systèmes de vecteurs hôtes, et la viabilité des systèmes de vecteurs hôtes.
Une ELR est réalisée afin d'évaluer convenablement les exigences liées au confinement physique et aux pratiques opérationnelles nécessaires lors des manipulations génétiques qui présentent au moins une des caractéristiques suivantes :
- Elles modifient la pathogénicité ou la virulence d'agents pathogènes.
- Elles influent sur la réponse d'un agent pathogène à un agent pharmaceutique (p. ex. changement dans la résistance aux antibiotiques).
- Elles suppriment du matériel génétique ou introduisent du nouveau matériel génétique qui peut entraîner des effets indésirables (p. ex. l'insertion d'un oncogène).
- Elles provoquent la production de toxines par des microorganismes recombinés.
- Elles élargissent la gamme d'hôtes ou augmentent le tropisme cellulaire d'agents pathogènes.
- Elles créent de nouveaux mécanismes ou des traits indésirables chez des animaux transgéniques.
- Elles produisent des souches atténuées d'agents pathogènes recombinés qui ont perdu leurs facteurs de virulence.
- Elles produisent des systèmes de vecteurs hôtes d'origine bactérienne ou virale peu aptes à survivre en dehors de la zone de confinement.
Les facteurs à considérer lors de l'évaluation des risques associés aux OGM comprennent :
- le niveau de confinement de l'organisme receveur;
- le niveau de confinement de l'organisme donneur;
- la capacité de réplication de l'OGM;
- les caractéristiques (ou propriétés) du segment provenant de l'organisme donneur incorporé dans la particule recombinée;
- les facteurs pathogènes potentiels associés au segment de l'organisme donneur;
- les nouveaux dangers présentés par l'OGM, qui peuvent ne pas être bien caractérisés.
4.3.8.3 Vecteurs viraux
Il est possible d'évaluer les risques associés aux systèmes de vecteurs viraux en examinant les facteurs à considérer en matière d'OGM énumérés à la section 4.3.8.2, de même que le choix du système de vecteurs, les caractéristiques de sécurité intégrées dans le système et le type d'inserts transgéniques codés par le vecteur. Le recours à des systèmes de vecteurs rétroviraux, notamment des vecteurs lentiviraux dérivés du virus de l'immunodéficience humaine de type 1 (VIH-1), peut entraîner d'autres risques qui devraient également être évalués. Dans le but de diminuer le risque de production de rétrovirus capables de réplication (c.-à-d. un virus recombiné capable d'auto-réplication), la conception des systèmes de vecteurs lentiviraux récemment produits intègre des mesures de sécurité supplémentaires, y compris le remplacement des protéines d'enveloppe natives du VIH-1 par une enveloppe de protéines hétérologues, l'isolation des propriétés liées à la production de vecteurs et à l'encapsidation dans un minimum de quatre plasmides différents, le retrait des gènes essentiels à la réplication des gènes de type sauvage, et l'élaboration de vecteurs lentiviraux auto-inactivantsNote de bas de page 21.
Les principaux risques associés aux systèmes de vecteurs viraux sont les suivants :
- la possibilité de production et de propagation de rétrovirus capables de réplication (RCR);
- le potentiel oncogénétique;
- la possibilité d'accroissement de la pathogénicité;
- la possibilité de séroconversion (c.-à-d. indication de séropositivité pour le VIH résultant d'une exposition à un vecteur lentiviral), même en présence de virus qui ne se répliquent pas.
4.3.8.4 Dispositifs et systèmes issus de la biologie de synthèse
Les risques associés aux dispositifs et aux systèmes issus de la biologie de synthèse et de l'ADN synthétique (ADNs) sont semblables aux risques associés aux technologies des OGM et de l'ADNr. La principale différence réside dans le fait que la biologie de synthèse vise la conception et la création de fonctions et de systèmes biologiques nouveaux, qui n'existent pas dans la nature, ou la modification de fonctions et de systèmes existants, ce qui complique l'évaluation des risques que peuvent poser les produits qui en sont issus. En premier lieu, une évaluation des risques que présentent les organismes parents devrait être réalisée. En second lieu, une évaluation des propriétés et des incidences potentielles des différents éléments, systèmes ou organismes manipulés par les chercheurs (modifiés ou présents dans la nature) a besoin d'être réalisée, compte tenu du fait que les organismes, qu'ils soient pathogènes ou non, peuvent aussi bien comprendre des éléments pathogènes que des éléments non pathogènes.
Les risques associés à la biologie de synthèse proviennent : de l'organisme manipulé (c.-à-d. le châssis), du type et de l'origine du matériel génétique ajouté, et des risques supplémentaires des différentes composantes travaillant de concert. La biologie de synthèse comporte également le risque inhérent que ce type de recherche présente la possibilité de double usage ou qu'il soit utilisé à des fins malveillantes, de manière délibérée ou non. Avant une expérience, on devrait prendre en compte non seulement l'origine des composantes, mais aussi les effets synergétiques possibles qui pourraient augmenter la pathogénicité d'un organisme. Il est souvent difficile de quantifier la pathogénicité lorsqu'on combine des éléments provenant de différentes sources, qu'on combine des éléments qui n'ont jamais existé ensemble dans un organisme naturel ou qu'on met en œuvre une fonction biologique qui n'existe pas dans la nature. Puis, en dernier lieu, il faut évaluer les effets de la synergie entre les différents éléments de ce système unique et nouveau. Cerner les risques associés à l'insertion d'ADNs dans les organismes et déceler les interactions imprévues générées par l'expression du génome fabriqué constituent probablement la plus grande difficulté de l'évaluation des risques.
4.3.9 ARN infectieux
L'ARN viral purifié, de polarité positive, peut causer une infection et, subséquemment, la production de virus fonctionnels complets dans les cellules hôtesNote de bas de page 22. Par conséquent, il est nécessaire que des mesures supplémentaires soient prises lors de la manipulation du matériel génomique des virus à ARN de polarité positive. Le virus de la poliomyélite et le virus de l'hépatite C sont des exemples de virus à ARN qui produisent de l'ARN infectieux de polarité positive et qui ont la capacité de causer des maladies chez l'humainNote de bas de page 23; le virus de la fièvre aphteuse et le virus de la peste porcine classique font de même, mais causent plutôt des maladies chez les animauxNote de bas de page 24Note de bas de page 25. Le virus du Nil occidental est un exemple d'un agent pathogène zoonotique ayant un génome d'ARN de polarité positiveNote de bas de page 23. Avant toute manipulation d'ARN viral infectieux de polarité positive, il convient de réaliser une ELR qui tient compte des éléments suivantsNote de bas de page 26:
- L'infection avec un ARN viral de polarité positive n'est pas aussi efficace qu'une infection causée par des particules virales entières;
- Puisque l'ARN résiste à des températures plus élevées que les protéines, il est possible d'extraire l'ARN infectieux de polarité positive des virus inactivés par la chaleur;
- La copie d'ADN de certains virus à ARN est également infectieuse (p. ex. poliovirus, rétrovirus);
- Les anticorps propres aux virus n'ont aucun effet sur l'infectiosité de l'ARN viral de polarité positive;
- Le tropisme de l'ARN viral infectieux simple brin de polarité positive pourrait être plus élevé (c.-à-d. type de cellule et gamme d'hôtes) que celui des particules virales entières.
4.3.10 Lignées cellulaires
Les lignées cellulaires ne sont pas considérées comme des matières infectieuses, sauf lorsqu'elles sont porteuses d'agents pathogènes. On peut obtenir de plus amples renseignements sur les lignées cellulaires réglementées par l'ASPC et l'ACIA en communiquant directement avec elles ou en consultant leurs sites Web. La plupart des lignées cellulaires sont bien caractérisées et devraient être manipulées au niveau de confinement déterminé pour les agents pathogènes qu'elles contiennent, le cas échéant. Une ELR devrait être effectuée avant de travailler avec des lignées cellulaires dont on sait ou pense qu'elles contiennent des agents pathogènes afin de déterminer le niveau de confinement adapté à l'organisme contaminant du groupe de risque le plus élevé. L'un des principaux dangers associés à la manipulation de toute lignée cellulaire se rapporte à l'expression de virus latents. Des séquences virales endogènes ont été observées dans diverses lignées cellulaires provenant d'espèces de mammifères, y compris des lignées provenant d'humains. En cas de manipulation de lignées cellulaires non recombinées, une évaluation des risques devrait être réalisée et comprendre les éléments suivants :
- L'organisme source : pour le personnel, les risques associés aux lignées cellulaires provenant des tissus d'humains ou de primates non humains (PNH) sont généralement plus élevés que ceux associés aux lignées cellulaires provenant d'animaux qui ne sont pas étroitement apparentés aux humains;
- La source du tissu : elle fournit des renseignements sur les contaminants et les virus latents (p. ex. oncogènes) potentiellement présents;
- Le type de lignée cellulaire : on en sait bien plus sur les cultures cellulaires commerciales intensivement caractérisées que sur les cultures primaires et les lignées cellulaires continues produites en laboratoire;
- La population de départ : le groupe de reproducteurs ou la colonie de l'organisme particulier à partir duquel la lignée cellulaire a été obtenue peut accroître le risque que la matière soit porteuse d'agents pathogènes.
En ce qui concerne la manipulation de lignées cellulaires recombinées ou génétiquement modifiées, l'évaluation des risques devrait comprendre, en plus des éléments ci-dessus, les éléments suivants :
- Les propriétés de la lignée cellulaire hôte; dans le cas des hybridomes, les propriétés de chacune des cellules incluses devraient être prises en considération;
- Le vecteur utilisé pour la transformation;
- Le transfert de séquences virales;
- Le transfert de facteurs de virulence;
- L'activation de virus endogènes;
- Le produit génique recombiné;
- La présence de virus assistant.
4.3.11 Échantillons primaires
Les échantillons primaires sont ceux qui proviennent directement d'un humain ou d'un animal. La LAPHT et le RAPHT ne s'appliquent pas aux agents pathogènes humains et aux toxines qui se trouvent dans un milieu où ils sont naturellement présents (c.-à-d. dans des échantillons primaires). Il est toutefois à noter que les échantillons prélevés chez un animal qui a délibérément été exposé à un agent pathogène humain ou à une toxine (p. ex. par l'infection ou l'inoculation expérimentale) sont réglementés en vertu de la LAPHT et du RAPHT. En outre, la LSA et le RSA s'appliquent à tous les échantillons primaires importés qui contiennent naturellement ou non un agent zoopathogène ou une partie d'un tel agent qui conserve sa pathogénicité.
Les agents pathogènes peuvent être transmis par des individus symptomatiques ou asymptomatiquesNote de bas de page 27. Par conséquent, il est important que les échantillons primaires soient considérés comme potentiellement infectieux. Ceux-ci comprennent le sang, les composants sanguins (p. ex. sérum, plasma), d'autres liquides organiques (p. ex. urine, fèces, salive, lait) ou les tissus prélevés chez des humains ou des animaux, exposés à un agent pathogène ou à une toxine.
Les pratiques de base sont des lignes directrices en matière de prévention des infections élaborées par l'ASPC, lesquelles sont destinées au personnel des milieux de soins de santé afin de prévenir leur exposition à des sources potentielles d'agents pathogènesNote de bas de page 27. Les pratiques de base et les précautions universelles visant à prévenir la transmission des agents pathogènes par l'exposition à des tissus humains ou des liquides organiques dans un cadre professionnel sont énoncées au chapitre 21Note de bas de page 28Note de bas de page 29.
Les hôpitaux, les laboratoires de santé publique et les laboratoires vétérinaires de diagnostic mènent régulièrement des activités de diagnostic qui comportent des échantillons primaires, mais ne visent ni la mise en culture, ni la concentration, ni l'épuration de l'agent pathogène (p. ex. titrage immuno-enzymatique utilisant un antigène absorbé [analyse ELISA], extraction de matériel génétique, fixation d'échantillons de tissus à des fins d'analyse histologique). Dans la plupart des cas, les risques associés à ce type d'activités sont considérés comme plus faibles que les risques associés aux cultures ou au travail in vivo. Les exigences liées au confinement physique et aux pratiques opérationnelles applicables aux activités comportant des échantillons primaires peuvent être moins rigoureuses que les exigences liées à la manipulation de cultures pures (c.-à-d. faire l'objet d'une dérogation) en fonction des activités du laboratoire et des risques associés à l'agent pathogène soupçonné d'être présent dans l'échantillon primaire. L'ASPC et l'ACIA s'occupent de déterminer les niveaux de confinement associés aux agents pathogènes; la NCB est, quant à elle, axée sur la performance, ce qui permet au personnel des installations de procéder à des ELR pour déterminer les stratégies d'atténuation des risques à adopter en fonction de leurs activités. Si un échantillon semble être porteur d'un agent pathogène appartenant à un groupe de risque supérieur au niveau de confinement de l'installation où sont effectuées les analyses, il peut être nécessaire d'adopter des pratiques opérationnelles additionnelles ou de transférer l'échantillon à une installation dont le niveau de confinement est approprié. Ces mesures peuvent être établies en consultation avec l'ASPC et l'ACIA.
4.3.12 Échantillons, tissus et cellules autologues
L'infection à des fins expérimentales de cellules, de tissus ou d'autres échantillons prélevés chez la personne qui réalise l'expérience peut exposer cette personne à des dangers. Ces pratiques sont interdites (matrice 4.6 de la NCB). Toute personne qui utilise un procédé comportant la transformation in vitro ou un autre type de modification génétique de cellules provenant de son propre corps (c.-à-d. des cellules autologues) peut être touchée par une affection maligne (p. ex. dans le cas d'une modification des cellules pour qu'elles expriment un oncogène) ou par l'expression d'une protéine non usuelle possédant des propriétés pharmacologiques (p. ex. dans le cas d'une modification des cellules pour qu'elles expriment une toxine). Les expériences de ce genre mettent la personne à risque, car la protection immunitaire innée, qui permet normalement de détruire les cellules étrangères, est alors contournée. Les membres du personnel ne devraient pas mener de telles expériences dans les aires de laboratoire ou les zones de confinement où ils travaillent, ni donner ou recueillir des échantillons ou des tissus provenant de leur propre corps ou de celui d'un autre membre du personnel.
4.3.13 Manipulation de matières biologiques du groupe de risque 1
Les règlements administrés par l'ASPC et l'ACIA ne s'appliquent pas aux agents pathogènes du GR1; la NCB ne mentionne aucunes exigences liées aux activités qui les comportent. Néanmoins, même si les matières biologiques du GR1 présentent un faible risque pour la santé humaine ou animale, elles devraient tout de même être manipulées de façon sécuritaire dans un laboratoire de base ou un espace de travail avec des animaux de base. La prudence est de mise, et des pratiques de travail sécuritaires (p. ex. bonnes pratiques microbiologiques) devraient toujours être employées lors de la manipulation de ces matières. Le chapitre 21 fournit de plus amples renseignements sur le travail avec des matières du GR1.
4.4 Gestion du risque
Pour gérer les risques associés aux agents pathogènes humains, aux agents zoopathogènes et aux toxines, il faut bien comprendre les exigences prévues par la loi qui régissent les activités qui y sont liées (p. ex. importation, manipulation, possession); il faut également tenir compte des compétences des personnes concernées et des limites des installations où les matières sont manipulées et entreposées. En vertu de la législation applicable (c.-à-d. la LAPHT, le RAPHT, la LSA et le RSA), les organisations et les personnes qui manipulent ou entreposent des toxines ou des agents pathogènes humains ou zoopathogènes doivent se conformer à la NCB et peuvent faire l'objet d'une inspection par l'ASPC ou l'ACIA. La gestion des risques associés aux agents pathogènes et aux toxines est assurée par la conformité aux lois applicables et par la réalisation périodique d'ELR. Bien qu'il soit possible de consulter l'ASB ou toute autre personne désignée, il incombe aux membres du personnel de l'installation d'effectuer une ELR propre à leur zone de confinement et aux procédés utilisés (matrice 4.1 de la NCB). L'ASPC et l'ACIA peuvent aussi être consultées sur la détermination du groupe de risque et du niveau de confinement qui conviennent à un agent pathogène donné. Le chapitre 5 présente les mesures administratives ainsi que les rôles et responsabilités.
Le processus d'évaluation des risques présentés par des matières infectieuses ou des toxines suit les mêmes principes mis en œuvre dans la plupart des programmes de santé et sécurité au travail qui visent à réduire les risques et dangers auxquels les travailleurs sont soumisNote de bas de page 30. Les mécanismes de contrôle des risques liés à la santé et à la sécurité en milieu professionnel s'appliquent également à la biosécurité et à la biosûreté. Ces mesures de contrôle sont les suivantes :
- L'élimination (y compris la substitution) : existe-t-il un agent pathogène ou un processus qui présente un niveau de risque moins important que celui utilisé et qui permettrait d'arriver au même résultat?
- Les mesures d'ingénierie : entre autres, le choix et l'utilisation de dispositifs de confinement primaire (p. ex. les cages de confinement primaire, les enceintes de sécurité biologique [ESB], les récipients fermés, et les systèmes de chauffage, ventilation et air climatisé [CVAC]).
- Les mesures administratives : mesures qui peuvent modifier la façon dont les tâches sont réalisées, telles que les politiques et les procédures opératoires normalisées (PON).
- L'équipement de protection individuel (EPI) : l'EPI choisi et porté permet de réduire ou de minimiser le risque d'exposition aux matières infectieuses ou aux toxines.
Les lois sur la sécurité et d'autres références en matière de sécurité stipulent souvent que la liste de mesures ci-dessus présente la hiérarchie des mesures de contrôle, ce qui veut dire que ces mesures devraient être appliquées dans l'ordre sous lequel elles sont présentées. Lors de la réalisation d'une ELR, l'EPI devrait être le dernier élément de contrôle analysé.
4.4.1 Évaluations locales des risques
Les ELR sont des évaluations propres à un endroit en particulier, réalisées pour repérer les dangers associés aux activités menées ainsi qu'aux agents pathogènes, aux matières infectieuses ou aux toxines manipulées. Ces évaluations permettent d'examiner des éléments particuliers du programme de biosécurité et peuvent aussi permettre d'orienter l'évaluation globale des risques. Les employés qui travaillent avec les matières infectieuses et les toxines dans la zone de confinement sont les mieux placés pour contribuer à la réalisation d'une ELR destinée à cerner les dangers associés aux activités quotidiennes et à déterminer les mesures d'atténuation des risques. En fonction des procédures ou des tâches qui seront accomplies, il pourrait exister d'autres dangers (p. ex. chimique, radiologique et physique) qui nécessiteraient une analyse élargie des tâches dans le cadre d'un programme général de santé et sécurité. Dans ce cas, l'analyse élargie des risques liés à l'emploie peut déjà comprendre l'ELR pour les risques de biosécurité associés à la matière infectieuse et aux toxines. L'ASB devrait être impliqué dans l'élaboration de l'ELR. Si l'organisation dispose d'un CIB, comme le décrit le chapitre 5, il pourrait s'avérer utile d'aussi le mettre à contribution. Pour obtenir de plus amples renseignements ou confirmer le résultat de l'évaluation, il pourrait également assurer la liaison avec l'ASPC et l'ACIA.
4.4.1.1 Définir les tâches et les procédures
La première étape d'une ELR est de repérer les tâches et les procédures qui comportent la manipulation de matières infectieuses ou de toxines dans la zone de confinement. La possibilité que les matières infectieuses ou les toxines présentent des risques pour les employés, la communauté ou l'environnement devrait également être évaluée. Il est important de couvrir tous les risques connus et tous les risques potentiels associés aux activités menées et aux matières infectieuses et aux toxines concernées. Cette étape de l'ELR est essentielle puisqu'il est impossible de bien évaluer le risque associé à un danger si l'activité visée n'a pas été bien cernée.
4.4.1.2 Diviser les tâches en étapes
Toutes les activités comportant des matières infectieuses ou des toxines menées dans une zone de confinement (p. ex. la production à grande échelle, les activités de diagnostic, le travail in vivo avec des petits animaux ou des gros animaux) devraient être décrites. Pour réduire le travail nécessaire à la réalisation de chaque ELR et évaluer efficacement le risque réel, il est important de séparer en étapes les différentes tâches d'une même activité. Si une modification est apportée à une seule des étapes d'une tâche qui avaient été déterminées dans une ELR antérieure, seuls les effets de cette étape auront besoin d'être réévalués. Il est également crucial de connaître la quantité et la concentration des matières infectieuses ou des toxines utilisées au cours de l'activité, car cela permet de mieux évaluer les risques associés à chaque étape.
4.4.1.3 Définir les risques d'exposition potentiels pour chaque étape
Le risque (c.-à-d. l'éventualité d'un événement indésirable ainsi que les conséquences de cet événement) peut être caractérisé en fonction, d'une part, des matières infectieuses ou des toxines utilisées et, d'autre part, des activités menées. Chaque tâche (ou étape) entraînera un potentiel différent menant à une exposition (p. ex. l'émission d'ultrasons a une forte probabilité de générer des aérosols). Le potentiel d'exposition dépendra également des caractéristiques (p. ex. pathogénicité, virulence, voie de transmission), de la forme (p. ex. culture liquide, matrice solide, spores lyophilisées) et de la quantité (p. ex. quantité, volume, concentration) de l'agent pathogène. L'attribution de probabilités et de conséquences à toutes les combinaisons de facteurs possibles permettra de déterminer le risque connexe pour chaque étape. La figure 4-1 illustre une matrice qui peut aider à visualiser le concept en traçant la probabilité et la conséquence en vue de définir les risques.
4.4.1.4 Déterminer les stratégies d'atténuation appropriées pour chaque étape
Dans le contexte des ELR, les stratégies d'atténuation des risques sont des pratiques en matière de biosécurité mises en place pour réduire les risques cernés. Les stratégies d'atténuation des risques devraient toujours correspondre au niveau de risque. Les mesures de contrôle de la section 4.4 sont présentées dans l'ordre sous lequel elles devraient être étudiées et évaluées. Des stratégies d'atténuation des risques (p. ex. l'utilisation de dispositifs de confinement primaire, de PON, lesquelles décrivent les bonnes pratiques microbiologiques, de pratiques de décontamination et, d'un EPI approprié) devraient être créées, appliquées, puis revues et mises à jour régulièrement. Parfois, le concept de risque acceptable peut aussi entrer en jeu. Le concept de risque acceptable est fondé sur le postulat selon lequel le risque zéro n'existe pas; le niveau de risque tolérable ou « acceptable » est fondé sur une évaluation des risques. Si les risques associés aux matières infectieuses, aux toxines ou aux activités concernées sont jugés trop élevés, il peut être nécessaire de modifier ou d'annuler le projet.
Figure 4-1 : Matrice d'évaluation des risques
Le risque peut être évalué en fonction de la probabilité qu'un évènement survienne, et les conséquences de cet évènement.
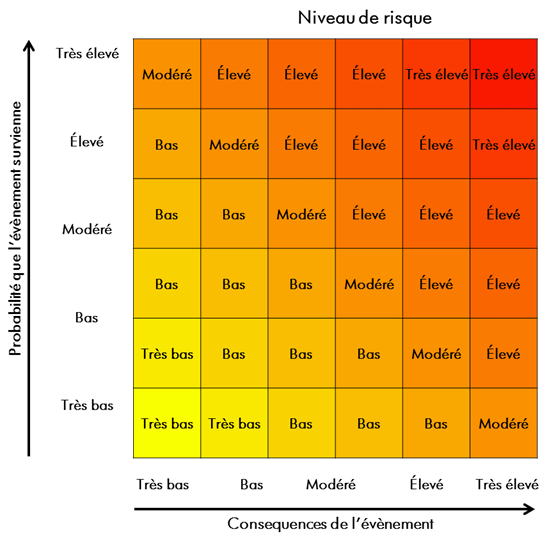
Équivalent textuel - Figure 4-1
Figure 4‑1 : Matrice d’évaluation des risques
Cette figure présente une matrice destinée à l’évaluation du degré de risque en fonction de la probabilité qu’un évènement survienne, ainsi que des conséquences de cet évènement.
Références
- Note de bas de page 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 2
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note de bas de page 3
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note de bas de page 4
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note de bas de page 5
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Note de bas de page 6
- United States Army Chemical School. (2005). FM 3-11.9/MCRP 3-37.1B/NTRP 3-11.32/AFTTP(I) 3-2.55: Potential Military Chemical/Biological Agents and Compounds. Fort Leonard Wood, MO, États-Unis : United States Army Chemical School.
- Note de bas de page 7
- Prusiner, S.B. (2004). Prion Biology and Diseases, 2e éd., Cold Spring Harbor, NY, États-Unis : Cold Spring Harbor Laboratory Press.
- Note de bas de page 8
- Aguzzi, A., Nuvolone, M., & Zhu, C. (2013). The immunobiology of prion diseases. Nature Reviews Immunology. 13:888-902.
- Note de bas de page 9
- Organisation mondiale de la santé animale. (2015). General Disease Information Sheets: Bovine Spongiform Encephalopathy (BSE). Consulté le 3 novembre 2015 à l’adresse http://www.oie.int/doc/ged/D13944.PDF
- Note de bas de page 10
- Bae, S.-E., Jung, S., Kim, H.-Y. et Son, H.S. (2012). Correlation analysis for the incubation period of prion disease. Prion. 6(3): 276-281.
- Note de bas de page 11
- Collinge, J., Whitfield, J., McKintosh, E., Beck, J., Mead, S., Thomas, D.J. et Alpers, M.P. (2006). Kuru in the 21st century- an acquired human prion disease with very long incubation periods. The Lancet, 367(9528): 2068-2074.
- Note de bas de page 12
- Organisation mondiale de la Santé. (2003). WHO Manual for Surveillance of Human Transmissible Spongiform Encephalopathies including variant Creutzfeldt-Jakob disease, Genève, Suisse : Organisation mondiale de la Santé.
- Note de bas de page 13
- Weissmann, C., Enari, M., Klöhn, P.-C., Rossi, D., & Flechsig, E. (2002) Transmission of Prions. Proceedings of the National Academy of Sciences . 99(Suppl. 4):16378-16383.
- Note de bas de page 14
- Denkers, N. D., Hayes-Klug, J., Anderson, K. R., Seelig, D. M., Haley, N. J., Dahmes, S. J., Osborn, D. A., et al. (2013). Aerosol Transmission of Chronic Wasting Disease in White-Tailed Deer. Journal of Virology. 87(3): 1890-1892.
- Note de bas de page 15
- Haybaeck, J., Heikenwalder, M., Klevenz, B., Schwarz, P., Margalith, I., Bridel, C., Mertz, K., et al. (2011) Aerosols Transmit Prions to Immunocompetent and Immunodeficient Mice. PLoS Pathog 7(1): e1001257. doi:10.1371/journal.ppat.1001257
- Note de bas de page 16
- Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention des États-Unis et les National Institutes of Health des États-Unis. (2009). Biosafety in Microbiological and Biomedical Laboratories, 5e éd., Washington, DC, États-Unis : Government Printing Office.
- Note de bas de page 17
- Department of Health du Royaume-Uni, Advisory Committee on Dangerous Pathogens et le Spongiform Encephalopathy Advisory Committee. (2015). Transmissible Spongiform Encephalopathy Agents: Safe Working and the Prevention of Infection - Annex C: General Principles of Decontamination and Waste Disposal. Guidance from the Advisory Committee on Dangerous Pathogens and the Spongiform Encephalopathy Advisory Committee. Londres, Royaume-Uni : Department of Health.
- Note de bas de page 18
- World Health Organization. (2000). WHO Infection Control Guidelines for Transmissible Spongiform Encephalopathies. Geneva, Switzerland: World Health Organization.
- Note de bas de page 19
- Groupe d'Australie. (2015). Liste des agents pathogènes humains et animaux et des toxines réglementés à l'exportation. Consulté le 3 novembre 2015 à l'adresse http://www.australiagroup.net/fr/human_animal_pathogens.html.
- Note de bas de page 20
- Organisation mondiale de la santé animale. (2015). Maladies, infections et infestations de la Liste de l'OIE. Consulté le 4 octobre 2015, á l'adresse http://www.oie.int/fr/sante-animale-dans-le-monde/oie-listed-diseases-2015/
- Note de bas de page 21
- Zufferey, R., Dull, T., Mandel, R. J., Bukovsky, A., Quirox, D., Naldini, L. et Trono, D. (1998). Self-Inactivating Lentivirus Vector for Safe and Efficient In Vivo Gene Delivery. Journal of Virology. 72(12):9873-9880.
- Note de bas de page 22
- Nguyen, M. et Haenni, A. L. (2003). Expression Strategies of Ambisense Viruses. Virus Research. 93(2):141-150.
- Note de bas de page 23
- Knipe, D. M. (éd.). (2007). Fields Virology, 5e éd., Philadelphie, PA, États-Unis : Lippincott Williams & Wilkins.
- Note de bas de page 24
- Belsham, G. J. et Bostock, C. J. (1988). Studies on the Infectivity of Foot-and-Mouth Disease Virus RNA using Microinjection. Journal of General Virology . 69:265-274.
- Note de bas de page 25
- Van Gennip, H. G. P., van Rijn, P. A., Widjojoatmodjo, M. N. et Moormann, R. J. M. (1998). Recovery of Infectious Classical Swine Fever Virus (CSFV) from Full-Length Genomic cDNA Clones by a Swine Kidney Cell Line Expressing Bacteriophage T7 RNA Polymerase. Journal of Virological Methods. 78(1-2):117-128.
- Note de bas de page 26
- Wong, D. (2009). Virus Replication. Consulté le 3 novembre 2015 à l'adresse http://virology-online.com/general/Replication.htm.
- Note de bas de page 27
- Agence de la santé publique du Canada. (2012). Pratiques de base et précautions additionnelles visant à prévenir la transmission des infections dans les établissements de santé, Ottawa, ON, Canada : Agence de la santé publique du Canada.
- Note de bas de page 28
- Santé Canada. (2002). Guide de prévention des infections - La prévention et la lutte contre les infections professionnelles dans le domaine de la santé. Canada Communicable Disease Report 28S1:1-264. Consulté le 8 juillet 2014 à l'adresse http://publications.gc.ca/collections/Collection/H12-21-3-28-1F.pdf
- Note de bas de page 29
- United States Department of Labor. (2001). Occupational Safety and Health Standards: Bloodborne Pathogens. Title 29 Code of Federal Regulations. 1910,1030 Washington, DC, États-Unis : United States Department of Labor.
- Note de bas de page 30
- Centre canadien d'hygiène et de sécurité au travail. (2015). Fiches d'information Réponses SST : Contrôle des dangers. Consulté le 3 novembre 2015 à l'adresse http://www.cchst.ca/oshanswers/hsprograms/hazard_control.htm
Chapitre 5 - Gestion du programme de biosécurité
Un programme de biosécurité vise à prévenir les infections et les maladies chez le personnel, et à protéger le publique, l'environnement et la population animale contre les dangers en prévenant la libération accidentelle d'agents pathogènes ou de toxines. Pour être efficace, le programme de biosécurité doit promouvoir et renforcer les pratiques de travail sécuritaires, améliorer la performance en matière de sécurité et accroître la conformité réglementaire grâce à une combinaison d'activités de formation, de documentation, d'inspections, d'évaluations, d'examens et de communications claires. Un programme de biosécurité peut comprendre une composante de biosûreté ou avoir un programme de biosûreté distinct, afin d'assurer une protection contre le vol, la perte ou l'utilisation malveillante d'agents pathogènes, de toxines, ou de toute autre matière infectieuse. La gestion d'un programme de biosécurité permet, entre autres, de s'assurer que tous les aspects du programme de biosécurité sont en place. Les exigences particulières à la gestion du programme de biosécurité réalisée dans des installations réglementées par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA) sont énoncées à la matrice 4.1 de la Norme canadienne sur la biosécurité (NCB), 2e éditionNote de bas de page 1.
Le niveau de détail et de complexité du programme de biosécurité dépend de la nature de l'organisation (c.-à-d. sa taille, sa structure et sa complexité) et des activités qui y sont menées. Dans les organisations exerçant peu d'activités comportant des agents pathogènes, des toxines, ou de matière infectieuse, il peut suffire, pour élaborer un programme de biosécurité, d'élargir la portée d'un programme de sécurité déjà en place de manière à prendre en compte les besoins particuliers de l'installation en matière de biosécurité. Dans des organisations plus complexes telles que les universités, il peut être nécessaire d'avoir des employés se consacrant à la tâche de veiller à l'atteinte des buts du programme de biosécurité. Bien que certaines installations plus complexes préfèrent séparer les composantes de biosécurité et de biosûreté en deux programmes distincts, la biosûreté fait partie du programme de biosécurité dans le cadre de la NCB et du présent document. Le présent chapitre propose une façon de bien gérer un programme de biosécurité et décrit les principaux éléments d'un programme de biosécurité, lesquels seront examinés plus en détail dans les prochains chapitres.
5.1 Mesures de contrôle administratives
La réussite de tout programme de biosécurité repose sur l'engagement et la participation active de tous les membres de l'organisation, y compris de la haute direction, des superviseurs, l'agent de la sécurité biologique (ASB), et du personnel. Les mesures de contrôle administratives mises en œuvre par la plus haute autorité de la structure organisationnelle (c.-à-d. la haute direction) grâce aux politiques et aux procédures permettent d'assurer la protection des travailleurs dans toute l'installation contre l'exposition aux agents pathogènes humains, aux agents zoopathogènes et aux toxines. La présente section décrit les rôles et les responsabilités essentiels pour un programme de biosécurité efficace. Les mesures de contrôle administratives précises nécessaires au niveau opérationnel pour les installations réglementées par l'ASPC ou l'ACIA sont énoncées dans la matrice 4.1 de la NCB. Le Plan de surveillance administrative à l'égard des agents pathogènes et des toxines dans un contexte de recherche (voir l'annexe A) est exigé de tout demandeur de permis permettant des activités contrôlées impliquant des agents pathogènes humains et des toxines qui entend effectuer de la recherche scientifique. Ce Plan peut être utile pour consigner les contrôles administratifs déjà existant.
5.1.1 Politique de biosécurité
Une politique de biosécurité ou code de pratique, qui est propre à l'établissement, est recommandé; il pourrait s'agir d'une politique, d'un code ou d'un plan autonomes traitant spécifiquement de la biosécurité, ou d'une politique de biosécurité intégrée à une politique ou à un plan de santé et de sécurité existant. La politique de biosécurité peut refléter l'engagement de la haute direction en ce qui a trait à la biosécurité, ainsi que les principes directeurs, les normes de biosécurité et de biosûreté applicables (p. ex. NCB, Organisation internationale de normalisation [ISO], Conseil canadien de protection des animaux [CCPA], lois [c.-à-d. la Loi sur les agents pathogènes humains et les toxines (LAPHT), le Règlement sur les agents pathogènes humains et les toxines (RAPHT), la Loi sur la santé des animaux (LSA), le Règlement sur la santé des animaux (RSA) et les lois fédérales/provinciales/territoriales applicables], les mécanismes de protection des employés, les objectifs du programme, les exigences en matière de reddition de comptes, les responsabilités, de même que les conséquences et les mesures disciplinaires en cas de non-conformité délibérée ou répétéeNote de bas de page 2Note de bas de page 3Note de bas de page 4Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8. Une politique peut établir le système de responsabilisation interne en fonction des agents pathogènes, des toxines et de toute autre matière infectieuse réglementé (p. ex. des animaux infectés ou intoxiqués, des produits ou sous-produits porteurs d'un agent pathogène ou d'une toxine). Il est essentiel de communiquer la politique au personnel pour assurer que tous les travailleurs connaissent leurs responsabilités ainsi que les mesures disciplinaires en cas de non-conformité. Le chapitre 19 fournit de plus amples renseignements sur l'imputabilité relative aux agents pathogènes et aux toxines, et le système de responsabilisation interne.
5.1.2 Fonction du programme
La fonction du programme correspond à la description des travaux dont l'exécution est prévue ou proposée dans une zone de confinement; elle sert à consigner la portée des activités menées dans une installation. Elle comprend la liste des agents pathogènes, des toxines et des autres matières infectieuses réglementées dont l'utilisation est prévue dans l'installation. La documentation du type d'activités exercées dans l'installation au niveau le plus large (p. ex. quel est le type d'activités, soit universitaires ou éducatives, hospitalières ou reliées aux soins de santé, de surveillance de santé publique, de surveillance de l'environnement, vétérinaires, reliés à la santé des animaux, de recherche et de développement, de fabrication ou de production) constitue un bon point de départ pour décrire l'objectif du programme. À partir de ce point, la portée des travaux dans le cadre des activités prévues à l'intérieur de l'installation, y compris les activités in vitro avec des agents pathogènes et des toxines (p. ex. activités de diagnostic de routine, recherche scientifique ou production à grande échelle), et des activités in vivo avec des agents pathogènes et des toxines (p. ex. projets avec de petits animaux ou de grands animaux). Pour les projets in vivo avec des agents pathogènes et des toxines, l'objectif du programme comprend une liste de toutes les espèces animales qui seront utilisées. L'objectif du programme peut être documenté à l'échelon organisationnel; par contre, dans certains cas où l'on mène des activités diversifiées au sein d'une même organisation ou installation (p. ex. les universités), il peut s'avérer approprié d'élaborer un objectif de programme à l'échelon de la zone de confinement.
Dans les zones de confinement où des agents zoopathogènes non indigènes ou des agents pathogènes qui causent des maladies animales émergentes sont manipulés, les modifications à la fonction du programme (p. ex. ajout d'un nouvel agent pathogène, d'une nouvelle toxine ou d'une nouvelle espèce animale) ou aux procédures opératoires normalisées (PON) qui peuvent influer le bioconfinement ou la biosécurité sont présentées à l'ACIA avant leur mise en œuvre pour permettre à l'ACIA de confirmer qu'elles sont acceptables afin de maintenir le confinement (matrice 4.1 de la NCB).
5.1.3 Rôles et responsabilités
Dans la plupart des organisations, la haute direction est l'autorité responsable de la délégation des pouvoirs appropriés en matière de biosécurité. La haute direction a aussi la responsabilité de maintenir les ressources nécessaires au fonctionnement du programme de biosécurité, d'assurer la conformité du programme aux exigences légales et, enfin, de veiller à ce que les problèmes en matière de biosécurité soient adéquatement pris en compte, en ordre de priorité, et corrigés. La haute direction établit les politiques et les pratiques, lesquelles décrivent les précautions raisonnables à prendre pour prévenir la libération d'agents pathogènes et de toxines. Elle joue aussi un rôle dans l'amélioration continue du programme de biosécurité, qui doit demeurer adapté aux besoins.
Les gestionnaires et les superviseurs sont chargés de s'assurer que le personnel respecte les lois et les règlements en matière de biosécurité. Lorsque des activités réglementées comportant la manipulation d'agents pathogènes humains et de toxines sont autorisées par un permis en vertu de la LAPHT, la personne indiquée comme titulaire du permis détient la responsabilité juridique ultime visant les activités menées avec les agents pathogènes et les toxines dans l'installation visée par le permis. Tous les membres du personnel effectuant du travail avec des agents pathogènes humains et des toxines dans une installation visée par un permis ont des responsabilités précises décrites dans la LAPHT et le RAPHT (résumées à la section 1.3 de la NCB).
Au Canada, dans les installations possédant des agents zoopathogènes et des toxines importées en vertu d'un permis d'importation d'agents zoopathogènes conformément à la LSA et au RSA, la personne indiquée comme importateur sur ce permis ou sur le permis visant les agents pathogènes et les toxines assume la responsabilité ultime concernant les agents pathogènes, les toxines et les autres matières infectieuses réglementées importés. Tous les membres du personnel qui manipulent des agents zoopathogènes, des toxines et d'autres matières infectieuses réglementées importés dans l'une installation autorisée à importer ou à recevoir des matières importées par transfert, en vertu d'un permis d'importation d'agents zoopathogènes conformément à la LSA et au RSA, ont des responsabilités précises (résumées à la section 1.4 de la NCB). Il incombe toujours à la partie visée par le règlement de comprendre ses obligations au titre de la LAPHT, du RAPHT, de la LSA et du RSA, le cas échéant; on encourage les parties visées par le règlement à consulter les sections pertinentes de la loi pour comprendre parfaitement les exigences.
Dans la mesure du possible, un cadre supérieur de l'organisation (c.-à-d. la haute direction) devrait être désigné comme représentant du titulaire de permis ou importateur pour allouer la surveillance des agents pathogènes, des toxines, et de toute autre matière infectieuse appropriée à l'installation. L'obligation de rendre compte est décrite dans le chapitre 19.
5.1.4 Agent de la sécurité biologique
Le responsable de la biosécurité ou l'ASB est une personne possédant les connaissances adéquates qui est chargée de la surveillance des pratiques de biosécurité et de biosûreté, y compris le programme de biosécurité de l'organisation. Dans de nombreuses installations, le rôle de responsable de la biosécurité ou d'ASB peut être assigné à une personne qualifiée qui remplit cette fonction à temps partiel (p. ex. microbiologiste en chef, technicien de laboratoire) ou il peut être délégué à une personne qualifiée qui s'acquitte de cette fonction à temps plein, selon ce qui a été établi par l'organisation. Dans certaines grandes organisations, plusieurs personnes peuvent exercer la fonction de responsable de la biosécurité ou d'ASB afin de gérer les éléments clés du programme de biosécurité. La LAPHT et le RAPHT ont été conçus pour refléter le rôle central de l'ASB en la réduction des risques dans les établissements où des agents pathogènes et des toxines sont manipulés et entreposés. Ils ont été conçus pour fournir à l'ASB l'autorité et les contrôles nécessaires pour faciliter leur travail en précisant les compétences, les fonctions et le pouvoir d'un ASB.
Le responsable de la biosécurité ou l'ASB doit posséder des connaissances adaptées aux risques associés au travail avec les agents pathogènes et les toxines dans l'installation; connaître la LAPHT, le RAPHT, la LSA et le RSA, ainsi que toutes les autres lois fédérales ou provinciales/territoriales applicables; connaître les niveaux de confinement de l'installation, ainsi que les politiques, les normes et les pratiques en matière de biosécurité et de biosûreté adaptées aux risques associés au travail avec les agents pathogènes et les toxines effectué dans l'installation. Il est recommandé que l'ASB actualise et approfondisse régulièrement ses connaissances sur les sujets liés à la biosécurité, ce qui lui permet de rester bien informé et à jour dans les domaines liés à la gestion des risques associés aux agents pathogènes et aux toxines manipulés ou entreposés au sein de l'organisation. Conformément à l'article 36 de la LAPHT, un ASB désigné doit être nommé dans les installations qui présentent une demande de permis visant les activités réglementées effectuées sur des agents pathogènes humains et des toxines. L'article 8 du RAPHT fournit de plus amples renseignements sur les compétences des ASB désignés dans les installations visées par un permis.
L'ASB joue un rôle clé en aidant le personnel scientifique et technique à se retrouver dans les obligations administratives et réglementaires associées à la biosécurité. Les responsabilités de l'ASB sont distinctes de celles des membres du comité de santé et de sécurité au travail. Le responsable de la biosécurité ou l'ASB désigné est responsable de la surveillance des pratiques de biosécurité et de biosûreté, y compris la gestion générale du programme de biosécurité, ce qui peut comprendre l'élaboration de politiques, la mise en œuvre du programme, la surveillance de la conformité, la réalisation d'évaluations des risques et d'inspections ou de vérifications internes; il peut superviser la formation en matière de biosécurité et consigner les données s'y rapportant; il peut aussi participer aux enquêtes sur les incidents, rédiger les rapports et recueillir la documentation exigée par les agences de réglementation ainsi que les présenter; il peut communiquer avec les employés de la zone de confinement, les employés de soutien, le personnel d'entretien ménager et les entrepreneurs au sujet des questions de biosécurité; il peut aussi travailler à l'amélioration continue du programme (matrice 4.1 de la NCB; RAPHT 9[1]). Le responsable de la biosécurité ou l'ASB désigné est également chargé de vérifier que les renseignements indiqués dans les demandes ou les renouvellements de permis, les demandes de permis d'importation d'agents zoopathogènes et les demandes de transfert sont exacts et complets; il est également chargé de communiquer avec l'ASPC et l'ACIA au nom du titulaire du permis ou du titulaire de permis d'importation d'agents zoopathogènes, le cas échéant. Bien que les responsabilités de l'ASB puissent être distinctes de celles des membres du comité de santé et de sécurité au travail, il est recommandé que l'ASB fasse partie du comité afin de lui permettre de tisser des liens appropriés en matière de sécurité. L'article 9 du RAPHT fournit de plus amples renseignements sur les fonctions et les pouvoirs légaux des ABS désignés dans les installations qui détiennent un permis.
L'ASB désigné peut être remplacé pour différentes raisons, notamment en cas de changement d'emploi ou d'absence prolongée (p. ex. congé sabbatique, congé parental). Les titulaires de permis doivent aviser l'ASPC immédiatement en cas de changement d'ASB désigné (RAPHT 36[6]). Par conséquent, un examen devrait être effectué au sein de l'organisation en vue de déterminer les circonstances qui justifient la désignation d'un nouvel ASB et la notification de l'ASPC. Il peut être avantageux de nommer des remplaçants pour les personnes-ressources en matière de biosécurité pour assumer les responsabilités quotidiennes de l'ASB pendant les absences à court terme de l'ASB désigné (p. ex. vacances).
5.1.5 Comité institutionnel de biosécurité
Un comité institutionnel de biosécurité (CIB) peut également prendre part au système de gestion d'un programme de biosécurité. L'ASB, ou le responsable de la biosécurité, devrait assurer la liaison avec le CIB en organisant des réunions périodiques où seraient abordés les problèmes et les préoccupations en matière de biosécurité, ainsi que les améliorations à envisager et à apporter aux politiques et aux protocoles. Le CIB peut aider l'ASB dans l'évaluation des risques, l'examen et l'approbation de protocoles de biosécurité, les conflits en matière de biosécurité et d'autres aspects liés à la biosécurité ou à la biosûreté. Les membres du CIB devraient être choisis judicieusement, de manière à ce que le CIB soit composé d'individus provenant de différents champs d'expertise. Il est recommandé de nommer au sein du CIB au moins un membre du personnel de recherche ou du personnel technique, un représentant de la direction, un conseiller médical qui pourra être consulté au besoin et l'ASB. Selon l'installation, d'autres membres pourraient faire partie de ce comité, par exemple des membres du personnel technique de l'installation ou un technicien en soins aux animaux.
5.2 Évaluations des risques et planification
Des évaluations des risques sont effectuées pour relever les dangers et les stratégies d'atténuation appropriées ainsi que pour vérifier si les mesures d'atténuation des risques sont proportionnelles au niveau de risque. Il existe de nombreux types d'évaluation des risques liée à la manipulation d'agents pathogènes et de toxines, notamment l'évaluation globale des risques, décrite plus bas. Pour que les lacunes à combler puissent être clairement repérées, l'évaluation devrait être faite en regard des exigences énoncées dans les chapitres 3, 4 et 5 de la NCB et des pratiques exemplaires existantes.
La première étape d'une évaluation des risques de biosécurité ou de biosûreté est toujours de déterminer les agents pathogènes, les toxines et toute autre matière infectieuse qui sont ou seront présents, afin de déterminer et de traiter les risques associés. Il peut s'avérer nécessaire de vérifier les inventaires existants (y compris les matières entreposées à long terme) et les propositions de recherche afin d'avoir une bonne représentation des risques présents dans l'installation. À la lumière des règlements, des normes et des lignes directrices applicables, dans le contexte d'activités de programme planifiées, un examen de l'installation devrait aussi être effectué afin d'établir les niveaux de confinement des laboratoires existants et de cerner d'éventuelles lacunes dans l'aménagement de l'installation ou dans les mesures de contrôle techniques. Le partage d'espaces de travail en laboratoire à l'intérieur de l'installation (p. ex. entre plusieurs chercheurs, plusieurs agents et différentes organisations) est un facteur à prendre en considération dans l'enquête puisque ces espaces peuvent avoir des répercussions sur la façon de gérer le programme de biosécurité. Il existe plusieurs normes et lignes directrices en matière de biosécurité sur le plan international qui peuvent fournir de l'aide supplémentaire en ce qui concerne les pratiques exemplaires et la réalisation des évaluations des risques de biosécurité et de biosûretéNote de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12. D'autres types d'évaluation des risques dont la portée est plus précise sont abordés au chapitre 4 (Évaluations des risques associés aux agents pathogènes et Évaluations locales des risques) et au chapitre 6 (Évaluation des risques de biosûreté).
5.2.1 Évaluations globales des risques
Au moment d'élaborer un programme de biosécurité, une évaluation globale des risques est effectuée afin de cerner les dangers et d'établir les stratégies d'atténuation des risques appropriées (matrice 4.1 de la NCB). Le processus d'évaluation globale des risques consiste en une évaluation générale qui soutient le programme de biosécurité dans son ensemble et qui peut englober plusieurs zones de confinement au sein d'un établissement ou d'une organisation.
L'évaluation globale des risques permet de recenser les dangers grâce à un examen systématique du type de matières biologiques présentes, examen qui englobe le personnel manipulant ces matières, les lieux de manipulation et d'entreposage de ces matières et les activités menées (p. ex. activités de diagnostic, recherche scientifique, travail à grande échelle, recombinaison génétique, travail avec des animaux). Cet examen permet de déterminer les questions de biosécurité les plus pressantes et de répartir les ressources là où elles peuvent être les plus efficaces. Une évaluation globale des risques permet d'orienter l'élaboration des stratégies d'atténuation des risques prévues dans le programme de biosécurité, notamment les mesures de contrôle, les pratiques et les procédures techniques et administratives, et les activités de formation. Cette évaluation comprend une analyse générale des risques et des scénarios d'exposition ou de libération éventuelle, notamment l'examen de facteurs tels que l'ensemble des différents types de travaux à réaliser, l'équipement ainsi que les divers protocoles requis. Une évaluation globale des risques fournit une vue d'ensemble des risques associés au programme de biosécurité et peut être facilitée par des évaluations locales des risques (ELR), lesquelles sont axées sur des éléments particuliers du programme.
L'évaluation globale des risques peut également comprendre un plan de communication des risques conçu pour répondre efficacement aux préoccupations du public concernant les risques associés à l'installation et à son exploitation. Un plan de communication des risques efficace est proactif et mis en œuvre dès les premières étapes de la planification de la construction de l'installation; il demeure utile même après l'entrée en activité de l'installation. Le plan peut comprendre un engagement rapide ainsi qu'une communication ouverte avec le public. La confiance, la transparence et l'accès à l'information sans compromettre la biosûreté sont donc des éléments essentiels d'un plan efficace de communication des risques; l'engagement du public devrait être maintenu pendant la durée de vie entière de l'installation.
5.3 Réalisation d'un programme de biosécurité
Bien que les programmes de biosécurité ne soient pas les mêmes d'une organisation à l'autre, un certain nombre d'éléments de base communs doivent être présents. S'ils sont fondés sur un engagement et une planification solides de la part de la direction, ces éléments fournissent un cadre rigoureux pour un programme de biosécurité efficace. La complexité d'un élément de programme donné dépend des résultats de l'évaluation globale des risques ainsi que de la nature et des activités de l'organisation. Dans le but de limiter le chevauchement d'exigences et pour améliorer l'efficacité de leurs opérations, une organisation ou une institution pourrait décider d'incorporer leur programme de biosécurité dans un système de gestion existant.
5.3.1 Manuel de biosécurité
Un Manuel de biosécurité comprenant les politiques, les programmes et les plans de l'établissement doit être élaboré, mis en œuvre et tenu à jour (matrice 4.1 de la NCB). Le Manuel de biosécurité est l'outil le plus courant et le plus efficace pour consigner le programme de biosécurité et décrire par quels moyens l'organisation ou l'installation atteindra les buts et les objectifs liés au programme. Il est aussi l'un des outils les plus efficaces pour s'assurer que le personnel connaît les dangers, les risques, les stratégies d'atténuation, les interventions d'urgence et les pratiques de travail sécuritaires, et un outil que le personnel consulte au besoin pour vérifier les mises à jour et raviver ses connaissances sur ces points. Selon le niveau de détail et la complexité du programme, le Manuel de biosécurité peut soit être un document distinct ou être intégré dans un ou plusieurs manuels plus généraux de santé et de sécurité au sein de l'organisation. Une description du programme de biosécurité, ainsi que chacun des éléments principaux décrits plus bas, est comprise dans le Manuel de biosécurité afin que tout le personnel connaisse la structure du programme et ses responsabilités.
5.3.2 Plan de biosûreté
Un plan de biosûreté doit être élaboré et mis en œuvre par les installations où des agents pathogènes ou des toxines sont manipulés ou entreposés pour décrire et énoncer les mesures de sécurité qui visent à prévenir leur perte, leur vol, leur utilisation à mauvais escient, leur détournement ou leur libération intentionnelle. Le chapitre 6 fournit de plus amples renseignements sur la biosûreté.
5.3.3 Programme de surveillance médicale et d'évaluation
Les installations où l'on manipule ou entrepose des agents pathogènes ou des toxines doivent élaborer, mettre en œuvre et tenir à jour un programme de surveillance médicale (matrice 4.2 de la NCB). L'objectif principal de ce programme est de faciliter la prévention des maladies relatives à l'exposition du personnel de laboratoire à des matières infectieuses ou à des toxines, et leur détection lorsqu'elles surviennent afin de protéger la santé de la communauté contre celles-ci. Le chapitre 7 fournit de plus amples renseignements et des points à prendre en compte concernant les programmes de surveillance médicale et d'évaluation.
5.3.4 Programme de formation
Un programme de formation, fondé sur l'évaluation des besoins en matière de formation, doit être élaboré, mis en œuvre, évalué, amélioré et tenu à jour au besoin afin de cerner les besoins actuels et futurs du personnel de l'installation en ce qui concerne la formation, ainsi que les lacunes du programme de formation existant (matrice 4.3 de la NCB). La formation est un élément essentiel des programmes de biosécurité et de biosûreté afin que les employés soient bien informés des risques associés aux agents pathogènes et aux toxines avec lesquels ils travailleront, ainsi que des pratiques de travail sécuritaires et des stratégies d'atténuation approuvées. Le chapitre 8 fournit de plus amples renseignements et des points à prendre on compte concernant les programmes de formation.
5.3.5 Pratiques de travail sécuritaires et procédures opératoires normalisées
Les bonnes pratiques microbiologiques, décrites au chapitre 21, constituent le fondement de toute pratique de travail sécuritaire lorsqu'il est question de matières infectieuses (matrice 4.6 de la NCB). Toutes les procédures concernant le travail avec des matières potentiellement infectieuses ou des toxines sont évaluées de manière à s'assurer que des pratiques de travail sécuritaires ont été établies (matrice 4.1 de la NCB). Les pratiques de travail sécuritaires peuvent être inscrites dans les PON afin que tous les membres du personnel puissent facilement les comprendre et les mettre en œuvre.
Les PON sont des procédures détaillées, étape par étape, présentées en cours de formation qui sont lues avant la première exécution de la procédure pour rappeler les procédures rarement effectuées et quand les PON sont modifiés. Elles servent de documents de référence pouvant être consultés par des vérificateurs internes et externes, et peuvent faciliter l'évaluation de la conformité de l'installation par rapport aux exigences du programme. Les pratiques de travail sécuritaires et les PON propres à la zone de confinement (p. ex. équipement de protection individuel [EPI], procédures d'entrée et de sortie, et gestion des déchets)sont établies pour tenir compte des questions de biosécurité spécifiques de la zone de confinement et ajoutées au Manuel de biosécurité afin qu'elles soient consignées et accessibles à tout le personnel de la zone de confinement (matrice 4.1 de la NCB).
5.3.6 Planification des interventions d'urgence
Un plan d'intervention d'urgence (PIU) décrit les mesures à prendre en cas de déversement, d'exposition, de libération d'agents pathogènes ou de toxines, de fuite d'un animal infecté, de blessure ou de maladie chez un membre du personnel, de panne de courant, d'incendie, d'explosion ou de toute autre situation d'urgence (p. ex. inondation, tremblement de terre, ouragan) [matrice 4.9 de la NCB]. Le PIU devrait prendre en compte la structure physique du bâtiment ainsi que son emplacement (p. ex. conditions climatiques extrêmes, tremblement de terre, inondation). Ce type de plan vise à protéger la santé et la sécurité humaines et animale, et à protéger les biens et l'environnement. Le chapitre 17 fournit de plus amples renseignements sur les PIU.
5.3.7 Conformité réglementaire
Pour assurer la conformité réglementaire, il est essentiel de bien comprendre les lois et les règlements pertinents, notamment la LAPHT et le RAPHT en ce qui concerne les endroits où sont manipulés des agents pathogènes humains ou des toxines, de même que la LSA et le RSA pour ce qui est des agents zoopathogènes ou des toxines. Il est donc important que les responsables de chaque installation où l'on manipule ou entrepose des agents pathogènes ou des toxines établissent un lien, par l'intermédiaire de l'ASB ou d'un autre responsable de la biosécurité, avec les agences de réglementation pertinentes, notamment l'ASPC et l'ACIA, et au besoin avec les autres organisations gouvernementales, non gouvernementales, provinciales, territoriales et municipales concernées à l'échelle canadienne. Le chapitre 23 fournit de plus amples renseignements sur la surveillance réglementaire.
5.4 Mesure de l'efficacité du programme
Un système de gestion expose le cadre des processus et des procédures qu'une organisation peut appliquer pour atteindre des objectifs précis. De façon générale, les systèmes de gestion suivent un cycle de planification, de mise en œuvre, de mesure et d'amélioration (ou cycle « Plan-Do-Check-Act », comme le décrit en anglais l'ISO), selon lequel le système de gestion lui-même est continuellement perfectionnéNote de bas de page 2.
L'efficacité de tout système de gestion repose sur le suivi et la mesure de sa performance en fonction des buts et des objectifs établis dans le programme. Cela comprend les points suivant pour un programme de biosécurité :
- la façon dont on empêche les infections et les maladies chez le personnel;
- la façon dont on empêche la libération d'agents pathogènes ou de toxines;
- la façon qu'on assure la conformité aux lois;
- la façon qu'on fait la promotion de la sécurité.
Des mécanismes internes pour déterminer l'efficacité du programme de biosécurité sont mis en vigueur; les mesures de la performance produisent des données qualitatives et quantitatives pouvant être recueillies et analysées de manière à fournir des renseignements sur le succès du programme. Les outils décrits ci-dessous sont couramment utilisés pour évaluer un programme de biosécurité.
5.4.1 Déclaration des incidents et enquêtes
Les rapports d'incidents, les enquêtes sur les incidents et les mesures correctives peuvent renseigner sur l'efficacité du programme de biosécurité, car ils mettent en lumière les insuffisances et les lacunes au niveau des procédures ou du programme lui-même. Les rapports d'incidents et les enquêtes sur les incidents sont requis dans des situations particulières, telles que la découverte d'une intoxication ou d'une infection contractée en laboratoire (ICL), d'une exposition, ou la défaillance d'un système ou d'un appareil de confinement. Les incidents peuvent servir d'indicateurs du succès du programme, même s'ils sont généralement sous-déclarés et constituent, par conséquent, une mesure quantitative inexacte. Le chapitre 18 offre de plus amples renseignements sur la déclaration et la documentation d'incidents, et l'enquête sur les incidents.
5.4.2 Registres
Les registres sont des documents concernant le programme de biosécurité ou les systèmes de bioconfinement qui contiennent les éléments de preuve ou l'information comptable pour les événements qui se sont produits (p. ex. ce qui a été accompli, obtenu, effectué ou maintenu). On y a consigné la plupart des activités, dont les suivantes : la formation, les accès aux zones de confinement, les importations, l'entretien et les réparations, l'étalonnage et le suivi des appareils, la décontamination, ainsi que l'expédition, la réception et le transfert. Ils peuvent être utilisés pour évaluer si les éléments essentiels de biosécurité sont respectés (p. ex. quelles sont les zones de confinement auxquelles chaque personne a accès? Cette personne a-t-elle reçu une formation? Quels agents pathogènes sont manipulés ou entreposés dans l'installation? Les cycles d'autoclavage sont-ils toujours efficaces?).
Les registres sont conservés dans les dossiers afin de prouver qu'une activité donnée a été effectuée et de consigner les résultats obtenus (matrice 4.10 de la NCB). Il est important que les registres soient lisibles et qu'ils définissent clairement l'activité, le produit ou le service en question. Les registres historiques doivent être conservés pendant une période déterminée, devraient être faciles à récupérer et être conservés à l'abri des dangers ou des pertes.
5.4.2.1 Personnes autorisées
La NCB exige que les installations tiennent un dossier de toutes les personnes qui entrent et sortent de la zone de confinement où se trouvent des agents biologiques à cote de sécurité élevée (ABCSE), des zones de NC3 (qui comprennent les zones de confinement de gros animaux [zone GA] de NC3 [NC3-Ag]), et des zones de NC4 (matrice 4.10 de la NCB). Cela peut être accompli par le maintien d'un journal d'entrée et de sortie ou par voie électronique en demandant à tous les membres du personnel d'utiliser une carte électronique pour entrer dans la zone de confinement et en sortir.
De plus, la LAPHT exige que les titulaires de permis dressent et tiennent à jour la liste de l'ensemble des personnes qu'ils autorisent à accéder aux diverses zones de l'installation (p. ex. bâtiment et numéros de salle) visées par le permis (LAPH 31). La liste doit être remise à l'ASPC sur demande.
Cette liste doit inclure, mais sans s'y limiter, les employés, les étudiants, les chercheurs, les visiteurs, les membres du personnel chargés du nettoyage et de l'entretien ainsi que les entrepreneurs, peu importe s'ils manipulent ou non des agents pathogènes ou des toxines. La méthode de gestion de la liste des personnes autorisées est laissée à la discrétion de l'installation. Chaque chercheur ou gestionnaire de laboratoire doit connaître les personnes autorisées à entrer dans les aires visées par un permis; il est également possible de tirer ces renseignements des dossiers des étudiants ou des dossiers des ressources humaines.
5.4.3 Inventaire
Les processus de reddition de comptes et de gestion de l'inventaire à l'égard des agents pathogènes, des toxines, et de toute autre matière infectieuse réglementée permettent de trouver rapidement les agents pathogènes, les matières infectieuses ou les toxines, au besoin, et de repérer plus facilement les éléments manquants. Tout écart remarqué peut servir à déterminer les améliorations possibles, telles que celles des systèmes d'inventaire, de la formation continue du personnel, ou la mise en œuvre d'un nouveau système. Le chapitre 19 fournit de plus amples renseignements sur la reddition de comptes à l'égard des agents pathogènes et des toxines, et sur la gestion de l'inventaire.
5.4.4 Inspections et vérifications internes
Les inspections et les vérifications internes sont des éléments importants de tout programme de biosécurité, qui permettent de repérer de façon proactive les dangers, les insuffisances et les aspects à améliorer, de manière à aider à prévenir les accidents, les incidents et les expositions. Les inspections et les vérifications internes sont effectuées ou coordonnées par l'ASB, avec ou sans la participation des membres du personnel de l'installation, des superviseurs, des directeurs, de la gestion, le CIB, ou même les membres du comité de santé et de sécurité au travail indépendamment des inspections de l'ASPC et de l'ACIA. Il existe de nombreuses définitions des termes « vérification » et « inspection », qui sont souvent utilisés de manière interchangeable. Pour les besoins du présent document, les inspections internes sont effectuées en personne, elles ont lieu à des intervalles réguliers, elles sont rigoureusement consignées, elles se déroulent selon une procédure écrite qui indique les éléments à inspecter conformément aux exigences internes et externes. Les vérifications internes se font plus périodiquement, elles sont ciblées et elles peuvent être effectuées en personne ou sur papier. Les documents portant sur les inspections et les vérifications indiquent clairement les mesures correctives nécessaires.
En général, les inspections internes ont lieu au moins tous les ans (matrice 5.1 de la NCB), bien qu'il puisse être indiqué de passer plus fréquemment en revue certains éléments critiques du programme. L'ASB, les membres du CIB la haute direction et des membres du personnel formés de manière appropriée peuvent mener les inspections internes en se promenant dans l'installation. Ces promenades donnent l'occasion d'observer l'environnement de travail physique, le matériel et les pratiques de travail, ainsi que de s'assurer que l'EPI est utilisé correctement. Il est également utile d'interroger les employés et les superviseurs, de prendre connaissance de leurs préoccupations et d'examiner les documents et les registres pertinents.
Des vérifications périodiques entre les inspections internes peuvent être un moyen utile de faire respecter et de favoriser la conformité. Les vérifications, qui peuvent se faire aléatoirement et sans préavis, devraient être effectuées par une personne ne participant pas aux activités évaluées.
Les rapports sur les inspections et les vérifications internes décrivent en détail les résultats des inspections ou des vérifications, ainsi que toute mesure corrective à prendre à l'égard des insuffisances et des éléments non conformes observés. Les procédures liées aux inspections et aux vérifications internes devraient notamment prévoir un suivi rapide des insuffisances, des dates cibles auxquelles les mesures correctives devraient être prises ainsi que des vérifications à effectuer pour confirmer la mise en œuvre des mesures correctives.
5.4.5 Exigences réglementaires en matière de reddition de comptes
La LAPHT et le RAPHT énoncent des exigences en matière de reddition de comptes pour le titulaire de permis dans les installations autorisées à mener des activités liées à des agents pathogènes humains et à des toxines. De plus, les redditions de comptes habituelles adressées à l'ASPC et à l'ACIA peuvent être requis en fonction des conditions liées au permis ou celles liées au permis d'importation d'agents zoopathogènes, ou à la demande de l'une ou l'autre des agences. Par exemple, conformément à la matrice 5.1 de la NCB, le rapport annuel des essais de vérification et de performance est requis en fonction d'une condition liée au permis, ainsi qu'une condition liée au permis d'importation d'agents zoopathogènes. Le chapitre 19 fournit de plus amples renseignements sur les exigences réglementaires en matière de reddition de comptes.
5.5 Amélioration continue du programme
Pour rester pertinent, applicable et efficace, un bon programme de biosécurité est examiné régulièrement sur le plan de la gestion et continuellement amélioré. Des rapports périodiques sur le programme (p. ex. trimestriels, semi-annuels, annuels) peuvent servir à examiner les résultats du programme en regard des buts et des objectifs fixés. On peut en outre embaucher une tierce partie qui effectuera un examen des éléments individuels du système de gestion du programme, ainsi que du programme dans son entièreté, de façon objective et déterminera si celui-ci comporte des lacunes. L'examen aidera à répondre à des questions générales sur le système de gestion du programme telles que :
- Le système est-il en place et fonctionne-t-il?
- Est-ce que les procédures, les processus et les plans appropriés ont été mis en place pour assurer l'atteinte des buts et des objectifs du programme?
- Le programme est-il communiqué adéquatement au personnel et bien compris par celui-ci?
- Le programme doit-il être mis à jour?
- Le système est-il mis à jour en fonction de changement?
- Des ressources adéquates sont-elles allouées à l'entretien du système?
La haute direction devrait également examiner le programme de biosécurité à intervalles réguliers pour assurer l'efficacité du programme. Par exemple, cet examen pourrait servir à déterminer si le programme permet d'assurer la conformité aux exigences légales en vertu des lois en vigueur. La haute direction peut aussi vérifier si le système actuel correspond toujours aux buts et aux objectifs à long terme de l'établissement ou de l'organisation.
L'examen du programme de biosécurité peut également permettre de cerner les éléments non conformes ou d'autres problèmes qui pourraient entraîner la non-conformité. Des mesures correctives devraient être prises chaque fois que des éléments non conformes sont observés, et des mesures préventives devraient être appliquées pour empêcher le problème de se reproduire. Ces mesures constituent un cadre qui peut aider à garder le programme sur la bonne voie par rapport aux buts et aux objectifs fixés, et elles permettent de mettre l'accent sur la sécurité du personnel.
Références
- Note de bas de page 1
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada.
- Note de bas de page 2
- ISO 9001:2008, Systèmes de management de la qualité - Exigences. (2008). Genève, Suisse: Organisation internationale de normalisation.
- Note de bas de page 3
- ENV/MC/CHEM(98)17. (1998). Série de l'OCDE sur les Bonnes pratiques de laboratoire et vérification de ces principes Numéro 1: Les Principes de l'OCDE de Bonnes pratiques de laboratoire (tels que révisés en 1997). Paris, France : Direction de l'Environnement, Organisation de Coopération et de Développement Économiques.
- Note de bas de page 4
- Conseil canadien de protection des animaux. (2003). Lignes directrices sur : les animaleries - les caractéristiques, la conception et le développement, Ottawa, ON, Canada : Conseil canadien de protection des animaux.
- Note de bas de page 5
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Note de bas de page 6
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Note de bas de page 7
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Note de bas de page 8
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Note de bas de page 9
- CEN Workshop 31 - Laboratory biosafety and biosecurity. CEN Workshop Agreement (CWA) 15793:2011, Laboratory biorisk management. (2011). Bruxelles, Belgique : Comité européen de normalisation.
- Note de bas de page 10
- CEN Workshop 55 - CEN Workshop Agreement (CWA) 16393:2012, Laboratory biorisk management - Guidelines for the implementation of CWA 15793:2008. (2012). Bruxelles, Belgique : Comité européen de normalisation.
- Note de bas de page 11
- Department of Health and Human Services des États-Unis, Centers for Disease Control and Prevention des États Unis et les National Institutes of Health des États-Unis. (2009). Biosafety in Microbiological and Biomedical Laboratories, 5e éd., Washington, DC, États-Unis: Government Printing Office.
- Note de bas de page 12
- Organisation mondiale de la Santé. (2004). Manuel de sécurité biologique en laboratoire, 3e éd., Genève, Suisse : Organisation mondiale de la Santé.
Détails de la page
- Date de modification :
