Recommandations pour la qualité de l’eau potable au Canada : Paramètres opérationnels
Document technique
pour consultation publique
Fin de la période de consultation :
le 31 mai 2024
Objectif de la consultation
Le présent document technique évalue les renseignements disponibles sur le calcium, le magnésium, la dureté, les chlorures, les sulfates, les matières dissoutes totales (MDT) et le sulfure (sous forme de sulfure d'hydrogène) afin de mettre à jour les valeurs recommandées pour ces paramètres opérationnels dans l'eau potable. La présente consultation vise à recueillir des commentaires sur les recommandations proposées pour ces paramètres opérationnels, sur la démarche suivie pour leur élaboration et sur les répercussions possibles de leur mise en œuvre.
Il existe sept documents techniques, soit un pour chacun des paramètres opérationnels que sont le calcium, le magnésium, la dureté, les chlorures, les sulfates, les MDT et le sulfure d'hydrogène. Le présent document regroupe et actualise, en un seul document, les renseignements sur ces sept paramètres opérationnels (à savoir des substances dont la présence dans l'eau pourrait avoir une incidence sur le traitement de l'eau et sur l'acceptation de l'eau potable par les consommateurs) et propose des recommandations à leur égard.
Dans le document technique existant sur :
- le calcium, élaboré en 1987 et confirmé en 2005, on a déterminé qu'il n'était pas nécessaire d'établir une concentration maximale acceptable (CMA), car rien n'indiquait que le calcium dans l'eau potable pouvait avoir des effets sur la santé. Les données étaient insuffisantes pour établir un objectif d'ordre esthétique (OE). Le présent document ne propose pas d'OE ni de CMA pour le calcium. Il est plutôt question du calcium dans les sections portant sur la réduction de la dureté.
- le magnésium, élaboré en 1978, on a déterminé qu'il n'était pas nécessaire d'établir une CMA, car rien n'indiquait que le magnésium dans l'eau potable avait des effets sur la santé. Le présent document ne propose pas d'OE ni de CMA pour le magnésium. Il est plutôt question du magnésium dans les sections portant sur la réduction de la dureté.
- la dureté, élaboré en 1979, on a déterminé qu'il n'était pas nécessaire d'établir une CMA, car les principaux éléments contribuant à la dureté (soit le calcium et le magnésium) n'avaient pas été jugés préoccupants pour la santé publique. Le présent document ne propose pas d'OE ni de CMA pour la dureté. Il fournit plutôt des recommandations en matière de traitement et d'exploitation pour réduire la dureté dans les systèmes de traitement de l'eau potable.
- les chlorures, élaboré en 1979 et confirmé en 2005, on a fixé un OE de ≤ 250 mg/L en raison du goût que les chlorures peuvent donner à l'eau et du risque de corrosion dans le réseau de distribution. Pour ces deux mêmes raisons, le présent document propose de maintenir l'OE pour les chlorures à ≤ 250 mg/L.
- les sulfates, élaboré en 1994, on a fixé un OE de ≤ 500 mg/L en raison du goût que les sulfates peuvent donner à l'eau. Pour cette même raison, le présent document propose de maintenir l'OE pour les sulfates à ≤ 500 mg/L.
- les MDT, élaboré en 1994, on a fixé un OE de ≤ 500 mg/L en raison de l'incrustation excessive des conduites d'eau, des chauffe-eau et des appareils ménagers. Pour cette même raison, le présent document propose de maintenir l'OE pour les MDT à ≤ 500 mg/L.
- le sulfure (sous forme de sulfure d'hydrogène), élaboré en 1992, on a fixé un OE de ≤ 0,05 mg/L (50 μg/L) en raison du goût et de l'odeur que le sulfure peut donner à l'eau. Pour ces mêmes raisons, le présent document propose de maintenir l'OE pour le sulfure à ≤ 0,05 mg/L.
Le présent document est mis à la disposition du public pour une période de consultation de 60 jours. Veuillez faire parvenir vos commentaires (avec justification, le cas échéant) à Santé Canada par courriel à l'adresse suivante :
Les commentaires doivent nous parvenir avant le 31 mai 2024. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il convient de noter que le présent document technique pourrait être révisé après évaluation des commentaires reçus et que, si nécessaire, une recommandation pour la qualité de l'eau potable sera formulée. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Valeurs recommandées proposées
Des objectifs d'ordre esthétique (OE) sont proposés pour les paramètres suivants dans l'eau potable:
- chlorures ≤ 250 mg/L
- sulfates ≤ 500 mg/L
- matières dissoutes totales (MDT) ≤ 500 mg/L
- sulfure (sous forme de sulfure d'hydrogène) ≤ 0,05 mg/L
Table des matières
- Résumé
- 1.0 Considérations relatives à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul des valeurs basées sur la santé (VBS)
- 4.0 Considérations relatives à l'analyse
- 5.0 Considérations relatives au traitement
- 6.0 Stratégies de gestion
- 7.0 Considérations internationales
- 8.0 Justification des objectifs esthétiques
- 9.0 Références
- Annexe A : Liste des abréviations
- Annexe B : Tableaux des données provinciales
- Annexe C : Données des enquêtes sur l'eau potable menées par Santé Canada
- Annexe D : Résumé de l'élimination de la dureté totale selon les différentes technologies à l'échelle résidentielle
- Annexe E : Apport en sodium résultant de l'utilisation d'un adoucisseur d'eau, par degré de dureté
Résumé
Le présent document technique a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable (CEP). Il regroupe et actualise tous les renseignements pertinents sur les sept paramètres suivants : calcium, magnésium, dureté, chlorures, sulfates, MDT et sulfure d'hydrogène.
Exposition
Le calcium, le magnésium, la dureté, les chlorures, les sulfates, les MDT et le sulfure d'hydrogène sont présents à l'état naturel dans toutes les eaux canadiennes. C'est dans les aquifères que leurs concentrations sont les plus importantes.
Effets sur la santé
Le calcium, le magnésium, les chlorures et les sulfates sont des éléments essentiels.
Des études menées chez l'humain ont montré que la prise de suppléments de calcium peut augmenter le risque de formation de calculs rénaux. Il est peu probable que la consommation d'aliments et d'eau, à elle seule, entraîne un apport excessif de calcium et une hypercalcémie. Une valeur basée sur la santé de 300 mg/L est proposée pour le calcium sur la base d'un risque accru de formation de calculs rénaux.
Des études menées chez l'humain ont montré qu'un apport accru de chlorures, sous forme de chlorure de sodium, peut augmenter la pression artérielle. Une valeur basée sur la santé de 470 mg/L est proposée pour les chlorures sur la base d'un risque accru de haute pression artérielle.
À l'heure actuelle, il n'y a pas suffisamment de données pour établir des valeurs basées sur la santé pour le magnésium, la dureté, les sulfates, les MDT ou le sulfure d'hydrogène.
Considérations esthétiques
On considère que le calcium, le magnésium, la dureté, les chlorures, les sulfates, les MDT et le sulfure d'hydrogène ont une importance opérationnelle pour les services d'eau potable et les consommateurs d'eau à l'échelle résidentielle.
Des concentrations élevées de chlorures peuvent donner à l'eau un goût désagréable en présence de sodium, de calcium, de potassium et de magnésium. Les sulfates sont également associés à un seuil gustatif; en effet, l'eau contenant des concentrations modérées de sulfates est plus acceptable, du point de vue du goût, pour la plupart des consommateurs. Le sulfure d'hydrogène constitue un problème surtout en raison de son odeur nauséabonde d'œuf pourri et de son faible seuil olfactif. Des concentrations élevées de MDT peuvent entraîner une incrustation excessive des conduites d'eau, des chauffe-eau et des appareils électroménagers. Les préoccupations concernant la présence de ces substances dans l'eau potable sont souvent liées aux plaintes des consommateurs.
Les OE pour les chlorures (≤ 250 mg/L), les sulfates (≤ 500 mg/L), les MDT (≤ 500 mg/L) et le sulfure (sous forme de sulfure d'hydrogène) (≤ 0,05 mg/L) visent à réduire les plaintes formulées en raison d'un goût ou d'une odeur inacceptable ou d'une incrustation excessive, et à améliorer la confiance des consommateurs dans la qualité de l'eau potable. Les OE sont principalement basés sur l'acceptation du goût et de l'odeur, qui varie selon la source d'eau, les conditions locales, l'accoutumance, le pH et la température de l'eau.
Considérations relatives à l'analyse et au traitement
L'élaboration d'une recommandation pour l'eau potable tient compte de la capacité de mesurer les contaminants et de les enlever des sources d'approvisionnement en eau potable. Plusieurs méthodes d'analyse permettant de mesurer tous les paramètres opérationnels à des valeurs bien inférieure à l'OE proposé pour chacun des paramètres.
À l'échelle municipale, les technologies de traitement qui permettent de réduire les concentrations de calcium, de magnésium, de dureté, de chlorures, de sulfates, de MDT et de sulfure d'hydrogène dans l'eau potable comprennent l'adoucissement, la filtration sur membrane, l'échange d'ions et l'aération. La plupart des installations de traitement bien exploitées et optimisées peuvent atteindre des concentrations dans l'eau traitée bien inférieures à l'OE proposé pour chaque paramètre.
Dans les cas où l'on souhaite réduire ces substances à l'échelle des petits systèmes ou résidentielle, par exemple, un puits privé, un dispositif de traitement de l'eau potable résidentiel peut être une option. L'échange d'ions (adoucisseurs d'eau) constitue la solution qui présente le meilleur potentiel pour la réduction globale des paramètres opérationnels. Lors de l'utilisation d'un dispositif de traitement de l'eau potable résidentiel, il est important de prélever des échantillons d'eau entrant et sortant du dispositif de traitement et de les envoyer à un laboratoire accrédité pour analyse, afin de s'assurer que l'enlèvement est adéquat. L'utilisation et l'entretien de routine des dispositifs de traitement, y compris le remplacement des composants des filtres, doivent être effectués conformément aux spécifications du fabricant.
Les personnes qui suivent un régime alimentaire à faible teneur en sodium ou qui doivent limiter leur exposition au sodium devraient savoir que les adoucisseurs d'eau résidentiels augmentent la concentration de sodium dans l'eau traitée. Dans ce cas, il est recommandé de faire en sorte qu'une partie de l'eau qui sert le plus souvent à la consommation (c.-à-d. l'eau du robinet de la cuisine) contourne l'adoucisseur afin d'éviter un apport excessif en sel. En règle générale, les enfants de moins de 8 ans ne devraient pas boire d'eau contenant du sodium provenant d'un adoucisseur d'eau, car leur apport en sodium pourrait dépasser la limite supérieure recommandée de 1,5 à 1,9 mg de sodium par jour.
Application des recommandations
Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable.
Le présent document vise à actualiser, à regrouper et à remplacer les documents techniques actuels des recommandations sur sept paramètres : le calcium, le magnésium, la dureté, les chlorures, les sulfates, les matières dissoutes totales et le sulfure d'hydrogène. Aux fins du présent document, ces sept paramètres sont appelés « paramètres opérationnels ».
Tous les responsables de systèmes d'approvisionnement en eau potable devraient mettre en place une approche axée sur la gestion des risques, par exemple une approche « de la source au robinet » ou un plan de salubrité de l'eau pour assurer la salubrité de l'eau. Ces stratégies nécessitent une évaluation du réseau pour : caractériser la source d'approvisionnement en eau, décrire les barrières de traitement qui préviennent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. La surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (p. ex. procédures opérationnelles normalisées, mesures correctives et interventions en cas d'incident). D'autres protocoles pour valider le plan de gestion de la sécurité sanitaire de l'eau sont adoptés (par exemple, tenue de registres, satisfaction des consommateurs). Il faut aussi former les opérateurs pour veiller à ce que ce plan soit efficace en tout temps.
Étant donné que les valeurs de ces paramètres opérationnels peuvent varier considérablement dans les sources d'eau, dans les installations de traitement et dans les réseaux de distribution, les programmes de surveillance devraient être adaptés aux systèmes pour permettre aux responsables de systèmes d'approvisionnement en eau potable de bien comprendre la qualité de leur eau, de la source au robinet. Les programmes de surveillance devraient être conçus en fonction des facteurs de risque qui contribuent à la probabilité de trouver des concentrations élevées de calcium et de chlorures dans le réseau d'eau potable. Ces facteurs peuvent comprendre les caractéristiques chimiques de l'eau de la source d'approvisionnement et l'utilisation de sels de voirie, entre autres. Les lieux, la fréquence et les types d'échantillonnage varieront d'un réseau à l'autre, selon l'objectif souhaité et les considérations propres au site. La section 6.0, Stratégies de gestion, contient des renseignements détaillés sur la surveillance suggérée.
1.0 Considérations relatives à l'exposition
Le calcium, le magnésium, la dureté, les chlorures, les sulfates, les MDT et le sulfure d'hydrogène sont présents à l'état naturel dans la plupart des eaux canadiennes, mais c'est dans les aquifères que leur présence est la plus importante. On considère que ces paramètres ont une importance opérationnelle et esthétique, en particulier pour les responsables de systèmes d'approvisionnement en eau potable souterraine et les propriétaires de puits privés. Leur bonne gestion contribuera à garantir une eau potable de bonne qualité et agréable au goût.
Dans la nature, l'eau entre en contact avec des minéraux, des sels, des métaux et des végétaux – y compris des matières moléculaires et colloïdales – qui sont ensuite dissous dans l'eau. On appelle « matières dissoutes totales », ou MDT, la somme de ces substances dissoutes dans l'eau. Les MDT se composent principalement d'ions tels que le calcium, le magnésium, le sodium, les bicarbonates, les chlorures et les sulfates. Le sulfure d'hydrogène est produit par la décomposition des matières organiques en l'absence d'oxygène, mais il peut également y avoir réduction directe des sulfates en sulfure d'hydrogène en présence de bactéries sulfato-réductrices. Le sulfure d'hydrogène est largement présent dans les sédiments et l'eau, ainsi que dans les déchets biologiques.
Étant donné que certains de ces paramètres sont généralement mesurés, manipulés et surveillés ensemble, nous les décrivons en sous-groupes dans le présent document :
- Calcium et magnésium : le calcium et le magnésium sont les principaux cations qui contribuent à la dureté de l'eau.
- Chlorures et sulfates : les chlorures et les sulfates sont surtout associés à des préoccupations d'ordre esthétique, mais ils présentent également des problèmes opérationnels liés à la corrosion.
- MDT : les MDT sont un facteur déterminant du goût de l'eau et de son acceptation par les consommateurs. Des concentrations élevées de MDT posent également des problèmes opérationnels liés à l'incrustation.
- Sulfure d'hydrogène : le sulfure d'hydrogène dégage une odeur nauséabonde d'œuf pourri; c'est souvent la principale raison pour laquelle on élimine cette substance lors du traitement de l'eau.
1.1 Propriétés, utilisations et sources dans l'environnement
Les paramètres examinés dans le présent document sont les principaux cations et anions présents à l'état naturel dans les eaux canadiennes; c'est dans les aquifères que leurs concentrations sont les plus importantes.
1.1.1 Calcium, magnésium et dureté
La dureté de l'eau est définie comme étant la somme de tous les cations multivalents présents dans une solution. Les principaux ions responsables de la dureté sont le calcium et le magnésium. Bien que la dureté soit causée par le calcium, le magnésium et divers autres métaux, la définition simple de la dureté de l'eau est la quantité de calcium et de magnésium dissous dans l'eau. Les ions de strontium, de fer, de baryum et de manganèse contribuent également à la dureté globale de l'eau, mais ils sont généralement présents en concentrations inférieures. Pour le consommateur, une eau dure a un pouvoir de réaction moindre avec le savon. En effet, l'eau dure a besoin d'une quantité considérable de savon pour produire de la mousse. De plus, elle provoque l'incrustation des conduites d'eau chaude, des chauffe-eau et d'autres appareils électroménagers (Davis, 2010; Crittenden et coll., 2012).
Les eaux souterraines sont généralement plus dures que les eaux de surface, elles sont riches en acide carbonique et en oxygène dissous, et leur pouvoir solvatant est habituellement élevé. De longs temps de séjour de l'eau dans des formations géologiques riches en calcium (p. ex. la calcite, le gypse et la dolomie) peuvent conduire à des niveaux de dureté pouvant atteindre plusieurs milliers de milligrammes par litre. Les temps de séjour et la solubilité peuvent varier selon les saisons dans certains aquifères.
Les principales sources du magnésium contenu dans les eaux naturelles sont les minéraux ferromagnésiens des roches ignées et les carbonates de magnésium des roches sédimentaires. Les principales sources naturelles contribuant à la dureté de l'eau sont les roches sédimentaires, les eaux d'infiltration dans le sol et le ruissellement.
| Propriété | Calcium | Magnésium |
|---|---|---|
| Numéro CAS | 7440-70-2 | 7439-95-4 |
| Formule moléculaire | Ca | Mg |
| Masse molaire (g/mol) | 40,078 | 24,3050 |
| Point de fusion | 842 °C, 1 115 K | 648,8 °C, 921,8 K |
| Point d'ébullition | 1 484 °C, 1 757 K | 1 090 °C, 1 363 K |
| Masse volumique à la température ambiante (g•cm-3) | 1,55 | 1,738 |
Le calcium est le cinquième élément naturel le plus abondant et constitue la principale source de dureté de l'eau. Parmi les formes les plus courantes de calcium, mentionnons le carbonate de calcium (CaCO3), le gypse (CaSO4·2H2O), l'anhydrite (CaSO4) et la fluorine (CaF2) (Yaroshevsky, 2006; Crittenden et coll., 2012). Les eaux de surface contiennent généralement des concentrations de calcium plus faibles que les eaux souterraines. On a notamment observé dans certaines régions du pays une diminution des concentrations de calcium dans les sources d'eau de surface. En comparant les concentrations observées dans les années 1980 à celles des années 2000, on a constaté une diminution du calcium dans plusieurs lacs boréaux dont la teneur en calcium était déjà faible (Jeziorski et coll., 2008). On croit que cette diminution serait attribuable à la réduction des apports de calcium dans les plans d'eau par le sol, les précipitations acides ayant été fortement réduites au cours de cette période. La présence accrue des moules zébrées envahissantes causerait également la diminution des concentrations de calcium dans certaines sources d'eau de surface (Chapra et coll., 2012).
Le magnésium est le huitième élément naturel le plus abondant, et on le trouve généralement dans des minéraux tels que la magnésite, la dolomite, l'olivine, la serpentine, le talc et l'amiante. Il est présent dans toutes les eaux naturelles et contribue largement à la dureté de l'eau. L'eau provenant de régions riches en roches magnésiennes peut contenir entre 10 mg/L et 50 mg/L de magnésium. Les sulfates et les chlorures de magnésium sont très solubles, et l'eau en contact avec ces dépôts peut contenir plusieurs centaines de milligrammes de magnésium par litre. Les effluents industriels peuvent contenir des concentrations de magnésium tout aussi élevées. Le calcium et le magnésium peuvent également être introduits intentionnellement dans un approvisionnement d'eau potable lors du traitement de l'eau. Lorsque la dureté est extrêmement faible (eau douce) dans un système d'approvisionnement en eau potable, il peut être nécessaire d'ajouter du calcium ou du magnésium à l'eau pour réduire les effets de la corrosion en aval. Les sources de dureté peuvent comprendre l'utilisation d'un contacteur au calcaire ou avec billes, ou l'injection directe d'une solution ou d'une boue liquide composée d'hydroxydes de calcium ou de magnésium.
Le degré de dureté de l'eau potable peut être classé comme suit, en fonction de la concentration de CaCO3 : eau douce, eau moyennement dure (ou modérément dure), eau dure et eau très dure. Différentes plages de dureté sont décrites dans la littérature scientifique (tableau 2).
| Eau extrêmement douce (mg/L) |
Eau douce (mg/L) |
Eau moyennement dure ou modérément dure (mg/L) |
Eau dure (mg/L) |
Eau très dure (mg/L) |
Référence |
|---|---|---|---|---|---|
| 0–50 | 50–100 | 100–150 | 150–300 | > 300 | Davis (2010) |
| S.O. | 0-75 | 75–150 | 150–300 | > 300 | AWWA (2005) |
| S.O. | 0 à < 50 | 50 à < 100 | 100 à < 150 | > 150 | Crittenden et coll. (2012) |
| S.O. | 0 à < 60 | 60 à < 120 | 120 < 180 | > 180 | Mentionné dans Crittenden et coll. (2012) |
| S.O. | 0–60 | 61–120 | 121–180 | > 180 | USGS (2018) |
| S.O. | S.O. | 60–120 | 120–180 | > 180 | Droste (2019) |
|
|||||
En raison de la relation entre le calcium, le magnésium et la dureté, les spécialistes convertissent souvent les concentrations de calcium et de magnésium en équivalent CaCO3, qui est l'unité de mesure standard de la dureté. Pour exprimer la concentration de calcium en mg/L de CaCO3, on multiplie la concentration de calcium par 2,5 (d'après le ratio molaire). De même, pour exprimer la concentration de magnésium en mg/L de CaCO3, on multiplie la concentration de magnésium par 4,1 (d'après le ratio molaire).
L'acceptation de la dureté par le public varie considérablement selon les conditions locales, la tolérance du public, le pH et la température de l'eau. Les consommateurs peuvent s'habituer à des niveaux de dureté élevés dans leur eau. Une eau dont la dureté est supérieure à 200 mg/L est considérée comme mauvaise, mais elle est tolérée par les consommateurs; une eau dont la dureté est supérieure à 500 mg/L est inacceptable pour de nombreux usages domestiques et peut nécessiter un adoucissement. La palatabilité de l'eau dépend également de la composition ionique de celle-ci. L'adoucissement de l'eau par échange d'ions de sodium peut introduire des quantités élevées et indésirables de sodium dans l'eau potable. Il est donc recommandé de ne pas adoucir une partie de l'eau qui sert le plus souvent à la consommation (c.-à-d. l'eau du robinet de la cuisine) afin d'éviter un apport excessif en sel.
Les préoccupations d'ordre esthétique liées à la dureté de l'eau sont attribuables à la tendance des ions responsables de la dureté à précipiter (principalement sous forme de sels d'hydroxyde et de carbonate) et à former des dépôts ou incrustations à l'intérieur des conduites d'eau chaude et des chauffe-eau. Ce phénomène est généralement lié au pH et à la température. Ces deux caractéristiques modifient la solubilité du calcium et du magnésium et peuvent entraîner une sursaturation de la solution, ce qui provoque leur précipitation. Il peut alors en résulter une turbidité ou des particules visibles à l'œil nu. Selon le principal élément chimique responsable de la dureté, les consommateurs peuvent également constater une coloration de l'eau. Les dépôts de calcium et de magnésium sont généralement de couleur blanche.
Même si la dureté est causée par des cations multivalents, on parle souvent de dureté carbonatée et de dureté non carbonatée. La dureté carbonatée concerne la quantité de carbonates (CO32-) et de bicarbonates (HCO3-) qui peut être précipitée par chauffage. Ce type de dureté est responsable de l'incrustation des conduites d'eau chaude et des bouilloires. La dureté non carbonatée est due à l'association des cations responsables de la dureté avec les sulfates (SO4-), les chlorures (Cl-) et les nitrates (NO3-), ainsi que les sels de calcium et de magnésium tels que le sulfate de calcium (CaSO4), le chlorure de calcium (CaCl2), le chlorure de magnésium (MgCl2) et le sulfate de magnésium (MgSO4) (AWWA, 2016). Les substances responsables de la dureté non carbonatée sont plus facilement maintenues en solution, mais elles participent tout de même à l'inhibition du savonnage (Crittenden et coll., 2012).
Les responsables de systèmes d'approvisionnement en eau potable peuvent déterminer la quantité de CaCO3 qui précipitera le calcium en utilisant le potentiel de précipitation du carbonate de calcium (CCPP) pour prévoir le potentiel d'incrustation (Schock et Lytle, 2011; Tang et coll., 2021). Ce potentiel peut être calculé à l'aide de divers programmes informatiques ou d'applications utilisant des chiffriers électroniques (RTW, 2008; AWWA, 2017; APHA et coll., 2018).
Dans les régions où l'eau est dure, les tuyaux domestiques peuvent être obstruées par les incrustations (Coleman, 1976). L'eau dure peut également incruster les ustensiles de cuisine et augmenter la consommation de savon. L'eau dure est donc à la fois un désagrément et un fardeau économique pour le consommateur.
L'eau dure est généralement moins corrosive que l'eau douce (Letterman et American Water Works Association, 1999). Il a été indiqué qu'une dureté comprise entre 80 mg/L et 100 mg/L de CaCO3 assure un équilibre acceptable entre la corrosion et l'incrustation (Bean, 1968). D'autres seuils gustatifs pour les constituants mineurs de la dureté sont présentés dans les recommandations pour la qualité de l'eau potable concernant le manganèse et le fer (Santé Canada, 2019, 2023).
L'alcalinité sert à contrôler l'intensité du pouvoir tampon dans la plupart des systèmes d'approvisionnement en eau potable. Elle est étroitement liée à la dureté et est exprimée en milligrammes de CaCO3 par litre (mg/L de CaCO3). Comme l'alcalinité de la plupart des eaux de surface canadiennes est due à la présence de carbonates et de bicarbonates, leur alcalinité est semblable à leur dureté (Thomas, 1953).
La dureté peut également être mesurée en grains par gallon, où un grain par gallon est équivalant à 17,1 mg/L de CaCO3 (annexe E).
1.1.2 Chlorures et sulfates
Les chlorures sont largement répandus dans la nature, généralement sous forme de sels de sodium (NaCl) et de potassium (KCl); ils constituent environ 0,05 % de la lithosphère. Ce sont les océans qui
contiennent de loin la plus grande quantité de chlorures dans l'environnement. Des gisements souterrains de sel ont été découverts dans la plupart des provinces canadiennes. On trouve des gisements en couches dans le sud-ouest de l'Ontario, en Saskatchewan et en Alberta, et des gisements en dôme en Nouvelle-Écosse, au Nouveau-Brunswick, en Ontario, au Manitoba, en Saskatchewan et en Alberta.
Chapra et ses collaborateurs (2012) ont décrit les tendances à long terme des principaux ions dans le système des Grands Lacs. Ils ont noté que les concentrations minimales de chlorure dans le lac Ontario et le lac Érié ont été atteintes vers 1995 et 1985, respectivement, et qu'elles ont augmenté lentement au cours des années suivantes. La Commission géologique du Canada (2014) a constaté que les concentrations de chlorures avaient augmenté dans les puits municipaux urbains et que des concentrations de chlorures aussi élevées que 14 000 mg/L ont été trouvées dans les eaux souterraines peu profondes près des autoroutes à Toronto en raison de l'utilisation de sel de voirie pendant l'hiver. Les concentrations de chlorures dans toute la zone supérieure des Grands Lacs ont augmenté de façon constante depuis les années 1960. La tendance à l'augmentation des concentrations de chlorures a été observée dans toute l'Amérique du Nord (Kaushal et coll., 2018).
Les sulfates sont présents à l'état naturel dans de nombreux minéraux, dont la baryte (BaSO4), l'epsomite (MgSO4·7H2O) et le gypse (CaSO4·2H2O). Les sulfates sont évacués dans le milieu aquatique avec les rejets des industries qui emploient des sulfates et de l'acide sulfurique, notamment les mines et les fonderies, les usines de pâtes et papiers kraft, les usines de textiles et les tanneries. Le sulfate d'aluminium (alun) sert de coagulant dans le traitement de l'eau potable, et le sulfate de cuivre est utilisé pour combattre les algues bleues (cyanobactéries) dans les eaux brutes et les systèmes publiques d'approvisionnement en eau potable aux États-Unis. Les concentrations de sulfates diminuent lentement dans les lacs Érié et Ontario en raison de la réduction des effets des pluies acides causées par les activités industrielles. Dans les autres Grands Lacs (Michigan, Huron et Supérieur), les concentrations de sulfates sont restées stables au cours des 50 dernières années (Chapra et coll., 2012).
Le dioxyde de soufre (SO2) atmosphérique, formé par la combustion de combustibles fossiles et par les procédés de grillage utilisés en métallurgie, peut également contribuer à la teneur en sulfates des eaux de surface. Des sulfates ou des produits à base d'acide sulfurique servent aussi dans la fabrication de nombreux produits chimiques, teintures, verres, papiers, savons, textiles, fongicides, insecticides, agents astringents et émétiques. Ils sont également utilisés dans les industries minière, papetière, de la métallurgie et du placage, dans le traitement des eaux usées et dans le traitement du cuir.
| Propriété | Chlorure | Interprétation | Sulfate | Interprétation |
|---|---|---|---|---|
| Numéro CAS | 16887-00-6 | S.O. | 14808-79-8 | S.O. |
| Formule moléculaire | Cl- | S.O. | SO4-2 | S.O. |
| Masse molaire (g/mol) | 35,45 | S.O. | 96,064 | S.O. |
| Point de fusion | 101 °C | S.O. | S.O. | S.O. |
| Point d'ébullition | S.O. | S.O. | S.O. | S.O. |
| Masse volumique à la température ambiante | S.O. | S.O. | S.O. | S.O. |
| Solubilité | 6,3 mg/mL à 25 °C | Solubilité élevée | S.O. | S.O. |
|
||||
Des études ont montré que les chlorures et les sulfates ont un effet sur la corrosion des réseaux de distribution, en particulier sur la corrosion des conduites et des composants métalliques. Le ratio de masse chlorure/sulfate (RCS) sert d'indicateur du potentiel de corrosion galvanique, en particulier pour le plomb. Dudi et Edwards (2004) ont démontré de manière concluante qu'un RCS supérieur à 0,58 augmentait le relargage du plomb à partir du laiton à cause des connexions galvaniques. Il existe de plus amples renseignements sur le contrôle de la corrosion (Santé Canada, 2022a). L'indice de Larson (soit le ratio entre la somme de chlorure et de sulfate et le bicarbonate) est également important, un ratio élevé signifiant que l'eau est plus corrosive pour le fer (Larson et Skold, 1958). On a également constaté que les sulfates sont des nutriments qui jouent un rôle dans la croissance microbienne, soit en servant de carburant aux microorganismes, soit en consommant les résidus de désinfectants dans les réseaux de distribution. Pour de plus amples renseignements, consulter le document « Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution » (Santé Canada, 2022b).
Les chlorures et les sulfates peuvent jouer un rôle dans la dureté de l'eau en contribuant à la stabilité de la dureté non carbonatée. La dureté non carbonatée peut être due aux sels de chlorure de calcium, de sulfate de calcium, de chlorure de magnésium ou de sulfate de magnésium, qui sont titrés avec de l'acide éthylènediaminetétracétique (EDTA) pour déterminer la dureté de l'eau, mais ils ne sont pas considérés comme responsables de l'incrustation. Ils ne précipitent pas lorsqu'ils sont chauffés, mais ils nuisent au moussage du savon. Les sels de chlorure ou de sulfate de baryum ou de strontium contribuent aussi quelque peu à la dureté non carbonatée.
Il est très fréquent d'observer des concentrations élevées de chlorures dans l'eau potable provenant de sources souterraines. La présence de chlorures dans les sources d'eau potable peut être attribuée à diverses causes : dissolution des dépôts de sel, épandage de sels de voirie pour faire fondre la glace et la neige, effluents des industries chimiques, exploitation des puits de pétrole, eaux usées, drainage et irrigation, lixiviats de déchets, émanations volcaniques, embruns et intrusion d'eau de mer dans les zones côtières. Chacune de ces sources peut entraîner une contamination locale des eaux de surface et des eaux souterraines. Les ions chlorure sont très mobiles et finissent par être transportés dans des bassins fermés ou dans les océans.
Le chlorure de sodium est largement utilisé dans la production de substances chimiques industrielles comme la soude caustique (hydroxyde de sodium), le chlore, la soude (carbonate de sodium), la chlorite de sodium, le bicarbonate de sodium et l'hypochlorite de sodium. Au Canada, le chlorure de sodium et, dans une moindre mesure, le chlorure de calcium (CaCl2) servent au déneigement et au déglaçage. La quantité utilisée annuellement est estimée à environ 5 millions de tonnes de sel en hiver (Environnement et Changement climatique Canada, 2022). Une grande partie de ce sel de voirie pénètre directement dans les plans d'eau de surface locaux lors de la fonte printanière (Pieper et coll., 2018). Cependant, il a été démontré qu'une partie du sel s'accumule dans les sols et les formations géologiques en subsurface. Il en résulte une libération tardive dans le milieu aquatique environnant au cours des saisons suivantes et donc des concentrations élevées de sodium et de chlorures tout au long de l'année (Robinson et coll., 2017). La contamination de l'eau potable par les sels de voirie est généralement limitée aux puits situés à proximité des routes revêtues et des zones d'épandage intensif, et elle dépend de la topographie environnante (Commission géologique du Canada, 2014).
Les sels de sulfate de sodium, de potassium et de magnésium sont tous solubles dans l'eau, alors que les sulfates de calcium et de baryum et les sulfates de métaux lourds ne le sont pas. Les sulfates sont présents à l'état naturel dans de nombreux minéraux, dont la baryte (BaSO4), l'epsomite (MgSO4·7H2O) et le gypse (CaSO4·2H2O). L'interconversion réversible des sulfates et des sulfures dans le milieu naturel est connue sous le nom de « cycle du soufre ». Les sulfates sont évacuées dans le milieu aquatique avec les rejets des industries qui emploient des sulfates et de l'acide sulfurique, notamment les mines et les fonderies, les usines de pâtes et papiers kraft, les usines de textiles et les tanneries.
1.1.3 Matières dissoutes totales (MDT)
Les MDT représentent la somme de toutes les substances dissoutes (matières ioniques, moléculaires et colloïdales) présentes dans un échantillon d'eau. Les principaux ions contribuant aux MDT sont le calcium, le magnésium, le sodium, les chlorures et les sulfates.
Les MDT présentes dans les approvisionnements d'eau proviennent de sources naturelles, des égouts, du ruissellement urbain et agricole, et des eaux usées industrielles (Droste, 1997). La concentration de MDT dépend de la solubilité du sol et de la roche ainsi que du temps de contact, qui peut varier selon les saisons dans certains aquifères. Au Canada, les sels de voirie utilisés pour le déglaçage des routes peuvent contribuer de manière significative à la charge en MDT des approvisionnements d'eau (Chapra et coll., 2012).
L'eau contenant moins de 1 000 mg/L de MDT est considérée comme de l'eau douce, tandis que l'eau dont la concentration de MDT est comprise entre 1 000 mg/L et 10 000 mg/L est considérée comme de l'eau saumâtre (Crittenden et coll., 2012). La concentration de MDT dans l'eau varie en fonction de la solubilité des divers minéraux dans diverses régions géologiques. La concentration de MDT dans l'eau en contact avec du granité, du sable siliceux, un sol bien lessivé ou d'autres matières relativement insolubles peut être inférieure à 30 mg/L.
Les MDT sont généralement associées à des concentrations élevées d'ions qui augmentent la conductivité de l'eau et peuvent perturber la formation d'un film protecteur (Letterman et American Water Works Association, 1999). Lorsque la dureté est le principal facteur contribuant aux MDT, l'eau peut être corrosive pour le cuivre. Lorsque les sulfates et les chlorures sont les principaux anions contribuant aux MDT, l'eau peut être corrosive pour les matériaux à base de fer (Letterman et American Water Works Association, 1999). Une teneur élevée en MDT peut également entraîner l'incrustation des réseaux de distribution et des appareils électroménagers (Van der Aa, 2003).
1.1.4 Sulfure d'hydrogène
Le sulfure d'hydrogène (H2S) est un gaz naturel produit par la décomposition des matières organiques en l'absence d'oxygène; il peut également se former par réduction directe des sulfates par des bactéries sulfato-réductrices. Le sulfure d'hydrogène est largement présent dans les sédiments et l'eau, ainsi que dans les déchets biologiques.
On estime que les sources naturelles représentent 60 % à 90 % du sulfure d'hydrogène présent dans l'atmosphère de la planète (U.S. EPA, 1993a; Watts, 2000). Le sulfure d'hydrogène est produit naturellement par la réduction bactérienne non spécifique et anaérobie des sulfates et des composés organiques contenant du soufre, tels les protéines et les acides aminés (Hill, 1973). Il est présent à l'état naturel dans le pétrole brut, le gaz naturel, les gaz volcaniques et les sources chaudes, et il est libéré principalement sous forme de gaz. Le sulfure d'hydrogène est également présent naturellement dans divers milieux environnementaux, notamment les sédiments aquatiques anaérobies et les eaux souterraines, en raison principalement de la réduction bactérienne d'autres formes de soufre.
| Propriété | Sulfure d'hydrogène | Interprétation |
|---|---|---|
| Numéro CAS | 7783-06-4 | S.O. |
| Formule moléculaire | H2S | S.O. |
| Masse molaire (g/mol) | 35,45 | S.O. |
| Point de fusion (°C) | -85,49 | S.O. |
| Point d'ébullition (°C) | -60,33 | S.O. |
| Masse volumique à la température ambiante | 1,5392 g/L à 0 °C et 760 mm Hg | S.O. |
| Solubilité | 3 980 mg/L à 20 °C | Solubilité élevée |
|
||
Le sulfure d'hydrogène peut être libéré à la suite d'activités agricoles et de procédés industriels. Ces rejets comprennent ceux qui sont des sous-produits des activités du secteur pétrolier, car le gaz naturel et les gaz associés au pétrole brut contiennent du sulfure d'hydrogène à des concentrations allant de quantités traces jusqu'à 70% à 80 % par volume (Pouliquen et coll., 1989; Environnement Canada, 2004a). Le sulfure d'hydrogène peut également être produit lors de la fracturation hydraulique (Kahrilas et coll., 2015; Marriott et coll., 2016). Parmi les autres sources anthropiques, mentionnons le stockage du lisier liquide (Blunden et Aneja, 2008; Kim et coll., 2008), les usines de pâtes et papiers kraft (Teschke et coll., 1999; IPCS, 2003; ATSDR, 2006; Janssen et coll., 2009), les décharges (IPCS, 2003; ATSDR, 2006; Kim, 2006), la décomposition des déchets organiques lors du traitement des eaux usées (Muezzinoglu, 2003) et d'autres procédés industriels, dont le raffinage des métaux (MEO, 2007; INRP, 2023). Les rejets dans l'environnement se font surtout sous forme d'émissions dans l'air ambiant, quoique les sulfures (y compris le sulfure d'hydrogène) puissent également être évacués dans l'eau dans des conditions environnementales précises.
Lorsqu'il réagit avec les ions métalliques, le sulfure d'hydrogène peut accélérer la corrosion, qui peut devenir apparente quelques mois plus tard seulement. Le sulfure d'hydrogène peut réagir avec les tuyaux en fer, en acier et en cuivre ainsi qu'avec les tuyaux galvanisés et former des eaux noires, même en l'absence d'oxygène (Schock et Lytle, 2011). Des études ont montré que, dans certaines eaux, le sulfure d'hydrogène joue un rôle dans la dégradation des tuyaux en béton et en amiante-ciment (LeRoy et coll., 1996; Vollertsen et coll., 2008; Correa et coll., 2010; Radlinksi et Wolf, 2016).
1.2 Exposition
Des données de surveillance des eaux canadiennes ont été obtenues des provinces (sources municipales et non municipales). Aucune donnée n'a été reçue des territoires. Les données provenaient de divers approvisionnements d'eau au Canada, à savoir des eaux de surface et des eaux souterraines, ainsi que de l'eau traitée et distribuée ayant fait l'objet d'une surveillance (British Columbia Ministry of Health, 2021; ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario, 2021; ministère du Développement durable du Manitoba, 2021; ministère de l'Environnement et de la Lutte contre les changements climatiques du Québec, 2021; ministère de l'Environnement de la Nouvelle-Écosse, 2021; Saskatchewan Water Security Agency, 2021; ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard, 2021; ministère de la Santé du Nouveau-Brunswick, 2021; ministère des Affaires municipales et de l'Environnement de Terre-Neuve-et-Labrador, 2021). Les données d'exposition fournies reflètent les différentes limites de détection (LD) des laboratoires accrédités utilisées par les secteurs de compétence, ainsi que leurs programmes de surveillance respectifs. Par conséquent, l'analyse statistique des données d'exposition ne fournit qu'une vue partielle de la situation.
Les concentrations des paramètres étudiés dans les eaux souterraines brutes sont généralement plus élevées que dans les eaux de surface brutes. Les concentrations dans les eaux souterraines brutes sont présentées dans les tableau 5 et 6. Les tableaux complets pour chaque paramètre dans différents types d'eau sont présentés à l'annexe B.
En général, les niveaux mesurés de calcium, de magnésium, de dureté, de chlorures, de sulfates et de MDT étaient plus élevés dans les eaux souterraines brutes que dans les eaux de surface brutes. Toutefois, il convient de noter qu'en Saskatchewan, les eaux de surface brutes présentaient généralement des niveaux plus élevés de calcium, de magnésium, de dureté, de sulfates et de MDT que les eaux souterraines brutes. Dans les puits privés, on a constaté des tendances semblables à celles de l'eau brute provenant des services d'eau publics. Pour plusieurs paramètres, on a observé des fluctuations entre l'eau traitée et l'eau distribuée.
Les valeurs médianes pour le calcium et les chlorures étaient généralement inférieures aux valeurs basées sur la santé (VBS) déterminées pour ces substances, qui sont respectivement de 300 mg/L et de 470 mg/L (voir la section 3.0). Cependant, dans la plupart des provinces (Colombie-Britannique, Manitoba, Terre-Neuve, Nouvelle-Écosse, Ontario, Île-du-Prince-Édouard, Québec et Saskatchewan), la valeur maximale enregistrée pour le calcium dépassait la VBS. Pour les chlorures, la valeur maximale observée dans chaque province dépassait la VBS. Des données de surveillance limitées ont été fournies pour le sulfure d'hydrogène.
Province |
Calcium (mg/L) |
Magnésium (mg/L) |
Dureté (mg/L de CaCO3) |
Chlorures (mg/L) |
Sulfates (mg/L) |
MDT (mg/L) |
Sulfures (mg/L) |
|---|---|---|---|---|---|---|---|
| Colombie-Britannique | 59,1 | 13,2 | 215 | 6,3 | 29,7 | S.O. | S.O. |
| Manitoba | 73,7 | 40 | 368 | 18,4 | 60,4 | 521 | S.O. |
| Nouveau-Brunswick | 27,4 | 3,9 | 92 | 35,6 | 15 | 131 | 0.05 |
| Terre-Neuve | 27,5 | 6 | 96 | 25,5 | 8 | 181 | S.O. |
| Nouvelle-Écosse | 33,8 | 5,8 | 120 | 30 | 13 | 202 | 0,05 |
| Ontario | 85,7 | 25,3 | 320 | 70,3 | 34 | 448 | 0,03 |
| Île-du-Prince-Édouard | 36,6 | 12,5 | 159 | 18,5 | 7,8 | 208 | S.O. |
| Saskatchewan | 128 | 50,5 | 532 | 13,2 | 320 | 1 210 | S.O. |
|
|||||||
| Province | Calcium (mg/L) |
Magnésium (mg/L) |
Dureté (mg/L de CaCO3) |
Chlorures (mg/L) |
Sulfates (mg/L) |
MDT (mg/L) |
Sulfures (mg/L) |
|---|---|---|---|---|---|---|---|
| Colombie-Britannique | 59,1 | 12,9 | 234,5 | 6,4 | 32,6 | S.O. | S.O. |
| Nouvelle-Écosse | 27 | 4 | 98 | 21 | 11 | 180 | S.O. |
| Île-du-Prince-Édouard | 32,5 | 13,1 | 136,4 | 14,8 | 6,4 | 214 | S.O. |
| Québec | 44,3 | 10,9 | 166 | 91,2 | 40,7 | 684 | 0,075 |
|
|||||||
Santé Canada a réalisé plusieurs enquêtes ciblées sur l'eau potable dans lesquelles elle a mesuré ces paramètres opérationnels (annexe C; Santé Canada, 2022c).
- Les données de l'Enquête nationale sur l'eau potable menée en 2009–2010 par Santé Canada figurent à l'annexe C.1.
- En 2007, une enquête ciblée a été menée auprès d'installations de traitement de l'eau alimentées par des sources d'eau à forte teneur en bromure. Dans le cadre de cette enquête, des données sur le calcium, le magnésium, la dureté, les chlorures, les sulfates et les MDT ont également été recueillies, et les résultats figurent à l'annexe C.2.
- En 2012–2013, une enquête nationale ciblée a été menée auprès d'installations de traitement de l'eau alimentées par des sources d'eau à forte teneur en sodium et en ammonium naturellement présent, dans lesquelles des chloramines étaient utilisées. Dans le cadre de cette enquête, des données sur le calcium, le magnésium, la dureté, les chlorures, les sulfates et les MDT ont également été recueillies, et les résultats figurent à l'annexe C.3.
Il existe des cartes hydrogéologiques montrant les niveaux de calcium, de magnésium, de dureté, de chlorures, de sulfates et de MDT dans les eaux de surface et les eaux souterraines (ministère des Pêches et de l'Environnement, 1978a, 1978b, 1978c). Un aperçu détaillé des eaux souterraines du Canada est également disponible (Commission géologique du Canada, 2014).
2.0 Considérations relatives à la santé
2.1 Calcium, magnésium et dureté
2.1.1 Essentialité
Le magnésium et le calcium, les deux principaux cations responsables de la dureté de l'eau, sont des minéraux essentiels et bénéfiques pour la santé humaine à maints égards (IOM, 1997, 2011; Silva et coll., 2019). Les autres minéraux essentiels qui contribuent à la dureté de l'eau sont le cuivre, le fer, le manganèse et le zinc (Silva et coll., 2019; Water Resources, 2019). L'aluminium, le baryum, le cadmium et le plomb contribuent également à la dureté de l'eau, mais ce sont des éléments non essentiels (Exley, 2013; Chellan et Sadler, 2015; Water Resources, 2019). Le strontium est probablement un oligo-élément non essentiel (Bain et coll., 2009; Zhao et coll., 2015).
Le magnésium agit comme cofacteur dans plus de 300 réactions enzymatiques, et il joue un rôle indispensable dans l'homéostasie électrolytique ainsi que dans la synthèse des glucides, des lipides, des acides nucléiques et des protéines. Il est nécessaire à certaines fonctions précises dans divers organes, par exemple dans les systèmes cardiovasculaire et neuromusculaire (Wacker et Parisi, 1968; Cowan, 2002; Romani, 2013; EFSA, 2015a).
Le calcium joue un rôle important dans plusieurs fonctions physiologiques, dont la formation et la résorption des os, la médiation de la contraction vasculaire et de la vasodilatation, la fonction musculaire, la transmission nerveuse, la signalisation intracellulaire, la coagulation sanguine et la sécrétion hormonale (Campbell, 1990; Brown, 1991; Peacock, 2010; IOM, 2011; EFSA, 2015b).
Une carence en magnésium et en calcium peut nuire à la santé humaine, tandis qu'un apport accru se traduit généralement par des effets bénéfiques pour la santé. La carence en magnésium serait liée à un risque accru de maladie cardiovasculaire, d'hypertension, de diabète, d'ostéoporose, de cancer ainsi que de troubles rénaux et gastro-intestinaux (Tucker et coll., 1999; Anastassopoulou et Theophanides, 2002; Catling et coll., 2008; Rude et coll., 2009; Dong et coll., 2011; Rodríguez-Morán et coll., 2011; Kass et coll., 2012; Del Gobbo et coll., 2013; EFSA, 2015a; Zhang et coll., 2016; Rapant et coll., 2019). Une hypocalcémie et une hypokaliémie peuvent également survenir, ce qui peut entraîner des symptômes neurologiques ou cardiaques en présence d'une hypomagnésémie marquée (< 0,5 mmol/L) (EFSA, 2015a). La perte d'appétit, la fatigue, les spasmes musculaires et la faiblesse peuvent être des signes de carence en magnésium (Bowman et Russell, 2006).
Si l'apport alimentaire en calcium ne suffit pas à répondre aux besoins physiologiques, le squelette libère du calcium (résorption osseuse) afin de maintenir les concentrations sanguines dans la fourchette requise par les fonctions cellulaires et tissulaires normales. Il peut en résulter un rachitisme, de l'ostéomalacie, de l'ostéoporose et un risque accru de fractures (EFSA, 2015b). Un apport insuffisant en calcium a également été associé à un risque accru de calculs rénaux, de cancer colorectal, d'hypertension et d'accident vasculaire cérébral, de maladie coronarienne, de résistance à l'insuline et d'obésité (OMS, 2011).
2.1.2 Effets bénéfiques
Selon certains auteurs, la consommation d'eau dure assurerait une protection contre l'ostéoporose, le déclin des fonctions cognitives chez les personnes âgées, un faible poids à la naissance, divers cancers et le diabète sucré (Burton et Comhill, 1977; Yang et coll., 1997, 1998, 1999, 2000a; Rosborg et Kozisek, 2020). Un apport supérieur en magnésium ou en calcium aurait un effet protecteur contre les maladies cardiovasculaires, les accidents vasculaires cérébraux, la prééclampsie chez les femmes enceintes, l'hypertension et le syndrome métabolique (Melles et Kiss, 1992; Catling et coll., 2008; Nie et coll., 2013; Poursafa et coll., 2014; Chen et coll., 2015; Khan et coll., 2015; Moore-Schiltz et coll., 2015; Anderson et coll., 2016; Hofmeyr et coll., 2018; Cormick et coll., 2022).
Un apport accru en magnésium et en calcium assurerait également une protection contre divers cancers, notamment le cancer colorectal, le cancer de la prostate, le cancer du sein, le cancer de l'ovaire et le cancer du foie (Yang et coll., 2000a, 2000b; Kesse et coll., 2006; Chen et coll., 2010; Keum et coll., 2014; Aune et coll., 2015; Bonovas et coll., 2016; Hidayat et coll., 2016; Song et coll., 2017; Wesselink et coll., 2020; Zhong et coll., 2020; Shah et coll., 2021). Un apport accru en calcium a un effet positif sur la santé des os, car cela augmente la densité minérale osseuse, réduit les taux d'hormone parathyroïdienne circulante et les marqueurs du renouvellement osseux, et diminue le risque de fractures (Guillemant et coll., 2000; Meunier et coll., 2005; Silk et coll., 2015; Tai et coll., 2015; Weaver et coll., 2016; Liu et coll., 2020).
2.1.3 Effets nocifs
La dureté, le magnésium et le calcium ont un faible potentiel de toxicité par l'intermédiaire de l'eau potable chez l'humain. Des effets nocifs associés à un apport excessif en magnésium ou en calcium, ou encore à des niveaux élevés de dureté ont rarement été rapportés (OMS, 2009, 2011; Cotruvo et coll., 2017). Aucun effet nocif n'a été associé à l'ingestion de magnésium provenant de sources alimentaires; toutefois, la prise de suppléments de magnésium à une dose supérieure à l'apport quotidien recommandé peut entraîner des symptômes tels qu'une diarrhée osmotique (IOM, 1997; OMS, 2009, 2011). Une eau à très forte teneur en magnésium, associée à une forte teneur en sulfates (concentrations combinées > 400 mg/L), peut provoquer une diarrhée transitoire (Rosborg et Kozisek, 2020). Une eau à très forte teneur en magnésium (associée à un niveau élevé de MDT) peut augmenter le risque de calculs rénaux et d'autres types de calculs ainsi que de problèmes d'arthrite (Kozisek, 2020). Les symptômes d'un excès de magnésium peuvent inclure une altération de l'état mental, des diarrhées, une perte d'appétit, une faiblesse musculaire, des difficultés respiratoires, une pression artérielle basse et un rythme cardiaque irrégulier. Toutefois, les effets nocifs associés à l'ingestion de magnésium sont très probablement dus à un excès de magnésium dû à la prise de suppléments, et ils ne se produisent généralement pas chez les personnes dont la fonction rénale est normale (OMS, 2009, 2011; Rosborg et Kozisek, 2020). De même, il est difficile, voire impossible, d'obtenir un apport excessif en calcium uniquement à partir de la consommation d'aliments, et il est peu probable qu'une hypercalcémie survienne en cas d'apport élevé en calcium uniquement à partir de l'alimentation, en raison d'un mécanisme d'absorption intestinale étroitement régulé, l'excès de calcium étant excrété par les reins (OMS, 2009, 2011; IOM, 2011). L'apport excessif en calcium et l'hypercalcémie peuvent être provoqués par la prise de suppléments à forte teneur en calcium, en particulier lorsqu'ils sont accompagnés de suppléments de vitamine D, car ceux-ci peuvent augmenter l'absorption du calcium (Aloia et coll., 2014; EFSA, 2015b). La prise de calcium provenant de suppléments au-delà de l'apport maximal tolérable (AMT) (1 000 à 3 000 mg par jour selon le stade de vie) augmente le risque d'hypercalcémie, d'hypercalciurie, de calcification vasculaire et des tissus mous, de calculs rénaux, de cancer de la prostate, de constipation, et d'interactions avec le fer et le zinc (IOM, 2011). Les symptômes cliniques d'une hypercalcémie persistante sont la fatigue, la faiblesse musculaire, l'anorexie, les nausées, les vomissements, la constipation, l'arythmie tachycardique, la calcification vasculaire et des tissus mous, le retard de croissance et la perte de poids (EFSA, 2015b). L'hypercalcémie peut provoquer une insuffisance rénale ainsi qu'une calcification vasculaire et des tissus mous, dont une calcinose conduisant à une néphrocalcinose et à des calculs rénaux (IOM, 2011). L'exposition cutanée à une eau très dure peut exacerber la dermatite atopique (McNally et coll., 1998; Miyake et coll., 2004; Perkin et coll., 2016).
2.1.4 Génotoxicité et cancérogénicité
La mutagénicité du magnésium et du calcium a été jugée négligeable en présence ou pas du mélange S9 par Fujii et ses collaborateurs (2016), qui ont réalisé un test d'Ames en utilisant 0,031 à 0,25 mol/L de Mg(II) et 0,031 mol/L à 0,25 mol/L de Ca(II), avec Salmonella typhimurium TA100 comme souche bactérienne. Sanders et ses collaborateurs (2015) ont eu recours au test des comètes pour évaluer la génotoxicité du sulfate de magnésium sur des cellules de phéochromocytome (PC-12) cultivées à partir de la médullaire de la glande suprarénale de rat. Ils ont observé une augmentation, liée à la concentration, des dommages à l'ADN, avec un pourcentage de dommages de 8,1 % à la concentration de 5,01 µg/mL. À 50,01 µg/mL, le pourcentage de dommages à l'ADN était de 10,8 %.
Ribeiro et ses collaborateurs (2004) ont étudié le potentiel génotoxique de l'hydroxyde de calcium en réalisant le test des comètes sur des cellules de lymphome de souris et des fibroblastes humains. Les résultats ont montré que l'hydroxyde de calcium, à des concentrations de 20 µg/mL à 80 µg/mL, ne provoquait pas de dommages à l'ADN dans les cellules de mammifères.
Le magnésium semble jouer un rôle protecteur aux premiers stades de la cancérogenèse, mais il contribue à la prolifération des tumeurs existantes aux stades plus avancés (Anastassopoulou et Theophanides, 2002). Cela s'explique par le fait que le magnésium est nécessaire à la prolifération cellulaire. Dans les cellules néoplasiques, le magnésium intracellulaire augmente (en raison d'une diminution de l'affinité de liaison), et la synthèse des protéines et de l'ADN est favorisée (Leidi et coll., 2011). Parsons et ses collaborateurs (1974) ont rapporté que le maintien d'une concentration de magnésium plasmatique inférieure à 0,8 mg/100 mL chez des patients qui avaient déjà une tumeur entraînait généralement une régression de la tumeur.
Dans une étude portant sur 142 520 hommes adultes européens, une consommation élevée de calcium provenant de produits laitiers (mais pas d'autres aliments) a été positivement associée au risque de cancer de la prostate (Allen et coll., 2008). L'association entre la consommation de calcium présent dans les produits laitiers et le risque de cancer de la prostate découle probablement de sa forte corrélation avec d'autres aspects des produits laitiers, en particulier les protéines (Allen et coll., 2008).
2.2 Chlorures et sulfates
2.2.1 Essentialité
Les chlorures et les sulfates sont des composés essentiels. Les chlorures contribuent à la production d'acide chlorhydrique gastrique, à l'activité électrique en général (p. ex. l'activité musculaire et myocardique), au maintien de la pression artérielle et de la fonction rénale, ainsi qu'à l'équilibre volumétrique et électrolytique des liquides corporels (Kataoka, 2021). Les chlorures jouent également un rôle central dans le transport de l'oxygène, les échanges gazeux et la régulation de la rénine produite par l'appareil juxtaglomérulaire (McCallum et coll., 2015; Kataoka, 2021). Les cas de carence alimentaire en chlorures sont rares. De faibles apports en chlorure ont été décrits chez deux nourrissons allaités dont le lait maternel était déficient en chlorure, chez des nourrissons ayant reçu des préparations déficientes en chlorure, et chez des patients enfants et adultes ayant consommé des produits nutritionnels liquides déficients en chlorure (Asnes et coll., 1982; Hill et Bowie, 1983; Rodriguez-Soriano et coll., 1983; Kaleita, 1986; Miyahara et coll., 2009). Chez les nourrissons, l'hypochlorémie se caractérise par un retard de croissance, une léthargie, une irritabilité, une anorexie, des symptômes gastro-intestinaux, une faiblesse, une alcalose métabolique hypokaliémique et une hématurie (Gross et coll., 1980).
Les sulfates inorganiques sont nécessaires à la synthèse du 3'-phosphoadénosine-5'-phosphosulfate (PAPS). Le PAPS, également connu sous le nom de « sulfate actif », est nécessaire à la biosynthèse de nombreux composés essentiels contenant du soufre dans l'organisme, notamment la chondroïtine sulfate, le cérébroside sulfate, le dermatane sulfate, lhéparine sulfate, la tyrosine-O-sulfate, le taurolithocholate sulfate (sel biliaire) et l'œstrone 3-sulfate. Il existe des centaines de composés contenant du soufre dans le corps humain et ce dernier les synthétise tous, à l'exception des vitamines thiamine et biotine (IOM, 2005). Les besoins en sulfates sont satisfaits lorsque les apports atteignent les concentrations recommandées d'acides aminés soufrés, car la principale source de sulfates inorganiques pour l'humain provient du renouvellement des protéines corporelles, processus dans lequel interviennent les acides aminés soufrés que sont la méthionine et la cystéine. Ainsi, on ne trouve pas de carence en sulfates chez les personnes dont l'apport en protéines et en acides aminés soufrés est adéquat (IOM, 2005). Toutefois, une carence en sulfates peut diminuer la coagulation sanguine et la stabilité des vaisseaux sanguins, et un faible apport par l'entremise de l'eau potable peut contribuer à la constipation (Rosborg et Kozisek, 2020).
2.2.2 Effets bénéfiques
Des études d'observation ont montré une association inverse (c.-à-d. un effet protecteur) entre la concentration de chlorure sérique et la mortalité, toutes causes confondues, chez les patients hypertendus. Une concentration de chlorure sérique inférieure à 100 milliéquivalents par litre (mEq/L) a été associée à un risque accru de mortalité (mortalité toutes causes confondues, mortalité d'origine cardiovasculaire et mortalité d'origine autre que cardiovasculaire). Une réduction de 1,5 % de la mortalité toutes causes confondues a été observée pour chaque augmentation de 1 mEq/L de la concentration de chlorure sérique (McCallum et coll., 2013). Cependant, la concentration de chlorure sérique ne peut pas être utilisée comme marqueur de l'apport en chlorures, et il n'existe aucune étude sur le lien entre l'apport en chlorures ou l'excrétion urinaire de chlorures et les maladies cardiovasculaires (EFSA, 2019).
Les sulfates dans l'eau potable diminuent les risques pour la santé liés à la consommation de métaux lourds en agissant comme antagonistes (Watts, 1997).
2.2.3 Effets nocifs
Le principal effet nocif d'une consommation accrue de chlorures, sous forme de chlorure de sodium, est l'élévation de la pression artérielle, qui peut causer des maladies cardiovasculaires et rénales (Luft et coll., 1979; MacGregor et coll., 1989; Johnson et coll., 2001; Sacks et coll., 2001; IOM, 2005; EFSA, 2019). Il a été démontré que l'augmentation de la pression artérielle dépend de la présence concomitante de sodium et de chlorures. Chez les sujets normotendus et les sujets hypertendus, le chlorure de sodium a entraîné une élévation de la pression artérielle moyenne plus importante que le sodium combiné à d'autres anions (Kurtz et coll., 1987; Shore et coll., 1988; Kotchen et Kotchen, 1997; McCallum et coll., 2015). En moyenne, la pression artérielle augmente progressivement avec la consommation de chlorure de sodium (IOM, 2005). Chez les personnes normotendues, on a observé une augmentation significative de la pression artérielle lors de l'ingestion d'environ 7 500 à 13 900 mg par jour de chlorure de sodium (Mascioli et coll., 1991; Ganry et coll., 1993). Les personnes souffrant d'hypertension, de diabète et de maladie rénale chronique ainsi que les personnes âgées et les Afro-Américains ont tendance à être plus sensibles aux effets du chlorure de sodium sur la pression artérielle (Tuck et coll., 1990; Weinberger, 1993; Morimoto et coll., 1997; Morris et coll., 1999; Johnson et coll., 2001; Vollmer et coll., 2001; du Cailar et coll., 2002; IOM, 2005). Des facteurs génétiques influent également sur la réponse de la pression artérielle au chlorure de sodium (Hunt et coll., 1999; Lifton et coll., 2002; IOM, 2005). Bien que rare, une toxicité aiguë peut être provoquée par l'ingestion de 500 à 1 000 mg de chlorure de sodium par kilogramme de poids corporel (kg p.c.) (Expert Group on Vitamins and Minerals, 2003). Les symptômes comprennent des vomissements, une ulcération du tube digestif, une faiblesse musculaire et des lésions rénales, entraînant une déshydratation, une acidose métabolique et de graves effets sur le système nerveux central et périphérique. Un apport élevé en chlorure de sodium augmente l'excrétion de calcium et peut accroître le risque de formation de calculs rénaux (Castenmiller et coll., 1985; McParland et coll., 1989; Zarkadas et coll., 1989; Sakhaee et coll., 1993; Evans et coll., 1997; Lietz et coll., 1997; Expert Group on Vitamins and Minerals, 2003; Lin et coll., 2003; IOM, 2005). Cependant, il n'existe pas de preuve substantielle pointant vers une relation entre un apport excessif en chlorure de sodium et une réduction de la densité minérale osseuse (Expert Group on Vitamins and Minerals, 2003). Le sodium et le chlorure contribuent tous deux à l'aggravation des symptômes de l'asthme induit par l'exercice, effet observé après une alimentation normale ou riche en chlorure de sodium (Mickleborough et coll., 2001). Les personnes qui suivent un régime alimentaire à faible teneur en sodium ou qui doivent limiter leur exposition au sodium devraient savoir que les adoucisseurs d'eau résidentiels augmentent la concentration de sodium dans l'eau traitée. L'annexe E contient des renseignements sur l'apport en sodium résultant de l'utilisation d'un adoucisseur d'eau, par niveau de dureté.
L'ingestion de sulfates a été associée à la diarrhée osmotique et à la colite ulcéreuse. La diarrhée osmotique est généralement de courte durée, mais elle peut être plus grave chez les nourrissons (Chien et coll., 1968; Backer, 2000; IOM, 2005). L'ampleur et la nature de l'effet laxatif dépendent du sel de sulfate en cause. Les personnes qui boivent de l'eau potable contenant des sulfates à des concentrations supérieures à 500 mg/L ressentent généralement des effets laxatifs (Chien et coll., 1968; Esteban et coll., 1997; Heizer et coll., 1997; U.S. EPA, 1999b, 2003a). Les effets laxatifs peuvent se produire à des concentrations plus faibles en présence de magnésium et de sulfates (concentrations combinées > 400 mg/L) (Rosborg et Kozisek, 2020). Une déshydratation peut également survenir si le remplacement des liquides n'est pas assuré (Arnaud, 2003). L'humain semble développer une tolérance à l'eau contenant des concentrations élevées de sulfates (Schofield et Hsieh 1983). Bien que la concentration et la vitesse d'accoutumance n'aient pas été déterminées, l'accoutumance se produit généralement en une à deux semaines chez l'adulte (U.S. EPA, 1999a, 2003a).
2.2.4 Génotoxicité et cancérogénicité
Selon les données épidémiologiques, il existe une association positive entre un apport excessif en chlorure de sodium et le risque de cancer gastrique (Expert Group on Vitamins and Minerals, 2003; Wang et coll., 2009; D'Elia et coll., 2014).
Le sulfate de potassium n'a pas été mutagène à 0,83 mg/plaque, 1,66 mg/plaque, 3,33 mg/plaque et 5,00 mg/plaque pour les souches TA98 (avec et sans activation par S9) et TA100 (avec activation par S9) de Salmonella typhimurim. Cependant, le sulfate de potassium a montré un faible effet mutagène sur la souche TA100 en l'absence d'activation par S9, mais sans que celui-ci soit lié à la dose (Kayraldiz et coll., 2006). Kasprzak et ses collaborateurs (1983) ont rapporté que le sulfate de nickel(II) n'a été ni toxique ni cancérogène deux ans après des injections intramusculaires de doses de 20 µL d'une solution de 0,2 M de sulfate de nickel(II) (4,4 µm/rat) ou de sulfate de sodium (utilisé comme solution témoin) tous les deux jours pendant quatre semaines [les rats ont reçu 15 doses de 20 µL d'une solution de 0,2 M de sulfate de nickel(II) ou de sulfate de sodium]. Après examen des données sur la toxicité des additifs alimentaires contenant des sulfates, le Select Committee de l'Environmental Protection Agency des États-Unis (U.S. EPA) a conclu que rien n'indique que l'acide sulfurique ou les sulfates d'ammonium, de calcium, de potassium et de sodium présentent un risque pour la santé publique lorsqu'ils sont utilisés aux concentrations actuelles ou aux concentrations auxquelles on peut raisonnablement s'attendre à l'avenir (U.S. EPA, 2003a).
Le Centre international de recherche sur le cancer (CIRC) et l'U.S. EPA n'ont pas évalué la cancérogénicité du calcium ni des sulfates inorganiques. Toutefois, le CIRC a évalué la cancérogénicité potentielle de certaines molécules contenant des sulfates, notamment le sulfate de diéthyle et le sulfate de diméthyle, et les a classées comme « probablement cancérogènes pour l'Homme ». Il a également classé le sulfate de diisopropyle et le sulfate de cobalt comme « peut-être cancérogènes pour l'Homme » (CIRC, 2018). En 2022, la cancérogénicité des sels solubles de cobalt(II) [ce qui comprend le sulfate de cobalt(II)] a été réévaluée, et ces sels seront désormais classés comme « probablement cancérogènes pour l'Homme » dans le volume 131 des Monographies du CIRC (Karagas et coll., 2022).
2.3 Matières dissoutes totales (MDT)
Il y a peu de données récentes sur les effets sur la santé associés à l'ingestion des MDT présentes dans l'eau potable. Les études récentes semblent se concentrer sur les effets de la dureté, plutôt que des MDT, sur la santé.
2.3.1 Essentialité
De nombreux ions qui composent les MDT, dont le magnésium, le calcium, le sodium, les chlorures et le potassium, sont des minéraux essentiels, et la consommation de ces ions en concentrations appropriées est bénéfique pour la santé humaine à maints égards. La consommation régulière d'eau distillée ou déminéralisée (c.-à-d. avec de faibles concentrations de MDT) pendant quelques semaines ou quelques mois peut entraîner des carences en calcium, en magnésium ou en sodium, menant à une fatigue extrême, des malaises, des nausées, des maux de tête, une fragilité des ongles et des cheveux, une prééclampsie, des contractions musculaires, des crampes dans les jambes et dans l'abdomen, une acidose métabolique, une diurèse accrue et des maladies cardiovasculaires (Kozisek, 2005, 2020).
2.3.2 Effets bénéfiques
Dans une vieille étude, on a démontré une corrélation négative (c.-à-d. un effet protecteur) significative entre les régions approvisionnées en eau à forte teneur en MDT et la mortalité par maladie cardiovasculaire chez les hommes adultes de 45 à 64 ans (Schroeder, 1960). Toutefois, de nouvelles données ont montré que cette corrélation est probablement due à une teneur élevée en magnésium ou en calcium plutôt qu'à une teneur élevée en MDT (Catling et coll., 2008; Del Gobbo et coll., 2013; Khan et coll., 2015). D'autres études ont fait état d'une relation inverse entre les concentrations de MDT dans l'eau potable et la fréquence du cancer et des maladies cardiaques athérosclérotiques (Schroeder, 1966; Burton et Comhill, 1977). Les données épidémiologiques obtenues chez des populations en Russie semblent indiquer que l'eau potable riche en minéraux peut réduire le risque d'hypertension, de maladies coronariennes, d'ulcères, de gastrite chronique, de goitre, de complications de la grossesse, de cholécystite, de néphrite, de retards de développement physique chez les enfants et de complications chez les nouveau-nés et les nourrissons (Lutaĭ, 1992; Mudryi, 1999).
2.3.3 Effets nocifs
Des concentrations élevées de MDT dans l'eau ne sont généralement pas nocives pour l'humain. Cependant, bien que les MDT soient composées de nombreux minéraux essentiels bénéfiques pour la santé humaine, de nombreux autres ions potentiellement nocifs peuvent également être présents. Pour bon nombre des sels qui composent les MDT et qui peuvent nuire à la santé (p. ex. l'arsenic, le bore, le cadmium, le chrome, les fluorures et les nitrates), Santé Canada a établi des concentrations maximales acceptables, ou CMA (voir la version la plus récente des Recommandations pour la qualité de l'eau potable au Canada – Tableaux sommaires) (Santé Canada, 2022d).
Des concentrations élevées (> 1 000 mg/L) de MDT peuvent provoquer chez certaines personnes un effet laxatif ou de la constipation, et accroître le risque de calculs rénaux, de problèmes d'arthrite et d'irritation des yeux et de la peau (Kahlown et coll., 2006; Hussain et coll., 2014; Meride et Ayenew, 2016; Kozisek, 2020). Selon des études menées en Russie, la consommation régulière et à long terme d'eau extrêmement riche en minéraux (MDT > 1 000 à 2 000 mg/L) augmenterait le risque de maladies touchant le système excréteur (c.-à-d. les reins et les voies urinaires), de maladies du tube digestif, de maladies affectant les fonctions reproductives féminines, de problèmes de développement chez les enfants, d'arthrite et de calculs (Shtannikov et Obyedkova, 1984; Shtannikov et coll., 1986; Lagutina et coll., 1990; Muzalevskaya et coll., 1993; Rylova, 2005). Au Sri Lanka, on a observé une corrélation positive et significative entre les concentrations de créatinine sérique (un signe clinique et symptôme de la maladie rénale chronique d'étiologie inconnue) et la teneur en MDT de l'eau potable (fourchette : 136,3 à 3 750 mg/L; moyenne : 687 mg/L) (Gobalarajah et coll., 2020).
2.3.4 Génotoxicité et cancérogénicité
Des données probantes indiquant une génotoxicité ou carcénogénicité des MDT n'ont pas été trouvées.. Le CIRC et l'U.S. EPA n'ont pas évalué la cancérogénicité des MDT. Toutefois, les métaux lourds dissous à l'état de traces qui peuvent être présents dans les MDT, notamment l'arsenic, le béryllium, le cadmium et le chrome(VI), sont classés comme « cancérogènes pour l'Homme » par le CIRC (CIRC, 2018; Rahman et coll., 2021). Les nitrates, qui peuvent également être présents dans les MDT, sont classés comme « probablement cancérogènes pour l'Homme » (groupe 2A) (CIRC, 2018). Le CIRC a également évalué la cancérogénicité potentielle de nombreuses molécules contenant du sodium, du potassium et des sulfates (CIRC, 2018).
2.4 Sulfure d'hydrogène
2.4.1 Rôle biologique
Le sulfure d'hydrogène n'est pas un élément essentiel, et il est biosynthétisé de manière endogène principalement par la cystathionine β-lyase et le tandem enzymatique cystéine aminotransférase et 3-mercaptopyruvate sulfurtransférase (Kashfi et Olson, 2013). Une partie du sulfure d'hydrogène endogène est également obtenue par réduction chimique non enzymatique d'espèces soufrées réactives (c.-à-d. les persulfures, les thiosulfates et les polysulfures) en présence d'équivalents réducteurs tels que le nicotinamide adénine dinucléotide phosphate (NADPH) et le nicotinamide adénine dinucléotide (NADH) (Cao et coll., 2019).
2.4.2 Effets nocifs
Il n'y a pas de données épidémiologiques sur la toxicité orale du sulfure d'hydrogène (OMS, 2003; ATSDR, 2016). Cependant, les sulfures alcalins irritent les muqueuses et peuvent provoquer des nausées, des vomissements et des douleurs épigastriques après ingestion (OMS, 2003). La dose orale de sulfure de sodium mortelle pour l'humain a été estimée entre 10 et 14 g (OMS, 1981).
Lorsqu'il est inhalé, le sulfure d'hydrogène présente une toxicité aiguë pour l'humain (Gosselin, 1984). On peut observer une irritation des yeux et des voies respiratoires à une concentration de 15 à 30 mg/m3, et des concentrations de 700 à 1 400 mg/m3 peuvent provoquer une perte de conscience et une paralysie respiratoire entraînant la mort (OMS, 1987). Les niveaux d'exposition au sulfure d'hydrogène qui entraînent un état de semi-conscience ou une perte de conscience temporaire (p. ex. 15 à 30 minutes) peuvent provoquer des déficits neurophysiologiques, neurocomportementaux, neurocognitifs, respiratoires et ophtalmologiques persistants (Hagley et South, 1983; Tvedt et coll., 1991a; Kilburn, 1993; Snyder et coll., 1995; U.S. EPA 2003b). Une perte de conscience prolongée peut entraîner une insuffisance respiratoire, une hypoxie et la mort (Milby, 1962; Wasch et coll., 1989; Khan et coll., 1990; Tvedt et coll., 1991b; U.S. EPA, 2003b). La surexposition au sulfure d'hydrogène peut occasionner divers symptômes transitoires du système nerveux central, notamment des étourdissements, des nausées et des maux de tête, ainsi que des effets à plus long terme, comme une perte de conscience subite (aussi appelée « coup de plomb »), qui ont tous été attribués aux effets directs du sulfure d'hydrogène sur le cerveau (Milby et Baselt, 1999a). Les concentrations associées au coup de plomb et à l'œdème pulmonaire ont été estimées entre 500 et 1 000 ppm (entre 695 et 1 390 mg/m3) et entre 250 et 500 ppm (entre 348 et 695 mg/m3), respectivement (Milby et Baselt, 1999a, 1999b; Reiffenstein et coll., 1992).
2.4.3 Génotoxicité et cancérogénicité
Attene-Ramos et ses collaborateurs (2010) ont mesuré la génotoxicité du sulfure d'hydrogène en réalisant le test des comètes sur des cellules épithéliales intestinales humaines (FHs 74 Int). Le sulfure d'hydrogène s'est révélé génotoxique à des concentrations comprises entre 250 et 2 000 µm. Les changements constatés dans l'expression génique ont été analysés après exposition à une seule concentration génotoxique, mais non cytotoxique, de sulfure d'hydrogène (500 µm). Des changements significatifs dans l'expression génique ont principalement été observés après une période d'exposition de 4 heures comparativement à une exposition de 30 minutes. Des fibroblastes pulmonaires humains cultivés ont été traités avec un donneur de sulfure d'hydrogène, en l'occurrence l'hydrogénosulfure de sodium (10 à 75 µm; 12 à 48 heures). L'hydrogénosulfure de sodium a provoqué une augmentation, liée à la concentration, de la formation de micronoyaux (indiquant des dommages à l'ADN) et de l'arrêt du cycle cellulaire (phase G1) (Baskar et coll., 2007).
Les données limitées dont on dispose ne montrent pas que le sulfure d'hydrogène provoque le cancer chez l'humain (ATSDR, 2016). L'U.S. EPA a déterminé que les données sur le sulfure d'hydrogène sont insuffisantes pour en évaluer la cancérogénicité (U.S. EPA, 2003b). Le CIRC n'a pas évalué la cancérogénicité du sulfure d'hydrogène.
3.0 Calcul des valeurs basées sur la santé (VBS)
3.1 Magnésium, calcium et dureté
3.1.1 Magnésium
Les données toxicologiques sur le magnésium sont insuffisantes pour permettre le calcul d'une VBS; en effet, on ne dispose pas de suffisamment de données sur la toxicité due à un excès de magnésium. L'Institute of Medicine (IOM) a établi pour le magnésium un AMT de 2 500 mg par jour pour les enfants de plus de 8 ans, les adolescents et les adultes (IOM, 1997). Il n'est pas possible de calculer une VBS en utilisant l'AMT établi par l'IOM (1997), car celui-ci ne s'applique pas au magnésium naturellement présent dans l'eau potable ou dans les aliments. Par ailleurs, il n'a pas été démontré que le magnésium, lorsqu'il est ingéré en tant que substance naturellement présente dans l'eau potable ou les aliments, entraîne des effets nocifs (IOM, 1997). Toutefois, on a observé des effets nocifs associés à un apport excessif en magnésium provenant de sources non alimentaires, comme divers sels de magnésium utilisés à des fins pharmacologiques, dont les laxatifs osmotiques. L'ingestion de concentrations adéquates de magnésium a un effet protecteur sur la santé humaine, tandis que les carences peuvent entraîner des effets toxicologiques nocifs. Par conséquent, aucune VBS n'est proposée pour le magnésium.
3.1.2 Calcium
L'IOM (2011) a calculé des AMT pour le calcium en tenant compte de l'excrétion du calcium dans les groupes d'âges plus jeunes et de la formation de calculs rénaux dans les groupes d'âge plus âgés. L'AMT de 2 000 mg par jour établi pour les adultes de plus de 50 ans a été sélectionné comme étant la valeur la plus appropriée pour calculer une VBS pour le calcium, car il s'agit de l'AMT le plus bas pour les personnes de plus de 1 an. La VBS pour le calcium est calculée comme suit :
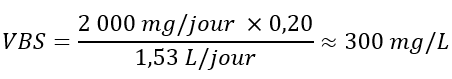
Équivalent textuel
Le valeur basée sur la santé est égale à 2 000 milligrammes par jour multiplié par 0,2, le tout divisé par 1,53 litres par jour. Cela équivaut environ 300 milligrammes par litre.
où :
- 2 000 mg/jour est l'AMT établi pour les adultes de plus de 50 ans et l'AMT le plus conservateur pour les personnes de plus de 1 an (IOM, 2011); il n'existe aucune donnée indiquant que les nourrissons sont plus sensibles à l'excès de calcium que les adultes.
- 0,20 est le facteur d'attribution pour l'eau potable; on l'utilise comme « valeur plancher », étant donné que l'eau potable n'est pas une source majeure d'exposition au calcium et que l'apport de calcium provient d'autres sources (c.-à-d. les aliments) (Krishnan et Carrier, 2013).
- 1,53 L/jour est le volume quotidien d'eau consommé par un adulte (Santé Canada, 2021).
3.1.3 Dureté
La dureté est le plus souvent mesurée comme la somme du magnésium et du calcium présents dans l'eau, exprimée en équivalent CaCO3, qui est l'unité de mesure standard de la dureté (voir la section 1.1.1, « Calcium, magnésium et dureté »). Par conséquent, on peut calculer une VBS pour la dureté de l'eau si des VBS sont proposées pour le magnésium et le calcium. Cependant, il n'est pas possible de calculer une VBS pertinente pour le magnésium, car l'AMT pour le magnésium ne s'applique qu'au magnésium provenant de sources non alimentaires, comme les suppléments (voir la section 3.1.1, « Magnésium »). Les effets nocifs sur la santé causés par un excès de magnésium ou de calcium (c.-à-d. les deux principaux ions responsables de la dureté de l'eau) sont généralement dus à la consommation de suppléments plutôt qu'à la consommation d'aliments et d'eau potable. Par conséquent, une VBS n'est pas justifiée pour la dureté de l'eau.
3.2 Chlorures et sulfates
3.2.1 Chlorures
L'IOM (2005) a établi des AMT pour le sodium et les chlorures afin d'assurer une protection contre le risque d'hypertension associé à la consommation de chlorure de sodium. Pour les chlorures, un AMT de 3 600 mg/jour a été fixé pour les personnes de 13 ans et plus. La VBS est calculée comme suit, à l'aide de l'AMT établi par l'IOM (2005) :

Équivalent textuel
Le valeur basée sur la santé est égale à 3 600 milligrammes par jour multiplié par 0,2, le tout divisé par 1,53 litres par jour. Cela équivaut environ 470 milligrammes par litre.
où :
- 3 600 mg/jour est l'AMT établi pour les chlorures pour les personnes de 13 ans et plus (IOM, 2005).
- 0,20 est le facteur d'attribution pour l'eau potable; on l'utilise comme « valeur plancher », étant donné que l'eau potable n'est pas une source majeure d'exposition au calcium et que l'apport de calcium provient d'autres sources (c.-à-d. les aliments) (Krishnan et Carrier, 2013).
- 1,53 L/jour est le volume quotidien d'eau consommé par un adulte (Santé Canada, 2021).
3.2.2 Sulfates
Les données épidémiologiques sont insuffisantes pour permettre le calcul d'une VBS pour les sulfates. Bien que plusieurs études aient examiné les effets de l'exposition humaine aux sulfates dans l'eau potable, aucune ne peut être utilisée pour caractériser la relation dose-réponse. Peterson (1951), Moore (1952) et Cass (1953) ont publié des données toxicologiques à long terme montrant une corrélation entre la consommation de sulfates et des effets laxatifs. Ces données sont insuffisantes, car elles reposent sur des souvenirs ayant peu de valeur scientifique (en d'autres mots, on a utilisé des enquêtes de type OUI/NON), et les concentrations de magnésium et de MDT dans les échantillons d'eau variaient (U.S. EPA, 2003a). La majorité des études toxicologiques à court terme n'ont pas trouvé d'association significative entre la consommation de sulfates et la diarrhée (Esteban et coll., 1997; Heizer et coll., 1997; U.S. EPA, 1999b). Dans une étude toxicologique à court terme, Chien et ses collaborateurs (1968) ont constaté une corrélation entre la consommation de sulfates et la diarrhée chez les nourrissons. Cependant, la concentration de MDT dans l'eau potable était élevée (de 2 424 mg/L à 3 123 mg/L), et le nombre de participants à l'étude était limité (n = 3).
Des effets nocifs liés à l'ingestion de sulfates ont été observés dans deux études chez des animaux. Toutefois, aucune de ces études ne permet de calculer une VBS. Narotsky et ses collaborateurs (2012) ont noté que la fréquence des diarrhées était liée à la dose chez des rats qui avaient consommé du sulfate de sodium dans l'eau potable. Or, ils n'ont pas indiqué si la différence dans la fréquence des diarrhées entre les groupes ayant reçu la substance était statistiquement significative, de sorte que les exigences relatives à la modélisation de la dose repère ne sont pas satisfaites. En outre, il n'est pas possible de calculer une dose sans effet nocif observé (NOAEL) ni une dose minimale avec effet nocif observé (LOAEL), étant donné que les doses de sulfate de sodium ont été exprimées en g/L dans l'eau potable, et que le poids corporel et la consommation d'eau ont varié tout au long de l'expérience. Par conséquent, il n'a pas été possible d'obtenir des doses exactes lors de la conversion des doses de sulfate de sodium des g/L en mg/kg p.c. par jour pour le calcul de la VBS. Gomez et ses collaborateurs (1995) ont constaté des cas de diarrhée chez des porcelets lors de l'ingestion de sulfates à des concentrations ≥ 1 600 mg/L dans les aliments. Leur étude ne permet pas non plus le calcul d'une VBS pour des raisons semblables aux raisons invoquées pour l'étude de Narotsky et ses collaborateurs (2012). L'IOM a examiné l'étude de Gomez et ses collaborateurs et a conclu qu'elle ne convenait pas au calcul d'un AMT (IOM, 2005).
Aucune VBS n'est donc proposée pour les sulfates. Cependant, selon de nombreux organismes internationaux, des effets cathartiques (laxatifs) et une irritation gastro-intestinale peuvent se produire en cas d'ingestion d'eau potable contenant des concentrations de sulfate ≥ 500 mg/L (NHMRC, NRMMC, 2011; OMS, 2017).
3.3 Matières dissoutes totales (MDT)
Comme les MDT sont constituées de nombreux sels, il est difficile de calculer une VBS pour ce paramètre. Les effets sur la santé liés aux divers sels qui composent les MDT doivent être analysés séparément. Des VBS distinctes ont déjà été calculées pour de nombreux sels qui sont présents dans les MDT et qui peuvent avoir des effets nocifs sur la santé (p. ex. le bore, les fluorures, les nitrates, l'arsenic et le chrome). Une VBS n'est donc pas justifiée pour les MDT.
3.4 Sulfure d'hydrogène
Les données toxicologiques sur le sulfure d'hydrogène sont insuffisantes pour permettre le calcul d'une VBS, car toutes les études disponibles, sauf une, sont fondées sur l'exposition par inhalation ou dans l'air au sulfure d'hydrogène et non sur l'exposition par voie orale (Beauchamp et coll., 1984; Arnold et coll., 1985; Jäppinen et Tola, 1990; Haahtela et coll., 1992; Kilburn et Warshaw, 1995; Richardson, 1995; Vanhoorne et coll., 1995; Bates et coll., 1997, 1998; Hessel et coll., 1997; Legator et coll., 2001; OMS, 2003; Lewis et Copley, 2015; ATSDR, 2016). Une seule étude sur l'exposition par voie orale chez les animaux a été trouvée dans la littérature (Wetterau et coll., 1964). On y a constaté une diminution de 23 % de la prise de poids corporel à 6,7 mg/kg p.c. par jour chez des porcs exposés pendant 104 jours et des troubles digestifs diarrhéiques chez des porcs exposés à 15 mg/kg p.c. par jour pendant quelques jours. L'interprétation de cette étude est limitée par le peu de détails fournis (p. ex. il n'y a aucune information sur les méthodes et les souches utilisées, le nombre d'animaux étudiés ou les données statistiques) (ATSDR, 2016). Il n'est donc pas possible de calculer une VBS à partir de ces données sur les animaux. L'IOM et Santé Canada n'ont pas établi d'apport quotidien recommandé pour les sulfures. Une VBS ne peut donc pas être calculée à partir d'un apport quotidien recommandé tel qu'un AMT. Ainsi, aucune VBS n'est proposée pour le sulfure d'hydrogène.
4.0 Considérations relatives à l'analyse
Plusieurs méthodes normalisées ainsi que des analyseurs commerciaux en ligne et trousses d'analyse portatives (tableau 7) permettent d'analyser le calcium, le magnésium, la dureté, les chlorures, les sulfates, les MDT et le sulfure d'hydrogène dans les sources d'approvisionnement en eau potable et dans l'eau potable. Les limites de détection de la méthode (LDM) dépendent de la matrice de l'échantillon, des instruments et des conditions de fonctionnement choisies; elles varient d'un laboratoire à l'autre. Les méthodes sont sujettes à diverses interférences, qui sont décrites dans les documents de référence ou les instructions pertinentes.
Pour mesurer avec précision la concentration de paramètres opérationnels à l'aide de ces analyseurs et ces trousses, les responsables de systèmes d'approvisionnement en eau potable devraient élaborer un programme d'assurance et de contrôle de la qualité comme celui décrit dans la méthode normalisée SM 3020 (Standard Methods 3020) (APHA et coll., 2018). Il est recommandé de vérifier périodiquement les résultats en recourant aux services d'un laboratoire accrédité. Les responsables de systèmes d'approvisionnement en eau potable devraient vérifier auprès de l'autorité responsable en matière d'eau potable si les résultats des analyses sont acceptables pour la production de rapports de conformité.
Les responsables de systèmes d'approvisionnement en eau potable devraient aussi discuter des exigences en matière d'échantillonnage avec le laboratoire accrédité chargé de l'analyse pour veiller à ce que les procédures de contrôle de la qualité soient respectées et que les seuils minimaux de déclaration soient suffisamment bas pour garantir une surveillance précise.
| Paramètre | Méthode normalisée | Méthode en ligne | Trousse d'analyse portativeNote de bas de page * |
|---|---|---|---|
| Calcium | X | X | X |
| Magnésium | X | X | X |
| Dureté | X | X | X |
| Sulfates | X | X | X |
| Chlorures | X | X | X |
| MDT | X | X | X |
| Sulfure d'hydrogène | X | X | X |
|
|||
4.1 Méthodes normalisées
4.1.1 Calcium, magnésium et dureté
Pour mesurer les concentrations de calcium et de magnésium, il est possible d'utiliser différentes méthodes normalisées par spectroscopie d'absorption atomique et par titrage (tableau 8 et 9). La méthode SM 2340B (APHA et coll., 2018) est la méthode privilégiée pour mesurer la dureté totale en tant que somme des résultats des analyses individuelles du calcium et du magnésium.
| Méthode (référence) |
Calcium | Magnésium | Interférences/commentaires |
|---|---|---|---|
| EPA 200.5 Rev. 4.2 (U.S. EPA, 2003c) |
X | X | Plage analytique non indiquée. |
| EPA 200.7 Rev. 4.4 (U.S. EPA, 1994) |
X | X |
Plage analytique non indiquée. Méthode sujette à interférence due à la matrice : MDT > 0,2 % (p/v). |
| EPA NERL 215.1 (U.S. EPA, 1978a) |
X | S.O. |
Plage optimale : 0,2 mg/L à 7,0 mg/L à une longueur d'onde de 422,7 nm. Méthode sujette à l'interférence des composés ioniques. À un pH > à 7, on obtient une concentration plus faible en calcium. |
| EPA NERL 242.1 (U.S. EPA, 1978b) |
S.O. | X |
Plage optimale : 0,02 mg/L à 0,5 mg/L à une longueur d'onde de 285,2 nm. Méthode sujette à l'interférence de l'aluminium. Interférence du sodium, du potassium et du calcium aux concentrations > 400 mg/L. |
| SM 3120B (APHA et coll., 2018) |
X | X |
Limite supérieure de la plage pour le Ca : 100 mg/L à une longueur d'onde de 317,93 nm. Limite supérieure de la plage pour le Mg : 100 mg/L à une longueur d'onde de 279,08 nm. Méthode sujette à l'interférence lorsque MDT > 1 500 mg/L. |
| SM 3111B (APHA et coll., 2018) |
X | X |
Plage optimale pour le Ca : 0,2 mg/L à 20 mg/L à une longueur d'onde de 422,7 nm. Plage optimale pour le Mg : 0,2 mg/L à 2,0 mg/L à une longueur d'onde de 285,2 nm. Des concentrations élevées de phosphates peuvent interférer avec l'analyse du calcium et magnésium; utiliser la méthode SM 311D pour le calcium... |
| SM 3111D (APHA et coll., 2018) |
X | S.O. |
Plage optimale pour le Ca : 0,2 mg/L à 20 mg/L à une longueur d'onde de 422,7 nm. Plage optimale pour le Mg : 0,2 mg/L à 2,0 mg/L à une longueur d'onde de 285,2 nm. Méthode sujette à l'interférence des phosphates pour l'analyse du magnésium. |
| USGS-NWQL: I-7152 (USGS, 1985a) |
X | S.O. |
Deux plages analytiques : 0,01 mg/L à 5,0 mg/L et 1,0 mg/L à 60 mg/L. Ajouter du lanthane afin de réduire l'interférence des phosphates, des sulfates et de l'aluminium. À un pH supérieur à 7, on obtient une concentration plus faible en calcium; acidifier l'échantillon à l'aide d'acide chlorhydrique dilué. |
USGS-NWQL: I-4447 |
S.O. | X |
Deux plages analytiques : 0,01 mg/L à 5,0 mg/L et 2,5 mg/L à 50 mg/L. Méthode sujette à l'interférence de l'aluminium à une concentration > 2 000 mg/L et du sodium, du potassium et du calcium aux concentrations > 400 mg/L. À un pH > 7, on obtient une concentration plus faible en calcium. |
|
|||
| Méthode (référence) |
Calcium | Dureté | Interférences/commentaires |
|---|---|---|---|
| EPA NERL 130.2 (U.S. EPA, 1971a) |
S.O. | X |
Plage analytique non indiquée. En présence de certains ions métalliques, la couleur au point de virage peut être moins nette ou estompée. |
| EPA NERL 215.2 (U.S. EPA, 1978c) |
X | S.O. |
Plage applicable : 0,5 mg/L à 25 mg/L de CaCO3. Interférences du strontium, magnésium et du baryum. En présence d'une alcalinité supérieure à 30 mg/L, la couleur au point de virage peut être moins nette. |
| SM 3500-Ca B (APHA et coll., 2018) |
X | S.O. |
Plage analytique non indiquée. Soustraction pour le Mg. Méthode non recommandée pour les échantillons contenant > 50 mg/L de phosphore. |
| SM 2340 Hardness C (APHA et coll., 2018) |
S.O. | X |
Plage analytique non indiquée. Certains ions métalliques peuvent causer de l'interférence. En présence de concentrations élevées de métaux lourds, analyser le calcium et le magnésium par une méthode n'utilisant pas d'EDTA. |
| USGS-NWQL: I-3338 (USGS, 1985c) |
S.O. | X |
Plage analytique non indiquée. Non applicable aux eaux acides contenant des concentrations excessives de métaux lourds. |
|
|||
4.1.2 Chlorures et sulfates
La méthode normalisée pour mesurer les chlorures et les sulfates est fondée sur la chromatographie ionique (tableau 10). Il existe également des méthodes normalisées d'analyse turbidimétrique, gravimétrique et potentiométrique (tableau 11 et 13). Les méthodes SM 4500-Cl- et SM 4500-SO42- permettent de sélectionner la méthode avec laquelle on peut analyser les chlorures et les sulfates, respectivement.
| Méthode (référence) |
Chlorures | Sulfates | Interférences/commentaires |
|---|---|---|---|
| U.S. EPA 300.1, Rev. 1.0 (U.S. EPA, 1999c) |
X | X |
Plage analytique non indiquée. Les acides organiques de faible poids moléculaire, les bromates et les chlorites peuvent interférer avec l'analyse des chlorures. |
| SM 4110 B (APHA et coll., 2017) |
X | X |
Plage analytique non indiquée. Filtrer les particules supérieures à 0,45 µm. Les acides organiques de faible poids moléculaire, les bromates et les chlorites peuvent interférer avec l'analyse des chlorures. |
| SM 4110 C (APHA et coll., 2017) |
X | X | Plage analytique non indiquée. |
| EPA-NERL: 375.4 (U.S. EPA, 1978d) |
S.O. | X |
Plage applicable : 1 à 40 mg/L. La couleur et les matières en suspension peuvent causer des interférences. |
|
|||
| Méthode (référence) |
Chlorures | Sulfates | Interférences/commentaires |
|---|---|---|---|
| SM 4500-SO42- E (APHA et coll., 2017) |
S.O. | X |
Plage analytique appropriée : 1 mg/L à 40 mg/L. La couleur et les matières en suspension en grandes quantités causeront des interférences. |
| SM 4500-Cl- B (APHA et coll., 2017) |
X | S.O. |
Plage analytique appropriée : 0,15 mg/L à 10 mg/L. Les ions sulfures, thiosulfates et sulfites causeront des interférences. |
| SM 4500-Cl- C (APHA et coll., 2017) |
X | S.O. | Plage analytique non indiquée. |
|
|||
| Méthode (référence) |
Sulfates | Interférences/commentaires |
|---|---|---|
| SM 4500-SO42- C (APHA et coll., 2017) |
X |
Plage analytique appropriée : > 10 mg/L. L'analyse gravimétrique du SO42- est sujet à des erreurs. Voir la méthode 4500- SO42-A pour connaître les interférences. |
| SM 4500-SO42- D (APHA et coll., 2017) |
X | Plage analytique appropriée : > 10 mg/L. |
| Méthode (référence) |
Chlorures | Interférences/commentaires |
|---|---|---|
| SM 4500-Cl- D (APHA et coll., 2017) |
X | Plage analytique non indiquée. |
4.1.3 Matières dissoutes totales (MDT)
Il existe des méthodes normalisées pour mesurer les MDT. La méthode SM 2540 B-D (APHA et coll., 2020) convient aux concentrations de MDT comprises entre 2,5 et 200 mg/L. Il est également possible de mesurer individuellement les principaux constituants ioniques des MDT (sodium, calcium, magnésium, chlorures, sulfates, etc.), puis d'additionner les concentrations pour estimer la concentration globale de MDT selon la méthode SM 2510 A 3020 (APHA et coll., 2017).
Par ailleurs, dans la méthode SM 2510 (APHA et coll., 2017) et Hach Method 8160 (Hach Co., 2021), on considère la conductivité comme une mesure de substitution des MDT que l'on peut utiliser pour la quantification rapide et la surveillance des procédés. Cette méthode emploie une sonde de conductivité, et on ne devrait l'utiliser que si une courbe d'étalonnage a préalablement établi le facteur de correction pour le type d'eau à analyser.
4.1.4 Sulfure d'hydrogène
Il existe quatre catégories de sulfures dans l'eau (sulfures totaux, sulfures dissous, sulfures acides volatils ou sulfure d'hydrogène non ionisé) qui peuvent être mesurées (tableau 14, figure 4500-S2-:I) selon les méthodes normalisées de l'APHA (APHA et coll., 2017). On peut se fonder sur le tableau ci-dessous pour choisir la méthode d'analyse des sulfures qui convient compte tenu des conditions. La méthode SM 4500-S2- H fournit des indications pour la mesure du sulfure d'hydrogène non ionisé (APHA et coll., 2017).
| Méthode (référence) |
Méthodologie | Interférences/commentaires |
|---|---|---|
| SM 4500-S2- D (APHA et coll., 2017) |
Colorimétrie | Plage analytique appropriée : 0,1 mg/L à 20 mg/L. |
| SM 4500-S2- E (APHA et coll., 2017) |
Dialyse des gaz au bleu de méthylène | Plage analytique appropriée : 0,002 mg/L à 0,100 mg/L. |
| SM 4500-S2- I (APHA et coll., 2017) |
Distillation au bleu de méthylène |
Plage analytique appropriée : > 1 mg/L. Mesure les sulfures totaux, qui comprennent le sulfure d'hydrogène et les sulfures métalliques solubles en milieu acide présents dans les matières en suspension. |
| SM 4500-S2- F (APHA et coll., 2017) |
Iodométrie | Plage analytique non indiquée. |
| SM 4500-S2- G (APHA et coll., 2017) |
Électrode sélective d'ions |
Plage analytique appropriée : > 0,03 mg/L. Les acides humiques peuvent interférer avec les électrodes sélectives d'ions argent/sulfure. |
| USGS-NWQL: I-3840 (USGS, 1985d) |
Titrage iodométrique |
Plage analytique appropriée : > 0,5 mg/L. Les substances réductrices telles que les sulfites et les ions de métaux lourds réagissent avec l'iode. |
4.1.4.1 Conservation et préparation des échantillons pour la mesure du sulfure d'hydrogène
Ballinger et Lloyd (1981) ont noté qu'une légère agitation de l'échantillon pendant 10 secondes entraînait la perte de 15 % du sulfure d'hydrogène de la solution. Il est donc important d'agiter ou d'aérer le moins possible les échantillons afin de minimiser la perte de sulfure d'hydrogène de la solution et d'assurer que les résultats de l'analyse reflètent la concentration réelle de sulfure d'hydrogène au moment et à l'endroit où l'échantillon a été prélevé.
Les éléments dont il faut tenir compte pour conserver les échantillons aux fins de l'analyse du sulfure d'hydrogène dans l'eau potable figurent dans les références énumérées dans le tableau 14. La méthode SM 4500-S2- C contient des directives sur la façon de prétraiter les échantillons afin d'éliminer les substances interférentes (c.-à-d. les agents réducteurs) pour les méthodes fondées sur l'iodométrie et le bleu de méthylène (APHA et coll., 2017). On utilise couramment l'acétate de zinc pour conserver l'échantillon d'eau au moment du prélèvement (Goodwin et coll., 1998; APHA et coll., 2017). Il est important de s'assurer que les mesures de conservation des échantillons respectent la procédure de manipulation des échantillons indiquée dans la méthode choisie.
4.2 Analyseurs en ligne et portatifs
4.2.1 Calcium, magnésium et dureté
Il existe dans le commerce des analyseurs en ligne et portables qui utilisent les principes de détection de la conductivité, de détection électrochimique et de détection optique pour quantifier la dureté. Les méthodes continues en ligne peuvent convenir à la surveillance des procédés d'adoucissement. Le titrage colorimétrique à l'EDTA en mode semi-continu peut fournir des signaux de contrôle des procédés permettant d'optimiser le contrôle des procédés d'adoucissement. Kruse (2018) a noté que les méthodes basées sur la conductivité présentent des limites aux fins de la mesure de la dureté, car certains minéraux ne contribuent pas à la dureté, mais contribuent à la conductivité.
Il existe également des trousses d'analyse portatives (utilisés sur le terrain) (tableau 15) pour l'analyse du calcium, du magnésium et de la dureté. Ces méthodes conviennent à la surveillance régulière des installations de traitement et des réseaux de distribution, lorsque la rapidité d'acquisition des résultats est plus importante que la précision de l'analyse. Le calcium, le magnésium et la dureté sont tous censés rester stables dans l'ensemble du réseau de distribution d'eau. Toutefois, il peut s'avérer nécessaire d'effectuer des tests sur place lorsque l'on souhaite réaliser des analyses dans des régions éloignées ou vérifier la stabilité des concentrations dans l'ensemble du réseau de distribution. Plusieurs fabricants proposent des trousses d'essais colorimétriques portatives, dont les résultats peuvent être lus à l'aide d'un comparateur visuel de couleur ou d'un spectrophotomètre portable.
| Méthode (référence) |
Calcium | Magnésium | Dureté totale | Interférences/commentaires |
|---|---|---|---|---|
| Hach 8204 – Titrage à l'EDTA (Hach, 2019) |
X | S.O. | S.O. | L'orthophosphate donne un virage lent. |
| Hach 8030 – Colorimétrie avec indicateur calmagite (Hach, 2015a) |
X | X | S.O. |
Plage allant jusqu'à 4,0 mg/L de CaCO3. Dilution requise au-delà de cette concentration. |
| Hach 8213 – Titrage à l'EDTA (Hach, 2015b) |
S.O. | S.O. | X | Plage de 10 à 4 000 mg/L de CaCO3. |
|
||||
4.2.2 Chlorures et sulfates
Il existe des analyseurs en ligne et portables permettant de quantifier les sulfates. Certains de ces analyseurs utilisent la colorimétrie (tableau 16) et les systèmes de titrage ont recours à une électrode sélective ionique à l'état solide plomb/sulfate. Divers trousses d'analyse sont offertes dans le commerce pour la détection des chlorures et des sulfates dans l'eau potable; ces trousses utilisent la méthode du nitrate mercurique et la turbidimétrie, respectivement.
Méthode (référence) |
Sulfates | Interférences/commentaires |
|---|---|---|
| EPA 375.2, Rev. 2.0 (U.S. EPA, 1993b) |
X | S.O. |
| EPA-NERL: 375.1 (U.S. EPA, 1971b) |
X |
Plage : 10 mg/L à 400 mg/L. Les cations peuvent causer des interférences. |
| SM 4500-SO42- F (APHA et coll., 2017) |
X | S.O. |
4.2.3 Matières dissoutes totales (MDT)
Il existe des sondes commerciales en ligne et des sondes portatives qui utilisent la conductivité pour fournir une mesure rapide des MDT dans l'eau. Selon le fabricant ou l'étalonnage, ces sondes portatives peuvent généralement mesurer des concentrations de MDT allant jusqu'à 1 g/L, et certaines peuvent même mesurer jusqu'à 500 g/L.
4.2.4 Sulfure d'hydrogène
Divers trousses d'analyse sont offertes dans le commerce pour la détection du sulfure d'hydrogène dans l'eau potable. Les bandelettes de test sont basées sur une méthode colorimétrique dans laquelle le papier se colore lorsqu'il est exposé au sulfure d'hydrogène. Cette méthode permet généralement d'obtenir un résultat en moins d'une minute. Toutefois, ces tests ne sont pas aussi précis que les méthodes de laboratoire.
On trouve aussi dans le commerce des trousses d'analyse qui sont plus précises que les bandelettes. Cependant, certaines de ces trousses nécessitent l'utilisation d'un colorimètre ou d'un spectrophotomètre portable pour déterminer la concentration de sulfure d'hydrogène. Des analyseurs en temps réel permettent également de mesurer rapidement les concentrations de sulfure d'hydrogène dans l'eau potable. Pandey et ses collaborateurs (2012) ont passé en revue les méthodes avec capteur couramment utilisées pour la surveillance du sulfure d'hydrogène, et ils ont notamment comparé le temps de réponse général, la limite de détection, la plage de fonctionnement commune et les limites des différentes techniques. Comme pour les méthodes de laboratoire, il est important d'agiter ou d'aérer le moins possible les échantillons qui seront analysés avec des trousses ou des bandelettes afin de réduire autant que faire se peut la perte de sulfure d'hydrogène de la solution. On s'assure ainsi que les résultats de l'analyse rendent compte de la concentration réelle de sulfure d'hydrogène au moment et à l'endroit où l'échantillon a été prélevé.
5.0 Considérations relatives au traitement
5.1 Traitement à l'échelle municipale
Plusieurs techniques de traitement permettent de réduire les sept paramètres opérationnels à l'échelle municipale. Les responsables de systèmes d'approvisionnement en eau potable devraient trouver un équilibre entre, d'une part, les considérations d'ordre esthétique (aspect visuel, goût et odeur) et sanitaire et, d'autre part, les préoccupations opérationnelles (incrustation des réseaux de distribution, des installations de plomberie et des appareils électroménagers, encrassement des unités de traitement par ultraviolets, contrôle de la corrosion) par l'élimination appropriée et la désinfection des microorganismes. Les mesures de réduction des paramètres (calcium, magnésium, dureté, chlorures, sulfates, MDT et sulfure d'hydrogène) énoncées dans les présentes recommandations ne devraient pas compromettre le processus de désinfection. Il est également possible que les stratégies de traitement visant à réduire un paramètre entraînent des effets non désirés en aval.
Le choix d'une technologie de traitement appropriée pour une source d'eau donnée dépend de nombreux facteurs, notamment les caractéristiques de la source d'eau brute, la concentration des paramètres et les conditions d'opération de la technique spécifique de traitement. Par exemple, comme la force ionique de l'eau peut avoir un effet sur l'efficacité des coagulants, il est recommandé de procéder à des essais de floculation (« jar tests ») lorsqu'on utilise un procédé de coagulation. On devrait tenir compte de ces facteurs pour veiller à ce que la technique de traitement choisie permette de réduire les paramètres d'intérêt dans l'eau potable. Comme on estime que ces paramètres de l'eau potable ont une importance à la fois opérationnelle et esthétique, il est important de s'assurer que les consommateurs jugent que l'eau traitée est acceptable pour la consommation, faute de quoi ils risquent de s'approvisionner en eau auprès de sources alternatives non sûres.
Comme ces substances naturelles coexistent dans l'environnement, les technologies permettant de les traiter sont souvent décrites ensemble dans la littérature scientifique. C'est pourquoi les présentes recommandations décrivent une approche groupée pour la réduction du calcium, du magnésium, de la dureté, des chlorures, des sulfates et des MDT. En raison de l'odeur nauséabonde du sulfure d'hydrogène, ce paramètre est souvent traité afin de réduire autant que possible sa concentration.
Il est recommandé de faire des tests à l'échelle de banc d'essai ou à l'échelle pilote avant de modifier le procédé ou d'introduire une nouvelle source d'eau afin de s'assurer qu'on peut traiter l'eau avec succès et que la conception du procédé est optimale.
5.1.1 Calcium, magnésium et dureté
La dureté totale ne pose généralement pas de problèmes d'ordre esthétique, à moins qu'elle ne soit liée au seuil gustatif du calcium ou du magnésium. Les technologies de traitement permettant de réduire le degré de dureté comprennent la technique classique d'adoucissement, le traitement par échange d'ions et la filtration sur membrane.
Les responsables de systèmes d'approvisionnement en eau potable et les propriétaires de puits privés peuvent choisir de ne pas traiter ces problèmes d'ordre esthétique étant donné qu'ils n'affectent pas la salubrité de l'eau. Une dureté élevée dans les réseaux de distribution peut former des dépôts ou des incrustations sur les parois des conduites, ce qui se traduit par des pertes de pression par frottement dans l'ensemble du réseau de distribution. Pour atténuer l'encrassement des conduites attribuable à la dureté, on peut réduire le degré de dureté ou ajuster le pH de manière à augmenter la solubilité des ions précipitants. La formation d'incrustations est particulièrement visible dans la plomberie des bâtiments ou sur les appareils sanitaires, où elle se présente sous la forme d'un dépôt blanc poudreux ou écailleux. Dans les réservoirs d'eau chaude et autres appareils de chauffage, les dépôts peuvent entraver le transfert de chaleur, ce qui entraîne une baisse de l'efficacité énergétique et une défaillance prématurée (Hofman et coll., 2006). Davis (2010) a constaté que des concentrations de magnésium supérieures à environ 40 mg/L de CaCO3 peuvent entartrer les chauffe-eau.
Lorsque les fournisseurs d'eau souhaitent réduire l'effet du calcium et du magnésium, ils visent surtout à diminuer la dureté plutôt qu'à l'éliminer complètement, car l'eau douce peut causer de la corrosion dans les réseaux de distribution d'eau potable et les installations de plomberie résidentielles. On trouvera de plus amples renseignements sur le contrôle de la corrosion dans le document de Santé Canada intitulé Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion (Santé Canada, 2022a). On peut réduire la dureté par précipitation chimique (adoucissement), par échange d'ions ou par filtration sur membrane. Le choix de la technologie de réduction dépend du type de dureté (carbonatée ou non carbonatée) que l'on désire réduire.
Bien que le calcium et le magnésium soient souvent les cations les plus présents en solution, il est important de tenir compte de la présence de sodium et de potassium, car ils contribuent également à la force ionique d'une solution. On trouvera de plus amples renseignements sur le potassium dans les Recommandations pour la qualité de l'eau potable traitant de cet élément, publiées par Santé Canada (Santé Canada, 2008).
5.1.1.1 Adoucissement à la chaux
L'adoucissement désigne l'élimination des ions multivalents à l'origine de la dureté. À l'échelle municipale, cette élimination se fait souvent par précipitation chimique des ions responsables de la dureté au moyen de l'ajout de chaux hydratée [hydroxyde de calcium, Ca(OH)2], de carbonate de soude (carbonate de sodium, Na2CO3) et/ou de soude caustique (hydroxyde de sodium, NaOH). On emploie souvent de la chaux vive (oxyde de calcium, CaO) et on la réhydrate en y ajoutant de l'eau pour créer une boue de chaux hydratée qu'on utilise ensuite pour adoucir l'eau (Davis, 2010). L'ampleur de la réduction de la dureté dépend du type d'agent de précipitation employé, de la dose utilisée, de la température, du pH du système d'approvisionnement en eau potable et du temps de contact au cours du procédé. La stœchiométrie chimique, la résolution d'équations d'équilibres simultanés, les diagrammes d'adoucissement et les essais appropriés (p. ex. essais de floculation [« jar tests »], essais à l'échelle pilote) peuvent servir à déterminer l'agent de précipitation approprié et la dose à utiliser (Letterman et American Water Works Association, 1999; Davis, 2010; Crittenden et coll., 2012). Comme l'adoucissement augmente le niveau de pH de l'eau à plus de 10 et parfois jusqu'à 11,5, le procédé peut inactiver certains microorganismes, car beaucoup ne survivent pas à un pH au-dessus de 10,5 (Logsdon et coll., 1994; AWWA, 1999; 2016).
En ce qui concerne les sources d'eau dont la dureté carbonatée est élevée et la dureté magnésienne est faible, l'adoucissement à la chaux en une seule étape est la méthode la plus simple. On ajoute de la chaux hydratée pour augmenter le pH de l'eau entre approximativement 9,5 et 10 et ainsi précipiter la dureté liée au calcium (Crittenden et coll., 2012). La quantité de CaCO3 et de Mg(OH)2 précipitée augmente avec le pH, jusqu'à l'atteinte d'un équilibre de 10,3 et de 10,8, respectivement. Cependant, ce pH peut varier légèrement en raison de l'interaction du calcium et du magnésium avec d'autres solutés dans l'eau (Letterman et American Water Works Association, 1999). En augmentant le pH, les ions bicarbonate sont convertis en ions carbonate non solubles (Droste, 2019; Letterman et American Water Works Association, 1999). Lorsque la source d'eau contient des concentrations élevées de calcium et de magnésium, on utilise un excès de chaux pour augmenter le pH au-dessus de 11,0 et ainsi précipiter le carbonate de magnésium et l'hydroxyde de magnésium en même temps que le calcium (AWWA, 1999; Lawler et Kweon, 2003; Crittenden et coll., 2012).
Lorsque le niveau de magnésium et/ou de dureté non carbonatée de la source d'eau est important, il est possible d'ajouter du carbonate de soude lors d'une étape ultérieure pour obtenir la réduction souhaitée de la dureté à un pH supérieur à 10,5 (Cadena et coll., 1974; Crittenden et coll., 2012). La soude caustique permet également de précipiter la dureté calcique lorsque la dureté carbonatée n'est pas suffisante pour réagir avec la chaux (Crittenden et coll., 2012). Cette réaction produit moins de boue, mais elle est généralement plus coûteuse que les méthodes d'adoucissement à la chaux, puisqu'elle est très abondante (Mercer et coll., 2005; Davis, 2010).
En règle générale, le niveau de dureté le plus bas qui peut être atteint avec l'adoucissement à la chaux est de 30 mg/L de CaCO3, pour le calcium et de 10 mg/L de CaCO3 pour le magnésium. Cette limite est due à la solubilité du CaCO3 et du Mg(OH)2, à la contrainte physique du mélange et du contact, et au manque de temps pour que la réaction soit complète (Davis, 2010). La limite théorique pour la réduction de la dureté de l'eau par l'adoucissement à la chaux et au carbonate de sodium est de 13,5 mg/L de CaCO3 (Cadena et coll., 1974).
Si elle est présente, la matière organique naturelle (MON) peut également précipiter et ralentir la précipitation de la dureté (Mercer et coll., 2005). Il faut neutraliser le dioxyde de carbone (CO2) et l'acide carbonique avant d'augmenter le pH, car ils entreront en compétition pour réagir avec la chaux avant que l'adoucissement ne puisse se produire (Letterman et American Water Works Association, 1999; AWWA, 2016).
Lorsque le pH dépasse le point de saturation du CaCO3, il est souvent nécessaire de recarbonater l'eau par l'ajout de CO2. La réaction de précipitation sera arrêtée, ce qui empêchera le dépôt de CaCO3 en aval du procédé de traitement et dans le réseau de distribution (Davis, 2010). L'ajout de CO2 entraîne la conversion de l'alcalinité carbonatée en alcalinité bicarbonatée et abaisse le pH de l'eau à un niveau plus neutre (Hill, 1924). Il est important de surveiller de près le CO2, car il peut réagir avec un excès de chaux, former du CaCO3 (AWWA, 2016) et accroître la dureté. La postchloration (avec du chlore gazeux) peut suffire à réduire le pH jusqu'au pH de saturation sans qu'il soit nécessaire de recarbonater l'eau (Crittenden et coll., 2012).
Pour l'adoucissement à la chaux, le temps de contact dépend fortement de la température, des réactions plus longues étant nécessaires lorsque l'eau est froide. Le temps de contact peut être insuffisant pour atteindre un état d'équilibre chimique dans les installations de mélange chimique (Hoover et Langelier, 1938), mais il peut néanmoins atteindre le point où les réactions ralentissent considérablement. Il faudra surveiller les filtres en aval afin d'éviter une précipitation excessive des solides contribuant à la dureté si les réactions sont incomplètes à l'étape d'adoucissement à la chaux dans les installations de traitement. Plusieurs études se sont penchées sur les effets détaillés de chacune de ces conditions (temps de contact, pH, etc.) (Droste et coll., 1997; Crittenden et coll., 2012). Les équations chimiques et les schémas de traitement des procédés d'adoucissement décrits ci-dessus sont disponibles dans Droste et coll., 1997; Letterman et American Water Works Association, 1999; Davis, 2010; Crittenden et coll., 2012; et AWWA, 2016.
Dans une étude sur le traitement intégré de l'eau par adoucissement et par ultrafiltration, les auteurs ont noté que les caractéristiques (p. ex. taille, structure, charge de surface) des précipités [p. ex. CaCO3, Mg(OH)2] formés au cours du procédé d'adoucissement peuvent influer sur l'élimination de la dureté (Lawler et Kweon, 2003). Randtke et ses collaborateurs (1982) ont constaté que, lorsque de la chaux est utilisée pour l'adoucissement, les cristaux formés sont petits et se déposent lentement, ce qui permet une élimination importante du Ca+. Lorsqu'on utilise du NaOH pour amorcer le processus, de nombreux noyaux sont produits et ceux-ci précipitent rapidement, ce qui entraîne une concentration de calcium résiduel plus élevée. Les précipités formés par la soude donnent une plus faible quantité de calcite. Ces propriétés ont une incidence sur l'élimination des ions responsables de la dureté, car elles influent sur la vitesse de décantation et l'affinité chimique pour les composés individuels (Lawler et Kweon, 2003). Le procédé d'adoucissement peut réduire simultanément d'autres substances dans l'eau brute. Il est possible de consulter une liste des substances inorganiques et de leur taux d'élimination observé (Letterman et American Water Works Association, 1999; Davis, 2010).
5.1.1.2 Traitement par mélange
Le traitement par mélange, aussi appelé traitement fractionné, est une forme plus avancée d'adoucissement par précipitation, dans laquelle la chaîne de traitement comprend un débit secondaire qui contourne les bassins d'adoucissement à la chaux et qui rejoint en aval l'eau complètement adoucie provenant des bassins d'adoucissement à la chaux (Davis, 2010; Crittenden et coll., 2012). Conçue pour offrir une méthode simple et économique de contrôle des procédés, cette technique nécessite beaucoup moins d'intervention de la part de l'opérateur que dans une usine d'adoucissement à la chaux classique (Cherry, 1955; Rossum, 1955; Black, 1966). La conception fractionnée permet de réduire les coûts d'exploitation, car on ne traite qu'une partie de l'eau pour éliminer la dureté, puis on la mélange avec d'autres eaux dans les installations de traitement (Cherry, 1955; Shuey, 1966; Davis, 2010).
Ce procédé permet d'éliminer davantage la dureté magnésienne, car il est possible de réaliser, dans les bassins, la sursaturation et la précipitation du calcium et du magnésium en une seule étape (Zipf et coll., 1981). Le traitement fractionné par excès de chaux peut réduire le magnésium à sa limite de solubilité de 10 mg/L de CaCO3 (Letterman et American Water Works Association, 1999). On peut ajouter du carbonate de sodium au débit recombiné afin de réduire la dureté non carbonatée (Zipf et coll., 1981). Il peut être nécessaire de recarbonater le débit recombiné par l'ajout de CO2 gazeux afin de stabiliser le pH et les caractéristiques de qualité de l'eau. Zipf et ses collaborateurs (1981) ont constaté que la recarbonatation peut ne pas être nécessaire pour le procédé à la chaux et au carbonate de sodium, ou s'il y a un retour suffisant de boues avec l'eau recombinée. Les auteurs ont également mis au point une méthode permettant de comprendre les relations d'équilibre afin de déterminer les concentrations souhaitées dans l'eau traitée, ainsi que les variables opérationnelles qui peuvent être utiles aux opérateurs des installations de traitement. Il faut accorder une attention particulière à la qualité de l'eau provenant d'une nouvelle source avant d'apporter tout changement (passage à une autre source, mélange ou interconnexion) à une source d'approvisionnement existante. Par exemple, si la nouvelle source d'eau est plus corrosive, elle peut entraîner un relargage de plomb ou de cuivre dans le réseau de distribution. On devrait analyser la qualité de l'eau du débit d'eau recombiné pour s'assurer qu'elle a atteint les concentrations désirées.
Adoucissement par précipitation améliorée
L'adoucissement par précipitation améliorée vise à réduire les niveaux de dureté et de carbone organique dissous (COD), ce qui permet ultimement de diminuer la formation de sous-produits de désinfection (U.S. EPA, 1999b; Carlson et coll., 2000). On emploie habituellement l'adoucissement par précipitation améliorée pour les sources d'eau ayant des concentrations élevées de MON, car le Mg(OH)2 solide précipité peut éliminer efficacement la MON (Lawler et Kweon, 2003). La grande quantité de chaux nécessaire à l'élimination du magnésium peut produire des boues volumineuses et causer des problèmes opérationnels (Lawler et Kweon, 2003). Rantke et ses collaborateurs (1982) ont noté que, même si on avait observé une réduction du COD avec les procédés d'adoucissement, les mécanismes sous-jacents n'étaient pas clairs. Ils ont également souligné la différence d'efficacité entre les procédés d'adoucissement à la chaux et les procédés d'adoucissement au carbonate de sodium. La présence de cations multivalents (p. ex. Ca2+, Mg2+) peut également entraîner la neutralisation de la charge des composés de la MON qui sont chargés négativement. Cependant, on ne pense pas qu'il s'agisse là du principal mécanisme d'élimination de la MON dans ce procédé d'adoucissement par précipitation. Leentvaar et Rebhun (1982) ont avancé qu'un mécanisme de floculation par balayage expliquerait une grande partie de l'élimination du carbone organique total associée à la précipitation du CaCO3, tandis qu'un mécanisme de neutralisation de la charge serait à l'origine de l'élimination de l'hydroxyde de magnésium. Un document d'orientation a été publié au sujet de l'utilisation des techniques de coagulation et d'adoucissement par précipitation améliorées (U.S. EPA, 1999b).
5.1.1.3 Filtration
Même si une grande partie des solides précipités se dépose dans les bassins de traitement, tous les procédés d'adoucissement peuvent nécessiter une étape de filtration pour éliminer les particules fines. Dans les usines d'adoucissement à la chaux, on emploie habituellement des filtres granulaires rapides. Cependant, le milieu filtrant peut s'encrasser en cas d'excès de particules provenant du procédé d'adoucissement à la chaux. De même, les éléments de membrane peuvent également s'encrasser. Dans une étude sur le traitement intégré de l'eau par adoucissement et par ultrafiltration réalisée par Lawler et Kweon (2003), les auteurs ont constaté que le degré de prétraitement (p. ex. l'ampleur de l'adoucissement) influe sur le degré d'encrassement et l'efficacité du traitement par filtration membranaire. En raison de la cinétique du procédé d'adoucissement, la précipitation peut se poursuivre à la surface ou dans les pores de la membrane pendant la décantation, à moins que la précipitation ne soit chimiquement arrêtée. La précipitation qui se produit à la surface ou dans les pores entraîne une diminution du flux. On peut utiliser le CCPP pour contrôler la précipitation sur les filtres. Après la recarbonatation, on vise habituellement un CCPP inférieur à 5 mg/L à l'entrée du filtre.
5.1.1.4 Adoucissement par échange d'ions
L'échange d'ions est un procédé physicochimique au cours duquel il y a échange d'ions dans l'eau brute contre des ions présents sur la phase solide d'une résine (AWWA, 2005; Crittenden et coll., 2012). Au fur et à mesure que les ions de l'eau brute déplacent les ions sur la résine, la capacité de celle-ci s'épuise graduellement, ce qui entraîne la percée du contaminant. Lorsque la résine a atteint sa capacité, on doit la régénérer pour qu'elle revienne à son état d'origine. Les résines échangeuses d'ions ont une affinité variable pour les divers ions, selon le type et la concentration des ions en solution et le type de résine choisi (Davis, 2005; Crittenden et coll., 2012). Le procédé repose sur des rapports stœchiométriques et l'électroneutralité, la charge de surface totale des billes de résine devant être maintenue en permanence (Crittenden et coll., 2012). Au point de départ, les résines échangeuses d'ions sont saturées de cations monovalents (généralement du sodium) (AWWA, 2005).
Les résines échangeuses de cations fortement acides utilisent généralement un groupement sulfonate fortement acide qui permet la dissociation complète des sels dans l'eau (Davis, 2010; Crittenden et coll., 2012). La dissociation complète des sels permet de réduire la dureté carbonatée et non carbonatée. Cette technologie convient à une large plage de pH, et les résines peuvent être régénérées par rinçage avec une solution fortement acide ou par trempage dans la saumure (sel de sodium) (AWWA, 2005; Crittenden et coll., 2012). Les responsables de systèmes d'approvisionnement en eau potable qui utilisent des résines échangeuses de cations fortement acides sous forme de sodium doivent être conscients que ce procédé pourrait introduire des quantités indésirables de sodium dans l'eau traitée.
Dans une étude portant sur l'adoucissement par échange d'ions (échange de sodium contre du Ca et du Mg) réalisée à l'échelle de banc d'essai au Texas, le système a été en mesure de faire passer le niveau de dureté de 388 à 7 mg/L, la concentration de calcium, de 88 à 1 mg/L, et la concentration de magnésium, de 41 à 1 mg/L (AWWA, 2003). L'eau adoucie était ensuite mélangée à d'autres sources d'eau pour obtenir un produit mélangé sous forme d'eau traitée. Les chercheurs ont estimé qu'il a fallu utiliser environ 2,6 tonnes de sel par million de gallons de produit mélangé pour ce procédé d'adoucissement. La teneur en sodium, qui était de 110 mg/L dans l'eau non traitée, est passée à 286 mg/L dans l'eau adoucie.
5.1.1.5 Filtration sur membrane
Les techniques de filtration sur membrane pour la réduction de la dureté de l'eau potable comprennent l'osmose inverse et la nanofiltration (U.S. EPA, 1999; Odell, 2010). Les membranes d'osmose inverse peuvent réduire les MDT et les ions monovalents, tandis que les membranes de nanofiltration servent principalement à réduire la dureté (Ca2+, Mg2+) (Bergman et coll., 1995). Les systèmes de traitement par osmose inverse nécessitent généralement une étape de préfiltration pour éliminer les particules et comportent souvent d'autres étapes de prétraitement, comme l'ajout d'agents anti-incrustant et la déchloration. Le perméat de la membrane a un faible pH et est très corrosif en raison du prétraitement acide qui empêche l'incrustation (Davis, 2010). L'adoucissement à la chaux, suivi d'une filtration et d'un ajustement du pH, est un prétraitement efficace permettant d'améliorer la performance de la membrane d'osmose inverse et de réduire l'incrustation causée par les sels minéraux présents dans les sources d'eau.
Un prétraitement est nécessaire pour préserver la durabilité des membranes, car la présence de chlore résiduel, de particules, de MON et d'ions incrustants (c.-à-d. Ca2+, Ba2+, fer et silice) dans l'eau d'alimentation peut nuire à la performance des procédés d'osmose inverse. Si les responsables de systèmes d'approvisionnement en eau potable envisagent d'utiliser des membranes d'osmose inverse, il est recommandé de réaliser des essais propres à l'installation pour établir les critères de conception, le potentiel d'encrassement et les besoins liés au prétraitement. Comme les technologies de filtration sur membrane telles que la nanofiltration et l'osmose inverse peuvent éliminer une forte concentration de cations bivalents (Ca2+ et Mg2+), on mélange parfois le perméat à l'eau d'alimentation pour obtenir un niveau de dureté acceptable.
Le post-traitement du perméat d'osmose inverse (c.-à-d. l'eau traitée) comporte habituellement l'ajustement du pH, l'ajout d'inhibiteurs de corrosion et la désinfection. Il faut également tenir compte de l'élimination du concentré obtenu par osmose inverse dans la conception et l'exploitation des installations d'osmose inverse. La formation de dépôts inorganiques, qui résulte de la précipitation de sels à l'intérieur du module membranaire, entraîne une baisse de débit du perméat et réduit la durée de vie de la membrane. De plus amples renseignements sur la réduction de l'incrustation par le CaCO3 ont été publiés par l'AWWA (2005).
Dans une étude pilote menée au Texas sur des membranes d'osmose inverse (pression de 130 psi, récupération de 81 %), les chercheurs ont réussi à faire passer la dureté de 388 mg/L à 3 mg/L, le calcium, de 88 mg/L à < 1 mg/L, et le magnésium, de 41 mg/L à < 1 mg/L (AWWA, 2003). Ils ont ensuite mélangé le perméat d'osmose inverse (68 %) avec des eaux souterraines non traitées (38 %) pour produire une eau mélangée présentant 149 mg/L de dureté, 34 mg/L de calcium et 16 mg/L de magnésium. La filtration sur membrane d'osmose inverse a également permis de réduire la concentration de MDT, qui est passée de 702 mg/L à 14 mg/L dans le perméat. Le pH du perméat était nettement plus bas que celui de l'eau d'alimentation, car de l'acide avait été ajouté à celle-ci afin d'accroître la récupération. Il faut généralement procéder à une reminéralisation avec de la chaux, du CO2 et du bicarbonate de sodium pour réduire la corrosivité de l'eau. Étant donné qu'une eau à faible teneur en minéraux peut laisser un goût amer, sec ou rugueux, la reminéralisation peut améliorer la qualité esthétique de l'eau traitée (Vingerhoeds et coll., 2016; Biyoune et coll., 2017; Lesimple et coll., 2020).
La filtration sur membrane de nanofiltration permet de rejeter jusqu'à 98 % du sulfate de magnésium. Les membranes de nanofiltration ont des pores beaucoup plus étroits (seuil de rétention de poids moléculaire de 500) et rejettent beaucoup d'ions plus gros (Conlon et McClellan, 1989). Dans une étude pilote portant sur deux membranes commerciales utilisant un mélange d'eau distillée et d'eaux souterraines, les membranes de nanofiltration ont atteint un taux de rejet variant entre 79,5 % et 98,4 % pour le calcium, entre 83,3 % et 99 % pour le magnésium, et entre 37,8 % et 83,4 % pour la dureté (Nasr et coll., 2013).
Mulford et ses collaborateurs (1999) ont réalisé une étude sur la filtration sur membrane de nanofiltration à grande échelle et à l'échelle pilote en Floride en ayant recours à différentes configurations de chaînes de traitement. Dans l'étude, l'installation à grande échelle a été en mesure de réduire la dureté, la faisant passer d'un niveau de 290 à 320 mg/L à un niveau de 28 à 46 mg/L, soit une réduction de la dureté de > 84 %. Dans une autre étude à grande échelle menée dans deux stations de traitement de l'eau potable en Floride, la filtration sur membrane de nanofiltration a permis de réduire les niveaux de dureté, les faisant passer d'environ 250 mg/L à une plage comprise entre 10 et 20 mg/L; on a mélangé l'eau filtrée avec l'eau provenant d'un procédé d'adoucissement à la chaux pour produire une eau traitée conforme aux exigences de qualité (Bartels et Wilf, 2007). Les auteurs ont constaté que la membrane de nanofiltration permettait de réduire considérablement le carbone organique total dans l'eau traitée comparativement à l'adoucissement à la chaux. Tang et ses collaborateurs (2019) ont évalué l'utilisation de membranes de nanofiltration dans une installation de traitement de l'eau à grande échelle aux Pays-Bas, et ils ont découvert que la filtration sur membrane de nanofiltration permettait de réduire les niveaux de dureté, les faisant passer de 200 à 130 mg/L; ils ont également constaté que le fait de mélanger l'eau non adoucie avec l'eau adoucie (perméat) permettait d'atteindre la dureté visée.
Dans une étude pilote réalisée en Allemagne, Gorenflo et ses collaborateurs (2002) ont observé que, en présence d'une eau ayant une forte concentration de sulfates et, possiblement, d'une complexation du Ca2+ par des acides humiques, la membrane de nanofiltration rejetait le Ca2+ et le Mg2+ à des taux plus élevés que ceux indiqués par le fabricant. Le taux de rejet du calcium était > 74 %, et celui du magnésium, > 86 %, alors que la concentration de calcium dans l'eau brute était de 114,7 mg/L, celle du magnésium, de 12,3 mg/L, et celle des sulfates, de 99 mg/L.
Plusieurs études à l'échelle de banc d'essai ont montré qu'il est possible de réduire la dureté par la filtration sur membrane de nanofiltration. Van de Bruggen et ses collaborateurs (2001) ont étudié quatre types de membranes de nanofiltration et, selon la membrane, ils ont constaté une réduction du niveau de dureté, qui est passé de 280 mg/L à une valeur comprise entre 14 et 140 mg/L. Selon les auteurs, les taux de rejet plus élevés pour certaines membranes de nanofiltration seraient attribuables aux effets de charge et à la taille des pores ainsi qu'aux interactions du Ca2+ et du Mg2+ avec les membranes ayant une surface de charge positive. Ghizellaoui et ses collaborateurs (2005) ont étudié l'effet de la pression sur les membranes de nanofiltration lorsque l'eau est très dure (600 ppm), et ils ont découvert qu'une pression élevée (4 à 16 bars) entraînait des taux de rétention du calcium et des bicarbonates supérieurs (50 % et 40 %, respectivement), tandis qu'une pression faible (1 et 2 bars) entraînait des taux de rétention inférieurs (34 % et 30 %, respectivement).
5.1.2 Chlorures et sulfates
La plupart des procédés de traitement de l'eau parviennent difficilement à éliminer les ions chlorures et sulfates. Les sources d'eau à forte teneur en sel (c.-à-d. les aquifères saumâtres ou sous l'influence de la mer) peuvent nécessiter un traitement afin de réduire les plaintes des consommateurs et d'obtenir une eau chimiquement stable qui ne sera pas corrosive pour les réseaux de distribution et la plomberie interne des bâtiments.
Il est possible de réduire les concentrations de chlorures et de sulfates par échange d'anions ou par osmose inverse. Les deux technologies produisent également des rejets (saumure concentrée) qui nécessitent un traitement supplémentaire afin d'atténuer les préoccupations environnementales (U.S. EPA, 1999b).
5.1.2.1 Filtration sur membrane
L'osmose inverse permet de rejeter > 90 % des chlorures et > 69 % des sulfates, selon la membrane utilisée (Biesheuvel et coll., 2019). La composition ionique spécifique, ainsi que le pH et la température de l'eau à traiter peuvent influer sur l'efficacité globale de la membrane. Dans certains cas, la membrane éliminera préférentiellement des concentrations supérieures de la forme sulfate de certains sels (p. ex. davantage de sulfate de sodium que de chlorure de sodium) en raison de la différence de taille entre les ions en cause.
En général, les unités de nanofiltration ont un faible taux de rejet pour les petits anions monovalents tels que les chlorures (aussi peu que 7 %) et sont souvent mieux adaptées à l'élimination des gros anions multivalents tels que les sulfates (élimination > 90 %), comme l'ont montré Nasr et ses collaborateurs (2013) dans une étude pilote.
Dans une étude pilote réalisée dans une installation de traitement de l'eau par ultrafiltration aux Pays-Bas, il a été possible de faire passer la concentration de sulfates de 140 à 0,1 mg/L (Duranceau, 2001).
Dans une étude menée à l'échelle de banc d'essai, Schaep et ses collaborateurs (1998) ont observé l'influence de la température sur le taux de rejet des chlorures par nanofiltration. Le taux de rejet était inférieur d'environ 10 % à 30 °C (soit environ 60 % d'après le graphique) comparativement à 10 °C (environ 70 %). Ce phénomène pourrait s'expliquer par l'influence de la température sur la viscosité de l'eau qui, à son tour, a une incidence sur le flux. Une telle baisse n'a pas été observée pour le calcium, le magnésium ou les sulfates dans la même étude.
La technologie d'osmose inverse est principalement utilisée pour éliminer les contaminants inorganiques et, parfois, les responsables de systèmes d'approvisionnement en eau potable peuvent choisir de mélanger l'eau traitée avec l'eau brute pour obtenir une eau traitée non corrosive. Dans de nombreux cas, l'eau produite par les unités d'osmose inverse est jugée corrosive pour les réseaux de distribution et les installations de plomberie résidentielles. Un traitement supplémentaire peut s'avérer nécessaire afin de reminéraliser l'eau avant sa distribution. Dans tous les cas, les opérateurs de systèmes doivent s'assurer que toutes les exigences en matière de traitement microbien sont respectées avant de distribuer l'eau aux consommateurs.
La formation d'incrustation inorganique (par exemple, silice, sulfate de baryum et CaCO3) constitue encore un obstacle important à l'obtention d'un taux élevé de récupération par osmose inverse; elle entraîne une baisse de débit du perméat et réduit la durée de vie de la membrane. L'adoucissement à la chaux, suivi d'une filtration et d'un ajustement du pH, est un prétraitement efficace permettant d'améliorer la performance de l'osmose inverse et de réduire l'incrustation causée par les sels minéraux présents dans les sources d'eau. De plus amples renseignements sur la réduction de l'incrustation par les sulfates ont été publiés par l'AWWA (2005).
5.1.2.2 Échange d'anions
Bien que la technologie d'échange d'anions permet de réduire les sulfates, la plupart des systèmes augmentent la concentration de chlorures dans les rejets. C'est pour cette raison que l'échange d'anions est rarement utilisé dans les systèmes municipaux d'approvisionnement en eau potable. Certains systèmes peuvent avoir recours à l'échange d'anions afin de réduire les concentrations de nitrates, ce qui aura pour effet d'augmenter les concentrations de chlorures. Par conséquent, si on utilise l'échange d'anions, il est important de surveiller les concentrations de chlorures pour vérifier si elles respectent la VBS proposée. Il existe également d'autres régénérants pour les résines échangeuses d'anions qui ne contiennent pas de chlorures, mais il est possible que les coûts d'exploitation augmentent.
5.1.2.3 Produits chimiques de traitement
De nombreux coagulants inorganiques sont des sels à base de chlorures ou de sulfates, par exemple le sulfate d'aluminium, le sulfate ferrique, le sulfate de polyaluminium, le chlorure de polyaluminium ou le coagulant à haute teneur en sulfate de chlorure de polyaluminium (Wu et coll., 2020). Ces coagulants ajoutent tous des chlorures et des sulfates solubles et peuvent contribuer à une grande partie du total des concentrations de l'eau traitée dans les usines de traitement conventionnel par coagulation et filtration. Dans les usines de filtration directe, les chlorures et les sulfates ont un effet plus modéré lors de la coagulation. La désinfection au chlore gazeux produit des ions chlorures libres lorsque le chlore aqueux se dissocie pour former de l'acide hypochloreux. Les unités d'échange d'ions ajoutent également des chlorures, car elles utilisent généralement du chlorure de sodium ou du chlorure de potassium comme saumure de régénération pour l'échange d'ions. Alors que les ions sodium et/ou potassium sont actifs dans les réactions d'échange de régénération, les ions chlorures sont tout simplement évacués dans le rejet lorsque la régénération est terminée. Cet apport supplémentaire de chlorures dans l'environnement est préoccupant, que ce soit sous forme de rejets locaux dans des champs d'épuration ou sous forme de rejets dans les égouts sanitaires. Il pourrait être nécessaire de stocker ou de concentrer cette saumure afin de limiter les effets sur l'environnement en aval. Peu importe l'application, il est important de s'assurer que tous les produits chimiques de traitement utilisés soient certifiés conformes à la norme NSF/ANSI/CAN 60 (Produits chimiques de traitement de l'eau potable – Effets sur la santé) (NSF/ANSI, 2021).
5.1.3 Matières dissoutes totales (MDT)
Les membranes d'osmose inverse et de nanofiltration sont en mesure de réduire les MDT (AWWA, 2005). Certains consommateurs sont en mesure de détecter le passage saisonnier d'une source d'eau à une autre lorsque la teneur en MDT varie considérablement, ce qui peut soulever des préoccupations injustifiées quant à la qualité de l'eau.
5.1.3.1 Filtration sur membrane
Les membranes d'osmose inverse peuvent réduire les MDT et les ions monovalents (Bergman et coll., 1995). Les systèmes de traitement par osmose inverse nécessitent généralement une étape de préfiltration pour éliminer les particules et comportent souvent d'autres étapes de prétraitement, comme l'ajout d'agents antitartre et la déchloration. Un prétraitement visant à réduire la dureté peut être nécessaire afin d'éviter l'incrustation sur des éléments de la membrane. L'adoucissement à la chaux, suivi d'une filtration et d'un ajustement du pH, est un prétraitement efficace permettant d'améliorer la performance de l'osmose inverse et de réduire l'incrustation causée par les sels minéraux présents dans les sources d'eau.
Des membranes de nanofiltration ont permis de réduire certains ions dissous par exclusion de taille dans des usines de traitement de l'eau à grande échelle en Floride, atteignant un taux de réduction des MDT de 33 % à 75 % (Bergman, 1995). Saitua et ses collaborateurs (2011) ont constaté une réduction de 53 % des MDT dans une étude pilote portant sur la filtration sur membrane; dans l'étude, les auteurs ont utilisé une membrane en polyamide pour traiter l'eau, qui présentait une concentration de MDT de 1 290 mg/L dans l'influent. En règle générale, la filtration sur membrane de nanofiltration permet d'éliminer les gros ions multivalents, comme ceux qui causent la dureté. En revanche, les ions monovalents traversent quand même la membrane.
5.1.3.2 Échange d'ions
Les systèmes échangeurs d'ions ont généralement peu d'effet sur les MDT, car cette technologie est conçue pour échanger les ions responsables de la dureté contre des ions qui ne participent pas à la dureté (Crittenden et coll., 2012). Davis (2010) a observé que l'échange d'ions avec une résine échangeuse d'anions fortement basiques peut réduire les MDT lorsque la concentration est inférieure à 500 mg/L et que la concentration de sulfates est < 50 mg/L.
L'adoucissement à la chaux est en mesure de réduire les MDT par l'enlèvement des bicarbonates de calcium et de magnésium sous forme de CaCO3 et de Mg(OH)2 solide, respectivement. Il convient de noter que cette méthode élimine également l'alcalinité et peut nécessiter un traitement supplémentaire pour traiter les problèmes de corrosion (Clifford, 1999).
5.1.4 Sulfure d'hydrogène
Le sulfure d'hydrogène est surtout un problème en raison de son odeur nauséabonde et de son faible seuil olfactif. Les technologies de traitement capables d'abaisser la concentration de sulfure d'hydrogène à ≤ 0,05 mg/L comprennent l'oxydation, l'aération et l'adsorption (Levine et coll., 2004a; Crittenden et coll., 2012; Lemley et coll., 1999; Duranceau et coll., 2010; Odell, 2010).
5.1.4.1 Oxydation
Les oxydants utilisés pour réduire le sulfure d'hydrogène comprennent le chlore, le peroxyde d'hydrogène (H2O2), le permanganate de potassium (KMnO4) et l'ozone (O3) (Thompson et coll., 1995; Levine et coll., 2004a; Crittenden et coll., 2012). Le tableau 17 présente une comparaison sommaire des différents oxydants et des doses requises. Les avantages et les inconvénients des oxydants sont décrits dans Duranceau et coll. (2010).
| Oxydant | Réaction d'oxydation | Dose (mg/mg H2S) |
|---|---|---|
| Chlore | H2S + Cl2 → S0 + 2HCl | 2,08 |
| H2S + 4H2O + 4Cl2 → H2SO4 + 8HCl | 8,33 | |
| Ferrate | 4H2S + 3HFeO4- + 7H+ → 3Fe+2 + S2O3-2 + 2S0 + 9H2O | 2,66 |
| 16H2S + 20HFeO4- + 10H2O → 20Fe(OH)3 + 3H2S2 + SO3-2 + 3S2O3-2 + 3SO4-2 + 6OH- | 4,44 | |
| Peroxyde d'hydrogène | H2S + H2O2 → S0 + 2H2O | 1,03 |
| HS- 4H2O2 → SO4- 2 4H2O + H+ (pH > 8) | 4,11 | |
| Ozone | S-2 + 4O3 + 4H2O → SO4-2 + 4O2 | 5,64 |
| Permanganate de potassium | 3H2S + 2KMnO4 → 3S0 + 2MnO22KOH + 2H2O | 3,09 |
| 3S-2 + 8KMnO4 + 4H2O → 8MnO2 + 3SO4-2 + 8KOH | 12,39 |
Les exigences chimiques pour une oxydation complète des sulfures dépendent du pH et de la température de la solution. En règle générale, la dose d'oxydant augmente avec le pH (Cadena et Peters, 1988). En général, une dose supérieure d'oxydant a tendance à former des sulfates plutôt que du soufre élémentaire, ce qui augmente la turbidité (Cadena et Peters, 1988; Thompson et coll., 1995; Levine et coll., 2004a).
Crittenden et ses collaborateurs (2012) ont observé la formation potentielle de polysulfures lors de l'utilisation de l'oxydation pour enlever le sulfure d'hydrogène. Il y a formation de polysulfures lorsque la concentration de sulfure d'hydrogène est > 1 mg/L et que le pH est < 9. La conversion en sulfates nécessite une dose d'oxydant supérieure aux exigences stœchiométriques et un pH > 8. Les polysulfures sont difficiles à éliminer, ils ont un goût et une odeur uniques, et ils peuvent former des complexes avec les métaux dans les réseaux de distribution, ce qui entraîne la formation d'eaux noires.
L'oxydation du sulfure d'hydrogène par le peroxyde d'hydrogène nécessite de longs temps de contact et de fortes doses d'oxydants. Il en résulte ensuite la formation non seulement de sulfate, mais aussi la formation de soufre colloïdal, qui peut augmenter la turbidité de l'eau (Duranceau et coll., 2010; Thompson et coll., 1995).
Levine et ses collaborateurs (2004a) ont mené une étude pilote dans laquelle ils ont utilisé du peroxyde d'hydrogène en association avec la filtration pour oxyder les eaux souterraines d'un champ de captage en Floride. L'étude pilote a montré que le peroxyde d'hydrogène permettait d'enlever > 60 % du sulfure d'hydrogène après un temps de contact de 6,5 minutes. L'utilisation combinée de l'oxydation catalysée par le sulfate ferrique aux fins de la coagulation du soufre colloïdal a permis d'accroître le taux d'élimination du sulfure d'hydrogène, qui a atteint > 80 %, avec un temps de contact plus court (< 6 minutes). Les auteurs ont conclu que l'utilisation du peroxyde d'hydrogène catalysé par le sulfate ferrique en association avec la filtration pouvait réduire le sulfure d'hydrogène (données sur l'élimination non fournies) et produire une eau peu turbide.
La chloration continue est une méthode courante d'oxydation du sulfure d'hydrogène qui nécessite l'utilisation d'une dose de 2,0 mg/L par 1,0 mg/L de sulfure d'hydrogène (Odell, 2010). Dans une étude réalisée sur le terrain par Lyn et Taylor (1992), l'oxydation par le chlore a entraîné la formation de soufre colloïdal à un pH > 3,8, et l'augmentation du pH a donné lieu à une hausse de la turbidité. Les auteurs ont également constaté que les conditions aérobies à bas pH favorisaient la formation de sulfates, tandis que les conditions anaérobies à pH élevé favorisaient la formation de soufre élémentaire. L'utilisation du chlore pour oxyder les sulfures peut entraîner la formation de sous-produits de désinfection, dont des trihalométhanes et des acides haloacétiques (Levine et coll., 2004a; Thompson et coll., 2010; Levine et coll., 2006; Stefen et coll., 2018).
Ortenberg et ses collaborateurs (2000) ont constaté que l'oxydation du sulfure d'hydrogène par le chlore permettait d'enlever complètement le sulfure d'hydrogène, mais qu'un goût désagréable demeurait. Ils ont émis l'hypothèse que l'oxydation du sulfure d'hydrogène par le chlore produisait du soufre élémentaire et des polysulfures (H2Sn), qui s'hydrolysaient à leur tour en sulfure d'hydrogène. Stefen et ses collaborateurs (2018) ont noté qu'un temps de contact plus long était nécessaire pour augmenter l'efficacité du chlore, mais qu'il pouvait également en résulter la formation de trihalométhanes.
L'utilisation de dioxyde de chlore pour oxyder le sulfure d'hydrogène a entraîné la formation des sous-produits de désinfection chlorites et chlorates, probablement en raison de la présence de constituants inorganiques sous forme réduite (Ortenberg et coll., 2000). L'enlèvement du sulfure d'hydrogène par l'ozone peut produire des sulfates, sans former de trihalométhanes (Stefen et coll., 2018).
Duranceau et ses collaborateurs (2010) ont noté que l'utilisation d'oxygène peut entraîner une oxydation incomplète, créant du soufre colloïdal et des polysulfures. Les auteurs ont également constaté que l'utilisation du ferrate comme oxydant réduisait les sulfures en deçà de la LDM (< 0,3 mg/L). Cependant, le niveau de turbidité a augmenté de manière significative après le contact avec cet oxydant.
Il est possible d'enlever le sulfure d'hydrogène de l'eau par l'utilisation de permanganate de potassium prétraité à l'acide sulfurique afin de réduire le pH, suivie de l'utilisation d'un dégazeur (Willey et coll., 1964). La cinétique du permanganate de potassium est rapide, l'équilibre chimique étant atteint 5 minutes après l'ajout de l'oxydant (Cadena et Peters, 1988). La réaction produit des particules de floc de MnO2 et du soufre élémentaire, qu'il est possible d'enlever par filtration (Duranceau et coll., 2010; Edwards et coll., 2011). Il est nécessaire de contrôler de près la dose de permanganate de potassium pour éviter la production d'eau rose causée par un excès de manganèse (Levine et coll., 2004a). En outre, le dioxyde de manganèse formé par la réaction peut produire une turbidité excessive dans le réseau de distribution (Levine et coll., 2004a).
Dans des études pilotes, Duranceau et ses collaborateurs (2010) ont utilisé de l'hypochlorite comme oxydant pour traiter des eaux souterraines en Floride. L'oxydant a été utilisé avant l'emploi d'un procédé breveté de filtration ou d'un filtre à sable vert de manganèse. Il y a eu régénération du processus en continu avec de l'eau de Javel pour enlever le sulfure d'hydrogène des eaux souterraines. Les résultats préliminaires ont montré que la combinaison de ces technologies permettait de réduire les sulfures, les faisant passer d'une concentration comprise entre 1,4 et 2,6 mg/L à une concentration de moins de 1,0 mg/L (limite de détection). Dans une autre étude pilote, Duranceau et Trupiano (2011) ont évalué sur des eaux souterraines en Floride deux procédés différents de filtration sur milieu oxydé : l'oxydation au NaOCl précédant une filtration par procédé exclusif et l'oxydation au NaOCl précédant la filtration au MnO2. Les deux procédés ont permis de réduire la concentration de sulfure en deçà de la limite de détection (< 0,1 mg/L) et de produire une eau traitée d'une turbidité < 1,0 UTN (unité de turbidité néphélométrique).
5.1.4.2 Aération
L'aération consiste à mettre l'eau et l'air en contact étroit pour éliminer les gaz dissous (comme le CO2) et oxyder les métaux dissous tels que le fer, de même que le sulfure d'hydrogène et les composés organiques volatils. L'aération est une méthode couramment employée pour traiter les sulfures lorsque leur concentration est inférieure à 2,0 mg/L et lorsqu'ils sont présents en phase gazeuse (Lemley et coll., 1999; Duranceau et coll., 2010; Odell, 2010). La préoxydation n'est pas recommandée pour l'aération du sulfure d'hydrogène, car elle peut produire des sulfures, des bisulfures ou du soufre solide, lesquels ne peuvent pas être éliminés par strippage à l'air et devront faire l'objet d'un traitement ultérieur par filtration de l'eau traitée (Odell, 2010).
Le pH de l'eau joue un rôle important dans la forme du sulfure d'hydrogène présent. Il est difficile d'enlever le sulfure d'hydrogène dans l'eau dont le pH est > 7, car la majeure partie du sulfure d'hydrogène est présente sous forme d'ions HS- et H+. Le fait de diminuer le pH de l'eau entrant dans un système d'aération peut améliorer l'efficacité de l'élimination du sulfure d'hydrogène et abaisser les niveaux de turbidité, mais peut aussi entraîner la formation de certains sous-produits de désinfection et accroître le taux de corrosion du cuivre (Thompson et coll., 1995; Edwards et coll., 2011). L'enlèvement des sulfures est d'environ 80 % à un pH de 6 et de seulement 70 % à un pH de 7 (Lemley et coll., 1999; Odell, 2010). L'aération de l'eau libère du CO2, ce qui augmente le pH, car le sulfure d'hydrogène est converti en HS-, réduisant ainsi l'efficacité globale du procédé de strippage (Levine et coll., 2004b; Munter et Vilu, 2008; Crittenden et coll., 2012).
L'utilisation d'aérateurs à cascades ou à plateaux et la volatilisation dans les installations de stockage souterraines ne sont qu'en partie efficaces pour l'enlèvement des sulfures, qui dépend du pH et des conditions atmosphériques (p. ex. davantage de sulfures sont éliminés par temps chaud et venteux) (Duranceau et coll., 2010). Montgomery (1985) a rapporté avoir utilisé un aérateur à à cascades sur plateaux sur un réservoir d'eaux souterraines et a constaté une élimination de seulement 20 % du sulfure d'hydrogène à la température et au pH ambiants. Le sulfure restant a été oxydé par le chlore en soufre élémentaire dans le réservoir. L'auteur a noté que le procédé produisait des niveaux élevés de turbidité et une odeur nauséabonde d'œuf pourri.
Les tours à garnissage ont une efficacité de strippage plus élevée, mais le CO2 est libéré plus rapidement que le sulfure d'hydrogène. Par conséquent, le pH change au fur et à mesure que l'eau s'écoule le long du matériau de garnissage, ce qui influe sur l'efficacité de l'élimination (Duranceau et coll., 2010). L'utilisation d'acide carbonique pour ajuster le pH avant l'aération par tour à garnissage peut s'avérer un prétraitement efficace et contribuer au contrôle de la corrosion (Duranceau et coll., 2010).
L'aération est largement utilisée en Estonie, où le procédé consiste à mettre en contact une fine pellicule d'eau descendante avec de l'air à la surface du matériau de garnissage en bois, en céramique ou en plastique. Munter et ses collaborateurs (1999) ont noté une diminution de la concentration de sulfure, qui est passée d'une valeur moyenne de 0,003 à 0,5 mg/L à une valeur de 0,3 mg/L. Dans une étude à grande échelle menée sur la côte ouest de l'Estonie, on a traité des eaux souterraines par aération suivie d'une filtration sur sables verts de manganèse, ce qui a permis de faire passer la concentration de sulfure d'hydrogène d'une fourchette de 0,64 à 3,4 mg/L à une fourchette de 0,04 à 0,89 mg/L.
L'utilisation d'un lit percolateur à grande échelle a permis d'éliminer le sulfure d'hydrogène de l'eau de puits en Grèce (Terkerlekopoulou et coll., 2010). L'eau de deux puits était stockée dans un château d'eau situé à 15 mètres du sol. L'eau coulait en cascade dans le réservoir d'homogénéisation et était soumise à une aération au moment de son passage dans le filtre, ce qui a permis d'éliminer le sulfure d'hydrogène (concentration comprise entre 1 et 1,3 mg/L dans l'eau brute) à la sortie du filtre (données sur l'eau traitée non fournies).
5.1.4.3 Échange d'ions
Le sulfure d'hydrogène peut être éliminé à l'aide de résines échangeuses d'anions, car une grande partie du sulfure d'hydrogène présent dans l'eau est sous forme ionisée. L'efficacité du système dépend de la résine choisie et de la concentration des anions en compétition (sulfates, carbone organique total et alcalinité) ainsi que du pH de l'eau. En règle générale, on utilise une résine de chlorure pour éliminer le sulfure d'hydrogène (Lemley et coll., 1999; Odell, 2010). La résine peut également s'encrasser en raison de la croissance de sulfobactéries, ce qui peut nuire à l'efficacité de l'élimination (Duranceau et coll., 2010).
Dans une étude pilote réalisée en Floride, on a constaté que l'échange d'anions sur lit fixe pouvait éliminer une concentration de 0,82 à 3,22 mg/L de sulfure dans l'eau brute (Levine et coll., 2006). Aucune donnée n'a été fournie sur l'élimination et l'eau traitée. Les auteurs ont également examiné les améliorations biologiques associées à l'échange d'anions, car la faible concentration d'oxygène dissous (< 2 mg/L) a favorisé la croissance de bactéries oxydantes de soufre à la surface supérieure de la résine, améliorant ainsi l'élimination du sulfure d'hydrogène en le convertissant en soufre élémentaire ou en sulfates. Les sous-produits de l'oxydation biologique du soufre, soit le soufre élémentaire et les sulfates, ont été éliminés par l'échangeur d'anions. Les auteurs ont constaté que le fait d'utiliser l'oxydation biologique du soufre en association avec l'échange d'anions offrait l'avantage d'augmenter la capacité d'échange, ce qui s'est traduit par des cycles de fonctionnement deux à trois fois plus longs, diminuant ainsi la fréquence de régénération de la colonne.
Dans une étude réalisée par Vidović et ses collaborateurs (2010) dans une installation pilote, les auteurs ont utilisé un système d'échange d'ions, suivi d'une colonne d'adsorption. Le système d'échange d'ions a permis d'éliminer jusqu'à 60 % du sulfure d'hydrogène en milieu acide (pH de 6,6 à 7,2); toutefois, en milieu alcalin, il n'y a eu aucune élimination du sulfure d'hydrogène. Le sulfure d'hydrogène qui n'avait pas été entièrement enlevé par le système d'échange d'ions l'a été ultérieurement par adsorption.
5.1.4.4 Milieux adsorbants
Le charbon actif en grains (CAG) peut généralement réduire le sulfure d'hydrogène à des concentrations inférieures à 0,3 mg/L (Lemley, 1999; Odell, 2010). Le charbon catalytique, un type de charbon actif dont la surface est modifiée, a la capacité de promouvoir ou de catalyser des réactions chimiques. Le charbon catalytique peut adsorber les sulfures à la surface du charbon et, en présence d'oxygène dissous, il oxyde les sulfures en soufre élémentaire (S8) et en sulfates (Megonnell et Spotts, 1994). Une concentration minimale d'oxygène dissous de 4,0 mg/L est nécessaire pour obtenir une oxydation complète du sulfure d'hydrogène en soufre élémentaire, qui peut alors être filtré (Saunders et Urbans, 1995; Lemley et coll., 1999; Odell, 2010).
Dans une série d'études pilotes réalisées par Ikehata et ses collaborateurs (2015) dans la ville de Huntington Beach, en Californie, les auteurs ont utilisé un milieu CAG produit à partir de coquille de noix de coco (milieu certifié conforme à la norme NSF 61) pour éliminer le sulfure d'hydrogène. À l'aide de cinq filtres CAG en série, il a été possible de réduire la concentration de sulfure d'hydrogène, la faisant passer d'une valeur comprise entre 0,02 et 0,7 mg/L à une valeur inférieure à la LDM de 0,01 mg/L.
On peut employer la filtration'sur sables ver's de manganèse pour traiter l'eau contenant moins de 5,0 mg/L de sulfure d'hydrogène (les données sur la performance de cette méthode n'ont pas été fournies). Le revêtement de dioxyde de manganèse sur le filtre catalyse le sulfure d'hydrogène gazeux en soufre solide, qui est ensuite filtré (Odell, 2010). Willey et ses collaborateurs (1964) ont réalisé une étude à grande échelle dans une usine de traitement de l'eau du centre de l'Indiana. L'usine fonctionnait depuis deux ans, et l'étude a montré que le sulfure d'hydrogène pouvait être éliminé de l'eau à l'aide d'un procédé de régénération consistant en un apport continu en permanganate de potassium dans l'eau traversant un filtre à sables verts de manganèse. Les auteurs ont également conclu qu'un dosage d'acide sulfurique étendu et l'aération permettaient d'éliminer mécaniquement une grande partie du sulfure d'hydrogène (passant de 11,3 ppm à une valeur inférieure à la LDM) et de réduire la demande en permanganate de potassium. Saunders et Lee (1996) ont constaté que, lorsque le permanganate de potassium est utilisé avec des sables verts de manganèse, les sables verts peuvent être encrassés par le fer et d'autres contaminants, ce qui permet au soufre de s'infiltrer si le permanganate de potassium vient à s'épuiser. Il est donc important de surveiller le filtre à sables verts de manganèse pour s'assurer qu'il fonctionne de manière optimale.
5.1.4.5 Filtration microbiologique
Les bactéries peuvent oxyder les sulfures en soufre en présence d'une quantité limitée d'oxygène. Lorsque la concentration d'oxygène dissous est < 0,1 mg/L, le produit dominant est le soufre élémentaire, tandis que, lorsque la concentration d'oxygène dissous est élevée, les sulfates constituent le produit dominant (Janssen et coll., 1998). La filtration microbiologique permet de réduire le sulfure d'hydrogène, mais les organismes peuvent se détacher des surfaces et causer de la turbidité en aval des installations de stockage (Duranceau et coll., 2010).
Levine et ses collaborateurs (2004b) ont mené des études pilotes pour comparer l'oxydation au peroxyde d'hydrogène en continu couplé à un système de filtration à courant ascendant en deux étapes avec et sans l'ajout d'une faible dose de sulfate ferrique comme catalyseur pour éliminer le sulfure d'hydrogène. L'ajout de sulfate ferrique a permis d'augmenter le taux d'élimination du sulfure d'hydrogène, le faisant passer d'un taux compris entre 20 % à 40 % (temps de contact d'environ 2 à 6 minutes) à un taux de plus de 80 % (temps de contact de 2 minutes), et de réduire la turbidité de l'eau produite à moins de 0,1 UTN, tout en diminuant la demande en chlore. Ce procédé a permis de réduire le sulfure d'hydrogène et la turbidité connexe, tout en diminuant la demande en chlore.
5.1.5 Résidus
Les boues résultant de l'ajout de chaux ou de carbonate de sodium peuvent représenter un fardeau opérationnel important pour les services de l'eau qui utilisent des procédés de précipitation chimique (AWWA, 1981). Les responsables de systèmes d'approvisionnement en eau potable devraient prendre des mesures afin d'éliminer régulièrement ces solides pour éviter que ces fines particules ne soient entraînées dans l'eau traitée. Il est également possible de réduire la quantité de boue en remplaçant partiellement la chaux ou le carbonate de sodium par de la soude caustique.
5.2 Traitement à l'échelle résidentielle
Plusieurs techniques de traitement peuvent réduire efficacement ces substances à l'échelle résidentielle, par exemple dans un petit système ou dans une habitation dont l'eau potable provient d'un puits privé.
Avant d'installer un dispositif de traitement, il convient de faire analyser l'eau pour en déterminer les caractéristiques chimiques générales, de même que la concentration des paramètres d'intérêt dans la source d'approvisionnement en eau. Il faudrait faire analyser périodiquement l'eau qui entre dans le dispositif de traitement et l'eau traitée par un laboratoire accrédité afin de confirmer l'efficacité du dispositif de traitement. Comme les dispositifs de traitement peuvent perdre leur capacité d'élimination avec l'usage et le temps, ils doivent être entretenus et/ou remplacés au besoin. Les consommateurs devraient vérifier la durée de vie prévue des composants de leur dispositif de traitement selon les recommandations du fabricant et assurer l'entretien requis. Certains systèmes résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d'une seule résidence, de sorte qu'ils peuvent aussi être utilisés dans des systèmes de petite taille.
Il existe des dispositifs de traitement certifiés pour à l'échelle résidentielle qui permettent de réduire la dureté, les sulfates, les chlorures, les MDT et le sulfure d'hydrogène.
5.2.1 Calcium, magnésium et dureté
Il existe actuellement un certain nombre de dispositifs de traitement certifiés à l'échelle résidentielle qui permettent d'éliminer de l'eau potable le calcium, le magnésium et d'autres éléments contribuant à la dureté de l'eau potable. Ces dispositifs comportent des systèmes d'échange de cations, d'osmose inverse et de distillation.
Les systèmes échangeurs d'ions (pour l'adoucissement de l'eau) certifiés conformes à la norme NSF/ANSI 44 (Residential Cation Exchange Water Softeners) permettent de réduire la dureté de l'eau potable. Pour être certifié conforme à la norme NSF/ANSI 44 pour la réduction de la dureté, le dispositif doit pouvoir faire passer la dureté de 20 grains par gallon (342 mg/L) dans l'eau à traiter à moins de 1,0 grain par gallon (17,1 mg/L) dans l'eau traitée (NSF/ANSI, 2022a). Des niveaux supérieurs de dureté nécessitent des quantités plus élevées de sel pour atteindre une dureté acceptable.
Les propriétaires qui ont un puits privé et qui utilisent un adoucisseur fonctionnant par échange d'ions sous forme de sodium devraient savoir que le dispositif de traitement peut introduire des quantités indésirables de sodium dans l'eau traitée. Il est recommandé d'utiliser une source d'approvisionnement distincte pour l'eau potable destinée à la consommation et aux usages culinaires. Si on utilise un adoucisseur d'eau, il est également recommandé de ne pas adoucir une partie de l'eau qui sert le plus souvent à la consommation (c.-à-d. l'eau du robinet de la cuisine) afin d'éviter un apport excessif en sel. L'annexe E contient des renseignements sur l'apport en sodium résultant de l'utilisation d'un adoucisseur d'eau, par degré de dureté.
Un système d'osmose inverse devrait pouvoir éliminer la dureté mais il n'existe pas de système certifié. En outre, l'utilisation d'un système d'osmose inverse pour éliminer des niveaux élevés de dureté entraînerait un encrassement plus rapide de la membrane, nécessiterait un entretien plus fréquent et réduirait la durée de vie de la membrane. Les consommateurs pourraient devoir prétraiter l'eau entrante pour réduire l'encrassement et prolonger la durée de vie de la membrane d'osmose inverse. Il n'est généralement pas pratique d'installer un système d'osmose inverse au point d'entrée de l'eau d'une résidence, car il faut de plus grandes quantités d'affluent pour obtenir le volume requis d'eau traitée.
Le procédé de distillation devrait aussi permettre d'éliminer la dureté, mais il n'existe pas de système certifié. Un système de distillation certifié conforme à la norme NSF/ANSI 62 (Drinking Water Distillation Systems) permet de réduire les MDT en utilisant le chlorure de sodium comme substitut. Pour être certifié conforme à la norme 62 pour l'enlèvement des MDT, le dispositif doit pouvoir réduire d'au moins 97 % une concentration moyenne de 1 000 mg/L de MDT dans l'eau à traiter (c.-à-d. l'amener à 30 mg/L) (NSF/ANSI, 2022b).
Les systèmes d'osmose inverse et de distillation devraient être installés uniquement au point d'utilisation, car l'eau traitée peut être corrosive pour les composants internes de la plomberie.
Dans un rapport détaillé préparé par Brodeur et Barbeau (2015) à partir des données de Barbeau et ses collaborateurs (2011), les auteurs ont présenté des données sur l'efficacité des technologies de traitement aux fins de l'élimination du manganèse dans les eaux souterraines. Le rapport présente également les résultats de l'élimination de la dureté pour 96 systèmes utilisant diverses techniques, avec une concentration moyenne de 136 356 µg/L (136,36 mg/L) dans l'eau brute et une concentration moyenne de 49 549 µg/L (49,50 mg/L) dans l'eau traitée. Les auteurs ont constaté que les systèmes d'échange d'ions et d'osmose inverse étaient en mesure de réduire la dureté, avec des taux d'élimination médians de 99 % et de 72 %, respectivement. Les résultats des différentes techniques sont résumés à l'annexe D (tableau D.1).
5.2.2 Chlorures et sulfates
Il existe peu de techniques permettant de réduire les chlorures et les sulfates à l'échelle résidentielle. Les chlorures et les sulfates ont tous deux tendance à rester en solution et participent à peu de réactions chimiques. Il est possible de réduire les concentrations de chlorures et de sulfates par échange d'anions ou par osmose inverse. On trouve actuellement un certain nombre de dispositifs de traitement résidentiel certifiés pour l'élimination des chlorures et des sulfates dans l'eau potable. Ces dispositifs utilisent des systèmes de filtration installés au point d'utilisation ou au point d'entrée.
Les systèmes de distillation pour l'élimination des sulfates et des chlorures doivent pouvoir faire passer les composés d'une concentration moyenne de 800 mg/L dans l'eau à traiter à une concentration maximale de 250 mg/L dans l'eau traitée (NSF/ANSI, 2022b).
Les propriétaires peuvent aussi s'approvisionner de sources d'eau et d'aquifères présentant des concentrations plus faibles de sulfates et de chlorures s'ils estiment que les concentrations actuelles sont trop élevées.
5.2.3 Matières dissoutes totales (MDT)
Il existe actuellement sur le marché un certain nombre de dispositifs de traitement résidentiel certifiés pour l'élimination des MDT dans l'eau potable. Ces dispositifs utilisent des systèmes de filtration au point d'utilisation ou au point d'entrée, des systèmes d'osmose inverse et des systèmes de distillation.
Les exigences relatives à la réduction des MDT sont décrites dans la norme NSF/ANSI 42 (Drinking Water Treatment Units – Aesthetic Effects). Pour être certifié conforme à la norme 42 pour l'élimination des MDT, le dispositif doit pouvoir faire passer les MDT d'une concentration moyenne de 1 500 mg/L dans l'eau à traiter à une concentration maximale de 500 mg/L dans l'eau traitée (NSF/ANSI, 2022c).
Les exigences relatives à la réduction des MDT sont également décrites dans la norme NSF/ANSI 58 (Reverse Osmosis Drinking Water Treatment). Pour être certifié conforme à la norme 58 pour l'élimination des MDT, le dispositif doit pouvoir réduire d'au moins 75 % une concentration moyenne de 750 mg/L de MDT dans l'eau à traiter (c.-à-d. l'amener à 187 mg/L) (NSF/ANSI, 2022d).
La norme NSF/ANSI 62 (Drinking Water Distillation Systems) s'applique à la réduction des MDT sous forme de chlorure de sodium dans l'eau potable. Pour être certifié conforme à la norme 62 pour l'élimination des MDT, le dispositif doit pouvoir réduire d'au moins 97 % une concentration moyenne de 1 000 mg/L de MDT dans l'eau à traiter (c.-à-d. l'amener à 30 mg/L) (NSF/ANSI, 2022b).
L'eau traitée par osmose inverse ou par distillation peut être corrosive pour les composants internes de la plomberie. Les dispositifs de traitement par osmose inverse ou par distillation devraient donc être installés uniquement au point d'utilisation. Il n'est généralement pas pratique d'installer un système d'osmose inverse au point d'entrée de l'eau, car il faut de plus grandes quantités d'influent pour obtenir le volume requis d'eau traitée. Il arrive parfois que le consommateur doive prétraiter l'eau entrante pour réduire l'encrassement de la membrane et en prolonger la durée de vie.
5.2.4 Sulfure d'hydrogène
Il existe actuellement des dispositifs de traitement résidentiel certifiés pour l'élimination du sulfure d'hydrogène dans l'eau potable. Ces dispositifs utilisent des systèmes de filtration installés au point d'utilisation ou au point d'entrée. Les exigences relatives à la réduction du sulfure d'hydrogène sont décrites dans la norme NSF/ANSI 42 (Drinking Water Treatment Units – Aesthetic Effects). Pour être certifié conforme à la norme 42 pour l'élimination du sulfure d'hydrogène, le dispositif doit pouvoir faire passer le sulfure d'hydrogène d'une concentration moyenne de 1,0 mg/L dans l'eau à traiter à une concentration maximale permissible de 0,05 mg/L dans l'eau traitée (NSF/ANSI, 2022c).
6.0 Stratégies de gestion
Tous les responsables de systèmes d'approvisionnement en eau potable devraient mettre en place une approche axée sur la gestion des risques, par exemple une approche « de la source au robinet » ou un plan de salubrité de l'eau pour assurer la salubrité de l'eau. Ces stratégies nécessitent une évaluation du réseau pour : caractériser la source d'approvisionnement en eau, décrire les barrières de traitement qui préviennent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. La surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (par exemple, procédures opérationnelles normalisées, mesures correctives et interventions en cas d'incident). D'autres protocoles pour valider le plan de gestion de la sécurité sanitaire de l'eau sont adoptés (par exemple, tenue de registres, satisfaction des consommateurs). Il faut aussi former les opérateurs pour veiller à ce que ce plan soit efficace en tout temps (Smeets et al., 2009).
On peut employer plusieurs stratégies de gestion afin de réduire les concentrations des paramètres opérationnels dans l'eau potable, notamment :
- Envisager le recours à un système centralisé de traitement pour le ou les paramètres préoccupants, tout en tenant compte des effets en aval sur les réseaux de distribution.
- Envisager de mélanger des sources d'eau présentant des concentrations plus faibles de ces paramètres.
- Réexaminer les caractéristiques de la source d'eau et la concentration du ou des paramètres préoccupants, et éventuellement utiliser une nouvelle source d'eau ayant des concentrations plus faibles de ces paramètres.
- Régler toute source anthropique des paramètres préoccupants.
- Informer le public sur la pertinence, pour les consommateurs, d'installer des systèmes de traitement au point d'entrée ou au point d'utilisation.
6.1 Stratégies de contrôle
Dans les sources d'eau où les concentrations des paramètres opérationnels sont supérieures à ce qui est acceptable, une ou plusieurs options de techniques de traitement (voir section 5.0) peuvent être mises en œuvre. D'autres stratégies de contrôle peuvent inclure le mélange contrôlé avant le point d'entrée du réseau, l'interconnexion avec et/ou l'achat d'eau à un autre système d'approvisionnement en eau potable. Il faut accorder une attention particulière à la qualité de l'eau provenant d'une nouvelle source avant d'apporter tout changement (passage à une autre source, mélange ou interconnexion) à l'approvisionnement existant. Par exemple, si la nouvelle source d'eau est plus corrosive, elle peut entraîner un relargage de plomb ou de cuivre dans le réseau de distribution. On devrait analyser la qualité de l'eau du débit d'eau recombiné pour s'assurer qu'elle possède les concentrations désirées.
6.1.1 Mélange
L'échange d'ions (adoucisseur d'eau) constitue la solution qui présente le meilleur potentiel pour la réduction globale des paramètres opérationnels. Pour adoucir l'eau, il est de pratique courante de faire dévier une partie de l'eau brute vers l'extérieur de le bassin de traitement, puis de mélanger l'eau ainsi déviée à l'eau traitée. Le mélange de l'eau traitée avec l'eau brute peut stabiliser l'eau traitée et diminuer les coûts de traitement en réduisant le volume d'eau traitée. Cela pourrait réduire le besoin de régénération, et réduire également les coûts d'élimination de la saumure et des produits chimiques (U.S. EPA, 1999b). Cependant, il faut prendre en compte la concentration de chaque paramètre dans la portion d'eau non traitée pour s'assurer que la concentration finale ne dépasse pas les objectifs de traitement.
Lorsque les responsables de systèmes d'approvisionnement en eau potable implantent une stratégie de contrôle telle qu'une nouvelle source d'eau, le mélange ou encore l'interconnexion avec une autre source afin de réduire la dureté, ils devraient évaluer la qualité de l'eau provenant des nouvelles sources et celle du mélange pour s'assurer qu'il n'y a pas d'interférence avec les procédés de traitement existants, qu'il n'y a pas d'effet sur le réseau de distribution ou d'autres problèmes de qualité de l'eau.
D'autres options généralement envisagées pour la réduction du calcium et du magnésium sont la séquestration ou la chélation. Ces deux procédés ont pour effet de stabiliser les ions bivalents et d'empêcher la précipitation dans des conditions normales. Habituellement, on utilise un polyphosphate de sodium ou de potassium pour isoler et stabiliser les ions en solution responsables de la dureté. Cela pourrait s'appliquer à la dureté calcique et magnésienne, ainsi qu'à des facteurs de dureté mineurs tels que le fer et le manganèse. La séquestration est généralement considérée comme une mesure de réduction temporaire, étant donné que son effet est d'une durée limitée (Kohl et Medlar, 2006).
Les effets de la chélation peuvent s'atténuer avec le temps, entraînant une précipitation dans les tuyaux et les appareils en aval. La séquestration n'est généralement pas recommandée comme stratégie, car elle peut avoir un effet négatif sur d'autres métaux (par exemple, le plomb). L'utilisation des polyphosphates est examinée plus en détail dans le document de Santé Canada intitulé Document de conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion (Santé Canada, 2022a).
6.2 Surveillance
Il est recommandé d'échantillonner régulièrement la prise d'eau de la station pour toutes les sources d'approvisionnement en eaux de surface afin de caractériser la variabilité saisonnière des paramètres opérationnels. Selon la nature du bassin versant, la fonte des neiges peut diluer la concentration de la plupart des paramètres. Cependant, il est possible qu'elle permette également la migration des eaux souterraines dans le réseau primaire d'eaux de surface, ce qui peut en fait augmenter les concentrations pendant une courte période au cours de la fonte printanière. Les réserves d'eaux souterraines présentent généralement une concentration plus stable de ces paramètres, mais il serait utile de les surveiller régulièrement, sur une base trimestrielle, afin de s'assurer que l'aquifère n'a pas changé de manière abrupte.
6.2.1 Caractérisation de la source d'approvisionnement en eau
Il faut caractériser la qualité de l'eau afin de suivre les changements possibles de la qualité de l'eau à la suite des mesures de réduction ou du traitement, et de définir les répercussions potentielles sur le réseau de distribution. Un changement dans la qualité de l'eau ne devrait jamais causer de problème de conformité. L'essai pilote de la méthode de traitement ou de l'option de réduction choisie pour contrer la dureté constitue aussi une importante étape dans l'évaluation des conséquences imprévues, telles que la modification de la qualité de l'eau.
6.2.2 Traitement
Après la mise en place d'un système de traitement pour réduire la dureté (y compris les mesures de réduction), il est recommandé de procéder à une surveillance trimestrielle au minimum, afin de confirmer que l'objectif d'ordre esthétique n'est pas dépassé. Il faut prélever les échantillons après le traitement et avant la distribution (généralement au point d'entrée du réseau de distribution). Le prélèvement d'échantillons appariés de l'eau à la source et de l'eau traitée permettra de vérifier l'efficacité du traitement ou de la mesure de réduction.
Les systèmes d'osmose inverse et d'échange d'ions sont souvent utilisés en mode de dérivation, c'est-à-dire qu'une partie du débit entrant (eau brute) est mélangée à l'eau traitée pour obtenir la qualité d'eau souhaitée. Lorsque cette méthode de réduction est utilisée, il est important de surveiller l'eau traitée mélangée et d'en mesurer la dureté finale.
6.2.3 Opérationnelle
Les services d'eau qui réduisent la dureté par la technique d'adoucissement à la chaux devraient contrôler sur une base opérationnelle la concentration de calcium et de magnésium, ainsi que le pH.
Si un service d'eau utilise un procédé d'adoucissement de l'eau par échange d'ions, les responsables devraient également surveiller, pour chaque échangeur, le moment à partir duquel le procédé cesse de réduire la dureté de l'eau, afin de déterminer à quel moment la résine doit être régénérée et d'obtenir le degré voulu de réduction de la dureté. Si on utilise des résines cationiques fortement acides sous forme d'ions hydrogène, un point opérationnel qu'il ne faut pas négliger est la possibilité que les contaminants donnent lieu à un pic chromatographique rapide. Le baryum et le calcium étant les cations de prédilection de ces résines échangeuses d'ions, on peut observer des pics chromatographiques pour certains ions, comme le sodium et le magnésium, dans l'eau traitée. Le traitement par résines échangeuses de cations fortement acides sous forme d'ions hydrogène et par résines échangeuses de cations faiblement acides doit être suivi d'une étape d'extraction du CO2 et d'une étape d'ajustement du pH ou de l'alcalinité afin de réduire la corrosivité de l'eau traitée.
Les responsables de systèmes d'approvisionnement en eau potable dont l'eau est traitée par résine échangeuse de cations sous forme d'ions sodium devraient savoir que ce procédé peut introduire des quantités indésirables de sodium dans l'eau traitée.
Les systèmes d'osmose inverse et d'échange d'ions sont souvent utilisés en mode de dérivation, c'est-à-dire qu'une partie du débit entrant (eau brute) est mélangée à l'eau traitée pour obtenir la qualité d'eau souhaitée. Lorsque cette méthode de réduction est utilisée, il est important de surveiller l'eau traitée mélangée et d'en mesurer la dureté finale.
6.2.4 Mélange
Il importe de surveiller l'eau traitée mélangée afin de déterminer la concentration finale des composants de la dureté. On devrait utiliser le même type de désinfectant (chlore ou chloramine) pour éviter les problèmes de qualité de l'eau et de désinfection. Il faut prendre en compte les problèmes de corrosion lorsqu'on mélange des eaux de qualité différente. Une augmentation du pH au cours de l'adoucissement à la chaux peut entraver l'efficacité des unités de désinfection primaire. Il est également possible d'éliminer davantage d'agents pathogènes par la phase de sédimentation des procédés d'élimination de la dureté par précipitation (Cornwell et coll., 2003).
6.2.5 Résidentiel
Les propriétaires de puits privés et les exploitants de petits systèmes sont encouragés à faire analyser la dureté de leur eau pour s'assurer que la concentration dans leur source d'approvisionnement est inférieure à l'objectif d'ordre esthétique. S'ils utilisent un dispositif de traitement résidentiel, les propriétaires de puits privés devraient faire analyser périodiquement l'eau qui entre dans le dispositif ainsi que l'eau traitée afin de s'assurer de l'efficacité de l'appareil. De plus, les propriétaires devraient savoir que l'utilisation d'adoucisseurs à échange d'ions peut introduire des quantités indésirables de sodium dans l'eau traitée.
7.0 Considérations internationales
L'U.S. EPA n'a établi aucune norme concernant la dureté de l'eau potable. Le calcium et le magnésium ne sont traités qu'indirectement comme composants de la dureté et sont considérés comme des paramètres d'ordre esthétique (USGS, 2018; 2023). L'U.S. EPA et l'Organisation mondiale de la Santé (OMS) classent la dureté globale (tableau 18) selon les catégories suivantes : douce, modérée, dure et très dure (McGowan, 2000; USGS, 2023).
| Eau douce (mg/L) |
Eau modérément dure (mg/L) |
Eau dure (mg/L) |
Eau très dure (mg/L) |
|
|---|---|---|---|---|
| Organisation mondiale de la Santé (OMS, 2009) | < 60 | 61–120 | 121–180 | > 180 |
| EPA des États-Unis (USGS, 2023) | < 60 | 61–120 | 121–180 | > 180 |
| Australie (NHMRC, NRMMC, 2011) |
< 60 Douce, mais corrosive |
60–200 Bonne |
200–500 Incrustation accrue |
> 500 Incrustation grave |
| Union européenne (Directive de l'UE sur l'eau potable, 2020) |
Varie selon les pays. Certains pays recommandent des concentrations minimales de Ca et de Mg afin d'éviter des problèmes de corrosion et de goût. | |||
Les chlorures et les sulfates sont visés par des limites d'ordre esthétique d'environ 250 mg/L dans de nombreux pays, y compris aux États-Unis, en Australie et dans l'Union européenne (tableau 19). L'OMS et l'Australie signalent également que les sulfates peuvent avoir un effet laxatif à la concentration de 500 mg/L.
Les MDT, qui sont une mesure globale des solides dissous, ont été placés sur la liste des contaminants secondaires de l'U.S. EPA, en raison de préoccupations quant au goût et d'ordre esthétique. L'OMS et l'Australie ont fixé une limite d'ordre esthétique de 0,05 mg/L pour le sulfure d'hydrogène.
| Chlorures (mg/L) |
Sulfates (mg/L) |
MDT (mg/L) |
H2S (mg/L) |
|
|---|---|---|---|---|
| Organisation mondiale de la Santé (OMS, 2009) |
|
|
|
|
| EPA des États-Unis (U.S. EPA, 2020) |
|
|
|
|
| Australie (NHMRC, NRMMC (2011) |
|
|
|
|
| Union européenne (Directive de l'UE sur l'eau potable, 2020) |
|
|
|
|
|
||||
8.0 Justification des objectifs esthétiques
Le seuil gustatif du calcium se situerait entre 100 et 300 mg/L (Burlingame et coll., 2007). Le magnésium peut également donner un goût désagréable (amer) à l'eau potable, avec un seuil gustatif compris entre 100 et 500 mg/L (Burlingame et coll., 2007).
L'augmentation de la teneur en ions chlorures peut également donner un goût désagréable à l'eau potable en présence de sodium, de calcium, de potassium et de magnésium (Burlingame et coll., 2007). Le seuil gustatif pour les chlorures est estimé entre 200 mg/L et 300 mg/L (Dietrich et Burlingame, 2015). Cependant, on pense que cet effet se produit de concert avec la concentration d'ions sodium, les ions chlorures ne modifiant que légèrement la perception du goût.
On a rapporté que les sulfates ont un seuil gustatif de 250 mg/L, le sulfate de sodium, un seuil de 250 mg/L, et le sulfate de calcium, un seuil de 1 000 mg/L (Lin et coll., 2019). Les sulfates en concentrations modérées sont plus acceptables pour la plupart des consommateurs, du point de vue du goût. La combinaison des sulfates et d'autres composants des MDT peut générer un profil gustatif qui reste équilibré et acceptable jusqu'à des concentrations modérées de MDT.
Les MDT sont un facteur déterminant du goût de l'eau, et l'acceptation par les consommateurs dépend de leur exposition préalable et de ce à quoi ils sont habitués (Lin et coll., 2019). Par exemple, en France, les consommateurs sont habitués à boire de l'eau minérale, et ils acceptent une eau contenant de 300 mg/L à 350 mg/L, tandis qu'en Californie, les consommateurs préfèrent une eau sans goût minéral avec environ 80 mg/L de MDT (Lin et coll., 2019). Van der Aa (2003) a noté que les consommateurs acceptent généralement l'eau dont le niveau de MDT est inférieur à 1 000 mg/L et que l'eau ayant un faible niveau de MDT peut sembler dénuée de goût. En règle générale, les consommateurs étaient capables de percevoir une différence de goût lorsque la concentration de MDT changeait d'environ 150 mg/L (Devesa et Dietrich, 2018).
Le sulfure (sous forme de sulfure d'hydrogène) est bien reconnaissable à son odeur d'œuf pourri. Son seuil olfactif est bas, de moins de 0,01 ppm à 0,3 ppm. La détermination d'un seuil olfactif comporte des incertitudes, car ce seuil varie selon la sensibilité individuelle (OMS, 2000; Greenberg et coll., 2013). Le seuil médian de détection de l'odeur du sulfure d'hydrogène se situe à 0,008 ppm d'après Amoore et Hautala (1983), selon une compilation de 25 rapports publiés au sujet du seuil olfactif.
D'après ces considérations relatives au goût et à l'odeur (qui varient selon la source d'eau, les conditions locales, l'accoutumance, le pH et la température de l'eau), des objectifs d'ordre esthétique sont proposés pour les composés suivants :
- chlorures : ≤ 250 mg/L
- sulfates : ≤ 500 mg/L
- MDT : ≤ 500 mg/L
- sulfure (sous forme de sulfure d'hydrogène) : ≤ 0,05 mg/L
Les objectifs d'ordre esthétique proposés visent à réduire au minimum les plaintes liées à un goût, une odeur ou une incrustation excessive inacceptables, et à améliorer la confiance des consommateurs dans la qualité de l'eau potable. Les méthodes d'analyse disponibles permettent de mesurer facilement les concentrations de ces paramètres opérationnels, et il existe des technologies de traitement efficaces disponibles à l'échelle municipale et résidentielle.
9.0 Références
- Allen, N.E., Key, T.J., Appleby, P.N., Travis, R.C., Roddam, A.W., Tjønneland, A., Johnsen, N.F., Overvad, K., Linseisen, J., Rohrmann, S., Boeing, H., Pischon, T., Bueno-De-Mesquita, H.B., Kiemeney, L., Tagliabue, G., Palli, D., Vineis, P., Tumino, R., Trichopoulou, A., Kassapa, C., Trichopoulos, D., Ardanaz, E., Larrãaga, N., Tormo, M.J., González, C.A., Quirós, J.R., Sánchez, M.J., Bingham, S., Khaw, K.T., Manjer, J., Berglund, G., Stattin, P., Hallmans, G., Slimani, N., Ferrari, P., Rinaldi, S. et Riboli, E. (2008). Animal foods, protein, calcium and prostate cancer risk: The European prospective investigation into cancer and nutrition. Br. J. Cancer, 98(9): 1574–1581.
- Aloia, J.F., Dhaliwal, R., Shieh, A., Mikhail, M., Fazzari, M., Ragolia, L. et Abrams, S.A. (2014). Vitamin D supplementation increases calcium absorption without a threshold effect. Am. J. Clin. Nutr., 99(3): 624–631.
- Amoore, J.E. et Hautala, E. (1983). Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatilities for 214 industrial chemicals in air and water dilution. J. Appl. Toxicol. 3(6): 272–290.
- Anastassopoulou, J. et Theophanides, T. (2002). Magnesium-DNA interactions and the possible relation of magnesium to carcinogenesis. Irradiation and free radicals. Crit. Rev. Oncol. Hematol., 42(1): 79–91.
- Anderson, J.J., Kruszka, B., Delaney, J.A., He, K., Burke, G.L., Alonso, A., Bild, D.E., Budoff, M. et Michos, E.D. (2016). Calcium intake from diet and supplements and the risk of coronary artery calcification and its progression among older adults: 10-year follow-up of the multi-ethnic study of atherosclerosis (MESA). J. Am. Heart Assoc., 5(10): e003815.
- APHA, AWWA et WEF (2017). Standard methods for the examination of water and wastewater. 23rd Ed. (Version en ligne). Standard methods for the examination of water and wastewater. American Public Health Association. Disponible à https://www.standardmethods.org/
- Arnaud, M. (2003). Mild dehydration: A risk factor of constipation? Eur. J. Clin. Nutr., 57(2): S88–S95.
- Arnold, I.M., Dufresne, R.M., Alleyne, B.C. et Stuart, P.J. (1985). Health implication of occupational exposures to hydrogen sulfide. J. Occup. Med., 27(5): 373–376 (cité dans ATSDR, 2016).
- Asnes, R.S., Wisotsky, D.H., Migel, P.F., Seigle, R.L. et Levy, J. (1982). The dietary chloride deficiency syndrome occurring in a breast-fed infant. J. Pediatr., 100(6): 923–924.
- ATSDR (2006). Toxicological profile for hydrogen sulfide. U.S. Department of Health and Human Services, Public Health Service, ATSDR, Atlanta, Géorgie.
- ATSDR (2016). Toxicological profile for hydrogen sulphide and carbonyl sulphide. U.S. Department of Health and Human Services. Public Health Service Agency for Toxic Substances and Disease Registry. Disponible à https://www.atsdr.cdc.gov/ToxProfiles/tp114.pdf
- Attene-Ramos, M.S., Nava, G.M., Muellner, M.G., Wagner, E.D., Plewa, M.J. et Gaskins, H.R. (2010). DNA damage and toxicogenomic analyses of hydrogen sulfide in human intestinal epithelial FHs 74 int cells. Environ. Mol. Mutagen., 51(4): 304–314.
- Aune, D., Navarro Rosenblatt, D.A., Chan, D.S., Vieira, A.R., Vieira, R., Greenwood, D.C., Vatten, L.J. et Norat, T. (2015). Dairy products, calcium, and prostate cancer risk: A systematic review and meta-analysis of cohort studies. Am. J. Clin. Nutr., 101(1): 87–117.
- AWWA (1981). Lime softening sludge treatment and disposal. Committee Report.. J. Am. Water Works Assoc., 73(11): 600-608.
- AWWA (1999). Water quality and treatment: A handbook of community water supplies. 5th ed. Letterman, R.D., Ed. McGraw-Hill, New York, NY.
- AWWA (2005). Water treatment plant design. Fourth edition. American Water Works Association et American Society of Civil Engineers. Denver, CO.
- AWWA (2016). Water system operations (WSO) Treatment, grade III&IV. American Water Works Association (AWWA). Denver, CO.
- Backer, L.C. (2000). Assessing the acute gastrointestinal effects of ingesting naturally occurring, high levels of sulfate in drinking water. Crit. Rev. Clin. Lab. Sci., 37(4): 389–400.
- Bain, S.D., Jerome, C., Shen, V., Dupin-Roger, I. et Ammann, P. (2009). Strontium ranelate improves bone strength in ovariectomized rat by positively influencing bone resistance determinants. Osteoporosis Int., 20(8): 1417–1428.
- Ballinger, D. et Lloyd, A. (1981). A method for the determination of sulphides in water, sewage, and effluents. Water Pollut. Control, 80(5): 648–654.
- Barbeau, B., Carrière, A. et Bouchard, M. (2011). Spatial and temporal variations in manganese concentrations in drinking water. J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng., 46(6): 608–616.
- Bartels, C., Lai, K. et Wilf, M. (2007). New generation of low fouling nanofiltration membranes. Proceedings of the 2007 EDS Conference, 2007, Halkidiki, Greece. Hydranautics, Oceanside, CA.
- Baskar, R., Li, L. et Moore, P.K. (2007). Hydrogen sulfide-induces DNA damage and changes in apoptotic gene expression in human lung fibroblast cells. Faseb j., 21(1): 247–255.
- Bates, M.N., Garrett, N., Graham, B. et Read, D. (1997). Air pollution and mortality in the Rotorua geothermal area. Aust. New Zealand J. Public Health, 21(6): 581-586.
- Bates, M.N., Garrett, N., Graham, B. et Read, D. (1998). Cancer incidence, morbidity and geothermal air pollution in Rotorua, New Zealand. Int. J. Epidemiol., 27(1): 10–14.
- Baylis, J.R. (1926). Factors other than dissolved oxygen influencing the corrosion of iron pipes. Ind. Eng. Chem., 18(4): 370–380.
- Bean (1968). Quality goals for potable water. J. Am. Water Works Assoc., 60: 1317.
- Beauchamp, R.O., Jr, Bus, J.S., Popp, J.A., Boreiko, C.J. et Andjelkovich, D.A. (1984). A critical review of the literature on hydrogen sulfide toxicity. Crit. Rev. Toxicol., 13(1): 25–97.
- Bergman, R.A. (1995). Membrane softening versus lime softening in Florida: A cost comparison update. Desalination, 102: 11–24.
- Biesheuvel, P., Zhang, L., Gasquet, P., Blankert, B., Elimelech, M. et Van Der Meer, W. (2019). Ion selectivity in brackish water desalination by reverse osmosis: Theory, measurements, and implications. Environ. Sci. Technol. Lett., 7(1): 42–47.
- Biyoune, M.G., Atbir, A., Bari, H., Hassnaoui, L., Mongach, E., Khadir, A., Boukbir, L., Bellajrou, R. et Elhadek, M. (2017). Remineralization of permeate water by calcite bed in the Daoura's plant (south of Morocco). Eur. Phys. J. Spec. Top., 226: 931–941.
- Black, A. (1966). Split-treatment water softening at Dayton. J. Am. Water Works Assoc., 58(1): 97–106.
- Blunden J. et Aneja V.P. (2008). Characterizing ammonia and hydrogen sulfide emissions from a swine waste treatment lagoon in North Carolina. Atmos. Environ., 42(14): 3277–3290.
- Bonovas, S., Fiorino, G., Lytras, T., Malesci, A. et Danese, S. (2016). Calcium supplementation for the prevention of colorectal adenomas: A systematic review and meta-analysis of randomized controlled trials. World J. Gastroenterol., 22(18): 4594-4603.
- Bowman, B.A. et Russell, R.M. (2006). Nutrition. 9th. Nutrition. ILSI Press, Washington, DC (cité dans Rosborg et Kozisek, 2020).
- British Columbia Ministry of Health. (2021). Communication personnelle avec D. Fishwick.
- Brodeur, M.E. et Barbeau, B. (2015). Performance of point-of-use and point-of-entry technologies for the removal of manganese in drinking water: Summary of the EDU-MANGO epidemiological study. Rapport préparé pour Santé Canada et disponible sur demande.
- Brown, E.M. (1991). Extracellular Ca2+ sensing, regulation of parathyroid cell function, and role of Ca2+ and other ions as extracellular (first) messengers. Physiol. Rev., 71(2): 371–411.
- Burlingame, G.A., Dietrich, A.M. et Whelton, A.J. (2007). Understanding the basics of tap water taste. J. Am. Water Works Assoc., 99(5): 100–111.
- Burton, A.C. et Comhill, J.F. (1977). Correlation of cancer death rates with altitude and with the quality of water supply of the 100 largest cities in the United States. J. Toxicol. Environ. Health, 3(3): 465–478.
- Cadena, F.C., Midkiff, W.S., et O'Connor, G.A. (1974). Calcium carbonate ion-pair as a limit to hardness removal. J. Am. Water Works Assoc., 66(9): 524–526.
- Cadena, F. et Peters, R.W. (1988). Evaluation of chemical oxidizers for hydrogen sulfide control. J. Water Pollut. Control Fed., 60(7): 1259–1263.
- Campbell, A.K. (1990). Calcium as an intracellular regulator. Proc. Nutr. Soc., 49(1): 51–56.
- Cao, X., Ding, L., Xie, Z.Z., Yang, Y., Whiteman, M., Moore, P.K. et Bian, J.S. (2019). A review of hydrogen sulfide synthesis, metabolism, and measurement: Is modulation of hydrogen sulfide a novel therapeutic for cancer? Antioxid. Redox Signal., 31(1): 1–38.
- Carlson, K., Via, S., Bellamy, B. et Carlson, M. (2000). Secondary effects of enhanced coagulation and softening. J. Am. Water Works Assoc., 92(6): 63–75.
- Cass, J. (1953). Report on the physiological effects of some common inorganic salts in water on man and domestic animals. Cincinnati, OH: The Ohio River Valley Water Sanitation Commission (cité dans Backer, 2000).
- Castenmiller, J.J., Mensink, R.P., van der Heijden, L., Kouwenhoven, T., Hautvast, J.G., de Leeuw, P.W. et Schaafsma, G. (1985). The effect of dietary sodium on urinary calcium and potassium excretion in normotensive men with different calcium intakes. Am. J. Clin. Nutr., 41(1): 52–60.
- Catling, L.A., Abubakar, I., Lake, I.R., Swift, L. et Hunter, P.R. (2008). A systematic review of analytical observational studies investigating the association between cardiovascular disease and drinking water hardness. J. Water Health, 6(4): 433–442.
- Chapra, S.C., Dove, A. et Warren, G.J. (2012). Long-term trends of great lakes major ion chemistry. J. Great Lakes Res., 38(3): 550–560.
- Chellan, P. et Sadler, P.J. (2015). The elements of life and medicines. Philos. Trans. A. Math. Phys. Eng. Sci., 373(2037): 20140182.
- Chen, P., Hu, P., Xie, D., Qin, Y., Wang, F. et Wang, H. (2010). Meta-analysis of vitamin D, calcium and the prevention of breast cancer. Breast Cancer Res. Treat., 121(2): 469–477.
- Chen, Y., Strasser, S., Cao, Y., Wang, K.S. et Zheng, S. (2015). Calcium intake and hypertension among obese adults in United States: Associations and implications explored. J. Hum. Hypertens., 29(9): 541–547
- Cherry, A.K. (1955). Split-treatment method of water softening. J. Am. Water Works Assoc., 47(4): 393–397.
- Chien, L., Robertson, H. et Gerrard, J.W. (1968). Infantile gastroenteritis due to water with high sulfate content. Can. Med. Assoc. J., 99(3): 102–104.
- CIRC (2018). Agents classified by the IARC monographs, volumes 1–123. Disponible à https://monographs.iarc.who.int/wp-content/uploads/2018/09/ClassificationsAlphaOrder.pdf
- Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Chapter 9. Dans : Water quality and treatment: a handbook of community water supplies, 5th edition. Letterman, R.D. (ed). American Water Works Association. Denver, CO.
- Coleman, R.L. (1976). Potential public health aspects of trace elements and drinking water quality. Ann. Okla. Acad. Sci., 5: 57.
- Commission géologique du Canada (2014). Canada's groundwater resources. Fitzhenry & Whiteside. Markham, Ontario. Disponible à https://publications.gc.ca/site/eng/9.854795/publication.html
- Conlon, W.J., et McClellan, S.A. (1989). Membrane softening: A treatment process comes of age. J. Am. Water Works Assoc., 81(11): 47–51.
- Cormick, G., Ciapponi, A., Cafferata, M.L., Cormick, M.S. et Belizán, J.M. (2022). Calcium supplementation for prevention of primary hypertension. Cochrane Database Syst. Rev., 1(1): CD010037.
- Cornwell, D.A., MacPhee, M.J., Brown, R.A. et Via, S.H. (2003). Demonstrating cryptosporidium removal using spore monitoring at lime-softening plants. J. Am. Water Works Assoc., 95(5): 124–133.
- Correa, J., Hahn, D. et Ellison, D. (2010). A variety of construction methods and pipeline materials help create a new sewer system. Proceedings of the Pipelines 2010 Conference, 2010, anonyme, pp. 13–22.
- Cotruvo, J.A., Costello, R. et Weglicki, W.B. (2017). Magnesium, hard water, and health. J. Am. Water Works Assoc., 109(11): 62–68.
- Cowan, J.A. (2002). Structural and catalytic chemistry of magnesium-dependent enzymes. Biometals, 15(3): 225–235.
- Crittenden, J.C., Trussell, R.R., Hand, D.W., Howe, K.J. et Tchobanoglous, G. (2012). MW's water treatment: Principles and design. Third edition. John Wiley & Sons, Hoboken, NJ.
- Davis, M.L. (2010). Water and wastewater engineering: Design principles and practise. Toronto: McGraw-Hill, NY, NY.
- Del Gobbo, L.C., Imamura, F., Wu, J.H.Y., de Oliveira Otto, Marcia C, Chiuve, S.E. et Mozaffarian, D. (2013). Circulating and dietary magnesium and risk of cardiovascular disease: A systematic review and meta-analysis of prospective studies. Am. J. Clin. Nutr., 98(1): 160–173.
- D'Elia, L., Galletti, F. et Strazzullo, P. (2014). Dietary salt intake and risk of gastric cancer. Cancer Treat. Res., 159: 83–95.
- Développement durable Manitoba (2021). Communication personnelle avec K. Philip, Section de la gestion de la qualité de l'eau.
- Devesa, R. et Dietrich, A.M. (2018). Guidance for optimizing drinking water taste by adjusting mineralization as measured by total dissolved solids (TDS). Desalination, 439: 147–154.
- Dietrich, A.M. et Burlingame, G.A. (2015). Critical review and rethinking of USEPA secondary standards for maintaining organoleptic quality of drinking water. Environ. Sci. Technol., 49(2): 708–720.
- Dong, J., Xun, P., He, K. et Qin, L. (2011). Magnesium intake and risk of type 2 diabetes: Meta-analysis of prospective cohort studies. Diabetes Care, 34(9): 2116–2122.
- Droste, R.L. (1997). Theory and practice of water and wastewater treatment. First Edition. Wiley. Hoboken, NJ.
- Droste, R.L. (2019). Theory and practice of water and wastewater treatment. Second Edition. Wiley. Hoboken, NJ.
- du Cailar, G., Ribstein, J. et Mimran, A. (2002). Dietary sodium and target organ damage in essential hypertension. Am. J. Hypertens., 15(3): 222–229.
- Dudi, A. et Edwards, M. (2004). Galvanic corrosion of lead bearing plumbing devices. Dans : Reconsidering lead corrosion in drinking water: Product testing, direct chloramine attack and galvanic corrosion. Faculty of the Virginia Polytechnic Institute and State University, Blacksburg, VA. pp. 69–105 (mémoire de maîtrise d'A. Dudi).
- Duranceau, S.J. (2001). Membrane practices for water treatment. First edition. American Water Works Association, Denver, CO.
- Duranceau, S.J., Trupiano, V.M., Lowenstine, M., Whidden, S. et Hopp, J. (2010). You cannot hide from hydrogen sulfide: But there are alternatives for treatment. Proceedings of the American Water Works Association Annual Conference and Exposition, 2010, American Water Works Association, Denver, CO.
- Duranceau, S.J. et Trupiano, V.M. (2011). Evaluation of oxidized media filtration for removing sulfides from groundwater. Desalination Water Treat., 28(1-3): 366–377.
- Edwards, S., Alharthi, R. et Ghaly, A.E. (2011). Removal of hydrogen sulphide from water. Am. J. Environ. Sci., 7(4): 295–305.
- EFSA (2015a). Scientific opinion on dietary reference values for magnesium. Groupe Scientifique sur la nutrition, les nouveaux aliments et les allergènes alimentaires (groupe NDA) de l'EFSA. 13(7): 4186. Disponible à https://www.efsa.europa.eu/en/efsajournal/pub/4186
- EFSA (2015b). Scientific opinion on dietary reference values for calcium. Groupe Scientifique sur la nutrition, les nouveaux aliments et les allergènes alimentaires (groupe NDA) de l'EFSA. 13(5): 4101. Disponible à https://www.efsa.europa.eu/en/efsajournal/pub/4101
- EFSA (2019). Dietary reference values for chloride. 27(9): 5779. Disponible à https://www.efsa.europa.eu/en/efsajournal/pub/5779
- Environnement et Changement climatique Canada (2022). Les sels de voirie : foire aux questions. Disponible à https://www.canada.ca/fr/environnement-changement-climatique/services/polluants/sels-voirie/foire-questions.html
- Esteban, E., Rubin, C.H., McGeehin, M.A., Flanders, W.D., Baker, M.J. et Sinks, T.H. (1997). Evaluation of infant diarrhea associated with elevated levels of sulfate in drinking water: A case-control investigation in South Dakota. Int. J. Occup. Environ. Health, 3(3): 171–176.
- Evans, C.E., Chughtai, A.Y., Blumsohn, A., Giles, M. et Eastell, R. (1997). The effect of dietary sodium on calcium metabolism in premenopausal and postmenopausal women. Eur. J. Clin. Nutr., 51(6): 394–399.
- Exley, C. (2013). Aluminum in biological systems. In: Encyclopedia of metalloproteins. Kretsinger, R.H., Uversky, V.N. and Permyakov, E.A. (eds.). Springer New York, pp. 33–34.
- Expert Group on Vitamins and Minerals (2003). Safe upper levels for vitamins and minerals. Disponible à https://cot.food.gov.uk/sites/default/files/vitmin2003.pdf
- Fang, W., Shi, L. et Wang, R. (2014). Mixed polyamide-based composite nanofiltration hollow fiber membranes with improved low-pressure water softening capability. J. Memb. Sci., 468: 52–61.
- Fujii, N., Yano, S. et Takeshita, K. (2016). Selective enhancing effect of metal ions on mutagenicity. Genes Environ., 38(1): 21.
- Ganry, O., Boudet, J., Wargon, C., Hornych, A. et Meyer, P. (1993). Effect of sodium bicarbonate and sodium chloride on arterial blood pressure, plasma renin activity and urinary prostaglandins in healthy volunteers. J. Hypertens. Suppl., 11(5): S202–3.
- Ghizellaoui, S., Chibani, A. et Ghizellaoui, S. (2005). Use of nanofiltration for partial softening of very hard water. Desalination, 179: 315–322.
- Gobalarajah, K., Subramaniam, P., Jayawardena, U.A., Rasiah, G., Rajendra, S. et Prabagar, J. (2020). Impact of water quality on chronic kidney disease of unknown etiology (CKDu) in Thunukkai Division in Mullaitivu District, Sri Lanka. BMC Nephrol., 21(1).
- Gomez, G.G., Sandler, R.S. et Seal Jr, E. (1995). High levels of inorganic sulfate cause diarrhea in neonatal piglets. J. Nutr., 125(9): 2325–2332.
- Goodwin, L.R., Francom, D., Urso, A. et Dieken, F.P. (1988). Determination of trace sulfides in turbid waters by gas dialysis/ion chromatography. Analytical chemistry. Anal. Chem., 60(3): 216–219.
- Gorenflo, A., Velázquez-Padrón, D. et Frimmel, F.H. (2002). Nanofiltration of a German groundwater of high hardness and NOM content: Performance and costs. Desalination, 151: 253–265.
- Gosselin, R. (1984). Hydrogen sulfide. Dans : Clinical toxicology of commercial products. Hydrogen sulfide. 5th ed. Williams & Wilkins, Baltimore, MD, pp. 198–202 (cité dans OMS, 2003).
- Greenberg, M.I., Curtis, J.A. et Vearrier D. (2013). The perception of odor is not a surrogate marker for chemical exposure: a review of factors influencing human odor perception. Clin. Toxicol. (Phila.), 51(2): 70–76.
- Gross, S.J., David, R.J., Bauman, L. et Tomarelli, R.M. (1980). Nutritional composition of milk produced by mothers delivering preterm. J. Pediatr., 96(4): 641–644.
- Guillemant, J., Le, H.T., Accarie, C., du Montcel, S.T., Delabroise, A.M., Arnaud, M.J. et Guillemant, S. (2000). Mineral water as a source of dietary calcium: Acute effects on parathyroid function and bone resorption in young men. Am. J. Clin. Nutr., 71(4): 999–1002.
- Haahtela, T., Marttila, O., Vilkka, V., Jäppinen, P. et Jaakkola, J.J. (1992). The South Karelia air pollution study: Acute health effects of malodorous sulfur air pollutants released by a pulp mill. Am. J. Public Health, 82(4): 603–605.
- Hach Co. (2015a). Hardness, calcium and magnesium: Calmagite colorimetric method 8030. 10th ed. Hach Company. Disponible à https://www.hach.com/WAH#H
- Hach Co. (2015b). Hardness, total: Titration method with EDTA method 8213. 8th ed. Hach Company. Disponible à https://www.hach.com/WAH#H
- Hach Co. (2019). Hardness, calcium: Titration method with EDTA method 8204. 9th ed. Hach Company. Disponible à https://www.hach.com/WAH#H
- Hach Co. (2021). Conductivity: USEPA direct measurement method 8160. 10th ed. Hach Company. Disponible à https://www.hach.com/WAH#H
- Hagley, S.R. et South, D.L. (1983). Fatal inhalation of liquid manure gas. Med. J. Aust., 2(9): 459–460.
- Heizer, W.D., Sandler, R.S., Seal Jr., E., Murray, S.C., Busby, M.G., Schliebe, B.G. and Pusek, S.N. (1997). Intestinal effects of sulfate in drinking water on normal human subjects. Dig. Dis. Sci., 42(5): 1055–1061.
- Hessel, P.A., Herbert, F.A., Melenka, L.S., Yoshida, K. et Nakaza, M. (1997). Lung health in relation to hydrogen sulfide exposure in oil and gas workers in Alberta, Canada. Am. J. Ind. Med., 31(5): 554–557 (cité dans U.S. EPA, 2003b).
- Hidayat, K., Chen, G.C., Zhang, R., Du, X., Zou, S.Y., Shi, B.M. et Qin, L.Q. (2016). Calcium intake and breast cancer risk: Meta-analysis of prospective cohort studies. Br. J. Nutr., 116(1): 158–166.
- Hill, F.B. (1973). Atmospheric sulfur and its links to the biota. Brookhaven Symp. Biol., 1(30): 159.
- Hill, I.D. et Bowie, M.D. (1983). Chloride deficiency syndrome due to chloride-deficient breast milk. Arch. Dis. Child., 58(3): 224–226.
- Hill, N.S. Jr. (1924). Recarbonization of softened water. Proceedings of the Chemical and Bacteriological Section, Detroit Convention, May 25, 1923.
- Hofman, J., Kramer, O., van der Hoek, J.P., Nederlof, M. et Groenendijk, M. (2006). Twenty years of experience with central softening in Netherlands: Water quality, environmental benefits, and costs. Dans : Proceedings of the International Symposium on Health Aspects of Calcium and Magnesium in Drinking Water, Washington, DC, pp. 24–26.
- Hofmeyr, G.J., Lawrie, T.A., Atallah, Á. et Torloni, M.R. (2018). Calcium supplementation during pregnancy for preventing hypertensive disorders and related problems. Cochrane Database Syst. Rev., 10(10): CD001059.
- Hoover, C.P. et Langelier, W.F. (1938). Practical application of the Langelier Method. J. Am. Water Works Assoc., 30(11), 1802–1807.
- Hunt, S.C., Geleijnse, J.M., Wu, L.L., Witteman, J.C., Williams, R.R. et Grobbee, D.E. (1999). Enhanced blood pressure response to mild sodium reduction in subjects with the 235T variant of the angiotensinogen gene. Am. J. Hypertens., 12(5): 460–466.
- Hussain, I., Shakeel, M., Faisal, M., Soomro, Z.A., Hussain, M. et Hussain, T. (2014). Distribution of total dissolved solids in drinking water by means of Bayesian kriging and Gaussian spatial predictive process. Water Quality, Exposure and Health, 6(4): 177–185.
- Ikehata., K., Komor, A.T., Li, Y., Qu, X., Kleinheiz, J., Lee, D.S., Trussell, C.B. et Hokanson, D.R. (2015). Removal of hydrogen sulfide from groundwater by granular activated carbon. 2015 CA-NV AWWA Annual Fall Conference, October 26–29, 2015, Las Vegas, NV.
- [INRP] Inventaire national des rejets de polluants [base de données disponible sur Internet]. (2022). 2013-2017. Données sur le H2S pour plusieurs années de déclaration. Gatineau, Québec : Environnement Canada. Disponible à
- https://pollution-dechets.canada.ca/inventaire-national-rejets
- IOM (1997). Dietary reference intakes for calcium, phosphorus, magnesium, vitamin D, and fluoride (1997). The National Academies Press, Washington, DC. Disponible à https://doi.org/10.17226/5776
- IOM (2005). Dietary reference intakes for water, potassium, sodium, chloride, and sulfate (2005). The National Academies Press, Washington, DC. Disponible à https://doi.org/10.17226/10925
- IOM (2011). Dietary reference intakes for calcium and vitamin D. The National Academies Press, Washington, DC. Disponible à https://nap.nationalacademies.org/read/13050/chapter/1
- IPCS (2003). Hydrogen sulfide: human health aspects. Concise international chemical assessment Document 53. Publié sous le parrainage conjoint du Programme des Nations Unies pour l'environnement, l'Organisation internationale du Travail, l'Organisation mondiale de la Santé et produit dans le cadre de l'Inter-Organization Programme for the Sound Management of Chemicals, Organisation mondiale de la Santé, Genève, Suisse.
- Janssen, A.J.H., Meijer, S., Bontsema, J. et Lettinga, G. (1998). Application of the redox potential for controlling a sulfide oxidizing bioreactor. Biotechnol. Bioeng., 60(2): 147–155.
- Janssen, A.J.H., Lens, P.N., Stams, A.J., Plugge, C.M., Sorokin, D.Y., Muyzer, G., Dijkman, H., Van Zessen, E., Luimes, P. et Buisman, C.J. (2009). Application of bacteria involved in the biological sulfur cycle for paper mill effluent purification. Sci. Total Environ. 407(4): 1333–1343.
- Jäppinen, P. et Tola, S. (1990). Cardiovascular mortality among pulp mill workers. Br. J. Ind. Med., 47(4): 259–262.
- Jeziorski, A., Yan, N.D., Paterson, A.M., DeSellas, A.M., Turner, M.A., Jeffries, D.S., Keller, B., Weeber, R.C., McNicol, D.K., Palmer, M.E., McIver, K., Arseneau, K., Ginn, B.K., Cumming, B.F. et Smol, J.P. (2008). The widespread threat of calcium decline in fresh waters. Science. 322(5906), 1374–1377.
- Jiang, L., He, P., Chen, J., Liu, Y., Liu, D., Qin, G. et Tan, N. (2016). Magnesium levels in drinking water and coronary heart disease mortality risk: A meta-analysis. Nutrients, 8(1).
- Johnson, A.G., Nguyen, T.V. et Davis, D. (2001). Blood pressure is linked to salt intake and modulated by the angiotensinogen gene in normotensive and hypertensive elderly subjects. J. Hypertens., 19(6): 1053–1060.
- Kahlown, M.A., Ashraf, M., Hussain, M., Salam, H.A. et Bhatti, A.Z. (2006). Impact assessment of sewerage and industrial effluents on water resources, soil, crops and human health in Faisalabad. Pakistan Council of Research in Water Resources, Islamabad. Disponible à https://pcrwr.gov.pk/wp-content/uploads/2020/Water-Management-Reports/Impact%20Assessment%20of%20Sewerage%20and%20Industrial%20Effluents%20on%20Water.pdf
- Kahrilas, G.A., Blotevogel, J., Stewart, S.P. et Borch, T. (2015). Biocides in hydraulic fracturing fluids: A critical review of their usage, mobility degradation, and toxicity. Environ. Sci. Technol., 49(1): 16–32.
- Kaleita, T.A. (1986). Neurologic/behavioral syndrome associated with ingestion of chloride-deficient infant formula. Pediatrics, 78(4): 714–715.
- Karagas, M.R., Wang, A., Dorman, D.C., Hall, A.L., Pi, J., Sergi, C.M., Symanski, E., Ward, E.M., Arrandale, V.H., Azuma, K., Brambila, E., Calaf, G.M., Fritz, J.M., Fukushima, S., Gaitens, J.M., Grimsrud, T.K., Guo, L., Lynge, E., Marinho-Reis, A.P., McDiarmid, M.A., Middleton, D.R.S., Ong, T.P., Polya, D.A., Quintanilla-Vega, B., Roberts, G.K., Santonen, T., Sauni, R., Silva, M.J., Wild, P., Zhang, C.W., Zhang, Q., Grosse, Y., Benbrahim-Tallaa, L., de Conti, A., DeBono, N.L., El Ghissassi, F., Madia, F., Reisfeld, B., Stayner, L.T., Suonio, E., Viegas, S., Wedekind, R., Ahmadi, S., Mattock, H., Gwinn, W.M. et Schubauer-Berigan, M.K. (2022). Carcinogenicity of cobalt, antimony compounds, and weapons-grade tungsten alloy. Lancet Oncol., 23(5): 577–578.
- Kashfi, K. et Olson, K.R. (2013). Biology and therapeutic potential of hydrogen sulfide and hydrogen sulfide-releasing chimeras. Biochem. Pharmacol., 85(5): 689–703.
- Kasprzak, K.S., Gabryel, P. et Jarczewska, K. (1983). Carcinogenicity of nickel(II)hydroxides and nickel(II)sulfate in Wistar rats and its relation to the in vitro dissolution rates. Carcinogenesis, 4(3): 275–279.
- Kass, L., Weekes, J. et Carpenter, L. (2012). Effect of magnesium supplementation on blood pressure: A meta-analysis. Eur. J. Clin. Nutr., 66(4): 411–418.
- Kataoka, H. (2021). Chloride in heart failure syndrome: Its pathophysiologic role and therapeutic implication. Cardiol. Ther., 10(2): 407–428.
- Kaushal, S.S., Likens, G.E., Pace, M.L., Utz, R.M., Haq, S., Gorman, J. et Grese, M. (2018). Freshwater salinization syndrome on a continental scale. Proc. Natl. Acad. Sci. U.S.A., 115(4), E574–E583.
- Kayraldiz, A., Kaya, F.F., Canimoǧlu, S. et Rencüzoǧullari, E. (2006). Mutagenicity of five food additives in Ames/Salmonella/microsome test. Ann. Microbiol., 56(2): 129–133.
- Kesse, E., Bertrais, S., Astorg, P., Jaouen, A., Arnault, N., Galan, P. et Hercberg, S. (2006). Dairy products, calcium and phosphorus intake, and the risk of prostate cancer: Results of the French prospective SU.VI.MAX (supplémentation en vitamines et minéraux antioxydants) study. Br. J. Nutr., 95(3): 539–545.
- Keum, N., Aune, D., Greenwood, D.C., Ju, W. et Giovannucci, E.L. (2014). Calcium intake and colorectal cancer risk: Dose-response meta-analysis of prospective observational studies. Int. J. Cancer, 135(8): 1940–1948.
- Khan, A.A., Schuler, M.M., Prior, M.G., Yong, S., Coppock, R.W., Florence, L.Z. et Lillie, L.E. (1990). Effects of hydrogen sulfide exposure on lung mitochondrial respiratory chain enzymes in rats. Toxicol. Appl. Pharmacol., 103(3): 482–490.
- Khan, B., Nowson, C.A., Daly, R.M., English, D.R., Hodge, A.M., Giles, G.G. et Ebeling, P.R. (2015). Higher dietary calcium intakes are associated with reduced risks of fractures, cardiovascular events, and mortality: A prospective cohort study of older men and women. J. Bone Miner. Res., 30(10): 1758–1766.
- Kilburn, K.H. (1993). Case report: Profound neurobehavioral deficits in an oil field worker overcome by hydrogen sulfide. Am. J. Med. Sci., 306(5): 301–305 (as cited in U.S. EPA, 2003b).
- Kilburn, K.H. et Warshaw, R.H. (1995). Hydrogen sulfide and reduced-sulfur gases adversely affect neurophysiological functions. Toxicol. Ind. Health, 11(2): 185–197.
- Kim, K.H. (2006). Emissions of reduced sulphur compounds (RSC) as a landfill gas (LFG): a comparative study of young and old landfill facilities. Atmos Environ. 40:6567–6578.
- Kim, K.Y., Ko, H.J., Kim, H.T., Kim, Y.S., Young, M.R., Lee, C.M. et Kim, C.N. (2008). Quantification of ammonia and hydrogen sulphide emitted from pig buildings in Korea. J. Environ. Manage., 88(2): 195–202.
- Kohl, P.M. et Medlar, S.J. (2006). Occurrence of manganese in drinking water and manganese control. American Water Works Association, Denver, CO.
- Kotchen, T.A. et Kotchen, J.M. (1997). Dietary sodium and blood pressure: Interactions with other nutrients. Am. J. Clin. Nutr., 65(2 Suppl): 708S–711S.
- Kozisek, F. (2020). Regulations for calcium, magnesium or hardness in drinking water in the European Union member states. Regul. Toxicol. Pharmacol., 112: 104589.
- Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
- Kruse, P. (2018). Review on water quality sensors. J. Phys. D: Appl. Phys. 51:203002
- Kurtz, T.W., Al-Bander, H.A. et Morris, R.C.J. (1987). "Salt-sensitive" essential hypertension in men. Is the sodium ion alone important? N. Engl. J. Med., 317(17): 1043–1048.
- Lagutina L.E., Shtannikov, E.V. et Makarova, O.A. (1990). Health status and some indicators of function of excretory system in children in conditions of long term consumption of water with unsuitable mineral composition (en russe). Pediatriia, (9): 40-44 (cité dans Rosborg et Kozisek, 2020).
- Larson, T.E. et Skold, R.V. (1958). Current research on corrosion and tuberculation of cast iron. J. Am. Water Works Assoc., 50(11): 1429–1432.
- Lawler, D.S. et Kweon, J.H. (2003). Integrated water treatment: Softening and ultrafiltration. Awwa Research Foundation, Denver, CO.
- Leentvaar, J. et Rebhun, M. (1982). Effect of magnesium and calcium precipitation on coagulation-flocculation with lime. Water Res., 16(5): 655–662.
- Legator, M.S., Singleton, C.R., Morris, D.L. et Philips, D.L. (2001). Health effects from chronic low-level exposure to hydrogen sulfide. Arch. Environ. Health, 56(2): 123–131 (cité dans U.S. EPA, 2003b).
- Leidi, M., Wolf, M. et Maier, J.A.M. (2011). Magnesium and cancer: More questions than answers. Dans : Magnesium in the central nervous system [Internet]. Vink, R. et Nechifor, M. (eds.). Adelaide, Australie : University of Adelaide Press. Disponible à https://www.ncbi.nlm.nih.gov/books/NBK507261/
- Lemley, A.T., Schwartz, J.J. et Wagenet, L.P. (1999). Hydrogen sulphide in household drinking water. Cornell University, Fact Sheet 7.
- LeRoy, P., Schock, M.R., Wagner, I. et Holtschulte, H. (1996). Cement-based materials. Dans : Internal Corrosion of Water Distribution Systems. 2nd ed. American Water Works Association Research Foundation et DVGW Technologiezentrum Wasser, Denver, CO. pp. 313–388.
- Lesimple, A., Ahmed, F.E. et Hilal, N. (2020). Remineralization of desalinated water: Methods and environmental impact. Desalination, 496: 114692.
- Levine, A.D., Raymer, B.J. et Jahn, J. (2004a). Hydrogen sulfide and turbidity control using catalysed oxidation coupled with filtration for groundwater treatment. J. Water Supply Res. Technol., 53(5): 325–337.
- Levine, A.D., Raymer, B.J. et Jahn, J. (2004b). Evaluation of biological hydrogen sulfide oxidation coupled with two-stage upflow filtration for groundwater treatment. J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng., 39(5): 1263–1279.
- Levine, A.D., Romero-Cotrino, C., Minnis, R.J., Perone, J. et Amitzoglou, P. (2006). Biologically enhanced anion exchange for removal of hydrogen sulfide from groundwater. WQTC conference. American Water Works Association, Denver, CO.
- Lewis, R.J. et Copley, G.B. (2015). Chronic low-level hydrogen sulfide exposure and potential effects on human health: A review of the epidemiological evidence. Critical reviews in toxicology. Crit. Rev. Toxicol., 45(2): 93–123.
- Lietz, G., Avenell, A. et Robins, S.P. (1997). Short-term effects of dietary sodium intake on bone metabolism in postmenopausal women measured using urinary deoxypyridinoline excretion. Br. J. Nutr., 78(1): 73–82.
- Lifton, R.P., Wilson, F.H., Choate, K.A. et Geller, D.S. (2002). Salt and blood pressure: New insight from human genetic studies. Cold Spring Harb. Symp. Quant. Biol., 67: 445–450.
- Lin, P., Ginty, F., Appel, L.J., Aickin, M., Bohannon, A., Garnero, P., Barclay, D. et Svetkey, L.P. (2003). The DASH diet and sodium reduction improve markers of bone turnover and calcium metabolism in adults. J. Nutr., 133(10): 3130655–3136.
- Lin, T.F., Watson, S., Dietrich, A.M. et Suffet, I. H. (2019). Taste and odour in source and drinking water: causes, controls, and consequences. IWA Publishing, Londres, Royaume-Uni. DOI : 10.2166/9781780406664.
- Liu, C., Kuang, X., Li, K., Guo, X., Deng, Q. et Li, D. (2020). Effects of combined calcium and vitamin D supplementation on osteoporosis in postmenopausal women: A systematic review and meta-analysis of randomized controlled trials. Food Funct., 11(12): 10817–10827.
- Logsdon, G. S., Frey, M.M., Stefanich, M.D., Johnson, S.L., Feely, D.E., Rose, J.B. et Sobsey, M. (1994). The removal and disinfection efficiency of lime softening processes for Giardia and Viruses. Awwa Research Foundation et American Water Works Association, Denver, CO (Project # #90648).
- Logue, J.N., Ramaswamy, K. et Hersh, J.H. (2001). Investigation of illness associated with exposure to hydrogen sulfide among Pennsylvania school students. J. Environ. Health, 63(6): 9–13.
- Luft, F.C., Rankin, L.I., Bloch, R., Weyman, A.E., Willis, L.R., Murray, R.H., Grim, C.E. et Weinberger, M.H. (1979). Cardiovascular and humoral responses to extremes of sodium intake in normal black and white men. Circulation, 60(3): 697–706.
- Lutaĭ, G.F. (1992). Chemical composition of the drinking water and the health of the population (en russe). Gig. Sanit., 1(1): 13–15 (cité dans Kozisek, 2005).
- Lyn, T.L et Taylor, J.S. (1992). Assessing sulfur turbidity formation following chlorination of hydrogen sulfide in groundwater. J. Am. Water Works Assoc., 84(9): 103–112.
- MacGregor, G.A., Markandu, N.D., Sagnella, G.A., Singer, D.R. et Cappuccio, F.P. (1989). Double-blind study of three sodium intakes and long-term effects of sodium restriction in essential hypertension. Lancet, 2(8674): 1244–1247.
- Marriott, R.A., Payman, P., Marrugo-Hernandez, J.J. et Raval, S. (2016). Hydrogen sulfide formation in oil and gas. Can. J. Chem., 94(4): 406–413.
- Mascioli, S., Grimm, R., Jr, Launer, C., Svendsen, K., Flack, J., Gonzalez, N., Elmer, P. et Neaton, J. (1991). Sodium chloride raises blood pressure in normotensive subjects. The study of sodium and blood pressure. Hypertension, 17(1 Suppl): I21–I26.
- McCallum, L., Jeemon, P., Hastie, C.E., Patel, R.K., Williamson, C., Redzuan, A.M., Dawson, J., Sloan, W., Muir, S., Morrison, D., McInnes, G.T., Freel, E.M., Walters, M., Dominiczak, A.F., Sattar, N. et Padmanabhan, S. (2013). Serum chloride is an independent predictor of mortality in hypertensive patients. Hypertension, 62(5): 836–843.
- McCallum, L., Lip, S. et Padmanabhan, S. (2015). The hidden hand of chloride in hypertension. Pflugers Arch., 467(3): 595–603.
- McGowan, W. (2000). Water processing: Residential, commercial, light-industrial. 3rd ed. Water Quality Association.
- McNally, N.J., Williams, H.C., Phillips, D.R., Smallman-Raynor, M., Lewis, S., Venn, A. et Britton, J. (1998). Atopic eczema and domestic water hardness. Lancet, 352(9127): 527–531.
- McParland, B.E., Goulding, A. et Campbell, A.J. (1989). Dietary salt affects biochemical markers of resorption and formation of bone in elderly women. BMJ, 299(6703): 834–835.
- Megonnell, N.E. et Spotts, S.D. (1994). Can "sulfur water" be cured with carbon? It may help oxidize one odor-causing gas. Water technol., 19(3): 128–32.
- Melles, Z. et Kiss, S.A. (1992). Influence of the magnesium content of drinking water and of magnesium therapy on the occurrence of preeclampsia. Magnes. Res., 5(4): 277–279.
- MEO (2007). Ontario air standard for total reduced sulphur. Direction de l'élaboration des normes, ministère de l'Environnement de l'Ontario.
- Mercer, K.L., Lin, Y.-P. et Singer, P.C. (2005). Enhancing calcium carbonate precipitation by heterogeneous nucleation during chemical softening. J. Am. Water Works Assoc., 97(12): 116–125.
- Meride, Y. et Ayenew, B. (2016). Drinking water quality assessment and its effects on residents health in Wondo Genet campus, Ethiopia. Environmental Systems Research, 5(1): 1–7.
- Meunier, P.J., Jenvrin, C., Munoz, F., de la Gueronnière, V., Garnero, P. et Menz, M. (2005). Consumption of a high calcium mineral water lowers biochemical indices of bone remodeling in postmenopausal women with low calcium intake. Osteoporos. Int., 16(10): 1203–1209.
- Mickleborough, T.D., Gotshall, R.W., Kluka, E.M., Miller, C.W. et Cordain, L. (2001). Dietary chloride as a possible determinant of the severity of exercise-induced asthma. Eur. J. Appl. Physiol., 85(5): 450–456.
- Milby, T.H. (1962). Hydrogen sulfide intoxication. Review of the literature and report of unusual accident resulting in two cases of nonfatal poisoning. J. Occup. Med., 4: 431–437 (cité dans U.S. EPA, 2003b).
- Milby, T.H. et Baselt, R.C. (1999a). Hydrogen sulfide poisoning: Clarification of some controversial issues. Am. J. Ind. Med., 35(2): 192–195 (cité dans U.S. EPA, 2003b).
- Milby, T.H. et Baselt, R.C. (1999b). Health hazards of hydrogen sulfide: Current status and future directions. Environ. Epidemiol. Toxicol., 1: 262–269 (cité dans U.S. EPA, 2003b).
- Ministère de la Santé du Nouveau-Brunswick (2021). Communication personnelle avec K. Gould.
- Ministère de l'Environnement de la Nouvelle-Écosse (2021). Communication personnelle avec A. Polegato.
- Ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario (2021). Communication personnelle avec S. Deshpande.
- Ministère de l'Environnement et de la Lutte contre les changements climatiques du Québec (2021). Communication personnelle avec P. Cantin.
- Ministère des Affaires municipales et de l'Environnement de Terre-Neuve-et-Labrador (2021). Communication personnelle avec H. Khan.
- Ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard (2021). Communication personnelle avec G. Somers.
- Ministère des Pêches et de l'Environnement (1978a). Planche 28. Qualité des eaux de surface. Atlas hydrologique du Canada. Disponible à https://ftp.maps.canada.ca/pub/nrcan_rncan/raster/atlas/eng/hydro_1978/water_quality/28_Water_Quality_Surface_Waters_1978_150.jpg
- Ministère des Pêches et de l'Environnement (1978b). Planche 30. Hydrogéologie des dépôts meubles. Atlas hydrologique du Canada. Disponible à https://ftp.maps.canada.ca/pub/nrcan_rncan/raster/atlas/eng/hydro_1978/hydrogeology/30_Surficial_Hydrogeology_1978_150.jpg
- Ministère des Pêches et de l'Environnement (1978c). Planche 31. Hydrogéologie de la roche de fond. Atlas hydrologique du Canada. Disponible à https://ftp.maps.canada.ca/pub/nrcan_rncan/raster/atlas/eng/hydro_1978/hydrogeology/31_Bedrock_Hydrogeology_1978_150.jpg
- Miyahara, J., Aramaki, S. et Yokochi, K. (2009). Dietary chloride deficiency due to new liquid nutritional products. Pediatr. Int., 51(2): 197–200.
- Miyake, Y., Yokoyama, T., Yura, A., Iki, M. et Shimizu, T. (2004). Ecological association of water hardness with prevalence of childhood atopic dermatitis in a Japanese urban area. Environ. Res., 94(1): 33–37.
- Montgomery, J.M. (1985). Water treatment: Principles and design. John Wiley & Sons, Hoboken, NJ.
- Moore, E. (1952). Physiological effects of the consumption of saline drinking water. A progress report to the 16th meeting of the subcommittee on sanitary engineering and environment. Appendix B. Anonymous Washington, DC: National Academy of Sciences. pp. 221–227 (cité dans Backer, 2000).
- Moore-Schiltz, L., Albert, J.M., Singer, M.E., Swain, J. et Nock, N.L. (2015). Dietary intake of calcium and magnesium and the metabolic syndrome in the national health and nutrition examination (NHANES) 2001–2010 data. Br. J. Nutr., 114(6): 924–935.
- Morimoto, A., Uzu, T., Fujii, T., Nishimura, M., Kuroda, S., Nakamura, S., Inenaga, T. et Kimura, G. (1997). Sodium sensitivity and cardiovascular events in patients with essential hypertension. Lancet, 350(9093): 1734–1737.
- Morris, R.C.J., Sebastian, A., Forman, A., Tanaka, M. et Schmidlin, O. (1999). Normotensive salt sensitivity: Effects of race and dietary potassium. Hypertension, 33(1): 18–23.
- Mudryi, I.V. (1999). Effects of the mineral composition of drinking water on the population´s health (review) (en russe). Gig. Sanit., 1: 13–15 (cité dans Kozisek, 2005).
- Muezzinoglu A. (2003). A study of volatile organic sulfur emissions causing urban odors. Chemosphere, 51(4): 245–252.
- Mulford, L.A., Taylor, J.S., Nickerson, D.M. et Chen, S.-S. (1999). NF performance at full and pilot scale. J. Am. Water Works Assoc., 91(6): 64–76.
- Munter, R., Kallas, J., Trapido, M., Veressinina, Y. et Veil, H. (1999). Estonian ground water: Quality problems and technology for improvement. Kem.-Kemi, 26(7): 552–556.
- Munter, R. et Vilu, H. (2008). Drinking water production from well water with high sulfur and sulfur bacteria content. J. Environ. Eng., 134(5): 376–381.
- Muzalevskaya, L.S., Lobkovskiy A.G. et Kukarina, N.I. (1993). Prevalence of cholelithiasis and urolithiasis, osteoporosis and salt arthropathy in relation to water hardness (en russe). Gig. Sanit., 58(12): 17–20 (cité dans Rosborg et Kozisek, 2020).
- Narotsky, M.G., Pressman, J.G., Miltner, R.J., Speth, T.F., Teuschler, L.K., Rice, G.E., Richardson, S.D., Best, D.S., McDonald, A., Hunter III, E.S. et Simmons, J.E. (2012). Developmental toxicity evaluations of whole mixtures of disinfection by-products using concentrated drinking water in rats: Gestational and lactational effects of sulfate and sodium. Birth Defects Res. Part B Dev. Reprod. Toxicol., 95(3): 202–212.
- Nasr, A.B., Charcosset, C., Amar, R.B. et Walha, K. (2013). Defluoridation of water by nanofiltration. J. Fluor. Chem., 150: 92–97.
- NHMRC, NRMMC (2011). Australian Drinking Water Guidelines Paper 6 National Water Quality Management Strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia. Disponible à https://www.nhmrc.gov.au/about-us/publications/australian-drinking-water-guidelines
- Nie, Z., Wang, Z., Zhou, B., Tang, Z. et Wang, S. (2013). Magnesium intake and incidence of stroke: Meta-analysis of cohort studies. Nutr. Metab. Cardiovasc. Dis., 23(3): 169–176.
- NSF/ANSI (2021). NSF International Standard/American National Standard/National Standard of Canada Standard 60: Drinking Water Treatment Chemicals – Health Effects. NSF International, Ann Arbor, MI.
- NSF/ANSI (2022a). NSF International/American National Standards Institute Standard 44: Residential Cation Exchange Water Softeners. NSF International, Ann Arbor, MI.
- NSF/ANSI (2022b). NSF International/American National Standards Institute Standard 66: Drinking Water Distillation Systems. NSF International, Ann Arbor, MI.
- NSF/ANSI (2022c). NSF International/American National Standards Institute Standard 42: Drinking Water Treatment Units-Aesthetic Effects). NSF International, Ann Arbor, MI.
- NSF/ANSI (2022d). NSF International/American National Standards Institute Standard 58: Reverse Osmosis
- Drinking Water Treatment Systems. NSF International, Ann Arbor, MI
- Odell, L.H. (2010). Treatment technologies for groundwater. American Water Works Association, Denver, CO.
- OMS (1981). Hydrogen sulfide. (Environmental Health Criteria, No. 19), Genève (cité dans OMS, 2003b).
- OMS (1987). Air quality guidelines for Europe. Copenhague : Bureau régional de l'Europe de l'OMS. Disponible à https://apps.who.int/iris/handle/10665/107364
- OMS (2000). Chapter 6.6: Hydrogen sulfide. Dans : Air quality guidelines: Part II. Evaluation of human health risks. Bureau régional de l'Europe de l'OMS, Organisation mondiale de la Santé, Copenhague, Danemark.
- OMS (2003). Hydrogen sulfide in drinking-water. Background document for development of WHO guidelines for drinking-water quality. WHO/SDE/WSH/03.04/07, Genève, Suisse. Disponible à https://cdn.who.int/media/docs/default-source/wash-documents/wash-chemicals/hydrogensulfide-bd.pdf?sfvrsn=2f03ad98_4
- OMS (2009). Calcium and magnesium in drinking water: Public health significance. Genève, Suisse. Disponible à https://apps.who.int/iris/bitstream/handle/10665/43836/9789241563550_eng.pdf
- OMS (2011). Hardness in drinking-water. Background document for development of WHO guidelines for drinking-water quality. WHO/HSE/WSH/10.01/10, Genève, Suisse. Disponible à https://apps.who.int/iris/handle/10665/70168
- OMS (2017). Directives de qualité pour l'eau de boisson: Quatrième édition intégrant le premier additif. Disponible à https://www.who.int/fr/publications/i/item/9789241549950
- Ortenberg, E., Groisman, L. et Rav-Acha, C. (2000). Taste and odour removal from an urban groundwater establishment- A case study. Water Sci. Technol., 42(1-2): 123-128.
- Pandey, S.K., Kim, K.-H. et Tang, K.-T. (2012). A review of sensor-based methods for monitoring hydrogen sulfide. Trends Analyt. Chem., 32: 87–99.
- Parsons, F.M., Edwards, G.F., Anderson, C.K., Ahmad, S., Clark, P.B., Hetherington, C. et Young, G.A. (1974). Regression of malignant tumours in magnesium and potassium depletion induced by diet and haemodialysis. Lancet, 1(7851): 243–244.
- Peacock, M. (2010). Calcium metabolism in health and disease. Clin. J. Am. Soc. Nephrol., 5 Suppl 1: S23–30.
- Perkin, M.R., Craven, J., Logan, K., Strachan, D., Marrs, T., Radulovic, S., Campbell, L.E., MacCallum, S.F., McLean, W.H., Lack, G., Flohr, C. et Enquiring About Tolerance Study Team (2016). Association between domestic water hardness, chlorine, and atopic dermatitis risk in early life: A population-based cross-sectional study. J. Allergy Clin. Immunol., 138(2): 509–516.
- Peterson, N. (1951). Sulfates in drinking water. Official Bulletin: North Dakota Water and Sewage Works Conference (ed.). pp. 6–11 (cité dans Backer, 2000).
- Pieper, K.J., Tang, M., Jones, C.N., Weiss, S., Greene, A., Mohsin, H., Parks, J. et Edwards, M.A. (2018). Impact of road salt on drinking water quality and infrastructure corrosion in private wells. Environ. Sci. Technol., 52(24) : 14078–14087.
- Pouliquen, F., Blanc, C. et Arretz, E. (1989). Hydrogen sulfide. Dans : Elvers, B., Hawkins, S., Ravenscroft, M. et Schultz, G., eds. Ullmann's Encyclopedia of Industrial Chemistry. Deerfield Beach, FL. VCH Publishers. A13:467–485.
- Poursafa, P., Kelishadi, R., Amin, M.M., Hashemi, M. et Amin, M. (2014). First report on the association of drinking water hardness and endothelial function in children and adolescents. Arch. Med. Sci., 10(4): 746–751.
- Radlinski, M. et Wolf, J. (2016). Condition assessment and service life analysis of an asbestos-cement sewer pipe. Proceedings of the Pipelines 2016 Conference, 2016, Kansas City, MO. American Society of Civil Engineers (ASCE), pp. 321–333.
- Rahman, M.A., Islam, M.R., Kumar, S. et Al-Reza, S.M. (2021). Drinking water quality, exposure and health risk assessment for the school-going children at school time in the southwest coastal of Bangladesh. J. Water Sanit. Hyg. Develop., 11(4): 612–628.
- Randtke, S.J., Thiel, C.E., Liao, M.Y. et Yamaya, C.N. (1982). Removing soluble organic contaminants by lime-softening. J. Am. Water Works Assoc., 74(4): 192–202.
- Rapant, S., Cveková, V., Fajíková, K., Hajdúk, I., Hiller, E. et Stehlíková, B. (2019). Hard water, more elastic arteries: A case study from Krupina District, Slovakia. Int. J. Environ. Res. Public. Health., 16(9): 1521.
- Reiffenstein, R.J., Hulbert, W.C. et Roth, S.H. (1992). Toxicology of hydrogen sulfide. Annu. Rev. Pharmacol. Toxicol., 32: 109–134.
- Ribeiro, D.A., Marques, M.E.A. et Salvadori, D.M.F. (2004). Lack of genotoxicity of formocresol, paramonochlorophenol, and calcium hydroxide on mammalian cells by comet assay. J. Endod., 30(8): 593–596.
- Richardson, D.B. (1995). Respiratory effects of chronic hydrogen sulfide exposure. Am. J. Ind. Med., 28(1): 99–108 (cité dans U.S. EPA, 2003b).
- Robinson, H.K., Hasenmueller, E.A. et Chambers, L.G. (2017). Soil as a reservoir for road salt retention leading to its gradual release to groundwater. Appl. Geochem., 83: 72–85.
- Rodríguez-Morán, M., Simental Mendía, L.E., Zambrano Galván, G. et Guerrero-Romero, F. (2011). The role of magnesium in type 2 diabetes: A brief based-clinical review. Magnes. Res., 24(4): 156–162.
- Rodriguez-Soriano, J., Vallo, A., Castillo, G., Oliveros, R., Cea, J.M. et Balzategui, M.J. (1983). Biochemical features of dietary chloride deficiency syndrome: A comparative study of 30 cases. J. Pediatr., 103(2): 209–214.
- Romani, A.M.P. (2013). Magnesium in health and disease. Dans : Interrelations between essential metal ions and human diseases. Sigel, A., Sigel, H. et Sigel, R.K.O., eds. Springer, Allemagne, pp. 49–79 (cité dans Cotruvo, 2017).
- Rosborg, I. et Kozisek, F. (2020). Drinking water minerals and mineral balance: Importance, health significance, safety precautions. 2nd ed. Springer, Cham, Suisse.
- Rossum, J. (1955). Split-treatment softening of water. Ind. Eng. Chem., 47(11): 2313–2317.
- RTW, Inc. (2008). Tetra Tech (RTW) model for water chemistry, process and corrosion control. Rothberg, Tamburini
and Winsor, Inc. (Tetra Tech RTW). AWWA, Denver, CO. - Rude, R.K., Singer, F.R. et Gruber, H.E. (2009). Skeletal and hormonal effects of magnesium deficiency. J. Am. Coll. Nutr., 28(2): 131–141.
- Rylova, N.V. (2005). Influence of mineral composition of drinking water on health status of children (en russe). Gig. Sanit., 70(1): 45–46 (cité dans Rosborg et Kozisek, 2020).
- Sacks, F.M., Svetkey, L.P., Vollmer, W.M., Appel, L.J., Bray, G.A., Harsha, D., Obarzanek, E., Conlin, P.R., Miller, E.R.3rd, Simons-Morton, D.G., Karanja, N., Lin, P.H. et DASH-Sodium Collaborative Research Group (2001). Effects on blood pressure of reduced dietary sodium and the dietary approaches to stop hypertension (DASH) diet. DASH-sodium collaborative research group. N. Engl. J. Med., 344(1): 3–10.
- Sakhaee, K., Harvey, J.A., Padalino, P.K., Whitson, P. et Pak, C.Y. (1993). The potential role of salt abuse on the risk for kidney stone formation. J. Urol., 150(2 Pt 1): 310–312.
- Saitua, H., Gil, R. et Padilla, A.P. (2011). Experimental investigation on arsenic removal with a nanofiltration pilot plant from naturally contaminated groundwater. Desalination, 274: 1–6.
- Sanders, T., Liu, Y.M. et Tchounwou, P.B. (2015). Cytotoxic, genotoxic, and neurotoxic effects of Mg, Pb, and Fe on pheochromocytoma (PC-12) cells. Environ. Toxicol., 30(12): 1445–1458.
- Santé Canada (2008). Document de conseils sur le potassium provenant des adoucisseurs d'eau. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/document-conseils-potassium-provenant-adoucisseurs-eau.html
- Santé Canada (2019). Recommandations pour la qualité de l'eau potable au Canada : document technique – le manganèse. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-manganese.html
- Santé Canada (2021). Facteurs d'exposition utilisés dans les évaluations des risques pour la santé humaine au Canada. Fiche de renseignements. Santé Canada, Ottawa, Ontario. Disponible à https://www.canada.ca/fr/sante-canada/services/substances-chimiques/fiches-renseignements/facteurs-exposition-evaluations-risques-sante-humaine-canada.html
- Santé Canada (2022a). Conseils sur l'échantillonnage et les mesures d'intervention pour le contrôle de la corrosion. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. (En cours de publication)
- Santé Canada (2022b). Conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/conseils-surveillance-stabilite-biologique-eau-potable-reseaux-distribution.html
- Santé Canada (2022c). Communication personnelle d'Anca-Maria Tugulea, Bureau de la science et de la recherche en santé environnementale.
- Santé Canada (2022d). Recommandations pour la qualité de l'eau potable au Canada – Tableau sommaire. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. Disponible à https://publications.gc.ca/collections/collection_2020/sc-hc/H129-24-2020-fra.pdf
- Santé Canada (2023). Recommandations pour la qualité de l'eau potable au Canada : document technique – le fer. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa, Ontario. (En cours de publication)
- Saskatchewan Water Security Agency (2021). Communication personnelle avec S. Hase.
- Saunders, S. et Urbans, M.J. (1995). Count on catalytic carbons for hydrogen sulfide. They can help you handle its offensive odors. Water technol. 18(6): 41–44.
- Saunders., S. et Lee, M. (1996). The bottom line on sulfide removal. Catalytic carbon can provide cost-effective removal. Water technol. 19(7): 24–26.
- Schock, M.R. et Lytle, D.A. (2011). Chapter 20: Internal corrosion and deposition control. Dans : Edzwald, J.K., ed., Water quality and treatment: A handbook on drinking water. Sixth edition. McGraw-Hill, New York, NY.
- Schofield, R. et Hsieh, D. (1983). Criteria and recommendations for standards for sulfate in military field supplies. Lawrence Livermore National Laboratory, Contract no. UCRL-53481-4, Livermore, CA (cité dans U.S. EPA, 2003a).
- Schroeder, H.A. (1960). Relation between mortality from cardiovascular disease and treated water supplies: Variations in states and 163 largest municipalities of the United States. J. Am. Med Assoc., 172(17): 1902–1908.
- Schroeder, H.A. (1966). Municipal drinking water and cardiovascular death rates. J. Am. Med. Assoc., 195(2): 81–85.
- Shah, S.C., Zhu, X., Dai, Q., Peek, R.M. et Shrubsole, M.J. (2021). Magnesium intake is associated with a reduced risk of incident liver cancer, based on an analysis of the NIH-American Association of Retired Persons (NIH-AARP) diet and health study prospective cohort.. J. Clin. Nutr., 113(3): 630–638.
- Shore, A.C., Markandu, N.D. et MacGregor, G.A. (1988). A randomized crossover study to compare the blood pressure response to sodium loading with and without chloride in patients with essential hypertension. J. Hypertens., 6(8): 613–617.
- Shtannikov, E.V. et Obyedkova, G.Y. (1984). Effect of level of drinking water mineralization on female reproductive functions (en russe). Gig. Sanit., 49(9): 20–23 (cité dans Rosborg et Kozisek, 2020).
- Shtannikov E.V., Lagutina, L.E. et Maneshina, O.A. (1986). Effect of drinking water of high total dissolved solids on urinary tract in children (en russe). Gig. Sanit., 51(10): 90–92 (cité dans Rosborg et Kozisek, 2020).
- Shuey, B.S. (1966). Economics of split-treatment water softening. J. Am. Water Works Assoc., 58(1): 107–112.
- Silk, L.N., Greene, D.A. et Baker, M.K. (2015). The effect of calcium or calcium and vitamin D supplementation on bone mineral density in healthy males: A systematic review and meta-analysis. Int. J. Sport Nutr. Exerc. Metab., 25(5): 510–524.
- Silva, C.S., Moutinho, C., Ferreira da Vinha, A. et Matos, C. (2019). Trace minerals in human health: Iron, zinc, copper, manganese and fluorine. International Journal of Science and Research Methodology, 13(3): 57–80.
- Smeets, P.W.M.H., Medema, G.J. et van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2: 1–14.
- Snyder, J.W., Safir, E.F., Summerville, G.P. et Middleberg, R.A. (1995). Occupational fatality and persistent neurological sequelae after mass exposure to hydrogen sulfide. Am. J. Emerg. Med., 13(2): 199–203.
- Song, X., Li, Z., Ji, X. et Zhang, D. (2017). Calcium intake and the risk of ovarian cancer: A meta-analysis. Nutrients, 9(7): 679.
- Stefan, D.S., Meghea, I. et Stefan, D.M. (2018). Comparative study on the removal of hydrogen sulfide and ammonia from natural water using oxygen, air and chlorine. Proceedings of the 18th International Multidisciplinary Scientific GeoConference SGEM, July 2018, 18: pp. 227–234.
- Tai, V., Leung, W., Grey, A., Reid, I.R. et Bolland, M.J. (2015). Calcium intake and bone mineral density: Systematic review and meta-analysis. BMJ, 351: h4183.
- Tang, C., Merks, C.W.A.M. et Albrechtsen, H.-J. (2019). Water softeners add comfort and consume water – comparison of selected centralised and decentralised softening technologies. Water Supply, 19(7): 2088–2097.
- Tang, C., Godskesen, B., Aktor, H., van Rijn, M., Kristensen, J.B., Rosshaug, P.S., Albrechtsen, H.-J. et Rygaard, M. (2021). Procedure for calculating the calcium carbonate precipitation potential (CCPP) in drinking water supply: Importance of temperature, ionic species and open/closed system. Water, 13(42): 42.
- Tekerlekopoulou, A.G., Papazafiris, P.G.D. et Vayenas, D.V. (2010). A full-scale trickling filter for the simultaneous removal of ammonium, iron and manganese from potable water. J. Chem. Technol. Biotechnol., 85(7): 1023–1026.
- Teschke, K., Ahrens, W., Andersen, A., Boffetta, P., Fincham, S., Finkelstein, M., Henneberger, P., Kauppinen, T., Kogevinas, M., Korhonen, K., Liss, G., Liukkonnen, T., Osvoll, P., Savela, A., Szadkowska-Stanczyk, I., Westberg, H. et Widerkiewicz, K. (1999). Occupational exposure to chemical and biological agents in the nonproduction departments of pulp, paper, and paper product mills: An international study. Am. Ind. Hyg. Assoc. J., 60(1): 73–83.
- Thomas, J.F.J. (1953). Industrial water resources of Canada: Scope, procedure, and interpretation of survey studies. Ministère des Mines et des Relevés Techniques, Ottawa, Ontario.
- Thompson, M.A., Kelkar, U.G. et Vickers, J.C. (1995). The treatment of groundwater containing hydrogen sulfide using microfiltration. Desalination, 102(1–3): 287–291.
- Tuck, M., Corry, D. et Trujillo, A. (1990). Salt-sensitive blood pressure and exaggerated vascular reactivity in the hypertension of diabetes mellitus. Am. J. Med., 88(3): 210–216.
- Tucker, K.L., Hannan, M.T., Chen, H., Cupples, L.A., Wilson, P.W. et Kiel, D.P. (1999). Potassium, magnesium, and fruit and vegetable intakes are associated with greater bone mineral density in elderly men and women. Am. J. Clin. Nutr., 69(4): 727–736.
- Tvedt, B., Skyberg, K., Aaserud, O., Hobbesland, A. et Mathiesen, T. (1991a). Brain damage caused by hydrogen sulfide: A follow-up study of six patients. Am. J. Ind. Med., 20(1): 91–101 (cité dans U.S. EPA, 2003b).
- Tvedt, B., Edland, A., Skyberg, K. et Forberg, O. (1991b). Delayed neuropsychiatric sequelae after acute hydrogen sulfide poisoning: Affection of motor function, memory, vision and hearing. Acta Neurol. Scand., 84(4): 348–351 (cité dans U.S. EPA, 2003b).
- UE (2020). Directive (UE) 2020/2184 du Parlement européen et du Conseil du 16 décembre 2020 relative à la qualité des eaux destinées à la consommation humaine (refonte) (Texte présentant de l'intérêt pour l'EEE). Journal officiel de l'Union européenne, L435/1. Disponible à https://eur-lex.europa.eu/eli/dir/2020/2184/oj?locale=fr#d1e32-54-1
- U.S. EPA (1971a). EPA-NERL: 130.2: Hardness, total (mg/L as CaCO3) (titrimetric, ethylenediamine tetraacetate). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1971b). EPA-NERL: 375.1: Sulfate (colorimetric, automated, chloranilate). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1978a). EPA-NERL: 215.1: Calcium (atomic absorption, direct aspiration). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1978b). EPA-NERL: 242.1: Magnesium (atomic absorption, direct aspiration). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1978c). EPA-NERL: 215.2: Calcium (titrimetric, ethylenediamine tetraacetate). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1978d). EPA-NERL: 375.4: Sulfate (turbidimetric). Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1988). National Secondary Drinking Water Regulations. CFR 40 Part 143, 53 FR 37412, Sept. 26, 1988. U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (1993a). Health assessment document for hydrogen sulfide. Office of Research and Development, U.S. Environmental Protection Agency, Washington, DC (Document ID: EPA/600/8-86/026F).
- U.S. EPA (1993b). EPA-NERL: 375.2: Determination of sulfate by automated colorimetry. Revision 2.0. Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1994). EPA-NERL: 200.7: Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Revision 4.4. Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
- U.S. EPA (1999a). Health effects from exposure to sulfate in drinking water workshop. Office of Water, EPA 815-R-99-002, Washington, DC. Disponible à https://nepis.epa.gov/Exe/ZyPDF.cgi/200021JF.PDF?Dockey=200021JF.PDF
- U.S. EPA (1999b). Health effects from exposure to high levels of sulfate in drinking water study. Office of Water, EPA 815-R-99-001. Disponible à https://nepis.epa.gov/Exe/ZyPDF.cgi/200021IN.PDF?Dockey=200021IN.PDF
- U.S. EPA (1999c). METHOD 300.1 revision 1.0: Determination of inorganic anions in drinking water by ion chromatography. National Exposure Research Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH. Disponible à https://www.epa.gov/sites/default/files/2015-06/documents/epa-300.1.pdf
- U.S. EPA (1999d). Enhanced coagulation and enhanced precipitative softening guidance manual. Office of Water, U.S. Environmental Protection Agency (Document ID: EPA-815-R-99-012).
- U.S. EPA (2003a). Drinking water advisory: Consumer acceptability advice and health effects analysis on sulfate. Washington, DC. Disponible à
- https://www.epa.gov/sites/default/files/2014-09/documents/support_cc1_sulfate_healtheffects.pdf
- U.S. EPA (2003b). Toxicological review of hydrogen sulfide (CAS no. 7783-06-4) in support of summary information on the integrated risk information system (IRIS). Washington, DC. Disponible à https://cfpub.epa.gov/ncea/iris/iris_documents/documents/toxreviews/0061tr.pdf
- U.S. EPA. (2003c). Method 200.5 revision 4.2: Determination of trace elements in drinking water by axially viewed inductively coupled plasma-atomic emission spectrometry. Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH. Disponible à https://www.epa.gov/sites/default/files/2015-08/documents/method_200-5_rev_4-2_2003.pdf
- USGS (1985a). Method: I-7152: Calcium, suspended-recoverable, water, FLAA. United States Geological Survey, National Water Quality Laboratory.
- USGS (1985b). Method: I-1447: Magnesium, dissolved, FLAA. United States Geological Survey, National Water Quality Laboratory.
- USGS (1985c). Method: I-1338: Hardness in water by colorimetric titration. United States Geological Survey, National Water Quality Laboratory.
- USGS (1985d). Method L: I-3840: Sulfide, titrimetric, iodometric. United States Geological Survey, National Water Quality Laboratory.
- USGS (2018). Hardness of water. USGS Water Science School. United States Geological Survey. Washington, DC. Disponible à https://www.usgs.gov/special-topics/water-science-school/science/hardness-water
- USGS (2023). Frequently asked questions about water. United States Geological Survey. Washington, DC. Disponible à https://www.usgs.gov/faqs/do-you-have-information-about-water-hardness-united-states
- Van Der Aa, M. (2003). Classification of mineral water types and comparison with drinking water standards. Environ. Geol., 44(5): 554-563.
- Van der Bruggen, B., Everaert, K., Wilms, D. et Vandecasteele, C. (2001). Application of nanofiltration for removal of pesticides, nitrate and hardness from ground water: Rejection properties and economic evaluation. J. Memb. Sci., 193: 239–248.
- Vanhoorne, M., de Rouck, A. et de Bacquer, D. (1995). Epidemiological study of eye irritation by hydrogen sulphide and/or carbon disulphide exposure in viscose rayon workers. Ann. Occup. Hyg., 39(3): 307–315.
- Vidović, M.M., Jovićević, J.N., Krstić, J.D., Tomić, I.D. et Rogan, S.S. (2010). The influence of ph on removal of H2S and natural organic matter by anion resin. Desalination Water Treat., 21(1-3): 255-263.
- Vingerhoeds, M.H., Nijenhuis-de Vries, M.A., Ruepert, N., van der Laan, H., Bredie, W.L.P. et Kremer, S. (2016). Sensory quality of drinking water produced by reverse osmosis membrane filtration followed by remineralisation. Water Res., 94: 42–51.
- Vollertsen, J., Nielsen, A.H., Jensen, H.S., Wium-Andersen, T. et Hvitved-Jacobsen, T. (2008). Corrosion of concrete sewers-the kinetics of hydrogen sulfide oxidation. Sci. Total Environ. 394(1): 162-170.
- Vollmer, W.M., Sacks, F.M., Ard, J., Appel, L.J., Bray, G.A., Simons-Morton, D.G., Conlin, P.R., Svetkey, L.P., Erlinger, T.P., Moore, T.J., Karanja, N. et DASH-Sodium Trial Collaborative Research Group (2001). Effects of diet and sodium intake on blood pressure: Subgroup analysis of the DASH-sodium trial. Ann. Intern. Med., 135(12): 1019–1028.
- Wacker, W.E.C. et Parisi, A.F. (1968). Magnesium metabolism. N. Engl. J. Med., 278(13): 712–717 (cité dans IOM, 1997).
- Wang, X., Terry, P. et Yan, H. (2009). Review of salt consumption and stomach cancer risk: Epidemiological and biological evidence. World J. Gastroenterol., 15(18): 2204–2213.
- Wasch, H.H., Estrin, W.J., Yip, P., Bowler, R. et Cone, J.E. (1989). Prolongation of the P-300 latency associated with hydrogen sulfide exposure. Arch. Neurol., 46(8): 902–904.
- Watts, D.L. (1997). Trace elements and other essential nutrients: Clinical application of tissue mineral analysis. 2nd writer's B-l-o-c-k edition (cité dans Rosborg et Kozisek, 2020).
- Watts, S.F. (2000). The mass budgets of carbonyl sulfide, dimethyl sulfide, carbon disulfide and hydrogen sulfide. Atmos. Environ. 34(5): 761–779.
- Weaver, C.M., Alexander, D.D., Boushey, C.J., Dawson-Hughes, B., Lappe, J.M., LeBoff, M.S., Liu, S., Looker, A.C., Wallace, T.C. et Wang, D.D. (2016). Calcium plus vitamin D supplementation and risk of fractures: An updated meta-analysis from the national osteoporosis foundation. Osteoporos. Int., 27(1): 367–376.
- Weinberger, M.H. (1993). Racial differences in renal sodium excretion: Relationship to hypertension. Am. J. Kidney Dis., 21(4 Suppl 1): 41–45.
- Wesselink, E., Kok, D.E., Bours, M.J.L., De Wilt, J.H.W., Van Baar, H., Van Zutphen, M., Geijsen, A.M.J.R., Keulen, E.T.P., Hansson, B.M.E., Van Den Ouweland, J., Witkamp, R.F., Weijenberg, M.P., Kampman, E. et Van Duijnhoven, F.J.B. (2020). Vitamin D, magnesium, calcium, and their interaction in relation to colorectal cancer recurrence and all-cause mortality. Am. J. Clin. Nutr., 111(5): 1007–1017.
- Wetterau, H., Oekert, W. et Knape, U.G. (1964). Tests for the application of dried green fodder with higher hydrogen sulfide content (experiments with poultry and fattened pigs). Fetterung. 5: 383–393 (en allemand) (cité dans ATSDR, 2016).
- Willey, B.F., Jennings, H. et Muroski, F. (1964). Removal of hydrogen sulfide with potassium permanganate. J. Am. Water Works Assoc., 56(4): 475–479.
- Wu, Z., Zhang, X., Pang, J., Li, J., Li, J. et Zhang, P. (2020). High-poly-aluminum chloride sulfate coagulants and their coagulation performances for removal of humic acid. RSC Adv., 10(12): 7155–7162.
- Yang, C.Y., Chiu, H.F., Chiu, J.F., Tsai, S.S. et Cheng, M.F. (1997). Calcium and magnesium in drinking water and risk of death from colon cancer. Jpn. J. Cancer Res., 88(10): 928–933.
- Yang, C.Y., Cheng, M.F., Tsai, S.S. et Hsieh, Y.L. (1998). Calcium, magnesium, and nitrate in drinking water and gastric cancer mortality. Jpn. J. Cancer Res., 89(2): 124–130.
- Yang, C.Y., Tsai, S.S., Lai, T.C., Hung, C.F. et Chiu, H.F. (1999). Rectal cancer mortality and total hardness levels in Taiwan's drinking water. Environ. Res., 80(4): 311–316.
- Yang, C.Y., Chiu, H.F., Cheng, B.H., Hsu, T.Y., Cheng, M.F. et Wu, T.N. (2000a). Calcium and magnesium in drinking water and the risk of death from breast cancer. J. Toxicol. Environ. Health Part A, 60(4): 231–241.
- Yang, C.Y., Chiu, H.F., Tsai, S.S., Cheng, M.F., Lin, M.C. et Sung, F.C. (2000b). Calcium and magnesium in drinking water and risk of death from prostate cancer. J. Toxicol. Environ. Health A, 60(1): 17–26.
- Yaroshevsky, A.A. (2006). Abundances of chemical elements in the earth's crust. Geochem. Int., 44(1): 48–55.
- Zarkadas, M., Gougeon-Reyburn, R., Marliss, E.B., Block, E. et Alton-Mackey, M. (1989). Sodium chloride supplementation and urinary calcium excretion in postmenopausal women. Am. J. Clin. Nutr., 50(5): 1088–1094.
- Zhang, X., Li, Y., Del Gobbo, L.C., Rosanoff, A., Wang, J., Zhang, W. et Song, Y. (2016). Effects of magnesium supplementation on blood pressure: A meta-analysis of randomized double-blind placebo-controlled trials. Hypertension, 68(2): 324–333.
- Zhao, S., Wang, X., Li, N., Chen, Y., Su, Y. et Zhang, J. (2015). Effects of strontium ranelate on bone formation in the mid-palatal suture after rapid maxillary expansion. Drug Des. Dev. Ther., 9: 2725–2734.
- Zhong, G.C., Peng, Y., Wang, K., Wan, L., Wu, Y.Q.L., Hao, F.B., Hu, J.J. et Gu, H.T. (2020). Magnesium intake and primary liver cancer incidence and mortality in the prostate, lung, colorectal and ovarian cancer screening trial. International journal of cancer. Int. J. Cancer, 147(6): 1577–1586.
- Zipf, K.A. Jr. et Luthy, R.G. (1981). Chemical equilibria in split-treatment softening of water. J. Am. Water Works Assoc., 73(6): 304–311.
Annexe A : Liste des abréviations
- µm
- micromole
- ADN
- acide désoxyribonucléique
- AMT
- apport maximal tolérable
- ANSI
- American National Standards Institute
- AWWA
- American Water Works Association
- CaCO3
- carbonate de calcium
- CAG
- charbon actif en grains
- CCPP
- potentiel de précipitation du carbonate de calcium
- CIRC
- Centre international de recherche sur le cancer
- CMA
- concentration maximale acceptable
- CO2
- dioxyde de carbone
- COD
- carbone organique dissous
- EDTA
- acide éthylènediaminetétracétique
- ESSIDES
- eau souterraine sous l'influence directe d'eau de surface
- IOM
- Institute of Medicine
- LDQ
- limite de quantitation
- MDT
- matières dissoutes totales
- MON
- matière organique naturelle
- NSF
- NSF International
- OE
- objectif d'ordre esthétique
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- S9
- mélange métabolique
- U.S. EPA
- Environmental Protection Agency des États-Unis
- UE
- Union européenne
- USGS
- United States Geological Survey
- UTN
- unité de turbidité néphélémétrique
- VBS
- valeur basée sur la santé
Annexe B : Tableaux des données provinciales
Les données fournies par les provinces provenaient de diverses approvisionnements en eau potable au Canada, à savoir des eaux de surface et des eaux souterraines, ainsi que de l'eau traitée et distribuée ayant fait l'objet d'une surveillance (British Columbia Ministry of Health, 2021; ministère de l'Environnement, de la Protection de la nature et des Parcs de l'Ontario, 2021; ministère du Développement durable du Manitoba, 2021; ministère de l'Environnement et de la Lutte contre les changements climatiques du Québec, 2021; ministère de l'Environnement de la Nouvelle-Écosse, 2021; Saskatchewan Water Security Agency, 2021; ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard, 2021; ministère de la Santé du Nouveau-Brunswick, 2021; ministère des Affaires municipales et de l'Environnement de Terre-Neuve-et-Labrador, 2021).
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Colombie-Britannique 2016– 2021 |
Municipale | Eau souterraine – brute | 117/117 | 59,1 | 95,8 | 531 |
| Eau de surface – distribuée | 5/5 | 67,2 | NC | 90,3 | ||
| Eau souterraine et/ou de surface – brute | 54/54 | 39,9 | 100,8 | 141 | ||
| Eau souterraine et/ou de surface – traitée | 13/13 | 17 | 84,4 | 90,3 | ||
| Eau souterraine et/ou de surface – distribuée | 358/366 | 38,7 | 85,7 | 195 | ||
| Eau de surface – brute | 10/10 | 14,4 | 75,2 | 107 | ||
| Eau de surface – distribuée | 5/5 | 27,9 | NC | 38,2 | ||
| Non municipale | Eau souterraine – brute | 127/127 | 59,1 | 97,3 | 531 | |
| Eau souterraine – traitée | 3/3 | 72,5 | NC | 90,3 | ||
| Eau souterraine – distribuée | 1/1 | NC | NC | 69,8 | ||
| Eau souterraine – non spécifié | 212/215 | 45,6 | 85,6 | 195 | ||
| Eau souterraine et/ou de surface – brute | 33/33 | 41,3 | 91,7 | 107 | ||
| Eau souterraine et/ou de surface – traitée | 6/6 | 7,6 | NC | 87,4 | ||
| Eau souterraine et/ou de surface – non spécifié | 205/211 | 39,1 | 91,1 | 193 | ||
| Eau de surface – brute | 24/24 | 13,9 | 59,2 | 96 | ||
| Eau de surface – traitée | 10/10 | 14,9 | 33,2 | 33,6 | ||
| Eau de surface – distribuée | 2/2 | NC | NC | 35,8 | ||
| Eau de surface – non spécifié | 46/46 | 27 | 57,4 | 124 | ||
| Manitoba 2009– 2020 |
Municipale et non municipale | Eau souterraine et ESSIDES – brute | 581/581 | 73,7 | 150 | 546 |
| Eau souterraine et ESSIDES – non désinfectée | 323/323 | 65,7 | 118 | 383 | ||
| Eau souterraine et ESSIDES – traitée | 571/572 | 57,2 | 115 | 347 | ||
| Eau souterraine et ESSIDES – distribuée | 282/282 | 62,8 | 133 | 360 | ||
| Eau souterraine et/ou de surface – brute | 55/55 | 30,9 | 94,2 | 125 | ||
| Eau souterraine et/ou de surface – non désinfectée | 22/22 | 45,4 | 112,3 | 126 | ||
| Eau souterraine et/ou de surface – traitée | 55/55 | 23,1 | 53,7 | 120 | ||
| Eau souterraine et/ou de surface – distribuée | 20/20 | 28,6 | 62,2 | 161 | ||
| Eau de surface – brute | 306/306 | 23,5 | 88,6 | 219 | ||
| Eau de surface – traitée | 306/306 | 19 | 58,2 | 227 | ||
| Eau de surface – distribuée | 194/194 | 19,7 | 63,5 | 232 | ||
| Nouveau-Brunswick (0,05– 0,2) 2016– 2019 |
Municipale et semi-publique | Eau souterraine – brute | 977/977 | 27,4 | 66 | 188 |
| Eau souterraine – traitée | 338/338 | 24,7 | 67,4 | 162 | ||
| Eau souterraine – distribuée | 554/554 | 33,2 | 56 | 132 | ||
| Eau souterraine – non spécifié | 161/161 | 46,5 | 112 | 191 | ||
| Eau souterraine et de surface – brute | 288/288 | 5,5 | 7,7 | 42,3 | ||
| Eau souterraine et de surface – traitée | 5/5 | 6,9 | NC | 9,2 | ||
| Eau souterraine et de surface – distribuée | 552/552 | 6,1 | 64,8 | 89,5 | ||
| Eau de surface – brute | 97/97 | 4,4 | 32,1 | 78,1 | ||
| Eau de surface – traitée | 1/1 | NC | NC | 2,6 | ||
| Eau de surface – distribuée | 259/259 | 7,9 | 28,1 | 55,1 | ||
| Terre-Neuve-et-Labrador (0,1– 1) 2015– 2020 |
Municipale | Eau souterraine – brute | 252/254 | 27,5 | 55 | 250 |
| Eau souterraine – distribuée | 1 317/1 357 | 28 | 64 | 266 | ||
| Eau de surface – brute | 657/735 | 2 | 19 | 88 | ||
| Eau de surface – distribuée | 3 409/3 823 | 3 | 19 | 95 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et semi-publique | Eau souterraine – brute | 186/186 | 33,8 | 85,1 | 438 |
| Eau souterraine – traitée | 314/319 | 29 | 66,1 | 330 | ||
| Eau souterraine – distribuée | 4/4 | 37,9 | NC | 63,1 | ||
| Eau de surface – brute | 79/79 | 2,2 | 7,1 | 29 | ||
| Eau de surface – traitée | 400/401 | 5,8 | 20,2 | 56 | ||
| Eau de surface – distribuée | 24/24 | 6,8 | 12,4 | 16,8 | ||
| Non municipale | Eau souterraine – brute | 752/752 | 27 | 71,9 | 609 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 2 157/2 159 | 85,7 | 130 | 453 |
| Eau souterraine – traitée | 1 147/1 148 | 84,5 | 125 | 253 | ||
| Eau souterraine – distribuée | 821/821 | 80,6 | 106 | 139 | ||
| Eau souterraine et de surface – brute | 218/218 | 66,5 | 99,2 | 177 | ||
| Eau souterraine et de surface – traitée | 41/41 | 81,4 | 92,5 | 97,9 | ||
| Eau souterraine et de surface – distribuée | 699/699 | 36,3 | 42,4 | 150 | ||
| Eau de surface – brute | 894/894 | 32,4 | 37,8 | 216 | ||
| Eau de surface – traitée | 1 124/1 124 | 33,7 | 37,6 | 117 | ||
| Eau de surface – distribuée | 1 611/1 611 | 8 | 32,4 | 114 | ||
| Île-du-Prince-Édouard (0,02 mg/L) 2016– 2021 |
Municipale | Eau souterraine – brute | 852/857 | 36,6 | 91,4 | 188,2 |
| Non municipale | Eau souterraine – brute | 14 515/15 141 | 32,5 | 62 | 2 783 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 1 915/1 945 | 44,3 | 87 | 1 900 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 270/270 | 128 | 205,1 | 358 |
| Eau souterraine et de surface – traitée | 117/136 | 48 | 134 | 369 | ||
| Eau souterraine et de surface – distribuée | 3 084/3 183 | 62 | 179,8 | 593 | ||
| Eau de surface – brute | 136/137 | 75 | 103 | 172 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Colombie-Britannique (2016– 2021) |
Municipale | Eau souterraine – brute | 107/107 | 6,3 | 36,9 | 793 |
| Eau souterraine – distribuée | 5/5 | 4,1 | NC | 68,1 | ||
| Eau de surface – brute | 9/9 | 0,7 | 80,7 | 210 | ||
| Eau de surface – distribuée | 5/5 | 2,2 | 6,5 | 6,8 | ||
| Non municipale | Eau souterraine – brute | 116/117 | 6,4 | 50 | 793 | |
| Eau souterraine – traitée | 3/3 | 9,4 | NC | 43,4 | ||
| Eau souterraine – distribuée | 1/1 | NC | NC | 1,3 | ||
| Eau souterraine – non spécifié | 189/191 | 4,8 | 51,2 | 293 | ||
| Eau de surface – brute | 23/23 | 0,5 | 5,6 | 210 | ||
| Eau de surface – traitée | 10/10 | 0,8 | 1,8 | 3,2 | ||
| Eau de surface – distribuée | 2/2 | NC | NC | 27,2 | ||
| Eau de surface – non spécifié | 41/42 | 1,6 | 21,4 | 57,3 | ||
| Manitoba (2009– 2020) |
Municipale et non municipale | Eau souterraine et ESSIDES – brute | 571/571 | 18,4 | 172 | 1 280 |
| Eau souterraine et ESSIDES – non désinfectée | 305/305 | 20,5 | 262,2 | 1 390 | ||
| Eau souterraine et ESSIDES – traitée | 541/541 | 19,8 | 139 | 879 | ||
| Eau souterraine et ESSIDES – distribuée | 4/4 | 49,8 | NC | 85,4 | ||
| Eau de surface – brute | 305/305 | 4,7 | 50,4 | 1 830 | ||
| Eau de surface – traitée | 306/306 | 14 | 70,9 | 352 | ||
| Eau de surface – distribuée | 6/6 | 18 | NC | 39,3 | ||
| Nouveau-Brunswick (0,01– 0,2) 2016– 2019 |
Municipale | Eau souterraine – brute | 1 328/1 367 | 35,6 | 78,6 | 280 |
| Eau souterraine – traitée | 338/338 | 37,3 | 149,6 | 540 | ||
| Eau souterraine – distribuée | 554/554 | 27,4 | 83,2 | 407 | ||
| Eau souterraine – non spécifié | 156/156 | 39,8 | 225,5 | 503 | ||
| Eau souterraine et de surface – brute | 288/288 | 5,8 | 9,9 | 33,1 | ||
| Eau souterraine et de surface – traitée | 5/5 | 11,4 | NC | 14,3 | ||
| Eau souterraine et de surface – distribuée | 552/552 | 10,7 | 68,2 | 78 | ||
| Eau de surface – brute | 97/97 | 3,8 | 10,9 | 134 | ||
| Eau de surface – traitée | 1/1 | NC | NC | 5 | ||
| Eau de surface – distribuée | 259/259 | 5,8 | 15,4 | 106 | ||
| Terre-Neuve-et-Labrador (0,1– 1) 2015– 2020 |
Municipale | Eau souterraine – brute | 253/254 | 25,5 | 73 | 405 |
| Eau souterraine – distribuée | 1 354/1 357 | 29 | 83 | 610 | ||
| Eau de surface – brute | 727/735 | 8 | 20 | 570 | ||
| Eau de surface – distribuée | 3 722/3 823 | 12 | 25 | 610 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et non municipale | Eau souterraine – brute | 201/201 | 30 | 142 | 960 |
| Eau souterraine – traitée | 285/285 | 36 | 140 | 1 600 | ||
| Eau souterraine – distribuée | 4/4 | 11,5 | NC | 67 | ||
| Eau de surface – brute | 91/91 | 8 | 21 | 51 | ||
| Eau de surface – traitée | 397/404 | 15 | 31,7 | 88 | ||
| Eau de surface – distribuée | 24/24 | 6 | 13 | 14 | ||
| Non municipale | Eau souterraine – brute | 743/743 | 21 | 170 | 2 200 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 2 790/2 801 | 70,3 | 270 | 1 715 |
| Eau souterraine – traitée | 1 272/1 272 | 53 | 177 | 561,6 | ||
| Eau souterraine – distribuée | 1 155/1 155 | 55,7 | 173,6 | 330 | ||
| Eau souterraine et de surface – brute | 168/168 | 70,2 | 124,5 | 331 | ||
| Eau souterraine et de surface – traitée | 223/223 | 13,8 | 74,5 | 116 | ||
| Eau souterraine et de surface – distribuée | 815/815 | 28,9 | 37,8 | 100 | ||
| Eau de surface – brute | 894/895 | 24,5 | 34 | 190 | ||
| Eau de surface – traitée | 941/941 | 27 | 39,3 | 170 | ||
| Eau de surface – distribuée | 1 804/1 806 | 6,1 | 87,8 | 160 | ||
| Île-du-Prince-Édouard (0,26) 2016– 2021 |
Municipale | Eau souterraine – brute | 856/856 | 18,5 | 117,5 | 2 140 |
| Non municipale | Eau souterraine – brute | 14 590/14 615 | 14,8 | 59,8 | 15 000 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 1 999/2 065 | 91,2 | 130 | 11 000 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 266/267 | 13,2 | 151,5 | 616,5 |
| Eau souterraine et de surface – traitée | 135/136 | 17,1 | 60,8 | 394,7 | ||
| Eau souterraine et de surface – distribuée | 3 032/3 049 | 21,6 | 87 | 1 120 | ||
| Eau de surface – brute | 159/159 | 18,6 | 52 | 1 065,6 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L de CaCO3) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Colombie-Britannique (2016– 2021) |
Municipale | Eau souterraine – brute | 111/111 | 215 | 454 | 1 650 |
| Eau souterraine – distribuée | 5/5 | 236 | NC | 389 | ||
| Eau de surface – brute | 10/10 | 44 | 399,3 | 1 140 | ||
| Eau de surface – distribuée | 5/5 | 95,1 | NC | 162 | ||
| Non municipale | Eau souterraine – brute | 120/120 | 234,5 | 469,1 | 1 650 | |
| Eau souterraine – traitée | 3/3 | 286 | NC | 367 | ||
| Eau souterraine – distribuée | 1/1 | NC | NC | 200 | ||
| Eau souterraine – non spécifié | 199/203 | 183 | 452,4 | 1 150 | ||
| Eau de surface – brute | 24/24 | 41,8 | 207,8 | 1 140 | ||
| Eau de surface – traitée | 10/10 | 46,3 | 101,1 | 102 | ||
| Eau de surface – distribuée | 2/2 | NC | NC | 319 | ||
| Eau de surface – non spécifié | 46/46 | 86,4 | 282,5 | 606 | ||
| Manitoba (2009– 2020) |
Municipale et non municipale | Eau souterraine et ESSIDES – brute | 571/571 | 368 | 677 | 1 570 |
| Eau souterraine et ESSIDES – non désinfectée | 305/305 | 337 | 649 | 1 650 | ||
| Eau souterraine et ESSIDES – traitée | 538/541 | 278 | 546 | 1 360 | ||
| Eau souterraine et ESSIDES – distribuée | 4/4 | 111 | NC | 170 | ||
| Eau de surface – brute | 305/305 | 91,7 | 416,2 | 1 130 | ||
| Eau de surface – traitée | 306/306 | 76,7 | 245,5 | 861 | ||
| Eau de surface – distribuée | 6/6 | 143,4 | NC | 310 | ||
| Nouveau-Brunswick (0,2– 0,7) 2016– 2019 |
Municipale | Eau souterraine – brute | 1 176/1 176 | 91,8 | 196 | 543 |
| Eau souterraine – traitée | 338/338 | 78,5 | 207 | 476 | ||
| Eau souterraine – distribuée | 551/551 | 102 | 174 | 392 | ||
| Eau souterraine – non spécifié | 161/161 | 125 | 296 | 499 | ||
| Eau souterraine et de surface – brute | 61/61 | 23 | 111 | 126 | ||
| Eau souterraine et de surface – traitée | 5/5 | 20 | NC | 25 | ||
| Eau souterraine et de surface – distribuée | 306/306 | 23 | 216 | 289 | ||
| Eau de surface – brute | 97/97 | 14 | 88,4 | 224 | ||
| Eau de surface – traitée | 1/1 | 8,5 | 8,5 | 8,5 | ||
| Eau de surface – distribuée | 259/259 | 22,8 | 81 | 158 | ||
| Terre-Neuve-et-Labrador (1) 2015– 2020 |
Municipale | Eau souterraine – brute | 251/253 | 96 | 190 | 700 |
| Eau souterraine – distribuée | 1 316/1 357 | 95 | 218,4 | 747 | ||
| Eau de surface – brute | 666/735 | 7 | 83 | 273 | ||
| Eau de surface – distribuée | 3 419/3 823 | 10 | 70,8 | 291 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et non municipale | Eau souterraine – brute | 182/183 | 120 | 257,2 | 1 250 |
| Eau souterraine – traitée | 252/263 | 84,2 | 208 | 850 | ||
| Eau souterraine – distribuée | 4/4 | 104 | NC | 210 | ||
| Eau de surface – brute | 76/76 | 8,6 | 23,2 | 82 | ||
| Eau de surface – traitée | 382/383 | 17,8 | 52 | 190 | ||
| Eau de surface – distribuée | 23/23 | 18,7 | 36,4 | 47 | ||
| Non municipale | Eau souterraine – brute | 692/692 | 98 | 260 | 1 740 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 2 142/2 143 | 320 | 458 | 1 410 |
| Eau souterraine – traitée | 1 240/1 240 | 318 | 460 | 924 | ||
| Eau souterraine – distribuée | 1 119/1 119 | 236 | 383 | 548 | ||
| Eau souterraine et de surface – brute | 167/167 | 278 | 362,4 | 577 | ||
| Eau souterraine et de surface – traitée | 49/49 | 305 | 407,2 | 434 | ||
| Eau souterraine et de surface – distribuée | 702/702 | 126 | 158 | 476 | ||
| Eau de surface – brute | 1 148/1 148 | 115 | 131 | 668 | ||
| Eau de surface – traitée | 1 442/1 442 | 118 | 131 | 476 | ||
| Eau de surface – distribuée | 945/945 | 26 | 123 | 415 | ||
| Île-du-Prince-Édouard 2016– 2021 |
Municipale | Eau souterraine – brute | 857/857 | 159 | 247,8 | 1 164 |
| Non municipale | Eau souterraine – brute | 14 665/14 723 | 136,4 | 202,3 | 11 090 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 604/604 | 166 | 337,7 | 3 902 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 260/260 | 531,5 | 909,7 | 1 528 |
| Eau souterraine et de surface – traitée | 136/136 | 194 | 640,5 | 1 475 | ||
| Eau souterraine et de surface – distribuée | 2 977/2 996 | 298,5 | 848,5 | 4 980 | ||
| Eau de surface – brute | 134/134 | 407 | 596,7 | 1 023 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Colombie-Britannique (2016– 2021) |
Municipale | Eau souterraine – brute | 121/121 | 13,2 | 72,5 | 177 |
| Eau souterraine – distribuée | 5/5 | 16,6 | NC | 49,1 | ||
| Eau de surface – brute | 9/9 | 2 | 10,5 | 12,4 | ||
| Eau de surface – distribuée | 5/5 | 10,8 | NC | 16,2 | ||
| Non municipale | Eau souterraine – brute | 131/131 | 12,9 | 72,5 | 177 | |
| Eau souterraine – traitée | 3/3 | 14,7 | NC | 45,1 | ||
| Eau souterraine – distribuée | 1/1 | NC | 6,2 | 6,2 | ||
| Eau souterraine – non spécifié | 211/214 | 12,5 | 52,3 | 176 | ||
| Eau de surface – brute | 23/23 | 2 | 15,7 | 25 | ||
| Eau de surface – traitée | 10/10 | 2,7 | 4,5 | 5,8 | ||
| Eau de surface – distribuée | 2/2 | 60 | NC | 65 | ||
| Eau de surface – non spécifié | 45/45 | 5,8 | 28,8 | 93,6 | ||
| Manitoba (2009– 2020) |
Municipale et non municipale | Eau souterraine et ESSIDES – brute | 581/581 | 40 | 83,8 | 153 |
| Eau souterraine et ESSIDES – non désinfectée | 325/325 | 37,2 | 93,1 | 214 | ||
| Eau souterraine et ESSIDES – traitée | 575/576 | 28,8 | 69,7 | 145 | ||
| Eau souterraine et ESSIDES – distribuée | 282/285 | 29,4 | 72,2 | 127 | ||
| Eau de surface – brute | 306/306 | 7,1 | 50,3 | 147 | ||
| Eau de surface – traitée | 307/307 | 5,9 | 23,8 | 90,3 | ||
| Eau de surface – distribuée | 195/196 | 6,8 | 25,6 | 89 | ||
| Nouveau-Brunswick (0,05– 1) 2016– 2019 |
Municipale | Eau souterraine – brute | 973/973 | 3,9 | 11,3 | 38 |
| Eau souterraine – traitée | 338/338 | 2,6 | 9,4 | 20,1 | ||
| Eau souterraine – distribuée | 554/554 | 3,6 | 10,1 | 16,3 | ||
| Eau souterraine – non spécifié | 161/161 | 4,1 | 9,6 | 22,5 | ||
| Eau souterraine et de surface – brute | 61/61 | 1,1 | 6,2 | 6,8 | ||
| Eau souterraine et de surface – traitée | 5/5 | 0,7 | NC | 0,8 | ||
| Eau souterraine et de surface – distribuée | 306/306 | 0,9 | 11,3 | 15,8 | ||
| Eau de surface – brute | 97/97 | 0,8 | 2,1 | 7 | ||
| Eau de surface – traitée | 1/1 | NC | NC | 0,5 | ||
| Eau de surface – distribuée | 259/259 | 0,9 | 2,6 | 5 | ||
| Terre-Neuve-et-Labrador (1) 2015– 2020 |
Municipale | Eau souterraine – brute | 236/254 | 6 | 14 | 27 |
| Eau souterraine – distribuée | 1 287/1 357 | 5 | 15 | 41 | ||
| Eau de surface – brute | 445/735 | 0,5 | 7 | 37 | ||
| Eau de surface – distribuée | 2 284/3 823 | 0,6 | 5 | 39 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et semi-publique | Eau souterraine – brute | 182/186 | 5,8 | 14 | 57,7 |
| Eau souterraine – traitée | 263/286 | 4 | 14 | 110 | ||
| Eau souterraine – distribuée | 4/4 | 2,5 | NC | 11,8 | ||
| Eau de surface – brute | 77/77 | 0,8 | 1,3 | 545 | ||
| Eau de surface – traitée | 390/392 | 0,9 | 3,4 | 580 | ||
| Eau de surface – distribuée | 24/24 | 0,4 | 1,2 | 1,4 | ||
| Non municipale | Eau souterraine – brute | 750/751 | 4 | 16 | 75 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 1 984/1 986 | 25,3 | 37,3 | 84,6 |
| Eau souterraine – traitée | 986/987 | 25,5 | 39,5 | 71,7 | ||
| Eau souterraine – distribuée | 665/665 | 27 | 35,9 | 46,3 | ||
| Eau souterraine et de surface – brute | 214/214 | 19,7 | 26,2 | 34,2 | ||
| Eau souterraine et de surface – traitée | 41/41 | 23,7 | 25,7 | 32,4 | ||
| Eau souterraine et de surface – distribuée | 553/553 | 8,9 | 13,9 | 36,9 | ||
| Eau de surface – brute | 856/864 | 8,3 | 9,2 | 31,2 | ||
| Eau de surface – traitée | 1 065/1 075 | 8,6 | 9,3 | 29,9 | ||
| Eau de surface – distribuée | 1 535/1 563 | 2 | 8,1 | 28,6 | ||
| Île-du-Prince-Édouard (0,01) 2016– 2021 |
Municipale | Eau souterraine – brute | 852/857 | 12,5 | 20,1 | 168,6 |
| Non municipale | Eau souterraine – brute | 14 424/15 141 | 13,1 | 20 | 1 006 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 1 895/1 996 | 10,9 | 25 | 327,9 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 266/270 | 50,5 | 94 | 168 |
| Eau souterraine et de surface – traitée | 116/136 | 19 | 71,5 | 152 | ||
| Eau souterraine et de surface – distribuée | 2 941/3 155 | 30 | 97 | 924 | ||
| Eau de surface – brute | 136/137 | 52 | 91,4 | 166 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Colombie-Britannique 2016– 2021 |
Municipale | Eau souterraine – brute | 105/106 | 29,7 | 128,5 | 1 490 |
| Eau souterraine – distribuée | 5/5 | 38,1 | NC | 137 | ||
| Eau de surface – brute | 9/9 | 7,1 | 57,2 | 147 | ||
| Eau de surface – distribuée | 5/5 | 6 | NC | 47,7 | ||
| Non municipale | Eau souterraine – brute | 115/116 | 32,6 | 140,5 | 1 490 | |
| Eau souterraine – traitée | 2/3 | 16,5 | NC | 116 | ||
| Eau souterraine – distribuée | 1/1 | NC | NC | 32,3 | ||
| Eau souterraine – non spécifié | 185/187 | 27 | 134,6 | 582 | ||
| Eau de surface – brute | 23/23 | 7,1 | 33,3 | 147 | ||
| Eau de surface – traitée | 9/9 | 7,3 | 14,7 | 14,8 | ||
| Eau de surface – distribuée | 2/2 | 11 | NC | 12,3 | ||
| Eau de surface – non spécifié | 40/41 | 10,9 | 47,2 | 273 | ||
| Manitoba 2009– 2020 |
Municipale et non municipale | Eau souterraine et ESSIDES – brute | 555/571 | 60,4 | 389 | 1 310 |
| Eau souterraine et ESSIDES – non désinfectée | 290/305 | 51,6 | 358,8 | 2 260 | ||
| Eau souterraine et ESSIDES – traitée | 522/541 | 49,7 | 295 | 1 220 | ||
| Eau souterraine et ESSIDES – distribuée | 4/4 | 34,1 | NC | 101 | ||
| Eau de surface – brute | 303/305 | 4,4 | 205 | 497 | ||
| Eau de surface – traitée | 273/306 | 6,2 | 142 | 468 | ||
| Eau de surface – distribuée | 5/6 | 55,8 | NC | 277 | ||
| Nouveau-Brunswick (0,05– 2) 2016– 2009 |
Municipale | Eau souterraine – brute | 1 327/1 366 | 15 | 47 | 83 |
| Eau souterraine – traitée | 338/338 | 10 | 34 | 440 | ||
| Eau souterraine – distribuée | 554/554 | 12 | 30 | 73 | ||
| Eau souterraine et/ou de surface – non spécifié | 156/156 | 13 | 23 | 104 | ||
| Eau souterraine et de surface – brute | 54/54 | 5,5 | 8,7 | 18 | ||
| Eau souterraine et de surface – traitée | 5/5 | 2 | NC | 3 | ||
| Eau souterraine et de surface – distribuée | 298/298 | 4 | 37 | 51 | ||
| Eau de surface – brute | 87/87 | 2 | 3,6 | 23 | ||
| Eau de surface – traitée | 1/1 | NC | NC | 2 | ||
| Eau de surface – distribuée | 251/251 | 12 | 31 | 47 | ||
| Terre-Neuve-et-Labrador (1– 2) 2015– 2020 |
Municipale | Eau souterraine – brute | 244/254 | 8 | 24 | 550 |
| Eau souterraine – distribuée | 1 299/1 357 | 9 | 25 | 598 | ||
| Eau de surface – brute | 368/735 | 1 | 3 | 120 | ||
| Eau de surface – distribuée | 2 224/3 823 | 1 | 4 | 120 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et non municipale | Eau souterraine – brute | 191/202 | 13 | 66,4 | 1 100 |
| Eau souterraine – traitée | 264/279 | 13 | 100 | 620 | ||
| Eau souterraine – distribuée | 4/4 | 30 | NC | 34 | ||
| Eau de surface – brute | 65/91 | 3 | 14 | 31 | ||
| Eau de surface – traitée | 361/406 | 10 | 31 | 71 | ||
| Eau de surface – distribuée | 24/24 | 16,5 | 26 | 29 | ||
| Non municipale | Eau souterraine – brute | 723/742 | 11 | 94,9 | 1 600 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 1 825/1 865 | 39,7 | 110 | 1 000 |
| Eau souterraine – traitée | 1 003/1 059 | 34 | 78,3 | 827 | ||
| Eau souterraine – distribuée | 980/989 | 27,6 | 62,5 | 190 | ||
| Eau souterraine et de surface – brute | 159/159 | 31,2 | 44,8 | 69,4 | ||
| Eau souterraine et de surface – traitée | 37/37 | 44,9 | 51,2 | 53 | ||
| Eau souterraine et de surface – distribuée | 793/793 | 25 | 26,7 | 66 | ||
| Eau de surface – brute | 745/745 | 23,8 | 26 | 91 | ||
| Eau de surface – traitée | 921/922 | 26 | 34,3 | 92 | ||
| Eau de surface – distribuée | 852/852 | 26,7 | 34,5 | 45 | ||
| Île-du-Prince-Édouard (0,03) 2016– 2021 |
Municipale | Eau souterraine – brute | 857/857 | 7,8 | 15,6 | 287,1 |
| Non municipale | Eau souterraine – brute | 14 946/15 121 | 6,4 | 14,8 | 2 126 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 1 842/1 999 | 40,7 | 52 | 3 624 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 263/263 | 320 | 867,5 | 1 710 |
| Eau souterraine et de surface – traitée | 136/136 | 90,4 | 764 | 1 381,6 | ||
| Eau souterraine et de surface – distribuée | 2 981/3 014 | 148,2 | 805,5 | 8 560 | ||
| Eau de surface – brute | 137/137 | 350 | 808,2 | 1 936,2 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Manitoba | Municipale et non municipale | Eau souterraine et ESSIDES – brute | 571/571 | 521 | 1 320 | 3 120 |
| Eau souterraine et ESSIDES – non désinfectée | 305/305 | 521 | 1 206 | 4 890 | ||
| Eau souterraine et ESSIDES – traitée | 541/541 | 456 | 1 030 | 3 030 | ||
| Eau souterraine et ESSIDES – distribuée | 4/4 | 300 | NC | 486 | ||
| Eau souterraine et/ou de surface – brute | 56/56 | 219 | 848,5 | 981 | ||
| Eau souterraine et/ou de surface – non désinfecté | 21/21 | 620 | 1 290 | 1 650 | ||
| Eau souterraine et/ou de surface – traitée | 56/56 | 194 | 656,5 | 1 030 | ||
| Eau souterraine et/ou de surface – distribuée | 2/2 | 114 | NC | 163 | ||
| Eau de surface – brute | 305/305 | 120 | 640,2 | 3 160 | ||
| Eau de surface – traitée | 305/306 | 136,5 | 472 | 1 410 | ||
| Eau de surface – distribuée | 6/6 | 224 | NC | 593 | ||
| Nouveau-Brunswick (1– 5) |
Municipale | Eau souterraine – brute | 103/103 | 131 | 179 | 429 |
| Eau souterraine – distribuée | 50/50 | 123 | 205,2 | 493 | ||
| Eau souterraine et de surface – brute | 5/5 | 22 | NC | 25 | ||
| Eau souterraine et de surface – traitée | 5/5 | 49 | NC | 58 | ||
| Eau de surface – brute | 8/8 | 61 | NC | 101 | ||
| Eau de surface – distribuée | 12/12 | 52 | 98,5 | 101 | ||
| Terre-Neuve-et-Labrador (1– 5) 2015– 2020 |
Municipale | Eau souterraine – brute | 253/253 | 181 | 309,2 | 1 030 |
| Eau souterraine – distribuée | 1 356/1 357 | 190 | 367 | 1 550 | ||
| Eau de surface – brute | 735/735 | 30 | 120 | 1 000 | ||
| Eau de surface – distribuée | 3 772/3 823 | 43 | 128,9 | 1 100 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et non municipale | Eau souterraine – brute | 194/194 | 201,5 | 477,6 | 2 380 |
| Eau souterraine – traitée | 303/304 | 248 | 432,8 | 2 900 | ||
| Eau souterraine – distribuée | 4/4 | 80 | NC | 345 | ||
| Eau de surface – brute | 90/92 | 24,5 | 65,8 | 119 | ||
| Eau de surface – traitée | 407/409 | 67 | 115 | 396 | ||
| Eau de surface – distribuée | 24/24 | 42,5 | 80,2 | 95 | ||
| Non municipale | Eau souterraine – brute | 737/737 | 180 | 598 | 4 200 | |
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 711/711 | 448 | 870 | 1 880 |
| Eau souterraine – traitée | 540/540 | 478 | 810,1 | 1 530 | ||
| Eau souterraine – distribuée | 336/337 | 442 | 667,8 | 952 | ||
| Eau souterraine et de surface – brute | 124/124 | 374 | 514,3 | 797 | ||
| Eau souterraine et de surface – traitée | 70/70 | 202 | 444,5 | 507 | ||
| Eau souterraine et de surface – distribuée | 605/605 | 187 | 212 | 728 | ||
| Eau de surface – brute | 429/435 | 83 | 187 | 860 | ||
| Eau de surface – traitée | 579/581 | 134 | 210 | 634 | ||
| Eau de surface – distribuée | 820/831 | 100 | 160 | 1 120 | ||
| Île-du-Prince-Édouard 2016– 2021 |
Municipale | Eau souterraine – brute | 1/1 | 208 | NC | 208 |
| Non municipale | Eau souterraine – brute | 5/5 | 214 | NC | 513 | |
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 443/444 | 684,3 | 1 125,7 | 13 837,4 |
| Saskatchewan 2015– 2020 |
Municipale | Eau souterraine – brute | 210/210 | 1 210,5 | 2 149,4 | 3 320 |
| Eau souterraine et de surface – traitée | 80/80 | 810 | 2 201,3 | 3 043 | ||
| Eau souterraine et de surface – distribuée | 2 364/2 364 | 745,5 | 2 067,8 | 13 395 | ||
| Eau de surface – brute | 109/109 | 903 | 1 606,8 | 3 426 | ||
|
||||||
| Province (LD en mg/L) |
Source municipale ou non municipale | Type d'eau | Nombre de détections/échantillons | Concentration (mg/L) | ||
|---|---|---|---|---|---|---|
| Médiane | 90e centile | Max. | ||||
| Nouveau-Brunswick (0,05) 2016– 2019 |
Eau souterraine | Eau souterraine – brute | 3/3 | 0,05 | NC | 0,05 |
| Eau souterraine – distribuée | 1/1 | NC | NC | 0,05 | ||
| Nouvelle-Écosse 2016– 2020 |
Municipale et semi-publique | Eau souterraine – brute | 1/23 | 0,05 | 0,05 | 0,1 |
| Eau souterraine – traitée | 0/4 | < LD | NC | < LD | ||
| Eau de surface – brute | 0/21 | < LD | NC | < LD | ||
| Eau de surface – traitée | 25/25 | 0,01 | 0,05 | 0,05 | ||
| Eau de surface – distribuée | 1/1 | NC | NC | 0,005 | ||
| Ontario 2018– 2021 |
Municipale | Eau souterraine – brute | 218/590 | < LD | 0,0261 | 2,6 |
| Eau souterraine – traitée | 1/64 | 0,01 | NC | < LD | ||
| Eau souterraine et de surface – distribuée | 0/6 | < LD | NC | < LD | ||
| Eau de surface – brute | 1/63 | 0,005 | NC | 0,01 | ||
| Eau de surface – traitée | 0/12 | < LD | < LD | < LD | ||
| Eau de surface – distribuée | 0/1 | NC | < LD | < LD | ||
| Québec 2010– 2014 |
Non municipale | Eau souterraine – brute | 86/948 | < LD | < LD | 8,7 |
|
||||||
Annexe C : Données des enquêtes sur l'eau potable menées par Santé Canada
C.1 Enquête nationale sur l'eau potable (2009– 2010)
| Type d'eau | Été (mg/L) | Hiver (mg/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/ échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 18/18 | 33,5 | 42,1 | 87,5 | 140 | 17/17 | 32,0 | 42,8 | 93,4 | 130 |
| Puits – eau traitée | 17/17 | 33,0 | 42,7 | 89,4 | 140 | 16/16 | 31,0 | 41,8 | 92,0 | 130 |
| Puits – distribution | 54/54 | 33,5 | 39,3 | 77,2 | 150 | 27/27 | 29,0 | 28,9 | 48,4 | 50 |
| Lac – eau brute | 21/21 | 13,0 | 17,0 | 37,0 | 41 | 20/20 | 17,5 | 20,2 | 44,7 | 55 |
| Lac – eau traitée | 21/21 | 11,0 | 16,9 | 38,0 | 42 | 20/20 | 12,5 | 20,3 | 44,0 | 53 |
| Lac – distribution | 57/57 | 10,0 | 17,6 | 39,0 | 47 | 31/31 | 11,0 | 18,9 | 42,0 | 54 |
| Rivière – eau brute | 26/26 | 33,0 | 34,6 | 61,5 | 81 | 22/22 | 45,5 | 42,8 | 77,0 | 100 |
| Rivière – eau traitée | 26/26 | 33,5 | 34,9 | 60,5 | 81 | 22/22 | 42,0 | 39,9 | 73,8 | 100 |
| Rivière – distribution | 77/77 | 33,0 | 36,3 | 66,8 | 120 | 36/36 | 44,0 | 44,1 | 63,0 | 100 |
| Limite de quantification (LDQ) = 0,2 mg/L. | ||||||||||
| Type d'eau | Été (mg/L) | Hiver (mg/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 18/18 | 9,9 | 14,0 | 32,2 | 68 | 17/17 | 14,0 | 14,6 | 25,2 | 67 |
| Puits – eau traitée | 17/17 | 9,1 | 13,6 | 24,6 | 69 | 16/16 | 12,0 | 14,6 | 27,0 | 67 |
| Puits – distribution | 54/54 | 8,8 | 14,0 | 28,0 | 76 | 27/27 | 6,7 | 9,0 | 18,4 | 22 |
| Lac – eau brute | 21/21 | 2,2 | 5,0 | 11,0 | 28 | 20/20 | 2,2 | 5,9 | 11,9 | 33 |
| Lac – eau traitée | 21/21 | 2,0 | 4,7 | 11,0 | 27 | 20/20 | 2,3 | 5,6 | 11,0 | 33 |
| Lac – distribution | 57/57 | 1,7 | 4,5 | 11,4 | 28 | 31/31 | 1,3 | 6,0 | 10,0 | 34 |
| Rivière – eau brute | 26/26 | 5,9 | 11,0 | 22,0 | 54 | 22/22 | 8,0 | 12,7 | 26,5 | 43 |
| Rivière – eau traitée | 26/26 | 5,5 | 8,3 | 18,0 | 22 | 22/22 | 8,2 | 10,0 | 19,7 | 28 |
| Rivière – distribution | 77/77 | 5,5 | 8,5 | 18,4 | 36 | 36/36 | 13,0 | 12,7 | 19,5 | 28 |
| Limite de quantification (LDQ) = 0,05 mg/L. | ||||||||||
| Type d'eau | Été (mg/L de CaCO3) | Hiver (mg/L de CaCO3) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/ échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 18/18 | 130,0 | 161,9 | 291,0 | 620 | 16/16 | 140,0 | 165,7 | 335,0 | 590 |
| Puits – eau traitée | 17/17 | 130,0 | 162,0 | 302,0 | 630 | 15/15 | 150,0 | 163,9 | 330,0 | 590 |
| Puits – distribution | 54/54 | 130,0 | 156,5 | 305,0 | 690 | 27/27 | 99,0 | 108,8 | 180,0 | 200 |
| Lac – eau brute | 21/21 | 38,0 | 64,1 | 140,0 | 220 | 20/20 | 60,0 | 74,2 | 141,0 | 270 |
| Lac – eau traitée | 21/21 | 39,0 | 62,0 | 130,0 | 210 | 20/20 | 42,5 | 74,2 | 150,0 | 270 |
| Lac – distribution | 57/57 | 38,0 | 62,7 | 132,0 | 220 | 25/25 | 40,0 | 83,9 | 216,0 | 270 |
| Rivière – eau brute | 26/26 | 115,0 | 131,9 | 255,0 | 420 | 21/21 | 160,0 | 164,5 | 340,0 | 370 |
| Rivière – eau traitée | 26/26 | 120,0 | 121,8 | 225,0 | 280 | 21/21 | 150,0 | 145,9 | 240,0 | 370 |
| Rivière – distribution | 77/77 | 120,0 | 125,9 | 248,0 | 440 | 30/30 | 150,0 | 161,8 | 250,0 | 370 |
| Limite de quantification (LDQ) = 1 mg/L. | ||||||||||
| Type d'eau | Été (mg/L) | Hiver (mg/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections*/échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 18/18 | 13,0 | 29,2 | 87,6 | 120 | 16/16 | 18,0 | 39,1 | 88,5 | 240 |
| Puits – eau traitée | 17/17 | 16,0 | 33,1 | 108,0 | 120 | 15/15 | 13,0 | 41,5 | 106,0 | 240 |
| Puits – distribution | 54/54 | 15,0 | 28,4 | 99,7 | 150 | 27/27 | 8,0 | 25,1 | 89,2 | 110 |
| Lac – eau brute | 17/21 | 9,0 | 25,8 | 34,2 | 260 | 16/20 | 9,0 | 34,4 | 54,0 | 330 |
| Lac – eau traitée | 21/21 | 12,0 | 26,8 | 36,0 | 280 | 20/20 | 11,5 | 33,3 | 45,0 | 350 |
| Lac – distribution | 57/57 | 13,0 | 28,6 | 36,4 | 290 | 24/25 | 10,0 | 61,1 | 266,6 | 360 |
| Rivière – eau brute | 24/26 | 11,5 | 18,6 | 47,5 | 80 | 20/21 | 6,0 | 19,7 | 47,9 | 110 |
| Rivière – eau traitée | 26/26 | 13,0 | 21,1 | 51,0 | 97 | 20/21 | 10,0 | 25,5 | 58,1 | 140 |
| Rivière – distribution | 77/77 | 12,0 | 22,1 | 47,4 | 220 | 28/30 | 9,0 | 31,9 | 93,1 | 140 |
| Limite de quantification (LDQ) = 1 mg/L. | ||||||||||
| Type d'eau | Été (mg/L) | Hiver (mg/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections*/échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/ échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 17/18 | 16,0 | 84,5 | 204,0 | 630 | 15/16 | 16,0 | 92,8 | 276,4 | 640 |
| Puits – eau traitée | 17/17 | 37,0 | 85,9 | 205,0 | 620 | 15/15 | 21,0 | 95,3 | 268,0 | 650 |
| Puits – distribution | 54/54 | 16,0 | 77,2 | 250,8 | 650 | 27/27 | 37,0 | 35,7 | 62,4 | 65 |
| Lac – eau brute | 16/21 | 9,0 | 14,0 | 36,5 | 49 | 16/20 | 10,0 | 16,4 | 35,0 | 75 |
| Lac – eau traitée | 18/21 | 11,5 | 16,4 | 37,0 | 50 | 17/20 | 17,0 | 21,2 | 46,6 | 73 |
| Lac – distribution | 49/57 | 12,0 | 17,9 | 39,0 | 53 | 25/25 | 23,0 | 27,4 | 60,6 | 75 |
| Rivière – eau brute | 22/26 | 21,5 | 41,6 | 85,1 | 260 | 18/21 | 34,5 | 53,5 | 118,3 | 260 |
| Rivière – eau traitée | 25/26 | 39,0 | 64,8 | 126,0 | 280 | 20/21 | 46,0 | 65,8 | 114,9 | 290 |
| Rivière – distribution | 72/77 | 46,0 | 68,3 | 120,0 | 280 | 30/30 | 52,0 | 83,0 | 163,0 | 280 |
| Limite de quantification (LDQ) = 1 mg/L. | ||||||||||
| Type d'eau | Été (mg/L) | Hiver (mg/L) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e | Max. | Nombre de détections/échantillons | Médiane | Moyenne | 90e | Max. | |
| Puits – eau brute | 18/18 | 185,5 | 372,5 | 801,6 | 1 710 | 16/16 | 211,5 | 412,6 | 914,0 | 1 710 |
| Puits – eau traitée | 17/17 | 195,0 | 387,7 | 877,0 | 1 710 | 15/15 | 216,0 | 426,7 | 962,0 | 1 690 |
| Puits – distribution | 54/54 | 190,5 | 356,8 | 868,9 | 1 720 | 27/27 | 219,0 | 301,5 | 660,2 | 833 |
| Lac – eau brute | 21/21 | 61,0 | 101,5 | 159,0 | 673 | 20/20 | 73,0 | 125,7 | 193,9 | 874 |
| Lac – eau traitée | 21/21 | 60,0 | 110,5 | 161,0 | 683 | 20/20 | 74,5 | 135,9 | 200,3 | 880 |
| Lac – distribution | 57/57 | 64,0 | 114,8 | 164,4 | 706 | 25/25 | 87,0 | 198,2 | 620,0 | 894 |
| Rivière – eau brute | 26/26 | 149,0 | 183,2 | 360,0 | 710 | 21/21 | 186,0 | 226,0 | 495,0 | 650 |
| Rivière – eau traitée | 26/26 | 161,0 | 201,7 | 352,0 | 542 | 21/21 | 225,0 | 230,5 | 375,0 | 609 |
| Rivière – distribution | 77/77 | 163,0 | 209,2 | 381,2 | 768 | 30/30 | 222,0 | 279,3 | 533,6 | 612 |
| MDT : matières dissoutes totales. Limite de quantification (LDQ) = 1 mg/L. | ||||||||||
C.2 Enquête ciblée sur l'eau potable, 2007
| Type d'eau | Calcium (mg/L), LDQ = 0,2 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 12/12 | 33,5 | 45,9 | 148,2 | 180 |
| Puits – eau traitée | 12/12 | 33,5 | 46,9 | 148,2 | 190 |
| Lac – eau brute | 5/5 | 1,9 | 18,9 | NC | 47 |
| Lac – eau traitée | 5/5 | 13 | 15,6 | NC | 31 |
| Rivière – eau brute | 2/2 | 89,5 | 89,5 | NC | 110 |
| Rivière – eau traitée | 2/2 | 92 | 92,0 | NC | 110 |
|
|||||
| Type d'eau | Magnésium (mg/L), LDQ = 0,05 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 12/12 | 15 | 23,7 | 66,8 | 79 |
| Puits – eau traitée | 12/12 | 14 | 21,7 | 64,8 | 80 |
| Lac – eau brute | 5/5 | 0,94 | 7,5 | NC | 18 |
| Lac – eau traitée | 5/5 | 0,94 | 7,5 | NC | 18 |
| Rivière – eau brute | 2/2 | 25,5 | 25,5 | NC | 28 |
| Rivière – eau traitée | 2/2 | 26 | 26,0 | NC | 28 |
|
|||||
| Type d'eau | CaCO3 (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 16/16 | 155 | 206,06 | 490 | 770 |
| Puits – eau traitée | 16/16 | 145 | 197,6 | 475 | 800 |
| Lac – eau brute | 8/8 | 7,5 | 51,9 | NC | 190 |
| Lac – eau traitée | 8/8 | 23 | 53,25 | NC | 150 |
| Rivière – eau brute | 2/2 | 330 | 330 | NC | 390 |
| Rivière – eau traitée | 2/2 | 340 | 340 | NC | 390 |
|
|||||
| Type d'eau | Chlorures dissous (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 16/16 | 72 | 70,3 | 140 | 190 |
| Puits – eau traitée | 16/16 | 85 | 80,4 | 170 | 210 |
| Lac – eau brute | 8/8 | 8,5 | 7,4 | NC | 10 |
| Lac – eau traitée | 8/8 | 10 | 10,3 | NC | 15 |
| Rivière – eau brute | 2/2 | 125 | 125,0 | NC | 150 |
| Rivière – eau traitée | 2/2 | 155 | 155,0 | NC | 190 |
|
|||||
| Type d'eau | SO4 dissous (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 16/16 | 9,5 | 90,5 | 306,5 | 484 |
| Puits – eau traitée | 16/16 | 48 | 111,1 | 307 | 456 |
| Lac – eau brute | 8/8 | 2,5 | 19,0 | NC | 73 |
| Lac – eau traitée | 8/8 | 15 | 29,9 | NC | 89 |
| Rivière – eau brute | 2/2 | 82,5 | 82,5 | NC | 90 |
| Rivière – eau traitée | 2/2 | 90,5 | 90,5 | NC | 96 |
|
|||||
| Type d'eau | MDT (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 16/16 | 662,5 | 715,5 | 1 245 | 1 550 |
| Puits – eau traitée | 16/16 | 748,5 | 725,8 | 1 235 | 1 540 |
| Lac – eau brute | 8/8 | 22 | 80,6 | NC | 279 |
| Lac – eau traitée | 8/8 | 50,5 | 92,3 | NC | 245 |
| Rivière – eau brute | 2/2 | 558,5 | 558,5 | NC | 644 |
| Rivière – eau traitée | 2/2 | 597,5 | 597,5 | NC | 695 |
|
|||||
C.3 Enquête ciblée sur l'eau potable, 2012– 2013
| Type d'eau | Calcium (mg/L), LDQ = 0,2 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 19/19 | 13,0 | 31,6 | 92,2 | 140,0 |
| Puits – eau traitée | 19/19 | 6,8 | 24,4 | 93,0 | 99,0 |
| Puits – distribution | 14/14 | 12,0 | 30,2 | 89,8 | 96,0 |
| Lac – eau brute | 1/1 | 52 | 52 | 52 | 52 |
| Lac – eau traitée | 1/1 | 50 | NC | NC | 50 |
| Lac – distribution | 1/1 | 52 | NC | NC | 52 |
| Rivière – eau brute | 6/6 | 85,0 | 84,3 | NC | 91,0 |
| Rivière – eau traitée | 6/6 | 80 | 80,5 | NC | 90 |
| Rivière – distribution | 6/6 | 78 | 76,8 | NC | 91 |
|
|||||
| Type d'eau | Magnésium (mg/L), LDQ = 0,05 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 19/19 | 2,5 | 9,6 | 17,4 | 73 |
| Puits – eau traitée | 19/19 | 2 | 5,7 | 16,4 | 24 |
| Puits – distribution | 14/14 | 3,3 | 7,4 | 18,9 | 23 |
| Lac – eau brute | 1/1 | 8,6 | NC | NC | 8,6 |
| Lac – eau traitée | 1/1 | 8,5 | NC | NC | 8,5 |
| Lac – distribution | 1/1 | 9 | NC | NC | 9 |
| Rivière – eau brute | 6/6 | 20,5 | 19,5 | NC | 24 |
| Rivière – eau traitée | 6/6 | 20,5 | 19,7 | NC | 24 |
| Rivière – distribution | 6/6 | 19,5 | 19,3 | NC | 24 |
|
|||||
| Type d'eau | CaCO3 (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 19/19 | 42 | 118,4 | 306 | 650 |
| Puits – eau traitée | 19/19 | 22 | 84,5 | 304 | 340 |
| Puits – distribution | 14/14 | 41,5 | 105,5 | 305 | 330 |
| Lac – eau brute | 1/1 | 160 | 160 | NC | 160 |
| Lac – eau traitée | 1/1 | 160 | NC | NC | 160 |
| Lac – distribution | 1/1 | 170 | NC | NC | 170 |
| Rivière – eau brute | 6/6 | 290 | 290 | NC | 300 |
| Rivière – eau traitée | 6/6 | 290 | 283,3 | NC | 300 |
| Rivière – distribution | 6/6 | 290 | 273,3 | NC | 300 |
|
|||||
| Type d'eau | Chlorures dissous (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 19/19 | 66 | 70,3 | 152 | 170 |
| Puits – eau traitée | 19/19 | 76 | 82,1 | 162 | 180 |
| Puits – distribution | 14/14 | 77 | 87,8 | 155 | 170 |
| Lac – eau brute | 1/1 | 55 | NC | NC | 55 |
| Lac – eau traitée | 1/1 | 56 | NC | NC | 56 |
| Lac – distribution | 1/1 | 59 | NC | NC | 59 |
| Rivière – eau brute | 6/6 | 86,5 | 67,7 | NC | 100 |
| Rivière – eau traitée | 6/6 | 94,5 | 78,0 | NC | 120 |
| Rivière – distribution | 6/6 | 93,5 | 73,8 | NC | 110 |
|
|||||
| Type d'eau | Sulfates dissous (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/ échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 16/19 | 275 | 399,5 | 910 | 920 |
| Puits – eau traitée | 17/19 | 360 | 400,6 | 900 | 920 |
| Puits – distribution | 13/14 | 370 | 405,8 | 868 | 920 |
| Lac – eau brute | 1/1 | 21 | NC | NC | 21 |
| Lac – eau traitée | 1/1 | 20 | NC | NC | 20 |
| Lac – distribution | 1/1 | 21 | NC | NC | 21 |
| Rivière – eau brute | 6/6 | 56 | 57,5 | NC | 71 |
| Rivière – eau traitée | 6/6 | 55,5 | 58 | NC | 73 |
| Rivière – distribution | 6/6 | 58 | 57 | NC | 72 |
|
|||||
| Type d'eau | MDT (mg/L), LDQ = 1 mg/L | ||||
|---|---|---|---|---|---|
| Nombre de détections/échantillons | Médiane | Moyenne | 90e centile | Max. | |
| Puits – eau brute | 19/19 | 1 090 | 1 132,5 | 1 852 | 2 060 |
| Puits – eau traitée | 19/19 | 1 080 | 1 212,6 | 1 868 | 2 050 |
| Puits – distribution | 14/14 | 1 285 | 1 243,7 | 1 858 | 1 910 |
| Lac – eau brute | 1/1 | 260 | NC | NC | 260 |
| Lac – eau traitée | 1/1 | 250 | NC | NC | 250 |
| Lac – distribution | 1/1 | 260 | NC | NC | 260 |
| Rivière – eau brute | 6/6 | 446 | 409,5 | NC | 451 |
| Rivière – eau traitée | 6/6 | 449 | 411,5 | NC | 470 |
| Rivière – distribution | 6/6 | 424 | 394,5 | NC | 470 |
|
|||||
Annexe D : Résumé de l'élimination de la dureté totale selon les différentes technologies à l'échelle résidentielle
| Moyenne | Médiane | Min. | Max. | Pourcentage d'échantillons au-dessus de la valeur | Centile | |||
|---|---|---|---|---|---|---|---|---|
| 120 mg/L | 180 mg/L | 75e | 95e | |||||
| Dispositifs de traitement de l'eau, total (n = 96) | ||||||||
Influent (g/L) |
136 356 | 112 581 | 156 | 419 661 | 44,8 % | 24,0 % | 175 631 | 369 694 |
| Eau traitée (mg/L) | 49 549 | 3 632 | 44 | 376 034 | 17,7 % | 7,3 % | 72 369 | 204 207 |
| % de réduction | 67 % | 95 % | -111 % | 99,97 % | S.O. | S.O. | 99,58 % | 100 % |
| Échange d'ions (n = 54) | ||||||||
| Influent (µg/L) | 155 740 | 115 706 | 469 | 419 661 | 48,1 % | 27,8 % | 237 422,8 | 385 947 |
| Eau traitée (µg/L) | 29 507 | 1 886 | 83 | 326 359 | 7,4 % | 3,7 % | 39 467,25 | 179 062 |
| % de réduction | 81 % | 99 % | -111 % | 99,9 % | S.O. | S.O. | 99,8 % | 100 % |
| Charbon activé (n = 18) | ||||||||
| Influent (µg/L) | 115 749 | 103 011 | 156 | 279 420 | 44,4 % | 22,2 % | 156 814 | S.O. |
| Eau traitée (µg/L) | 108 350 | 100 743 | 83 | 292 259 | 50 % | 16,7 % | 153 558 | S.O. |
| % de réduction | 19 % | 8 % | -8 % | 90,6 % | S.O. | S.O. | 31 % | S.O. |
| Osmose inverse (n = 9) | ||||||||
| Influent (µg/L) | 30 865 | 2 803 | 269 | 138 639 | 22,2 % | 0 % | 65 002 | S.O. |
| Eau traitée (µg/L) | 880 | 287 | 44 | 5 144 | 0 % | 0 % | 760 | S.O. |
| % de réduction | 66 % | 72 % | 21,4 % | 99,97 % | S.O. | S.O. | 95 % | S.O. |
| Sables verts (n = 3) | ||||||||
| Influent (µg/L) | 107 478 | 73 769 | 67 743 | 180 921 | 33 % | 33 % | 180 921 | S.O. |
| Eau traitée (µg/L) | 113 275 | 73 694 | 71 146 | 194 985 | 33 % | 33 % | 194 985 | S.O. |
| % de réduction | S.O. | S.O. | -7,8 % | 0,1 % | S.O. | S.O. | S.O. | S.O. |
| Microfiltre en céramique (n = 1) | ||||||||
| Influent (µg/L) | 104 048 |
S.O. | S.O. | S.O. | 0 % | 0 % | S.O. | S.O. |
| Eau traitée (µg/L) | 101 113 | S.O. | S.O. | S.O. | 0 % | 0 % | S.O. | S.O. |
| % de réduction | 2,82 % | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
| Filtre à sédiments (n = 1) | ||||||||
| Influent (µg/L) | 173 939 | S.O. | S.O. | S.O. | 100 % | 0 % | S.O. | S.O. |
| Eau traitée (µg/L) | 173 947 | S.O. | S.O. | S.O. | 100 % | 0 % | S.O. | S.O. |
| % de réduction | 0 | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. | S.O. |
| Combinaisons (n = 10) | ||||||||
| Influent (µg/L) | 171 856 | 131 206 | 40 475 | 369 333 | 50 % | 30 % | 325 567 | S.O. |
| Eau traitée (µg/L) | 59 027 | 2 569 | 119 | 376 034 | 20 % | 10 % | 62 554 | S.O. |
| % de réduction | 87 % | 99 % | -1,8 % | 99,9 % | S.O. | S.O. | 100 % | S.O. |
|
||||||||
Annexe E : Apport en sodium résultant de l'utilisation d'un adoucisseur d'eau, par degré de dureté
Certains types d'adoucisseurs d'eau peuvent ajouter du sodium à l'eau au cours du processus d'adoucissement. La contribution dans l'eau du sodium provenant d'un adoucisseur d'eau varie en fonction du degré de dureté de l'eau. Lorsque la dureté est élevée, la quantité de sodium ajoutée à l'eau est elle aussi élevée. Le tableau ci-dessous montre qu'un adoucisseur d'eau utilisant du chlorure de sodium peut augmenter de manière significative l'apport en sodium en comparaison avec l'apport en sodium habituel provenant de l'eau potable chez les adultes canadiens.
| Dureté de l'eau potable (mg/L de CaCO3) |
Dureté (grain par gallonNote de bas de page a) |
Sodium ajouté (mg/L) |
|---|---|---|
| 100 (acceptable)Note de bas de page b | 5,8 | 46 |
| 200 (mauvaise) | 11,7 | 92 |
| 500 (inacceptable) | 29,2 | 230 |
|
||
Lorsqu'on utilise un adoucisseur d'eau, il est recommandé de ne pas adoucir une partie de l'eau qui sert le plus souvent à la consommation (c.-à-d. l'eau du robinet de la cuisine). En règle générale, les enfants de moins de 8 ans ne devraient pas boire d'eau contenant du sodium provenant d'un adoucisseur d'eau, car leur apport en sodium pourrait dépasser la limite supérieure recommandée (1,5 à 1,9 mg par jour) (IOM, 2005). Si vous ou un membre de votre famille suivez un régime alimentaire à faible teneur en sodium, il est recommandé de consulter votre médecin.
Détails de la page
- Date de modification :
