Façonner l’avenir : guide de discussion pour la phase 2 des consultations du CEPMB sur les nouvelles lignes directrices
Guide de discussion
Guide de discussion
Table des matières
- Glossaire
- 1. Observations préliminaires
- 2. Au sujet du CEPMB
- 3. Consultation sur les Lignes directrices
- 4. Perspectives importantes: Aborder des thèmes essentiels qui vont au-delà de l'autorité décisionnelle du CEPMB
- 5. Aperçu du cadre proposé
- 6. Sujets de discussion
- 7. Prochaines étapes
- 8. Études de cas : Critères décisionnels pour entreprendre des examens approfondis
Glossaire
Ces définitions sont fournies à titre indicatif seulement; elles n’ont aucune valeur juridique et doivent être lues conjointement avec les dispositions législatives en vigueur.
Médicaments brevetés : Médicaments faisant l’objet d’au moins un brevet pour une invention liée au médicament au sens du paragraphe 79(2) de la Loi sur les brevets. Une invention est liée à un médicament si elle est destinée à des médicaments ou à la préparation ou la production de médicaments, ou susceptible d’être utilisée à de telles fins
Médicament existantNote de bas de page 1: Médicament breveté avec un prix moyen maximal potentiel (PMMP) ou un prix moyen non excessif (PMNE) projeté en date du 1er juillet 2022.
Nouveau médicamentNote de bas de page 2: Médicament breveté sans PMMP ou PMNE projeté en date du 1er juillet 2022.
Brevet : Instrument émis par le Commissaire aux brevets sous forme de lettres patentes pour une invention.
CEPMB7 : France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis.
CEPMB11 : Australie, Belgique, France, Allemagne, Italie, Japon, Pays-Bas, Norvège, Espagne, Suède et Royaume-Uni.
Personnel du CEPMB (le « personnel ») : Les fonctionnaires chargés de l’exécution des tâches quotidiennes du CEPMB.
Titulaire de droits : Au sens du paragraphe 79(1) de la Loi sur les brevets, « le titulaire d’un brevet et la personne ayant pour le moment droit à l’avantage d’un certificat de protection supplémentaire délivré à l’égard du brevet, ainsi que quiconque peut exercer tout droit d’un titulaire relativement à ce certificat ».
Engagement volontaire (EV) : Engagement écrit d’un titulaire de droits de rajuster son prix et/ou de payer une somme d’argent au receveur général. Un EV représente une promesse faite par un titulaire de droits au Conseil d’examen du prix des médicaments brevetés. Un EV peut aboutir à une recommandation de clôture d’un examen approfondi. Les EV n’ont pas valeur de précédent.
1. Observations préliminaires
En 2019, le gouvernement a proposé de modifier le Règlement sur les médicaments brevetés afin d’introduire de nouveaux facteurs d’examen des prix (valeur pharmacoéconomique, taille du marché et PIB) que le CEPMB devrait prendre en compte lors de la surveillance de la pratique de prix excessifs. Il a modifié l’annexe des pays de comparaison pour lesquels les titulaires de droits doivent fournir des renseignements sur les prix au CEPMB et a également exigé des titulaires de droits qu’ils présentent des renseignements sur tous les rajustements de prix (en valeurs nettes), y compris les rabais consentis dans le cadre d’ententes d’inscription de produits.
Les modifications proposées ont été contestées devant les tribunaux provinciaux et fédéraux, ce qui a donné lieu à une nouvelle jurisprudence résultant de deux procédures judiciaires - Merck Canada inc. c. Procureur général du CanadaNote de bas de page 3 et Médicaments Novateurs Canada c. Canada (Procureur général)Note de bas de page 4 – portant sur la portée du mandat du CEPMB et des pouvoirs qui lui sont conférés. Par la suite, et compte tenu de l’évolution du domaine pharmaceutique et de la décision prise dans l’affaire Merck, où les nouveaux facteurs d’examen des prix ont été jugés anticonstitutionnelsNote de bas de page 5, le gouverneur en conseil, sur recommandation du ministre de la Santé, a décidé de ne pas procéder aux modifications relatives aux nouveaux facteurs d’examen des prix et aux exigences en matière de fourniture de renseignements sur les prix nets. Le gouvernement a plutôt décidé de ne mettre en œuvre que l’annexe actualisée de onze pays (« CEPMB11 ») et de réduire les exigences en matière de fourniture de renseignements pour les médicaments considérés comme posant un risque moindre de se vendre à des prix excessifs, ce qui a été confirmé comme étant à la fois constitutionnel et conforme à la Loi sur les brevets dans les instances judiciaires. Ces mesures sont entrées en vigueur le 1er juillet 2022.
Contrairement à l’annexe des pays de comparaison qui était en place depuis près de trois décennies (« CEPMB7 »), le CEPMB11 procure un panier de prix plus homogène qui exclut les États-Unis, dont les prix étaient les plus élevés au monde (jusqu’à 3,5 fois plus élevés que les prix au CanadaNote de bas de page 6).
Il est désormais nécessaire de modifier les Lignes directrices du CEPMB pour tenir compte de la nouvelle réalité législative et jurisprudentielle et pour donner suite à l’engagement du Conseil de moderniser et de simplifier son cadre administratif. Comme toujours, le Conseil attend avec impatience les commentaires des intervenants pour passer à l’étape suivante de ce processus de consultation.2. Au sujet du CEPMB
2.1 Aperçu du CEPMB
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) a été créé en 1987 à la suite d’une série de réformes importantes de la Loi sur les brevets (la « Loi ») visant à renforcer la protection des brevets des médicaments au CanadaNote de bas de page 7.
Le CEPMB est un organisme quasi judiciaire indépendant ayant un double mandat d’examen des prix et de production de rapports. Dans le cadre de son mandat d’examen des prix, il s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs. Pour ce faire, il examine les prix auxquels les titulaires de droits vendent les médicaments brevetés sur les marchés canadiens. Si un prix est jugé excessif lors d'une audience publique, le Conseil peut ordonner une réduction du prix et/ou la redistribution des recettes excédentaires.
Le mandat et la compétence du CEPMB sont établis en vertu des articles 79 à 103 de la Loi, et ces articles relèvent de la responsabilité du ministre de la Santé. La Loi définit les facteurs dont le CEPMB (le « Conseil ») doit tenir compte pour déterminer si le prix d’un médicament breveté est excessif. Elle confère au CEPMB le pouvoir de recueillir des renseignements auprès des titulaires de droits et définit les mesures correctives que le Conseil peut prendre pour remédier à la pratique de prix excessifs.
La Loi ne définit pas ce qu’est un prix « excessif » et demande plutôt au CEPMB de tenir compte des facteurs suivants précisés au paragraphe 85(1) de la Loi:
- le prix de vente du médicament sur un tel marché;
- le prix de vente de médicaments de la même catégorie thérapeutique sur un tel marché;
- le prix de vente du médicament et d’autres médicaments de la même catégorie thérapeutique à l’étranger;
- les variations de l’indice des prix à la consommation;
- tous les autres facteurs précisés par les règlements d’application du présent paragraphe.
Le Règlement sur les médicaments brevetés (le « Règlement ») définit les renseignements que les titulaires de droits doivent présenter au CEPMB et les délais dans lesquels ils doivent être fournis. Il s’agit de renseignements de base tels que les renseignements sur l’identité du médicament et les renseignements relatifs au prix et aux ventes du médicament.
De nombreux concepts fondamentaux de la Loi et du Règlement ont été approfondis dans les Lignes directrices du CEPMB. Le CEPMB est habilité à formuler des lignes directrices non contraignantes après consultation des intervenants pertinents.
2.2 Rôle des Lignes directrices
La Loi précise que le Conseil ne peut se prononcer sur le caractère excessif du prix d’un médicament breveté qu’à l’issue d’une audience. Toutefois, le Conseil n’a pas la capacité de tenir des audiences pour chaque médicament breveté relevant de sa compétence. Par conséquent, le Conseil a besoin d’un mécanisme pour réduire le nombre de cas où les prix des médicaments font l’objet d’une audience.
En vertu du paragraphe 96(4) de la Loi sur les brevets, le CEPMB peut publier des lignes directrices non contraignantes (les « Lignes directrices ») sur des questions relevant de sa compétence. Le Conseil souhaite que ces Lignes directrices atteignent deux objectifs principaux : a) améliorer l’efficience administrative du Conseil et b) assurer la transparence et la prévisibilité pour les titulaires de droits en ce qui concerne le processus généralement suivi par le personnel du CEPMB (le « personnel ») pour repérer les médicaments brevetés posant un risque plus élevé de se vendre à des prix excessifs en vue d’un examen approfondi ou d’une éventuelle audience. Étant donné que la Loi stipule que le Conseil ne doit tenir compte des facteurs énoncés au paragraphe 85(2) que s’il n’est pas en mesure de déterminer si le médicament est vendu ou a été vendu à un prix excessif après avoir tenu compte des facteurs énoncés au paragraphe 85(1), ces Lignes directrices ne visent que les facteurs énoncés au paragraphe 85(1) et n’envisagent pas des considérations qui ne pourraient être soulevées qu’en vertu du paragraphe 85(2).
Les Lignes directrices ne présument ni ne déterminent si un prix donné est excessif. Seul le Conseil, siégeant en tribunal, peut statuer sur le caractère excessif d’un prix, à l’issue d’une audience. Le rôle des Lignes directrices et, par extension, du personnel qui s’y réfère, n’est pas d’« approuver » ou de « fixer » les prix des médicaments brevetés. Le rôle du personnel est d’« examiner » le prix courant fixé par le titulaire des droits pour chaque médicament breveté. Durant cette phase, le prix est « à l’étude ». Le personnel peut soit recommander au président de clore l’examen (le statut serait alors « examiné »), soit lui recommander la tenue d’une audience (maintien du statut « à l’étude »).
Bien que les Lignes directrices ne soient pas contraignantes, le Conseil estime que des lignes directrices transparentes, prévisibles et équitables au regard de la loi constituent un moyen efficace pour les titulaires de droits de gérer les risques. Par le passé, plus de 99 % des examens effectués par le personnel ont été résolus dans le cadre des Lignes directrices, sans qu’il soit nécessaire de tenir une audienceNote de bas de page 8. Ainsi, il est clair que les Lignes directrices sont un instrument important pour les intervenants et qu’elles peuvent être un outil efficace pour remplir le mandat législatif du CEPMB.
3. Consultation sur les Lignes directrices
Le CEPMB travaille actuellement sur la mise à jour de ses Lignes directrices afin de tenir compte des modifications apportées au Règlement sur les médicaments brevetés (DORS/94-688), entré en vigueur le 1er juillet 2022, ainsi que de la jurisprudence récente, et sur une gestion optimale de ses ressources. Les modifications réglementaires ont donné lieu à une annexe actualisée de onze pays de comparaison (« CEPMB11 »)Note de bas de page 9 et à une réduction des exigences en matière de fourniture de renseignements pour les médicaments considérés comme posant un risque moindre de se vendre à des prix excessifs.
Le Conseil a mis en place un processus de consultation sur les Lignes directrices en trois phases, lequel a débuté en septembre 2023.
| Les phases de la consultation | Activité |
|---|---|
Phase 1 |
Document d’orientation et table ronde sur les politiques |
Phase 2 |
Guide de discussion |
Phase 3 |
Lignes directrices provisoires |
Au cours de la première phase du processus de consultation, le CEPMB a publié un document d’orientation comportant six sujets clés conçus pour favoriser une discussion productive entre les intervenants et le CEPMB. En décembre 2023, le CEPMB a organisé une table ronde de deux jours sur les politiques pour inviter les intervenants à faire part de leurs commentaires en personne. La rétroaction écrite peut être lue sur le site Web du CEPMB, et un résumé de la rétroaction en personne peut être examiné dans le Rapport « Ce que nous avons appris ».
Le Conseil estime que la première phase de consultation a été une réussite, car elle a permis de nouer un dialogue fructueux avec des intervenants issus de nombreux milieux de la société canadienne, et a contribué au recensement et à l’évaluation des enjeux et des préoccupations.
Le CEPMB lance aujourd’hui une deuxième phase de consultation sur ses nouvelles lignes directrices avec la publication du présent Guide de discussion, qui permet de poursuivre des consultations approfondies, ciblées et productives. Les intervenants auront un aperçu du point de vue du Conseil sur les enjeux qu’il doit prendre en compte dans l’élaboration des prochaines lignes directrices. Le Guide de discussion propose un cadre qui indique une direction pour certains de ces enjeux et offre un éventail d’options pour d’autres.
Le CEPMB invite les intervenants à lui faire part de leurs commentaires sur les sujets abordés dans ce Guide de discussion, par écrit, avant la date limite du 11 septembre 2024.
Le Conseil a l’intention de publier de nouvelles lignes directrices provisoires d’ici la fin de l’année 2024, après avoir pris en compte les commentaires reçus lors des deux phases précédentes. Ces lignes directrices feront l’objet d’une période d’avis et de consultation avant leur finalisation et leur mise en œuvre, prévue pour 2025, à moins qu’une nouvelle consultation sur une version modifiée ne soit nécessaire.
4. Perspectives importantes: Aborder des thèmes essentiels qui vont au-delà de l'autorité décisionnelle du CEPMB
Au cours des consultations qu’il a menées jusqu’à présent, le Conseil s’est entretenu avec un large éventail d’intervenants sur des sujets liés à l’industrie pharmaceutique canadienne et, plus largement, à l’écosystème canadien des sciences de la vie, qui comprend les patients et leurs représentants, les prestataires de soins de santé, les chaînes d’approvisionnement des pharmacies, les payeurs (publics/privés), les innovateurs, les spécialistes des essais cliniques et les organismes de réglementation gouvernementaux. Le Conseil a apprécié ces discussions et les informations fournies par le biais de soumissions écrites et de présentations lors de tables rondes.
Bien que ces sujets soient de grand intérêt, le Conseil tient à préciser qu’un certain nombre d‘entre eux ne relèvent pas du pouvoir décisionnel du CEPMB conféré par la loi. Le Conseil est d’avis que l’inclusion de questions qui ne relèvent pas directement de sa compétence limiterait sa capacité à élaborer des lignes directrices transparentes, prévisibles et équitables au regard de la loi.
À titre d’exemple, plusieurs intervenants ont demandé que le CEPMB adopte une approche « pangouvernementale » des politiques gouvernementales actuelles, comme l’initiative en matière de biofabrication et de sciences de la vie, la stratégie pour soutenir l’accès aux médicaments pour les maladies rares et le Régime national d’assurance médicaments. La réponse du Conseil est que, bien qu’il soit important que les membres du Conseil et le personnel soient au courant de ces initiatives, aucune disposition au paragraphe 85(1) de la Loi sur les brevets ne permet de tenir compte légalement de ces initiatives dans les Lignes directrices.
Le Conseil est un tribunal quasi judiciaire établi par une loi qui n’est habilité qu’à empêcher la vente de médicaments brevetés à des prix excessifs. Le Conseil considère qu’il doit s’en tenir strictement au mandat qui lui a été confié.
Ainsi, même si de nombreuses questions et préoccupations soulevées lors de la phase 1 de notre processus de consultation ne peuvent pas être et ne seront pas directement abordées dans nos prochaines Lignes directrices, elles n’en demeurent pas moins des sujets d’intérêt. Certains de ces sujetsqui ne relèvent pas du pouvoir décisionnel du Conseil sont présentés ci-dessous.
Titulaires de droits, industrie et consultants de l’industrie |
Récompenser l’innovation
|
|---|---|
| Pharmacies, associations de pharmacies et distributeurs | Chaîne d’approvisionnement
|
| Payeurs privés | Redistribution des recettes excédentaires
|
| Groupes représentant les patients | Accès aux médicaments
|
Perspectives des patients
|
|
Pharmacoéconomie et rentabilité
|
5. Aperçu du cadre proposé
Le schéma ci-dessous donne une vue d’ensemble de la manière dont les questions clés s’inscrivent dans le processus d’examen des prix proposé par le CEPMB et de la place qu’elles occupent.

Figure - Version texte
Ce diagramme illustre le processus d’examen des prix proposé par le CEPMB pour les médicaments brevetés. Il est divisé en plusieurs sections pour mettre en évidence les différentes étapes du processus.
Le cadre proposé est décrit ci-dessous :
- Dépôt des titulaires de droits auprès du CEPMB
- Section A – Examen initial des prix
- Le CEPMB utilisera la première période de dépôt d’un médicament (premier dépôt semestriel) pour effectuer un examen initial des prix, avec les critères de sélection fondés sur la comparaison des prix internationaux (CPINT).
- Section B – Examen annuel des prix
- Le CEPMB effectuera un examen annuel des prix de tous les médicaments brevetés relevant de sa compétence, avec les critères de sélection fondés sur la CPI et les variations de l’indice des prix à la consommation (IPC).
- Les mêmes critères de sélection de la comparaison des prix internationaux (CPINT) établis dans l’examen initial seront utilisés dans l’examen annuel.
- Tous les médicaments (« existants » et « nouveaux ») seront assujettis aux mêmes critères de sélection.
- Section C – Dispositions particulières
- Les plaintes serviront de processus distinct permettant de sélectionner les médicaments aux fins d’un examen approfondi. Des dispositions particulières pour certains marchés de produits thérapeutiques sont également envisagées.
- Évaluation des critères de sélection
- Les médicaments brevetés qui ne répondent à aucun critère de sélection dans l’examen initial ou l’examen annuel des prix seraient considérés comme étant à l’étude à ce moment-là, et aucune autre mesure ne sera prise par le personnel tant que le prix du médicament n’aura pas été examiné de nouveau l’année suivante ou qu’une plainte n’aura pas été reçue.
- Les médicaments qui répondent aux critères de sélection feront l’objet d’un examen approfondi (Section D : Examen approfondi).
- Section D : Examen approfondi
- Tous les facteurs énoncés au paragraphe 85(1) seront pris en compte.
- L’examen approfondi permettra d’évaluer la comparaison selon la catégorie thérapeutique des prix nationaux (CCTn), la comparaison des prix internationaux (CPINT), la comparaison selon la catégorie thérapeutique des prix internationaux (CCTi), ainsi que les variations de l’indice des prix à la consommation (IPC).
- Les résultats de l’examen approfondi peuvent déboucher sur une recommandation à l’intention du président de clore l’examen (avec ou sans engagement) ou de procéder à l’émission d’un avis d’audience.
La structure de base du processus d’examen des prix envisagé par le Conseil peut être décrite en quatre parties principales (« Sections ») : Section A : Examen initial des prix; Section B : Examen annuel des prix; Section C : Dispositions particulières; et Section D : Examen approfondi.
Section A : Examen initial des prix : Décrit le processus et les critères de sélection que le personnel utilisera pour repérer les médicaments brevetés posant un risque plus élevé d‘être vendus à des prix excessifs en vue d’un examen approfondi. Selon le cadre proposé, le CEPMB fera ce qui suit :
Sur cette base, les prix courants posant un faible risque de prix excessifs feront l’objet d’un examen initial par le Conseil dans un délai de 60 jours et ne nécessiteront pas d’autre examen jusqu’à l’examen annuel (Section B) ou à la réception d’une plainte (Section C). |
Section B : Examen annuel des prix : Décrit la surveillance continue des médicaments pour lesquels un examen initial des prix a déjà été effectué. Selon le cadre proposé, le CEPMB fera ce qui suit :
Les médicaments brevetés qui ne répondent à aucun critère de sélection lors de l'examen initial ou l’examen annuel des prix seront considérés comme ayant été examinés à ce moment-là et aucune mesure supplémentaire ne sera prise par le personnel jusqu’à ce que le médicament fasse l’objet d’un nouvel examen l’année suivante ou qu’il fasse l’objet d’une plainte. |
Section C : Dispositions particulières – Rôle des plaintes : Décrit le rôle des plaintes en tant que processus distinct permettant de recenser les médicaments devant faire l’objet d’un examen approfondi. Selon le cadre proposé, le CEPMB fera ce qui suit :
|
Section D : Examen approfondi : Un processus analytique mené par le personnel qui prend en compte tous les facteurs énoncés au paragraphe 85(1). À la fin du processus, le personnel recommandera au président de clore l’examen approfondi ou d’émettre un avis d’audience. Le président décidera alors s’il y a lieu de tenir une audience ou de clore l’examen approfondi sans tenir d’audience. Selon le cadre proposé, le CEPMB fera ce qui suit :
Bien que les critères d’examen approfondi soient comparés au prix courant du médicament, le Conseil continuera d’utiliser les renseignements fournis par le titulaire des droits sur le prix de vente moyen par emballage et/ou les recettes nettes, lorsque le président examine un montant de recettes excédentaires potentielles dans le cadre d’un engagement volontaire pris par le titulaire de droits. |
5.1 Section A : Examen initial des prix des médicaments brevetés
Dès qu’un médicament breveté est vendu au Canada, il est assujetti à la compétence du CEPMB en matière d’examen des prix. En vertu du paragraphe 4(2) du Règlement, les titulaires de droits sont tenus de fournir au CEPMB des renseignements sur les prix et les ventes dans les 30 jours suivant la date de la première vente du médicament au Canada et, par la suite, tous les six mois. Selon le cadre proposé, le CEPMB utilisera la première période de dépôt d’un médicament (premier dépôt semestriel) pour effectuer un examen initial fondé sur la comparaison des prix internationaux (CPINT) (en vertu de l’alinéa 85(1)(c) de la Loi). L’examen permettra de comparer le prix courant d’un médicament au Canada avec le prix courant dans les pays de comparaison du CEPMB11, dans le but de recenser les médicaments qui pourraient nécessiter un examen plus approfondi.
L’utilisation du prix de référence obtenu par la CPINT comme critère de sélection est un point de départ logique pour recenser efficacement les cas susceptibles de nécessiter un examen plus approfondi. Son utilisation présente de nombreux avantages :
- Le premier est que la CPINT est basée sur les renseignements fournis par les titulaires de droits dans leurs dépôts auprès du CEPMB et que ces renseignements sont donc connus par eux à l’avance.
- En outre, il est entendu que les prix internationaux des médicaments peuvent déjà refléter, dans une certaine mesure, la disponibilité de médicaments de comparaison sur ces marchés.
- La CPINT est donc transparente et prévisible pour les titulaires de droits et constitue le premier type d’examen des prix que le CEPMB peut effectuer, étant donné que cette comparaison ne s’appuie pas sur des examens scientifiques ou les prix publics d’autres médicaments.
Contrairement aux Lignes directrices précédentes, le Conseil a décidé de réserver l’utilisation de la comparaison selon la catégorie thérapeutique des prix nationaux (CCTn) (selon l’alinéa 85(1)(b) de la Loi) et la comparaison selon la catégorie thérapeutique des prix internationaux (CCTi) (selon l’alinéa 85(1)(c) de la Loi) (collectivement, la « CCT ») seulement dans le cadre d’un examen approfondi. Cette approche est conforme à l’objectif du CEPMB de parvenir à un équilibre entre le recensement des cas de prix excessifs potentiels et la gestion de ses ressources.
Le Conseil reconnaît que l’application et la pertinence de la CCT peuvent varier en fonction des circonstances propres à chaque médicament, notamment de son indication principale et des éléments de comparaison disponibles au moment de l’évaluation. Contrairement à la CPINT, la CCT ne permet pas une comparaison directe des prix avec le même médicament. Par conséquent, l’avis du Conseil est que dans le cadre d’un examen approfondi, le personnel devrait tenir compte de la CCT en combinaison avec d’autres facteurs, comme la CPINT et l’IPC.
5.2 Section B : Examen annuel des prix des médicaments brevetés
Conformément à la Loi sur les brevets, le mandat du CEPMB ne se limite pas à un examen initial des prix au moment du lancement du médicament, mais englobe également une surveillance continue des prix pendant toute la durée de vie du brevet pour veiller à ce qu’ils ne deviennent pas excessifs à tous les stades du cycle de vie du brevet du médicament. Ceci est rendu possible par les exigences en matière de fourniture de renseignements stipulées par le Règlement, qui demandent aux titulaires de droits de fournir des renseignements sur les prix deux fois par an.
Selon le cadre proposé, le CEPMB procédera à un examen annuel des prix de tous les médicaments brevetés relevant de sa compétence.
- Pour plus de clarté, il n’y aura aucune distinction entre les « nouveaux médicaments »Note de bas de page 14 et les « médicaments existants »Note de bas de page 15 en ce qui concerne le processus d’examen des prix. La seule différence avec les médicaments existants est que pour ceux qui dépassent la valeur des critères de sélection de la CPINT choisis par le Conseil, les titulaires de droits disposeront d’un certain délai pour s’adapter aux Lignes directrices après leur mise en œuvre, avant qu’une évaluation fondée sur la CPINT ne soit entreprise, ce qui pourrait donner lieu à un examen approfondi.
- Ce contrôle annuel appliquera les mêmes critères de sélection établis à des fins de CPINT que ceux utilisés lors de l’examen initial et cela pour tous les examens annuels subséquents.
- Si une CPINT ne peut être réalisée en raison de l’absence de prix communiqués par les pays du CEPMB11 (p. ex. le Canada est le premier des 11 pays de comparaison à commercialiser le médicament), elle ne donnera pas lieu à un examen approfondi.
- En outre, le personnel comparera les variations de prix des médicaments aux variations de l’IPC en tant que critère de sélection pour repérer les médicaments justifiant un examen approfondi.
L’utilisation de la CPINT et de l’IPC comme critères de sélection continue d’offrir aux titulaires de droits le même degré de transparence et de prévisibilité que lors de l’examen initial, étant donné que ces critères sont basés sur des informations accessibles au public (c.-à-d. l’IPC) ou sont directement sous le contrôle des titulaires de droits (c.-à-d. la CPINT). Le Conseil estime que ce processus assure un équilibre approprié qui permet une surveillance continue sans créer un fardeau administratif excessif, tout en maintenant la prévisibilité pour les titulaires de droits.
5.3 Section C : Dispositions particulières
5.3.1 Rôle des plaintes
Dans le cadre des anciennes lignes directrices, un examen complet (utilisant à la fois les comparaisons des prix internationaux et la catégorie thérapeutique) était effectué pour tous les médicaments, qu’une plainte ait été déposée ou non. Par conséquent, la réception d’une plainte n’avait pas d’incidence significative sur le type ou le niveau d’examen effectué (les « tests » appliqués aux prix).
Selon l’approche proposée, tous les médicaments feraient l’objet d’un examen initial (sur la base des prix internationaux uniquement), et seuls les médicaments passant à l’étape de l’examen approfondi feraient l’objet d’un examen complet (sur la base des prix internationaux, de l’IPC et de comparaisons selon la catégorie thérapeutique). Le Conseil envisage d’utiliser la réception d’une plainte relative à un prix comme un moyen additionnel pour procéder à un examen approfondi.
Selon le cadre proposé, les personnes ou groupes autorisés (voir le Sujet 4 ci-dessous), qui estiment que le prix d’un médicament breveté est excessif sur un marché au Canada, peuvent soumettre une plainte au CEPMB. La réception de la plainte enclenchera un examen approfondi.
Le CEPMB utilise depuis longtemps un processus fondé sur les plaintes pour atteindre deux objectifs clés :
1. Comme mesure provisoire permettant de prendre en compte, le cas échéant, des situations particulières qui ne sont pas couvertes par le processus d’examen initial et d’examen annuel des prix.
Si les critères de sélection du processus d’examen initial et d’examen annuel des prix constituent une première étape importante dans le recensement des cas devant faire l’objet d’un examen approfondi, il se peut qu’ils ne permettent pas de détecter tous les cas qui pourraient justifier un tel examen. Dans certains cas, les critères de sélection prévus dans les Lignes directrices ne permettent pas d’identifier des situations particulières nécessitant un examen approfondi. Par conséquent, le Conseil considère le rôle des plaintes comme un mécanisme essentiel pour veiller à ne pas passer à côté de scénarios inattendus.
2. Pour reconnaître que certains médicaments sont moins susceptibles d’être vendus à des prix excessifs en raison des spécificités du marché en question.
Le CEPMB utilise depuis longtemps le processus fondé sur les plaintes pour limiter les examens des médicaments dans des secteurs où le risque de prix excessifs est moindre et pour concentrer les ressources du CEPMB sur les médicaments posant un risque plus élevé de se vendre à des prix excessifs. En vertu du Règlement, les prix des médicaments brevetés en vente libre, de certaines substances réglementées en vente libre, des médicaments génériques et des médicaments vétérinaires n’ont pas à être communiqués au CEPMB, à moins que le CEPMB ne le demande expressément.
Selon le cadre proposé, le Conseil mettra en œuvre cette mesure en exigeant que, pour les médicaments assujettis à des obligations réduites en matière de fourniture de renseignements, un examen approfondi ne soit entrepris que si une plainte est reçue.
5.4 Section D : Examen approfondi
Un examen approfondi tiendra compte de tous les facteurs énoncés au paragraphe 85(1), ce qui comprend tous les tests appliqués aux prix courants (CPINT, variations de l’IPC et CCT). Par conséquent, l’examen approfondi comprendra une analyse des données scientifiques et des renseignements sur les prix.
Les critères de comparaison selon la catégorie thérapeutique seront établis au cours de l’analyse scientifique décrite dans le graphique ci-dessous. Par la suite, des prix seront identifiés pour les comparateurs et le personnel examinera la pertinence des comparateurs dans le contexte fourni par l’examen scientifique. Le personnel examinera alors au cas par cas l’importance des critères de comparaison selon la catégorie thérapeutique, la CPINT pertinente et l’IPC.
Par exemple, si les critères de comparaison selon la catégorie thérapeutique sont très similaires, la CCT peut avoir plus de poids dans l’analyse que la CPINT, alors que l’inverse peut être vrai lorsque les comparateurs sont moins similaires. La mise en balance de toutes les comparaisons de prix sur la base des facteurs énoncés au paragraphe 85(1) déterminera la recommandation du personnel : la clôture de l’examen approfondi ou la tenue d’une audience (avis d’audience). La décision finale de clore l’examen approfondi ou d’émettre un avis d’audience incombe au président.
Rôle des engagements
Si le personnel recommande un avis d’audience, le titulaire des droits peut choisir de soumettre un engagement volontaire (EV) avant l’émission dudit avis. Tout engagement volontaire proposé sera porté à la connaissance du président. Le président déterminera si une audience est dans l’intérêt public ou si l’examen approfondi doit être clôturé en tenant compte de la pertinence de la recommandation du personnel basée sur les facteurs, et de tout engagement volontaire proposé par le titulaire des droits.
À titre de rappel, après l’émission d’un avis d’audience, ni le personnel ni le président ne sont autorisés à étudier un engagement volontaire. Si le titulaire des droits cherche à conclure un accord après l’émission d’un avis d’audience, cet accord doit être présenté au panel d’audience, qui a le pouvoir exclusif de décider d’interrompre l’audience sur la base des termes de l’accord proposé.
Recettes excédentaires
Le personnel ne calculera pas les recettes excédentaires potentielles dans le cadre de l’examen approfondi, mais les recettes excédentaires potentielles incluses dans l’engagement volontaire soumis par le titulaire de droits continueront d’être basées sur le prix de vente moyen par emballage et/ou les renseignements sur les recettes nettes (prix de transaction moyen) communiqués par le titulaire de droits conformément au Règlement, et non sur les prix courants.
Transparence et communication continue avec les titulaires de droits
Le personnel veillera à ce que les titulaires de droits soient tenus informés de l’état d’avancement de leur examen. Ils recevront des notifications et auront la possibilité d’apporter leurs observations à des moments clés du processus d’examen. Les échéanciers et les étapes de notification suivants sont notamment envisagés :

Figure - Version texte
Ce schéma décrit les échéanciers suggérés et les étapes de notification envisagées. L’information présentée dans ce schéma est décrite en détail dans le texte.
Étapes 1 à 2 – Évaluation des critères de sélection : Le personnel enverra une lettre aux titulaires de droits dans les 60 jours suivant la réception de leur dépôt semestriel pour leur indiquer si certains de leurs médicaments feront l’objet d’un examen approfondi. Ce délai de 60 jours s’applique à la fois aux examens initiaux et aux examens annuelsNote de bas de page 16.
Si un examen approfondi est déclenché, il pourrait être achevé relativement rapidement (dans un délai d’environ 12 mois) dans certaines circonstances (p. ex. pour les produits pour lesquels l’examen scientifique détermine rapidement qu’il n’y a pas de comparateurs et que la CPINT est relativement simple et non controversée), ou pourrait prendre plus de temps (jusqu’à environ 28 mois) pour les cas très complexes.
Étapes 2 à 3 – Examen scientifique et examen des prix : Une fois l’examen approfondi déclenché, l’équipe scientifique établira les critères de comparaison en vue d’une éventuelle CCT. Les titulaires de droits seront informés dans un délai de 6 à 8 mois (voire plus si l’intervention du Groupe consultatif sur les médicaments pour usage humain [GCMUH] est requise). Si un titulaire de droits souhaite fournir des renseignements supplémentaires en vue d’un nouvel examen scientifique, il disposera d’un délai de 90 jours pour le faire. Ce nouvel examen ramènera le processus d’évaluation à l’étape 2, à savoir l’examen scientifique.
Parallèlement, le personnel entamera son examen du prix du médicament dans l’attente des résultats de l’examen scientifique. À ce stade, le personnel peut également recevoir les observations des titulaires de droits, au cas par cas.
Étapes 3 à 4 – Examen des prix : Une fois l’examen scientifique terminé, le personnel procédera à une évaluation conformément à l’alinéa 85(1)(b), en ajoutant des renseignements sur les prix à la CCT. Le processus de sélection et d’analyse de la CCT est décrit dans l’examen approfondi au point 6.3 ci-dessous.
Après l’évaluation individuelle des facteurs énoncés au paragraphe 85(1), le personnel met en balance tous les facteurs et recommande au président de clore l’examen approfondi (avec ou sans engagement volontaire) ou de procéder à l’émission d’un avis d’audience.
La mise en balance des facteurs n’est pas définie par la Loi ou le Règlement. Comme par le passé, lors de l’élaboration des recommandations au président, le personnel indiquera comment la mise en balance est affectée par les données probantes disponibles et la pondération recommandée, qui peut varier au cas par cas (voir la section 8 pour des exemples d’études de cas), tout en veillant à appliquer sa méthode de mise en balance de manière cohérente afin de garantir un traitement équitable pour tous les titulaires de droits.
Si le résultat de l’examen approfondi est une recommandation au président d’émettre un avis d’audience, le personnel informera le titulaire des droits de cette recommandation. Le titulaire des droits disposera de trois mois pour répondre avant que le président ne décide d’émettre ou non l’avis d’audience.
Les titulaires de droits peuvent soumettre un engagement volontaire (EV) à tout moment après avoir été informés que le personnel du CEPMB va entamer un examen approfondi. Tous les EV seront soumis au président, accompagnés d’une analyse et d’une recommandation de la part du personnel du CEPMB.
6. Sujets de discussion
6.1 Examen initial et examen annuel des prix

Figure - Version texte
Ce diagramme montre le processus d’examen des prix proposé par le CEPMB pour les médicaments brevetés. Il met l’accent sur l’examen initial et l’examen annuel des prix (sections A et B) et met en évidence des thèmes de discussion précis. Le diagramme indique également où ces thèmes s’inscrivent dans le cadre proposé, avec des sections grisées indiquant leur place.
Thème 1 : Niveau de prix parmi les pays de comparaison du CEPMB11 à utiliser dans l’examen initial et l’examen annuel des prix.
- Le Conseil étudie les options suivantes :
- PIM (Prix international médian)
- Point médian (le point médian entre le PIM et le PEPI)
- PEPI (le plus élevé des prix internationaux)
Thème 2 : Délai que le personnel doit respecter, après la mise en œuvre des Lignes directrices, avant de pouvoir établir si un médicament existant remplit les critères de sélection de la CPINT.
- Le Conseil étudie les options suivantes :
- Un an
- Deux ans
- Trois ans
Thème 3 : Examen approfondi fondé sur les critères d’augmentation de l’IPC.
- Le Conseil étudie les options suivantes :
- Option 1 : Si l’augmentation du prix courant est supérieure à celle de l’IPC sur un an;
- Option 2 : Si l’augmentation cumulée du prix courant au cours des deux dernières années est supérieure à celle de l’IPC combiné des deux dernières années et que l’augmentation n’a eu lieu qu’au cours de l’année écoulée.
6.1.1 Niveau de prix parmi les pays de comparaison du CEPMB11 à utiliser dans l’examen initial et l’examen annuel des prix
En vertu de l’alinéa 85(1)(c) de la Loi, le Conseil est tenu de prendre en compte les prix auxquels le médicament et d’autres médicaments appartenant à la même catégorie thérapeutique ont été vendus à l’étranger, dans la mesure où ces renseignements sont disponibles. Comme il est indiqué dans le cadre ci-dessus, le Conseil utilisera la comparaison des prix internationaux (CPINT) pour le même médicament uniquement (sans tenir compte des médicaments de la même catégorie thérapeutique) comme critère principal pour recenser les médicaments devant faire l’objet d’un examen approfondi.
Le Conseil souhaite obtenir des commentaires sur le niveau de prix établi par les pays du CEPMB11 qui devrait être utilisé pour cet examen initial. Le Conseil vise à atteindre un équilibre entre le recensement des cas potentiels de prix excessifs et la gestion de ses ressources.
Le Conseil a identifié trois critères de CPINT qui pourraient améliorer son efficience administrative et assurer la transparence et la prévisibilité pour les titulaires de droits. Ces trois options sont les suivantes :
- Prix international médian (PIM)
- Le plus élevé des prix internationaux (PEPI)
- Le point médian entre le PIM et le PEPI
Le Conseil comprend la position adoptée par de nombreux titulaires de droits au cours de la phase 1 de la consultation, à savoir que le plus élevé des prix internationaux (« PEPI ») communiqués par les titulaires de droits est le niveau de prix le plus approprié pour les Lignes directrices, car il est impossible qu’un prix inférieur au PEPI soit excessif. Le Conseil souligne néanmoins que, dans certains cas, il est possible qu’un prix inférieur au PEPI soit excessif, tout comme il est possible qu’un prix supérieur au PEPI ne soit pas excessif. En particulier, une de ces situations est possible lorsque le prix de référence de la CCT est nettement inférieur à celui de la CPINT, comme ce fut le cas dans les audiences Shire BioChem Inc. (Adderall XR, 2008) et Horizon Pharma (Procysbi, 2022), où le Conseil a estimé qu’un prix supérieur au point médian entre la CCT et le prix international médian (PIM) était excessif.
Pour cette raison, entre autres, le Conseil continue à étudier la question de savoir si un niveau de prix inférieur au PEPI du CEPMB11 pourrait être plus approprié comme outil de sélection pour sélectionner les médicaments devant faire l’objet d’un examen approfondi, étant donné que le Conseil propose de ne pas utiliser la CCT lors de l’examen initial des prix. En ce qui concerne l’efficience administrative, le Conseil est conscient que le nombre d’examens annuels approfondis que le personnel peut effectuer est limité et que le nombre d’examens approfondis augmente au fur et à mesure que la valeur des critères de sélection de la CPINT se situe en dessous du PEPI. Quelques données importantes sur le nombre de médicaments dans chaque catégorie sont fournies à la figure 1, ci-dessous.
Enfin, certains des commentaires formulés par les intervenants au cours de la phase 1 suggèrent que certains d’entre eux considèrent l’application des critères de sélection comme un moyen de déterminer si un prix est excessif. À cet égard, le Conseil rappelle que l’utilisation de critères de sélection n’est pas censée être et ne doit pas être interprétée comme un moyen de déterminer si un prix est excessif. La question de savoir si un prix est excessif est une décision qui ne peut être prise par le Conseil que dans le cadre de l’évaluation des circonstances particulières entourant le prix d’un médicament breveté lors d’une audience publique et ne peut être tranchée dans le cadre des Lignes directrices. En effet, il est possible qu’un examen approfondi déclenché parce que le prix d’un médicament est supérieur à la CPINT soit clos après une analyse plus approfondie, avec ou sans réception d’un engagement volontaire.
Sujet 1 : Niveau de prix parmi les pays de comparaison du CEPMB11 à utiliser dans l’examen initial et l’examen annuel des prix
Le Conseil étudie les options suivantes :
- Option 1 : Prix international médian* (PIM)
- Option 2 : Le plus élevé des prix internationaux (PEPI)
- Option 3 : Le point médian* entre le PIM et le PEPI
*Remarques sur les prix
- La médiane ne sera calculée que pour les médicaments dont les prix sont déclarés dans au moins deux pays du CEPMB11. Si le médicament est vendu dans un nombre pair de pays, la médiane sera calculée comme la moyenne simple entre les deux prix intermédiaires. Si le médicament est vendu dans un nombre impair de pays, la médiane est le prix moyen.
- En ce qui concerne le point médian, le Conseil propose que le point médian entre le PIM et le PEPI soit une moyenne simple entre ces deux prix.
- Lorsqu’il existe un seul prix international de comparaison, ce dernier sera alors considéré comme le PEPI. En l’absence de prix internationaux de comparaison (p. ex. le Canada est le premier pays du CEPMB11 à commercialiser le médicament), le critère de sélection de la CPINT ne sera pas utilisé pour entreprendre un examen approfondi.
Prix courants des médicaments brevetés au Canada par rapport aux pays de comparaison du CEPMB11
Figure 1. Répartition des prix courants des médicaments brevetés au Canada par rapport aux pays de comparaison du CEPMB11Note de bas de page 17

Figure - Version texte
Ce diagramme en barres représente la part de tous les médicaments brevetés en 2023 (en haut) et des nouveaux médicaments au moment de leur lancement (en bas) pendant leur période de lancement en 2022 et en 2023.
Les barres sont subdivisées en quatre bandes pour afficher les parts des médicaments aux prix courants pratiqués au Canada : inférieur ou égal au prix international médian (PIM) (vert foncé); supérieur au PIM et inférieur ou égal au point médian (vert pâle); supérieur au point médian et inférieur ou égal au plus élevé des prix internationaux (PEPI) (bleu pâle); et supérieur au PEPI (bleu foncé).
| Liste <= PIM | PIM-Méd | Méd-PEPI | Liste > PEPI | |
|---|---|---|---|---|
Tous les DIN |
22 % |
25 % |
21 % |
32 % |
Intro - DIN |
63 % |
15 % |
13 % |
8 % |
Tous les médicaments
- 32 % de tous les médicaments brevetés avaient des prix courants au Canada supérieurs au plus élevé des prix internationaux (PEPI) du CEPMB11 en 2023.
- 53 % de tous les médicaments brevetés avaient des prix courants au Canada supérieurs au point médian entre le PIM et le PEPI du CEPMB11 en 2023.
- 78 % de tous les médicaments brevetés avaient des prix courants au Canada supérieurs au PIM en 2023.
Nouveaux médicaments dans la première période de dépôt (lors du lancement)
- 8 % des nouveaux médicaments avaient des prix courants au Canada supérieurs au plus élevé des PEPI du CEPMB11 au cours de leur première période de dépôt.
- 21 % des nouveaux médicaments avaient des prix courants au Canada supérieurs au point médian entre le PIM et le PEPI du CEPMB11 au cours de leur première période de dépôt.
- 37 % des nouveaux médicaments avaient des prix courants au Canada supérieurs au PIM du CEPMB11 au cours de leur première période de dépôt.
6.1.2 Dispositions transitoires pour les médicaments existants
Comme il est indiqué au point 5.2, un délai sera accordé aux titulaires de droits pour les médicaments existants dont les prix courants sont supérieurs aux valeurs des critères de sélection de la CPINT, choisis par le Conseil, pour leur laisser le temps de s’adapter aux Lignes directrices avant que leurs médicaments ne fassent l’objet d’un examen approfondi. Cet examen se fondera sur les prix courants les plus récents communiqués par le titulaire des droits.
Sujet 2 : Délai que le personnel doit respecter, après la mise en œuvre des Lignes directrices, avant de pouvoir établir si un médicament existant remplit les critères de sélection de la CPINT
Le Conseil étudie les options suivantes :
Option 1 : un an
Option 2 : deux ans
Option 3 : trois ans
6.1.3 Facteur de l’IPC
En vertu de l’alinéa 85(1)d) de la Loi, le Conseil est tenu de prendre en compte les variations de l’indice des prix à la consommation (IPC). Selon le cadre proposé, le facteur d’IPC sera évalué lors de l’examen annuel des prix. Au cours de cet examen, le personnel comparera les variations de prix des médicaments aux variations de l’IPC pour repérer les médicaments justifiant un examen approfondi.
Le Conseil propose d’utiliser l’IPC comme critère pouvant mener à un examen approfondi. À cet égard, le Conseil envisage deux options pour mieux tenir compte de l’évolution historique des augmentations de prix au Canada.
Sujet 3 : Examen approfondi fondé sur les critères d’augmentation de l’IPC
Le Conseil étudie les options suivantes :
Option 1 : Si l’augmentation du prix courant est supérieure à celle de l’IPC sur un an.
- Prévisible et transparente : L’évaluation est fondée sur les prix courants communiqués par les titulaires de droits (prix courants de l’année précédente et de l’année en cours) et sur l’IPC réel de l’année en cours, tel qu’il est publié par Statistique Canada.
Option 2 : Si l’augmentation cumulée du prix courant au cours des deux dernières années est supérieure à celle de l’IPC combiné des deux dernières années et que l’augmentation n’a eu lieu qu’au cours de la dernière année (c.-à-d. qu’il n’y a pas eu d’augmentation du prix au cours de la première des deux années, puis une augmentation au cours de la deuxième année).
6.2 Dispositions particulières

Figure - Version texte
Ce diagramme illustre le processus d’examen des prix proposé par le CEPMB pour les médicaments brevetés, en mettant l’accent sur la section des dispositions particulières. Cette section porte sur le rôle des plaintes et les considérations thérapeutiques propres au marché. Le diagramme met en évidence des thèmes de discussion précis pour lesquels le Conseil sollicite des commentaires et montre comment ils s’inscrivent dans le cadre proposé. Les sections grisées indiquent leur place dans l’ensemble du cadre proposé.
Thème 4 : Personnes ou groupes autorisés à déposer une plainte.
Le CEPMB envisage de limiter les plaintes aux personnes suivantes :
- Option 1 : Le ministre fédéral de la Santé ou n’importe lequel de ses homologues provinciaux ou territoriaux
- Option 2A : Option 1 ci-dessus et les payeurs publics seulement
- Option 2B : Option 1 et les payeurs privés et publics
- Option 3 : Tout le monde, sauf les titulaires de droits
- Option 4 : Aucune limitation ou restriction
Thème 5 : Élargissement de la liste des produits qui ne feraient l’objet d’un examen approfondi que sur réception d’une plainte pour y inclure les médicaments biosimilaires et/ou les vaccins.
Le Conseil étudie les options suivantes :
- Option 1 : Le CEPMB traitera les biosimilaires ou les vaccins de la même façon que les autres médicaments.
- Option 2 : Le CEPMB ne procédera à un examen approfondi des prix des biosimilaires ou des vaccins que si une plainte est reçue.
6.2.1 Plaintes
Selon le cadre proposé, les plaintes serviront de mécanisme clé pour recenser les médicaments susceptibles de justifier un examen approfondi. L’un des principaux objectifs du processus fondé sur les plaintes, tel que décrit à la section 5.3.1 du présent Guide de discussion, est de veiller à ce que les situations particulières non couvertes par le processus d’examen des prix du CEPMB puissent être identifiées et faire l’objet d’un examen approfondi en cas de besoin.
Le Conseil cherche à trouver un équilibre entre l’inclusivité et la transparence, d’une part, et la nécessité de prévenir les abus et de veiller à ce que les cas de prix excessifs potentiels puissent être décelés, d’autre part. Il est essentiel de parvenir à cet équilibre pour assurer une surveillance continue efficace, réduire le fardeau administratif et maintenir la prévisibilité pour les titulaires de droits.
À cette fin, le Conseil envisage différentes options pour définir qui peut déposer une plainte entraînant automatiquement un examen approfondi. Il pourrait s’agir de ne permettre qu’au ministre fédéral de la Santé ou à n’importe lequel de ses homologues provinciaux ou territoriaux de déposer des plaintes ou de n’imposer aucune restriction quant aux personnes pouvant déposer une plainte auprès du CEPMB, entre autres options intermédiaires.
Sujet 4 : Personnes ou groupes autorisés à déposer une plainte
Le Conseil étudie les options suivantes :
Option 1 : Limiter les plaintes au ministre fédéral de la Santé ou à n’importe lequel de ses homologues provinciaux ou territoriaux
- Permet de veiller à ce que les principaux responsables gouvernementaux ayant un intérêt direct pour la santé publique portent à l’attention du CEPMB les cas les plus pertinents de prix potentiellement excessifs.
- Conforme au paragraphe 86(2) de la Loi sur les brevets.
- Les membres du public peuvent contacter leurs élus s’ils craignent que le prix d’un médicament breveté ne soit excessif.
Option 2A : Limiter les plaintes à l’option 1 ci-dessus et aux payeurs publics uniquement;
Option 2B : Limiter les plaintes à l’option 1 ci-dessus et aux payeurs privés et publics
- Option qui permet d’élargir l’éventail des plaintes déposées par les payeurs concernés.
Option 3 : Limiter les plaintes à tout le monde, sauf aux titulaires de droits
- Option qui rend accessible le processus de plaintes à un large éventail d’intervenants susceptibles d’avoir des plaintes légitimes, tout en excluant ceux qui ont un intérêt commercial direct, permettant ainsi d’éviter toute utilisation potentiellement inappropriée du processus.
Option 4 : Aucune limitation ou restriction
- Option qui traite toutes les parties sur un pied d’égalité et garantit un éventail de plaintes aussi large que possible. Le CEPMB reconnaît que ce scénario pourrait donner lieu à un grand nombre de plaintes et, le cas échéant, il envisagerait des mesures pour minimiser la possibilité que certaines plaintes soient inappropriées.
6.2.2 Considérations thérapeutiques propres au marché
Un autre objectif important du processus fondé sur les plaintes a été de reconnaître que certains médicaments sont moins susceptibles d’être vendus à prix excessifs en raison des spécificités du marché en question. Comme il est indiqué à la section 5.3.1 du présent Guide de discussion, pour les médicaments pour lesquels les exigences en matière de fourniture de renseignements sont réduites en vertu du Règlement, le Conseil a choisi de n’ouvrir un examen approfondi que lorsqu’une plainte est reçue. Le Conseil reconnaît que d’autres catégories thérapeutiques peuvent également poser un risque moindre de prix excessifs et envisage d'étendre la liste des médicaments admissibles au processus fondé sur les plaintes uniquement, le tout afin de donner la priorité aux médicaments présentant un risque plus élevé.
Sujet 5 : Élargissement de la liste des produits qui ne feraient l’objet d’un examen approfondi qu’à la réception d’une plainte pour y inclure les médicaments biosimilaires et/ou les vaccins
Le Conseil étudie les options suivantes :
Option 1 : Le CEPMB traitera les biosimilaires ou les vaccins brevetés de la même façon que les autres médicaments.
Option 2 : Le CEPMB ne procédera à un examen approfondi des prix des biosimilaires ou des vaccins que si une plainte est reçue.
Il convient de noter que tous les produits susmentionnés relèvent toujours de la compétence du Conseil, pour autant qu’ils soient brevetés. Une plainte concernant l’un d’entre eux entraînerait automatiquement le lancement d’un examen approfondi, qui pourrait ou non déboucher sur une recommandation d’ouverture d’une enquête sur des prix excessifs.
6.3 Examen approfondi : Comparaison selon la catégorie thérapeutique et processus d’examen scientifique

Figure - Version texte
Ce diagramme illustre le processus d’examen des prix proposé par le CEPMB pour les médicaments brevetés. Il met l’accent sur la section d’examen approfondi de la section D, qui comprend la prise en compte de tous les facteurs et la formulation d’une recommandation au président. Le diagramme décrit également les thèmes de discussion pour lesquels le Conseil sollicite des commentaires et indique où ils s’inscrivent dans le cadre proposé. Les sections grisées indiquent leur place dans l’ensemble du cadre.
Thème 6 : Utilisation des données cliniques pour contextualiser le degré de similitude des médicaments de comparaison sélectionnés pour la CCT.
Le Conseil étudie les options suivantes :
- Un degré de similitude est établi pour l’ensemble des médicaments de comparaison
- Un degré de similitude sera attribué à chaque médicament de comparaison
Thème 7 : Rôle futur du Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Le Conseil étudie les options suivantes :
- Option 1 : Le GCMUH ne sera sollicité que de façon ponctuelle lorsque le personnel le jugera nécessaire.
- Option 2 : Ne plus recourir aux services du GCMUH – le processus scientifique sera mené par le personnel.
En vertu des alinéas 85(1)(b) et (c) de la Loi, le Conseil doit tenir compte des prix auxquels d’autres médicaments appartenant à la même catégorie thérapeutique ont été vendus sur le marché en question et à l’étranger (dans la mesure où l’information est disponible) pour évaluer si le prix d’un médicament breveté est excessif. Cette comparaison se limite à la sélection des médicaments de référence et à la compréhension du contexte dans lequel ils sont commercialisés, du point de vue des prix. Ce processus n’est pas destiné à reproduire ou à remplacer une analyse de la valeur thérapeutique ou une évaluation de l’efficacité clinique. Les évaluations des technologies de la santé (ETS), les analyses coût-efficacité et autres évaluations comparatives détaillées de l’efficacité clinique ne sont pas incluses dans les facteurs prévus au paragraphe 85(1) ni dans le Règlement. En revanche, d’autres organisations de l’écosystème des sciences de la vie sont autorisées à réaliser ces évaluations, dotées de moyens et de ressources pour réaliser des ETS à l’aide d’un ensemble complet de pratiques exemplaires. Il s’agit notamment des organismes d’évaluation des technologies de la santé du Canada, à savoir l’Agence des médicaments du Canada (CDA-AMC, anciennement l’ACMTS) et l’Institut national d’excellence en santé et services sociaux (INESSS), ainsi que de divers ministères provinciaux et organismes d’examen des prix des produits pharmaceutiques.
Comme il est indiqué dans le cadre ci-dessus, le Conseil attendra que le médicament ait été sélectionné pour un examen approfondi avant de procéder à une CCT.
Établir des critères de comparaison pour une CCT
La première étape consiste en un examen scientifique, un processus fondé sur des données probantes qui aboutit à une liste recommandée de critères potentiels de comparaison selon la catégorie thérapeutique pour un médicament breveté. La liste est créée par le personnel scientifique du Conseil, indépendamment de toute information sur les prix. La liste est ensuite fournie, avec le contexte scientifique pertinent, au personnel chargé de l’examen des prix, qui y ajoute les renseignements pertinents sur les prix (prix courants) afin de pouvoir effectuer des comparaisons entre les prix courants.
Le Conseil n’envisage pas de modifier la manière dont les médicaments seront sélectionnés par un examen scientifique à des fins de comparaison et continuera d’utiliser les méthodes précédemment appliquées. L’examen scientifique d’un nouveau médicament breveté continuera à se fonder sur des renseignements provenant de diverses sources, dont les suivantes :
- Recherches menées par un centre d’information sur les médicaments (CIM) – Le personnel peut faire appel aux services de divers CIM pour obtenir des renseignements scientifiques, notamment des renseignements sur les essais cliniques et les directives de pratique clinique. La base de l’examen du CIM est l’indication décrite dans la monographie du produit ou, dans le cas d’un médicament n’ayant pas encore reçu d’avis de conformité (AC), des renseignements similaires à ceux contenus dans la monographie du produit.
- Recherches menées par le personnel – Le personnel peut également mettre à jour les recherches et compléter les données et les éléments de preuve du titulaire des droits et du CIM en utilisant d’autres sources.
- Commentaires des titulaires de droits.
- Recherches menées par des experts externes (entrepreneurs) désignés par le CEPMB.
Une fois les critères de comparaison potentiels établis par le groupe d’examen scientifique, la liste est renvoyée au groupe chargé de l’examen des prix avec les données scientifiques pertinentes pour permettre à ce dernier de comprendre les principaux points de comparaison et de déterminer le poids relatif du critère de comparaison dans l’évaluation au titre de l’alinéa 85(1)(b), et de contextualiser la CCT potentielle comme il est indiqué dans la section suivante.
6.3.1 Contextualisation de la CCT potentielle
Le Conseil reconnaît que les cadres précédents du CEPMB étaient axés sur une évaluation de la valeur de l’innovation (niveau d’amélioration thérapeutique) comme la pierre angulaire de son processus d’examen des prix. Quoique l’innovation est un aspect essentiel de la Loi sur les brevets dans son ensemble, elle n’est pas en soi un facteur prévu au paragraphe 85(1). Le paragraphe 85(1) se concentre plutôt sur les comparaisons de prix à différents niveaux, y compris celles des prix des médicaments de comparaison selon la catégorie thérapeutique.
À cet égard, le CEPMB reconnaît que même si un médicament peut avoir la même indication ou utilisation approuvée qu’un nouveau médicament breveté faisant l’objet d’un examen approfondi et peut être sélectionné comme médicament de comparaison potentiel aux fins d’une éventuelle CCT, il peut y avoir des variations dans le degré de comparabilité entre les médicaments.
Le Conseil estime qu’il devrait y avoir un mécanisme en place, autre que le niveau d’amélioration thérapeutique utilisé précédemment, pour évaluer et reconnaître ces variations dans le cadre du processus d’examen scientifique. Reconnaître ces différences fournit un contexte essentiel pour le personnel du CEPMB. En effet, lorsqu’il formule ses recommandations au président, ce contexte aide le personnel à pondérer la CCT par rapport aux autres facteurs prévus au paragraphe 85(1) dans le cadre d’un examen approfondi.
Par exemple, si les critères de comparaison selon la catégorie thérapeutique sont très similaires, la CPINT peut avoir moins de poids dans l’analyse que la CCT, alors que le contraire peut être vrai lorsque les comparateurs sont moins similaires.
Sujet 6 : Utilisation des données cliniques pour contextualiser le degré de similitude des médicaments de comparaison sélectionnés pour la CCT.
Le Conseil étudie les options suivantes :
Option 1 : Un degré de similitude est établi pour l’ensemble des médicaments de comparaison
Option 2 : Un degré de similitude sera attribué à chaque médicament de comparaison
Le CEPMB étudie actuellement deux options pour évaluer le degré de similitude entre le nouveau médicament breveté faisant l’objet d’un examen approfondi et le ou les médicaments choisis comme comparateurs aux fins d’une éventuelle CCT.
Selon les deux options, si le nouveau médicament breveté est le seul médicament vendu au Canada qui traite efficacement une maladie ou une indication particulière, aucun médicament de comparaison ne sera sélectionné et aucun test de la CCT ne sera effectué.
Option 1 – Un degré de similitude est établi pour l’ensemble des médicaments de comparaison.
Cette approche consiste à évaluer le degré de similitude du médicament à l’étude avec le groupe de médicaments de comparaison dans son ensemble et à attribuer au médicament à l’étude une cote de similitude unique.
L’approche permettant de définir un degré de similitude consisterait à évaluer les preuves cliniques telles que l’efficacité, l’innocuité, le profil des effets indésirables, la voie d’administration et la commodité pour le patient, parmi d’autres considérations possibles. Les données probantes seront examinées sur la base de normes de qualité reconnues, de données provenant de publications de haute qualité à comité de lecture, y compris des essais cliniques de comparaison directe de phase III, des méta-analyses de haute qualité mises en réseau ou des évaluations des technologies de la santé, auxquelles on accordera le plus de poids.

Figure - Version texte
Ce diagramme est une visualisation d’une approche d’évaluation du degré de similitude du médicament à l’étude avec le groupe de médicaments de comparaison dans son ensemble. Le médicament à l’étude est évalué. On lui attribue une cote correspondant à son degré global de similitude avec l’ensemble du groupe de médicaments de comparaison.
Option 2 – Un degré de similitude sera attribué à chaque médicament de comparaison.
Cette approche de la définition du degré de similitude prendrait en compte les mêmes données probantes que celles mentionnées dans l’option 1; toutefois, chaque médicament de comparaison potentiel se verrait attribuer un degré de similitude propre, ce qui permettrait d’établir un classement des différents médicaments de comparaison. Cette option fournit un niveau de comparabilité plus détaillé, dans le but de mieux tenir compte des forces et des faiblesses des différents médicaments de comparaison lors de l’évaluation au titre de l’alinéa 85(1)b).

Figure - Version texte
Ce diagramme est une visualisation d’une approche d’évaluation du degré de similitude du médicament à l’étude avec chaque médicament de comparaison séparément. Le médicament à l’étude est évalué et chaque médicament de comparaison possible se verra attribuer un degré de similitude.
Utilisation du degré de similitude dans le processus d’examen des prix
Contrairement au niveau précédent d’amélioration thérapeutique, le degré de similitude (option 1 ou option 2) ne serait pas utilisé pour déterminer directement les tests applicables aux prix, mais plutôt pour donner au personnel un aperçu du degré de comparabilité des renseignements contenus dans la CCT, comme il est indiqué dans la description du processus d’examen approfondi figurant à la section 5.4.6.3.2 Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) est un organisme consultatif composé de professionnels de la santé indépendants qui sont sous contrat avec le CEPMB pour participer aux évaluations scientifiques, en raison de leurs vastes connaissances générales de la pharmacothérapie, de l’évaluation des médicaments, de l’utilisation des médicaments et des méthodes de recherche clinique. Le GCMUH a toujours fourni des conseils impartiaux au personnel du CEPMB dans le cadre du processus d’examen scientifique. Les membres du GCMUH n’examinent pas les documents en tant qu’experts cliniques spécialisés, mais ils peuvent solliciter l’avis d’experts cliniques de temps à autre.
Toutefois, le Conseil reconnaît que le personnel du CEPMB chargé de l’examen scientifique possède l’expertise nécessaire pour formuler des recommandations sur les médicaments de comparaison et les posologies comparables dans le cadre d’une CCT. L’équipe d’examen scientifique fonctionne indépendamment du processus d’examen des prix et n’examine pas les renseignements sur les prix. Elle participe aux évaluations détaillées fondées sur des données probantes et ne donne son avis que sur les questions scientifiques qui nécessitent une élucidation.
À l’avenir, le Conseil souhaiterait savoir si le GCMUH devrait être consulté de manière ponctuelle, à la demande du personnel dans les cas où celui-ci aurait besoin d’un avis supplémentaire sur la CCT, ou si l’on ne devrait plus du tout recourir aux services du GCMUH et supprimé ce dernier.
Sujet 7 : Rôle futur du Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Le Conseil étudie les deux options suivantes :
Option 1 : Le GCMUH ne sera sollicité que de façon ponctuelle lorsque le personnel le jugera nécessaireNote de bas de page 18.
Option 2 : Ne plus recourir aux services du GCMUH – le processus scientifique sera mené par le personnel.
Si le Conseil décide d’utiliser les recommandations du GCMUH de manière ponctuelle, il ne le fera que lorsque l’équipe d’examen scientifique du CEPMB cernera des problèmes ou des questions spécifiques nécessitant un avis supplémentaire. Dans un souci d’optimisation des ressources, cette décision marque un changement par rapport au processus précédent dans lequel le GCMUH examinait chaque médicament assujetti à la compétence du CEPMB.
7. Prochaines étapes
Dans les semaines à venir, le CEPMB organisera un webinaire réunissant plusieurs intervenants, au cours duquel il donnera un aperçu du cadre proposé et répondra à toutes les questions.
Un avant-projet des nouvelles lignes directrices du CEPMB devrait être rendu public d’ici la fin de l’année 2024.
Le CEPMB invite les intervenants à lui faire part de leurs commentaires sur les sujets abordés dans le présent Guide de discussion, par écrit, avant la date limite du 11 septembre 2024. Bien que les intervenants puissent commenter n’importe quel aspect de ce Guide de discussion, nous nous intéressons avant tout au point de vue des intervenants sur l’incidence et les conséquences des sept sujets suivants, tels qu’ils sont présentés précédemment dans le présent document :
Sujet 1 : Niveau de prix parmi les pays de comparaison du CEPMB11 à utiliser dans l’examen initial et l’examen annuel des prix
Option 1 : PIM
Option 2 : PEPI;
Option 3 : Point médian entre le PIM et le PEPI
Sujet 2 : Le délai à respecter par le personnel, après la mise en œuvre des Lignes directrices, pour déterminer si le critère de sélection de la CPINT pour un médicament existant est rempli.
Option 1 : un an
Option 2 : deux ans
Option 3 : trois ans
Sujet 3 : Examen approfondi fondé sur les critères d’augmentation de l’IPC.
Option 1 : Si l’augmentation du prix courant est supérieure à celle de l’IPC sur un an
Option 2 : Si l’augmentation cumulée du prix courant au cours des deux dernières années est supérieure à celle de l’IPC combiné des deux dernières années et que l’augmentation n’a eu lieu qu’au cours de la dernière année (c.-à-d. qu’il n’y a pas eu d’augmentation du prix au cours de la première des deux années, puis une augmentation au cours de la deuxième année).
Sujet 4 : Personnes ou groupes autorisés à déposer une plainte.
Option 1 : Limiter les plaintes au ministre fédéral de la Santé ou à n’importe lequel de ses homologues provinciaux ou territoriaux.
Option 2A : Limiter les plaintes à l’option 1 ci-dessus et aux payeurs publics uniquement.
Option 2B : Limiter les plaintes à l’option 1 ci-dessus et aux payeurs privés et publics.
Option 3 : Limiter les plaintes à tous, à l’exception des titulaires de droits.
Option 4 : Aucune limitation ou restriction.
Sujet 5 : Élargissement de la liste des produits qui ne feraient l’objet d’un examen approfondi qu’à la réception d’une plainte pour y inclure les médicaments biosimilaires et/ou les vaccins.
Option 1 : Le CEPMB traitera les biosimilaires ou les vaccins brevetés de la même façon que les autres médicaments.
Option 2 : Le CEPMB ne procédera à un examen approfondi des prix des biosimilaires ou des vaccins que si une plainte est reçue.
Sujet 6 : Utilisation des données cliniques pour contextualiser le degré de similitude des médicaments de comparaison sélectionnés pour la CCT.
Option 1 : Un degré de similitude est établi pour l’ensemble des médicaments de comparaison.
Option 2 : Un degré de similitude sera attribué à chaque médicament de comparaison.
Sujet 7 : Rôle futur du Groupe consultatif sur les médicaments pour usage humain (GCMUH)
Option 1 : Le GCMUH ne sera sollicité que de façon ponctuelle lorsque le personnel le jugera nécessaire.
Option 2 : Ne plus recourir aux services du GCMUH – le processus scientifique sera mené par le personnel.
8. Exemples : Critères décisionnels pour entreprendre des examens approfondis

Figure - Version texte
Ce diagramme illustre le processus d’examen des prix proposé par le CEPMB pour les médicaments brevetés, en mettant en évidence les études de cas visant à démontrer comment le personnel peut tenir compte des facteurs pendant le processus d’examen approfondi pour en arriver à une recommandation à l’intention du président. Les exemples divisés en deux parties. La partie 1 comprend des scénarios dans lesquels les critères de sélection ne sont pas remplis, ne donnant ainsi pas lieu à un examen approfondi. La partie 2 porte sur des scénarios dans lesquels un examen approfondi est déclenché.
Aucun examen approfondi
- Exemple no 1 : Prix courant inférieur au prix de référence de la CPINT
- Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au prix de référence de la CPINT
Examen approfondi
- Exemple no 3 : Prix courant supérieur au prix de référence de la CPINT, sans CCT
- Exemple no 4 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT inférieur à celui de la CPINT
- Exemple no 5 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT supérieur à celui de la CPINT
- Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec CCT
- Exemple no 7 : Plainte, avec CCT
Pour aider les intervenants à comprendre comment le personnel peut évaluer les facteurs au cours du processus d’examen approfondi afin d’arriver à une recommandation au président, plusieurs exemples ont été préparées à des fins de discussion.
Les exemples sont divisés en deux parties : La partie 1 comprend des scénarios dans lesquels les critères de sélection ne sont pas remplis, ne donnant ainsi pas lieu à un examen approfondi. La partie 2 comprend des scénarios dans lesquels un examen approfondi est déclenché. Dans ces scénarios, les exemples illustrent le cadre décisionnel qui peut être appliqué par le personnel du CEPMB dans sa recommandation au président en fonction de la façon dont les renseignements disponibles sur les facteurs pertinents énoncés au paragraphe 85(1) peuvent apparaître dans une situation donnée.
Ces exemples de cas ne sont pas exhaustifs et ne visent pas à couvrir tous les scénarios susceptibles de se présenter dans le cadre d’examens approfondis. Il convient notamment de ne pas tenir compte de la différence d’amplitude représentée par les lignes et de la distance qui les sépare, étant donné que les exemples ne visent qu’à représenter les positions relatives des lignes, et non la distance qui les sépare ou le poids précis.
Partie |
Exemples |
1. Aucun examen approfondi |
Exemple no 1 : Prix courant inférieur au prix de référence de la CPINT |
Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au prix de référence de la CPINT |
|
2. Examen approfondi |
Exemple no 3 : Prix courant supérieur au prix de référence de la CPINT, sans CCT |
Exemple no 4 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT inférieur à celui de la CPINT |
|
Exemple no 5 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT supérieur à celui de la CPINT |
|
Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec CCT |
|
Exemple no 7 : Plainte, avec CCT |
Ces exemples ne sont pas destinés à engager le personnel ou le Conseil à effectuer un examen approfondi ou tenir une audience, et l’approche analytique peut être modifiée en fonction des faits disponibles durant l’examen. Toutes les recommandations du personnel et les décisions du président et du Conseil dépendent des circonstances particulières du dossier en question.
Partie 1 (aucun examen approfondi)
Exemple no 1 : Prix courant inférieur au prix de référence de la CPINT

Figure - Version texte
Ce graphique illustre le cas où, au cours de l’examen initial, le prix courant canadien est inférieur au prix de référence obtenu par la comparaison des prix internationaux (CPINT). Au cours de la période d’examen annuel, le prix courant canadien et le prix de référence de la CPINT diminuent au fil du temps. Le prix courant canadien demeure inférieur au prix de référence de la CPINT, ce qui ne donne pas lieu à un examen approfondi. Le graphique est divisé en deux parties, séparées par une ligne pointillée : la partie gauche représente la période d’examen initial des prix, et la partie droite représente la période d’examen annuel. La ligne bleue représente le prix courant canadien et la ligne verte représente la CPINT.
Situation
- Lors de l’examen initial, le prix courant au Canada est inférieur au prix de référence de la CPINT.
- Le prix de référence de la CPINT tend à diminuer avec le temps, mais le prix courant au Canada diminue lui aussi.
- En l’absence d’augmentation du prix courant, les variations de l’IPC ne sont pas à prendre en compte.
- Aucune plainte n’est reçue concernant ce médicament.
Analyse
- Aucune analyse supplémentaire n’est nécessaire, car le médicament ne requiert pas d’examen approfondi.
Recommandation potentielle
- S.O. – Le médicament ne requiert pas un examen approfondi.
Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au prix de référence de la CPINT

Figure - Version texte
Ce graphique illustre le cas où, au cours de l’examen initial, le prix courant canadien est inférieur au prix de référence de la CPINT. Au cours de la période d’examen annuel, l’augmentation du prix courant canadien est inférieure à celle de l’IPC et ne donne donc pas lieu à un examen approfondi. Le graphique est divisé en deux parties, séparées par une ligne pointillée : la partie gauche représente la période d’examen initial des prix, et la partie droite représente la période d’examen annuel. La ligne bleue représente le prix courant canadien et la ligne verte représente la CPINT.
Situation
- Lors de l’examen initial, le prix courant au Canada est inférieur au prix de référence de la CPINT.
- Le prix de référence de la CPINT ne fluctue pas dans le temps, mais le prix courant au Canada augmente.
- L’augmentation du prix courant est inférieure à celle de l’IPC.
- Aucune plainte n’est reçue concernant ce médicament.
Analyse
- Aucune analyse supplémentaire n’est nécessaire, car le médicament ne requiert pas d’examen approfondi.
Recommandation potentielle
- S.O. – Le médicament ne requiert pas un examen approfondi.
Partie 2 (Examen approfondi)
Exemple no 3 : Prix courant supérieur au prix de référence de la CPINT, sans CCT
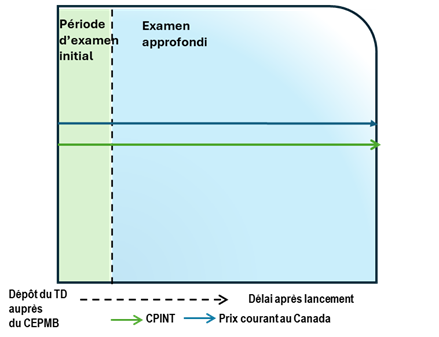
Figure - Version texte
Ce graphique illustre le cas où le prix courant canadien est supérieur au prix de référence de la CPINT, ce qui donne lieu à un examen approfondi. Le tableau est divisé en deux sections : la section verte pour la période d’examen initial des prix et la section bleue pour la période d’examen approfondi. La ligne bleue représente le prix courant canadien et la ligne verte représente la CPINT.
Situation
- Au cours de l’examen initial, le prix courant au Canada est supérieur au prix de référence de la CPINT. Il en résulte un examen approfondi.
Analyse
- Le déclenchement d’un examen approfondi donne lieu à un examen scientifique; cependant, il n’y a pas de critères de comparaison selon la catégorie thérapeutique et il n’est pas possible d’effectuer une CCT.
- Au cours de l’examen approfondi, il est observé que le prix courant au Canada reste supérieur au prix de référence de la CPINT, mais qu’aucune augmentation du prix courant n’est appliquée par le titulaire des droits.
- En l’absence de CCT et d’aucune augmentation du prix courant à comparer à l’indice des prix à la consommation (IPC), le seul facteur prévu au paragraphe 85(1) est la CPINT. Le personnel du CEPMB peut tenir compte de la différence entre le prix courant au Canada et le prix de référence de la CPINT, du nombre de pays ayant déclaré le prix du médicament, ainsi que de la fourchette de prix établis dans les différents pays du CEPMB11.
Recommandation potentielle
- Ce cas pourrait donner lieu à une recommandation de clôture de l’examen approfondi ou à un avis d’audience, en fonction du positionnement du prix courant au Canada par rapport à l’analyse plus complète du marché international.
Exemple no 4 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT inférieur à celui de la CPINT

Figure - Version texte
Ce graphique illustre le cas où le prix courant canadien est supérieur au prix de référence de la CPINT, ce qui donne lieu à un examen approfondi. Au cours de l’examen approfondi, la CCT est réalisée et son résultat est inférieur au prix courant et au prix de référence de la CPINT. Le tableau est divisé en deux sections : la section verte pour la période d’examen initial des prix et la section bleue pour la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente la CPINT et la ligne orange représente la CCT.
Situation
- Au cours de l’examen initial, le prix courant au Canada est supérieur au prix de référence de la CPINT. Il en résulte un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs médicaments de comparaison. Ce prix courant du médicament est supérieur au résultat de la CCT.
- Bien qu’aucune augmentation du prix courant n’ait été appliquée par le titulaire des droits, l’analyse suggère que le prix courant au Canada est supérieur à la fois au prix de référence de la CPINT et la CCT.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT (y compris le degré de comparabilité et le nombre de médicaments de comparaison), ainsi que de la différence entre le prix courant au Canada et le prix de référence de la CPINT, du nombre de pays où le prix du médicament a été déclaré et de la fourchette de prix établis par tous les pays du CEPMB11.
Recommandation potentielle
- Le prix courant au Canada étant supérieur au prix de référence de la CPINT et la CCT, il faudrait que le contexte particulier du cas par rapport à ces facteurs justifie le prix du médicament pour que le personnel du CEPMB recommande la clôture de cet examen approfondi. Il est plus probable que ce cas aboutisse à la recommandation d’un avis d’audience.
Exemple no 5 : Prix courant supérieur au prix de référence de la CPINT, avec résultat de la CCT supérieur à celui de la CPINT

Figure - Version texte
Ce graphique illustre le cas où le prix courant canadien est supérieur au prix de référence de la CPINT, ce qui donne lieu à un examen approfondi. Au cours de l’examen approfondi, la CCT est réalisée et son résultat est supérieur au prix courant et au prix de référence de la CPINT. Le tableau est divisé en deux sections : la section verte pour la période d’examen initial des prix et la section bleue pour la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente la CPINT et la ligne orange représente la CCT.
Situation
- Au cours de l’examen initial, le prix courant au Canada est supérieur au prix de référence de la CPINT. Il en résulte un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs médicaments de comparaison. Ce résultat de la CCT du médicament est supérieur au prix courant.
- Aucune augmentation du prix courant n’a été appliquée par le titulaire des droits, de sorte que le facteur de l’IPC n’est pas pris en compte.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT (y compris le degré de comparabilité et le nombre de médicaments de comparaison), ainsi que de la différence entre le prix courant au Canada et le prix de référence de la CPINT, du nombre de pays où le prix du médicament a été déclaré et de la fourchette de prix établis par tous les pays du CEPMB11.
Recommandation potentielle
- Étant donné que le prix courant au Canada est supérieur au prix de référence de la CPINT, mais inférieur à celui de la CCT, il faudrait tenir compte du contexte propre au cas par rapport à ces facteurs. Si la CCT présente un degré élevé de comparabilité, le personnel recommandera probablement la clôture de l’examen approfondi. Si la CCT présente un faible degré de comparabilité, le personnel recommandera probablement un avis d’audience.
Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec CCT

Figure - Version texte
Ce graphique illustre le cas où, après un certain temps sur le marché, le prix courant canadien augmente plus que l’IPC, ce qui donne lieu à un examen approfondi. Au cours de l’examen approfondi, la CCT est réalisée et son résultat est inférieur au prix courant et au prix de référence de la CPINT. Le tableau est divisé en deux sections : la section verte pour la période d’examen initial des prix et la période d’examen annuel précédant l’augmentation des prix et la section bleue pour la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente la CPINT et la ligne orange représente la CCT.
Situation
- Après un certain temps sur le marché, le prix courant augmente plus que l’IPC.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs médicaments de comparaison. Ce prix courant du médicament est supérieur au résultat de la CCT.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT (y compris le degré de comparabilité et le nombre de médicaments de comparaison), ainsi que de la différence entre le prix courant au Canada et le prix de référence de la CPINT, du nombre de pays où le prix du médicament a été déclaré et de la fourchette de prix établis par tous les pays du CEPMB11.
Recommandation potentielle
- Le prix courant au Canada est inférieur au prix de référence de la CPINT. Compte tenu de l’augmentation supérieure à l’IPC et de la CCT inférieure, il faudrait tenir compte du contexte propre au cas selon ces facteurs, y compris la différence entre le prix courant au Canada et la CPINT, l’ampleur de l’augmentation des prix et la comparabilité relative de la CCT.
- Lorsque la CCT se compose de médicaments comparables à haut degré, le personnel du CEPMB peut recommander un avis d’audience.
Exemple no 7 : Plainte, avec CCT

Figure - Version texte
Ce graphique illustre le cas où le prix courant canadien est inférieur au prix de référence de la CPINT et demeure inchangé. Après un certain temps sur le marché, une plainte est reçue, ce qui donne lieu à un examen approfondi. Au cours de l’examen approfondi, la CCT est réalisée et son résultat est inférieur au prix courant et au prix de référence de la CPINT. Le tableau est divisé en deux sections : la section verte pour la période d’examen initial des prix et la période d’examen annuel précédant la réception d’une plainte et la section bleue pour la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente la CPINT et la ligne orange représente la CCT.
Situation
- Au fil du temps sur le marché, le prix courant au Canada et la CPINT demeurent inchangés.
- Une plainte est reçue. Cela donnera lieu à un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs médicaments de comparaison. Ce prix courant du médicament est supérieur au résultat de la CCT.
- Le personnel doit prendre en compte la CCT, et la mettre en balance avec la CPINT, ainsi que le fait que le prix courant au Canada n’a pas changé. La recommandation du personnel dépendra fortement du contexte de la CCT et de l’ampleur de l’écart de prix.
Recommandation potentielle
- Dans une situation où la CPINT a beaucoup plus de poids que la CCT compte tenu du contexte, le personnel peut recommander que l’examen approfondi soit clôturé. Dans le cas contraire, le personnel peut recommander l’émission d’un avis d’audience.
Soumissions écrites
Soumissions écrites
Vous trouverez ci-dessous les sousmissions reçus par le CEPMB pendant la période de consultation.
Webinaire
Webinaire
Cette présentation a été faite lors du webinaire du 12 août 2024, fournissant des détails et des informations supplémentaires sur le guide de discussion.
Réunions virtuelles pour les intervenants
Réunions virtuelles pour les intervenants
En réponse aux demandes des intervenants, le CEPMB a invité tous ceux qui ont envoyé leurs commentaires à donner des détails sur leur soumission dans le cadre d’une série de réunions virtuelles, où les membres du Conseil ont demandé plus de renseignements. Le CEPMB remercie tous ceux qui ont participé.
Les membres du public intéressés ont été invités à voir les réunions, qui ont eu lieu les journées suivantes :
- Vendredi 20 septembre, de 13 h à 15 h
- Lundi 23 septembre, de 10 h à 12 h
- Mercredi 25 septembre, de 13 h à 15 h
- Mercredi 2 octobre, de 10 h à 12 h
- Mercredi 2 octobre, de 13 h à 15 h
Détails de la page
- Date de modification :
 Version PDF (2,2 Mo)
Version PDF (2,2 Mo)