Évaluation et Rapport de situation du COSEPAC sur le Caribou de Peary (Rangifer tarandus pearyi) au Canada 2015

- Table des matières
- COSEPAC - sommaire de l'évaluation - novembre 2015
- COSEPAC - résumé
- Résumé technique
- Préface
- Historique du COSEPAC
- Mandat du COSEPAC
- Composition du COSEPAC
- Définitions (2015)
- Description et importance de l'espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances des populations
- Menaces et facteurs limitatifs
- Protection, statuts et classifications
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique du ou des rédacteurs du rapport
- Collections examinées
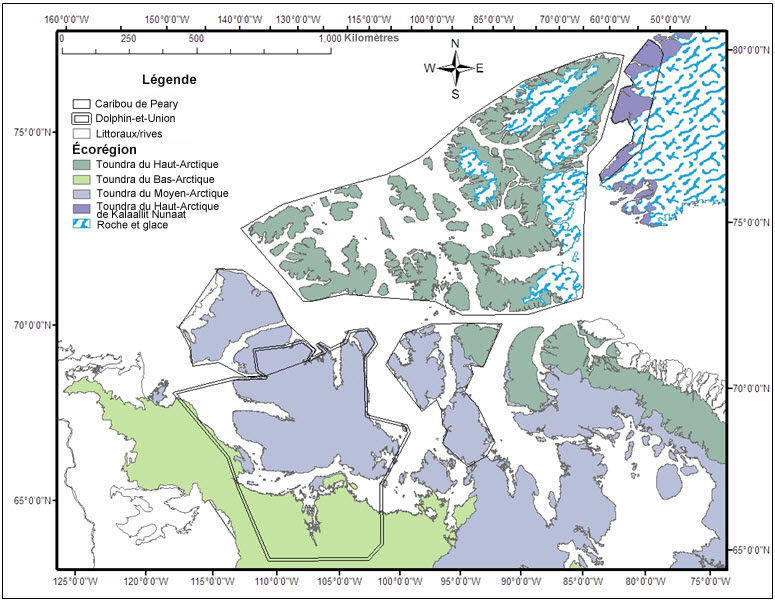
- Figure 1. Sous-populations de caribous de Peary (Johnson et al., en préparation; voir Structure des sous-populations; tableau 1). Le vert pâle et le mauve pâle indiquent des observations supplémentaires de caribous de Peary à l'extérieur de l'aire de répartition principale des sous-populations Banks-Victoria et Prince of Wales Somerset-Boothia, respectivement. .
- Figure 2. Renseignements des collectivités sur l'emplacement de l'habitat et les corridors de déplacement importants du caribou de Peary.
- Figure 3. Répartition du caribou de Peary (avec le polygone de la zone d'occurrence) selon les relevés les plus récents et les renseignements des collectivités.
- Figure 4. Écozones terrestres de l'archipel arctique (selon Olsen et al., 2001).
- Figure 5. Estimations des effectifs d'après divers relevés réalisés dans des îles pour quatre sous-populations de caribous de Peary : A) Banks–Victoria; B) Prince of Wales–Somerset–Boothia; C) est des îles Reine-Élisabeth; D) ouest des îles Reine-Élisabeth. Les estimations sont extrapolées des zones d'étude aux îles entières pour faciliter la comparaison d'une année à l'autre. Certaines estimations antérieures (en particulier pour l'OIRE) tiennent compte des faons. Les totaux ont été calculés seulement lorsque des estimations des effectifs étaient disponibles pour chaque île dans un groupe pour une année donnée. L'écart-type est fourni dans le cas de certains relevés à l'annexe 1.
- Figure 6. Potentiel de mise en valeur des ressources (y compris les routes et les voies de navigation) dans l'Arctique canadien.
- Figure 7. Parcs nationaux et autres aires protégées (p. ex. aires de gestion de la faune et refuges d'oiseaux migrateurs).
- Tableau 1. Groupes d'îles et îles connexes considérées pour chaque sous-population de caribous de Peary (modifiées à partir de Johnson et al., en préparation). Voir la figure 1 pour la carte connexe.
- Tableau 2. Résumé du nombre de relevés par sous-population de caribous de Peary, de 1961 à 2014. Source : Gunn et Poole (2014).
- Tableau 3. Estimations des effectifs et des tendances (sur 3 générations [27 ans] et sur 2 générations [18 ans]) de 4 sous-populations de caribous de Peary. Les données des relevés complètes se trouvent à l'annexe 1.
- Annexe 1 - estimations tirées des relevés et estimations corrigées
- Annexe 1A. Estimations tirées des relevés et estimations corrigées en fonction de la superficie pour la sous-population Banks–Victoria (adapté de Johnsonet al., en préparation).
- Annexe 1B. Estimations tirées des relevés et estimations corrigées en fonction de la superficie pour la sous-population Prince of Wales–Somerset–Boothia (adapté de Johnsonet al., en préparation).
- Annexe 1C. Estimations tirées des relevés et estimations corrigées en fonction de la superficie pour la sous-population de l'est des îles Reine-Élisabeth (adapté de Johnsonet al., en préparation).
- Annexe 1D. Estimations tirées des relevés et estimations corrigées en fonction de la superficie pour la sous-population de l'ouest des îles de la Reine-Élisabeth (adapté de Johnsonet al., en préparation).
- Annexe 2. Calculateur des menaces de l'UICN – caribou de Peary (UD 1).
COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada

COSEPAC
Comité sur la situation
des espèces en péril
au Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l'on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2015. Évaluation et Rapport de situation du COSEPAC sur le caribou de Peary (Rangifer tarandus pearyi) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xiii + 104 p. (Registre public des espèces en péril).
Rapport(s) précédent(s) :
COSEPAC. 2004. Évaluation et Rapport de situation du COSEPAC sur le caribou de Peary Rangifer tarandus pearyi et le caribou de la toundra Rangifer tarandus groenlandicus (population de Dolphin-et-Union) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada. Ottawa. xi + 101 p.).
Gunn, A., F.L. Miller et D.C. Thomas. 1979. COSEWIC status report on the Peary caribou Rangifer tarandus pearyi in Canada. Comité sur la situation des espèces menacées de disparition au Canada. Ottawa. 40 p.
Miller, F.L. 1991. Update COSEWIC status report on the Peary caribou Rangifer tarandus pearyi In Canada. Comité sur la situation des espèces menacées de disparition au Canada. Ottawa. 124 p.
Le COSEPAC remercie Lee Harding (SciWrite Environmental Services) d'avoir rédigé le rapport de situation sur le caribou de Peary (Rangifer tarandus pearyi) au Canada, aux termes d'un marché conclu avec Environnement Canada. La supervision et la révision du rapport ont été assurées par Justina Ray, coprésidente du Sous-comité de spécialistes des mammifères terrestres du COSEPAC
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel COSEPAC
Site Web COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Peary Caribou Rangifer tarandus pearyi in Canada.
Illustration/photo de la couverture :
Caribou de Peary -- Photo (caribou de Peary dans la péninsule Svartfjeld, île d'Ellesmere, 2015). Photo : Morgan Anderson, gouvernement du Nunavut.
Alétris farineux
Aletris farinosa
Le caribou de Peary est le plus petit caribou d'Amérique du Nord. Il est principalement blanc, mais son dos est gris foncé et le devant de ses pattes arbore une bande grise. En hiver, le gris foncé de son dos peut tourner au brun foncé, et certains individus semblent être presque entièrement blancs. Le velours de ses bois est de couleur grise plutôt que brune comme celui du chevreuil et des autres caribous. Comparativement aux bois des autres caribous, ceux du caribou de Peary sont de moindre envergure, mais, autrement, ils sont semblables. Son crâne présente un rostre court et une calotte crânienne développée. Ses sabots sont courts et larges. Le caribou de Peary se distingue des autres caribous du Canada sur le plan génétique.
Le caribou de Peary fait partie intégrante de la culture et de l'économie des Inuits et des Inuvialuits. En tant que seule source de viande de caribou pour plusieurs collectivités arctiques, il est important dans l'économie de subsistance des collectivités locales, et il est représenté dans les produits d'artisanat traditionnel qui sont commercialisés et collectionnés partout au Canada et à l'échelle internationale. Subsistant aux limites de l'existence des végétaux et des animaux, le caribou de Peary fait partie intégrante de la biodiversité arctique et est de plus en plus important dans les études scientifiques sur la réaction des écosystèmes aux changements climatiques.
Le caribou de Peary est endémique au Canada et présent dans les Territoires du Nord-Ouest et au Nunavut. Parmi tous les caribous d'Amérique du Nord, il est celui dont l'aire de répartition se trouve la plus au nord; en effet, sa présence est presque exclusive à l'archipel arctique canadien, à l'exception de l'île de Baffin. Le caribou de Peary parcourt des distances relativement longues, notamment des migrations annuelles sur la glace de mer, des déplacements réguliers au sein de son domaine vital comptant plusieurs îles, et des déplacements irréguliers à grande échelle parmi les îles pendant les hivers rigoureux. Quatre sous-populations sont reconnues selon des données génétiques probantes, l'ampleur des déplacements interinsulaires ainsi que l'expertise scientifique et locale :
- îles Banks et Victoria
- île Prince of Wales
- île Somerset et presqu'île de Boothia
- est des îles Reine-Élisabeth et
- ouest des îles Reine-Élisabeth.
L'habitat du caribou de Peary est la toundra arctique dépourvue d'arbres, principalement dans les écorégions de la toundra du Haut-Arctique et du Moyen-Arctique. La majeure partie de l'aire de répartition peut être caractérisée comme un désert polaire marqué d'étés courts et frais et d'hivers longs et froids. La saison de croissance est brève (de 50 à 60 jours) et variable. En général, la couverture de neige est présente de septembre à mai (île Banks) ou jusqu'aux dernières semaines de juin (île Melville). La couverture terrestre dominée par une végétation sèche représente environ 36 % de la zone dépourvue de glace de l'aire de répartition du caribou de Peary, tandis que le terrain va d'étendues relativement plates (sud et ouest) à montagneuses (nord et est). Le climat présente une forte variation régionale, avec des gradients est-ouest et nord-sud des précipitations et des températures, qui influe sur la productivité primaire et la disponibilité de nourriture. La biomasse végétale aérienne varie de moins de 100 g/m2 (îles Reine-Élisabeth et parties du groupement des îles Prince of Wales et Somerset) jusqu'à une quantité de 500 à 2 000 g/m2 dans certaines régions (île Banks et île Prince of Wales). Le caribou de Peary a un régime alimentaire diversifié et polyvalent, son alimentation variant selon les saisons, en fonction de la nourriture disponible et de la valeur nutritive connexe. Essentiellement, tout l'habitat historique du caribou de Peary est disponible et n'a pas été perdu ou fragmenté par des développements industriels ou autres développements anthropiques.
Le caribou de Peary s'est adapté de plusieurs façons à son environnement arctique, notamment en ayant un corps compact pour conserver la chaleur, des sabots qui lui permettent de marcher et de creuser dans la neige accumulée par le vent, et un pelage qui lui assure une capacité de camouflage. Il s'est adapté à la croissance limitée des végétaux, à la saison de croissance très courte et aux longues périodes où la végétation sur pied est gelée et couverte de neige.
Le caribou de Peary est une espèce polygyne qui vit en petits groupes et maintient une vaste dispersion dans le paysage, même pendant la mise bas et la saison du rut. On estime qu'il vit environ 15 ans à l'état sauvage, et il a des indices vitaux grandement variables. Les biches donnent habituellement naissance à leur premier faon vers l'âge de trois ans; dans des conditions de grande disponibilité de nourriture, elles peuvent mettre bas chaque année, mais cette situation est rare. Les femelles doivent occasionnellement composer avec des années d'accès restreint à de la nourriture, ce qui fait en sorte qu'elles ne se reproduisent pas ou qu'elles sèvrent leurs faons prématurément. La période intergénérationnelle (âge moyen des parents de la cohorte de l'année en cours) ne peut pas être calculée avec précision, mais elle est estimée à neuf ans.
Il est difficile d'évaluer les tendances des effectifs du caribou de Peary depuis que les premiers relevés ont été effectués dans les années 1960 en raison de la fréquence irrégulière des relevés (dans le temps et l'espace), ainsi que des changements apportés au plan et à la méthode de relevé. De 1961 à 2014, des organismes gouvernementaux ont effectué un total de 154 relevés aériens pour évaluer les effectifs du caribou de Peary dans l'ensemble de l'Arctique canadien. Il n'y a pas eu une seule année où toute l'aire de répartition a fait l'objet de relevés.
La population actuelle de caribous de Peary est évaluée à environ 13 200 individus matures. Au début des années 1960, lorsque le premier recensement de la population a été effectué, il y avait environ 50 000 caribous de Peary. En 1987, la population était d'environ 22 000 individus matures. Elle a atteint un creux en 1996, soit environ 5 400 individus, à la suite de mortalités massives liées à des épisodes de verglas qui ont particulièrement touché la sous-population de l'ouest des îles Reine-Élisabeth. Les chiffres ont augmenté depuis, mais la population ne s'est pas totalement rétablie. La sous-population Prince of Wales-Somerset-Boothia, qui composait presque la moitié de la population connue de caribous de Peary en 1987, a commencé à décliner dans les années 1980 pour des raisons qui demeurent incomprises. Bien que le dernier relevé ait été effectué en 2006, aucune donnée probante n'indique un rétablissement à ce jour. Les chiffres de Banks-Victoria augmentent depuis 10 ans, mais pas ceux de l'île Victoria. Les deux sous-populations du nord (est et ouest des îles Reine-Élisabeth) ont augmenté de manière générale depuis le milieu des années 1990, bien que les nifaons de référence ne soient pas bien connus. Le déclin global de la population de caribous de Peary sur 3 générations (27 ans) est évalué à 35 %, tandis que la tendance sur 2 générations est positive (environ 142 %).
L'impact global des menaces calculé est très élevé-moyen pour le caribou de Peary. Cette vaste plage d'intensité de l'impact des menaces découle de l'effet combiné du nombre élevé de menaces, dont l'impact est principalement faible, et de l'incertitude considérable, de l'imprévisibilité ainsi que du chevauchement et de l'interaction potentiels de la plupart des menaces individuelles.
La menace ayant le plus grand impact sur le caribou de Peary découle des diverses répercussions des changements climatiques, notamment l'intensité et la fréquence accrues des phénomènes météorologiques violents, qui nuisent à l'accessibilité à de la nourriture, ainsi que la diminution de l'étendue et de l'épaisseur de la glace de mer, qui cause des changements dans les habitudes de migration et de déplacement. La mesure dans laquelle de tels effets négatifs pourraient être annulés par des augmentations de la productivité végétale est incertaine. Parmi les autres menaces connues, présumées ou prévues qui ont ou auraient des répercussions négatives sur le succès reproducteur ou la survie du caribou de Peary en raison du réchauffement climatique figurent les agents pathogènes (particulièrement ceux des genres Brucella et Erysipelothrix) et l'augmentation du trafic maritime. Les menaces directes ayant un plus faible impact englobent la chasse, la production d'énergie, l'exploitation minière, les intrusions humaines découlant d'activités de travail (non touristiques), les exercices militaires effectués toute l'année, l'augmentation du trafic de motoneiges, d'hélicoptères et d'avions, la compétition avec le bœuf musqué et la pollution atmosphérique.
Dans le cadre de son évaluation la plus récente, soit en 2015, le COSEPAC a désigné le caribou de Peary « espèce menacée ». Le caribou de Peary figure actuellement à titre d'espèce en voie de disparition à l'<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a> de la Loi sur les espèces en péril (2011), et il a été inscrit comme espèce menacée aux termes de la Loi sur les espèces en péril (TNO) en 2013. Le caribou de Peary est cogéré au Nunavut aux termes de l'Accord sur les revendications territoriales du Nunavut, et dans les Territoires du Nord-Ouest, aux termes de la Convention définitive des Inuvialuit. L'Accord et la Convention confèrent le pouvoir principal de gestion des espèces sauvages au Conseil de gestion des ressources fauniques du Nunavut et au Conseil consultatif de gestion de la faune, respectivement.
| Durée d'une génération | 9 ans |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d'individus matures? | Non |
| Pourcentage estimé de déclin continu du nombre total d'individus matures sur deux générations | Augmentation globale d'environ 142 % |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d'augmentation] du nombre total d'individus matures au cours des trois dernières générations. | Déclin global d'environ 35 % |
| Pourcentage [prévu ou présumé] [de réduction ou d'augmentation] du nombre total d'individus matures au cours des trois prochaines générations. | Inconnu |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d'augmentation] du nombre total d'individus matures au cours de toute période de [trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé? | Non, en ce qui concerne les deux sous-populations en déclin |
| Y a-t-il des fluctuations extrêmes du nombre d'individus matures? | Non |
| Sujet | Information |
|---|---|
| Superficie estimée de la zone d'occurrence | 1 914 910 km2 |
| Indice de zone d'occupation (IZO, établi à partir d'une grille à carrés de 2 km de côté) | 366 384 km2 |
| La population totale est-elle gravement fragmentée? | Non |
| Nombre de localités (Voir « Définitions et abréviations » sur le site Web du COSEPAC et IUCN (février 2014) pour obtenir des précisions sur ce terme.) |
Inconnu, mais supérieur à 10 |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d'occurrence? | Non |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de l'indice de zone d'occupation? Déclin antérieur de la zone d'occupation en raison d'une quasi-disparition de la sous-population Prince of Wales-Somerset-Boothia. |
Non |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de (sous-)populations? Le nombre de sous-populations est stable, à moins qu'on ne confirme la disparition de la sous-population Prince of Wales-Somerset-Boothia. |
Possiblement |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localités? | Inconnu |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l'étendue ou la qualité] de l'habitat? On prévoit un déclin de la glace de mer, et les phénomènes météorologiques violents (dont la fréquence, et possiblement la gravité, devraient augmenter à certains endroits) pourraient entraîner une diminution de la qualité de l'habitat. Toutefois, la productivité de l'habitat pourrait accroître, particulièrement pour les deux sous-populations du nord. |
Possiblement |
| Y a-t-il des fluctuations extrêmes du nombre de populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? | Non |
| Y a-t-il des fluctuations extrêmes de la zone d'occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l'indice de zone d'occupation? | Non |
| Sujet | Information |
|---|---|
| Sous-populations (au moment du dernier relevé) | - |
| Banks-Victoria | ~2 250 |
| Prince of Wales-Somerset-Boothia | < 10 |
| Est des îles Reine-Élisabeth | ~ 3 000 |
| Ouest des îles Reine-Élisabeth | ~ 8 000 |
| Total (somme des relevés les plus récents) | ~13 200 |
| Sujet | Information |
|---|---|
| La probabilité de disparition de l'espèce à l'état sauvage est d'au moins [20 % sur 5 générations (= 54 ans), ou 10 % sur 100 ans] | S.O. |
A-t-on effectué un calcul des menaces pour cette espèce : Oui
Membres : Justina Ray (coprésidente SCS MT, modératrice), Dave Fraser (C.-B., modérateur), Dan Benoit (coprésident, Sous-comité des CTA), Suzanne Carriere (T.N.-O.), Nic Larter (T.N.-O.)
Spécialistes externes : Tracy Davison (T.N.-O.), Marsha Branigan (T.N.-O.), Joanna Wilson (T.N.-O.), Morgan Anderson (NU), Lisa-Marie LeClerc (NU), Andrew Maher (APC), Renee Wissink (APC), Peter Sinkins (APC), David Lee (NTI), Cheryl Johnson (EC), Agnes Richards (EC), Donna Bigelow (SCF), Dawn Andrews (SCF), Lisa Pirie (SCF), Anne Gunn (rédactrice du rapport sur la situation du caribou des toundras [UD 3]), Karla Letto (CGRFN), John Lucas (CCGF), Phillip Manik, père (Resolute Bay HTO), Peter Qayutinuak, père (Spence Bay HTA – Taloyoak), Issiac Elanik (Sachs Harbour HTC), Bradley Carpenter (Olohaktomiut HTC – Uluhaktok) Impact global des menaces : très élevé-moyen Impact moyen-élevé : changements climatiques : a) changements de l'habitat terrestre, disparition de la glace de mer, élévation du niveau de la mer et b) phénomènes météorologiques (pluie sur neige) violents (verglas). Impact faible-moyen : agents pathogènes, voies maritimes Impact faible : chasse, compétition (bœuf musqué) et prédation (loups), production d'énergie, exploitation minière, intrusions humaines découlant d'activités de travail (non touristiques), exercices militaires effectués toute l'année, trafic de motoneiges, d'hélicoptères et d'avions, et polluants atmosphériques.
| Sujet | Information |
|---|---|
| Situation des populations de l'extérieur | Aucune |
| Une immigration a-t-elle été constatée ou est-elle possible? | Non |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | S.O. |
| Y a-t-il suffisamment d'habitat disponible au Canada pour les individus immigrants? | S.O. |
| La possibilité d'une immigration depuis des populations externes existe-t-elle? | S.O. |
| Sujet | Information |
|---|---|
| L'information concernant l'espèce est-elle de nature délicate? | Non |
COSEPAC : La désignation initiale considérée comme une seule unité qui comprenait le caribou de Peary, Rangifer tarandus pearyi, et ce qu'on appelle aujourd'hui le caribou de Dolphin-et-Union, Rangifer tarandus groenlandicus. Cette unité a été désignée « menacée » en avril 1979. Division en 1991 pour permettre la désignation de trois populations distinctes : population de l'île Banks (en voie de disparition), population du haut Arctique (en voie de disparition) et population du bas Arctique (menacée). En mai 2004, les trois désignations de population ont été désactivées, et le caribou de Peary a été évalué séparément du caribou de Dolphin-et-Union, Rangifer tarandus groenlandicus. La sous-espèce pearyi est composée d'une partie de l'ancienne « population du bas Arctique » et de toutes les anciennes populations du « haut Arctique » et « de l'île Banks », et elle a été désignée « en voie de disparition » en mai 2004. Le caribou de Peary a été reconnu comme l'une des 12 unités désignables du caribou au Canada par le COSEPAC (2011).
Le présent rapport comporte des renseignements qui sont devenus accessibles après la dernière mise à jour du rapport de situation du COSEPAC (COSEWIC, 2004) sur le caribou de Peary (Rangifer tarandus pearyi). En 1991, avant l'adoption de la Loi sur les espèces en péril (LEP), on considérait que tous les caribous de l'ensemble de l'archipel arctique canadien, à l'exception de l'île de Baffin, étaient des caribous de Peary (Miller, 1991). En 2004, le COSEPAC a évalué deux entités :
- le caribou de Peary, qui englobait tous les caribous de l'archipel arctique, à l'exception de l'île de Baffin, ainsi que du centre et du sud de l'île Victoria et
- le caribou de Dolphin-et-Union, une population distincte sur le plan génétique qui occupe le reste de l'île Victoria et qui migre vers le continent à l'hiver en traversant le détroit de Dolphin-et-Union.
Le COSEPAC a entrepris une analyse de la structure des unités désignables (UD) du caribou au Canada en tant que projet spécial (COSEWIC, 2011) afin de définir les unités pour les futures évaluations et réévaluations de la situation de cette espèce, conformément aux dernières lignes directrices. La reconnaissance du caribou de Peary et du caribou de Dolphin-et-Union comme deux des 12 UD au Canada a été confirmée par ce projet spécial.
Contrairement au rapport du COSEPAC (COSEWIC, 2004), le présent rapport porte seulement sur le caribou de Peary. Depuis la dernière évaluation, des relevés ont été effectués dans les aires de répartition des quatre sous-populations de caribous de Peary afin de mettre à jour les données sur les effectifs et les tendances. Le relevé le plus important a été effectué dans l'est du Haut-Arctique, où les populations n'avaient pas fait l'objet de relevés depuis 1961. D'autres relevés aériens ont permis de clarifier ou de mettre à jour les tendances. De récentes analyses génétiques (MacFarlane et al., 2014) fondées sur l'ADN nucléaire (microsatellite) ont confirmé la distinction génétique du caribou de Peary des autres caribous, particulièrement son isolement et sa divergence par rapport au caribou de la toundra dans un passé relativement récent (fin du Pléistocène ou début de l'Holocène).
Les autres contributions importantes à cette mise à jour englobent :
- une évaluation de la cote de conservation du caribou de Peary (SARC, 2012), y compris les connaissances traditionnelles autochtones, effectuée par le gouvernement des Territoires du Nord-Ouest;
- des mises à jour des connaissances écologiques traditionnelles sur le caribou recueillies et résumées à partir de sources autochtones par le Sous-comité des connaissances traditionnelles autochtones (CTA) du COSEPAC.
En 2011, le caribou de Peary a été inscrit à la LEP en tant qu'espèce en voie de disparition, à la suite des résultats de la dernière évaluation effectuée par le COSEPAC en 2004. Environnement Canada élabore actuellement un programme de rétablissement du caribou de Peary (Environment Canada, en préparation). Le présent rapport repose sur des CTA (notamment Inuit Qaujimajatuqangit [IQ; connaissances traditionnelles inuites]), la compilation de données sur les populations, différentes cartes et d'autres données scientifiques recueillies dans le cadre de ce processus.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d'une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d'une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d'être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d'autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l'Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d'information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu'en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d'Environnement et Changement climatique Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Classe : Mammifères; Ordre : Artiodactyles; Famille : Cervidés; Sous-famille : Capréolinés
Nom scientifique : Rangifer tarandus pearyi Allen, 1902.
Noms communs : Caribou de Peary (français), Peary Caribou (anglais), Tuktu (pluriel : Tuktuk; Inuvialuktun), Tuktuinak (Inuinnaqtun), Tuktuaraaluit (Siglitun), Tuttunguluurat (Ummarmiutun).
Le caribou de Peary (voir la couverture) est une sous-espèce de caribou (Rangifer tarandus) qui est principalement restreinte à l'archipel arctique du Canada. Il a été décrit pour la première fois par Allen (1902) en tant que Rangifer pearyi, mais Flerov (1952) l'a réduit au rang de sous-espèce par la suite. Cette désignation a été retenue par Banfield (1961), qui a effectué la dernière révision taxinomique officielle de Rangifer, se fiant au compte rendu de Manning (1960) concernant le caribou de Peary, lequel était fondé sur un examen de 60 crânes, peaux et os de pattes.
En comparaison avec d'autres UD du caribou du Canada, le caribou de Peary a un pelage plus blanc à plus gris en toutes saisons. Son corps est plus petit, ses pattes et sa face sont plus courtes, ses sabots sont plus courts et larges, et le velours de ses bois est gris (Manning, 1960; Geist, 1998; Ekaluktutiak HTA, 2013; Gjoa Haven HTA, 2013; Spence Bay HTO, 2013). Son pelage est long, soyeux et blanc crème au début de l'hiver, devenant pelucheux et brunâtre sur le dos au printemps, lorsque des taches brun foncé apparaissent autour des yeux et sur le cou en raison de la mue. Son pelage d'été est d'un gris ardoise sur le dessus, parfois dépourvu d'une bande prononcée sur les flancs, et blanc sur le dessous; ses pattes sont blanches, à l'exception d'une mince bande sur le devant (voir Unités désignables).
Le caribou de Peary a été officiellement décrit en 1902 à partir de crânes et de peaux recueillis dans l'île d'Ellesmere et les îles avoisinantes (Allen, 1902, 1908). Le crâne présente un rostre court et pointu, mais la rangée de molaires est proportionnellement longue (Banfield, 1961; Manning et Macpherson, 1961). Manning (1960) a décrit une gradation de la taille et des proportions du crâne, ainsi qu'une augmentation de la taille à partir des îles du sud (Banks et Prince of Wales) jusqu'au nord des îles Reine-Élisabeth (IRE). Dans ces dernières, la taille a tendance à augmenter d'est en ouest et du nord au sud (Manning, 1960; Thomas et Everson, 1982). Des Inuits de Resolute Bay ont déclaré que les caractéristiques uniques du caribou de Peary deviennent plus prononcées dans les îles situées au nord de la région de l'île Bathurst (Taylor, 2005).
Thomas et Everson (1982) ont collaboré avec des chasseurs inuits à recueillir des mesures sur les caribous de l'ouest des îles Reine-Élisabeth (OIRE), de l'île Prince of Wales, de l'île Somerset et de la presqu'île de Boothia, et les échantillons ont servi ultérieurement à des analyses d'ADN (McFarlane et al., 2009; 2014). Les mesures du corps ont confirmé la gradation de la taille du crâne soulignée par Manning (1960). La longueur moyenne du corps variait de 146,1 ± 1,3 cm (é.-t.) (n = 27) chez les femelles de l'île Prince Patrick, la grande île la plus à l'ouest des IRE, à 152,9 ± 1,1 (é.-t.) cm (n = 25) chez les femelles de l'île Prince of Wales (Thomas et Everson, 1982; la série n'englobait pas les individus de l'est des îles Reine-Élisabeth [EIRE], de l'île Banks et du nord-ouest des îles Victoria). Des caribous au corps inhabituellement grand, qui, autrement, étaient semblables au caribou de Peary, ont fait l'objet de relevés dans l'île Prince of Wales en août 1958 et en 1978 (Manning et Macpherson, 1961; Thomas et Everson, 1982), et ont été nommés « ultra pearyi » (Manning et Macpherson, 1961) ou « super pearyi » (Banfield, 1961). Les mesures de ces sept mâles en 1958 étaient semblables à celles des cinq mâles au corps exceptionnellement grand de l'île Prince of Wales (Thomas et Everson, 1982).
Les caribous de l'Amérique du Nord ont été divisés en deux lignées au moyen d'analyses génétiques des séquences d'ADN mitochondrial (ADNmt). La lignée béringienne-eurasienne et la lignée nord-américaine ont chacune été nommées selon leurs sources ancestrales dans les refuges pléistocènes présumés (COSEWIC, 2011; Klütsch et al., 2012; Yannic et al., 2014). Le caribou de la toundra, le caribou de Peary et le caribou de Dolphin-et-Union font partie de la lignée béringienne-eurasienne. Après la dernière période glaciaire, soit lorsque les populations se sont élargies et ont colonisé (ou recolonisé) les terres nordiques, l'hybridation a entraîné une introgression des haplotypes de chaque groupe dans un autre groupe à une fréquence suffisamment faible pour laisser chaque lignée distincte et clairement séparable (Klütsch et al.,2012). Selon Eger et al. (2009), des analyses de l'ADNmt tendaient à confirmer l'existence de deux refuges pendant la dernière période glaciaire : l'île Banks et le Haut-Arctique. Le refuge du Haut-Arctique était représenté par les caribous de l'île Bathurst, qui étaient isolés des autres caribous de Peary. Au sein de la lignée béringienne-eurasienne, les profils d'ADNmt ne se sont pas différenciés d'une sous-espèce à l'autre (Eger et al., 2009).
Une analyse génétique fondée sur l'ADN nucléaire (microsatellite), quant à elle, corrobore l'affirmation selon laquelle le caribou de Peary se distingue génétiquement des autres UD du caribou, notamment les UD de Dolphin-et-Union et de la toundra (COSEWIC, 2011; McFarlane et al., 2014). Serrouya et al. (2012) ont utilisé des caribous de Peary de l'île Bathurst (n = 20) et des caribous de Dolphin-et-Union (n = 43), ainsi que 2 hardes de caribous de la toundra comme groupes externes dans leur examen du caribou des montagnes. Ils ont observé que le caribou de Peary constituait un clade distinct avec une différenciation importante (FST = 0,07) de son plus proche voisin (caribou de Dolphin-et-Union). McFarlane et al. (2009) ont analysé l'ADN nucléaire de spécimens des îles Melville, Banks, Victoria (nord-ouest), Bathurst et Prince of Wales. McFarlane et al. (2014) ont également inclus les plus anciens spécimens disponibles du caribou de Peary (1914-1958) ainsi que des échantillons contemporains, pour examiner, plus particulièrement, la relation des caribous « ultra-pearyi » prélevés dans l'île Prince of Wales en 1958. Les mâles de la « ultra-pearyi »ne se distinguaient pas génétiquement des autres caribous de Peary, ce qui porte à croire qu'ils ne constituaient pas une forme hybride entre le caribou de la toundra et le caribou de Peary, et que la grande taille de leur corps était probablement attribuable aux conditions environnementales.
La fréquence allélique globale différait de manière importante parmi les points d'échantillonnage appuyant la structure des sous-populations. La diversité la plus faible (hétérozygotie et diversité allélique) se trouvait chez les caribous habitant l'île Melville, la région de l'île Bathurst ainsi que les îles Prince of Wales et Somerset, notamment les échantillons prélevés dans l'île Prince of Wales en 1958. La variabilité était inférieure à celle de l'île Banks et de la presqu'île de Boothia, ou du caribou de Dolphin-et-Union et du caribou de la toundra (McFarlane et al., 2009, 2014). La diversité génétique la plus faible reflète probablement les réductions périodiques des effectifs, même si les échantillons anciens et contemporains ne se distinguaient pas les uns des autres. Les caribous de Peary du nord de l'île d'Ellesmere présentaient également une faible variabilité, ce qui indique souvent un goulot d'étranglement génétique antérieur (Petersen et al., 2010).
La vaste répartition du caribou de Peary au sein de bon nombre d'îles et de milieux a mené à la proposition de diverses itérations d'unités aux fins de gestion. Le COSEPAC (Miller, 1991) a accordé une désignation de statut distincte à quatre groupes d'îles de l'aire de répartition du caribou de Peary, tandis qu'en 2004, il a séparé le caribou de Peary du caribou de Dolphin-et-Union aux fins de désignation de statut, tout en reconnaissant la même structure des sous-populations de caribous de Peary. Cette structure n'a pas été entièrement appuyée par des analyses génétiques ultérieures. Des travaux préliminaires ont permis de cerner une différenciation génétique importante parmi les échantillons prélevés dans diverses îles (McFarlane et al., 2009), mais un échantillonnage plus large et l'utilisation d'une analyse bayésienne qui ne se fonde pas sur l'emplacement des échantillons pour regrouper les animaux ont appuyé la présence de deux groupes :
- les îles Prince of Wales, Somerset et Reine-Élisabeth, et
- la presqu'île de Boothia, le caribou de Dolphin-et-Union et le caribou de la toundra.
Les spécimens de l'île Banks et du nord-ouest de l'île Victoria n'ont pas été assignés fortement à l'un des groupes. Toutefois, des comparaisons par paires ont révélé d'importantes différences entre les sites d'échantillonnage (McFarlane et al., 2014). Les analyses ont également révélé un fondement génétique de la gradation latitudinale des mesures morphologiques.
Un examen des renseignements des des chercheurs et des collectivités issus du processus de planification du rétablissement de la LEP (Johnson et al., en préparation) a utilisé trois sources de données pour définir les sous-populations de caribous de Peary :
- les analyses génétiques;
- l'étendue des déplacements interinsulaires, selon des connaissances locales et des données télémétriques limitées;
- les avis d'experts scientifiques et locaux.
La structure spatiale utilisée dans le présent rapport renvoie aux sous-populations habitant des îles ou des régions d'îles qui présentent des emplacements définis de relevés et des renseignements sur le cycle vital.
Il existe probablement un flux génique restreint entre, d'une part, les caribous des îles Banks et Victoria, et, d'autre part, ceux du reste de l'aire de répartition du caribou de Peary. Zittlau et al. (2009) ont conclu que les échantillons de l'île Banks et de l'inlet Minto (nord-ouest de l'île Victoria) n'étaient pas considérablement différents, et, la plupart du temps (58 et 33 %, respectivement), ils pouvaient être assignés à l'un ou l'autre des groupes. Ces échantillons présentaient une faible assignation à d'autres échantillons, ce qui laisse croire à un certain degré d'isolement (Zittlau et al., 2009).
| Sous-population | Groupe d'îles | Îles |
|---|---|---|
| Banks-Victoria | Îles Banks et Victoria | Îles Banks et Victoria |
| Prince of Wales-Somerset-Boothia | Îles Prince of Wales et Somerset, presqu'île de Boothia | Îles Prince of Wales, Somerset, Russell, King William, Pandora, Prescott, Vivian et Lock, presqu'île de Boothia |
| Ouest des îles Reine-Élisabeth | Groupe de l'île Bathurst | Complexe de l'île Bathurst (îles Cameron, Vanier, Marc, Massey, Alexander et Bathurst), île Cornwallis, île Little Cornwallis et île Helena |
| Ouest des îles Reine-Élisabeth | Groupe de l'île Melville | Îles Melville, Prince Patrick, Eglinton, Emerald et de Byam Martin |
| Ouest des îles Reine-Élisabeth | Groupe de l'île Devon | Îles Devon, Baillie Hamilton, Coburg, Dundas/Margaret et North Kent |
| Ouest des îles Reine-Élisabeth | Groupe des îles des Premiers ministres | Îles Mackenzie King, Brock et Borden |
| Ouest des îles Reine-Élisabeth | Groupe des îles Ringnes | Ellef Ringnes, Amund Ringnes, Cornwall, King Christian, Meighen et Lougheed |
| Est des îles Reine-Élisabeth | Île d'Ellesmere | Îles d'Ellesmere, Graham et Buckingham |
| Est des îles Reine-Élisabeth | Île Axel Heiberg | Îles Axel Heiberg, Stor et Hevod |
D'après des données scientifiques et les CTA des Inuvialuits, avant 1980 environ, soit lorsque les effectifs étaient encore relativement élevés, les caribous de Peary effectuaient des déplacements saisonniers entre l'île Banks et le nord-ouest de l'île Victoria, et c'est pourquoi les individus habitant dans ces deux îles ont été reconnus comme une sous-population par le COSEPAC (COSEWIC, 2004). Par exemple, plusieurs relevés aériens effectués depuis 1982, en plus de suivis plus récents par satellite, n'ont pas permis de prouver de tels déplacements, et les chasseurs inuits n'ont signalé aucune preuve de déplacement dans la dernière décennie (Paulatuk HTC, 2013).
Les déplacements de femelles munies de colliers émetteurs à transmission par satellite effectués entre 1987 et 1989 (Gunn et Fournier, 2000) et entre 1996 et 2006 (Poole et al., 2010; ENR, données inédites, 2011, cité dans SARC, 2012) indiquaient une séparation spatiale et temporelle de la sous-population de caribous de Peary du nord-ouest de l'île Victoria par rapport aux caribous de Dolphin-et-Union. Même si des études de télémétrie indiquaient que les caribous de Peary femelles se limitaient principalement à la zone située au nord et à l'ouest d'une ligne tracée entre l'inlet Minto et la baie Wynniatt, les CTA des Inuvialuits révèlent qu'elles peuvent (quoique rarement) se trouver au sud, jusqu'à l'inlet Admiralty, et à l'est, jusqu'à la rivière Kagloryuak (CTA, dans Poole et al., 2010;SARC, 2012; figure 1). Les Inuvialuits d'Ulukhaktok et les Inuits de Cambridge Bay reconnaissent deux types de caribous dans l'île Victoria, caribous dont la taille, la couleur et le goût sont différents : ceux qui se trouvent dans le nord-ouest (caribous de Peary) et les autres, qui passent l'été dans les parties du centre, du sud et de l'est (caribous de Dolphin-et-Union; Elias, 1993; Gunn et al., 2011). Les Inuits de l'île Victoria se souviennent de caribous migrateurs et non migrateurs dans l'île Victoria avant les années 1920 (Manning, 1960; SARC, 2013).

Description longue de la figure 1
Carte illustrant l'aire de répartition de chacune des quatre sous-populations de caribous de Peary (Banks-Victoria, Prince of Wales-Somerset-Boothia, ouest des îles Reine-Élisabeth, et est des îles Reine-Élisabeth). L'emplacement des autres observations de caribous de Peary à l'extérieur de l'aire de répartition principale des sous-populations Banks-Victoria et Prince of Wales-Somerset-Boothia est également indiqué.
Les données sur les déplacements et les observations des collectivités portent à croire que le complexe des îles Prince of Wales et Somerset servait de sous-population interinsulaire comptant, au même moment, de nombreux caribous qui migraient, selon les saisons, entre les îles et la presqu'île de Boothia (Johnson et al., en préparation). Par exemple, des déplacements d'est en ouest à grande échelle (comprenant des centaines de caribous) se sont produits entre les aires d'hivernage de l'île Somerset et les aires d'estivage et de mise bas des îles Prince of Wales et Russell ainsi que de leurs îles satellites, comme Pandora, Prescott, Vivian et Lock. Ce ne sont pas tous les individus qui ont pris part à ces déplacements, et l'utilisation des diverses îles variait selon les années (Miller, 1990, 1991, 1995,1997a; Miller et al. 2005a, 2007a, b). La presqu'île de Boothia faisait également partie de l'aire d'hivernage, et des aires de mise bas ont également été trouvées dans l'île Somerset. On a également répertorié une migration printanière du sud-est (presqu'île de Boothia/île Somerset) vers le nord-ouest (îles Prince of Wales/Somerset), puis un retour à travers le détroit de Peel gelé à l'automne (Gunn et Decker, 1984; Gunn et Dragon, 1998; Miller et al., 2005a; Gjoa Haven HTA, 2013; Spence Bay HTO, 2013). Certains déplacements d'un très petit nombre de caribous ont été effectués du nord au sud, entre l'île Prince of Wales et les îles Mecham, Russell, Hamilton, Young et Lowther avoisinantes dans le détroit de Barrow; ces déplacements ont été présumés à partir de pistes sur la glace de mer et de la densité changeante des caribous sur les petites îles. Après des recherches exhaustives de caribous ou de pistes de caribous à travers le détroit de Barrow jusqu'aux îles Bathurst et Cornwallis ou jusqu'à l'île Little Cornwallis, effectuées par hélicoptère entre 1977 et 1980, Miller (1990) a conclu qu'aucun déplacement régulier à grande échelle n'a été effectué entre le groupe Prince of Wales-Somerset et le groupe des IRE, même si des traverses occasionnelles ont pu avoir lieu et ont été signalées par des chasseurs à Resolute Bay (CWS, 2015).
Des mesures du crâne et du corps (Thomas et Everson, 1982) et des observations (Gunn et Decker, 1984; Miller et al., 2007b) ont confirmé la présence du caribou de Peary et du caribou de la toundra sur la presqu'île de Boothia. Le suivi par satellite de cinq femelles en 1991 et en 1992 a démontré que le caribou de Peary et le caribou de la toundra mettaient tous deux bas sur les côtes est et ouest du nord de la presqu'île de Boothia, respectivement, mais ne maintenaient pas de séparation spatiale pendant la saison du rut (saison de reproduction; Gunn et al., 2000a), laissant croire à une certaine possibilité de croisements occasionnels.
Le statut et les effectifs des sous-espèces du caribou dans l'île King William et d'autres îles près de la presqu'île de Boothia sont incertains. Les mentions historiques du caribou dans l'île King William font référence à la migration saisonnière du caribou de la toundra à partir de la presqu'île Adelaide (résumées à l'annexe G, Gunn et al., 2000a). Des chasseurs de Gjoa Haven ont signalé que certains caribous se sont déplacés de l'île Prince of Wales à l'île King William au début ou vers la moitié des années 1970 (J. Keanik comm. pers., cité dans Gunn et Dragon, 1998). Miller (1991) a cité la communication personnelle de Gunn de 1989, qui indiquait qu'il n'y avait que quelques caribous « semblables au caribou de Peary » à cet endroit en 1989, et que des chasseurs inuits avaient vu à la fois des caribous semblables au caribou de Peary et des caribous de la toundra. Groves et Mallek (2011) ont consigné 204 ± 115 caribous adultes dans l'île King William en 2009 dans le cadre de relevés des oiseaux migrateurs, mais n'ont pas établi une distinction plus poussée. Dans la présente évaluation, ces caribous sont inclus en tant que membres de la sous-population Prince of Wales-Somerset-Boothia pour les besoins du calcul de la zone d'occurrence, mais ne sont pas inclus dans les estimations des effectifs des sous-populations.
L'OIRE est composé de cinq complexes d'îles dans lesquels se trouvent plusieurs petits groupes d'îles et où le caribou effectue des déplacements saisonniers interinsulaires et réguliers ( tableau 1 ) : le groupe de l'île Bathurst, le groupe de l'île Melville, le groupe de l'île Devon, le groupe des îles des Premiers ministres, et le groupe de l'île Ringnes. La division de l'OIRE et de l'EIRE a été modifiée à partir de Miller et al. (2005 b), à la suite de renseignements concernant les déplacements interinsulaires obtenus récemment grâce aux rencontres communautaires et aux opinions d'experts (figure 2; Johnson et al., en préparation).
Macpherson (1961) a été le premier à formuler l'hypothèse concernant des déplacements à grande échelle au sein du groupe d'îles des Premiers ministres, selon ses observations et celles de Stefansson (1921) de la fluctuation du nombre de caribous. Tener (1963) a confirmé les déplacements interinsulaires après avoir observé des pistes de caribous depuis l'île Mackenzie King jusqu'à l'île Borden. De nombreux caribous du complexe Melville-Prince Patrick passent l'hiver dans l'île Prince Patrick et, au printemps, se déplacent vers les îles Eglinton, Emerald, Melville et Byam Martin pour y passer l'été (Miller et al., 1977a). Des déplacements interinsulaires saisonniers sont également connus au sein du complexe de l'île Bathurst grâce à des observations et à des caribous munis de colliers émetteurs (Miller, 1990, 1995a, 2002; Poole et al., 2015). Ces tendances sont validées par des renseignements fournis par les collectivités (figure 2; Johnson et al., en préparation).
Miller et al. (2005 b) estimaient que l'EIRE comptait 14 îles d'une superficie de plus de 130 km2 chacune, y compris les îles d'Ellesmere et Axel Heiberg, et celles dans les groupes d'îles Ringnes et Devon. Johnson et al. (en préparation) ont modifié cette division pour y inclure les îles Axel Heiberg (notamment les îles Stor et Hevod) et d'Ellesmere seulement, après avoir obtenu de plus amples renseignements techniques et communautaires, assignant le reste à l'OIRE. Environ 95 500 km2 ou 39 % de la zone de terre des îles d'Ellesmere et Axel Heiberg sont couverts de calottes glaciaires et de champs enneigés en permanence. Des déplacements interinsulaires sont probablement effectués, mais sont peu décrits. Selon des CTA, il existerait une migration hivernale sur la glace de mer entre le sud de l'île d'Ellesmere et les îles Smith et Cone (Taylor, 2005).
Certaines différences d'habitat viennent à leur tour appuyer la division entre l'OIRE et l'EIRE. Plus précisément, il existe certaines différences entre la géomorphologie, les types de végétation et le climat, qui partagent une classification commune dans l'écozone de la Cordillère arctique (liée aux calottes glaciaires) et l'écorégion des montagnes d'Ellesmere au sein de l'écozone du Haut-Arctique (Ecological Stratification Working Group, 1996). Les données probantes à l'appui de la délimitation de cette zone comme une sous-population étaient moindres à celles des trois autres unités démographiques (Johnson et al., en préparation).
Le COSEPAC (2011) reconnaissait la sous-espèce du caribou de Peary avec toutes ses sous-populations comme l'une des 11 UD du caribou existantes. Des mesures de la divergence génétique entre le caribou de Peary et le caribou de la toundra sur le continent, et également entre le caribou de Peary et le caribou de Dolphin-et-Union, corroborent le caractère distinct du caribou de Peary, et ce, en dépit des chevauchements occasionnels de leur répartition annuelle. De nouvelles données génétiques obtenues depuis la publication du rapport sur les UD réaffirment la nature unique du caribou de Peary (McFarlane et al., 2014). Des spécialisations morphologiques reflètent les adaptations aux environnements arctiques (p. ex. une face et des pattes plus courtes) (Banfield, 1961). Les comportements uniques englobent l'utilisation de plusieurs îles comme domaine vital par certaines sous-populations (voir Structure spatiale et variabilité de la population), et le fait de ne pas former de grands rassemblements après la mise bas, contrairement au caribou de la toundra (Festa-Bianchet et al., 2011).

Description longue de la figure 2
Carte illustrant l'emplacement de l'habitat et des corridors de déplacement importants, y compris les traversées maritimes, du caribou de Peary, selon les renseignements obtenus des collectivités nordiques.
Les peuples de l'Arctique canadien chassent le caribou depuis plus de 4 000 ans (Manseau et al., 2004). Le caribou de Peary est important dans l'économie de subsistance des collectivités où il est présent, et il fait partie intégrante de la culture des Inuits et des Inuvialuits. Il constitue la seule source de viande de caribou pour plusieurs collectivités arctiques. Il est fréquemment représenté dans l'art des Inuits et des Inuvialuits, et leurs bois tombés sont sculptés pour produire de l'artisanat traditionnel. Persistant aux limites de l'existence de végétaux et d'animaux, le caribou de Peary fait partie intégrante de l'écologie et de la biodiversité de l'Arctique. Il peut être une proie importante pour les loups (Canis lupus), et il est de plus en plus important dans l'étude de la réaction des écosystèmes aux changements climatiques. Le caribou de Peary est un symbole important des îles de l'Arctique canadien.
L'aire de répartition du caribou de Peary se trouve entièrement au Canada, à l'exception possible d'animaux au Groenland. Anderson (1946) a suggéré que les caribous présents depuis le nord-ouest du Groenland jusqu'au nord du bassin Kane pourraient être des caribous de Peary, et Banfield (1961) en a convenu. Miller (1991), citant Meldgaard (1986) qui a résumé des rapports d'Inuits du Groenland, a confirmé que de petits caribous, possiblement des migrants du Canada, étaient régulièrement observés et capturés par des chasseurs au Groenland. Les Inuits ont indiqué que, normalement, jusqu'à 10 (mais occasionnellement plus de 100) individus étaient tués chaque année et que des pistes de caribous étaient souvent observées entre l'île d'Ellesmere et le Groenland. Roby et al. (1984) ont effectué des relevés dans la région de la baie Inglefield et du bassin Kane et n'ont aperçu aucun caribou vivant, mais ils ont découvert une mandibule de caribou dans le nord-ouest du Groenland (baie Renssalaer, au nord de Cape Inglefield et sur le bord sud du bassin Kane), qui était d'une longueur de 178 mm, ce qui « …n'entre pas dans la plage de mesures du caribou de la toundra canadienne [c'est-à-dire qu'elle est plus petite]... la mandibule appartenait probablement à un spécimen du caribou de Peary » [traduction]. Ils ont également examiné l'historique des déclins du caribou dans cette région en raison de temps violent et d'une chasse excessive. Il semble donc probable que les caribous du bassin Kane appartenaient au R. t. pearyi, mais qu'ils sont maintenant disparus du Groenland, bien que quelques individus puissent rarement traverser à partir de l'île d'Ellesmere (Taylor, 2005).
Parmi tous les caribous de l'Amérique du Nord, le caribou de Peary est celui dont l'aire de répartition est la plus septentrionale (figure 1; Festa-Bianchet et al., 2011). Il se rencontre dans l'ensemble de l'archipel arctique, à l'exception de l'île de Baffin (qui est occupée par le caribou de la toundra). Le caribou de Peary est également présent dans le nord-ouest de l'île Victoria, et certains éléments indiquent des déplacements vers d'autres parties de cette île. Un petit nombre de caribous se trouvent (ou se trouvaient) sur la presqu'île de Boothia et possiblement dans l'île King William (voir Structure des sous-populations). Le caribou de Peary se disperse à travers la mer de glace, occasionnellement ou dans le cadre de déplacements saisonniers, et pourrait se trouver sur n'importe quelle île, bien que ce ne soit pas la totalité des petites îles qui compte des habitants toute l'année.
Les relevés de populations étant habituellement effectués au printemps et à l'été en raison de la durée du jour, la répartition hivernale est moins bien documentée. Toutefois, des renseignements récemment recueillis dans le contexte de la planification du rétablissement dirigée par Environnement Canada indiquent une répartition à plus grande échelle que celle rapportée par le COSEPAC (COSEWIC 2004). Des membres de Cambridge Bay ont signalé que le caribou de Peary a été observé toute l'année sur l'ensemble de l'île Victoria, quoiqu'en petits nombres (Ekaluktutiak HTA, 2013). Il a été aperçu à l'occasion sur le continent dans deux principales régions : pointe Pearce et presqu'île de Parry (Paulatuk HTC, 2013). Il a été vu près de Cambridge Bay et sur le continent, près de Kugluktuk (Ekaluktutiak HTA, 2013). Sur le continent, les observations les plus à l'ouest ont été faites (Banfield, 1961; Manning et Macpherson, 1958; Youngman, 1975) à Old Crow (Yukon), dans l'île Herschel (Yukon), dans l'île Baillie (Territoires du Nord-Ouest) et au cap Dalhousie (Territoires du Nord-Ouest) au début des années 1950; ces observations ont été liées à des années de verglas dans l'île Banks.
La zone d'occurrence du caribou de Peary est de 1 914 910 km2 en territoire canadien selon la méthode du plus petit polygone convexe, comme l'indique la figure 3 (carte et calculs de la zone effectués par D. Andrews, Environnement Canada). L'indice de zone d'occupation (calculé à partir d'une grille à carrés de 2 km de côté), tel que défini par des données d'observation obtenues par des relevés seulement (Johnson et al., en préparation), est de 91 465 carrés, soit 366 384 km2 (D. Andrews, Environnement Canada, in litt.).
Le polygone de la zone d'occurrence englobe toutes les observations de caribous, selon le relevé le plus récent pour chaque île (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>) combiné aux renseignements des collectivités (voir Statut et tendances des populations).

Description longue de la figure 3
Carte illustrant l'aire de répartition du caribou de Peary dans un polygone de zone d'occurrence, selon des relevés scientifiques récents et des renseignements obtenus des collectivités nordiques.
L'île Banks est l'île de l'archipel arctique canadien située la plus à l'ouest, et sa superficie est d'environ 71 000 km2. Des données historiques indiquent que le caribou de Peary occupe pratiquement toute l'île, au moins de manière saisonnière (Nagy et al., 1996). Selon la répartition déterminée par un relevé estival effectué dans les années 1980, les caribous de Peary étaient les plus nombreux dans le nord-ouest et l'est de l'île, et certains individus se trouvaient à l'extrémité sud (Nagy et al., 1996, figure 4.). Pendant les années 1990, le nombre de caribous a atteint un creux. Le relevé effectué à l'été 1998 indiquait que les caribous étaient le plus nombreux dans le nord-ouest et le long de la côte ouest; aucun caribou n'a été trouvé à l'extrémité sud, et quelques individus ont été observés du côté est (Nagy et al., 2013a). Le nombre de caribous a augmenté depuis les années 1990; en effet, le relevé le plus récent indiquait une répartition plus élargie dans l'île, bien que la plupart des occurrences demeurent concentrées dans le nord-ouest (Davison et al., 2014).
Le caribou de Peary occupe une superficie d'environ 36 000 km2 depuis le nord-ouest de l'île Victoria jusqu'au nord de l'inlet Minto (Nagy et al., 2009b). Malgré la fluctuation du nombre de caribous de Peary, ceux-ci ont toujours occupé le nord-ouest de l'île, qui, selon la télémesure satellitaire, demeure séparé de la zone abritant des caribous de Dolphin-et-Union (Davison et Williams, 2013).
Les îles Prince of Wales et Somerset couvrent une superficie de plus de 58 000 km2 et, selon des données historiques (Gunn et Decker, 1984; Miller et Kiliaan, 1981; Gunn et Dragon, 1998), elles étaient pratiquement toutes occupées, au moins selon les saisons, lorsque les populations étaient élevées dans les années 1960 et 1970. Les migrations annuelles au sein de cette sous-population sont bien documentées par les collectivités (Gjoa Haven HTA, 2013; Resolute HTO, 2013; Sachs Harbour HTC, 2013; Spence Bay HTO, 2013). Par exemple, entre 1977 et 1980, les pistes de caribous à travers la glace de mer menaient effectivement à ces deux îles principales, à plusieurs îles satellites et à la partie nord de la presqu'île de Boothia (voir ci-dessous) pour la majeure partie de chaque année, ce qui fait que ce complexe représentait essentiellement une seule aire de répartition de plus de 93 000 km2 (Miller et al., 2005b).
Le caribou a essentiellement disparu de la presqu'île de Boothia vers les années 1940 (résumé dans Gunn et Ashevak, 1990) avant de l'occuper de nouveau pendant les années 1980, selon des données obtenues pendant le premier relevé aérien effectué en 1973 (Fischer et Duncan, 1976). Bien que le caribou de Peary et le caribou de la toundra y soient tous deux présents, la proportion de chacun n'a pas été quantifiée dans le cadre des relevés aériens. La plupart des caribous de Peary habitaient dans la presqu'île de Boothia, au nord de Taloyoak, mais certains d'entre eux migraient, selon les saisons, de l'île Somerset ou Prince of Wales à l'automne, et vice versa au printemps (Gunn et Ashevak, 1990). Le nombre de caribous de cette sous-population a une fois de plus décliné pour atteindre un niveau très faible (voir Fluctuations et tendances).
L'OIRE couvre une superficie d'environ 180 000 km2; les plus grandes îles sont Melville (42 776 km2) et Devon (38 764 km2), suivies de l'île Prince Patrick (16 316 km2) et de l'île Bathurst (16 042 km2). La majeure partie de la zone de terre (à l'exception de l'île Devon) présente une élévation de moins de 300 m (Miller et al., 2005a), et la majorité constitue de l'habitat utilisable, non couvert par des glaciers. La nature sporadique des relevés et le caractère peu documenté des CTA restreignent les tendances connues en matière de répartition principalement à celles qui ont cours l'été. Certaines données indiquent que le caribou de Peary a tendance à ne pas utiliser les petites îles en période d'abondance réduite (Miller et al., 1977a). Par exemple, même si des données sur le caribou de Peary ont été consignées systématiquement dans les îles Brock, Eglinton et Emerald en 1961, de 1972 à 1974 et de 1987 à 1988, le caribou de Peary n'a pas été observé en 1997 (Gunn et Dragon, 2002), soit lorsque les effectifs étaient très faibles dans la région. Sa présence a été confirmée de nouveau en 2012 (Davison et Williams, 2012) et coïncidait avec une hausse démographique (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
Le complexe de l'île Bathurst et les îles avoisinantes ont fait l'objet des travaux de relevés les plus importants dans l'OIRE, dont les données recueillies couvrent une période de 50 ans. Ces données présentent un aperçu de la répartition spatiale du caribou selon les saisons et pendant des périodes d'effectif faible et élevé de la population (Poole et al., 2015).
Les deux plus grandes îles qui constituent cette sous-population couvrent une superficie d'environ 240 000 km2. Contrairement à l'OIRE, la majeure partie de la région se trouve à une élévation de plus de 300 m et est couverte de glaciers et de calottes glaciaires, ce qui la rend donc inutilisable par le caribou de Peary. Des relevés récents (Jenkins et al., 2011; Anderson et al., 2014; Anderson et Kingsley, 2015) ont indiqué la présence du caribou de Peary dans toutes les zones non couvertes de glaciers des îles d'Ellesmere et Axel Heiberg.
La répartition du caribou de Peary est connue grâce aux relevés aériens qui ont couvert la plupart des îles, ainsi qu'aux connaissances locales et traditionnelles, obtenues principalement par l'entremise de la chasse.
Dans les zones accessibles à partir des huit collectivités inuites et inuvialuites établies au sein de l'aire de répartition du caribou de Peary (figures 1-3), bon nombre de familles et de chasseurs, trappeurs et pêcheurs des collectivités inuites et inuvialuites passent des semaines ou des mois, en toutes saisons, en expédition. L'adoption généralisée des motoneiges depuis les années 1970 ou l'utilisation d'avions de brousse pour joindre des campements éloignés a permis aux chasseurs de couvrir une plus grande distance à la recherche de caribous ou de bœufs musqués (Ovibos moschatus) (Condon, 1996). Dans les régions que les gens visitent régulièrement, les compétences particulières nécessaires à la poursuite des traditions culturelles entraînent un niveau global de sensibilisation élevé à la répartition, à la densité et à la condition du caribou et d'autres espèces sauvages (c.f. Dumond, 2007; SARC, 2012, 2013).
Des renseignements propres à la gestion des espèces sauvages sont également communiqués dans les réunions d'associations locales de chasseurs et de trappeurs, ainsi qu'entre elles et les conseils régionaux de gestion des ressources fauniques. De cette façon les connaissances sur la situation, les déplacements et les conditions des espèces sauvages sont accumulées et diffusées au sein des villages et d'un village à l'autre. Les habitants des villages éloignés sont donc au courant des activités relatives aux espèces sauvages qui se déroulent dans l'ensemble des territoires et au-delà de ceux-ci. De telles connaissances pourraient être comprises, interprétées et communiquées de diverses façons par différentes personnes, mais elles deviennent néanmoins des connaissances partagées par les collectivités.
Les tendances de répartition du caribou de Peary sont moins connues dans les régions éloignées des collectivités. La plupart des observations fortuites du caribou de Peary découlent de voyages de chasse (SARC, 2012; SCF, 2013). La fréquence des expéditions de chasse diminue également. Par exemple, moins de chasseurs de Sachs Harbour et d'Ulukhaktok chassent le caribou que par le passé (Condon, 1996; Collings et Condon, 1996; Nagy, 1999; Pearce et al., 2011), et l'incertitude entourant les conditions de neige et de glace fait en sorte que les familles préfèrent voyager le long de la côte plutôt qu'à l'intérieur des terres (Riedlinger, 2001). Les résidents de Cambridge Bay ont souligné dans des réunions communautaires que les déplacements vers le nord de l'île Victoria sont peu courants (Ekaluktutiak HTA, 2013). De manière semblable, les résidents de Gjoa Haven ne se rendent pas assez fréquemment aux îles Prince of Wales, Matty et Tennet pour être en mesure de dire à quel moment les caribous s'y trouvent ou connaître le degré de variation de leur nombre au fil du temps (Gjoa Haven HTA, 2013). Des membres de Sachs Harbour ont indiqué qu'en raison des changements apportés aux pratiques de chasse les gens ne passent plus de longues périodes à se déplacer sur les terres de l'île Banks à la recherche de caribous, et que, maintenant, ils s'aventurent rarement à plus de 50 miles au nord de la ville (Sachs Harbour HTC, 2013).
Les activités de recherche visant à mesurer la répartition spatiale au sein de chacune des quatre sous-populations sont également fondées sur les relevés aériens de chaque île. La fréquence et la couverture de ces relevés ont grandement varié depuis les premiers relevés systématiques effectués en 1961 (voir Activités et méthodes d'échantillonnage; tableau 2 ). Il est toutefois improbable qu'il existe des régions non explorées dans l'aire de répartition du caribou de Peary, étant donné les activités systématiques réalisées et l'étendue de la couverture en général. Néanmoins, la répartition et la taille de la plupart des sous-populations au fil du temps ne sont pas bien connues, et même la répartition actuelle est inconnue dans certaines parties de l'aire de répartition.
Le caribou de Peary vit principalement dans la toundra du Haut-Arctique et du Moyen-Arctique (Olson et al., 2001; figure 4).
Le climat de l'aire de répartition du caribou de Peary est variable et violent, et imprévisible; les étés sont courts et frais, et les hivers, longs et froids. La saison de croissance (de la sortie de la dormance jusqu'à la coloration de 50 % des feuilles) est relativement fixée à une durée de 50 à 60 jours chez les espèces végétales (Svoboda, 1977). En général, la couverture de neige est présente de septembre à mai (île Banks) ou jusqu'aux dernières semaines de juin (île Melville) (SARC, 2012).
Les données sur le climat ne sont fournies que par huit stations météorologiques dispersées dans l'ensemble de l'aire de répartition du caribou de Peary, et elles sont toutes côtières. Par conséquent, elles sont plus représentatives des conditions sur les IRE que de celles des grandes zones de terre des îles Banks et Victoria. Par exemple, les températures estivales de l'intérieur de l'île Banks peuvent être supérieures de 10 oC à celles consignées par la station météorologique de Sachs Harbour (N. Larter, comm. pers., 2015).
Description longue de la figure 4
Carte illustrant l'emplacement des écozones terrestres de l'archipel arctique en lien avec les aires de répartition du caribou de Peary et du caribou de Dolphin-et-Union. Le caribou de Peary vit principalement dans la toundra du Haut-Arctique et du Moyen-Arctique.
Depuis 1980, des données climatiques spatiales sont accessibles à l'échelle de ½ degré de latitude par 2/3 de degré de longitude à partir de l'ensemble de données Modern Era Retrospective Analysis for Research and Applications (MERRA). Les données de MERRA de 1980 à 2014 pour les îles ou les groupes d'îles occupés par le caribou de Peary montrent les fluctuations des variables climatiques dans l'ensemble de l'aire de répartition du caribou de Peary grâce aux gradients est-ouest et nord-sud; il y a également un degré élevé de variabilité annuelle, qui change selon les régions (Russell et al., 2013). Par exemple, comparativement à l'île Banks, l'île Bathurst compte moins de degrés-jours de croissance (DJC) cumulatifs (la température de base sous laquelle la croissance des végétaux est nulle) inférieurs à 0 en juin et en juillet (230 ± 20,0 [é.-t.] par rapport à 557 ± 34,0 [é.-t.]). Ce résultat s'explique le mieux par l'emplacement plus au nord de l'île, mais également par sa masse terrestre plus petite et son littoral bien défini. Dans l'île Bathurst, le début de croissance des végétaux est également plus tardif (différence moyenne parfois décuplée le 15 juin) et caractérisé par une variabilité annuelle plus élevée que sur l'île Banks.
Le climat des îles arctiques est fortement régionalisé, avec des gradients est-ouest et nord-sud pour les précipitations et les températures en raison de l'influence des masses d'air du Pacifique dans l'ouest et des masses d'air de l'Atlantique dans l'est (Maxwell, 1981). Ces intrusions sont périodiquement à l'origine de la hausse des températures pendant les tempêtes de neige, qui entraîne du verglas et rend la neige dense et épaisse (Rennert et al., 2009). Les oscillations décennales de la pression atmosphérique dans le nord de l'Atlantique et le nord du Pacifique compliquent l'analyse des tendances météorologiques. La diversité spatiale des régimes climatiques dans l'ensemble de l'aire de répartition du caribou de Peary crée une grande diversité de types de végétation, ce qui a une incidence sur la façon dont chaque sous-population réagit à la variation du climat.
Les terres dominées par une végétation sèche couvrent environ 36 % de la superficie libre de glace de l'aire de répartition du caribou de Peary. La biomasse des végétaux aériens s'étend de moins de 100 g/m2 dans la majeure partie des IRE et certaines zones du groupe Prince of Wales-Somerset, tandis que certaines zones des îles Banks et Prince of Wales comptent de 500 à 2 000 g/m2 (Gould et al., 2003). La productivité primaire nette est de 0 à 50 g/m2/an dans la grande majorité de l'aire de répartition du caribou de Peary, et de 150 à 250 g/m2/an, sur des parties des îles Banks et Victoria (Gould et al., 2003). L'île Banks possède la plus grande superficie présentant une biomasse végétale élevée (plus de 1 000 g/m2), un vaste couvert arbustif et une forte productivité primaire parmi toutes les aires de répartition des sous-populations de caribous de Peary (Gould et al., 2003).
Le pergélisol est continu partout, et seule une mince couche active (~40 cm; Callaghan et al., 2005) fond pendant l'été, ce qui limite la végétation dominante à des vivaces florifères, comme les saxifrages (Saxifraga spp.), le pavot arctique (Papaver radicatum), le silène acaule (Silene acaulis), les pédiculaires (Pedicularis spp.) et l'oxyrie de montagne (Oxyria digyna), ainsi qu'à des mousses, des joncs, des graminées, des carex et des arbustes nains (p. ex. Salix spp. et Dryas spp.).
Le caribou de Peary utilise une grande variété de milieux et se rencontre le plus couramment dans le désert polaire et la toundra de hautes terres qui sont mésiques-xériques et qui comportent un couvert végétal clairsemé à modéré en altitude intermédiaire et haute (Parker et Ross, 1976; Wilkinson et al., 1976; Miller et al., 1977a, b; Russell et al., 1978; SARC, 2012). Dans l'OIRE, Thomas et al. (1999) ont indiqué que le caribou de Peary n'utilisait ou ne choisissait pas les milieux dotés présentant le plus de couvert végétal et de cultures sur pied. La dernière étude démontrait que la densité des boulettes fécales du caribou à l'été était plus grande dans les crêtes des hautes terres à végétation clairsemée où les lichens, les saules, les luzules (Luzula spp.), le pavot arctique et la stellaire à longs pédicelles (Stellaria longipes) étaient relativement abondants. Les sites d'alimentation hivernaux étaient habituellement caractérisés par une grande abondance d'espèces de Luzula et de lichens.
Des études sur la disponibilité de nourriture, les cultures sur pied, la biomasse, la productivité primaire au-dessus du sol et l'abondance d'espèces ou de groupes de végétaux ont été effectuées pendant les périodes sans neige (Larter et Nagy, 2001a; Gould et al., 2003; Larter et Nagy, 2003). En général, ces études indiquaient qu'il y avait plus de nourriture ou de biomasse végétale disponibles que nécessaire pour une nutrition adéquate, même s'il est possible qu'ils ne soient pas accessibles en hiver en raison des conditions de neige.
Les faibles densités de caribous de Peary, la taille relativement petite de leurs groupes et leur mobilité pendant qu'ils s'alimentent empêchent habituellement la surutilisation des sites d'alimentation malgré la productivité faible qui caractérise de telles zones (p. ex. Parker, 1978; Miller et Kiliaan, 1981). Malheureusement, comme l'ont indiqué Miller et al. (1977 a:46), il n'existe aucune mesure quantitative de la condition des aires de répartition liée aux déclins du caribou de Peary, et cette lacune dans les connaissances persiste. De manière globale, des études ont laissé entendre que, même s'il est possible que la disponibilité de nourriture ne limite pas les populations de caribous de Peary, de grandes densités pourraient, en théorie, affecter la végétation et créer une compétition entre les herbivores dans certaines conditions. Seules des recherches limitées ont été effectuées sur les liens entre l'alimentation et les conditions de neige en ce qui concerne la dynamique des sous-populations (Larter et Nagy, 2000a, 2001 b), et ces recherches n'ont pas été effectuées pendant toutes les phases d'effectifs élevés et faibles au sein de toutes les sous-populations (Tyler, 2010; mais voir ci-dessous en ce qui concerne l'île Banks).
L'accumulation d'énergie pendant la courte saison de croissance des végétaux est importante pour le caribou de Peary, car elle peut assurer une bonne condition physique pour le reste de l'année. Elle nécessite un certain degré d'adaptation comportementale pour permettre aux animaux de réagir à la variation de la disponibilité de nourriture. La plupart des éléments prouvant cette capacité d'adaptation proviennent du Svalbard, un groupe d'îles du Haut-Arctique situé au nord de la Norvège, où le renne du Svalbard (Rangifer platyrhynchus) augmente ses déplacements quand la glace au sol restreint la disponibilité de nourriture (Meland, 2014). Le renne du Svalbard fait un choix entre qualité des aliments et quantité d'aliments en fonction des changements de l'abondance des lichens et des mousses/graminoïdes ainsi que des stratégies d'évitement des parasites (Van der Wal, 2006).
Le régime alimentaire du caribou de Peary a été relativement bien étudié dans l'ouest de l'Arctique (Shank et al., 1978; Thomas et Kroeger, 1980; Thomas et Edmonds, 1983; Larter et Nagy, 1997; Lenart et al., 2002). Le caribou de Peary a un vaste régime alimentaire polyvalent qui varie en fonction des saisons, selon la nourriture disponible et la valeur nutritive connexe.
Le régime alimentaire dans l'île Banks a été décrit lorsque le nombre de caribous de Peary connaissait une augmentation (Shank et al., 1978) et une diminution (Larter et Nagy, 1997), dans un contexte où il y avait chevauchement avec le régime alimentaire du bœuf musqué. Thomas et Kroeger (1980) ont examiné la digestibilité des aliments en été et en hiver en étudiant les caribous de l'île Prince of Wales. La digestibilité des carex était plus grande en hiver qu'en été, celle de la thamnolie vermiculaire (Thamnolia vermicularis) était de 18 % en été, comparativement à 62 % en hiver, et celle des mousses était plus élevée en été qu'en hiver. Thomas et Edmonds (1983) ont produit un rapport sur le régime alimentaire en fin d'hiver depuis l'OIRE jusqu'aux îles Prince of Wales et Somerset. Dans cette étude, les lichens représentaient de 2 à 15 % du régime, tandis que les carex et les mousses représentaient respectivement de 15 à 57 % et de 13 à 58 %. En été, le caribou choisit des aliments riches en protéines digestibles en se nourrissant de fleurs, particulièrement celles de la saxifrage à feuilles opposées (Saxifraga oppositifolia), des pédiculaires et du pavot arctique (Parker et Ross, 1976; Parker, 1978), et il se nourrit grandement de feuilles de saule dans les îles Melville et Axel Heiberg. Pendant les hivers inhabituellement rudes, le caribou est restreint à un régime composé de nourriture grandement indigeste, comme les rameaux de saule, ce qui peut mener à la malnutrition (Parker, 1978).
Des mesures liées au régime alimentaire ont indiqué que les lichens composent une proportion relativement faible de l'alimentation hivernale et estivale chez le caribou de Peary, contrairement au caribou de la toundra (revu par Wilkinson et Shank, 1974; Miller, 1998; Larter et Nagy, 2004). Par exemple, dans une étude effectuée dans l'île Banks, les lichens étaient d'une importance mineure dans le régime alimentaire, probablement en raison de leur faible disponibilité (cultures sur pied = 2,96 g/m2), tandis que les carex, les saules, les légumes (Astragalus spp. et Oxytropis spp.) et la dryade à feuilles entières (Dryas integrifolia) prédominaient (Larter et Nagy, 1997; Larter et Nagy, 2004). Les connaissances traditionnelles des Inuvialuits révèlent que le caribou de Peary mange des lichens (genres Cladina et Cladonia), connus largement sous le nom de « tuktut niqait » (« tuttut niqingi » en dialecte uummarmiutun), c'est-à-dire « nourriture de caribou »; de la flavocétraire nivéale (Flavocetraria nivalis) et de la thamnolie vermiculaire, connue sous les noms de « aqiarungat » et de « akeagonak »; divers types de lichens saxicoles, connus généralement sous le nom de « qaviut » (Bandringa, 2010). L'aire d'hivernage du caribou est souvent liée à l'abondance du Cetraria delisei et de la thamnolie vermiculaire, des lichens crustacés et des graminées (p. ex. le vulpin boréal [Alopecurus alpinus]) et des joncs (p. ex. le jonc à deux glumes [Juncus biglumis]). Sur l'est de l'île Melville, Thomas et al. (1999) ont découvert que la quantité de lichens dans le régime alimentaire hivernal du caribou de Peary dépendait des conditions de neige; en effet, les lichens étaient moins présents dans le régime alimentaire pendant les années où la neige était plus dense et dure.
La faible proportion de lichens dans le régime alimentaire mesurée à partir d'échantillons du rumen ou de boulettes fécales pourrait refléter le fait que les lichens sont plus rares dans l'aire de répartition du caribou de Peary que dans les aires de répartition d'autres caribous (Thomas et al., 1999; Russell et al., 1978). Une raison probable est que les substrats sous-jacents sont principalement alcalins et défavorables aux lichens. Un parallèle possible pourrait être la faible présence des lichens sur le Svalbard, où la végétation a changé à la suite du broutage par les rennes de 1978 à 2013, passant de lichens à un mélange de mousses et de graminoïdes plus productif et résilient (van der Waal et al., 2001; Ronning, 2014). Toutefois, dans les endroits où le renne a connu un déclin, les lichens fruticuleux se sont rétablis après une période de 100 à 200 ans (van der Waal et al., 2001).
Le caribou de Peary se nourrit habituellement en marchant, plutôt qu'en restant sur place comme le fait le bœuf musqué (COSEWIC, 2004, et références citées dans ce document). Le caribou peut se déplacer de trois à quatre km en moyenne par heure tout en se nourrissant activement (Miller et al., 1982). Dans des conditions idéales, soit lorsque la neige est molle et relativement peu épaisse, le caribou se nourrit en poussant simplement la neige avec son nez pour dégager la végétation. À mesure que la densité de la neige augmente, il creuse de petits cratères dispersés, contrairement au bœuf musqué et au caribou de la toundra, dont les groupes créent souvent de grandes zones de cratères. Lorsque la couverture de neige devient trop dure et dense, le caribou de Peary cherche de la nourriture sur les sites sans neige ou les sites ayant seulement une couverture de neige peu épaisse (p. ex. les régions exposées et balayées par le vent). Pendant l'hiver, dans l'île Banks, il se nourrit souvent en creusant dans la neige des habitats de hautes terres (hautes terres stériles, toundra bosselée et toundra rocheuse), où la neige est plus molle et moins épaisse que dans les prés humides (Larter et Nagy, 2001 b).
Pratiquement tout l'habitat historique du caribou de Peary est disponible et n'a pas été perdu ou fragmenté par des développements industriels ou d'autres développements anthropiques. Il y a peu d'habitat potentiel actuellement inoccupé, autre que le groupe d'îles Prince of Wales-Somerset et la presqu'île de Boothia.
Aux rencontres d'information des collectivités tenues dans le cadre des rencontres d'Environnement Canada sur le rétablissement, des membres de l'organisation de chasseurs et de trappeurs de Cambridge Bay (2013) ont affirmé craindre que des activités antérieures aient nui à l'habitat du caribou. Des membres des collectivités de Gjoa Haven, de Grise Fiord et de Resolute Bay ont également formulé de multiples commentaires sur des activités d'exploration antérieures qui ont laissé des sites contaminés et des bidons d'essence (Gjoa Haven HTA, 2013; Iviq HTA, 2013; Resolute Bay HTO, 2013).
Dans un contexte de changements climatiques, des changements (p. ex. changements de la végétation [productivité et croissance des arbustes] et conditions de neige) se sont déjà produits dans l'habitat du caribou de Peary (SARC, 2012), et il est prévu que le rythme de ces changements augmente (voir Menaces – Changements climatiques).
Les caribous et les rennes sont polygynes (voir par exemple Holand et al., 2007), mais on en connaît peu sur le système de reproduction du caribou de Peary (Petersen et al., 2010). La petite taille typique des groupes de caribous de Peary (Tener, 1963; Miller et al., 1982; Nagy et al., 1996) laisse croire à un système semblable à un harem.
Le caribou de Peary a des indices vitaux très variables. De 1970 à 2010, la productivité (proportion de femelles avec petits) dans l'OIRE a varié de 0 à 88 %, et dans l'île Banks, de 3 à 33 % (SARC, 2012). Le taux de survie hivernale des petits dans l'île Banks de 1991 à 1999 est passé de 23 à 86 % (SARC, 2012). Il existe généralement peu d'information sur le rapport entre les sexes chez les adultes, tout comme sur la longévité et l'âge à la dernière reproduction. Selon les CTA, les femelles ayant une bonne condition physique peuvent mettre bas chaque année une fois la maturité sexuelle atteinte (de 2 à 4 ans), mais les chasseurs n'ont pas observé de fœtus chez les femelles récoltées après des hivers rigoureux (SARC, 2012, et références citées dans ce document).
On ne possède pas d'information à propos de la durée d'une génération pour cette espèce. Le COSEPAC (COSEWIC, 2004) a estimé une durée intergénérationnelle de 7 ans pour le caribou de Peary, mais aucune justification n'a été fournie; cette durée a été adoptée par le Comité sur les espèces en péril des Territoires du Nord-Ouest (SARC, 2012) aux fins de l'évaluation du caribou de Peary dans les Territoires du Nord-Ouest. Les femelles peuvent vivre jusqu'à 15 ans dans la nature (SARC, 2012). Elles seraient fécondes toute leur vie adulte (au moins 13 ans, l'âge maximal échantillonné; Thomas et al., 1976), même si la sénescence a été observée chez des rennes de 7 à 11,5 ans (voir par exemple Weladji et al., 2010). Ainsi, l'âge médian des parents pourrait être de 8,5 à 9,5 ans. Étant donné la définition de la durée d'une génération de l'UICN, c'est-à-dire l'âge moyen des parents dans la cohorte actuelle, et compte tenu du taux de roulement des individus reproducteurs dans une population (IUCN, 2014), la durée d'une génération chez le caribou de Peary a été établie à 9 ans aux fins de la présente évaluation.
Le caribou de Peary est adapté à la croissance limitée des plantes, à la saison de croissance très restreinte et aux longues périodes où la végétation sur pied est gelée et couverte de neige (voir Habitat).
Malgré la faible différenciation génétique, on croit que les différences comportementales et morphologiques entre le caribou de Peary et le caribou de la toundra résultent de la forte pression sélective dans leur environnement de l'Extrême-Arctique (Manning, 1961). Des extrémités corporelles plus petites réduisent la surface exposée et la perte de chaleur. Il est donc possible que la valeur adaptative du museau plus petit et plus large du caribou de Peary puisse également prévenir la perte de chaleur tout en permettant la conservation d'une rangée de dents molariformes assez longue pour se nourrir efficacement.
Tener (1963) et d'autres auteurs ont noté, chez le caribou de Peary, une petite taille des groupes (généralement 12 individus ou moins) ainsi que des rassemblements très dispersés, contrairement au caribou de la toundra (dont les hardes comptent souvent 1 000 individus et plus). La taille des groupes augmente légèrement avant la mise bas, se stabilise ou diminue durant la période de la mise bas, avant d'augmenter dans les rassemblements post-mise bas, lorsque les caribous se déplacent des zones côtières vers les terres intérieures (Nagy et al., 1996). Cependant, « rassemblement post-mise bas » est un terme relatif puisque les groupes sont formés de dizaines d'individus, et non de centaines ou de milliers d'individus comme c'est le cas chez le caribou de la toundra. Les mécanismes sous-jacents peuvent différer; la petite taille des groupes et leur dispersion pourraient constituer une adaptation à un milieu où les plantes fourragères sont peu nombreuses et clairsemées (comparativement aux aires de répartition du caribou sur le continent), pour éviter la prédation et/ou le harcèlement des insectes.
La biomasse de plantes fourragères de certains habitats du caribou de Peary (p. ex. île Banks; Larter et Nagy, 2001a) et la prévalence relativement faible des moustiques et des hypodermes, qui permettent un broutage ininterrompu (Gunn et Skogland, 1997), peuvent permettre une accumulation substantielle de graisse. L'accumulation de réserves de graisse durant l'été et l'automne est essentielle à la survie et à la reproduction lors d'hivers rigoureux (Thomas, 1982; Nagy et al., 1996).
Le caribou de Peary se déplace sur des distances relativement longues, y compris durant les migrations annuelles sur la glace de mer, les déplacements réguliers dans son domaine vital constitué de plusieurs îles ainsi que les déplacements irréguliers à grande échelle entre les îles lors d'hivers rigoureux (voir Structure spatiale et variabilité de la population; figure 3).
Les îles de l'archipel arctique canadien sont entourées de glace pendant au moins 9 mois de l'année (Miller et al., 2005b); le caribou de Peary effectue la plupart de ses déplacements interinsulaires lors de la période où la banquise côtière présente les meilleures qualité et concentration, ce qui correspond à la période de déplacement vers les aires hivernales et printanières/estivales (Jenkins et Lecomte, 2012). Cependant, on a également observé des caribous de Peary qui nageaient entre les îles lors de déplacements saisonniers (Miller, 1995a).
Il existe de nombreuses mentions de caribous de Peary traversant la glace de mer lors de migrations saisonnières entre les îles et entre le continent et les îles de l'Arctique. Il ne s'agit pas nécessairement de corridors de migration utilisés habituellement, mais plutôt de larges zones de migration que les individus utilisent pour se déplacer des aires d'hivernage vers les aires de mise bas et les aires d'estivage (Miller et al., 2005b). Par exemple, Miller et al. (2005 b) ont noté 73 sites de traverse regroupant 850 pistes de caribous de Peary dans le nord-est du détroit de Franklin (entre la presqu'île de Boothia et l'île Prince of Wales) et le détroit de Peel (entre les îles Somerset et Prince of Wales) en 3 ans (de 1977 à 1980). Ces traverses étaient relativement bien réparties, peu importe la longueur de la glace de mer à traverser ou de l'élévation des points de départ ou d'arrivée de la traverse. Certains signes appuient également l'hypothèse d'une répartition forcée durant les hivers caractérisés par des épisodes de verglas ou des chutes de neige supérieures à la normale (voir SARC, 2012).
On en sait peu sur la dispersion, mais des analyses de l'ADNmt ont montré une faible fréquence de la dispersion unidirectionnelle récente (au cours des dernières générations), de l'OIRE vers l'île Banks, le nord-ouest de l'île Victoria et les îles Prince of Wales et Somerset, ainsi que des îles Prince of Wales et Somerset vers l'île Banks et la péninsule de Boothia (McFarlane et al., 2014).
On est grandement préoccupé, notamment à l'échelle des collectivités locales, par les relations interspécifiques entre le bœuf musqué et le caribou de Peary. Les CTA et les connaissances des collectivités locales ont mis l'accent sur cette question (voir SARC, 2012). Les Inuits de Resolute Bay et de Grise Fiord ont mentionné qu'une grande abondance de bœufs musqués est souvent suivie d'un déclin de la population de caribous dans une zone spécifique (Taylor, 2005). Lors des rencontres d'Environnement Canada sur le rétablissement du caribou de Peary, les participants des collectivités ont signalé la compétition avec le bœuf musqué comme une menace importante pesant sur le caribou de Peary, comme le montreraient des signes d'évincement du caribou par le bœuf musqué ou des tendances démographiques contrastantes (Olohaktomiut HTC, 2013; Paulatuk HTC, 2013; Spence Bay HTO, 2013).
Par le passé, dans l'île Banks, dans le nord-ouest de l'île Victoria et dans les îles Prince of Wales et Somerset, les effectifs du caribou de Peary et du bœuf musqué affichaient des tendances opposées (Gunn et al., 1991; Gunn et Dragon, 1998; Nagy et al., 2009e; Davison et al., 2013). À la fin des années 1980, parallèlement à un déclin important du caribou de Peary dans l'île Somerset, les chasseurs ont noté que les zones précédemment occupées par l'espèce étaient maintenant utilisées par le bœuf musqué (cité dans Taylor, 2005). Des déclins récents associés à des maladies du bœuf musqué dans les îles Banks et Victoria (Kutz et al., 2015) n'ont pas été accompagnés d'une augmentation aussi rapide du nombre de caribous de Peary que par le passé (voir Menaces et facteurs limitatifs). La bactérie isolée et jugée responsable de la maladie chez le bœuf musqué est un généraliste qui pourrait également infecter le caribou; cependant, son rôle dans la dynamique de la population actuelle de caribous de Peary n'a pas été approfondi. Des déclins parallèles du bœuf musqué et du caribou de Peary sont également observés, par exemple, dans l'OIRE, mais il y a des différences relatives aux taux de rétablissement (Miller et al., 1977b; Gunn et Dragon, 1998; Anderson, 2014). Des phénomènes météorologiques jouent souvent un rôle dans ces déclins concomitants.
Les commentaires fréquents formulés dans les registres de CTA des Inuvialuits (voir par exemple Peter Esau, cité dans Berger, 1976) laissent croire que le caribou de Peary et le bœuf musqué sont en compétition pour la nourriture. Cependant, Parker (1978) a conclu que, lors d'hivers aux conditions de neige moyennes dans l'île Bathurst, il n'y a pas de compétition interspécifique entre les deux espèces. Il laisse toutefois penser qu'il pourrait y avoir de la compétition lors d'hivers rigoureux puisque les deux espèces cherchaient des saules sur des pentes et des crêtes exposées. Une analyse rétrospective de l'hiver rigoureux de 1973-1974, qui a tué de nombreux individus des deux espèces dans l'île Bathurst, donne à penser qu'il n'y avait pas de compétition interspécifique parce que les densités des boulettes fécales des deux espèces montraient une association négative et que les relations avec certaines espèces fourragères contrastaient de façon importante (Thomas et al., 1999).
Des chercheurs se fondent largement sur la comparaison de l'utilisation de l'habitat ou du chevauchement des sites d'alimentation des deux espèces pour évaluer indirectement la compétition. Dans l'île Banks, Wilkinson et Shank (1974) ainsi que Vincent et Gunn (1981) n'ont trouvé aucun signe de compétition pour la nourriture ou l'espace entre les deux espèces. Par contre, au fur et à mesure de l'augmentation du nombre de bœufs musqués dans les années 1990, des études ont révélé que l'alimentation des deux espèces se chevauchait (Larter et Nagy, 1997, 2004). Cela . La possibilité d'une compétition apparente dans certaines conditions ne peut cependant pas être exclue. Selon Jenkins (2006), il est possible que les caribous se tiennent loin des bœufs musqués pour éviter la prédation par les loups. Gunn et al. (2011) ont également émis l'hypothèse selon laquelle la hausse du nombre de bœufs musqués favorisait la hausse du nombre de loups qui, à son tour, ferait augmenter les taux de prédation sur les caribous de Peary.
Plusieurs observateurs ont noté que la ségrégation spatiale entre le caribou de Peary et le bœuf musqué pourrait avoir un fondement comportemental plus grand que les préférences d'habitat. On a observé une ségrégation dans l'île Banks (voir par exemple Kevan, 1974; Wilkinson et Shank, 1974), l'île Melville (Thomas et al., 1999), l'île Axel Heiberg (Tener, 1963), l'île Bathurst (Ferguson, 1987) et l'île d'Ellesmere (Jenkins, 2006; Manseau et al., 2004; Tener, 1963). Selon les résidents d'Ulukhaktok, les caribous se seraient déplacés vers Cambridge Bay pour échapper aux bœufs musqués de l'inlet Minto (Gunn, 2005). Les CTA des Inuvialuits et des Inuits font souvent référence à l'évitement des bœufs musqués par les caribous, qui n'aiment pas leur odeur ou qui n'aiment simplement pas les bœufs musqués (résidents d'Ulukhaktok, cités dans Kassam, 2009; Ekaluktutiak HTO, 2013; Iviq HTA, 2013; Palaulatuk HTC, 2013). Selon les CTA, les caribous pourraient éviter les zones grandement utilisées par les bœufs musqués parce que ceux-ci piétinent la végétation et tassent la neige, ce qui nuit à la recherche de nourriture (SARC, 2012).
Les résidents de Sachs Harbour ont précédemment établi des liens entre le nombre élevé de loups, l'augmentation du nombre de bœufs musqués et le déclin des caribous de Peary dans l'île Banks (Sachs Harbour Conservation Plan, 1998, cité dans SARC, 2012). Dans l'île Banks et dans le nord-ouest de l'île Victoria, les populations de bœufs musqués ont grandement augmenté dans les années 1960, suite au programme d'empoisonnement mis en œuvre de 1955 à 1959 qui visait à réduire le nombre de loups (Heard, 1984). Nagy et al. (1996) ont noté que les populations de loups avaient augmenté considérablement dans l'île Banks lors d'une période d'augmentation du nombre de bœufs musqués et de réduction du nombre de caribous, que la prédation des caribous par les loups avait été observée et que les caribous de Peary de l'île Banks se trouvaient peut-être dans une situation où une biomasse élevée de bœufs musqués favorise une hausse de la population de loups. Même si les taux de prédation des caribous sont faibles, les conséquences peuvent être importantes, notamment à cause des faibles effectifs. Nagy et al. (2013) ont également mentionné qu'on a vu en 1998, pour la première fois en 20 ans, que la population de bœufs musqués dans l'île Banks montrait des signes de déclin, tandis que le nombre de loups observé durant les relevés des ongulés continuait d'augmenter.
Par ailleurs, dans le nord-ouest de l'île Victoria, selon un relevé des connaissances locales, la population de loups avait augmenté des années 1970 aux années 1990 pendant que la population de bœufs musqués augmentait et que celle de caribous de Peary déclinait (Gunn, 2005). Selon Gunn (2005), le nombre élevé de bœufs musqués pourrait maintenir des effectifs élevés de loups et entraîner une prédation relativement forte des caribous restants.
On compte également comme prédateurs du caribou de Peary le grizzli (Ursus arctos) et le carcajou (Gulo gulo). Le renard arctique (Vulpes lagopus) attaque aussi parfois les caribous juvéniles (SARC, 2013). Des membres de collectivités où se trouvent deux sous-populations méridionales de caribous de Peary mentionnent une augmentation du nombre d'observations récentes de grizzlis et/ou de carcajous (Ekaluktutiak HTA, 2013; Gjoa Haven HTA, 2013; Sachs Harbour HTC, 2013; Spence Bay HTO, 2013).
La prévalence et l'intensité des infections et maladies parasitaires chez le caribou de Peary sont peu connues. L'hypoderme est un parasite du caribou qui est relativement facile à suivre, mais la prévalence de l'hypoderme comme parasite du caribou dans l'île Banks et dans le nord-ouest de l'île Victoria est inconnue. Dans les îles Melville et Prince Patrick, 11 et 16 % des caribous de Peary recueillis de 1974 à 1979 avaient des hypodermes, respectivement (Thomas et Kiliaan, 1990). Une des seules informations qu'on possède sur les autres parasites et maladies concerne des caribous de l'île Banks, chez qui des Inuvialuits ont fait état de kystes cysticerques dans les muscles : les principaux hôtes de ce parasite sont les loups ou les renards (Vulpes spp.); le nombre de kystes varie chez le caribou et pourrait être lié au cycle vital du renard (Nagy et al., 1998).
On en connaît davantage sur les maladies touchant les bœufs musqués de l'île Banks, mais on ne sait pas si les maladies et les parasites de cette espèce constituent une menace pour le caribou de Peary. Certains parasites et maladies observés chez le bœuf musqué n'ont pas été notés chez le caribou, y compris la yersiniose, qui est courante chez le bœuf musqué (Larter et Nagy, 1999). Des parasites du genre Giardia sont observés chez le bœuf musqué, mais pas chez le caribou; cependant, un autre parasite protozoaire, du genre Cryptosporidium, a été trouvé dans 22 % des échantillons fécaux du caribou de Peary de l'île Banks dans les années 1990 (Nagy et al., 1998).
Le caribou de la toundra et le bœuf musqué ont en commun plusieurs parasites, dont des helminthes gastrointestinaux et une espèce de strongle pulmonaire (Kutz et al., 2012), et sont vulnérables à plusieurs des mêmes pathogènes, y compris les bactéries Brucella suis et Erysipelothrix rhusiopathiae (voir Menaces et facteurs limitatifs). On a émis l'hypothèse voulant que la compétition entre le caribou et le bœuf musqué soit due à la présence de parasites (nématodes abomasales) (Hughes et al., 2009).Deux nématodes abomasales, le Teladorsagia boreoarcticus et le Marshallagia marshalli,sont liés à un mauvais état physique et à de faibles indices liés aux protéines chez le bœuf musqué et le caribou, respectivement (Steele, 2013; Kutz et al., données inédites). Ces nématodes sont courants chez le bœuf musqué, et leur abondance relative chez le caribou semble augmenter là où ce dernier vit en sympatrie avec le bœuf musqué (Hughes et al., 2009; Kutz et al., 2012; Steele et al., 2013). Les caribous de la toundra de la région de Kangerlussuaq, dans l'ouest du Groenland, présentent une faune parasitique dominée par des parasites se trouvant également chez les bœufs musqués qui y ont été introduits. Le Marshallagia marshalli est souvent associé à de faibles indices des protéines et du gras rénal chez le caribou de la toundra du Groenland (Steele et al., 2013). À ce jour, les études ont été mal conçues pour évaluer les effets du T. boreoarcticus chezle caribou, mais ce parasite à des effets négatifs sur l'état physique chez le bœuf musqué (Kutz, Nagy, Checkley, données inédites). Le nématode Ostertagia gruehneri a aussi des conséquences négatives sur l'état physique et la gravidité chez le caribou et le renne (Irvine et al., 2001; Steele, 2013).
Un parallèle avec le caribou de Peary pourrait se faire en examinant les effets subcliniques des nématodes parasitiques chez le renne de Svalbard. Chez cette espèce, les nématodes gastrointestinaux ont eu suffisamment d'effets sur la masse corporelle pour réduire les taux de gravidité (Irvine et al., 2001), ce qui laisse penser que les parasites pourraient avoir des effets subcliniques. Ces effets incluent des changements du comportement de quête de nourriture pour éviter les risques d'infection (Van der Waal et al., 2000).
Le plan de relevé dans l'Archipel arctique doit tenir compte des faibles densités et de la vaste aire de répartition des animaux (Gunn et Poole, 2014). L'énorme superficie (7 % de la superficie totale du Canada) et l'éloignement de la région, qui dispose de rares bases opérationnelles, constituent des contraintes logistiques. Par conséquent, les relevés ont été peu fréquents, chacun couvrant une seule île ou un sous-ensemble d'îles. La fréquence irrégulière des relevés (dans le temps et l'espace), ainsi que les modifications au plan et à la méthode de relevé, compliquent l'évaluation des tendances des effectifs du caribou de Peary depuis la conduite des premiers relevés dans les années 1960 (Gunn et Poole, 2014).
La plupart des relevés étaient constitués de transects aériens en bandes, et les densités observées à l'intérieur de ceux-ci étaient extrapolées aux zones à l'extérieur, selon l'hypothèse voulant que les caribous de Peary soient uniformément répartis à l'intérieur des strates. La plupart des relevés étaient stratifiés, un plus grand effort étant déployé aux endroits abritant des densités relatives élevées, connues ou soupçonnées, de caribous, et moins d'effort étant déployé ailleurs. Tous les observateurs n'ont pas fait la distinction entre les classes d'âge; ceux qui l'on fait ont signalé « des individus excluant les faons » ou « des jeunes d'un an et des adultes » ou « des jeunes d'un peu moins d'un an (la production de faons de l'été précédent, de 10 mois environ) et des adultes », selon le moment du relevé. L'amélioration de l'exactitude d'un relevé (c.-à-d. en réduisant l'altitude de relevé et la largeur des transects), tout en maintenant le même niveau d'effort, en réduit la précision parce que la couverture est moindre (Gunn et Poole, 2014). La précision est habituellement, mais pas toujours (en particulier lors des premières années de relevé), une mesure de la variance (c.-à-d. intervalle de confiance [IC] à 95 % ou écart-type [é.-t.]). Autrement, les effectifs proviennent de dénombrements minimaux, qui sont aussi parfois tirés de relevés aériens non systématiques ou de relevés d'autres espèces (p. ex. bœuf musqué). La télémétrie par émetteurs radio VHF ou satellites a été appliquée dans les îles Banks, Bathurst et d'Ellesmere, ce qui a permis d'améliorer la description des migrations saisonnières dans l'île Bathurst (Poole et al., 2015), mais, ailleurs, les données télémétriques n'ont pas fait l'objet d'un rapport.
Le biais imputable à l'observabilité des animaux (la couleur du pelage par rapport au paysage, les conditions d'éclairage, etc.) et à l'expérience des observateurs est probablement élevé, et il n'est généralement pas mesuré (Gunn et Poole, 2014).
En 1961, J.S. Tener a dirigé les premiers relevés aériens systématiques ciblant le caribou de Peary (et le bœuf musqué) à l'échelle des IRE (Tener, 1963). Les chercheurs ont appliqué la stratification, mais n'ont pas réparti l'effort de relevé en fonction de la densité des caribous parce que de l'information préalable n'était pas disponible. Le biais s'approchait probablement de celui d'autres relevés, compte tenu de la faible largeur des bandes et l'altitude de relevé. Bien que Tener n'ait pas calculé la variance des estimations, un nouveau calcul subséquent fait par Miller et al. (2005 b) incluait des limites de confiance. Par conséquent, le coefficient de variation (CV) pour les parties ouest et est de la zone d'étude s'élevait respectivement à 22 et à 8 %, ce qui représente la couverture et s'approche du niveau de précision des estimations subséquentes. Les relevés effectués par Tener (1963) ont permis d'estimer provisoirement l'effectif du caribou de Peary à 25 845 individus dans les IRE (2 des 4 sous-populations reconnues dans la présente évaluation). Ce nombre inclut 12 799 caribous présents dans la seule île Melville (Tener, 1963).
Selon des Inuits de Grise Fiord et de Resolute Bay, la population de caribous de Peary ne pouvait pas être aussi abondante que l'a signalé Tener (Ferguson et al., 2001), et leurs doutes persistaient lors de récentes rencontres communautaires d'ordre technique dirigées par Environnement Canada dans le cadre du processus de planification du rétablissement de l'espèce (p. ex. Iviq HTA, 2013; Resolute Bay HTO, 2013). Par contre, les effectifs estimés par Tener (1963) pour l'île Bathurst en 1961 étaient semblables aux estimations enregistrées en 1993 (Miller, 1995b) et 2013 (Anderson, 2014). Les récents relevés réalisés depuis le dernier rapport de situation sur la sous-espèce incluent ceux de Jenkins et al. (2011), qui ont calculé les effectifs au Nunavut (à l'exception de l'île Byam Martin, de l'est de l'île Melville, de l'est de l'île Mackenzie King et de l'île Borden) de 2001 à 2008. Ces derniers ont utilisé une combinaison de relevés aériens au printemps, de relevés en motoneige en hiver et d'échantillonnages par distance (Buckland, 2001), fondés sur des méthodes de transects linéaires, pour estimer la densité et l'abondance des adultes et des petits d'un peu moins d'un an.
La plupart des relevés s'appuient sur des transects suivis dans des îles individuelles ou des groupes d'îles, ce qui est avantageux pour comparer les estimations d'une année à l'autre. Dans d'autres régions, comme cela a été établi pour le renne à Svalbard (Norvège), même de légères différences dans les superficies de relevés consécutifs mènent à des sous-estimations et à des variations interannuelles des effectifs (Lee et al., 2015). Étant donné que les relevés aériens les plus récents ont été effectués en été, seuls les relevés d'été sont présentés ici pour les îles qui ont fait l'objet de relevés multiples au cours d'une seule année afin de maintenir l'uniformité d'une année à l'autre. Les densités (nombre de caribous par superficie recensée) ont été calculées d'après les dénombrements de caribous le long des transects, puis ont été utilisées pour estimer l'effectif caribous dans une superficie recensée donnée (habituellement une île).
Les effectifs issus de divers relevés n'ont pas été systématiquement extrapolés à la même superficie pour tous les relevés effectués au cours des dernières décennies. Pour assurer l'uniformité, Johnson et al. (en prép.) ont recalculé la superficie des îles (d'après Nagy et al., 2009) au moyen d'un masquage des masses terrestres obtenu à l'aide du jeu de données CanVec – produit numérique de référence cartographique d'accès libre produit par Ressources naturelles Canada (Government of Canada, 2015). Ils ont utilisé la projection cartographique équidistante conique d'Albers pour obtenir des estimations de superficie, qui sont utilisées systématiquement dans la présente évaluation pour obtenir des estimations des effectifs corrigées en fonction de la superficie. Les estimations ajustées en fonction de la superficie supposent une densité uniforme dans chaque île recensée qui, bien qu'elle soit peu probable, facilite la comparaison entre les années (Johnson et al., en prép.). La précision n'a pas été prise en compte dans les estimations corrigées en fonction de la superficie (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
De 1961 à 2014, des organismes gouvernementaux ont réalisé un total de 154 relevés aériens pour estimer les effectifs du caribou de Peary dans l'ensemble de l'Arctique canadien ( tableau 2 ; <a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>). La fréquence et l'étendue spatiale des relevés ont été grandement variables à l'échelle de ce territoire au cours de ces 53 années. Les îles Banks (sous-population Banks-Victoria) et Bathurst (sous-population de l'OIRE) ont été les plus souvent recensées. Gunn et Poole (2014) ont calculé la couverture (pourcentage de la superficie totale qui a été recensée) et la précision (coefficient de variation [CV]) pour chaque île. Parmi les quatre sous-populations, la couverture variait en moyenne de 14 à 33 %, et la précision, de 17 à 33 % ( tableau 2 ).
| Sous-population | Précision (CV) (%) | Couverture (%) | Nombre de relevés | Période |
|---|---|---|---|---|
| Banks-Victoria | 31 | 18 | 39 | 1970 à 2014 |
| Prince of Wales-Somerset-Boothia | 17 | 15,5 | 26 | 1974 à 2006 |
| Ouest des IRE | 26 | 33 | 79 | 1961 à 2013 |
| Est des IRE | 22 | 14 | 10 | 1961 à 2007 |
Dans la mesure du possible, le nombre d'adultes (individus de plus de 1 an) a été utilisé pour établir le nombre approximatif d'individus matures. Un certain nombre de relevés n'ont pas produit d'estimations du nombre de faons. Le nombre d'individus matures dans chaque sous-population a été estimé en additionnant les effectifs de toutes les principales îles ayant fait l'objet de relevés relativement fréquents pendant une même période; une estimation grossière de l'effectif total a ensuite été dérivée à partir du total des effectifs des quatre sous-populations.
L'ensemble de l'aire de répartition du caribou de Peary n'a jamais été entièrement couvert dans une année donnée, et cela n'a pas été tenté depuis le relevé effectué par Tener en 1961 (Tener, 1963). Les tendances globales sur deux et trois générations de la population de caribous de Peary et celles de chacune des grandes sous-populations sont estimées ici grâce à des comparaisons des estimations par relevés corrigées en fonction de la superficie de chacune des principales îles occupées par chaque sous-population (voir Abondance).
Les incertitudes associées à ces estimations des effectifs et des tendances sont nombreuses en raison de divers facteurs : erreurs dans les estimations des relevés (décrites ci-dessus), début tardif de la capacité de reproduction produisant des surestimations du nombre d'individus matures (voir Cycle vital et reproduction), méthodes de relevé variables, plages variables de la période utilisée pour établir les tendances approximatives de la population sur deux ou trois générations d'une île à l'autre, manque de précision des valeurs de la superficie terrestre et hypothèses non validées en ce qui concerne les estimations corrigées en fonction de la superficie (voir ci-dessus).
Les plus récents relevés sur le caribou de Peary effectués dans l'ensemble de l'aire de répartition de la sous-espèce dans l'Extrême-Arctique ont produit un total estimatif d'environ 13 700 adultes et jeunes d'un an ( tableau 1 ). Cette estimation est toutefois dérivée d'un sous-ensemble de toutes les îles, dont certaines n'ont pas été recensées au cours de la dernière décennie. Par conséquent, le degré de certitude associé à ce nombre total estimatif est faible.
Les effectifs totaux de toutes les îles servent d'estimations moyennes de la taille de la population de caribous de Peary au fil du temps ( tableau 1 ; figure 5). Des mortalités massives dues à des événements stochastiques (et imprévisibles) périodiques sont caractéristiques de l'écologie du caribou de Peary, comme le décrivent les sections suivantes portant sur chacune des sous-populations (Miller et al., 1977a; Parker, 1978; Harding, 2004; Festa-Bianchet et al., 2011). Ces événements ne sont pas tous connus, car, à cause des longues périodes séparant les relevés, des déclins marqués et des rétablissements subséquents peuvent être passés inaperçus. D'après l'information disponible, ni les mortalités massives ni les périodes de hausse des effectifs ne semblent être synchrones dans l'ensemble de l'aire répartition du caribou de Peary. Les tendances des effectifs dérivées de relevés épars au sein de chaque sous-population au cours des cinq dernières décennies sont décrites dans la section suivante.
Les plus récents relevés effectués dans l'île Banks (2014; Davison et al., 2014) et le nord-ouest de l'île Victoria (2015; Davison et Williams, 2013) ont recensé un total d'environ 2 252 individus matures dans cette sous-population ( tableau 1 ; <a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>). Des relevés effectués à la fin des années 1980 indiquent des effectifs considérablement plus élevés (> 8 000), de même qu'un recul global sur 3 générations (27 ans) d'environ 68 % dans les îles Banks et Victoria combinées. Les derniers relevés ont indiqué une modeste tendance à la hausse du nombre d'individus matures dans l'île Banks, alors que le nombre dans l'île Victoria pourrait avoir récemment diminué de nouveau (figure 5; <a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
Selon les connaissances des collectivités locales (citées dans Usher, 1971), le nombre de caribous a fluctué à cause des hivers rudes au début des années 1950, qui avaient tué certains caribous et poussé d'autres à migrer hors de l'île Banks. Les premières estimations établies par relevés quantitatifs dans l'île Banks établissent les effectifs d'adultes et de petits à 4 000 en 1952–1953 (Manning et Macpherson, 1958), à 2 351 en 1959 (MacPherson, 1960), à 5 000 à 8 000 en 1970 (Kevan, 1974), et à 12 098 en 1972 (Urquhart 1973). Les estimations pour 1970 et 1972 provenaient de relevés aériens systématiques, bien que Kevan (1974) n'ait répertorié que la moitié nord de l'île Banks. Selon les observateurs, avant 1972, la plupart des caribous, sinon tous, étaient concentrés à l'extrémité nord de l'île. Dès 1972, la sous-population s'était répandue dans l'ensemble de l'île (Urquhart, 1973). Urquhart (1973) a mentionné que des chutes de neige particulièrement abondantes à l'automne 1970 avaient amené un certain nombre de caribous à quitter l'île Banks pour se rendre sur le continent, alors que d'autres sont morts de malnutrition. Hunters a signalé que de nombreux caribous sont morts au cours de cet hiver (cité dans Gunn et Dragon, 1998), et Urquhart (1973), en extrapolant à partir des 39 carcasses dénombrées en juin 1971, a estimé que 879 caribous étaient morts.
| Sous-population | Île (groupe) |
Premier relevé sur 3 générations | Première estimation sur 3 gén. corrigée en fonction de la superficie | Premier relevé sur 2 générations | Première estimation sur 2 gén. corrigée en fonction de la superficie | Relevé le plus récent | Estimation la plus récente corrigée en fonction de la superficie | Nbre d'années de données de suivi (3 gén.) | Changement approx. (%) sur 3 générations | Nbre d'années de données de suivi (2 gén.) | Changement approx. (%) sur 2 générations |
|---|---|---|---|---|---|---|---|---|---|---|---|
| BANKS-VICTORIA | Banks | 1987 | 4 296 | 1998 | 454 | 2014 | 2 248 | 27 | - 47,67 | 16 | 395,15 |
| BANKS-VICTORIA | N.-O. Victoria | 1987 | 2 790 | 1998 | 137 | 2015 | 4 Note du tableaua | 28 | - 99,86 | 17 | - 97,08 |
| PRINCE OF WALES-SOMERSET-BOOTHIA | Boothia | 1985 | 4 738 | 1995 | 3 265 | 2006 | 1 Note du tableaua | 21 | - 99,98 | 11 | - 99,97 |
| PRINCE OF WALES-SOMERSET-BOOTHIA | Prince of Wales | 1980 | 4 212 | 1995 | 5 Note du tableaua | 2004 | 1 Note du tableaua | 24 | - 99,98 | 9 | - 80,00 |
| PRINCE OF WALES-SOMERSET-BOOTHIA | Somerset | 1980 | 577 | 1995 | 115 | 2005 | 4 Note du tableaua | 25 | - 99,31 | 10 | - 96,52 |
| PRINCE OF WALES-SOMERSET-BOOTHIA | Russell | 1980 | 605 | 1995 | 0 | 2004 | 0 | 24 | - 100,00 | 9 | |
| EIRE | Axel Heiberg | 1995 | 94 Note du tableaub | 1995 | 94 Note du tableaub | 2007 | 2 255 | 12 | - | 12 | 2 298,94 |
| EIRE | Ellesmere | 1989 | 396 Note du tableaub | 1995 | 149 Note du tableaub | 2015 | 918 | 26 | 132,81 | 20 | 516,11 |
| OIRE | Melville | 1987 | 955 Note du tableaub | 1997 | 797 | 2012 | 2 740 | 25 | 186,91 | 15 | 243,79 |
| OIRE | Prince Patrick | 1986 | 156 Note du tableaub | 1997 | 87 | 2012 | 2 746 | 26 | 1 660,26 | 15 | 3 056,32 |
| OIRE | Eglinton | 1986 | 79 Note du tableaub | 1997 | 0 | 2012 | 181 | 26 | 129,11 | 15 | - |
| OIRE | Emerald | 1986 | 14 Note du tableaub | 1997 | 0 | 2012 | 45 | 26 | 221,43 | 15 | - |
| OIRE | Byam Martin | 1987 | 100 Note du tableaub | 1997 | 0 | 2012 | 121 | 25 | 21,00 | 15 | - |
| OIRE | McKenzie King | 1974 | 60 Note du tableaub | 1997 | 36 | 1997 | 36 | 23 | - | 0 | - |
| OIRE | Borden | 1973 | 16 Note du tableaub | 1973 | 16 Note du tableaub | 1973 | 16 | 0 | - | 0 | - |
| OIRE | Brock | 1973 | 24 Note du tableaub | 1997 | 0 | 1997 | 0 | 24 | - | 0 | - |
| OIRE | Devon | 2002 | 110 Note du tableaub | 2002 | 110 Note du tableaub | 2008 | 17 | 6 | - 84,55 | 6 | - 84,55 |
| OIRE | Lougheed | 1985 | 0 | 1997 | 103 | 2007 | 375 | 22 | - | 10 | 264,08 |
| OIRE | Complexe de l'île Bathurst | 1988 | 1 070 Note du tableaub | 1997 | 81 | 2013 | 1 463 Note du tableaub | 25 | 36,73 | 16 | 1 706,17 |
| OIRE | Cornwallis | 1988 | 52 Note du tableaub | 2002 | 2 | 2013 | 4 Note du tableau a | 25 | - 92,31 | 11 | 100,00 |
| OIRE | Little Cornwallis | 1988 | 0 | 2002 | 0 | 2013 | 1 Note du tableau a | 25 | - | 11 | - |
| OIRE | Helena | 1988 | 26 Note du tableaub | 1997 | 0 | 2013 | 2 Note du tableau a | 25 | - | 16 | - |
| Globale (approx.) | - | - | 21 637 | - | 5 451 | - | 13 178 | - | - 35,31 | - | 141,75 |
Les estimations disponibles tirées de relevés aériens réalisés dans l'île Banks semblent indiquer des déclins réguliers à partir de 1982 et une certaine stabilité à un faible niveau de 1992 à 2010 (Gunn, 2005; Davison et Williams, 2013). L'augmentation de l'effectif, qui est passé de 2 351 en 1959 (MacPherson, 1960) à 12 098 en 1972 (Urquhart, 1973), sous-entend un taux fini d'augmentation moyen (λ) de 1,14, soit 14 % par an. Le taux a ensuite diminué plus ou moins régulièrement, pour s'établir à un creux de 451 ± 60 (IC) en 1998 (Nagy et al., 2013a). Cependant, Nagy et al. (2006) étaient d'avis que l'estimation de 1998 était basse pour des raisons non précisées. L'effectif a ensuite augmenté, pour atteindre environ 1 142 ± 324 (IC) en 2001 (Nagy et al., 2006; taux fini d'augmentation de 30 % sur 3 ans) et 2 234 en 2014 (Davison et al., 2014). Cette dernière valeur constitue l'estimation la plus récente (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
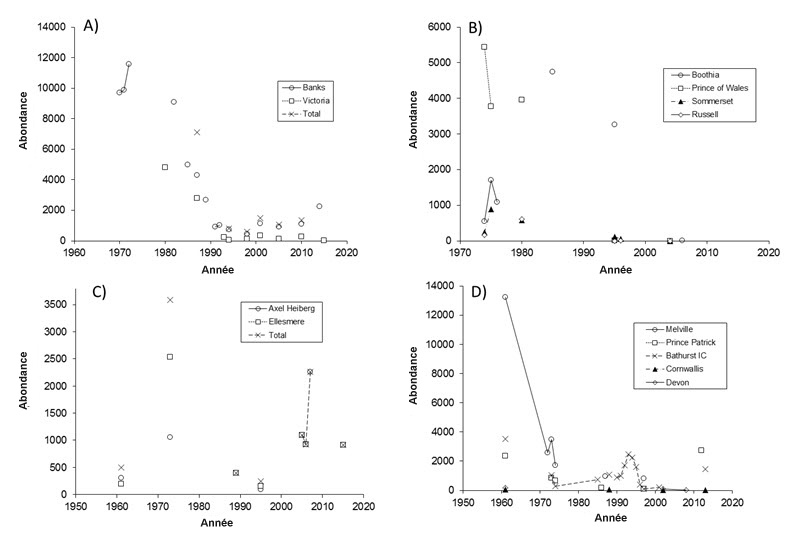
Description longue de la figure 5
Quatre graphiques présentant les estimations des effectifs d'après divers relevés réalisés dans des îles pour chacune des quatre sous-populations de caribous de Peary. Les estimations sont extrapolées des zones d'étude aux îles entières pour faciliter la comparaison d'une année à l'autre.
La tendance globale du caribou de Peary dans le nord-ouest de l'île Victoria semble plus variable que celle dans l'île Banks, bien que les relevés y aient été moins fréquents. Les renseignements historiques réunis aux fins du plan de conservation communautaire d'Olokhaktomiut (Anonyme, 2008) indiquent que, de 1900 à vers 1920, l'effectif du caribou de Peary était à la hausse. Toutefois, un épisode de pluie verglaçante vers 1920 a provoqué une mortalité considérable. L'effectif a fluctué par la suite jusque dans les années 1970. Il était difficile, au cours des hivers 1991-1992 et 1992-1993, pour les chasseurs d'Ulukhaktok de trouver des caribous de Peary (Community of Ulukhaktok, Wildlife Management Advisory Council [NWT] et Joint Secretariat, 2008). De 1980 à 1993, la sous-population du nord-ouest de l'île Victoria a fait l'objet de 5 relevés, qui ont révélé un déclin rapide, d'un pic de 4 512 caribous en juillet-août 1980 (Jakimchuk et Carruthers, 1980) à un creux estimatif de 159 en 1993 (Gunn, 2005). Le relevé de 2015 (avril-mai) a recensé un seul groupe de 2 individus, alors que le relevé précédent (juillet-août 2010) avait produit une estimation de 150 ± 104 adultes. Les raisons du déclin continu de l'effectif du nord-ouest de l'île sont inconnues, mais elles ne sont pas considérées comme liées à une maladie ou à la chasse (Davison et Williams, 2013).
Le nombre de caribous de Peary dans la sous-population Prince of Wales–Somerset–Boothia est présumé proche de zéro à l'heure actuelle, mais le relevé le plus récent a été effectué il y a presque 10 ans. Les relevés aériens ciblant cette sous-population de 1980 à 1985 ont produit des estimations qui atteignaient les 10 000 individus matures, nombre qui a chuté pour ne représenter qu'une poignée d'individus lors des relevés les plus récents, ce qui laisse supposer un déclin de près de 100 %. Les chasseurs locaux continuent de voir des caribous de Peary et leurs pistes à l'occasion dans les îles (Ekaluktutiak HTA, 2013; Resolute Bay HTO, 2013), mais seulement à de très faibles densités, et ils prévoient que le rétablissement de la sous-population sera long et lent (Campbell, 2006).
Un aîné inuk s'est souvenu que son père disait que les caribous étaient abondants dans l'île Somerset dans les années 1920 et qu'on les chassait jusqu'en 1928 ou 1930, période marquée par une mortalité considérable. L'espèce a continué d'être présent en petits nombres dans cette île et l'île Prince of Wales jusqu'à la fin des années 1960, lorsque leur nombre a commencé à augmenter (Taylor, 2005). Les chasseurs de Taloyoak ont aussi indiqué que le nombre de caribous dans les îles Prince of Wales, Somerset et Russell, ainsi que dans la presqu'île de Boothia, était faible des années 1940 au début des années 1970, avant d'augmenter (Gunn et al., 2006, et références citées). À la fin des années 1970, il y avait « … beaucoup de caribous, assez pour fabriquer des vêtements d'hiver » [traduction] dans les deux îles (CTA, citées dans Taylor, 2005).
Le pic d'abondance s'élevait à un total de 5 682 caribous dans les îles Prince of Wales et Somerset en 1974 (Fischer et Duncan, 1976) et 4 831 ± 543 dans la presqu'île de Boothia en 1985 (Gunn et Ashevak, 1990; Gunn et Dragon, 1998). Dans les années 1980, lorsque le nombre de caribous était élevé dans l'île Somerset et les petites îles qui l'entourent, les Inuits ont commencé à voir des signes de maladie ou de parasites chez les animaux. Des caribous trouvés morts n'étaient pas morts de vieillesse ou à cause de la prédation exercée par les loups, et le nombre de caribous a commencé à diminuer (CTA, dans Taylor, 2005). Les chasseurs de Resolute Bay ont aussi indiqué que, dès le début des années 1990, le déclin était tellement marqué qu'ils ont cessé de chasser dans les îles Prince of Wales et Somerset. Un relevé effectué en 1995, reposant sur les mêmes méthode et couverture qu'en 1980, n'a trouvé que sept caribous dans les trois îles (Gunn et Dragon, 1998). Étant donné que seulement deux de ces caribous observés en 1995 étaient présents dans un transect, aucune estimation quantitative n'a pu être faite. Un relevé non systématique des caribous et de ses pistes effectué en avril et mai 1996 a donné deux caribous dans l'île Somerset (Miller, 1997). En 2004, aucun caribou n'a été vu lors des relevés aériens des îles, et les équipes au sol n'ont vu que quatre individus dans l'île Somerset (Jenkins et al., 2011). Aucun relevé n'a été effectué dans la région depuis 2006, lorsque Dumond (2006) a aperçu un caribou lors d'un relevé visant le bœuf musqué. Bien que des pistes et des individus soient vus à l'occasion (Ekaluktutiak HTA, 2013; Resolute HTO, 2013), rien n'indique que les effectifs se sont reconstitués.
Gunn et al. (2006) ont examiné les facteurs qui expliquent la disparition presque totale du caribou de Peary dans les îles Prince of Wales, Somerset et Russell, et ils ont conclu que le déclin des effectifs du milieu des années 1980 au milieu des années 1990 résultait de la diminution à long terme des taux de survie des petits et des femelles reproductrices due à la chasse continue et à la prédation accrue par les loups. Le déclin de cette sous-population a également coïncidé avec une augmentation du nombre de bœufs musqués et l'élargissement de son aire de répartition (Campbell, 2006; Gunn et al., 2006), bien qu'il n'existe aucune preuve scientifique confirmant ou infirmant la détérioration des conditions dans l'aire de répartition. Miller et al. (2007a) ont proposé qu'une combinaison de facteurs pourrait limiter les taux de croissance de la population, notamment la prédation exercée par les loups, les conditions météorologiques extrêmes, la chasse et les maladies.
Malgré l'incertitude scientifique, le déclin de la sous-population de caribous de Peary de Prince of Wales–Somerset–Boothia avait été annoncé. Simon Idlout se rappelle que son père, Timothy Idlout, avait prédit au début des années 1980 que le nombre de caribous allait chuter brusquement en se fondant sur une mortalité massive qui avait eu lieu dans des conditions semblables dans les années 1920 (cité dans Taylor, 2005). Des chasseurs de Gjoa Haven ont signalé que certains caribous avaient quitté l'île Prince of Wales pour se rendre dans l'île King William au début ou au milieu des années 1970 (J. Keanik, comm. pers., cité dans Gunn et Dragon, 1998). Campbell (2006) a également précisé que, selon les connaissances traditionnelles des Inuits, le déclin était une occurrence naturelle et prévue causée par les impacts de la surabondance des années 1970 et du début des années 1980. Selon ces connaissances, l'émigration constitue le principal mécanisme du déclin. Gunn et al. (2006) ont étudié ce facteur, et ils ont conclu qu'aucun stimulus environnemental grave et prolongé connu n'était suffisant pour amener un si grand nombre de caribous à abandonner leurs territoires, et qu'il n'y avait aucun signe d'une augmentation des effectifs dans les îles voisines qui pourrait compenser ces pertes.
Thompson et Fischer (1980) ont estimé que le nombre de caribous de Peary dans la presqu'île de Boothia en 1974, 1975 et 1976 se situait respectivement entre 561 et 626 bêtes (relevés de juin et août), entre 1 109 et 1 739 bêtes (relevés de mars et juin) et à 1 120 bêtes (relevé de mars). Ils ont interprété l'augmentation soudaine de l'effectif de 1974 à 1975 comme une immigration à grande échelle en provenance de l'île Prince of Wales. Ils ont souligné (citant Fischer et Duncan, 1976) que l'île Prince of Wales avait connu une baisse d'effectif concurrente d'ampleur semblable, et que, selon eux, étant donné que la population de l'île Prince of Wales n'avait pas augmenté en 1976 alors que celle de la presqu'île de Boothia était demeurée au même niveau ou avait augmenté cette même année, le grand nombre d'immigrants de l'île Prince of Wales était resté dans la presqu'île de Boothia. Gunn et Dragon (1998) ont estimé le nombre de caribous dans la presqu'île de Boothia en 1995 à 6 658 ± 1 728 (é.-t.), mais ils n'ont pas fait la distinction entre le caribou de Peary et le caribou de la toundra, bien que les deux sous-espèces aient été observées. La migration des caribous de Peary à partir de l'île Somerset a apparemment cessé, à la suite de leur quasi-disparition au milieu des années 1990.
Deux sous-populations de caribous de Peary sont reconnues dans les IRE, dont la majorité des îles appartiennent à l'OIRE ( tableau 1 ; figure 1). Les derniers recensements de la plupart des grandes îles, qui constituent presque la moitié (179 648 km2) de la superficie totale de l'OIRE, ont été effectués en 2012 et 2013 (Anderson, 2014). L'île Bathurst a bénéficié de l'attention la plus régulière, 10 estimations ayant été faites sur une période de 41 ans (Gunn et Poole, 2014). Les relevés ont permis de déceler deux mortalités massives pendant cette période, suivies d'un rétablissement des effectifs. Miller et Barry (2009) ont examiné les données démographiques portant sur la période de 20 ans entre les effondrements des effectifs dans le centre-sud des IRE, où le caribou de Peary a connu un taux de croissance annuel moyen de 13,2 % entre 1974 et 1994, qui a grimpé à 20,5 % au cours des 6 dernières années, de 1988 à 1994. Après le premier effondrement des effectifs, Miller et al. (1975) ont calculé le déclin de la sous-population, qui s'élevait à 92 % dans l'île Bathurst, à 87 % dans l'île Melville et à 72 % dans l'île Prince Patrick. Des relevés aériens réalisés au printemps 1975 ont confirmé que le déclin avait continué (ou qu'un deuxième déclin s'était produit) en 1974 et 1975 (Gunn et al., 1981). Les relevés ont confirmé une autre « mortalité massive catastrophique » (ou deux, si les années individuelles sont comptées) dans l'OIRE : en 1994–1995, lorsque la sous-population du centre-sud (île Bathurst et îles voisines) s'est effondrée, pour passer de 3 155 caribous (d'après un nouveau calcul par Miller et Barry [2009]) à 542 caribous, et en 1996–1997 (Gunn et Dragon, 2002), alors qu'il ne restait plus 78 caribous (aucun faon recensé) dans les 7 principales îles fréquentées par la sous-population.
Relativement peu de relevés ont été effectués dans certaines îles. Le relevé le plus récent visant le groupe des Premiers ministres a eu lieu en 1997 (îles Mackenzie King et Brock), l'île Borden n'ayant été recensée qu'en 1973 ( tableau 1 ; <a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
La plus récente estimation combinée des effectifs (2012-2013) dans les îles Melville, Prince Patrick, Eglinton, Emerald, Byam Martin, Cornwallis, Little Cornwallis et Helena, ainsi que dans le complexe de l'île Bathurst, les situent à environ 7 300 adultes. Les relevés qui ont été effectués dans ces mêmes régions de 1986 à 1988 ont produit un total de 2 500 individus (y compris les faons). Cela suppose une augmentation de 232 % des effectifs totaux au cours des 3 dernières générations.
Miller et Barry (2009) ont soutenu que le principal facteur qui limitait le nombre de caribous de Peary dans les IRE était les événements météorologiques stochastiques isolés et peu fréquents, notamment les conditions d'enneigement ou de glace particulièrement rigoureuses, qui causent une baisse ou l'échec de la reproduction, une diminution du taux de survie des nouveau-nés et/ou une hausse du taux de mortalité des adultes. Ils n'ont relevé aucun signe de détérioration de l'aire de répartition ou de limites à la production annuelle des plantes aériennes laissant supposer des réactions directes dépendantes de la densité.
Complexe de l'île Bathurst – Les premiers relevés du complexe de l'île Bathurst, effectués en 1961 (Tener, 1963), ont produit une estimation de 3 509 individus, y compris les faons (estimation recalculée par Milller et al., 2005). Les relevés subséquents, en 1973-1974, ont permis de constater des déclins brusques, après quoi les effectifs ont augmenté d'environ 4 % par an sur la période de 7 ans suivant l'effondrement (1974-1975 à 1980–1981; Miller et Barry,2009). En 1994, la population s'était reconstituée, atteignant presque le même niveau qu'au début des années 1960 (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>). Après avoir interrompu la chasse dans le complexe de l'île Bathurst après l'effondrement des années 1970, les chasseurs y sont revenus à la fin des années 1980 et ont chassé jusqu'à ce qu'un autre effondrement se produise au milieu des années 1990, à la suite d'un événement de pluie et de verglas à l'automne, après lequel ils ont vu de nouveau de nombreuses carcasses de caribous de Peary et de bœufs musqués (CTA, citées dans Taylor, 2005). Trois effondrements successifs annuels survenus en hiver, de 1994–1995 à 1996–1997, ont réduit la population à environ 2 à 3 % de la taille de 1961 ou de 1994 (Miller et Barry, 2009; <a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>). Seuls 2 relevés ont été effectués depuis ce temps, le dernier (2013) montrant une augmentation, le nombre d'individus atteignant 1 482 ± 387 (é.-t.) (y compris les faons; Anderson, 2014).
Comme le décrit en détail le COSEPAC (COSEWIC, 2004), l'information disponible tient clairement les événements météorologiques indépendants de la densité pour responsables des deux effondrements de la population, la principale cause de la mortalité étant la famine due aux conditions d'enneigement ou de glace prolongées entravant l'accès à de la nourriture pendant une longue période. Le succès reproducteur et le taux de survie des faons étaient faibles pendant ces périodes; l'émigration a été exclue à cause du nombre de carcasses. Les aînés de Resolute Bay se rappellent de mortalités massives semblables dans les années 1930 (Resolute Bay HTO, 2013).
En ce qui concerne la reconstitution de la population après les effondrements, la faible fréquence des relevés systématiques complique la comparaison et l'interprétation des augmentations des effectifs, et ce, même dans le complexe de l'île Bathurst, qui est pourtant relativement bien étudié. De 1975 à 1994, le nombre de caribous dans ces îles et les îles voisines a augmenté à un taux fini moyen d'environ 13 % par an (λ= 1,13; Miller et Gunn, 2003 b), malgré qu'il s'élevait à 20 % par an de 1988 à 1993 et à 36 % par an de 1998 à 2001, soit après les mortalités massives du milieu des années 1990. Après 2001 et jusqu'à la fin de 2013, le nombre de caribous a augmenté à un taux plus faible de 18 % par an (λ= 1,18). Des taux élevés de reproduction annuelle et de survie des nouveau-nés, ainsi qu'un faible taux de mortalité des adultes, étaient évidents de 1988 à 1994, lorsque la taille de la population a triplé et que les conditions météorologiques étaient favorables (Miller et Barry, 2009).
Les caribous ne semblent jamais avoir été nombreux dans l'île Cornwallis et les petites îles voisines, constituées principalement de roche calcaire à couvert végétal clairsemé.
Complexe Melville–Prince Patrick et groupe des îles des Premiers ministres – Bien qu'elles n'aient pas été aussi souvent étudiées que le complexe de l'île Bathurst, les îles du complexe Melville–Prince Patrick et du groupe des Premiers ministres ne semblent pas avoir connu d'aussi fréquentes ou d'aussi graves mortalités massives. Des relevés effectués en 1973 (4 323 caribous) et 1974 (2 418 caribous) ont permis de documenter un déclin ou une mortalité massive avant 1973 et une mortalité massive en 1973–1974, d'après les dénombrements des carcasses et le faible pourcentage (presque zéro) de faons (Miller et al., 1975). Toutefois, la gravité était différente d'une île à l'autre et plus marquée dans les îles du nord-ouest; les déclins étaient également moins marqués que dans l'île Bathurst et les îles voisines (Miller et al., 1975:20).
Les tendances à long terme dans les îles du complexe Melville–Prince Patrick et le groupe des îles des Premiers ministres révèlent un déclin des effectifs depuis les années 1970 jusqu'à 1997 (bien que l'île Borden n'ait pas été recensée) et une augmentation menant à un total d'environ 6 000 adultes et jeunes d'un an en juillet 2012 (Davison et Williams, 2012) (bien que le groupe des Premiers ministres n'ait pas été recensé). Le relevé de 2012 a également permis de documenter la recolonisation d'îles occupées dans le passé.
Les relevés peu fréquents peuvent dissimuler des effondrements soudains des effectifs, comme cela s'est produit à l'hiver 1996–1997, lorsque de nombreuses carcasses de caribou ont été observées (Gunn et Dragon, 2002). Comme les estimations de la sous-population étaient semblables en 1986–1987 à celles de 1997 (voir ci-dessus), Gunn et Dragon (2002) étaient d'avis qu'il y avait aussi eu une augmentation non documentée des effectifs entre 1987 et 1996.
Les premiers explorateurs ont laissé des observations sur l'abondance de caribous et d'autres animaux sauvages dans les deux groupes d'îles situés le plus à l'ouest (p. ex. Parry, 1821; M'Dougall, 1857; Henessey, cité dans Bernier, 1910; Stefansson, 1921). En 1958–1959, MacPherson (1961) a recensé les îles Emerald et Eglinton, le complexe Melville–Prince Patrick et le groupe des îles des Premiers ministres, et il a estimé que le nombre total de caribous s'élevait à 6 898 (aucun caribou n'était présent dans les îles Brock et Eglinton). Tener (1963) a estimé en 1961 qu'il y avait un total de 12 799 caribous dans l'île Melville, total qu'il a extrapolé à partir de son dénombrement de 769 caribous dans 3 strates de l'île. Il a remarqué qu'ils étaient répartis dans tous les coins de l'île, par opposition à la répartition côtière en grappes qu'il avait observée dans l'île Bathurst. Tout en admettant une incertitude dans certaines hypothèses sous-tendant ses calculs, Tener (1963:22) a déclaré qu'il y avait peu de doute que la population totale de caribous s'élève dans les milliers, soit beaucoup plus qu'on le croyait jusqu'alors.
Miller (1987, 1988) a recensé les îles Prince Patrick, Eglinton et Emerald en 1986 (181 ± 59 [é.-t.]), et les îles Melville (943 ± 126 [é.-t.]) et Byam Martin (98 ± 37 [é.-t.]) en 1987; les estimations combinées pour les 2 années donnent un total de 1 222 caribous (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>). En 1997, Gunn et Dragon (2002) ont repéré 907 adultes et jeunes d'un an dans 3 îles, soit l'île Melville (787 ± 97 [é.-t.]), l'île Prince Patrick (84 ± 34 [é.-t.]) et l'île Mackenzie King (36 ± 22 [é.-t.]), mais ils n'ont vu aucun caribou vivant dans les îles Eglinton, Byam Martin, Emerald et Brock. Ils n'ont par ailleurs pas recensé l'île Borden. À l'été 1997, les caribous morts représentaient 43 % des caribous d'un an et plus dénombrés à l'été 1997 dans l'OIRE, mais le taux de mortalité variait entre les îles (30 % pour l'île Melville, 84 % pour l'île Bathurst, 22 % pour l'île Lougheed et 40 % pour le groupe des îles des Premiers ministres; Gunn et Dragon, 2002).
Îles Lougheed, Ringnes et Devon – L'estimation faite par Tener (1963) en 1961 situait les effectifs à 566 caribous dans les îles Amund Ringnes et Ellef Ringnes (13 % de faons), à 269 dans les îles King Christian et Cornwall (30 % de faons) et à 1 325 dans l'île Lougheed (22,1 % de faons). D'après des relevés au sol, Stefansson (1921) a estimé les effectifs à 300 caribous, ce qui correspond à l'extrapolation faite par Macpherson (1961) à partir des 56 caribous dénombrés par un géologue depuis une haute colline d'où il pouvait observer environ le quart de l'île. Des chasseurs de Resolute Bay ont indiqué que l'île Lougheed abritait un grand nombre de caribous en santé au début des années 1970 (Tony Manik, cité dans Taylor, 2005). Après l'effondrement de 1973–1974, aucun caribou n'a été documenté (mais les relevés étaient peu fréquents), puis Gunn et Dragon (2002) ont estimé que 101 ± 73 (é.-t.) adultes et jeunes d'un an vivaient dans l'île en 1997. Comme les autres groupes d'îles de l'OIRE, l'île Lougheed a été touchée par les mortalités massives du milieu des années 1990; environ 22 % de la population était représentée par des caribous morts en 1997 (Gunn et Dragon, 2002). L'estimation la plus récente situait l'effectif à 372 ± 234 (IC) adultes et jeunes d'un peu moins d'un an dans l'île Lougheed et les 4 plus petites îles s'étendant au sud de cette dernière (appelées collectivement le groupe Findlay) en 2007 (Jenkins et al., 2011). Des caribous ont été vus seulement dans l'île Lougheed.
En 2002, Jenkins et al. (2011) ont dénombré 35 caribous (aucun faon) dans l'ouest de l'île Devon, la plupart se trouvant à l'extérieur des transects, et ont fait une estimation approximative de 40 caribous. Lors d'un relevé plus exhaustif (7 985 km) de toutes les régions non glaciaires de l'île Devon et de petites îles voisines en 2008, ils ont dénombré seulement 17 caribous de Peary.
D'une superficie de 239 413 km2, l'EIRE, constitué de seulement 2 grandes îles reculées (îles d'Ellesmere et Axel Heiberg), est plus vaste que l'OIRE. Seulement quelques relevés ont été effectués depuis la publication de l'étude de Tener (1963), les comptes rendus les plus récents ayant été publiés en 2005-2007 (Jenkins et al., 2011) et 2015 pour le sud de l'île d'Ellesmere (Anderson et Kingsley, 2015). L'information disponible donne à penser que les effectifs ont augmenté depuis les années 1990, mais il est important de souligner que les relevés récents ont couvert plus de régions que dans le passé ( tableau 1 ).
En 1961, Tener (1963), reconnaissant l'incertitude fondée sur la faible couverture et d'autres facteurs, a fourni des estimations « provisoires » de 300 caribous (14 % de faons) dans l'île Axel Heiberg (estimation qu'il a caractérisée comme « intuitive ») et de 200 caribous dans l'île d'Ellesmere (11 % de faons), estimation qui reposait sur une très faible couverture, en particulier dans le nord de l'île. D'après les cartes et les fiches de terrain originales de Tener, Miller et al. (2005 b) ont recalculé les estimations de 1961 et obtenu presque le double du nombre total de caribous de Peary. Hendrigan (cité dans MacPherson, 1963) a estimé qu'il y avait 150 caribous dans l'île Axel Heiberg en 1960, dont plus de la moitié se trouvait dans le nord de l'île, du cap Stallworthy au détroit de Nansen, qui constitue aussi la région où Tener a recensé des animaux en 1961. Depuis ce temps, quelques relevés partiels ont été effectués. Par exemple, Riewe (1973) a estimé qu'il y avait 35 caribous en 1973 aux alentours des fjords Skaare et Wolf, situés dans le sud-est de l'île Axel Heiberg, Zoltai et al. (1981) n'ont pas vu de caribous dans leur zone d'étude située sur le versant est de l'île Axel Heiberg en 1980, tandis que Gauthier (1996) a signalé un minimum de 25 caribous dans l'île Axel Heiberg (du fjord Skaare au fjord Mokka puis vers l'ouest jusqu'au fjord Li) en juin 1995. L'île n'a pas été entièrement recensée avant 2007, lorsqu'une estimation a donné 2 291 caribous d'un an et plus, la plupart se trouvant sur le versant est (Jenkins et al., 2011). Toutefois, des vols de reconnaissance réalisés au cours de l'été en 2014 le long des versants est et sud-est n'ont relevé que trois mâles adultes et une biche accompagnée de son faon à la hauteur des fjords Skaare et Wolf (M. Anderson, comm. pers., 2015). Cette île est trop éloignée pour que les chasseurs y aient souvent accès. Les chercheurs basés au fjord Expedition, qui y accèdent le plus souvent, rapportent avoir vu des caribous à l'occasion sur le terrain limité qu'ils couvrent (M. Anderson, comm. pers., 2015).
Depuis le relevé effectué par Tener dans l'île d'Ellesmere, plusieurs relevés ont couvert des parties de l'île, en particulier le sud. Riewe (1973) a estimé qu'il y avait 150 caribous dans ce secteur en 1973, alors que Case et Ellsworth (1991) ont estimé qu'il y en avait 89 ± 31 (é.-t.). Gauthier (1996) y a dénombré 38 individus en juin 1995. Le sud de l'île a fait l'objet d'un autre relevé en 2005, tout comme l'île Graham; ce relevé a donné une estimation de 219 adultes (IC à 95 % : 109–442). Un relevé aérien a été effectué dans le même secteur en mars 2015; il a produit une estimation de 183 ± 128 (é.-t.) caribous, ce qui indique une stabilité à une faible densité dans le sud de l'île (Anderson et Kingsley, 2015). Le dernier relevé aérien du centre et du nord de l'île a eu lieu en 2006; il a produit une estimation de 802 adultes (IC à 95 % : 531–1 207) (Jenkins et al., 2011).
Les connaissances traditionnelles des Inuits font état de la présence continue mais aussi de la rareté générale des caribous dans le sud de l'île d'Ellesmere jusqu'au début des années 2000, lorsque leur nombre a commencé à augmenter. Des habitants de Grise Fiord ont aussi signalé des fluctuations du nombre de caribous, et plus particulièrement de leur répartition, dans le sud de l'île (Taylor, 2005). Des résidents de Grise Fiord et de Resolute Bay, de même que des pilotes et des chercheurs qui y travaillent au printemps et en été, voient aussi des caribous de Peary dans l'île Axel Heiberg lorsqu'ils y vont (rarement). Les indications peuvent aussi donner à penser que le caribou est en voie de recoloniser des régions qu'il n'a pas occupées depuis 15 à 25 ans (Campbell, 2006).
Compte tenu du manque de régularité des relevés (des îles différentes ont été recensées dans des années différentes, ce qui peut ne pas représenter précisément les sous-populations), des grandes lacunes dans les données ainsi que de la méthode et de la couverture de relevé variables, les tendances globales pour le caribou de Peary et chacune de ses quatre sous-populations doivent être considérées comme des approximations, et toute interprétation doit être faite avec prudence.
Le COSEPAC, (COSEWIC, 2004) donne une estimation totale de 50 000 caribous de Peary dans les années 1960 à 1970, période où ont été réalisés les premiers dénombrements. En 1987, soit il y a presque 3 générations, la population s'élevait à environ 22 000 individus matures (y compris quelques faons, en particulier dans l'OIRE). La population de caribous de Peary a atteint son creux en 1996, lorsqu'elle ne comptait plus que 5 400 individus matures environ ( tableau 1 ). La dernière évaluation du COSEPAC a produit une estimation de la population de 7 000 individus (COSEWIC, 2004), alors que l'estimation actuelle la situe à 13 700. Malgré une tendance générale à la hausse de la population sur 2 générations d'environ 150 %, le déclin sur 3 générations s'élève à un peu plus de 35 % ( tableau 1 ).
La sous-population de l'OIRE a connu un déclin dévastateur au milieu des années 1990, attribuable à des épisodes de verglas, alors que le déclin des sous-populations Banks–Victoria et Prince of Wales–Somerset–Boothia a commencé presque une décennie plus tôt, plus graduellement et pour des raisons mal comprises. La sous-population Prince of Wales–Somerset–Boothia, qui constituait en 1987 presque la moitié (10 000 individus matures) de la population estimative de caribous de Peary, ne montre aucun signe de rétablissement. L'effectif de la sous-population Banks-Victoria a augmenté au cours de la dernière décennie, mais pas dans l'île Victoria. L'effectif de la sous-population de l'OIRE a augmenté dans l'ensemble depuis le milieu des années 1990, tout en fluctuant un peu, alors que l'effectif de la sous-population de l'EIRE semble augmenter aussi, bien que les données de référence soient hautement incertaines ( tableau 1 ).
Les variations de la taille de la population de caribous de Peary ne répondent pas à la définition de l'UICN de « fluctuations extrêmes » (IUCN, 2014) parce que le degré des variations d'effectifs est inférieur à un facteur de dix, n'est pas synchrone chez les quatre sous-populations et reflète davantage une réduction des effectifs (suivie d'un certain rétablissement) en réponse à des menaces, plutôt qu'un cycle récurrent naturel d'augmentation et de réduction. Les CTA révèlent toutefois une tendance des effectifs de à fluctuer au fil du temps au cours du dernier siècle (Ekaluktutiak HTA, 2013; Resolute Bay HTO, 2013; Sachs Harbour HTC, 2013; Spence Bay HTO, 2013), et de nombreux relevés des îles indiquent une variabilité considérable autour de la moyenne (<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a>).
À un moment donné, le nord-ouest du Groenland constituait l'unique source possible d'immigration du caribou de Peary à l'extérieur du Canada, mais il existe peu de preuves qu'il y existe encore une population (voir Aire de répartition mondiale).
Les menaces directes pesant sur le caribou de Peary analysées dans le présent rapport sont classées et évaluées selon le système unifié de classification des menaces proposé par l'Union internationale pour la conservation de la nature (UICN) et le Partenariat pour les mesures de conservation (Conservation Measures Partnership, ou CMP) (IUCN-CMP) (Master et al., 2009). Les menaces sont définies comme les activités ou les processus immédiats qui ont des effets négatifs directs sur la population de caribous de Peary. Les résultats sur l'impact, la portée, la gravité et l'immédiateté des menaces sont présentés sous forme de tableau à l'annexe 2. L'impact global des menaces calculé est très-élevé-moyen pour le caribou de Peary. La vaste plage d'intensité des impacts des menaces résulte de l'effet combiné du nombre élevé de menaces ayant un impact en bonne partie faible ainsi que de l'incertitude considérable, de l'imprévisibilité, et du chevauchement et de l'interaction possibles des menaces individuelles.
Les paragraphes qui suivent présentent des descriptions des menaces, par ordre décroissant d'impact des menaces.
Les menaces ayant le plus grand impact sur le caribou de Peary découlent de la myriade d'effets du climat changeant. Les changements climatiques ont déjà eu des répercussions sur l'Arctique, et ils s'y produisent à un rythme plus rapide que dans d'autres écosystèmes mondiaux (ENR, 2011; IPPC, 2013; Stern et Gaden, 2015). Des signes mesurables du réchauffement de l'Arctique et des répercussions écologiques observées et prévues sont fréquemment signalés (Hinzman et al., 2005; Lim et al., 2008; Post et al., 2013). Les Inuits de la région de Kitikmeot ont constaté une gamme de changements sur le continent : étés plus longs, cycles gel-dégel inhabituels au printemps, débâcle printanière hâtive créant des étendues d'eau libre, englacement automnal tardif, glace plus mince (sur les lacs et la mer), nifaons d'eau plus bas et chutes de neige réduites (Golder Associates Ltd., 2003). Pour les îles de l'Arctique, des représentants de collectivités ont signalé des effets semblables à ceux qui se produisent dans la région de Kitikmeot, en plus de la disparition d'icebergs au nord de l'île King William, la réduction de l'étendue de la glace de plusieurs années, la couverture de neige plus dure et plus rugueuse, et le changement de la direction des vents dominants qui modifie l'orientation des bancs de neige (Golder Associates Ltd., 2003, et sources citées).
Dans le cas du caribou de Peary, les changements de trois variables climatiques (abiotiques) dans l'Arctique – phénomènes météorologiques violents, température et précipitations – expliquent la plus grande partie des effets des changements climatiques sur la population (effets examinés dans Johnson et al., en préparation). Ces changements sont tant négatifs que positifs pour l'accessibilité à de la nourriture et la diminution de l'étendue et de l'épaisseur de la glace de mer. Les principaux impacts sur la population vont de changements dans les habitudes de migration et de déplacement à des épisodes de mortalité périodiques, y compris des effondrements de la population. Les changements climatiques peuvent aussi avoir un effet positif découlant de la prolongation de la saison de croissance et de l'augmentation de la biomasse de nourriture. L'état des glaces et la couverture de neige moduleront également l'accès des chasseurs aux caribous.
Déplacement et altération de l'habitat (menaces de l'UICN No 11.1)
Les températures moyennes annuelles ont augmenté dans tout l'Arctique canadien de 1950 à 2007, et cette augmentation a eu des répercussions sur la période et le degré de croissance des végétaux et la diversité de ces derniers (Zhang et al., 2011). Les températures de l'air en surface dans l'Arctique depuis 2005 sont plus élevées qu'elles ne l'ont été pendant toute période de cinq ans depuis les années 1880, moment où elles ont été mesurées pour la première fois. De plus, les mesures provenant de sédiments lacustres, d'anneaux de croissance d'arbres et de carottes de glace donnent à penser que les récentes températures estivales sont les plus élevées des 2 000 dernières années (AMAP, 2012). D'autres changements ont été documentés, notamment des apports d'eau chaude accrus dans l'océan Arctique à partir de l'océan Pacifique, des baisses de l'étendue et de la durée de la couverture de neige (la superficie terrestre recouverte de neige au début de l'été a diminué de 18 % depuis 1966) et la disparition de la glace de mer dans l'Arctique à un taux plus élevé au cours des 10 dernières années que le taux moyen pour les 20 années précédentes. L'épaisseur de la glace de mer diminue également, et la couverture de glace de mer est de plus en plus dominée par de la glace plus jeune et plus mince (AMAP, 2012).
Il est difficile de modéliser les températures futures dans l'Arctique à cause des incertitudes entourant la fonte de la couverture de neige et le retrait de la glace de mer, qui accélèrent déjà beaucoup plus vite qu'il ne l'avait été prédit (voir ci-dessous). Les experts conviennent néanmoins que, d'ici 2100, la moyenne des prévisions de la température de l'air en hiver dans l'Arctique selon divers scénarios de concentration de CO2 sera une augmentation de la température de 2 à 9°C au-dessus de la moyenne pour 1986–2005; les prévisions les plus élevées vont jusqu'à environ 15°C au-dessus de la moyenne pour 1986–2005 (IPCC, 2013b). Christensen et al. (2013) ont prédit que, d'ici 2035, la température annuelle moyenne en surface dans l'Arctique augmentera de 1,5 oC, la température moyenne en hiver (décembre à février) devant normalement augmenter plus que la température moyenne en été (juin à août) (+ 1,7°C en hiver contre + 1°C en été). La moyenne des prévisions de la température de la surface de la mer se traduit par une augmentation de la température de 4 à 14°C selon des scénarios de concentration de CO2 raisonnablement prévisibles, les estimations selon le scénario de concentration de CO2 la plus élevée situant l'augmentation de la température à environ 23°C au-dessus de la moyenne pour 1986–2005 (IPPC, 2013).
De 1951 à 2008, les précipitations annuelles moyennes ont augmenté de 0,63 à 5,83 mm/année/décennie à l'échelle de l'Arctique (IPCC, 2013). Les données recueillies aux stations climatiques des Territoires du Nord-Ouest révèlent une augmentation des chutes de neige de 20 à 40 % dans la toundra arctique (GNWT, 2014). Selon les prévisions, les précipitations annuelles moyennes devraient encore augmenter de 6 % d'ici 2035, étant plus abondantes en hiver qu'en été (Christensen et al., 2013).
Cette catégorie de menaces comprend trois composantes principales : les modifications de l'habitat terrestre, le retrait de la glace de mer et la hausse du niveau de la mer. Collectivement, ces menaces devraient toucher la plus grande partie, sinon la totalité, de l'aire de répartition du caribou de Peary, l'impact global allant de modéré à grave en fonction de nombreux facteurs concurrents.
Modifications de l'habitat terrestre
Les augmentations de la température (et d'autres changements climatiques, comme l'augmentation de la concentration de CO2) ont mené à une augmentation de la biomasse végétale. Ahern (2010) a utilisé une analyse de l'indice de végétation par différence normalisée (IVDN) obtenu de satellites pour montrer que la croissance végétale a augmenté dans les parties sud et ouest de l'aire de répartition du caribou de Peary au cours des trois dernières décennies. En résumé, l'Arctique devient plus en plus vert et la productivité primaire augmente (Eamer et al., 2013). Ces changements incluent la feuillaison et la floraison hâtives des plantes, qui reflètent le réchauffement général au cours de la même période (Oberbauer et al., 2013). Toutefois, la mesure dans laquelle le verdissement, dû principalement à la plus grande biomasse d'arbustes (en particulier d'arbustes à feuilles persistantes), améliorera l'habitat ou la disponibilité de nourriture et offrira un contenu nutritionnel suffisant pour le caribou de Peary, est inconnue. Un modèle spatialement explicite bâti par Tews et al. (2007a) leur a permis de conclure que, selon des scénarios où la fréquence des phénomènes météorologiques extrêmes ne changeait pas au cours du présent siècle, une augmentation projetée de 50 % de la biomasse pourrait atténuer la gravité des mortalités massives au sein de la population pendant les années avec perturbations. Toutefois, lorsque l'inaccessibilité à de la nourriture pendant les hivers difficiles augmentait de plus de 30 % au cours de la même période, comme on pourrait s'y attendre si la fréquence et la gravité des épisodes de perturbation augmentaient (résultat prévu des changements climatiques; Larsen et al., 2014), les modèles laissaient supposer des effets négatifs nets sur la dynamique de la population de caribous de Peary.
Plusieurs auteurs ont émis l'opinion qu'un décalage phénologique pourrait menacer le caribou de Peary si les changements climatiques venaient à modifier la synchronisation actuelle entre, d'une part, la mise bas et la lactation et, d'autre part, la feuillaison et la floraison des plantes (Festa-Bianchet et al., 2011; Gunn, 1995, 1998; Gunn et Skogland, 1997; Oberbauer et al., 2013; Parks Canada, 2010; Tews et al., 2007b). Ce décalage se produit peut-être déjà dans d'autres aires de répartition du caribou dans l'Arctique. Dans l'ouest du Groenland, le début hâtif de la saison de croissance des plantes pendant une période d'augmentation de la température a entraîné une augmentation de la mortalité des faons et une diminution, d'un facteur de quatre, du recrutement de faons sur une période d'environ 10 ans (Kerby et Post, 2013; Post et Forchhammer, 2008).
Retrait de la glace de mer
Le retrait de la glace de mer se produit à un rythme plus rapide que ne le prévoyaient les premiers modèles (Overland et Wang, 2013). L'étendue de la glace saisonnière en 2012 a diminué jusqu'à sa valeur la plus faible enregistrée, prolongeant une tendance qui a accéléré après 2000. L'étendue en 2012 se situait à environ la moitié de l'étendue moyenne en été de 1979 à 2000, alors que l'étendue maximale en hiver était la cinquième plus faible au cours des 35 dernières années (Vinas, 2013). L'étendue de la glace de mer en septembre pourrait encore reculer de 43 à 94 % d'ici 2100; selon le scénario des émissions de CO2 les plus élevées, il est probable que l'océan Arctique sera presque libre de glace en septembre avant le milieu du siècle (IPCC, 2013). L'étendue de la glace de mer pérenne et pluriannuelle dans l'Arctique a diminué de 1979 à 2012, et l'épaisseur moyenne de la glace de mer en hiver dans le bassin arctique a diminué de 1,3 à 2,3 m de 1980 à 2008 (IPCC, 2013). Pour ce qui est des traversées de glace de mer par les caribous de Peary (figure 2), les déclins de la concentration totale de glace de mer qui se sont produits de 2001 à 2010 s'élevaient à 50 % dans le détroit de M'Clintock et à 38 % dans le chenal de l'Arctique de l'Est (Stern et Gaden, 2015). La tendance générale va vers un englacement plus tardif et des épisodes de dégel plus fréquents durant l'hiver aujourd'hui que dans le passé (Ekaluktituiak HTA, 2013).
La mesure dans laquelle le retrait de la glace de mer pourrait interrompre les migrations interinsulaires et d'autres déplacements du caribou de Peary dans des parties de son aire de répartition et avoir des impacts à l'échelle de la population est inconnue. Des chasseurs ont signalé des épisodes de noyade massive, dans les années 1950, de caribous de Peary qui traversaient d'une île à l'autre, et certains soupçonnaient que de telles hécatombes étaient la cause des déclins locaux (William Kagyut, cité dans Elias, 1993; Kassam, 2009). La nature de l'impact sur les sous-populations de caribous de Peary dépendrait du moment de la prise de la glace de mer à l'automne et de la débâcle à l'été, qui peut avoir une incidence sur les habitudes migratoires et la capacité des individus de traverser d'une île à l'autre en toute sécurité au bon moment. Les noyades qui se produisent quand la glace cède sous le poids des animaux lorsqu'ils tentent d'atteindre des aires d'alimentation plus convenables en hiver peuvent se traduire par une augmentation des taux de mortalité. Puisque le fait de changer d'îles, c'est-à-dire d'aires d'estivage, permet le rétablissement et la croissance des plantes fourragères (Miller et al., 2005b; Resolute Bay HTO, 2013), si des caribous de Peary sont forcés de rester dans l'une ou l'autre de ces îles, il peut y avoir des conséquences sur la qualité des aliments et l'état nutritionnel des animaux piégés.
Hausse du niveau de la mer
Le niveau de la mer a augmenté d'environ 0,19 m au cours des 110 dernières années (IPCC, 2013). Il est probable qu'il augmentera encore de 0,26 à 0,82 m au cours des 90 prochaines années (IPCC, 2013). Une telle hausse pourrait inonder de grandes étendues de l'île Prince of Wales, de l'île Prince Patrick et des îles du groupe des Premiers ministres et du groupe Ringnes (Pelletier et Medioli, 2014), où le relèvement isostatique ne contrebalance pas la hausse du niveau de la mer.
Tempêtes et inondations (menaces de l'UICN No 11.4)
Plusieurs occurrences de mortalité élevée ont été signalées après des épisodes de temps violents au cours des quatre dernières décennies. Les mortalités massives de caribous de Peary dans l'OIRE étaient liées au temps inhabituellement chaud au début de l'hiver, qui a causé la fonte des quelques premiers centimètres de neige, qui ont ultérieurement gelés complètement, bloquant ainsi l'accès à de la nourriture (COSEWIC, 2004, et autres). Il en est résulté un taux de mortalité en un hiver de 46 % (1973-1974) et de 30 % (1996-1997), et un taux de plus de 90 % lorsque se produisaient trois années successives de mauvais temps. Un tel événement a tendance à produire une croûte de glace sur la neige, ou à favoriser la percolation de la neige fondue à travers le manteau neigeux, qui gèle de nouveau en profondeur ou au contact du sol. À l'appui de ce fait, les connaissances traditionnelles des Inuits indiquent la formation de jusqu'à 5 cm de glace pendant certaines années (Jenkins et al., 2010a, b; Taylor, 2005). D'après des CTA semblables portant dans l'île Banks :« … à l'automne, la prise des glaces survient dans toute l'île, puis, avant que la neige s'accumule beaucoup, du temps doux et des précipitations de pluie se produisent. Ensuite, il fait assez froid pour que la pluie gèle sur le dessus de la neige, et c'est là que les caribous cherchent à quitter l'île, parfois même en passant par l'océan…. Ils mangeaient presque exclusivement de la glace » [traduction] (Frank Carpenter, cité dans Nagy, 1999:163).
L'ampleur de la menace que peuvent poser les changements climatiques pour le caribou de Peary dépendra de la fréquence et de la gravité des épisodes de verglas (pluie sur neige et dégel–regel). Bien qu'il ait été prédit que la fréquence et la gravité des événements météorologiques violents augmenteront, une grande incertitude entoure l'endroit et le moment où ils se produiront, ainsi que les répercussions connexes sur la dynamique de la population au cours des trois prochaines générations. De nombreux rapports indiquent que la fréquence des épisodes de verglas (pluie sur neige) a augmenté dans l'aire de répartition du caribou de Peary (Festa-Bianchet et al., 2011; Gunn, 1998; Gunn et Skogland, 1997; Harding, 2004; Miller et Gunn, 2003a; Sharma et al., 2009; Tews et al., 2007b, 2012; Vors et Boyce, 2009). Selon les prévisions, la fréquence de ces épisodes continuera à augmenter à l'avenir (Hansen et al., 2011; IPCC, 2013). Le temps imprévisible est lié à la prévalence des précipitations de pluie verglaçante, et les signes observés indiquent que les événements météorologiques stochastiques sont de plus en plus courants dans l'île Banks en raison des changements climatiques (Riedlinger, 2001).
Milller et Barry (2009) ont soutenu que les principaux déclins de la population de caribous de Peary sont survenus après des intempéries d'hiver parce que l'inaccessibilité à de la nourriture causait la famine. Les chasseurs des collectivités de l'Arctique considèrent aussi que ces phénomènes posent une grave menace pour le caribou de Peary (Resolute Bay HTO, 2013; Sachs Harbour HTC, 2013; Spence Bay HTO, 2013). Les effets négatifs des phénomènes météorologiques violents, comme le verglas, sur les populations semblent se manifester principalement par le biais de la mortalité accrue due à la rareté de nourriture en hiver (« pâturages pris sous la glace »; Hansen et al., 2011) ou à la baisse de la production de faons (Miller et al., 1977; Miller, 1991a; Gunn et Dragon, 2002; Miller et Gunn, 2003; Tews et al., 2007b). En revanche, Tyler (2010) a soutenu que l'effet de températures supérieures à 0 o C lorsqu'il y a de la neige au sol dépend de l'épaisseur de la neige. Si le temps chaud peut faire fondre la surface et endurcir la croûte en conditions de neige profonde, il peut aussi accroître la disponibilité de nourriture en conditions de neige peu profonde en faisant fondre la neige et en découvrant ainsi le feuillage.
Le rôle potentiel des maladies dans la dynamique de la population de caribous de Peary est mal compris. Les CTA sur le groupe Prince of Wales–Somerset indiquent que le plus grand nombre de maladies observées étaient accompagnées de déclins des effectifs dans les années 1980 (CTA, dans Taylor, 2005). Les études sur les maladies du caribou de Peary sont rares; par conséquent, les problèmes potentiels sont extrapolés à partir des connaissances portant sur d'autres écotypes du caribou et sur le bœuf musqué.
Le Brucella suis (biovar 4), l'Erysipelothrix rhusiopathiae, l'herpèsvirus des Cervidés, le virus parapox, les Neospora, les Besnoitia et les parasites gastrointestinaux figurent parmi les agents pathogènes connus potentiellement préoccupants qui nuisent au succès reproducteur ou à la survie du caribou. Parmi ceux-ci, les menaces les plus importantes proviendraient du Brucella suis et de l'Erysipelothrix rhusiopathiae.
Le Brucella suis (biovar 4) est une bactérie qui peut causer arthrite, bursite et infertilité. Il est associé à un déclin considérable des effectifs dans l'île Southampton depuis 2000 (Campbell, 2013). La bactérie n'avait jusqu'alors jamais été signalée chez le caribou de Peary, et une enquête sérologique dans l'île Banks en 1993-1994 n'a pas révélé la présence d'anticorps de cette maladie (p. ex. les échantillons de sérum ont donné des résultats négatifs à l'égard de la brucellose; Larter et al., 1996). Des cas cliniques ont toutefois été détectés chez des bœufs musqués de l'île Victoria, près de l'inlet Minto et de la rivière Ekalluk, de 1996 à 1998 (B. Elkin, comm. pers., 2015), de même que chez un bœuf musqué abattu pas un chasseur sportif près de Cambridge Bay plus récemment (2014) (M. Tomaselli, comm. pers., 2015). La présence de la bactérie chez les caribous de la toundra du continent est bien documentée, quoique la prévalence fluctue (Leighton, 2011; Curry, 2012). Les chasseurs ont signalé que la bactérie posait un risque de maladie émergente près de Taloyoak, Kugaaruk et Gjoa Haven, au Nunavut, dans les années 1980, et qu'elle était vraisemblablement transmise par le caribou de la toundra (Gunn et al., 1991). Il n'y a pas lieu de croire qu'elle n'envahira pas, si ce n'est pas déjà fait, la population de caribous de Peary. Les impacts à l'échelle de la population dépendront de la dynamique de la transmission; de faibles densités de caribous de Peary peuvent limiter sa propagation.
L'Erysipelothrix rhusiopathiae est une bactérie récemment déterminée comme une importante cause de mortalité généralisée chez le bœuf musqué dans les îles Banks et Victoria. Il est probable qu'il est en partie à l'origine des déclins observés de près de 70 % dans l'île Banks depuis 2010 (Kutz et al., 2013). Cet agent pathogène est généraliste et opportuniste; il infecte souvent des animaux domestiques qui sont considérés comme « stressés ». Chez le bœuf musqué et le caribou, il peut causer la mort soudaine, et, chez le premier, à toutes les classes d'âge. Plusieurs hardes de caribous de la toundra ont montré des résultats positifs à l'égard de l'exposition à la bactérie (S. Kutz, comm. pers., 2015), qui a été considérée comme responsable de la mort de caribous des montagnes en Colombie-Britannique (Forde, 2015). Bien qu'il reste de nombreuses incertitudes entourant l'origine et l'écologie de cette bactérie dans l'Arctique, les premières données donnent à penser que cette dernière devrait être considérée comme un agent pathogène d'intérêt pour tous les ongulés de l'Arctique, y compris le caribou de Peary (Forde, 2015).
En général, les scénarios actuels de réchauffement climatique prévoient l'expansion de l'aire de répartition de plusieurs agents pathogènes, ce qui s'est déjà produit dans le cas d'au moins un parasite, le strongle pulmonaire Varestrongylus eleguneniensis (Kutz et al., 2013). En 2010, ce parasite, qui infecte tant le caribou que le bœuf musqué, a été détecté pour la première fois dans l'île Victoria. Il y a probablement été introduit par le biais des migrations de caribous de Dolphin-et-Union ainsi que des déplacements sporadiques de bœufs musqués entre le continent et l'île. Les conditions climatiques récemment moins rigoureuses semblent avoir permis à ce parasite de se maintenir et d'étendre sa répartition géographique plus au nord, jusqu'à la région de la rivière Surrey (P. Kafle, comm. pers., 2015). Comme le parasite requiert des limaces ou des escargots comme hôtes intermédiaires, sa répartition pourrait être limitée par l'abondance de ces hôtes. Toutefois, un strongle pulmonaire apparenté du bœuf musqué a aussi étendu son aire de répartition jusque dans l'île, près d'Ulukhaktok, ce qui permet de prévoir que l'expansion dans l'aire de répartition du caribou de Peary. Bien que le V. eleguneniensis ne soit pas considéré comme particulièrement pathogène, la récente expansion de son aire de répartition montre que les changements climatiques entraînent déjà des changements dans la répartition et l'abondance d'agents pathogènes du caribou.
Le réchauffement climatique peut aussi se traduire par une vulnérabilité accrue du caribou aux maladies infectieuses et au harcèlement par les insectes. Les Inuits ont confirmé que le temps chaud peut causer un appauvrissement de l'état corporel chez le caribou, et ils ont remarqué une hausse de la mortalité due à l'épuisement lié à la chaleur et induit par les insectes, qu'ils ont attribué aux changements climatiques (CTA, dans Dumond, 2007; Thorpe et al., 2001).
Les conditions météorologiques estivales régulent l'activité des hypodermes. Dans les aires de répartition du caribou de la toundra, ces conditions sont maintenant plus favorables aux hypodermes, dont la saison d'activité s'est allongée de 1957 à 2009 (Gunn et al., 2011, et références citées). Les hypodermes sont nettement moins communs dans les îles de l'Extrême-Arctique (p. ex. 97 à 100 % de la harde de caribous de Beverly était infecté par des hypodermes, mais seulement 14 % de la harde de caribous de Peary l'étaient; Thomas et Kiliaan, 1990), mais le stade adulte, qui constitue le stade infectieux, durera peut-être plus longtemps si les températures estivales augmentent, tandis que leur prévalence pourra augmenter si le réchauffement planétaire continue.
En revanche, des températures estivales plus élevées peuvent ne pas être favorables à tous les parasites, notamment les vers gastrointestinaux (Hoar et al., 2012). Un climat plus chaud aura une incidence non seulement sur les maladies et les parasites existants, mais augmentera aussi la probabilité d'introduction d'espèces envahissantes (Kutz, 2007; Davidson et al., 2011).
Le déclin prévu de l'étendue de la glace de mer accroît la possibilité d'ouvrir des voies de navigation à longueur d'année dans l'archipel arctique canadien, notamment le passage du Nord-Ouest. L'atténuation de plus en plus marquée des conditions de glace devrait se traduire par la prolongation de la saison de navigation et l'intensification du trafic maritime. De 1990 à 2011, le trafic s'est intensifié de 75 %, atteignant un maximum de 19 transits en 2010 (NORDREG, cité dans ENR, 2011, mis à jour jusqu'en 2012 par SARC, 2012), avec de gros brise-glaces empruntant la route du nord entre les îles Melville et Banks (détroit de M'Clure : le trafic a sextuplé de 1993 à 2011; SARC, 2012). Les passages de navires de croisière ont déjà plus que triplé entre 1993 et 2007 (Judson, 2010, cité dans Gunn et al., 2011). Le trafic maritime a affiché une hausse de 75 % dans les eaux canadiennes de l'Arctique de 1990 à 2012, alors que l'étendue de la glace de mer avait diminué, et il devrait s'intensifier davantage. L'intensification du trafic maritime facilitée par l'exploitation des brise-glaces exacerberait les effets induits par le climat que sont la glace plus mince et les périodes d'eau libre plus longues (Gunn et al., 2011; Poole et al., 2010).
Le transport par eau comme menace potentielle pour le caribou de Peary doit être pris en compte en raison de ses migrations saisonnières interinsulaires (Paulatuk HTC, 2013; Resolute Bay HTO, 2013). En plus des conséquences potentielles de l'amincissement de la glace sur la population (décrites ci-dessus), l'ouverture de chenaux de navigation pendant l'hiver nuirait à certaines traverses entre les îles. La gravité de l'impact sur l'ensemble de la population dépendra des traverses touchées, de la régularité des effets d'une année à l'autre et de la taille des effectifs. Des chenaux de navigation (figure 6) pourraient s'ouvrir entre les îles Prince of Wales et Somerset (traverses Prince of Wales–Somerset et Reine-Élisabeth–Prince of Wales) et les îles Bathurst et Cornwallis, mais il est moins probable qu'ils toucheront les îles d'Ellesmere et Axel Heiberg, ou le groupe Ringnes, qui sont tous en grande partie entourés d'une banquise très serrée (figure 3) et ne sont pas situés sur une route commerciale.
L'exploration et l'exploitation énergétiques et minières (décrites ci-dessous; figure 6) pourraient également précipiter l'intensification du trafic maritime dans la région. Dans l'ensemble, le trafic maritime devrait augmenter dans l'archipel arctique canadien dans un avenir rapproché.
Les Inuits d'aujourd'hui et les cultures qui les ont précédés, dont les Thulés, desquels ils descendent, et les cultures dorset et pré-dorset non apparentées, chassent le caribou dans la région depuis au moins 4 000 ans (Fitzhugh, 1976; Friesen, 2013; Howse, 2008; Manseau et al., 2005; Meldgaard, 1960). La chasse à grande échelle et l'achat de viande de caribou par les explorateurs européens, et l'initiation des Inuits aux armes à feu par ces derniers (p. ex. par Peary dans les années 1890; Roby et al., 1984), ont causé ou accéléré certains déclins, par exemple dans l'île d'Ellesmere (Petersen et al., 2010).
La plus grande partie de l'aire de répartition du caribou de Peary est trop inaccessible depuis les établissements pour que les chasseurs puissent s'y rendre en motoneige. Aucune collectivité n'est établie dans le complexe Melville–Prince Patrick, les groupes des Premiers ministres et Ringnes, l'île Axel Heiberg et le nord de l'île d'Ellesmere (à l'exception de la base militaire d'Alert). Les stations météorologiques de Mould Bay (île Prince Patrick) et d'Isachsen (île Ellef Ringnes) sont actuellement inhabitées. Par conséquent, la chasse moderne au caribou de Peary a lieu dans des régions accessibles depuis les établissements situés dans l'aire de répartition de la population ou à proximité.
La chasse au caribou par les bénéficiaires de l'Accord sur les revendications territoriales du Nunavut (ARTN), c.-à-d. les Inuits, n'est pas limitée par la loi, à moins que survienne un problème de conservation qui entraîne l'établissement d'une prise totale autorisée (PTA). En l'absence d'une PTA, il n'existe aucune exigence de déclaration. Plus précisément, aux termes du chapitre 5, « lorsque la prise totale autorisée n'a pas été établie à l'égard […] d'un stock ou d'une population d'une ressource faunique […], un Inuk du Nunavik a le droit de récolter […], ce stock ou cette population dans la RMN, jusqu'à concurrence de la quantité dont il a besoin pour satisfaire l'ensemble de ses besoins économiques, sociaux et culturels ». La même situation s'applique aussi à la Convention définitive des Inuvialuit.
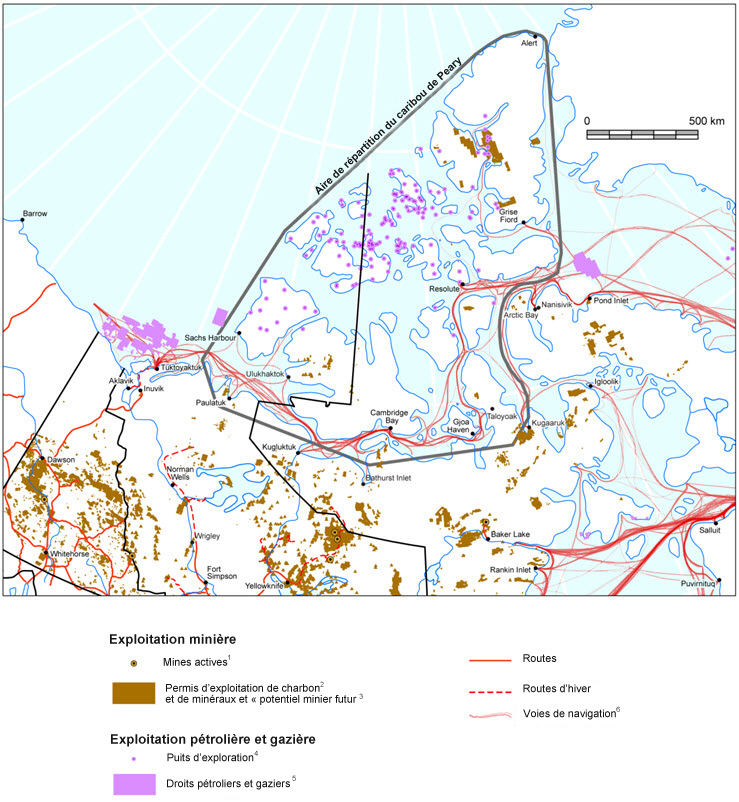
1 Mines actives : Agence canadienne de développement économique du Nord, (consulté le 15 décembre 2015)
2 Permis d’exploitation de charbon2 et de minéraux : Géomatique Yukon, Gouvernement du Yukon (consulté le 15 décembre 2015). Affaires autochtones et Développement du Nord Canada (consulté le 15 décembre 2015)
3 Potentiel minier futur : Gouvernement du Yukon, ministère de l’Énergie, des Mines et des Ressources du Yukon (consulté le 15 décembre 2015). Commission géologique des Territoires du Nord-Ouest, base de données NORMIN (http://ntgodata.nwtgeoscience.ca/) (Anglais seulement, consulté le 15 décembre 2015). NunavutGeoscience.ca, Mineral Exploration Overview Magazine 2012 (consulté le 15 décembre 2015)
4 Puits d’exploration : Ressources naturelles Canada, base de données BASIN (consulté le 15 décembre 2015)
5 Droits pétroliers et gaziers : Affaires autochtones et du Nord Canada, Fichiers numériques des droits pétroliers et gaziers (consulté le 15 décembre 2015)
6 Voies de navigation : Généralisation à partir de Routes de navigation dans l’Arctique canadien en 2010, Projets spéciaux et navigation dans l’Arctique, 2011, Transports Canada
Description longue de la figure 6
Carte illustrant l'emplacement des sites d'exploitation de ressources dans l'Arctique canadien. Pour ce qui est de l'exploitation minière, la carte indique l'emplacement des mines actives, des sites faisant l'objet d'un permis d'exploitation de charbon et de minéraux, ainsi que du potentiel minier futur. En ce qui concerne le pétrole et le gaz, la carte indique l'emplacement des puits d'exploration et des droits pétroliers et gaziers. Les autres renseignements portent sur les routes, les routes d'hiver et les voies de navigation.
L'absence de limites de prise et de déclaration obligatoire signifie que les registres de chasse ne sont pas tenus régulièrement, ce qui empêche toute analyse quantitative ou énumération des tendances. De plus, même lorsque les taux de chasse sont suivis, l'effort est sous-déclaré, ce qui ajoute à la difficulté de déterminer quand la chasse atteint des nifaons insoutenables. Toutefois, d'autres indications laissent supposer que les taux de prise actuels sont faibles là où la chasse est pratiquée dans l'aire de répartition du caribou de Peary. Une compilation des déclarations volontaires de prises de caribous de Peary au Nunavut au cours de la dernière décennie a révélé que les résidents de Resolute Bay abattent environ 10 à 36 animaux par année (principalement dans l'île Bathurst), alors que les résidents de Grise Fjord en abattent environ 10 à 60 dans les îles d'Ellesmere et Devon (Government of Nunavut, 2011). Les prises annuelles dans les Territoires du Nord-Ouest au cours de la dernière décennie s'élevaient à 12 caribous ou moins dans l'île Banks et à 0 dans l'inlet Minto et l'OIRE (Gissing et Fleck, 2011).
Les chasseurs inuits et inuvialuits ont la réputation de restreindre volontairement, par le biais de leurs associations locales, la chasse au caribou de Peary quand il est établi que les effectifs sont faibles (Ferguson, 1987; Ferguson et al., 2001; Larter et Nagy, 1995; 2000a; Miller et Gunn, 1978; Taylor, 2005). Par exemple, de 1974 à 1989, l'Association des chasseurs et des trappeurs de Resolute Bay a interdit la chasse au caribou de Peary dans l'île Bathurst. En 1982, dès qu'il a été constaté que les caribous de l'île Bathurst migraient vers l'île Cornwallis, l'interdiction a été élargie de manière à inclure cette île. De 1989 à 1996, à mesure que les effectifs ont augmenté, l'Association a autorisé une chasse limitée en consultation avec des biologistes du gouvernement territorial. Toutefois, après la mortalité massive qui s'est produite entre 1995 et 1997, la chasse a été interdite de nouveau. De même, les chasseurs inuits de Grise Fiord ont imposé pendant 10 ans un moratoire sur la chasse au caribou dans la plus grande partie du sud de l'île d'Ellesmere, soit de 1986 à 1996, période pendant laquelle les effectifs étaient faibles. Aucune limite de prise n'est actuellement exigée des bénéficiaires de l'ARTN qui chassent le caribou de Peary au Nunavut.
La chasse peut être un facteur qui a joué un rôle dans la tendance décroissante des effectifs du caribou de Peary dans le nord-ouest de l'île Victoria (Gunn et al., 1998). En réponse au déclin, le Comité de chasseurs et de trappeurs d'Olokhaktomiut a adopté une règle établissant une limite de zéro à la chasse, qui est maintenant imposée par la législation territoriale (Gunn, 2005). De 300 à 450 caribous (surtout des femelles) ont été abattus annuellement dans l'île Banks dans les années 1970 et 1980, ce qui a biaisé la sous-population en faveur des mâles et des individus plus jeunes (Larter et Nagy, 2000a). Malgré les mesures prises par les chasseurs de Sachs Harbor pour adopter un quota volontaire pour l'île Banks en 1990, la sous-population a continué à diminuer. Ce quota est encore en place (GNWT, 2011, cité dans SARC, 2012), et les relevés depuis 1998 montrent une tendance à la hausse (voir Fluctuations et tendances). Le Comité sur les espèces en péril des Territoires du Nord-Ouest (SARC, 2012) a signalé un taux de prise de 1 à 3 % dans l'île Banks depuis le milieu des années 2000. D'après l'abondance et les taux de prise estimatifs, Miller et al. (2007a, c) ont expliqué comment la chasse dans la presqu'île de Boothia pourrait avoir contribué au déclin de 98 % (1980-1995) de la sous-population Prince of Wales–Somerset (voir Fluctuations et tendances).
En résumé, il y a des antécédents de collaboration entre les associations communautaires locales et les biologistes à la mise en œuvre de la gestion communautaire en vue de reconnaître les impacts potentiels de la chasse sur la population de caribous de Peary dans certaines conditions. Par conséquent, les taux de chasse actuels par les collectivités inuites et inuvialuites situées dans l'aire de répartition du caribou de Peary semblent être faibles par rapport à ce qu'ils étaient dans les années 1990. Toutefois, la nature non méthodique de la collecte de statistiques sur la chasse, la faible fréquence des relevés de la population et la portée limitée de l'échantillonnage démographique pour quantifier le recrutement, la mortalité par âge et la fécondité entraînent collectivement une incertitude considérable des tendances démographiques, des taux de chasse et de leur interaction. Le succès continu de la gestion communautaire de la chasse à titre de composante dynamique de la conservation du caribou de Peary reposera sur le suivi adéquat et la capacité de tenir compte des tendances changeantes, y compris les déclins marqués de la harde de caribous de l'île de Baffin, de plusieurs hardes de caribous de la toundra sur le continent et des effectifs du bœuf musqué des îles Banks et Victoria (Kutz et al., 2015); de la demande croissante en caribous par les populations humaines en croissance rapide; de l'intérêt croissant pour les aliments traditionnels; des répercussions potentielles sur la chasse commerciale.
Des interactions possibles entre des proies multiples (en particulier le bœuf musqué) et le loup ont été mentionnées précédemment (voir Interactions interspécifiques). Bien que l'impact de la prédation exercée par le loup sur la dynamique de la population de caribous de Peary soit inconnu, de nombreux auteurs considèrent que la prédation pose une grave menace au rétablissement du caribou lorsque ses effectifs sont faibles (Nagy et al., 1996; Gunn et al., 2000b; SARC, 2012). L'influence que peuvent avoir de telles interactions dans un environnement en voie de réchauffement et de verdissement ajoute une nouvelle dimension à la question, et c'est pourquoi ces interactions sont considérées comme une menace, quoique de faible impact, dans le présent rapport de situation, et non comme un facteur limitatif.
Les activités industrielles sont actuellement limitées, les prix du marché étant un déterminant important de l'échelle et de l'intensité d'une activité à un moment donné. L'exploration minière, en particulier du charbon dans l'île d'Ellesmere, a cours dans l'aire de répartition du caribou de Peary (CWS, 2013; 2014; 2015), mais il se déroule peu d'activités de prospection sismique ou d'exploitation du pétrole et du gaz dans l'aire de répartition en général (figure 6).
Les années 1960 et 1970 étaient la période la plus active de prospection pétrolière et gazière dans l'aire de répartition du caribou de Peary, lorsque cette activité était répandue dans les îles Banks, Melville et Prince Patrick (Usher, 1971; Miller et al., 1977a). La mine Polaris, située dans l'île Little Cornwallis, était, de 1980 à 2002, la seule mine (Zn-Pb) située à l'intérieur de l'aire de répartition du caribou de Peary qui était exploitée. L'essor de la prospection pétrolière dans les années 1960, ainsi que d'autres facteurs, a mené à la découverte d'un gisement et à son exploitation; le soutien logistique requis pour l'exploitation a permis de poursuivre la prospection jusqu'à la fermeture de la mine en septembre 2002 (Dewing et al., 2006). Des activités d'exploration minière ont été menées dans les monts Shaler du nord-ouest de l'île Victoria dans les années 1990, mais elle n'a pas mené à l'aménagement d'une mine (SARC, 2012). Il existe peut-être des gisements de pétrole et de gaz, ainsi que de minéraux, dans l'ensemble de l'aire de répartition du caribou de Peary, et des puits d'exploration ont été forés partout dans l'île Banks et l'OIRE (figure 6). L'exploitation de gisements de charbon thermique à haute teneur, qui peuvent contenir du charbon métallurgique et qui ont été découverts à la surface ou à proximité de celle-ci dans l'île Axel Heiberg et le centre de l'île d'Ellesmere, a été proposée par WestStar Resources et, plus récemment, par la Canada Coal, qui détient les permis de la péninsule Fosheim. Ces deux entreprises ont toutefois retiré leur proposition en 2013 auprès de la Commission du Nunavut chargée de l'examen des répercussions en attente d'autres consultations. La délimitation du parc national Qausuittuq (situé dans le nord de l'île Bathurst) récemment publiée dans la Gazette du Canada reflète les recommandations du Comité supérieur de l'évaluation des ressources minérales et énergétiques, qui a établi un potentiel élevé de minéralisation de plomb-zinc sur la côte nord-est de l'île Bathurst et un potentiel pétrolier dans le sud-ouest de l'île Cameron, et exclut cette île du parc malgré son importance connue pour le caribou (Resolute Bay HTO, 2013; Poole et al., 2015).
Les CTA font état de préoccupations quant à la forte influence négative des activités industrielles sur le caribou de Peary, notamment :
- des effets négatifs directs sur la santé des animaux attribuables à la fumée et à la poussière produites par les explosions lors de la prospection sismique, ainsi qu'aux fuites de carburant ou de rouille provenant de fûts (Taylor, 2005; Ivig HTA, 2013; Resolute Bay HTO, 2013; Sachs Harbour HTC, 2013);
- un comportement d'évitement associé aux perturbations sensorielles (Taylor, 2005; CWS, 2013; Ivig HTA, 2013; Resolute Bay HTO, 2013), aux obstacles aux déplacements (Urquhart, 1973; Slaney and Co., Ltd., 1975) et aux appareils de forage et aux camps de prospection sismique (Riewe, 1973; Urquhart, 1973; Slaney and Co., Ltd., 1975; Sachs Harbour HTC, 2013);
- la perte d'habitat, en particulier dans les zones critiques pour la mise bas et les zones de densité élevée (SARC, 2012; Resolute Bay HTO, 2013; Sachs Harbour HTC, 2013).
Selon les Inuits de Resolute Bay et de Grise Fiord, les perturbations produites par les activités d'exploration pétrolière et gazière et la prospection de charbon et de métaux communs ont entravé le déplacement du caribou de Peary vers les zones nécessaires à sa survie pendant les années de fortes accumulations de neige (Jenkins et al., 2010a, b; Taylor, 2005).
La perte d'habitat du caribou de Peary résultant des impacts cumulatifs des projets et de l'infrastructure connexe est la plus grande source d'inquiétude; les impacts sur le caribou en général sont bien documentés (Vistnes et al., 2008; Festa-Bianchet et al., 2011). L'échelle de développement actuellement envisagée par l'industrie et le gouvernement du Canada – noufaons ports, mines et routes, et accroissement de la population humaine (Government of Canada, 2013) – peut constituer une menace pour le caribou de Peary si la gestion n'est pas fondée sur l'endroit et le moment (p. ex. voies migratoires, aires de mise bas, lieux de rut). Le caribou de Peary évite les activités industrielles, notamment les routes et la circulation des véhicules hors route, bien que des individus puissent s'approcher d'un tel véhicule par curiosité (Slaney and Co., Ltd., 1974, 1975; Nellemann et Cameron, 1998); il évite également les hélicoptères (Gunn, 1984; Gunn et Miller, 1980). Bien que ces effets soient localisés, ils peuvent nécessiter une plus grande dépense d'énergie de la part des caribous pendant les périodes difficiles sur le plan nutritionnel et inciter ces derniers à quitter leur habitat de prédilection. Les facteurs de stress cumulatifs peuvent aussi se traduire par une vulnérabilité accrue aux maladies infectieuses.
Il y a des indications montrant que les intrusions humaines résultant d'activités de travail (non touristiques) et les exercices militaires menés toute l'année sont à la hausse dans certaines parties de l'aire de répartition du caribou de Peary. Ces activités ont donné lieu à une augmentation de la circulation de motoneiges, d'hélicoptères et d'avions (y compris des vols non prévus). Si ces activités interrompent la quête de nourriture ou mènent à un comportement d'évitement nuisant aux déplacements, elles peuvent entraîner une hausse des coûts énergétiques chez le caribou (Weladji et Forbes, 2002). Les Inuits de Grise Fiord et de Resolute Bay ont également documenté leurs préoccupations quant aux impacts négatifs potentiels sur le caribou de Peary de la capture au filet, de la pose de collier et d'autres activités de recherche (Iviq HTA, 2013; Resolute Bay HTO, 2013). Aucune activité de capture de caribous de Peary n'a été entreprise au Nunavut depuis 2003 en raison des préoccupations communautaires.
Les systèmes climatiques mondiaux transportent des composés organiques volatils du sud au nord, où ils se condensent, se précipitent et s'accumulent (p. ex. Prowse et al., 2009). Les caribous de la toundra de l'île Baffin et du continent présentent des quantités traces de contaminants organiques, comme le HCB (hexachlorobenzène) et le PCB (polychlorobiphényles), qui sont probablement transportés par voie atmosphérique depuis d'autres continents, notamment l'Asie (Elkin et Bethke, 1995). Les teneurs en contaminants chez le caribou de Peary de l'île Banks ont été mesurées dans les années 1990. Ces animaux présentaient les plus faibles teneurs signalées dans l'étude de 15 sous-populations canadiennes de caribous, qui étaient semblables aux teneurs de fond relevées chez des humains (MacDonald et al., 1996; Larter et Nagy, 2000 b). Les collectivités inuites et inuvialuites ont exprimé des préoccupations au sujet des concentrations de contaminants, notamment en ce qui concerne l'île Bathurst (Resolute Bay HTO, 2013).
Les caribous de Peary de l'île Banks présentaient des teneurs rénales en métaux lourds plus faibles que celles des caribous de la toundra du continent, résultat que Larter et Nagy (2000 b) ont attribué à leur faible consommation de lichens. Les métaux lourds sont des éléments d'origine naturelle sans source anthropique locale connue.
Les modifications de l'habitat dues aux changements climatiques (p. ex. phénomènes météorologiques violents et retrait de la glace de mer) constituent la plus grave menace pesant sur le caribou de Peary, mais le moment et l'emplacement géographique des événements menaçants subséquents font qu'il est impossible d'estimer le nombre de localités distinctes, telles que définies par l'UICN (IUCN, 2014).
Le caribou de Peary est cogéré au Nunavut conformément à l'Accord sur les revendications territoriales du Nunavut, et dans les Territoires du Nord-Ouest, à la Convention définitive des Inuvialuit. Ces ententes confèrent le pouvoir de gestion des espèces sauvages faune aux conseils de gestion respectifs, soit le Conseil de gestion des ressources fauniques du Nunavut et le Conseil consultatif de la gestion de la faune (Territoires du Nord-Ouest).
Le COSEPAC a désigné le caribou de Peary « espèce menacée » dans sa plus récente évaluation, réalisée en 2015. Le caribou de Peary figure actuellement à titre d'espèce en voie de disparition à l'<a href="default.asp?lang=En&n=D7477596-1&offset=2">annexe 1</a> de la Loi sur les espèces en péril (2011) (Partie II, Gazette du Canada, vol. 145, no 4, 2011-02-16). Dans les Territoires du Nord-Ouest, le caribou de Peary est inscrit à titre d'espèce menacée à la Loi sur les espèces en péril (T.N.-O.). Les dispositions concernant la désignation d'espèce en péril en vertu de la Nunavut Wildlife Act n'ont pas encore été promulguées.
À l'échelle mondiale, le caribou de Peary s'est vu attribuer la cote de conservation G5T1 (NatureServe, 2012), ce qui signifie qu'il est une sous-espèce gravement en péril appartenant à une espèce par ailleurs largement répandue et commune. Il a été reçu la cote N1 à l'échelle nationale; S1 dans les Territoires du Nord-Ouest; SNR (non classée) au Nunavut (NatureServe, 2014).
Toutes les terres, sauf les terres privées appartenant à des organisations inuites ou à des municipalités, sont des terres de la Couronne du chef des territoires respectifs. La figure 7 illustre les parcs nationaux et d'autres aires fédérales protégées. Les parcs nationaux Quttinirpaaq (île d'Ellesmere), Qausuittuq (île Bathurst) et Aulavik (île Banks) sont situés dans l'aire de répartition du caribou de Peary.
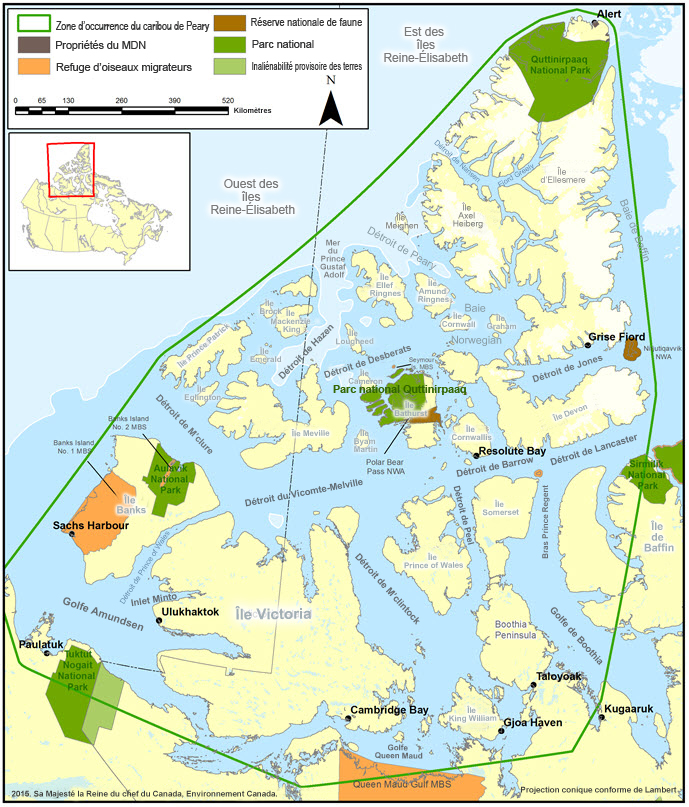
Description longue de la figure 7
Carte indiquant l'emplacement des parcs nationaux et des autres aires protégées, comme les aires de gestion de la faune et les refuges d'oiseaux migrateurs, au sein de la zone d'occurrence du caribou de Peary.
Les membres du Sous-comité de spécialistes des mammifères terrestres du COSEPAC ont fourni de judicieux examens, conseils et analyses tout au long du processus de compilation du présent rapport de situation. Le rédacteur remercie tout spécialement Agnes Richards, Cheryl Johnson et Erin Neaves, d'Environnement Canada, de lui avoir fourni des renseignements sur les aspects techniques du rétablissement du caribou de Peary, en particulier sur les effectifs de la population. Il remercie également Dawn Andrews, Jeff Bowman et Andrew Murray d'avoir préparé les figures, ainsi que les personnes suivantes, qui ont fourni des renseignements, des analyses et des examens approfondis et précieux soignés à diverses étapes.
| Instance | Nom des personnes-ressources |
|---|---|
| Service canadien de la faune | Siu-ling Han, Lisa Pririe, Bruce MacDonald, Vanessa Charlwood, Ruben Boles, Syd Cannings, Donna BigeFaible, Dawn Andrews, Cheryl A. Johnson, Agnes Richards, Erin Neave, Pauline Quesnelle |
| Parcs Canada | Patrick Nantel, Micheline Manseau, Andrew Maher |
| Territoires du Nord-Ouest | Suzanne Carrière, Nic Larter, Joanna Wilson, Claire Singer, Kendra McGreish, Michelle Henderson, Tracy Davison |
| Nunavut | Morgan Anderson, Lynda Orman, Lisa-Marie Leclerc |
| Centre(s) de conservation des données ou Centre(s) d'information sur le patrimoine naturel | Robert Anderson, Jennifer Doubt |
| Conseils de gestion des ressources fauniques : Conseil consultatif de la gestion de la faune; Conseil de gestion des ressources fauniques du Nunavut | Rebecca Jeppesen, Sarah Spencer, Peter Kydd, Deborah Simmons, Walter Bezha, Chris Hopkins, Larry Carpenter |
| Secrétariat du COSEPAC | Neil Jones, Jenny Wu |
| Autres personnes-ressources utiles | John Nagy, Nic Larter, Jack Brink, Anne Gunn, Georg Tews, Kim Poole, Keri McFarlane, Deb Jenkins, Nicolas Lecomte |
| Sous-comité de spécialistes des mammifères terrestres du COSEPAC | Jeff Bowman, Nicolas Lecomte, Susan Kutz, Christopher Kyle, Chris Johnson, Martin-Hughes St-Laurent, Graham Forbes, Hugh Broders, Scott Gilbert, Stephen Petersen, Ian Thompson |
Ahern, F. 2010. NDVI trends 1985 to 2006. Canadian Council of Resource Ministers, Ottawa, Ontario.
Allen, J.A. 1902. A new caribou from Ellesmereland. Bulletin of the American Museum of Natural History 16:409 412.
Allen, J.A. 1908. The Peary caribou (Rangifer pearyi Allen). Bulletin of the American Museum of Natural History 24:487-504.
AMAP (Arctic Monitoring and Assessment Programme). 2012. Arctic Climate Issues 2011: Changes in Arctic Snow, Water, Ice and Permafrost. SWIPA 2011 Overview Report. [Anglais seulement, consulté en septembre 2015].
Anderson, M. 2014. Distribution and abundance of Peary caribou (Rangifer tarandus pearyii) and muskoxen (Ovibos moschatus) on the Bathurst Island Group, May 2013. Nunavut Department of Environment, Wildlife Research Section, NWRT PROJECT 2-13-18, Igloolik, NU. 39 pp.
Anderson, M. et M.C.S. Kingsley. 2015. Distribution and abundance of Peary caribou (Rangifer tarandus pearyii) and muskoxen (Ovibos moschatus) on southern Ellesmere Island, March 2015. Nunavut Department of Environment, Wildlife Research Section, Status Report, Igloolik, NU. 46 pp
Anderson, R.M. 1946. Catalogue of Canadian recent mammals. Ottawa, National Museum of Canada Bulletin No. 102, Biological Series 31. 238 pp.
Anonyme. 2008. Olokhaktomiut Community Conservation Plan (OCCP). 2008. Prepared by the Community of Holman, Wildlife Management Advisory Council (NWT) and Joint Secretariat.
Bandringa, R. 2010. Inuvialuit Nautchiangit- Relationships between people and plants. Inuvialuit Cultural Resource Centre. 320 pp.
Banfield, A.W.F. 1961. A revision of the reindeer and caribou, genus Rangifer. National Museum of Canada Bulletin No. 177, Biological Series 66. 137 pp.
Berger, T. 1976. Transcripts of the proceedings at the community hearings of the Mackenzie Valley Pipeline Inquiry before the Honourable Mr. Justice Berger, Commissioner. March 4, 1976. Volume 42. Sachs Harbour, NWT.
Bernier, J.E. 1910. Report on the Dominion of Canada government expedition to the Arctic islands and Hudson Strait on board C. G. S. Arctic. Ottawa, Ontario, Government Printing Bureau. [Également disponible en français : Bernier, J.E. 1910. Rapport sur la croisière faite par le trois-mâts mixte Arctic de la Puissance du Canada dans l’archipel arctique et le Détroit d’Hudson, Ottawa (Ontario). Imprimerie nationale.]
Buckland, A.T., K.P. Burnham, J.L. Laake, D.L. Borchers et L. Thomas. 2001. Introduction to distance sampling: estimating abundance of biological populations. Oxford University Press, New York, New York.
Callaghan, T., L.O. Björn, E.S. Chapin III, Y. Chernov, T.R. Christensen, B. Huntley, R. Ims, M. Johanson, D. Jolly, S. Jonasson, N. Matveyeva, N. Panikov, W. Oechel et G. Shaver. 2005. Chapter 7 Arctic tundra and polar desert ecosystems. Pp. Chapter 7 1-172 in Arctic Climate Impact Assessment (ACIA) Scientific Report, Cambridge University Press.
Campbell, M.W. 2013. Population estimate of a declining population of island bound barren-ground caribou (Rangifer tarandus groenlandicus), Southampton Island NU. Research Update to the Department of Environment. Interim Report Department of Environment, Kivalliq Region, Arviat, Nunavut.
Campbell, M.W. 2006. Estimating Peary caribou (Rangifer tarandus pearyi) and muskox (Ovibos moschatus) numbers, composition and distributions on Ellesmere Island, Nunavut. Government of Nunavut, Department of Environment, Status Report No.19, Iqaluit, Nunavut. 12 pp.
Curry, P.S. 2012. Blood on filter paper for monitoring caribou health: efficacy, community-based collection, and disease ecology in circumpolar herds. Thèse de doctorat, Faculty of Medicine, University of Calgary, Calgary, Alberta, Canada. 308 pp.
CWS (Canadian Wildlife Service). 2012. Summary of Discussions at the 2012 Meeting of the Peary Caribou Recovery Strategy Development Group - October 16-18, 2012. Rapport inédit du Service canadien de la faune. Yellowknife, NT.
CWS. 2013. Summary of Discussions at the 2013 Meeting of the Peary Caribou Recovery Strategy Development Group - October 22-24, 2013. Rapport inédit du Service canadien de la faune. Yellowknife, NT.
CWS. 2015. Summary of Discussions at the 2015 Meeting of the Peary Caribou Recovery Strategy Development Group - February 17-19, 2015. Rapport inédit du Service canadien de la faune. Yellowknife, NT.
Case, R. et T. Ellsworth. 1991. Distribution and abundance of muskoxen and Peary caribou on southern Ellesmere Island, NWT, July 1989. Northwest Territories Department of Renewable Resources Manuscript Report No. 41, Yellowknife, NWT.
Christensen, J.H., K. Krishna Kumar, E. Aldrian, S.I. An, I.F.A. Cavalcanti, M. de Castro, W. Dong, P. Goswami, A. Hall, J.K. Kanyanga, A. Kitoh, J. Kossin, N.C. Lau, J. Renwick, D.B. Stephenson, S.P. Xie et T. Zhou. 2013. Climate Phenomena and their Relevance for Future Regional Climate Change. In : Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Stocker, T.F., Qin, D., Plattner, G.K., Tignor, M., Allen, S.K., Boschung, J., Nauels, A., Xia, Y., Bex. V., et P.M. Midgley (eds.). Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA.
Collings, P. et R. Condon. 1996. Blood on the ice: status, self-Esteem, and ritual injury among Inuit hockey players. Human Organization 55:253-262.
Condon, R. 1996. The Northern Copper Inuit: a history. Toronto, Ontariio, University of Toronto Press.
COSEWIC. 2004. COSEWIC assessment and update status report on the Peary caribou Rangifer tarandus pearyi and the barren-ground caribou Rangifer tarandus groenlandicus (Dolphin and Union population) in Canada (www.sararegistry.gc.ca/status/status_e.cfm). Committee on the Status of Endangered Wildlife in Canada (COSEWIC), Ottawa. x + 91 pp. [Également disponible en français : COSEPAC. 2004. Évaluation et Rapport de situation du COSEPAC sur le caribou de Peary(Rangifer tarandus pearyi) et le caribou de la toundra (Rangifer tarandus groenlandicus) (population de Dolphin-et-Union) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada. Ottawa. xi + 101 p.]
COSEWIC. 2011. Designatable units for caribou (Rangifer tarandus) in Canada. Committee on the Status of Endangered Wildlife in Canada, Ottawa, Ontario. 88 pp. [Également disponible en français : COSEPAC. 2011. Unités désignables du caribou (Rangifer tarandus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. 88 p.]
Davison, T., J. Adamczewski et J. Williams. 2014. Peary caribou and muskox survey on Banks Island, 2014 Summary. Rapport modifié inédit. Department of Environment and Natural Resources, GNWT, Inuvik Region.
Davison, T., J. Pongracz et J. Williams. 2013. Population survey of Peary caribou (Rangifer tarandus pearyi) and muskoxen (Ovibos moschatus) on Banks Island, Northwest Territories, July 2010. Rangifer 33 Special Issue 21:135-140.
Davison, T. et J. Williams. 2012. Caribou and muskoxen survey on Melville and Prince Patrick Islands, 2012 summary. Department of Environment and Natural Resources, GNWT, Inuvik Region, Inuvik, NWT.
Davison, T. et J. Williams. 2013. Peary caribou (Rangifer tarandus pearyi) and muskoxen (Ovibos moschatus) on northwest Victoria Island, Northwest Territories. Rangifer 33 Special Issue 21: 129-134.
Davison, T. et J. Williams. 2015. Caribou and muskox survey on Northwest Victoria Island, April/May 2015. Rapport préliminaire inédit. Department of Environment and Natural Resources, GNWT, Inuvik Region.
Dewing, K., R.J. Sharp et T. Muraro. 2006. Exploration history and mineral potential of the central Arctic Zn-Pb district, Nunavut. Arctic 59:415-427.
Dumond, M. 2006. Muskoxen abundance and distribution, and caribou distribution and calving areas on Boothia Peninsula, Nunavut. Nunavut Department of Environment Field Work Summary. Kuglutuk, NU.
Dumond, M. (ed). 2007. Western Kitikmeot caribou workshop. Iqaluit, Nunavut. Government of Nunavut, Department of Environment, Final Wildlife Report No. 19, 47 pp.
Eamer, J., G. Henry, A. Gunn et L. Harding. 2013. Arctic Ecozone+ status and trends assessment-draft September 2013. Environment Canada, Ottawa, Ontario.
Ecological Stratification Working Group. 1996. A national ecological framework for Canada. Ottawa, Ontario, Agriculture and Agri-Food Canada, Research Branch, Centre for Land and Biological Resources Research; and Ottawa: Environment Canada, State of the Environment Directorate, Ecozone Analysis Branch. 119 pp. [Également disponible en français : Groupe de travail sur la stratification écologique. 1996. Cadre écologique national pour le Canada, Ottawa (Ontario), Agriculture et Agroalimentaire Canada, Direction générale de la recherche, Centre de recherches sur les terres et les ressources biologiques; et Ottawa, Environnement Canada, Service de la conservation de l’environnement, Direction de l’analyse des écozones,144 p.]
Edlund, S.A. et Alt, B.T. 1989. Regional congruence of vegetation and summer climate patterns in the Queen Elizabeth Islands, Northwest Territories, Canada. Arctic 42:3–23.
Eger, J.L., T.P. Birt, A. Gunn et A.J. Baker. 2009. Genetic diversity and history of Peary caribou (Rangifer tarandus) in North America. K. McFarlane, A. Gunn, et C. Strobeck, (eds) Proceedings from the caribou genetics and relationships workshop, March 8-9, 2003, Edmonton, Alberta Wildlife and Economic Development, Government of the Northwest Territories, Yellowknife, Pp. 73. .
Ekaluktutiak HTA. 2013. Summary of HTA and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meetings - February 26, 2013. Rapport inédit du Service canadien de la faune. Cambridge Bay, NU.
Elias, A. 1993. Appendix A Survey of elders’ traditional knowledge of caribou in the Homan area in A. Gunn, The decline of caribou on Northwest Victoria Island: a review. Government of the Northwest Territories Draft File Report, Yellowknife, Northwest Territories 39-44 pp.
Elkin, B.T. et R.W. Bethke. 1995. Environmental contaminants in caribou in the Northwest Territories, Canada. Science of the total environment 160:307-321.
Environment Canada. 2015. Recovery Strategy for Peary Caribou (Rangifer tarandus pearyi) in Canada [en préparation].
Ferguson, M.A.D. 1987. Status of Peary caribou and muskox populations on Bathurst Island, N.W.T., August 1981. Arctic 40:131-137.
Ferguson, M.A.D., A. Idlout et J. Akeeagok. 2001. Conservation of the endangered Peary Caribou by Inuit in Canada’s High Arctic. Présenté au 9e Atelier sur le caribou d’Amérique, Kuujjuaq (Québec), du 23 au 27 avril 2001.
Festa-Bianchet, M., J.C. Ray, S. Boutin, S.D. Côté et A. Gunn. 2011. Conservation of caribou (Rangifer tarandus) in Canada: an uncertain future. Canadian Journal of Zoology 89:419-434.
Fischer, C.A. et E.A. Duncan. 1976. Ecological studies of caribou and muskoxen in the Arctic Archipelago and northern Keewatin. Renewable Resources Consulting Services Ltd., Edmonton, Alberta. 194 pp.
Fitzhugh, W. 1976. Environmental factors in the evolution of Dorset culture: A marginal proposal for Hudson Bay. Memoirs of the Society for American Archaeology:139-149.
Flerov, K.K. 1952. Mammals: musk deeer and deer. Fauna of the USSR, v. 1. Moscow, Russia, Academy of Science USSR.
Forde, T.L. 2015. Heightened resolution in wildlife health monitoring and outbreak investigations through the use of molecular and genomic tools. Thèse de doctorat. Veterinary Medical Sciences, Faculty of Veterinary Medicine, University of Calgary. 210 pp.
Friesen, T.M. 2013. The impact of weapon technology on caribou drive system variability in the prehistoric Canadian Arctic. Quaternary International 297:13-23.
Gauthier, L. 1996. Observations of wildlife on Ellesmere and Axel Heiberg islands between June 12-21, 1995. Northwest Territories Department of Renewable Resources Manuscript Report No. 86, Pond Inlet, NT.
Geist, V. 1998. Deer of the world: their evolution, behavior, and ecology. Mechanicsburg, Pennsylvania, Stackpole Books
Gissing, D. et S. Fleck. 2011. Petition To list the Peary caribou and Dolphin and Union caribou as endangered or threatened. Letter from Government of Northwest Territories and Government of Nunavut to U.S. Fish and Wildlife Service, Arlington, Va, June 3, 2011.
Gjoa Haven HTA. 2013. Summary of HTA Peary Caribou Federal Recovery Strategy Development Community Technical Meeting - February 28, 2013. Rapport inédit du Service canadien de la faune. Gjoa Haven, NU.
GNWT (Government of the Northwest Territories). 2014. State of the Environment Report. Department of Environment and Natural Resources, Government of the Northwest Territories. [Anglais seulement, consulté en septembre 2015].
Golder Associates Ltd. 2003. Report on Inuit qaujimajatuqangit literature, GAP analysis and workshop results related to the Doris North project, Hope Bay belt, Nunavut. Submitted to Miramar Hope Bay Limited, North Vancouver, B.C., November 13, 2003, Victoria, British Columbia.
Gould, W.A., M. Raynolds et D.A. Walker. 2003. Vegetation, plant biomass, and net primary productivity patterns in the Canadian Arctic. Journal of Geophysical Research 108:8167.
Government of Canada. 2015. CanVec - Hydrography data for Canada [consulté en septembre 2015]. [Également disponible en français : Gouvernement du Canada. 2015. CanVec – Données sur l’hydrographie du Canada.]
Government of Nunavut. 2011. Muskoxen and Peary caribou harvest database summary report, December, 2011 version 2.0. Wildlife Research Section, Baffin Region, Department of Environment, Pond Inlet, Nunavut.
Groves, D.J. et E.J. Mallek. 2011. Migratory bird surveys in the Canadian Arctic 2009. U.S. Fish and Wildlife Service. PDF [Anglais seulement, consulté le 27 septembre 2015].
Gunn, A. 1984. A review of research on the effects of human activities on barren-ground caribou of the Beverly and Kaminuriak herds, Northwest Territories. N.W.T. Wildlife Service File Report No. 43, Yellowknife, Northwest Territories. 66 pp
Gunn, A. 1995. Responses of Arctic ungulates to climate change. Pp 90-106 in D. L. Peterson, et D. R. Johnson (eds), Human ecology and climate change: people and resources in the far north. Washington D.C., Taylor and Francis.
Gunn, A. 1998. Weather, climate and Peary caribou and arctic-island caribou, Pp 1-19 in Conservation Breeding Specialist Group (SSC/IUCN), (ed), Population and habitat viability assessment workshop for the Peary caribou (Rangifer tarandus pearyi)-Briefing BookApple Valley, Minnesota.
Gunn, A. 2005. The decline of caribou on northwest Victoria Island: 1980-93. , Department of Resources and Economic Development File Report No. 133, Yellowknife, Northwest Territories. 64 pp.
Gunn, A. et J. Ashevak. 1990. Distribution, abundance and history of caribou and muskoxen north and south of the Boothia Isthmus, NWT May-June 1985. Department of Renewable Resources File Report No. 90, Coppermine, NWT.
Gunn, A. et R. Decker. 1984. Numbers and distribution of Peary caribou and muskoxen in July 1980 on Prince of Wales, Russell and Somerset Islands, Northwest Territories. Department of Renewable Resources File Report No. 38, Yellowknife, Northwest Territories. 56 pp.
Gunn, A. et J. Dragon. 1998. Status of caribou and muskox populations within the Prince of Wales Island-Somerset Island-Boothia Peninsula complex, NWT, July-August 1995. Department of Resources, Wildlife & Economic Development, Government of the Northwest Territories File Report No. 122, Yellowknife, NWT. 45 pp.
Gunn, A. et J. Dragon. 2002. Peary caribou and muskox abundance and distribution on the western Queen Elizabeth Islands, Northwest Territories and Nunavut June-July 1997. Department of Resources, Wildlife and Economic Development. File Report No. 130, Yellowknife, Northwest Territories. 93 pp.
Gunn, A. et B. Fournier. 2000. Caribou herd delimitation and seasonal movements on Victoria Island 1987-1989. Department of Resources, Wildlife and Economic Development File Report No. 125, Yellowknife, Northwest Territories. 104 pp.
Gunn, A. et F.L. Miller. 1980. Responses of Peary caribou cow-calf pairs to helicopter harassment in the Canadian High Arctic. Pp 497-507 in E. Reimers, E. Gaare, et S. Skjenneberg (eds), 2nd International Reindeer/Caribou Symposium. Røros, Norway, Direktoratet for vilt og ferskvannsfisk, Trondheim.
Gunn, A. et K. Poole. 2014. Summary report on survey design and methods to estimate trends in Peary caribou abundance between 1961 and 2013. Contract prepared for Environment Canada, Science and Technology, Landscape Science and Technology Division, Ottawa, Ontario, Canada.
Gunn, A. et T. Skogland. 1997. Responses of caribou and reindeer to global warming. Pp 191 in W. C. Oechl (ed) Global Change and Arctic Terrestial Ecosystems. New York, Springer-Verlag.
Gunn, A., F.L. Miller et D.C. Thomas. 1981. The current status and future of Peary caribou (Rangifer tarandus pearyi) on the Arctic Islands of Canada. Biological Conservation 19:283-296.
Gunn, A., C. Shank et B. McLean. 1991. The history, status and management of muskoxen on Banks Island. Arctic 44:188-195.
Gunn, A., U.S. Seal et P.S. Miller (eds). 1998. Population and habitat viability assessment workshop for the Peary caribou (Rangifer tarandus pearyi). Yellowknife, Northwest Territories. Conservation Breeding Specialist Group (SSC/IUCN), Apple Valley, Minnesota.
Gunn, A., B. Fournier et R. Morrison. 2000a. Seasonal movements and distribution of satellite-collared caribou cows on the Boothia and Simpson Peninsula areas, Northwest Territories, 1991-93. Department of Resources, Wildlife and Economic Development Manuscript Report No. 126, Yellowknife, Northwest Territories. 77 pp.
Gunn, A., F.L. Miller et J. Nishi. 2000b. Status of endangered and threatened caribou on Canada’s Arctic islands. Rangifer Special Issue 12:39-50.
Gunn, A., F.L. Miller, S.J. Barry et A. Buchan. 2006. A near-total decline in caribou on Prince of Wales, Somerset, and Russell islands, Canadian Arctic. Arctic 59:1-13.
Gunn, A., D. Russell et J. Eamer. 2011. Northern caribou population trends in Canada. Canadian Biodiversity: Ecosystem Status and Trends 2010. Ottawa, Ontario, Canadian Councils of Resource Ministers, Technical Thematic Report No. 10, 71 pp. [Également disponible en français : Gunn, A., D. Russell et J. Eamer. 2011. Tendances des populations de caribou des zones septentrionales du Canada. Biodiversité canadienne : état et tendances des écosystèmes en 2010, Rapport technique thématique nº 10, Ottawa (Ontario), Conseils canadiens des ministres des ressources, 78 p.]
Hansen, B.B., R. Aanes, I. Herfindal, J. Kohler et B.E. Sæther. 2011. Climate, icing, and wild arctic reindeer: past relationships and future prospects. Ecology 92:1917-1923.
Harding, L.E. 2004. The future of Peary caribou (Rangifer tarandus pearyi) in a changing climate. T. Hooper, (ed) Species at Risk 2004: Pathways to Recovery Conference Proceedings, Victoria, British Columbia, March 2-6, 2004, Ministry of Environment [disponible sur CD-ROM].
Heard, D.C. 1984. Historical and Present Status of Wolves in the Northwest Territories. Department of Renewable Resources. Government of the Northwest Territories. Information Series Report No. 4, Yellowknie, N.W.T. 21 pp.
Hinzman, L.D. et al. 2005. Evidence and implications of recent climate change in northern Alaska and other arctic regions. Climatic Change 72:251-298.
Holand, Ø., K.R. Askim, K.H. Røed, R.B. Weladji, H. Gjøstein et M. Nieminen. 2007. No evidence of inbreeding in a polygynous ungulate: the reindeer (Rangifer tarandus). Biology Letters 3:36-39.
Howse, L. 2008. Late Dorset caribou hunters: zooarchaeology of the Bell site, Victoria Island. Arctic Anthropology 45:22-40.
Hughes, J., S.D. Albon, R.J. Irvine et S. Woodin. 2009. Is there a cost of parasites to caribou? Parasitology 136:253-265.
Irvine, R., Stien, A., Dallas, J.F., Halvorsen, O. & Langvatn, R. 2001. Contrasting regulation of fecundity in two abomasal nematodes of Svalbard reindeer (Rangifer tarandus platyrhynchus). Parasitology 122:673-681.
IPCC (Intergovernmental Panel on Climate Change). 2013. Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Stocker, T.F., D. Qin, G.K. Plattner, M. Tignor, S.K. Allen, J. Boschung, A. Nauels, Y. Xia, V. Bex et P.M. Midgley (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. 1535 pp.
IUCN Standards and Petitions Subcommittee. 2014. Guidelines for Using the IUCN Red List Categories and Criteria. Version 11. Prepared by the Standards and Petitions Subcommittee. PDF [Anglais seulement, consulté le 27 septembre 2015].
Iviq HTA. 2013. Summary of HTA and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meetings - February 20 and 21, 2013. Rapport inédit du Service canadien de la faune. Grise Fiord, NU.
Jackimchuk, R.D. et D.R. Carruthers. 1980. Caribou and muskoxen on Victoria Island, N.W.T. R.D. Jackimchuk Management Associates Ltd. for Polar Gas Project, Sidney, British Columbia. 93 pp.
Jenkins, D. 2006. Estimating Peary caribou (Rangifer tarandus pearyi) and muskox (Ovibos moschatus) numbers, composition and distributions on Ellesmere Island, Nunavut. Government of Nunavut, Department of Environment, Status Report No. 18, Iqaluit, Nunavut. 8 pp.
Jenkins, D. et N. Lecomte. 2012. All about ice: Peary caribou movements in the Bathurst Islands Complex: Highlights report. Department of Environment, Government of Nunavut.
Jenkins, D., P. Curry, A. Millar, D. Karadag et S. Akeeagok. 2010a. Peary caribou workshop: sharing what we know about caribou, Grise Fiord. Summary Report. Department of Environment, Government of Nunavut, Iqaluit, Nunavut.
Jenkins, D., P. Curry, A. Millar, D. Karadag et S. Akeeagok. 2010b. Peary caribou workshop: sharing what we know about caribou. Resolute Bay, summary report. Department of Environment, Government of Nunavut, Iqaluit, Nunavut.
Jenkins, D.A., M. Campbell, G. Hope et J. Goor. 2011. Recent trends in abundance of Peary Caribou (Rangifer tarandus pearyi) and Muskoxen (Ovibos moschatus) in the Canadian Arctic Archipelago, Nunavut. Wildlife Research Section, Department of Environment Wildlife Report, No.1, Version 2, Pond Inlet, Nunavut. 184 pp.
Johnson, C.A., E. Neave, A. Richards, S.N. Banks et P. Quesnelle. En préparation. Knowledge assessment to inform the identification of critical habitat for Peary caribou, Rangifer tarandus pearyi, in the Canadian Arctic. Environment Canada, Science and Technology, Ottawa, Ontario, Canada.
Kassam, K.-A.S. 2009. Biocultural diversity and indigenous ways of knowing: human ecology in the Arctic. Calgary, Alberta, University of Calgary Press.
Kerby, J.T. et E. Post. 2013. Advancing plant phenology and reduced herbivore production in a terrestrial system associated with sea ice decline. Nature Communications. doi: 10.1038/ncomms3514.
Kevan, P.G. 1974. Peary caribou and muskoxen on Banks Island. Arctic 27:256-264.
Klütsch, C.F., M. Micheline et P.J. Wilson. 2012. Phylogeographical analysis of mtDNA data indicates postglacial expansion from multiple glacial refugia in woodland caribou (Rangifer tarandus caribou). PloS one 7:e52661.
Kutz S.J., J. Ducrocq, G.G. Verocai, B.M. Hoar, D.D. Colwell, K. Beckmen, L. Polley, B.T. Elkin et E.P. Hoberg. 2012. Parasites of ungulates of arctic North America and Greenland: A view of contemporary diversity, ecology, and impact in a world under change. Advances in Parasitology 79:99-252.
Kutz S.J., S. Checkley, G. Verocai, M. Dumond, E. Hoberg, R. Peacock, J.P. Wu, K. Orsel, K. Seegers, A.L. Warren et A. Abrams. 2013. Invasion, establishment, and range expansion of two parasitic nematodes in the Canadian Arctic. Global Change Biology 19:3254-3262.
Kutz, S.J., E.P. Hobert, P.K. Molnar, A. Dobson et G.G. Verocai. 2014. A walk on the tundra: host-parasite interactions in an extreme environment. International Journal for Parasitology: Parasites and Wildlife 3:198-208.
Kutz, S.J., T. Bollinger, M. Branigan, S. Checkley, T.Davison, M. Dumond, B. Elkin, T. Forde, W. Hutchins, A. Niptanatiak et K. Orsel. 2015. Erysipelothrix rhusiopathiae associated with recent widespread muskox mortalities in the Canadian Arctic. Canadian Veterinary Journal 56:560-563.
Larsen, J.N., O.A. Anisimov, A. Constable, A.B. Hollowed, N. Maynard, P. Prestrud, T.D. Prowse et J.M.R. Stone. 2014. Polar Regions. In : Climate Change 2014: Impacts, Adaptation and Vulnerability. Part B: Regional Aspects. Contribution of Working Group II to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change [Barros, V.R., Field, C.B., Dokken, D.J., Mastrandrea, M.D., Mach, K.J., Bilir, T.E., Chatterjee, M., Ebi, K.L., Estrada, Y.O., Genova, R.C., Girma, B., Kissel, E.S., Levy, A.N., MacCracken, S., Mastrandrea, P.R., White, L.L. (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA. p 1567-1612.
Larter, N.C. et J.A. Nagy. 1996. Caribou collection, Banks Island, November 1993-February 1994. Department of Renewable Resources, Government of the Northwest Territories, Yellowknife, NT. Manuscript Report No. 89, 54 pp.
Larter, N.C. et J.A. Nagy. 1997. Peary caribou, muskoxen and Banks Island forage: assessing seasonal diet similarities. Rangifer Special Issue 17:9-16.
Larter, N.C. et J.A. Nagy. 2000a. Calf production and overwinter survival estimates for Peary caribou, Rangifer tarandus pearyi, on Banks Island, Northwest Territories. Canadian Field-Naturalist 114:661-670.
Larter, N.C. et J.A. Nagy. 2000b. A comparison of heavy metal levels in the kidneys of High Arctic and mainland caribou populations in the Northwest Territories of Canada. Science of the total environment 246:109-119.
Larter, N.C. et J.A. Nagy. 2001a. Seasonal and annual variability in the quality of important forage plants on Banks Island, Canadian High Arctic. Applied Vegetation Science 4:115-128.
Larter, N.C. et J.A. Nagy. 2001b. Variation between snow conditions at Peary caribou and muskox feeding sites and elsewhere in foraging habitats on Banks Island in the Canadian High Arctic. Arctic, Antarctic, and Alpine Research 33:123-130.
Larter, N.C. et J.A. Nagy. 2003. Upland barren habitat of southern Banks Island excluded from grazing by large herbivores for five years: effects on aboveground standing crop. Manuscript Report No. 148, Inuvik, NWT. 14 pp.
Larter, N.C. et J.A. Nagy. 2004. Seasonal changes in the composition of the diets of Peary caribou and muskoxen on Banks Island. Polar Research 23:131-140.
Lee, A.M., E.M. Bjørkvoll, B.B. Hansen, S.D. Albon, A. Stien, B.E. Sæther, V. Steinar; V. Veiberg, L.E. Loe et V. Grøtan. 2015. An integrated population model for a long-lived ungulate: more efficient data use with Bayesian methods. Oikos. 124:806–816.
Leighton, F.A. 2011. Wildlife pathogens and diseases in Canada. Canadian Biodiversity: Ecosystem Status and Trends 2010. Technical Thematic Report No. 7. Ottawa, Ontario, Canadian Councils of Resource Ministers. [Également disponible en français : Leighton, F.A. 2011. Pathogènes et maladies de la faune au Canada. Biodiversité canadienne : état et tendances des écosystèmes en 2010, Rapport technique thématique nº 7, Ottawa (Ontario), Conseils canadiens des ministres des ressources.]
Lenart, E.A., R.T. Bowyer, J.V. Hoef et R.W. Ruess. 2002. Climate change and caribou: effects of summer weather on forage. Canadian Journal of Zoology 80:664-678.
Lim, D.S.S., J.P. Smol et M.S.V. Douglas. 2008. Recent environmental changes on Banks Island (N.W.T., Canadian Arctic) quantified using fossil diatom assemblages. Journal of Paleolimnology 40:385-398.
M’Dougall, G.F. 1857. The eventful voyage H.M. Discovery ship Resolute to the Arctic regions in search of Sir John Franklin and the missing crews of H.M. Discovery ships Erebus and Terror, 1852, 1853, 1854. London, UK, Longman, Brown, Green, Longmans, and Roberts.
MacDonald, C.R, L.L. Ewing, B.T. Elkin et A.M. Wiewel. 1996. Regional variation in radionuclide concentrations and radiation doses in caribou (Rangifer tarandus) in the Canadian Arctic; 1992-94. Science in the Total Environment 182:53-73.
MacPherson, A.H. 1959. A preliminary survey of arctic wildlife resources. Rapport inédit du Service canadien de la faune, Ottawa, Ontario.
MacPherson, A.H. 1960. Notes on abundance and distribution of mammals on Banks Island and Victoria Island, N.W.T. in the summer of 1959. Rapport inédit du Service canadien de la faune, Ottawa, Ontario.
MacPherson, A.H. 1961. On the abundance and distribution of certain mammals in the Western Arctic Islands in 1958-9. The Arctic Circular XIV:1-17.
Manning, T.H. 1960. The relationship of the Peary and barren ground caribou. Arctic Institute of North America Technical Paper No. 4.
Manning, T.H. et A.H. MacPherson. 1958. The mammals of Banks Island. Arctic Institute of North America Technical Paper No. 2:1-74.
Manning, T.H. et A.H. MacPherson. 1961. A biological investigation of Prince of Wales Island, N.W.T. Transactions Royal Canadian Institute 33:116-239.
Manseau, M., L. Dick, N. Lyons, C. St.-Pierre et J. Wood. 2004. Ecological history of Peary caribou and muskox on northern Ellesmere Island, ca. 4300 to present. Research Links 12:1-8.
Manseau, M., L. Dick et N. Lyons. 2005. People, caribou and muskoxen on northern Ellesmere Island: historical interactions and population ecology ca. 4300 BP to present. Winnipeg, Manitoba, Parks Canada, Western Canada Service Centre 67 pp. [Également disponible en français : Manseau, M., L. Dick et N. Lyons. 2005. Humains, caribous et boeufs musqués dans le nord de l’Île d’Ellesmere : interactions historiques et écologie des populations v. 4 300 AA jusqu’à aujourd’hui, Winnipeg (Manitoba), Parcs Canada, Centre de services de l’Ouest canadien, 67 p.]
Master, L., D. Faber-Langendoen, R. Bittman, G.A. Hammerson, B. Heidel, J. Nichols, L. Ramsay et A. Tomaino. 2009. NatureServe conservation status assessments: factors for assessing extinction risk. NatureServe, Arlington, VA. [consulté en septembre 2015].
Maxwell, J.B. 1981. Climatic regions of the Canadian Arctic Islands. Arctic 34(3):225-240.
McFarlane, K., A. Gunn et C. Strobeck (eds), 2009. Proceedings from the Caribou Genetics and Relationships Workshop, March 8-9, 2003. Edmonton, Alberta. Department of Natural Resources and Environment, Government of the Northwest Territories Manuscript Report No. 183.
McFarlane, K., F.L. Mille, S.J. Barry et G.A. Wilson. 2014. An enigmatic group of arctic island caribou and the potential implications for conservation of biodiversity. Rangifer 34:73-94.
Meland, M. 2014. Partial migration as a response to ground icing events in a high arctic ungulate. Mémoire de maîtrise ès sciences, Norwegian University of Life Sciences.
Meldgaard, J. 1960. Origin and evolution of Eskimo cultures in the Eastern Arctic, February 1960. Canadian Geographical Journal 60:64-75.
Meldgaard, M. 1986. The Greenland caribou - zoogeography, taxonomy, and population dynamics. Meddelelser om Groenland Bioscience 20:88.
Miller, F.L. 1987a. Peary caribou and muskoxen on Prince Patrick Island, Eglinton Island, and Emerald Isle, Northwest Territories, July 1986. Technical Report Series No. 29, Canadian Wildlife Service, Western and Northern Region, Edmonton, Alberta. 65 pp.
Miller, F.L. 1987b. Peary caribou and muskoxen on Bathurst, Alexander, Marc, Massey, Vanier, Cameron, Helena, Lougheed, and Edmund Wlaker Islands, Northwest Territories, July 1985. Canadian Wildlife Service, Prairie & Northern Region Technical Report Series No. 20, Edmonton, AB.
Miller, F.L. 1988. Peary caribou and muskoxen on Melville and Byam Martin islands, Northwest Territories, July 1987. Technical Report Series No. 37, Canadian Wildlife Service, Prairie & Northern Region, Edmonton, Alberta. 58 pp.
Miller, F.L. 1989. Reevaluation of the status of Peary caribou and muskox populations within the Bathurst Island complex, Northwest Territories, July 1988. Canadian Wildlife Service, Prairie and Northern Range Technical Report No. 78, Edmonton, AB.
Miller, F.L. 1990. Inter-island movements of Peary caribou: a review and appraisement of their ecological importance. Pp 608-632 in C. R. Harington (ed) Canada’s missing dimension - science and history in the Canadian Arctic Islands. Ottawa, Ontario, Canadian Museum of Nature No. 2.
Miller, F.L. 1991. Updated status report on the Peary caribou, Rangifer tarandus pearyi, in Canada. Committee on Status of Endangered Wildlife in Canada (COSEWIC), Ottawa, Ontario. 116 pp.
Miller, F.L. 1992. Peary caribou calving and postcalving periods, Bathurst Island complex, Northwest Territories, 1990. Canadian Wildlife Service, Prairie and Northern Region Technical Report Series No. 151, Edmonton, AB.
Miller, F.L. 1993. Peary caribou calving and postcalving periods, Bathurst Island complex, Northwest Territories, 1991. Canadian Wildlife Service, Prairie and Northern RegionTechnical Report Series No. 166, Edmonton, AB.
Miller, F.L. 1994. Peary caribou calving and postcalving periods, Bathurst Island complex, Northwest Territories, Canada, 1992. Canadian Wildlife Service Technical Report Series No. 186, Edmonton, Alberta. 99 pp.
Miller, F.L. 1995a. Inter-island water crossings by Peary caribou, south-central Queen Elizabeth Islands. Arctic 48:8-12.
Miller, F.L. 1995b. Peary caribou studies, Bathurst Island complex, Northwest Territories, July-August 1993. Canadian Wildlife ServiceTechnical Report Series No. 35, Edmonton, Alberta. 76 pp.
Miller, F.L. 1997a. Late winter absence of caribou on Prince of Wales, Russell and Somerset islands, Northwest Territories, April-May 1996. Canadian Wildlife Service Technical Report Series No. 291, Edmonton, Alberta. 34 pp.
Miller, F.L. 1997b. Peary caribou conservation studies, Bathurst Island complex, Northwest Territories, April-August 1994 and June-July 1995. Canadian Wildlife ServiceTechnical Report Series No. 295, 155 pp.
Miller, F.L. 1998. Status of Peary caribou and muskox populations within the Bathurst Island complex, south-central Queen Elizabeth Islands, Northwest Territories, July 1996. Canadian Wildlife ServiceTechnical Report Series No. 317, Ottawa, Ontario. 147 pp.
Miller, F.L. 2002. Multi-island seasonal home range use by two Peary caribou, Canadian High Arctic, 1993-94. Arctic 55:133-142.
Miller, F.L. et S.J. Barry. 2009. Long-term control of Peary caribou numbers by unpredictable, exceptionally severe snow or ice conditions in a non-equilibrium grazing system. Arctic 62:175-189.
Miller, F.L. et A. Gunn. 1978. Inter-island movements of Peary caribou south of Viscount Melville Sound, Northwest Territories. Canadian Field-Naturalist 92:327-331.
Miller, F.L. et A. Gunn. 2003a. Catastrophic die-off of Peary caribou on the Western Queen Elizabeth Islands, Canadian High Arctic. Arctic 56:381-390.
Miller, F.L. et A. Gunn. 2003b. Status, population fluctuations and ecological relationships of Peary caribou on the Queen Elizabeth Islands: Implications for their survival. Rangifer Special Issue 14:213-226.
Miller, F.L. et H.P.L. Kiliaan. 1981. Inter-island movements of Peary caribou in the Prince of Wales Island-Somerset Island-Boothia Peninsula complex, Northwest Territories, June 1980. Canadian Wildlife Service Progress Notes 120:1-7. [Également disponible en français : Miller, F.L. et H.P.L. Kiliaan. 1981. Déplacements interinsulaires du caribou de Peary dans le complexe île du Prince-de-Galles – île Somerset – presqu’île de Boothia (Territoires du Nord-Ouest), juin 1980. Cahier de biologie du Service canadien de la faune 120:1-7.]
Miller, F.L., R.H. Russell et A. Gunn. 1975. The recent decline of Peary caribou on Western Queen Elizabeth Islands of Artic Canada. Polarforschung 45:17-21.
Miller, F.L., R.H. Russell et A. Gunn. 1977a. Interisland movements of Peary caribou (Rangifer tarandus pearyi) on western Queen Elizabeth Islands, Arctic Canada. Canadian Journal of Zoology 55:1029-1037.
Miller, F.L., R.H. Russell et A. Gunn. 1977b. Distributions, movements and numbers of Peary caribou and muskoxen on western Queen Elizabeth Islands, Northwest Territories, 1972-74. Canadian Wildlife Service Report Series No. 40, Edmonton, Alberta, 55 pp.
Miller, F.L., E.J. Edmonds et A. Gunn. 1982. Foraging behaviour of Peary caribou in response to springtime snow and ice conditions. Canadian Wildlife Service Occasional Papers No. 48, 41 pp. [Également disponible en français : Miller, F.L., E.J. Edmonds et A. Gunn. 1982. Le comportement alimentaire du caribou de Peary selon les conditions de la neige et de la glace au printemps, Service canadien de la faune, Publication hors-série nº 48, 42 p.]
Miller, F.L., S.J. Barry et W.A. Calvert. 2005a. Sea-ice crossings by caribou in the south-central Canadian Arctic Archipelago and their ecological importance. Rangifer Special Issue 16:77-88.
Miller, F.L., S.J. Barry et W.A. Calvert. 2005b. Conservation of Peary caribou based on a recalculation of the 1961 aerial survey on the Queen Elizabeth Islands, Arctic Canada. Rangifer Special Issue 16:65-75.
Miller, F.L., S.J. Barry et W.A. Calvert. 2007a. Near-total loss of caribou on south-central Canadian Arctic Islands and the role of seasonal migration in their demise. Arctic 60:23-36.
Miller, F.L., S.J. Barry, W.A. Calvert et K.A. Zittlau. 2007b. Rethinking the basic conservation unit and associated protocol for augmentation of an” endangered” caribou population: An opinion. Rangifer 27:13-24.
Miller, F.L., S.J. Barry et W.A. Calvert. 2007c. The role of seasonal migration in the near-total loss of caribou on south-central Canadian Arctic Islands. Rangifer Special Issue 17:243-245.
Nagy, J.A., N.C. Larter et V.P. Fraser. 1996. Population demography of Peary caribou and muskox on Banks Island, N.W.T. 1982-1992. Rangifer Special Issue 9:213-222.
Nagy, J.A., N. Larter et W.H. Wright. 2006. Population estimates for Peary caribou and muskox on Banks Island, NT, July 2001. Department of Environment and Natural Resources, Government of the Northwest Territories Manuscript Report No. 199, Inuvik, Northwest Territories.
Nagy, J.A., N. Larter et W.H. Wright. 2009a. Population estimates for Peary caribou (Minto Inlet herd), Dolphin and Union caribou, and muskox on Northest Victoria Island, NT, July 2001. Department of Environment and Natural Resources, Government of the Northwest Territories Manuscript Report No. 202, Inuvik, Northwest Territories .
Nagy, J.A., A. Gunn et W.H. Wright. 2009b. Population estimates for Peary caribou (Minto Inlet herd), Dolphin and Union caribou, and muskox on Northwest Victoria Island, NT, July 2005. Department of Environment and Natural Resources Manuscript Report No. 203, Inuvik, Northwest Territories .
Nagy, J.A., N. Larter et W.H. Wright. 2009c. Population estimates for Peary caribou (Minto Inlet herd), Dolphin and Union caribou, and muskox on Northwest Victoria Island, NT, July 1998. Manuscript Report No. 201. Department of Environment and Natural Resources, Government of the Northwest Territories, Inuvik, Northwest Territories .
Nagy, J.A., P.B. Latour, W.H. Wright et N. Territories. 2009d. Population estimates for Peary caribou and muskox on Banks Island, NT, July 1982: a retrospective analysis. Yellowknife, Northwest Territories, Department of Environment and Natural Resources, Government of the Northwest Territories Manuscript No. 197.
Nagy, J.A., A. Gunn et W.H. Wright. 2009e. Population estimates for Peary caribou and muskox on Banks Island, NT, July 2005 Department of Environment and Natural Resources Manuscript Report No. 200 Yellowknife, Northwest Territories .
Nagy, J.A., A. Gunn et W.H. Wright. 2009f. Population estimates for Peary caribou and muskox on Banks Island, NT, August 1992. Environment and Natural Resources, Government of the Northwest Territories Manuscript Report 198. Yellowknife.
Nagy, J.A., N. Larter et W.H. Wright. 2013a. Population estimates for Peary caribou and muskox on Banks Island, NT, July 1998. Environment and Natural Resources Manuscript Report No. 224, Inuvik, Northwest Territories.
Nagy, J.A., N. Larter et W.H. Wright. 2013b. Population estimates for Peary caribou and muskox on Banks Island, NWT, July 1994. Environment and Natural Resources, Government of the Northwest Territories Manuscript Report 223. Yellowknife.
Nagy, M. 1999. Aulavik oral history project on Banks Island, NT: final report. Presented to Parks Canada - Western District, for the Inuvialuit Social Development Program, Inuvik, N.T.
NatureServe. 2014. NatureServe Explorer: An online encyclopedia of life [en ligne]. Version 7.1. NatureServe, Arlington, Virginia. [Anglais seulement, consulté en septembre 2015].
Nellemann, C. et R.D. Cameron. 1998. Cumulative impacts of an evolving oil-field complex on the distribution of calving caribou. Canadian Journal of Zoology 76:1425-1430.
Nishi, J. et L. Buckland. 2000. An aerial survey of caribou on Victoria Island, 15-17 June 1994. Northwest Territories Department of Resources, Wildlife and Economic Development File Report No. 128, Yellowknife, Northwest Territories. 88 pp.
Oberbauer, S.F., S.C. Elmendorf, T. Troxler, R.D. Hollister, A.V. Rocha, M.S. Bret-Harte, M.A. Dawes, A.M. Fosaa, G.H. Henry, T.T. Høve, F.C. Jarrad, I.S. Jónsdóttir, K. Klanderud, J.A. Klein, U. Molau, C. Rixen, N.M. Schmidt, G.R. Shaver, R.T. Slider, O. Totland, C.H. Wahren et J.M. Welker. 2013. Phenological responses of tundra plants to background climate variation tested using the International Tundra Experiment (ITEX). Philosophical Transactions of the Royal Society B 368:1624.
Olohaktomiut HTC. 2013. Summary of HTC and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meetings - March 4, 2013, Rapport inédit du Service canadien de la faune. Ulukhaktok, NT.
Olson, D.M., E. Dinerstein, E.D. Wikramanayake, N.D. Burgess, G.V. Powell, E.C. Underwood, J.A. D’amico, I. Itoua, H.E. Strand et J.C. Morrison. 2001. Terrestrial Ecoregions of the World: A New Map of Life on Earth A new global map of terrestrial ecoregions provides an innovative tool for conserving biodiversity. Bioscience 51:933-938.
Overland, J.E. et M. Wang. 2013. When will the summer Arctic be nearly sea ice free? Geophysical Research Letters 40:2097–2101, doi:10.1002/grl.50316.
Paulatuk HTC. 2013. Summary of HTC and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meeting - March 6, 2013. Rapport inédit du Service canadien de la faune. Paulatuk, NT.
Parker, G.R. 1978. The diets of muskoxen and Peary caribou on some islands in the Canadian High Arctic. Canadian Wildlife Service Occasional Papers No. 35, Edmonton, Alberta. 21 pp.
Parker, G.R. et R.K. Ross. 1976. Summer habitat use by muskoxen (Ovibos moschatus) and Peary caribou (Rangifer tarandus pearyi) in the Canadian High Arctic. Polarforschung 46:12-25.
Parks Canada. 2010. State of the Park Report 2010: Aulavik National Park of Canada. Parks Canada, Hull, Quebec. 50 pp. [Également disponible en français : Parcs Canada. 2010. Rapport sur l’état du parc 2010 : Parc national du Canada de Aulavik, Parcs Canada, Hull (Québec), 50 p.]
Parry, W.E. 1821. Journal of a voyage for the discovery of a Northwest passage from the Atlantic to the Pacific; performed in the years 1819-20, in His Majesty’s ships Hecla and Griper, under the Orders of William Edward Parry, with an appendix containing the scientific and other observations, Second Edition. London, UK, John Murray.
Pearce, T., H. Wright, R. Notaina, A. Kudlak, B. Smit, J. Ford et C. Furgal. 2011. Transmission of environmental knowledge and land skills among Inuit men in Ulukhaktok, Northwest Territories, Canada. Human Ecology 39:271-288.
Pelletier, B.R. et B.E. Medioli (eds.). 2014. Environmental Atlas of the Beaufort Coastlands. Geological Survey of Canada, Open File 7619. doi:10.4095/294601. 271 pp.
Petersen, S.D., M. Manseau et P.J. Wilson. 2010. Bottlenecks, isolation, and life at the northern range limit: Peary caribou on Ellesmere Island, Canada. Journal of Mammalogy 91:698-711.
Poole, K.G., A. Gunn, B.R. Patterson et M. Dumond. 2010. Sea ice and migration of the Dolphin and Union caribou herd in the Canadian Arctic: an uncertain future. Arctic 63:414-428.
Poole, K.G., A. Gunn, J. Wierzchowsk et M. Anderson. 2015. Peary caribou distribution within the Bathurst Island Complex relative to the boundary proposed for Qausuittuq National Park, Nunavut. Rangifer. Rangifer 35 (Spec. Iss. No. 23):81-98.
Post, E. et M.C. Forchhammer. 2008. Climate change reduces reproductive success of an Arctic herbivore through trophic mismatch. Philosophical Transactions of the Royal Society of London B 363:2369–2375.
Post, E., U.S. Bhatt, C.M. Bitz, J.F. Brodie, T.L. Fulton, M. Hebblewhite, J. Kerby, S.J. Kutz, I. Stirling et D.A. Walker. 2013. Ecological consequences of sea-ice decline. Science 341:519-524.
Prowse, T.D., C. Furgal, F.J. Wrona et J.D. Reist. 2009. Implications of climate change for northern Canada: freshwater, marine, and terrestrial ecosystems. AMBIO: A Journal of the Human Environment 38:282-289.
Reimers, E. 2012. Svalbard reindeer population size and trends in four sub-areas of Edgeøya. Polar Research 31:11089. http://dx.doi.org/10.3402/polar.v31i0.11089.
Riewe, R.R. 1973. Final report on a survey of ungulate poplutions on the Bjorne Peninsula, Ellesmere Island. Determination of numbers and distribution and assessment of the effects of seismic activities on the behaviour of these populations. University of Manitoba, Winnipeg, for Department of Indian and Northern Affairs, Ottawa, ON.
Rennert, K.J., G. Roe, J. Putkonen et C. Bitz. 2009. Soil thermal and ecological impacts of rain on snow events in the Circumpolar Arctic. Journal of Climate 22:2302-2315.
Resolute Bay HTO. 2013. Summary of HTO and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meetings - February 19, 2013. Rapport inédit du Service canadien de la faune. Resolute Bay, NU.
Riedlinger, D. 2001. Community-based assessments of change: Contributions of Inuvialuit knowledge to understanding climate change in the Canadian Arctic. University of Manitoba, Winnipeg, Manitoba. 139 pp.
Roby, D.D., H. Thing et K.L. Brink. 1984. History, status and taxonomic identity of caribou (Rangifer tarandus) in Northwest Greenland. Arctic 37:23-30.
Russell, R.H., E.J. Edmonds et J. Roland. 1978. Caribou and muskoxen habitat studies. Canadian Wildlife Service Environmental Social Program, Northern Pipelines, ESCOM Report No. A1-26, Edmonton, Alberta. 40 pp. [Également disponible en français : Russell, R.H., E.J. Edmonds et J. Roland. 1979. Études sur l’habitat du caribou et du boeuf musqué, Service canadien de la faune, Programme écologique et social Pipelines du Nord, Rapport ESCOM, nº AI-26, Edmonton (Alberta), 113 p.]
Russell, D.E., P.H. Whitfield, J. Cai, A. Gunn, R.G. White et K. Poole. 2013. CARMA’s MERRA-based caribou climate database. Rangifer, 33, Special Issue No. 21:145-152.
Sachs Harbour HTC. 2013. Summary of HTC, Elder and Public Peary Caribou Federal Recovery Strategy Development Community Technical Meetings - March 5, 2013, Rapport inédit du Service canadien de la faune. Sachs Harbour, NT.
SARC (Species at Risk Committee). 2012. Species status report for Peary Caribou (Rangifer tarandus pearyi) in the Northwest Territories. Species at Risk Committee, Yellowknife, NT. 137 pp.
SARC. 2013. Species status report for Dolphin and Union caribou (Rangifer tarandus groenlandicus x pearyi) in the Northwest Territories. Species at Risk Committee, Yellowknife, NT. 106 pp.
Serrouya, R., D. Paetkau, B. McLellan, S. Boutin, M. Campbell et D. Jenkins. 2012. Population size and major valleys explain microsatellite variation better than taxonomic units for caribou in western Canada. Molecular Ecology, 21:2588-2601.
Shank, C.C., P.F. Wilkinson et D.F. Penner. 1978. Diet of Peary caribou, Banks Island, N.W.T. Arctic 31:125-132.
Sharma, S., S. Couturier et S.D. Côté. 2009. Impacts of climate change on the seasonal distribution of migratory caribou. Global Change Biology 15:2549-2562.
Slaney, F.F. and Co. Ltd. 1974. Peary caribou and muskoxen and Panarctic’s seismic operations n Bathurst Island, N.W.T., 1974. Panarctic Oils Ltd., Calgary, Alberta. 156 pp.
Slaney, F.F. and Co. Ltd. 1975. Peary caribou and muskoxen and Panarctic’s seismic operations on Bathurst Island, N.W.T., 1975. Supplemental Report. Panarctic Oils Ltd., Calgary, Alberta. 11 pp.
Spence Bay HTO. 2013. Summary of HTO Peary Caribou Federal Recovery Strategy Development Community Technical Meeting - February 27, 2013. Rapport inédit du Service canadien de la faune. Taloyoak, NU.
Steele, J.F. 2013. The devil’s in the diversity: Divergent parasite faunas and their impact on body condition in two Greenland caribou populations. Mémoire de maîtrise ès sciences. Veterinary Medical Sciences, Department of Ecosystem and Public Health, Faculty of Veterinary Medicine, University of Calgary, Calgary, Alberta, Canada.
Steele, J., K. Orsel, C. Cuyler, E.P. Hoberg, N.M. Schmidt et S.J. Kutz. 2013. Divergent parasite faunas in adjacent populations of West Greenland caribou: Natural and anthropogenic influences on diversity. International Journal for Parasitology: Parasites and Wildlife 2:197-202.
Stefansson, V. 1921. The Friendly Arctic. New York, Macmillan and Co.
Stern, G.A. et A. Gaden. 2015. From Science to Policy in the Western and Central Canadian Arctic: An Integrated Regional Impact Study (IRIS) of Climate Change and Modernization. ArcticNet, Quebec City, 432 pp.
Svoboda, J. 1977. Ecology and primary production of raised beach communities. Pp 185-216 in L. C. Bliss (ed) Truelove Lowland, Devon Island, Canada: a High Arctic Ecosystem. Edmonton, Alberta, University of Alberta Press.
Taylor, A.D.M. 2005. Inuit Qaujimajatuqangit about population changes and ecology of Peary caribou and muskoxen on the High Arctic islands of Nunavut. Mémoire de maîtrise ès arts, Queen’s University, Kingston, Ontario.
Tener, J.S. 1963. Queen Elizabeth Islands game survey, 1961. Canadian Wildlife Service Occasional Papers No. 4, Edmonton, Alberta. 50 pp.
Tews, J., M.A.D. Ferguson et L. Fahrig. 2007a. Modeling density dependence and climatic disturbances in caribou: a case study from the Bathurst Island complex, Canadian High Arctic. Journal of Zoology 272:209-217.
Tews, J., M.A.D. Ferguson et L. Fahrig. 2007b. Potential net effects of climate change on High Arctic Peary caribou: lessons from a spatially explicit simulation model. Ecological Modelling 207:85-98.
Thomas, D.C. 1982. The relationship between fertility and fat reserves of Peary caribou. Canadian Journal of Zoology 60:597-602.
Thomas, D.C. et J. Edmonds. 1983. Rumen contents and habitat selection of Peary caribou in winter, Canadian Arctic Archipelago. Arctic and Alpine Research 15:97-105.
Thomas, D.C. et P. Everson. 1982. Geographic variation in caribou on the Canadian Arctic Islands. Canadian Journal of Zoology 60:2442-2454.
Thomas, D.D. et H.P.L. Kiliaan. 1990. Warble infestations in some Canadian caribou and their significance. Rangifer 10:409-417.
Thomas, D.C. et P. Kroeger. 1980. In vitro digestibilities of plants in rumen fluids of Peary caribou. Arctic 33:757-767.
Thomas, D.C., R.H. Russell, E. Broughton et P.L. Madore. 1976. Investigations of Peary caribou populations on some Canadian Arctic Islands, March 1975. Canadian Wildlife Service Progress Notes No. 64, Ottawa, Ontario. 13 pp.
Thomas, D.C., E.J. Edmonds et H.J. Armbruster. 1999. Range types and their relative use by Peary caribou and muskoxen on Melville Island, NWT. Canadian Wildlife Service Technical Report Series No. 343, Edmonton, Alberta. 146 pp.
Thompson, D.C. et C.A. Fischer. 1980. Numbers and distribution of caribou on the Boothia Peninsula, Northwest Territories. Canadian Field-Naturalist 94:171-174.
Thorpe, N., N. Hakongak, S. Eyegetok et Kitikmeot Elders. 2001. Thunder on the tundra: Inuit Qaujimajatuqangit of the Bathurst Caribou - Tuktu and Nogak Project. Generation Printing, Vancouver, British Columbia. 208 pp.
Tyler, N.J.C. 2010. Climate, snow, ice, crashes, and declines in populations of reindeer and caribou (Rangifer tarandus L.). Ecological Monographs 80:197-219.
Ulukhaktok, Wildlife Management Advisory Council (NWT), and Joint Secretariat. 2008. Olokhaktomiut Community Conservation Plan. Version 18 December 2009.
Urquhart, D.R. 1973. Oil exploration and Banks Island wildlife: a guideline for the preservation of caribou, muskox, and arctic fox populations on Banks Island, N.W.T. Northwest Territories Game Management Division, Yellowknife, Northwest Territories. 105 pp.
Usher, P.J. 1971. The Bankslanders: economy and ecology of a frontier trapping community. Volume 2 - Economy and ecology. Northern Science Research Group, Department of Indian Affairs and Northern Development, Ottawa, Ontario. 169 pp. [Également disponible en français : Usher, P.J. 1974. Les trappeurs de l’île Banks : l’économie et l’écologie d’une communauté esquimaude. Volume 2 – Économie et écologie, Bureau de recherches scientifiques sur le Nord, ministère des Affaires indiennes et du Nord canadien, Ottawa (Ontario), 181 p.]
Van der Wal, R., N. Madan, S. Van Lieshout, C. Dormann, R. Langvatn et S.D. Albon. 2000. Trading forage quality for quantity? Plant phenology and patch choice by Svalbard reindeer. Oecologia 123:108–115.
Van der Wal, R., Brooker, R., Cooper, E. et Langvatn, R. 2001. Differential effects of reindeer on high Arctic lichens. Journal of Vegetation Science, 12:705-710.
Van der Wal, R. 2006. Do herbivores cause habitat degradation or vegetation state transition? Evidence from the tundra. Oikos, 114:177-186.
Vincent, D. et A. Gunn. 1981. Population increase of muskoxen on Banks Island and implications for competition with Peary caribou. Arctic 34:175-179.
Vistnes, I., C. Nellemann, P. Jordhoy et O. Stoen. 2008. Summer distribution of wild reindeer in relation to human activity and insect stress. Polar Biology 31:1307-1317.
Vors, L.S. et M.S. Boyce. 2009. Global declines of caribou and reindeer. Global Change Biology 15:2626-2633.
Weladji, R.B. et B.C. Forbes. 2002. Disturbance effects of human activities on Rangifer tarandus habitat: implications for life history and population dynamics. Polar Geography 26:171-186.
Wilkinson, P.F., C.C. Shank et D.F. Penner. 1976. Muskox-caribou summer range relations on Banks Island, N.W.T. Journal of Wildlife Management 40:151-162.
Yannic, G. et al. 2013. Genetic diversity in caribou linked to past and future climate change. Nature Climate Change. DOI: 10.1038/NCLIMATE2074.
Youngman, P.M. 1975. Mammals of the Yukon Territory. National Museum of Canada. Publications in Zoology No. 10, 192 pp.
Ytrehus, B., Davidson, R. et Isaksen, K. 2015. Single Causative Factor for Severe Pneumonia Epizootics in Muskoxen? EcoHealth:1-3. doi:10.1007/s10393-015-1033-4.
Zhang, X., R. Brown, L. Vincent, W. Skinner, Y. Feng et E. Mekis. 2011. Canadian climate trends, 1950-2007. Canadian Biodiversity: Ecosystem Status and Trends 2010, Technical Thematic Report No. 5. Ottawa, Ontario, Canadian Councils of Resource Ministers. [Également disponible en français : Zhang, X., R. Brown, L. Vincent, W. Skinner, Y. Feng et E. Mekis. 2011. Tendances climatiques au Canada, de 1950 à 2007. Biodiversité canadienne : état et tendances des écosystèmes en 2010, Rapport technique thématique nº 5, Ottawa (Ontario), Conseils canadiens des ministres des ressources]
Zittlau, K., J. Nagy, A. Gunn et C. Strobeck. 2009. Do subspecific divisions make good conservation units? Pp 135-145 in K. McFarlane, A. Gunn, et C. Strobeck (eds), Proceedings from the Caribou Genetics and Relationships Workshop, March 8-9, 2003, Edmonton, Alberta. Department of Natural Resources and Environment, Government of the Northwest Territories Manuscript Report No. 183.
Zoltai, S.C., P.N. Boothroyd et G.W. Scotter. 1981. A natural resource survey of eastern Axel Heiberg Island, Northwest Territories. Parks Canada.
Lee E. Harding est titulaire d’un baccalauréat ès sciences en gestion de la faune et d’un doctorat en toxicologie de la faune. Aujourd’hui directeur de la SciWrite Environmental Sciences Ltd., il était auparavant, de 1976 jusqu’à sa retraite anticipée en 1997, biologiste principal et gestionnaire de programmes scientifiques à Environnement Canada. De 1977 à 1980, M. Harding a géré la Division de l’évaluation des impacts au bureau régional du Service de la protection de l’environnement, à Yellowknife, dans les Territoires du Nord-Ouest. De 1972 à1976, à titre de consultant en environnement évaluant l’impact des développements industriels dans l’Arctique, il a étudié le caribou de la toundra et le renne dans le delta du Mackenzie, le caribou des montagnes au Yukon et en Colombie-Britannique, et le caribou de Peary dans les îles Bathurst, Melville et Little Cornwallis. Il a été le premier à attirer l’attention sur le risque de disparition du caribou des montagnes en Colombie-Britannique dans un article publié dans une revue en 1975. M. Harding est le rédacteur de la réévaluation par le COSEPAC du caribou de Peary publiée en 2004.
Des collections n’ont pas été examinées dans le cadre de la présente réévaluation.
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1970 | juin | 5 300 | - | faons inclus | 38 804 | 1,8301 | 9 699 | Kevan, 1974 |
| 1971 | juin | 10 327 | - | faons inclus | 74 333 | 0,9554 | 9 866 | Urquhart, 1973 |
| 1972 | sept. | 12 098 | - | faons inclus | 74 333 | 0,9554 | 11 558 | Urquhart, 1973 |
| 1982 | juillet | 9 036 ± 2 927 | IC à 95 % | faons exclus | 70 582 | 1,0061 | 9 091 | Nagy et al., 2009d |
| 1985 | juillet | 4 931 ± 914 | é.-t. | faons exclus | 70 266 | 1,0064 | 4 983 | Nagy et al., 1996 |
| 1987 | juin | 4 251 ± 663 | é.-t. | faons exclus | 70 266 | 1,0064 | 4 296 | Nagy et al., 1996 |
| 1989 | juin | 2 641 ± 344 | é.-t. | faons exclus | 70 266 | 1,0164 | 2 669 | Nagy et al., 1996 |
| 1991 | juin-juillet | 897 ± 151 | é.-t. | faons exclus | 70 266 | 1,0164 | 907 | Nagy et al., 1996 |
| 1992 | août | 1 018 ± 270 | IC à 95 % | faons exclus | 70 583 | 1,0061 | 1 024 | Nagy et al., 2009f |
| 1994 | juillet | 742 ± 132 | IC à 95 % | faons exclus | 70 583 | 1,0061 | 747 | Nagy et al., 2013b |
| 1998 | juillet | 451 ± 123 | IC à 95 % | faons exclus | 70 583 | 1,0061 | 454 | Nagy et al., 2013a |
| 2001 | juillet | 1 142 ± 324 | IC à 95 % | faons exclus | 70 583 | 1,0061 | 1 149 | Nagy et al., 2006 |
| 2005 | juillet-août | 929 ± 289 | IC à 95 % | faons exclus | 70 585 | 1,0061 | 935 | Nagy et al., 2009e |
| 2010 | juillet | 1 097 ± 343 | IC à 95 % | faons exclus | 70 579 | 1,0061 | 1 104 | Davison et al., 2013 |
| 2014 | juillet | 2 234 ± 830 | IC à 95 % | faons exclus | 70 580 | 1,0061 | 2 248 | Davison et al., 2014 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1980 | août | 4 512 ± 988 | é.-t. | faons inclus | 33 520 | 1,0668 | 4 814 | Jakimchuk et Carruthers, 1980 |
| 1987 | juin | 2 600 | - | faons exclus | 32 710 | 1,0932 | 2 800 | Gunn, 2005; Gunn et Fournier, 2000 |
| 1993 | juin | 159 | - | faons inclus | 22 363 | 1,5990 | 250 | Gunn, 2005 |
| 1994 | juin | 39 ± 28 | é.-t. | faons inclus | 26 992 | 1,3248 | 52 | Nishi et Buckland, 2000 |
| 1998 | juillet | 95 ± 60 | IC à 95 % | faons exclus | 24 880 | 1,4373 | 137 | Nagy et al., 2009c |
| 2001 | juillet | 204 ± 103 | IC à 95 % | faons exclus | 20 364 | 1,7560 | 358 | Nagy et al., 2009a |
| 2005 | juillet | 66 ± 61 | IC à 95 % | faons exclus | 20 364 | 1.7560 | 116 | Nagy et al., 2009b |
| 2010 | juillet-août | 150 ± 104 | IC à 95 % | faons exclus | 20 364 | 1,7560 | 263 | Davison et Williams, 2013 |
| 2015 | avril-mai | 2 | - | nbre min. (faons exclus) | 20 364 | 1,7560 | 4 | Davison et Williams, 2015 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1974 | août | 561 | - | faons inclus | 33 000 | 0,9723 | 545 | Fischer et Duncan, 1976 |
| 1975 | juin | 1 739 | - | faons inclus | 32 811 | 0,9779 | 1 701 | Fischer et Duncan, 1976 |
| 1976 | mars | 1 120 | - | faons inclus | 32 941 | 0,9740 | 1 091 | Thompson et Fischer, 1980 |
| 1985 | juin | 4 831 ± 543 | é.-t. | adultes et jeunes d'un an | 32 715 | 0,9808 | 4 738 | Gunn et Ashevak, 1990, Gunn et Dragon, 1998 |
| 1995 | juillet et août | 3 329 | - | adultes et jeunes d'un an | 32 715 | 0,9808 | 3 265 | Gunn et Dragon, 1998 |
| 2006 | juin | 1 | - | nbre min. | 32 715 | 0,9808 | 1 | Dumond, 2006 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1974 | juillet | 5 437 | - | faons inclus | 33 770 | 1,0000 | 5 437 | Fischer et Duncan, 1976 |
| 1975 | juin | 3 768 | - | faons inclus | 33 643 | 1,0038 | 3 768 | Fischer et Duncan, 1976 |
| 1980 | juillet | 3 952 ± 932 | IC à 95 % | adultes et jeunes d'un an | 31 686 | 1,0658 | 3 952 | Gunn et Decker, 1984 |
| 1995 | juillet | 5 | - | nbre min. | 32 946 | 1,0251 | 5 | Gunn et Dragon, 1998 |
| 1996 | avril-mai | 0 | - | - | 33 340 | 1,0129 | 0 | Miller, 1997a |
| 2004 | avril | 0 | - | - | 33 274 | 1,0150 | 0 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1974 | juin | 245 | - | faons inclus | 24 786 | 0,9892 | 242 | Fischer et Duncan, 1976 |
| 1975 | juin | 903 | - | faons inclus | 24 786 | 0,9892 | 893 | Fischer et Duncan, 1976 |
| 1980 | juillet | 561 ± 300 | IC à 95 % | adultes et jeunes d'un an | 23 818 | 1,0294 | 577 | Gunn et Decker, 1984 |
| 1995 | juillet et août | 2 | - | nbre min. | 8 544 | 2,8695 | 115 | Gunn et Dragon, 1998 |
| 1996 | avril-mai | 2 | - | nbre min. | 23 818 | 1,0294 | 49 | Miller, 1997a |
| 2004 | avril | 0 | - | - | 25 549 | 0,9596 | 0 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1975 | juin | 159 | - | faons inclus | 940 | 1,0251 | 163 | Fischer et Duncan, 1976 |
| 1980 | juillet | 584 ± 90 | IC à 95 % | adultes et jeunes d'un an | 930 | 1,0362 | 605 | Gunn et Decker, 1984 |
| 1995 | juillet | 0 | - | - | 975 | 0,9883 | 0 | Gunn et Dragon, 1998 |
| 1996 | avril-mai | 0 | - | - | 940 | 1,0251 | 2 | Miller, 1997a |
| 2004 | avril | 0 | - | - | 937 | 1,0284 | 0 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classe d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 300 | - | faons inclus | 30 232 | 1,0053 | 302 | Tener, 1963 |
| 1973 | juillet | 35 | - | faons inclus | 1 010 | 30,0867 | 1 053 | Riewe, 1973 |
| 1995 | juin | 25 | - | nbre min. (faons inclus) | 8 101 | 3,7515 | 94 | Gauthier, 1996 |
| 2007 | avril-mai | 2 291 (1 636-3 208) | IC à 95 % | jeunes de 10 mois et adultes | 30 877 | 0,9842 | 2 255 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classe d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juin-août | 200 | - | faons inclus | 116 407 | 0,9585 | 192 | Tener, 1963 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classe d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1973 | juillet | 450 | - | faons inclus | 19 788 | 5,6389 | 2 538 | Riewe, 1973 |
| 1989 | juillet | 89 ± 31 | é.-t. | faons inclus | 25 050 | 4,4543 | 396 | Case et Ellesworth, 1991 |
| 2005 | mai | 219 (109-442) | IC à 95 % | adultes et jeunes d'un an | 22 243 | 5,0164 | 1 099 | Jenkins et al., 2011 |
| 2015 | mars | 183 ± 128 | é.-t. | adultes et jeunes d'un an | 22 243 | 5,0164 | 918 | Anderson et Kingsley, 2015 |
| Île | Année | Mois | Estimation des relevés | Type d'erreur | Classe d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|---|
| Centre de l'île d'Ellesmere | 1995 | juin | 38 | - | nbre min. (faons inclus) | 28 383 | 3,9313 | 149 | Gauthier, 1996 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classe d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 2006 | avril-mai | 802 (531-1207) | IC à 95 % | adultes et jeunes d'un an | 96 567 | 1,1555 | 927 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 12 799 | - | faons inclus | 41 334 | 1,0349 | 13 246 | Tener, 1963 |
| 1972 | août | 2 551 ± 724 | é.-t. | faons inclus | 42 220 | 1,0132 | 2 585 | Miller et al., 1977b; SARC, 2012 : Jenkins et al., 2011 |
| 1973 | juillet et août | 3 425 ± 618 | é.-t. | faons inclus | 42 220 | 1,0132 | 3 470 | Miller et al., 1977b; SARC, 2012 : Jenkins et al., 2011 |
| 1974 | juillet et août | 1 679 | - | faons inclus | 42 220 | 1,0132 | 1 701 | Miller et al., 1977b; SARC, 2012 : Jenkins et al., 2011 |
| 1987 | juillet | 943 ± 126 | é.-t. | faons inclus | 42 220 | 1,0132 | 955 | Miller, 1988 |
| 1997 | juillet | 787 ± 97 | é.-t. | aucun faon vu | 42 220 | 1,0132 | 797 | Gunn et Dragon, 2002 |
| 2012 | juillet-août | 2 728 ± 647 | IC à 95 % | jeunes de 1 an et plus | 42 583 | 1,0045 | 2 740 | Davison et Williams, 2012 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juillet | 2 254 | - | faons inclus | 15 750 | 1,0360 | 2 335 | Tener, 1963 |
| 1973 | juillet-août | 807 ± 259 | é.-t. | faons inclus | 15 830 | 1,0307 | 832 | Miller et al., 1977b; SARC, 2012; Jenkins et al., 2011 |
| 1974 | juillet-août | 621 ± 177 | é.-t. | faons inclus | 15 830 | 1,0307 | 640 | Miller et al., 1977b; SARC, 2012; Jenkins et al., 2011 |
| 1986 | juillet | 151 | - | faons inclus | 15 830 | 1,0307 | 156 | Miller, 1987 |
| 1997 | juin | 84 ± 34 | é.-t. | jeunes de 1 an et plus | 15 830 | 1,0307 | 87 | Gunn et Dragon, 2002 |
| 2012 | juillet-août | 2 708 ± 855 | IC à 95 % | jeunes de 1 an et plus | 16 090 | 1,0141 | 2 746 | Davison et Williams, 2012 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juillet | 204 | - | faons inclus | 1 427 | 1,0917 | 223 | Tener, 1963 |
| 1972 | août | 83 ± 59 | é.-t. | faons inclus | 1 550 | 1,0051 | 83 | Miller et al., 1977b |
| 1973 | août | 12 ± 9 | é.-t. | faons inclus | 1 550 | 1,0051 | 12 | Miller et al., 1977b |
| 1974 | juillet | 18 ± 10 | é.-t. | faons inclus | 1 550 | 1,0051 | 18 | Miller et al., 1977b |
| 1986 | juillet | 79 | - | faons inclus | 1 550 | 1,0051 | 79 | Miller, 1987 |
| 1997 | juillet | 0 | é.-t. | - | 1 550 | 1,0051 | 0 | Gunn et Dragon, 2002 |
| 2012 | juillet-août | 181 ± 134 | IC à 95 % | jeunes de 1 an et plus | 1 573 | 0,9902 | 181 | Davison et Williams, 2012 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juillet | 161 | - | faons inclus | 650 | 0,8556 | 138 | Tener, 1963 |
| 1973 | juillet | 39 | - | faons inclus | 550 | 1,0113 | 39 | Miller et al., 1977b |
| 1974 | juillet | 20 | - | faons inclus | 550 | 1,0113 | 20 | Miller et al., 1977b |
| 1986 | juillet | 14 (0-49) | IC à 95 % | faons inclus | 550 | 1,0113 | 14 | Miller, 1987 |
| 1997 | juillet | 0 | - | - | 550 | 1,0113 | 0 | Gunn et Dragon, 2002 |
| 2012 | juillet-août | 46 ± 78 | IC à 95 % | jeunes de 1 an et plus | 570 | 0,9756 | 45 | Davison et Williams, 2012 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1972 | août | 86 ± 65 | é.-t. | faons inclus | 1 160 | 1,0189 | 88 | Miller et al., 1977b; Jenkins et al., 2011 |
| 1973 | juillet | 43 ± 36 | é.-t. | faons inclus | 1 160 | 1,0189 | 44 | Miller et al., 1977b; Jenkins et al., 2011 |
| 1974 | août | 6 ± 4 | é.-t. | faons inclus | 1 160 | 1,0189 | 6 | Miller et al., 1977b; Jenkins et al., 2011 |
| 1987 | juillet | 98 ± 37 | é.-t. | faons inclus | 1 160 | 1,0189 | 100 | Miller, 1988; Jenkins et al., 2011 |
| 1997 | juillet | 0 | - | - | 1 160 | 1,0189 | 0 | Gunn et Dragon, 2002; Jenkins et al., 2011 |
| 2012 | juillet-août | 119 ± 73 | IC à 95 % | faons exclus | 1 158 | 1,0207 | 121 | Davison et Williams, 2012 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 2 192 | - | toutes | - | - | 2 192 | Tener, 1963 |
| 1973 | avril | 3 | - | nbre min. | - | - | 3 | Miller et al., 1977b |
| 1974 | avril | 60 | - | toutes | - | - | 60 | Miller et al., 1977b |
| 1997 | juillet | 36 ± 22 | é.-t. | jeunes de 1 an et plus | - | - | 36 | Gunn et Dragon, 2002 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 1 630 | - | toutes | - | - | 1 630 | Tener, 1963 |
| 1973 | avril | 16 | - | toutes | - | - | 16 | Miller et al., 1977b |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 190 | - | toutes | - | - | 190 | Tener, 1963 |
| 1973 | avril | 24 | - | toutes | - | - | 24 | Miller et al., 1977b |
| 1997 | juillet | 0 | - | - | - | - | 0 | Gunn et Dragon, 2002 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juin | 150 | - | faons inclus | 37 550 | 1,0323 | 155 | Tener, 1963 |
| 2002 | mai | 35 | - | nbre min. (faons inclus) | 12 316 | 3,1475 | 110 | Jenkins et al., 2011 |
| 2008 | avril-mai | 17 | - | nbre min. (faons inclus) | 39 731 | 0,9757 | 17 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | août | 1 325 | - | faons inclus | 808 | 1,6458 | 2 181 | Tener, 1963 |
| 1973 | avril | 66 | - | faons inclus | 1 300 | 1,0230 | 68 | Miller et al., 1977b |
| 1974 | avril | 0 | - | - | 1 300 | 1,0230 | 0 | Miller et al., 1977b |
| 1985 | juillet | 0 | - | - | 1 300 | 1,0230 | 0 | Miller, 1987b |
| 1997 | juillet | 101 ± 73 | é.-t. | jeunes de 1 an et plus | 1 300 | 1,0230 | 103 | Gunn et Dragon, 2002 |
| 2007 | avril | 372 (205-672) | IC à 95 % | jeunes de 1 an et plus | 1 319 | 1,0083 | 375 | Jenkins et al., 2011 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juin et juillet | 3 509 | - | faons inclus | - | - | 3 509 | Tener, 1963; ajusté par Miller et al., 2005 |
| 1973 | mars-avril | 990 | - | faons inclus | 19 266 | 1,0350 | 1 025 | Miller et al., 1977b |
| 1974 | août | 269 | - | faons inclus | 19 266 | 1,0350 | 278 | Miller et al., 1977b |
| 1985 | juillet | 724 (460-987) | IC à 95 % | faons inclus | 19 266 | 1,0350 | 749 | Miller, 1987b |
| 1988 | juillet | 1 034 ± 146 | é.-t. | faons inclus | 19 266 | 1,0350 | 1 070 | Miller, 1989 |
| 1990 | juillet | 871 | - | nbre min. (faons inclus) | 19 266 | 1,0350 | 901 | Miller, 1992 |
| 1991 | juin et juillet | 949 | - | nbre min. (faons inclus) | 19 266 | 1,0350 | 982 | Miller, 1993 |
| 1992 | juillet | 1 644 | - | nbre min. (faons inclus) | 19 266 | 1,0350 | 1 701 | Miller, 1994 |
| 1993 | août | 2 387 | - | nbre min. (faons inclus) | 19 266 | 1,0350 | 2 470 | Miller, 1995b |
| 1994 | juillet | 3 100 | - | faons inclus | 27 550 | 0,7238 | 2 244 | Miller, 1997b; Miller, 1998 |
| 1995 | juillet | 2 200 | - | nbre min. (faons inclus) | 27 550 | 0,7238 | 1 592 | Miller, 1997b; Miller, 1998 |
| 1996 | juillet | 552 ± 108 | é.-t. | faons inclus | 27 550 | 0,7238 | 400 | Miller, 1998 |
| 1997 | juin et juillet | 78 | - | jeunes de 1 an et plus | 19 266 | 1,0350 | 81 | Gunn et Dragon, 2002 |
| 2001 | mai | 187 (104-330) | IC à 95 % | jeunes de 1 an et plus | 19 644 | 1,0150 | 190 | Jenkins et al., 2011 |
| 2013 | mai | 1 482±387 | IC à 95 % | faons inclus | 20 200 | 0,9871 | 1 463 | Anderson, 2014 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juin | 43 | - | faons inclus | 6 915 | 1,0338 | 44 | Tener, 1963 |
| 1988 | juillet | 51 (0-107) | IC à 95 % | faons inclus | 7 000 | 1,0213 | 52 | Miller, 1989 |
| 2002 | mai | 1 | - | nbre min. | 3 411 | 2,0958 | 2 | Jenkins et al., 2011 |
| 2013 | mai | 2 | - | nbre min. (faons inclus) | 3 411 | 2,0958 | 4 | Anderson, 2014 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1961 | juin | 0 | - | - | 412 | 1,0249 | 0 | Tener, 1963 |
| 1973 | mars et août | 9 | - | faons inclus | 410 | 1,0294 | 9 | Miller et al., 1977b |
| 1974 | mars | 12 | - | faons inclus | 410 | 1,0294 | 12 | Miller et al., 1977b |
| 1988 | juillet | 0 | - | - | 410 | 1,0294 | 0 | Miller, 1989 |
| 2002 | mai | 0 | - | - | 381 | 1,1077 | 0 | Jenkins et al., 2011 |
| 2013 | mai | 1 | - | nombre total min. | 381 | 1,1077 | 1 | Anderson, 2014 |
| Année | Mois | Estimation des relevés | Type d'erreur | Classes d'âge | Superficie recensée (km2) | Facteur d'échelle | Estimation corrigée | Références |
|---|---|---|---|---|---|---|---|---|
| 1973 | avril | 0 | - | faons inclus | 220 | 1,5043 | 0 | Miller et al., 1977b |
| 1974 | mars | 3 | - | faons inclus | 220 | 1,5043 | 5 | Miller et al.,1977b |
| 1985 | juillet | 0 | - | - | 220 | 1,5043 | 0 | Miller, 1987 |
| 1988 | juillet | 17 (0-42) | IC à 95 % | faons inclus | 220 | 1,5043 | 26 | Miller, 1989 |
| 1990 | juillet | 34 | - | nbre min. (faons inclus) | 220 | 1,5043 | 51 | Miller, 1992 |
| 1991 | juin | 22 | - | nbre min. (faons inclus) | 220 | 1,5043 | 33 | Miller, 1993 |
| 1992 | juin | 46 | - | nbre min. (faons inclus) | 220 | 1,5043 | 69 | Miller, 1994 |
| 1995 | juin | 49 | - | nbre min. (faons inclus) | 220 | 1,5043 | 74 | Miller, 1997b |
| 1997 | juillet | 0 | - | - | 220 | 1,5043 | 0 | Gunn et Dragon, 2002 |
| 2001 | mai | 2 | - | nbre min. (faons inclus) | - | - | - | Jenkins et al.,2011 |
| 2013 | mai | 2 | - | nbre min. (faons inclus) | - | - | - | Anderson, 2014 |
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de nniveau 1 selon l'intensité de leur impact : Maximum de la plage d'intensité |
Comptes des menaces de nniveau 1 selon l'intensité de leur impact : Minimum de la plage d'intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 1 | 2 |
| C | Moyen | 2 | 1 |
| D | Faible | 3 | 5 |
| - | Impact global des menaces calculé : | Très élevé | Élevée |
| Numéro de la menace | Menace | Impact (calculé) |
Impact (calculé) Définition |
Portée (10 prochaines années) |
Gravité (10 ans ou 3 générations) |
Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | - | Négligeable | Négligeable (< 1 %) |
Extrême (71-100 %) |
Élevée (continue) |
- |
| 1.1 | Zones résidentielles et urbaines | - | Négligeable | Négligeable (< 1 %) |
Extrême (71-100 %) |
Élevée (continue) |
La portée inclut des parties de l'aire de répartition de l'espèce aliénées par des établissements humains ainsi qu'une zone tampon pour les animaux déplacés par les perturbations. |
| 3 | Production d'énergie et exploitation minière | D | Faible | Restreinte-petite (1-30 %) |
Légère (1-10 %) |
Élevée (continue) |
- |
| 3.1 | Forage pétrolier et gazier | D | Faible | Restreinte-petite (1-30 %) |
Légère (1-10 %) |
Modérée (peut-être à court terme, < 10 ans) |
Aucune activité de prospection sismique et aucun développement pétrolier et gazier ne se déroulent à l'heure actuelle, mais les participants sont d'avis qu'il est très probable que ces activités prendront de l'essor au cours des dix prochaines années. Des impacts de la prospection sismique (en particulier le dynamitage) sur les populations de caribous ont déjà été observés dans les années 1970, bien qu'il soit difficile de les dégager d'autres sources de déclin. Les impacts seront plus élevés si des activités d'intensité élevée sont menées là où la plus grande partie de la population se trouve à ce moment-là. |
| 3.2 | Exploitation de mines et de carrières | D | Faible | Petite (1-10 %) |
Légère (1-10 %) |
Élevée (continue) |
Des travaux de prospection minière ont eu cours (charbon dans la péninsule Foshein de l'île d'Ellesmere et dans l'île Axel Heiberg; jalonnement aux fins de l'exploitation du charbon dans l'île Banks), mais ces activités ont cessé lorsque les marchés se sont effondrés. Plusieurs vieux sites dans les îles Prince Patrick et Victoria doivent être nettoyés. |
| 4 | Corridors de transport et de service | CD | Moyen-faible | Restreinte-petite (1-30 %) |
Élevée-modérée (11-70 %) |
Élevée (Continue) |
- |
| 4.1 | Routes et voies ferrées | D | Faible | Petite (1-10 %) |
Légère (1-10 %) |
Modérée (peut-être à court terme, < 10 ans) |
- |
| 4.2 | Lignes de services publics | - | Négligeable | Négligeable (< 1 %) |
Négligeable (< 1 %) |
Inconnue | - |
| 4.3 | Voies de transport par eau | CD | Moyen-faible | Restreinte-petite (1-30 %) |
Élevé-modérée (11-70 %) |
Élevée (continue) |
Cette menace présente une vaste plage d'incertitude, en particulier au cours des 10 prochaines années. Sa gravité pour l'ensemble de la population dépendra des traverses interinsulaires touchées et de la taille des effectifs. Des chenaux de navigation pourraient s'ouvrir dans le complexe Prince of Wales Somerset; les traverses Reine-Élisabeth–Prince of Wales; Bathurst–Cornwallis; Banks-Victoria (peu probable) et le complexe de l'île d'Ellesmere. Les traverses interinsulaires sont particulièrement importantes pour le caribou de Peary. Au cours des 10 prochaines années, les projets de développement nécessitant le transport par eau, ainsi que les navires de croisière, pourraient avoir un impact élevé sur les traverses empruntées par les caribous. Les brise-glaces et les navires arrivent de plus en plus tôt dans l'Arctique chaque année, et y restent et continuent à briser la glace jusqu'à la fin de la saison pour faciliter la navigation des navires de croisière. L'ouverture du passage du Nord-Ouest donnant accès à la région de Kitikmeot a permis d'accroître le transport de minéraux vers le sud. |
| 4.4 | Corridors aériens | - | Négligeable | Négligeable (< 1 %) |
Légère (1-10 %) |
Modérée-faible | Vols commerciaux réguliers |
| 5 | Utilisation des ressources biologiques | D | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (continue) |
- |
| 5.1 | Chasse et capture d'animaux terrestres | D | Faible | Petite (1-10 %) |
Légère (1-10 %) |
Élevée (continue) | De nombreuses autres menaces et circonstances peuvent interagir avec la chasse et la capture d'animaux terrestres dans la détermination de la gravité : climat, réponse de la gestion et qualité des données de relevé. Pour ce qui est de la portée, une grande partie de l'aire de répartition est inaccessible. Gravité : Des quotas sont en place dans les territoires de chasse, et ce ne sont pas tous les caribous qui rencontrent un chasseur qui sont abattus. Si les gestionnaires font bien leur travail, il ne devrait pas y avoir de déclin. La hausse de la gravité, qui est maintenant qualifiée de légère, tient compte d'autres facteurs qui peuvent entraîner un déclin, notamment la mortalité non déclarée et la méconnaissance de l'état de la population. |
| 6 | Intrusions et perturbations humaines | D | Faible | Restreinte (11-30 %) | Légère (1-10 %) | Élevée (Continue) |
- |
| 6.1 | Activités récréatives | - | Négligeable | Négligeable (< 1 %) |
Négligeable (< 1 %) |
Élevée (continue) |
- |
| 6.2 | Guerre, troubles civils et exercices militaires | D | Faible | Restreinte (11-30 %) |
Légère (1-10 %) |
Élevée (continue) |
La fréquence des exercices militaires menés toute l'année augmente dans l'aire de répartition du caribou de Peary (surtout des exercices à bord de navires et au sol). Le personnel militaire voyage sur de longues distances, d'une île à l'autre. Ces activités devraient être plus fréquentes à l'avenir. |
| 6.3 | Travail et autres activités | D | Faible | Restreinte (11-30 %) |
Légère (1-10 %) |
Élevée (continue) |
La menace a trait aux activités menées sur terre : motoneiges, hélicoptères, avions, vols non prévus. Comme de plus amples recherches sont menées (p. ex. sur les changements climatiques), la circulation est à la hausse. |
| 8 | Espèces et gènes envahissants ou autrement problématiques | CD | Moyen-faible | Généralisée (71-100%) | Modérée-légère (1-30%) | Élevée (continue) |
- |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | CD | Moyen-faible | Grande-restreinte (11-70 %) |
Modérée-légère (1-30 %) |
Élevée (continue) |
Les agents pathogènes incluent des espèces indigènes et non indigènes. En ce qui concerne la portée de la menace, il règne une grande incertitude quant à la mesure dans laquelle la population sera touchée par des agents pathogènes au cours des 10 prochaines années. La portée ne sera probablement pas supérieure à 50 %. compte tenu des indications actuelles et de l'incertitude. Il faut tenir compte de l'interaction entre les changements climatiques et les relations entre hôte et agent pathogène qui est déjà en voie d'être documentée. Plus de cycles de parasites pourraient se produire si la température augmente. |
| 8.2 | Espèces indigènes problématiques | D | Faible | Généralisée (71-100 %) |
Légère (1-10 %) |
Élevée (continue) |
Le bœuf musqué, le loup, le carcajou et le grizzli entrent dans cette catégorie. La portée de la menace doit être généralisée parce que tous les caribous de Peary rencontrent une ou plusieurs de ces espèces. L'impact direct est incertain, mais probablement faible. Il existe toutefois des preuves d'une relation inverse entre le caribou et le bœuf musqué dans certaines régions, bien qu'elle varie dans l'ensemble de l'aire de répartition du caribou de Peary. Le mécanisme de la relation est inconnu, mais il pourrait que ce soit l'aversion. Dans certaines régions, les aînés disent que le nombre de bœufs musqués doit être limité afin de maintenir la population de caribous de Peary en santé. |
| 8.3 | Matériel génétique introduit | - | Inconnu | Petite (1-10 %) |
Inconnue | Élevée (continue) |
L'avenir dépend des changements climatiques et de la mesure à laquelle le caribou de la toundra et le caribou de Peary, ou le caribou de Peary et le caribou de Dolphin-et-Union, se rencontrent et s'hybrident. Le seul endroit où il existe une réelle possibilité de mélange est le nord-ouest de l'île Victoria, ce qui concerne 10 % de la population globale. Les résultats d'analyses génétiques révèlent un fort flux génique du caribou de Peary vers le sud; il ne se produit cependant pas une propagation correspondante de gènes du caribou de la toundra vers le nord. Ainsi, l'impact serait subi par le caribou de la toundra et le caribou de Dolphin-et-Union. Toutefois, l'impact (la gravité) de la menace sur le caribou de Peary est fondamentalement inconnu. |
| 9 | Pollution | - | Inconnu | Généralisée (71-100 %) |
Inconnue | Élevée (continue) |
- |
| 9.5 | Polluants atmosphériques | - | Inconnu | Généralisée (71-100 %) |
Inconnue | Élevée (continue) |
Il existe peu de sources de contaminants au Nunavut et dans les T. N.-O., mais ces endroits peuvent être des puits pour les polluants atmosphériques provenant du sud. À cause des vents, la menace est omniprésente. Les lichens ont tendance à absorber les polluants atmosphériques, mais ils ne constituent qu'une faible partie du régime alimentaire du caribou de Peary. Ces polluants seraient plus préoccupants s'ils étaient captés par le saule de l'Arctique. Des études ont montré que les caribous de l'île Banks ont une charge moindre en polluants que les caribous du continent. Les polybromodiphényléthers (utilisés dans les produits ignifuges), qui peuvent agir comme le DDT et se retrouvent chez la faune des T. N.-O., constituent une préoccupation croissante; leurs effets sont inconnus. Les courants aériens transportent les polluants depuis l'Inde et de la Chine vers l'Arctique. Les fractions volatiles se condensent et se précipitent sur la neige et la glace, et pénètrent dans les systèmes aquatiques. Les fractions légères, plus volatiles, se constatent dans les écosystèmes de l'Arctique. |
| 11 | Changements climatiques et phénomènes météorologiques violents | BC | Élevé-moyen | Généralisée (71-100 %) |
Élevée-modérée (11-70 %) |
Élevée (continue) |
- |
| 11 | Déplacement et altération de l'habitat | BC | Élevé-moyen | Généralisée (71-100 %) |
Élevée-modérée (11-70 %) |
Élevée (continue) |
Cette catégorie inclut le retrait de la glace de mer, la hausse du niveau de la mer, les modifications de l'habitat qui résultent des changements climatiques et les phénomènes atmosphériques violents. Les effets négatifs peuvent être compensés à certains endroits par des aspects positifs, comme la croissance de la végétation et de la biomasse. Parce que la majeure partie de cette végétation sera constituée d'arbustes, il n'est pas clair dans quelle mesure le caribou de Peary en bénéficiera vraiment. Si les changements se produisent graduellement, il pourrait y avoir plus de possibilités d'adaptation. Cette catégorie n'inclut pas les épisodes de verglas (voir 11.4) |
| 11 | Tempêtes et inondations | CD | Moyen-faible | Restreinte-petite (1-30 %) |
Élevée-modérée (11-70 %) |
Modérée (peut-être à court terme, < 10 ans) |
Le caribou de Peary peut se déplacer pour éviter les petits épisodes de verglas, mais si ces petits épisodes deviennent plus fréquents ou plus graves (à toutes les générations ou deux générations), l'impact pourra être élevé, comme à au moins deux reprises depuis le début du suivi du caribou de Peary dans les années 1960. Même si l'on s'attend à ce que la fréquence de ces épisodes augmente au cours des trois prochaines générations à cause des changements climatiques, une incertitude considérable entoure l'impact attendu sur la population de caribous de Peary. |
Classification des menaces d'après l'IUCN-CMP, Salafsky et al. (2008).
Détails de la page
- Date de modification :