Caribou (Rangifer tarandus) certaines populations : évaluation et rapport de situation du COSEPAC 2017
Caribou

© Caribou migrateur de l’Est - Steeve Côté.
Population migratrice de l’Est – En voie de disparition
Avril 2017
Population des monts Torngat – En voie de disparition
Novembre 2016
Table des matières
- Table des matières
- COSEPAC Sommaire de l’évaluation - Population migratrice de l’Est
- COSEPAC Sommaire de l’évaluation - Population des monts Torngat
- COSEPAC Résumé
- Résumé technique - Population migratrice de l’Est
- Résumé technique - Population des monts Torngat
- Préface
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Tailles et tendances des populations
- Menaces et facteurs limitatifs
- Facteurs limitatifs
- Menaces
- Exploitation de mines (uicn 3.2); impact négligeable pour la population des monts torngat, élevé à faible pour la population migratrice de l’est
- éléments linéaires (routes, lignes de services publics; uicn 4.1, 4.2); impact non calculé pour la population des monts torngat, faible pour la population migratrice de l’est
- Chasse (uicn 5.1); impact élevé pour la population des monts torngat, moyen pour la population migratrice de l’est
- Activités récréatives (uicn 6.1); impact négligeable pour les deux populations
- Incendies (uicn 7.1); impact non calculé pour la population des monts torngat, moyen à faible pour la population migratrice de l’est
- Espèces indigènes problématiques (uicn 8.2) – prédation; impact inconnu pour la population des monts torngat, faible pour la population migratrice de l’est, car, malgré l’inquiétude croissante, l’absence de quantifications de l’impact entraîne de l’incertitude.
- Espèces indigènes problématiques (uicn 8.2) – parasites et agents pathogènes; impact non calculé pour la population des monts torngat, faible pour la population migratrice de l’est, car, malgré l’inquiétude croissante, l’absence de données entraîne de l’incertitude.
- Pollution (uicn 9.2, 9.5); impact inconnu pour les deux populations, car, malgré l’inquiétude croissante, l’absence de données entraîne de l’incertitude.
- Changements climatiques - déplacement et altération de l’habitat (uicn 11,1); impact inconnu pour les deux populations, mais les effets futurs soulèvent des inquiétudes considérables; l’impact devrait être considérable après trois générations.
- Nombre de localités
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédacteurs du rapport
- Collections examinées
Liste des figures
- Figure 1. Répartition approximative de la population de caribous des monts Torngat et des quatre sous-populations de caribous migrateurs de l’Est.
- Figure 2. Répartition comparée de la sous-population de la rivière George à la fin des années 1990 et durant la période 2010 – 2014.
- Figure 3. Emplacement des aires de mise bas de la sous-population de la rivière George durant la période 1974 – 2010, indiqué en gris clair.
- Figure 4. Aire de répartition estimée de la sous-population de caribous des monts Torngat, représentée par le polygone rouge.
- Figure 5. Migrations printanières et automnales de caribous suivis par satellite faisant partie de la sous-population de la rivière aux Feuilles et de la sous-population de la rivière George, 2009-2011.
- Figure 6. Nombre d’individus de tous les âges estimé d’après des relevés aériens et soumis à une transformation logarithmique, pour les sous-populations de la rivière George (RG) et de la rivière aux Feuilles (RAF), de 1963 à 2016.
- Figure 7. Estimation des taux de survie des femelles adultes munies d’un collier émetteur radio dans les sous-populations de la rivière George et de la rivière aux Feuilles, avec écart-type.
- Figure 8. Pourcentage de mâles (toutes classes de tailles confondues) et de grands mâles observés durant les dénombrements automnaux avec classification effectués dans les sous-populations de la rivière George (TRG) et de la rivière aux Feuilles (TRAF).
- Figure 9. Ratio de faons pour 100 femelles adultes observé dans le cadre des dénombrements avec classification réalisés à l’automne dans les sous-populations de la rivière George (TRG) et de la rivière aux Feuilles (TRAF).
- Figure 10. Exemple d’expansion de la couverture arbustive sur une période de 20 ans, dans le parc national du Canada des Monts-Torngat.
Liste des tableaux
- Tableau 1. Plus récentes estimations du nombre d’individus de tous âges dans les souspopulations de caribous migrateurs de l’Est.
Liste des annexes
Information sur le document
Sommaire du statut de l’espèce du COSEPAC sur le Caribou Rangifer tarandus au Canada, 2017

COSEPAC
Comité sur la situation
des espèces en péril
au Canada

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les sommaires du statut de l’espèce du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages au Canada que l’on croit en péril. On peut citer le présent document de la façon suivante :
COSEPAC. 2017. Évaluation et Rapport de situation du COSEPAC sur le caribou(Rangifer tarandus), population migratrice de l’Est et population des monts Torngat,au Canada. Comité sur la situation des espèces en péril au Canada, Ottawa, xx + XX p. (Registre public des espèces en péril site Web).
Note de production :
Le COSEPAC remercie Steeve D. Côté et Marco Festa-Bianchet d’avoir rédigé le rapport de situation sur le caribou (Rangifer tarandus), population migratrice de l’Est et population des monts Torngat, au Canada, aux termes d’un marché conclu avec Environnement et Changement climatique Canada. La supervision et la révision du rapport ont été assurées par Graham Forbes, coprésident du Sous-comité de spécialistes des mammifères terrestres du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site Web du COSEPAC
Also available in English under the title “COSEWIC Assessment and Status Report on the Caribou Rangifer tarandus, Eastern Migratory population and Torngat Mountains population,in Canada.”
Illustration/photo de la couverture :
Caribou des monts Torngat -- Photo : Charles Jutras, MFFP.
Caribou migrateur de l’Est -- Photo : Steeve Côté.
COSEPAC sommaire de l’évaluation - Population migratrice de l’Est
Sommaire de l’évaluation - avril 2017
- Nom commun
- Caribou - population migratrice de l'Est
- Nom scientifique
- Rangifer tarandus
- Statut
- En voie de disparition
- Justification de la désignation
- La population migratrice de caribou est composée de quatre sous-populations présentes depuis les côtes de l’ouest de la baie d’Hudson jusqu’au Labrador. La population est actuellement estimée à 170 636 individus matures, estimation qui révèle un déclin global de 80 % des effectifs sur 3 générations (18-21 ans). Le déclin devrait se poursuivre à cause de la surexploitation et d’une diminution de la qualité de l’habitat associée aux changements climatiques et aux activités de développement. Deux sous-populations en déclin renferment environ 99 % de la population migratrice de l’Est : celle de la rivière George a connu un déclin de 99 % sur 3 générations et celle de la rivière Leaf, un déclin de 68 % sur 2 générations. La taille des populations migratrices de caribou fluctue, mais l’on craint que les menaces récentes et prévues limitent la croissance d’une population qui est actuellement à son niveau le plus bas enregistré. Les menaces semblent être moins courantes dans les deux sous-populations de l’ouest, lesquelles représentent environ seulement 4 % de la population totale existante. La plupart des autres caribous font partie de la sous-population de la rivière Leaf, qui continue de connaître un déclin.
- Répartition
- Manitoba, Ontario, Québec, Terre-Neuve-et-Labrador
- Historique du statut
- Espèce désignée « en voie de disparition » en avril 2017.
COSEPAC sommaire de l’évaluation - Population des monts Torngat
Sommaire de l’évaluation - novembre 2016
- Nom commun
- Caribou – population des monts Torngat
- Nom scientifique
- Rangifer tarandus
- Statut
- En voie de disparition
- Justification de la désignation
- Cette population est limitée à la péninsule d’Ungava dans l’est du Québec, dans le nord du Labrador et au Nunavut (Killiniq et les îles adjacentes). Aucune tendance quantitative n’est disponible, car les données de relevés sont limitées, mais la population totale a été estimée à 5 000 individus en 1980 et à 930 individus en 2014, ce qui semble indiquer un déclin significatif. Les connaissances traditionnelles autochtones indiquent également un déclin. La population correspond au statut d’espèce « en voie de disparition », car une seule population compte l’ensemble des 698 animaux matures estimés, un déclin de la population est évident et devrait se poursuivre en raison des taux de récolte et d’une diminution de la qualité de l’habitat associée aux changements climatiques. La population pourrait faire face à une disparition imminente en raison du faible nombre d’individus restants.
- Répartition
- Nunavut, Québec, Terre-Neuve-et-Labrador
- Historique du statut
- Espèce désignée « en voie de disparition » en novembre 2016.
COSEPAC Résumé
Caribou
Rangifer tarandus
Population migratrice de l’Est
Population des monts Torngat
Description et importance de l’espèce sauvage
Le caribou (Rangifer tarandus) est un cervidé de taille moyenne. Il possède des pattes relativement longues et de gros sabots qui facilitent ses déplacements dans la neige épaisse des milieux nordiques. Le caribou est au cœur de la culture, de la spiritualité et de la subsistance de nombreuses collectivités autochtones du Nord, et est également important pour des non-Autochtones du Canada. Les caribous présentent une grande variabilité sur le plan morphologique, écologique et comportemental à l’échelle de leur aire de répartition circumpolaire. En 2011, le COSEPAC a établi 12 unités désignables (UD) pour le caribou; le présent rapport de situation porte sur la population migratrice de l’Est (population ME; UD 4) et sur la population des monts Torngat (population des MT; UD 10).
Répartition
La population ME comprend quatre sous-populations, soit celle du cap Churchill, située sur le littoral de la baie d’Hudson, à la frontière entre le Manitoba et l’Ontario; celle du sud de la baie d’Hudson, principalement située plus au sud et à l’est, dans le nord de l’Ontario; celle de la rivière aux Feuilles (Leaf River), dans le nord du Québec; et celle de la rivière George, au Québec et au Labrador. La superficie de l’aire de répartition combinée est de plus de 1,5 million de km2. Les caribous des MT forment une seule population et occupent un territoire d’environ 28 000 km2 dans les monts Torngat, dans le nord du Labrador, le nord du Québec et le Nunavut (Killiniq et îles adjacentes).
Habitat
Les caribous migrateurs de l’Est utilisent principalement la toundra durant la période de mise bas et en été, et occupent la taïga et surtout la forêt boréale durant l’hiver. Les caribous des monts Torngat utilisent les zones alpines des plateaux montagneux des monts Torngat et les vallées adjacentes de même que des zones côtières. La mise bas a lieu sur des versants montagneux, dans des îles et sur des plateaux alpins.
Biologie
La longévité du caribou est habituellement de moins de 10 ans chez les mâles et de moins de 15 ans chez les femelles. La majorité des femelles âgées de 3 ans ou plus donnent naissance à un seul petit par année, ce qui fait que le taux de reproduction du caribou est plus faible que celui des autres cervidés d’Amérique du Nord. La primiparité peut survenir à l’âge de 2 ans lorsque les conditions de l’habitat sont favorables. On estime la durée d’une génération à 6 à 7 ans.
Taille et tendances des populations
La taille minimale de la population ME s’élève à 227 513 caribous de tous âges, selon les plus récentes estimations totales établies pour les sous-populations de la rivière aux Feuilles (2016) et de la rivière George (2016) ainsi que les plus récentes estimations minimales établies pour les sous-populations du cap Churchill (2007) et du sud de la baie d’Hudson (2011). Le nombre estimatif de caribous matures est de 170 636. Le nombre de caribous matures de la population ME il y a trois générations (18 – 21 ans) est estimé à 833 774, ce qui donne un déclin de 80 % sur trois générations. Les connaissances traditionnelles autochtones corroborent le déclin de la sous-population de la rivière George.
Il est établi que les sous-populations de l’est de l’aire de répartition de la population ME fluctuent (selon les connaissances traditionnelles autochtones et des données historiques), mais on ignore si les effectifs pourront augmenter de nouveau en raison de la présence de nouvelles menaces. Les caribous appartenant à ces UD sont associés au lichen et à la toundra dominée par les graminées, mais le paysage de la toundra change à cause du réchauffement climatique. Le nombre de caribous de la sous-population de la rivière George (qui constituait, jusqu’à récemment, la plus grande sous-population de caribous migrateurs de l’Est) a diminué, et les menaces qui pèsent sur les sous-populations de la rivière George et de la rivière aux Feuilles sont considérées comme importantes.
Le nombre de caribous de la population des MT a été estimé à environ 5 000 dans les années 1980 et à 930 (dont 698 caribous matures) au printemps 2014, ce qui correspond à une réduction de plus de 80 % en 35 ans environ (approximativement 4 – 5 générations). Les connaissances traditionnelles autochtones corroborent ce déclin. Il n’existe aucune donnée sur les variations de population sur une période de trois générations.
Menaces et facteurs limitatifs
Les caribous sont sensibles aux perturbations. Le développement industriel, et plus particulièrement l’exploitation minière et les réseaux routiers qui y sont associés, représente une menace pour les caribous ME. La récolte excessive de caribous ME et de caribous des MT contribue au déclin des populations. Les populations sont généralement restreintes par la disponibilité de la nourriture, mais la chasse de subsistance et la chasse sportive peuvent constituer un facteur limitatif lorsque les populations sont petites ou en déclin. Un parasite, le Besnoitia tarandi, est apparu dans les sous-populations de l’est de la population ME au milieu des années 2000 et pourrait avoir une incidence sur la productivité du caribou. Les changements climatiques, qui ont des effets sur la qualité de l’habitat et la disponibilité des ressources, semblent également constituer une menace pour les populations de caribous, compte tenu de l’augmentation du couvert arbustif dans la toundra. Selon le calculateur des menaces, l’impact des menaces est considéré comme « très élevé à élevé » pour le caribou ME, et « élevé » pour le caribou des MT.
Protection, statuts et classements
Le COSEPAC a évalué la situation du caribou ME (en voie de disparition) en avril 2017, et la situation du caribou des MT (en voie de disparition) en novembre 2016. En 2016, l’UICN a modifié la cote attribuée à la population mondiale de caribous, la faisant passer de « préoccupation mineure » à « vulnérable ». La cote mondiale attribuée au caribou par NatureServe est G5 (non en péril; dernière mise à jour en 2012), mais aucune cote n’a été établie pour les différentes UD reconnues par le COSEPAC. La cote provisoire accordée en 2015 aux caribous du Labrador (principalement à la sous-population de la rivière George) est S1S2 (gravement en péril à en péril).
Résumé technique – population migratrice de l’Est (unité désignable 4)
- Nom scientifique:
- Rangifer tarandus
- Nom français:
- Caribou – population migratrice de l’Est (unité désignable 4)
- Nom anglais:
- Caribou – Eastern Migratory population (Designatable Unit 4)
- Répartition au Canada:
- Terre-Neuve-et-Labrador, Québec, Ontario, Manitoba
Information démographique
| Sujet | Information |
|---|---|
Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN (2011) est utilisée) Selon un échantillon de femelles reproductrices dont l’âge est connu. |
Fourchette de 6 à 7 ans |
| Y a-t-il un déclin continu observé du nombre total d’individus matures? | Oui |
Pourcentage estimé de déclin continu du nombre total d’individus matures sur deux générations. Des déclins continus sont prévus; déclins de 97 % sur les deux dernières générations et de 59 % sur la dernière génération pour les sous-populations combinées de la rivière aux Feuilles et de la rivière George (renfermant la plus grande partie (99 %) de la population). |
Inconnu |
Pourcentage estimé de réduction du nombre total d’individus matures au cours des trois dernières générations. Déclin principalement dû à une diminution de 99 % sur trois générations de la sous-population de la rivière George, qui était auparavant la plus grande (74 % de la population ME), et à une diminution de 68 % (25 % de la population ME) de la sous-population de la rivière aux Feuilles sur deux générations. |
80 % |
Pourcentage prévu de réduction ou d’augmentation du nombre total d’individus matures au cours des trois prochaines générations (18 – 21 ans). Le pourcentage de réduction est difficile à prévoir en raison de la grande variabilité de la démographie des différentes sous-populations, mais on s’attend à ce que les déclins se poursuivent; le calculateur des menaces prévoit également un déclin continu. |
Inconnu, mais un déclin est prévu |
| Pourcentage de changement du nombre total d’individus matures au cours de toute période de trois générations (18 – 21 ans) commençant dans le passé et se terminant dans le futur. Le nombre total d’individus matures de la population ME a diminué de 97 %, principalement à cause du déclin des sous-populations de la rivière George et de la rivière aux Feuilles qui est survenu au cours des deux dernières générations. Aucune augmentation n’a été confirmée dans l’une ou l’autre des sous-populations au cours de la dernière génération (6 – 7 ans); les déclins n’ont pas été quantifiés, mais devraient se poursuivre à l’avenir, particulièrement dans les sous-populations de l’est. | Inconnu, mais probablement un déclin de plus de 90 % |
Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé? Les populations pourraient se rétablir, car le déclin est probablement enclenché par des facteurs dépendants de la densité, et la récolte excessive favorise ce déclin. Les causes n’ont toutefois pas cessé, et de nouvelles menaces pourraient limiter le rétablissement; le déclin des sous-population de la rivière George et de la rivière aux Feuilles se poursuit. |
Causes possiblement réversibles et comprises, mais n’ayant pas cessé |
Y a-t-il des fluctuations extrêmes (c.-à-d. > 10 ×) du nombre d’individus matures? Les sous-populations de la Rivière aux Feuilles et de la rivière George fluctuent de manière évidente; la sous-population de la rivière George a diminué de 99 % au cours des trois dernières générations, tandis que celle de la rivière aux Feuilles a diminué de 68 % sur deux générations. La présence de nouvelles menaces laisse croire que les populations pourraient ne pas se rétablir à la suite des déclins récents. |
Inconnu |
Information sur la répartition
| Sujet | Information |
|---|---|
| Superficie estimée de la zone d’occurrence Les territoires de certaines sous-populations se chevauchent à certaines saisons; la valeur totale indiquée résulte de la combinaison des aires de répartition. | > 2 millions de km2 Rivière George : 937 395 km2 (maximum depuis le début des années 1990) Rivière aux Feuilles : 663 810 km2 Cap Churchill : 27 192 km2 Sud de la baie d’Hudson : 310 000 km2 Total = 1,5 million de km2 |
Indice de zone d’occupation (IZO) La superficie des aires de mise bas est inconnue. |
Inconnu |
| La population est-elle « gravement fragmentée »? | Non |
Nombre de localités? ) Aucune menace n’a toujours le même impact; les menaces telles que la récolte excessive et le développement sont variables à l’échelle de vastes territoires. |
Nombre élevé |
Y a-t-il un déclin continu observé de la zone d’occurrence? Réduction probable à la limite est, mais le déclin d’environ 85 % de l’aire de répartition de la sous-population de la rivière George depuis 1999 est partiellement compensé par la présence de la sous-population de la rivière aux Feuilles sensiblement dans la même zone pendant une partie de l’année. |
En partie |
Y a-t-il un déclin continu observé de l’indice de zone d’occupation? Le déclin d’environ 85 % de l’aire de répartition de la sous-population de la rivière George depuis 1999 est partiellement compensé par la présence de la sous-population de la rivière aux Feuilles sensiblement dans la même zone pendant une partie de l’année. |
En partie |
| Y a-t-il un déclin continu observé du nombre de sous-populations? Quatre sous-populations sont reconnues et subsistent, mais la persistance de la sous-population de la rivière George est moins évidente. | Non |
Y a-t-il un déclin continu observé du nombre de localités? L’aire de répartition de la sous-population de la rivière George a diminué de 70 %, ce qui comprendrait un nombre inconnu de localités. |
Oui |
Y a-t-il un déclin continu observé de l’étendue et/ou de la qualité de l’habitat? Les effets des changements climatiques sont de plus en plus manifestes dans la toundra; leur impact en termes quantitatifs sur les populations est mal connu. |
Oui |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme.? |
Inconnu |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? La zone d’occupation de la sous-population de la rivière George a diminué de 70 % depuis 1999, mais on ignore s’il s’agit d’une simple fluctuation; la population ne pourra peut-être pas se rétablir à cause de la récolte excessive et de la modification de l’habitat. |
Possiblement |
Nombre d’individus matures dans chaque sous-population
| Sujet | Information |
|---|---|
| Sous-populations (utilisez une fourchette plausible) Le nombre d’individus matures est fondé sur une proportion de 75 % de la taille estimative de la population en 2016 (ou pour l’année la plus proche), ce qui exclut les individus de 2 ans ou moins. | Nombre d’individus matures |
| Rivière George | 6 704 |
| Rivière aux Feuilles | 149 250 |
| Sud de la baie d’Hudson | 12 479 |
| Cap Churchill | 2 203 |
| Total | 170 636 |
Analyse quantitative
| Sujet | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins 20 % sur 5 générations (30 ans). L’analyse de la viabilité de la population n’a pas été effectuée pour les sous-populations de l’UD. | S.O. |
Menaces (directes, de l’impact le plus élevé à l’impact le plus faible, selon le calculateur des menaces de l’UICN)
| Sujet | Information |
|---|---|
| L’impact global des menaces est considéré comme « très élevé à élevé » compte tenu des préoccupations concernant les projets d’exploitation minière et d’aménagement de routes dans l’aire de répartition des sous-populations de l’est, la récolte excessive de l’espèce, l’augmentation des incendies et la diminution prévue de la qualité de l’habitat de toundra associée aux changements climatiques. | Le principal facteur limitatif est la disponibilité de nourriture en été. |
Immigration de source externe (immigration de l’extérieur du Canada)
| Sujet | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada | S.O.; cette UD n’est présente qu’au Canada |
| Une immigration a-t-elle été constatée ou est-elle possible? | S.O. |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | S.O. |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | S.O. |
| Les conditions se détériorent-elles au Canada Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe)? |
En partie |
| Les conditions de la population source se détériorent-elles? Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe) |
S.O. |
| La population canadienne est-elle considérée comme un puits? Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe) |
Non |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | S.O. |
Nature délicate de l’information sur l’espèce
| Sujet | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Historique du statut
| Sujet | Information |
|---|---|
| COSEPAC : | Espèce désignée « en voie de disparition » en avril 2017. |
Statut et justification de la désignation
| Sujet | Information |
|---|---|
| Statut | En voie de disparition |
| Code alphanumérique | A2acd+4acd |
| Justification de la désignation | La population migratrice de caribou est composée de quatre sous-populations présentes depuis les côtes de l’ouest de la baie d’Hudson jusqu’au Labrador. La population est actuellement estimée à 170 636 individus matures, estimation qui révèle un déclin global de 80 % des effectifs sur 3 générations (18-21 ans). Le déclin devrait se poursuivre à cause de la surexploitation et d’une diminution de la qualité de l’habitat associée aux changements climatiques et aux activités de développement. Deux sous-populations en déclin renferment environ 99 % de la population migratrice de l’Est : celle de la rivière George a connu un déclin de 99 % sur 3 générations et celle de la rivière Leaf, un déclin de 68 % sur 2 générations. La taille des populations migratrices de caribou fluctue, mais l’on craint que les menaces récentes et prévues limitent la croissance d’une population qui est actuellement à son niveau le plus bas enregistré. Les menaces semblent être moins courantes dans les deux sous-populations de l’ouest, lesquelles représentent environ seulement 4 % de la population totale existante. La plupart des autres caribous font partie de la sous-population de la rivière Leaf, qui continue de connaître un déclin. |
Applicabilité des critères
| Sujet | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) | Correspond au critère de la catégorie « en voie de disparition », sous A2acd+4acd, en raison d’un déclin de 80 % sur trois générations (d’après des relevés aériens et des données de récolte et compte tenu de la modification de la qualité de l’habitat). On prévoit un déclin continu. |
| Critère B (petite aire de répartition, et déclin ou fluctuation) | Non applicable. La superficie de l’aire de répartition dépasse les seuils établis. |
| Critère C (nombre d’individus matures peu élevé et en déclin) | Non applicable. La taille de la population dépasse les seuils établis. |
| Critère D (très petite population totale ou répartition restreinte) | Non applicable. La taille de la population dépasse les seuils établis. |
| Critère E (analyse quantitative) | Non applicable. L’analyse de la viabilité de la population n’a pas été effectuée. |
Résumé technique - population des monts Torngat (unité désignable 10)
- Nom scientifique:
- Rangifer tarandus
- Nom français:
- Caribou – population des monts Torngat (unité désignable 10)
- Nom anglais:
- Caribou – Torngat Mountains population (Designatable Unit 10)
- Répartition au Canada:
- Terre-Neuve-et-Labrador, Québec, Nunavut
Information démographique
| Sujet | Information |
|---|---|
Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN (2011) est utilisée) Selon un échantillon de femelles reproductrices de la population migratrice de l’Est dont l’âge est connu. |
Fourchette de 6 à 7 ans |
Y a-t-il un déclin continu observé du nombre total d’individus matures? Nombre de caribous estimé à environ 5 000 (de tous âges) en 1980 et à 930 (698 caribous matures) en 2014. Taux de mortalité des adultes munis d’un collier émetteur radio d’environ 40 % en 2011-2013 (n = 35). |
Oui |
Pourcentage estimé de déclin continu du nombre total d’individus matures sur deux générations. Des déclins continus sont prévus, compte tenu des données démographiques et des menaces. |
Inconnu, mais un déclin est prévu |
Pourcentage estimé de réduction du nombre total d’individus matures au cours des trois dernières générations. Le déclin survenu de 1980 à 2014 est d’environ 81 %; cette période de 34 ans correspond à environ 4 à 5 générations (3 générations = 18 à 21 ans). |
Inconnu, mais le déclin est évident |
| Pourcentage prévu de réduction ou d’augmentation du nombre total d’individus matures au cours des trois prochaines générations (18 – 21 ans). | Inconnu, mais on ne prévoit pas d’augmentation |
Pourcentage de changement du nombre total d’individus matures au cours de toute période de trois générations (18 – 21 ans) commençant dans le passé et se terminant dans le futur. Le déclin est évident mais difficile à quantifier, car les estimations sont limitées pour les périodes correspondant à un certain nombre de générations; on prévoit un déclin futur, mais il est difficile à quantifier. |
Inconnu, mais le déclin est évident; des augmentations sont peu probables |
Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé? Certaines causes sont comprises, mais n’ont pas cessé; les taux de mortalité ne semblent pas soutenables, et les effets des changements climatiques continuent de se faire sentir. |
En partie |
Y a-t-il des fluctuations extrêmes (c.-à-d. > 10 ×) du nombre d’individus matures? Ce nombre est environ 5 fois moindre sur une période de 35 ans, mais on ne dispose que de deux estimations des effectifs. |
Inconnu |
Information sur la répartition
| Sujet | Information |
|---|---|
| Superficie estimée de la zone d’occurrence La zone d’occupation est considérée comme la zone d’occurrence en raison de l’usage intensif qui est fait du territoire. | 28 000 km2 |
Indice de zone d’occupation (IZO) La superficie de l’aire de mise bas est inconnue. |
Inconnu |
| La population est-elle « gravement fragmentée »? La population est constituée d’une seule sous-population. | Non |
Nombre de localités? ) Les menaces telles que la récolte excessive et le développement sont variables à l’échelle de vastes territoires. |
Nombre élevé |
| Y a-t-il un déclin observé de la zone d’occurrence? L’aire de répartition s’est rétrécie vers le nord, probablement de moins de 20 %. | Oui |
Y a-t-il un déclin continu observé de l’indice de zone d’occupation? La superficie de l’aire de mise bas est inconnue, mais le déclin général de la population laisse croire à une perte de localités. |
Déclin non observé, mais prévu |
Y a-t-il un déclin continu observé du nombre de sous-populations? Il n’y a qu’une seule sous-population. |
Non |
Y a-t-il un déclin continu observé du nombre de localités? On ignore ce qu’il est advenu de chacune des localités, mais le déclin général de la population laisse croire à une perte de localités. |
Déclin non observé, mais prévu |
Y a-t-il un déclin continu observé de l’étendue et/ou de la qualité de l’habitat? Les effets des changements climatiques sont de plus en plus manifestes dans la toundra; leur impact est mal connu. |
Oui |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme. ? |
Inconnu |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Inconnu |
Nombre d’individus matures dans chaque sous-population
| Sujet | Information |
|---|---|
| Sous-populations (utilisez une fourchette plausible) | Nombre d’individus matures |
| Monts Torngat Le nombre d’individus matures est fondé sur une proportion de 75 % de la taille estimative de la population en 2014 (930), ce qui exclut les individus de 2 ans ou moins. | 698 |
| Total | 698 |
Analyse quantitative
| Sujet | Information |
|---|---|
La probabilité de disparition de l’espèce à l’état sauvage est d’au moins 20 % sur 5 générations (30 ans). L’analyse de la viabilité de la population n’a pas été effectuée. |
Inconnu |
Menaces (directes, de l’impact le plus élevé à l’impact le plus faible, selon le calculateur des menaces de l’UICN)
| Sujet | Information |
|---|---|
| L’impact global des menaces est considéré comme « élevé » compte tenu des préoccupations concernant la récolte excessive de l’espèce et la diminution prévue de la qualité de l’habitat de toundra associée aux changements climatiques. | Le principal facteur limitatif serait la disponibilité de nourriture en été. |
Immigration de source externe (immigration de l’extérieur du Canada)
| Sujet | Information |
|---|---|
| Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada | Cette UD n’est présente qu’au Canada |
| Une immigration a-t-elle été constatée ou est-elle possible? | S.O. |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | S.O. |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | S.O. |
| Les conditions se détériorent-elles au Canada Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe)? |
En partie |
| Les conditions de la population source se détériorent-elles? Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe) |
S.O. |
| La population canadienne est-elle considérée comme un puits? Voir le tableau 3 (Lignes directrices pour la modification de l’évaluation de la situation d’après une immigration de source externe) |
S.O. |
| La possibilité d’une immigration depuis des populations externes existe-t-elle? | S.O. |
Nature délicate de l’information sur l’espèce
| Sujet | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
Statut
| Sujet | Information |
|---|---|
| COSEPAC | Espèce désignée « en voie de disparition » en novembre 2016. |
Historique du statut
| Sujet | Information |
|---|---|
| Statut | En voie de disparition |
| Code alphanumérique | C2a(ii) |
| Justification de la désignation | Cette population est limitée à la péninsule d’Ungava dans l’est du Québec, dans le nord du Labrador et au Nunavut (Killiniq et les îles adjacentes). Aucune tendance quantitative n’est disponible car les données de relevés sont limitées, mais la population totale a été estimée à 5 000 individus en 1980 et à 930 individus en 2014, ce qui semble indiquer un déclin significatif. Les connaissances traditionnelles autochtones indiquent également un déclin. La population correspond au statut d’espèce « en voie de disparition » car une seule population compte l’ensemble des 698 animaux matures estimés, un déclin de la population est évident et devrait se poursuivre en raison des taux de récolte et d’une diminution de la qualité de l’habitat associée aux changements climatiques. La population pourrait faire face à une disparition imminente en raison du faible nombre d’individus restants. |
Applicabilité des critères
| Sujet | Information | |
|---|---|---|
| Critère A (déclin du nombre total d’individus matures) | Non applicable. On note un déclin de 80 % de la population sur 4 à 5 générations, mais le taux de déclin n’est pas connu pour des périodes plus courtes. | |
| Critère B (petite aire de répartition, et déclin ou fluctuation) | Non applicable. La superficie de l’aire de répartition dépasse les seuils établis. | |
| Critère C (nombre d’individus matures peu élevé et en déclin) | Correspond au critère de la catégorie « espèces en voie de disparition », sous C2a(ii); la population d’individus matures se trouve dans une seule population, estimée à 698 caribous. | cellule vide |
| Critère D (très petite population totale ou répartition restreinte) | Correspond au critère de la catégorie « espèces menacées », sous D1; < 1 000 individus matures. | |
| Critère E (analyse quantitative) | Non applicable. L’analyse de la viabilité de la population n’a pas été effectuée. |
Préface
Six « populations importantes à l’échelle nationale » de caribous des bois ont été identifiées par le COSEPAC en 2002 et sont inscrites à la LEP (Loi sur les espèces en péril) : la population des montagnes du Nord (préoccupante), la population des montagnes du Sud (menacée), la population boréale (menacée), la population de la toundra forestière (non évaluée), la population de la Gaspésie – Atlantique (en voie de disparition) et la population insulaire de Terre-Neuve (préoccupante; 2014) (COSEWIC, 2002). En 2011, le COSEPAC a adopté une structure d’unités désignables pour tous caribous du Canada (COSEWIC, 2011); la population migratrice de l’Est (UD 4) et la population des monts Torngat (UD 10) sont évaluées pour la première fois dans le cadre du présent rapport.
Le COSEPAC remercie Steeve D. Côté et Marco Festa-Bianchet d’avoir rédigé le rapport de situation provisoire, aux termes d’un marché conclu avec Environnement et Changement climatique Canada. La participation de l’entrepreneur à la préparation du rapport de situation a pris fin avec l’adoption du rapport provisoire. Les modifications apportées au rapport de situation l’ont été sous la supervision Graham Forbes, coprésident du Sous-comité de spécialistes des mammifères terrestres du COSEPAC, compte tenu des commentaires formulés par les administrations concernées, les experts externes ainsi que les membres du Sous-comité et les membres du COSEPAC.
Historique du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Mandat du COSEPAC
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Composition du COSEPAC
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Définitions (2016)
- Espèce sauvage
- Espèce, sous-espèce, variété ou population géographiquement ou génétiquement distincte d’animal, de plante ou d’un autre organisme d’origine sauvage (sauf une bactérie ou un virus) qui est soit indigène du Canada ou qui s’est propagée au Canada sans intervention humaine et y est présente depuis au moins cinquante ans.
- Disparue (D)
- Espèce sauvage qui n’existe plus.
- Disparue du pays (DP)
- Espèce sauvage qui n’existe plus à l’état sauvage au Canada, mais qui est présente ailleurs.
-
En voie de disparition (VD)
(Remarque : Appelée « espèce disparue du Canada » jusqu’en 2003.) - Espèce sauvage exposée à une disparition de la planète ou à une disparition du pays imminente.
- Menacée (M)
- Espèce sauvage susceptible de devenir en voie de disparition si les facteurs limitants ne sont pas renversés.
-
Préoccupante (P)
(Remarque : Appelée « espèce en danger de disparition » jusqu’en 2000.) - Espèce sauvage qui peut devenir une espèce menacée ou en voie de disparition en raison de l'effet cumulatif de ses caractéristiques biologiques et des menaces reconnues qui pèsent sur elle.
-
Non en péril (NEP)
(Remarque : Appelée « espèce rare » jusqu’en 1990, puis « espèce vulnérable » de 1990 à 1999.) - Espèce sauvage qui a été évaluée et jugée comme ne risquant pas de disparaître étant donné les circonstances actuelles.
-
Données insuffisantes (DI)
(Remarque :Autrefois « aucune catégorie » ou « aucune désignation nécessaire ».) - Une catégorie qui s’applique lorsque l’information disponible est insuffisante (a) pour déterminer l’admissibilité d’une espèce à l’évaluation ou (b) pour permettre une évaluation du risque de disparition de l’espèce.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement et Changement climatique Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Description et importance de l’espèce sauvage
Nom et classification
Classe : Mammifères
Ordre : Artiodactyles
Famille : Cervidés
Nom scientifique : Rangifer tarandus (Linnaeus 1758)
Noms communs : caribou (français et anglais); Minunasawa atikw (innu-aimun); Ahtik/Atik (cri); Tuttu (inuktitut) (voir COSEWIC, 2012, pour les appellations autochtones).
Le caribou a une importance particulière sur le plan social, culturel et économique dans de nombreuses cultures autochtones (p. ex. Gordon, 2003, 2005; Polfus et al., 2016) et possède un nom dans de nombreuses langues. Le COSEPAC (COSEWIC, 2012) tient à jour une liste exhaustive des appellations du caribou autorisées à l’issue d’exercices de collecte de connaissances traditionnelles autochtones (CTA). Le terme « renne » est couramment utilisé en Eurasie. Des rennes ont été introduits dans certaines régions de l’Alaska, des Territoires du Nord-Ouest, de Terre-Neuve et des îles Belcher (Røed et al.,sous presse). Le présent rapport porte uniquement sur les caribous non introduits.
Les appellations taxinomiques utilisées pour désigner les caribous vivant dans les régions autres que l’Arctique prêtent à confusion, car des termes similaires (p. ex. caribou des bois, caribou boréal et caribou forestier) ont été utilisés de façon interchangeable pour décrire des écotypes et des sous-espèces. Le présent rapport respecte la structure des unités désignables (UD) établie par le COSEPAC (COSEWIC, 2011), laquelle comporte 12 UD (une disparue) du caribou au Canada. La détermination des UD est fondée sur cinq sources d’information : (1) la phylogénétique; (2) la diversité et la structure génétiques; (3) la morphologie; (4) les déplacements, le comportement et les stratégies du cycle vital et (5) la répartition (COSEWIC, 2011). Les différences morphologiques, comportementales et génétiques qui existent parmi les populations de caribous ont été attribuées aux grands processus spatio-temporels associés aux avancées glaciaires, aux refuges et à la recolonisation. Les déplacements de territoires liés au climat durant le Pléistocène ont modifié la répartition des Rangifer après la dernière glaciation (Grayson et Delpeche, 2005; Sommer et al., 2011; Yannic et al., 2014). Røed et al. (1991) ont conclu que le caribou avait recolonisé l’Amérique du Nord et l’Eurasie à partir d’au moins deux grands refuges : l’un au nord de l’inlandsis de Béringie-Eurasie, et l’autre au sud de l’inlandsis nord-américain (Yannic et al., 2014). L’expansion postglaciaire du caribou depuis la région située au sud de l’inlandsis nord-américain remonte probablement à 14 000 à 22 000 ans et se serait produite à partir de trois refuges différents : les montagnes Rocheuses, l’est du Mississippi et les Appalaches (Klütsch et al., 2012). Ces refuges correspondent à des lignées génotypiques distinctes qui ont divergé avant le dernier maximum glaciaire (il y a 38 000 à 48 000 ans).
Le présent rapport porte sur l’évaluation de la situation de deux UD : la population migratrice de l’Est (population ME) et la population des monts Torngat (population des MT) (Figure 1). La population ME est définie en fonction de son caractère distinct sur le plan comportemental et génétique, étant le seul groupe de caribous migrateurs principalement issu de la lignée d’Amérique du Nord (COSEWIC, 2011). La population des MT est considérée comme une UD en raison de ses caractères morphologiques distincts, mais surtout de ses tendances en matière de comportement; ses déplacements ressemblent à ceux des autres caribous « montagnards » de l’ouest du Canada (UD 7 et 8), notamment en ce qui a trait aux migrations saisonnières en altitude vers des territoires distincts et à la dispersion des femelles (plutôt qu’à leur rassemblement) durant la période de mise bas (COSEWIC, 2011).

Description longue de la figure 1
Carte illustrant la répartition approximative de la population de caribous des monts Torngat et des quatre sous-populations de caribous migrateurs de l’Est. Les zones où les aires des populations se chevauchent sont indiquées. La population des monts Torngat est confinée à la pointe nord de la péninsule bordée par la baie d’Ungava et la mer du Labrador, qui est partagée entre le Québec, Terre-Neuve-et-Labrador et le Nunavut. Les caribous migrateurs de l’Est occupent un territoire allant de la frontière du Manitoba et de l’Ontario jusqu’au Labrador, à l’exception d’une zone située le long du littoral ouest de la baie James.

Description longue de la figure 2
Deux cartes illustrant la répartition des caribous migrateurs de l’Est de la sous-population de la rivière George à la fin des années 1990 (carte a) et durant la période 2010 2014 (carte b), d’après des données d’émetteurs satellites. Les cartes montrent que l’aire de répartition a connu une contraction d’environ 85 pour cent.
Bien qu’il existe un certain flux génétique entre les UD adjacentes (p. ex. Boulet et al., 2007; Yannic et al., 2016), des analyses génétiques récentes ont corroboré les UD établies. Klutsch et al. (2016) ont analysé 10 locus microsatellites chez plus de 1 300 caribous du nord de l’Ontario et du nord-est du Manitoba. Ils ont conclu que l’écotype migrateur (ME; UD 4) était issu d’une introgression génétique du caribou de la toundra durant le Pléistocène tardif (il y a environ 14 000 ans) et d’une différenciation subséquente survenue au cours de l’Holocène, après le retrait des glaciers (il y a environ 7 000 ans) et le retour de la végétation. Par ailleurs, des analyses génétiques portant sur 16 locus microsatellites, réalisées sur 560 caribous du Québec et du Labrador, ont montré que la population ME et la population des MT provenaient de la même lignée d’Amérique du Nord, mais présentaient suffisamment de différences pour être considérées comme des unités désignables distinctes (Yannic et al., 2014, 2016).
Description morphologique
Les caribous présentent une grande variabilité sur le plan morphologique, écologique et comportemental à l’échelle de leur aire de répartition (Geist, 1998; Couturier et al., 2010). Le caribou est un cervidé de taille moyenne qui possède des pattes relativement longues, des sabots en forme de croissant ainsi qu’un museau large aux grands naseaux. Les sabots, très gros et souvent plus larges que longs, aident les caribous à se déplacer dans la neige épaisse et molle, à creuser dans la neige croûteuse à la recherche de nourriture et à nager. La couleur du pelage varie selon les saisons et d’une UD à l’autre. De façon générale, les caribous ME sont presque blancs en hiver et sont brun clair à brun moyen en été. Le pelage des caribous des MT est de coureur similaire.
La morphologie des bois varie selon l’écotype, le sexe, l’âge et la saison au sein de la population ME (Thompson et Abraham, 1994; Abraham et Thompson, 1998; Pond et al., 2016). Le poids et la taille des bois varient en fonction du milieu et des conditions nutritionnelles (Bergerud et al., 2008). Par exemple, les dénombrements avec classification effectués entre 2000 et 2012 ont révélé que 15 % à 20 % des femelles adultes de la sous-population de la rivière aux Feuilles n’avaient pas de bois; la proportion de femelles dépourvues de bois dans la sous-population de la rivière George au cours de cette période a baissé, passant d’environ 12 % à moins de 5 %, possiblement en raison d’une amélioration de l’état physique liée à la diminution de la densité de caribous (Caribou Ungava, données inédites).
Structure spatiale et variabilité de la population
Le COSEPAC utilise le terme « sous-population » pour désigner les populations au sein de l’aire de répartition d’une espèce ou d’une UD. Dans les publications scientifiques sur le caribou, les termes « troupeau », « harde », « aire de répartition » et « population locale » sont souvent utilisés pour désigner les groupes de niveau inférieur à l’UD. Il peut être difficile de délimiter ces « sous-unités » (Environment Canada, 2011; Nagy, 2011). L’UD des caribous ME comprend actuellement quatre sous-populations, soit celle du cap Churchill, dans la zone côtière à la frontière entre le Manitoba et l’Ontario; celle du sud de la baie d’Hudson (auparavant nommée la sous-population des îles Pen, le troupeau des basses terres côtières de la baie d’Hudson ou le caribou migrateur du sud de la baie d’Hudson; Abraham, comm. pers., 2016), située le long du littoral à la frontière entre le Manitoba et l’Ontario, mais s’étendant vers le sud-est jusqu’au cap Henrietta Maria; celle de la rivière aux Feuilles (Leaf River), dans le nord du Québec; et celle de la rivière George, au Québec et au Labrador.
La reconnaissance de ces sous-populations repose sur leur démographie et leur répartition, mais aussi sur le fait qu’elles présentent des différences considérées comme suffisantes sur le plan génétique (Kutsch et al., 2012, 2016; Yannic et al., 2016). Les différences existant entre ces sous-populations ne sont toutefois pas suffisamment importantes pour justifier l’établissement d’UD différentes (COSEWIC, 2011). Le Conseil de gestion des ressources fauniques de la région marine d’Eeyou croit que les sous-populations de la rivière aux Feuilles et de la rivière George devraient faire l’objet de rapports de situation distincts, arguant que les menaces qui pèsent sur elles sont différentes et que le fait de les combiner risque d’amoindrir leur importance (Pachano, comm. pers., 2016). Il est à noter que le COSEPAC n’utilise pas comme critères les menaces ou les unités de gestion pour délimiter les UD. Les menaces sont cependant analysées séparément pour chaque sous-population.
Les sous-populations de caribous migrateurs étaient auparavant définies en fonction de l’emplacement des aires de mise bas. Cet emplacement peut cependant varier de façon considérable au fil du temps (Williamson, 1997; Taillon et al., 2012a). Bien que la fidélité aux aires de mise bas soit généralement très grande au sein d’une sous-population, les individus peuvent changer d’aire de mise bas, comme en témoignent les rares échanges observés entre les sous-populations de la rivière George et de la rivière aux Feuilles durant une période de forte abondance (Boulet et al., 2007). Ces deux hardes font toutefois l’objet d’un suivi rigoureux, et rien n’indique qu’il y ait des échanges, selon les données recueillies sur les femelles munies d’un collier émetteur radio depuis 2008 (MFFP, données inédites; Moores, comm. pers., 2016). De plus, les caribous qui utilisent une aire de mise bas en particulier ont généralement tendance à utiliser une aire d’hivernage qui lui est associée. Cependant, comme on l’a constaté pour la sous-population de la rivière George depuis 2015 (Government of Newfoundland and Labrador, données inédites), l’emplacement et la superficie des aires d’hivernage peuvent varier avec le temps, notamment en réponse aux changements touchant la taille de la sous-population, les conditions climatiques et la disponibilité de la nourriture (Le Corre et al., 2014, données inédites).
On ne dispose d’aucune donnée sur la structure de la population dans le cas de la population des MT.
Importance de l’espèce
Le caribou fait partie intégrante de l’écologie, de l’économie et de la culture d’une grande partie du nord du Canada (Festa-Bianchet et al., 2011). Le caribou est le grand mammifère le plus abondant dans la majeure partie de son aire de répartition et fournit de la nourriture, des outils et des vêtements aux humains depuis des milliers d’années (Gordon, 2003, 2005). Ce mammifère continue de jouer un rôle essentiel sur le plan de la cohésion sociale et est à l’origine de nombreuses légendes et pratiques spirituelles qui dépeignent les liens solides existant entre le caribou et les peuples autochtones (Hummel et Ray, 2008; Vors et Boyce, 2009). Tant les caribous ME que les caribous des MT sont chassés à des fins de subsistance, et certaines sous-populations font l’objet d’une chasse sportive (récolte par des non-Autochtones). Ces deux types de chasse ont d’importantes retombées économiques (Wells et al., 2011). Le déclin des sous-populations de caribous dans plusieurs régions de l’Arctique a de graves répercussions sur les collectivités du Nord, surtout sur le plan de la sécurité alimentaire.
Répartition
Aire de répartition mondiale
Les Rangifer ont une vaste répartition circumpolaire dans les biomes boréaux, subarctiques et arctiques. On trouve la plupart des populations de rennes en Norvège, en Suède, en Finlande et en Russie. Le caribou, quant à lui, occupe de grandes parties du nord du Canada, du Groenland et de l’Alaska (Røed et al., sous presse). Les caribous ME et des MT se trouvent tous au Canada.
Aire de répartition canadienne
Population migratrice de l’est
Les quatre sous-populations de l’UD des caribous migrateurs de l’Est occupent un territoire allant de la frontière du Manitoba et de l’Ontario (sous-population du cap Churchill) jusqu’au Labrador (sous-population de la rivière George), à l’exception d’une zone située le long du littoral ouest de la baie James (Figure 1). Les territoires des sous-populations de la rivière George et de la rivière aux Feuilles, dans la partie est de l’aire de répartition, se chevauchaient durant une partie de l’année jusqu’à récemment (Government of Newfoundland and Labrador, données inédites), tout comme les territoires des sous-populations du cap Churchill et du sud de la baie d’Hudson, à l’ouest, mais aucun contact n’a été noté entre les sous-populations de l’est et de l’ouest (MFFP, données inédites). L’aire de répartition des sous-population du sud de la baie d’Hudson, de la rivière aux Feuilles et de la rivière George chevauche partiellement celle des « caribous sédentaires » (c.-à-d. du caribou des bois / caribou boréal non migrateur [UD 6]) durant l’hiver (COSEWIC, 2011; Rudolph et al., 2012; Pond et al., 2016; données inédites de Caribou Ungava et du gouvernement de Terre-Neuve-et-Labrador). Le territoire de la sous-population du cap Churchill, dans le nord de l’aire de répartition de l’UD des caribous ME en Ontario et au Manitoba, chevauche celui de la sous-population de Qamanirjuaq de l’UD 3 durant l’hiver (COSEWIC, 2011). L’aire de répartition récente de la sous-population de la rivière George se trouve principalement au Labrador et chevauche partiellement celle de la population des monts Torngat durant une partie de l’année (Figure 1).
Population des monts torngat
La sous-population des MT est confinée à la pointe nord de la péninsule bordée par la baie d’Ungava et la mer du Labrador (ci-après appelée la péninsule du Québec-Labrador), qui est partagée entre le Québec, Terre-Neuve-et-Labrador et le Nunavut (Killiniq et îles adjacentes) (Figure 1).
Zone d’occurrence et zone d’occupation
La zone d’occurrence de la population ME est très grande (> 2 millions de km2) et s’étend depuis le Labrador jusqu’à la côte ouest de la baie d’Hudson (Figure 1). La zone d’occupation comprend les aires de répartition des quatre sous-populations, dont certaines se chevauchent durant une partie de l’année. Les aires de mise bas pourraient être considérées comme la superficie minimale essentielle à la survie du caribou, mais leur superficie n’est pas connue, sauf pour la sous-population de la rivière George (Figure 2). De plus, l’emplacement des aires de mise bas n’est pas fixe et varie au fil du temps dans la zone d’occupation (c’est le cas, par exemple, pour la sous-population de la rivière George; Williamson, 1997; Taillon et al., 2012a; Figure 2).
L’ensemble de l’aire de répartition de chaque sous-population est considéré comme sa zone d’occupation, car il y a probablement très peu d’espace inutilisé à l’intérieur de ces aires. Les caribous sont très mobiles et occupent des territoires différents selon les saisons. Dans la sous-population du sud de la baie d’Hudson, une certaine proportion de la harde peut se trouver dans chaque territoire saisonnier, peu importe la saison (Pond et al., 2016), ce qui donne à penser qu’une grande partie de la zone d’occupation est utilisée, même lorsque des individus se trouvent ailleurs pour la mise bas. La zone d’occupation de l’UD des caribous ME est supérieure à 1,5 million de km2. La zone d’occupation de chacune des sous-populations est la suivante : rivière George (937 395 km2; maximum depuis les années 1990); rivière aux Feuilles (663 810 km2); cap Churchill (27 192 km2); sud de la baie d’Hudson (310 000 km2). La zone d’occupation totale est inférieure à la somme des zones d’occupation des sous-populations, car les sous-populations se chevauchent en partie (Figure 1). Ces estimations sont fondées sur les tendances d’utilisation de l’espace établies d’après les données sur les caribous suivis par satellite ou VHF (Abraham et al., 2012; Berglund et al., 2014; Pond et al., 2016; Caribou Ungava, données inédites).
L’utilisation relative de l’espace à l’intérieur d’une zone d’occupation change avec le temps. Dans la sous-population du sud de la baie d’Hudson, le territoire utilisé après la mise s’est déplacé de 500 km vers l’est depuis les années 1980, mais surtout durant les années 2000 (Abraham et al., 2012; Berglund et al., 2014; Newton et al., 2015; Pond et al., 2016).
La zone d’occupation de la sous-population de la rivière George a diminué d’environ 85 % entre les années 1990 et l’année 2010, avec le déclin de la population (Figure 3). La zone d’occupation de la sous-population de la rivière aux Feuilles a diminué, mais ce déclin n’a pas été quantifié. L’aire de répartition de la sous-population du sud de la baie d’Hudson a augmenté d’environ 30 % dans les années 1990. Aucun changement touchant la zone d’occupation n’a été noté pour la sous-population du cap Churchill. La variation globale de la zone d’occupation de l’UD des caribous ME est difficile à mesurer, car des portions de la sous-population de la rivière aux Feuilles subsistent dans des zones délaissées par la sous-population de la rivière George.
Dans le cas de la population des monts Torngat, la zone d’occurrence et la zone d’occupation s’établissent à 28 000 km2, selon les tendances d’utilisation de l’espace des caribous suivis par satellite depuis 2011. D’après les CTA et les données de télémétrie satellitaire, les caribous des MT n’occupent plus la région s’étendant de la baie Okak jusqu’à Hebron, au nord, depuis quelques années (Figure 4; Parks Canada Agency, 2008; Wilson et al., 2014). Les aires de mise bas et les autres territoires occupés de manière saisonnière n’ont pas été délimités, mais aucun changement concernant les aires de mise bas utilisées par les caribous des MT n’a été noté.

Description longue de la figure 3
Série de cartes montrant l’emplacement des aires de mise bas des caribous migrateurs de l’Est de la sous-population de la rivière George pour presque chaque année durant la période 1974-2010. Le centroïde de chaque aire de mise bas annuelle ainsi que l’emplacement de l’habitat faunique légal sont indiqués.

Description longue de la figure 4
Carte montrant l’aire de répartition estimée de la sous population de caribous des monts Torngat de 2011 à 2015, d’après des données d’émetteurs satellites.
Activités de recherche
L’analyse des activités de recherche est présentée à la section Taille et tendances des populations, car les données sur la répartition et la démographie sont dérivées d’une méthode commune utilisée pour les relevés aériens et/ou les activités de capture et d’étude télémétrique.
Habitat
Dans le présent rapport, l’habitat comprend les structures végétales (p. ex. la taïga) et les facteurs qui ont une incidence sur la survie et la productivité de l’espèce (p. ex. les taux de prédation). Il existe une forte concordance entre les CTA et la science occidentale en ce qui concerne les facteurs qui font partie de l’habitat principal du caribou.
Besoins en matière d’habitat
Utilisation de l’habitat
La question de la sélection de l’habitat à grande échelle est abordée dans la section Déplacements et dispersion.
Population migratrice de l’est
Les CTA indiquent que les femelles se rendent souvent sur des versants, des plateaux montagneux ou des îles pour mettre bas, probablement pour éviter les perturbations liées aux prédateurs et aux humains (Wilson et al., 2014). L'aire d’estivage et l’aire de mise bas sont principalement associées à l’utilisation d’une variété de complexes de tourbières et à l’évitement des riches marécages à conifères (thuya occidental [Thuja occidentalis], mélèze laricin [Larix laricina]), des zones comportant une grande densité de chicots, des grandes tourbières minérotrophes (> 200 km2) et des grands arbustes abondants tels que les saules (Salix spp.) (Berglund et al., 2014). En été, les caribous exploitent les milieux riches en graminoïdes et en arbustes décidus, et certaines femelles se déplacent vers les plateaux en altitude pour mettre bas (Crête et al., 1990; Manseau et al., 1996). La sélection d’aires d’alimentation riches en lichen pourrait être un facteur important concernant la répartition du caribou dans la forêt boréale, particulièrement durant l’hiver, lorsque le lichen peut être le seul aliment disponible (Mayor et al., 2009). Les lichens terricoles contiennent peu de protéines, mais constituent une source importante de glucides en hiver (Schaefer et Pruitt, 1991; Côté, 1998). La sous-population de caribous de la rivière George a également tendance à utiliser les landes élevées balayées par le vent, la neige y étant moins épaisse que dans les zones forestières de plus faible altitude (Pisapio, comm. pers., 2016). Les caribous peuvent creuser la neige pour atteindre les lichens terricoles ou se nourrir des lichens arboricoles qui se trouvent sur les vieux arbres (Williamson, 1997). La neige est généralement moins épaisse et moins croûteuse dans les forêts de conifères matures et âgées que dans les forêts claires; les caribous utilisent ces forêts de conifères pour accéder au lichen et se mettre à l’abri des rigueurs de l’hiver (Mosnier et al., 2003; Ferguson et Elkie, 2004; Mayor et al., 2009). Dans la sous-population du sud de la baie d’Hudson, l’utilisation des aires d’hivernage est liée aux conditions du sol et du couvert forestier qui assurent une abondance de lichens terricoles (espèces de Cladina et de Cladonia) (OMNRF, 2014a), et est souvent associée à des complexes de tourbières comprenant des tourbières minérotrophes, des tourbières ombrotrophes et des forêts claires de conifères bas (Berglund et al., 2014).
Population des monts torngat
Selon les CTA, les caribous des MT passent la plus grande partie de l’année dans un habitat dépourvu d’arbres (Wilson et al., 2014), mais entreprennent annuellement une migration altitudinale, utilisant les zones de toundra alpine en été et les vallées ainsi que les zones à plus basse altitude en hiver (Wilson et al., 2014; Caribou Ungava, données inédites). On possède peu de renseignements supplémentaires sur l’utilisation de l’habitat par les caribous de la sous-population des MT, mais il est probable que ceux-ci se nourrissent généralement des mêmes types d’aliments que les caribous de la sous-population de la rivière George. L’importance relative des espèces consommées dans l’aire de répartition des caribous des MT est inconnue.
Tendances en matière d’habitat
Les changements survenus récemment et les changements prévus dans le pourcentage de couverture arbustive sont analysés dans la section Menaces, sous la rubrique Changements climatiques.
Population migratrice de l’est
La quantité et la qualité de la végétation changent au fil du temps dans l’habitat, ce qui explique probablement les changements saisonniers et à long terme observés dans la répartition des caribous migrateurs. L’augmentation de la densité des caribous est suivie d’un déclin à l’échelle locale, qui peut permettre à la végétation de se rétablir (Crete et al., 1996; Bergerud et al., 2008; Newton et al., 2015). À la fin des années 1980 et au début des années 1990, la grande abondance de la sous-population de la rivière George a causé une dégradation de l’habitat, notamment le piétinement et la perte d’une grande partie de la couverture de lichens (Manseau et al., 1996; Boudreau et al., 2003; Boudreau et Payette, 2004; Théau et Duguay, 2004). Dans les zones broutées de l’aire d’estivage de la sous-population de la rivière George, la biomasse de lichen s’établissait en moyenne à 23 ± 14 g/m2, comparativement à 401 ± 14 g/m2 pour les zones non broutées; les tapis de lichen étaient absents, et la biomasse de feuilles de bouleau nain d’Europe (Betula nana) était moitié moindre dans les zones broutées de la toundra arbustive (Manseau et al., 1996). Les CTA montrent que les caribous se sont nourris d’aliments de faible qualité et ont piétiné les aires d’alimentation (Williamson, 1997). Apparemment, l’habitat s’est partiellement rétabli depuis, mais on ne dispose d’aucune mesure quantitative récente de la qualité de l’habitat (Caribou Ungava, comm. pers., 2016). Dans la sous-population du sud de la baie d’Hudson, la densité supérieure de caribous dans les zones côtières s’est accompagnée d’une diminution de la biomasse végétale, qui était toujours perceptible après de nombreuses années (Newton et al., 2014).
Les activités minières et les aménagements hydroélectriques réalisés dans certaines parties de l’aire de répartition du caribou ME modifient la quantité d’habitat structural disponible. Ces activités entraînent des changements dans l’hydrologie superficielle à l’échelle du paysage ainsi qu’une expansion du réseau de routes et d’infrastructures qui donnent accès à un plus grand nombre de secteurs pouvant servir de point de départ aux motoneigistes durant l’hiver. De plus, les barrages hydroélectriques construits au Québec et à Terre-Neuve-et-Labrador ont causé l’inondation de vastes zones qui faisaient auparavant partie de l’aire d’hivernage du caribou ME (Therrien et al., 2004). Dans la sous-population du sud de la baie d’Hudson, les activités minières et forestières de même que l’exploitation de tourbières sont très limitées ou même absentes, mais une route d’hiver a récemment été aménagée de Fort Severn à Shamattawa et à Gillam, au Manitoba, et traverse la partie nord de l’aire de répartition de la sous-population (Walton et al., 2011).
Population des monts torngat
Les tendances concernant l’habitat du caribou ne sont pas quantifiées de façon précise, mais certains changements signalés dans l’habitat de la population des MT sont associés aux changements climatiques. D’après les CTA, les monts Torngat verdissent (Parks Canada Agency, 2008). Le couvert végétal, particulièrement le couvert arbustif, a augmenté au cours des dernières décennies (Fraser et al., 2011; section Menaces). Les CTA mentionnées par Wilson et al. (2014) signalent la présence de végétation verte à des altitudes supérieures sur les versants montagneux ainsi que l’empiètement des arbustes sur de vieux sentiers.
Biologie
Cycle vital et reproduction
La longévité maximale enregistrée pour un caribou est de 22 ans, mais ce caribou était en captivité (Müller et al., 2010). Dans la nature, rares sont les mâles et les femelles qui vivent plus de 10 et 15 ans, respectivement (Thomas et Kiliaan, 1998). La structure d’âge au sein d’une population de caribous peut changer au fil du temps, car les taux de survie et de fécondité au sein de chaque classe d’âge varient eux aussi. Les importantes fluctuations d’effectifs observées chez les caribous migrateurs de la toundra sont probablement associées à la variation de l’âge moyen des femelles reproductrices, la structure d’âge étant plus jeune durant les phases de croissance de la population que durant les phases de déclin (Clutton-Brock et Coulson 2002; Festa-Bianchet et al., 2003). Dans le présent rapport, la durée d’une génération est fondée sur l’âge moyen des parents au sein de la population et reflète donc le taux de renouvellement des individus reproducteurs (IUCN Standards and Petitions Subcommittee, 2013). Chez les espèces récoltées, comme le caribou, le taux de récolte peut modifier le pourcentage d’individus reproducteurs plus âgés. On a estimé la durée d’une génération à 6 à 7 ans, d’après les données recueillies entre 1978 et 1985 sur 196 femelles d’âge connu de la sous-population de la rivière George (Caribou Ungava, comm. pers.).
Dans les populations de caribous, le rapport des sexes chez les adultes penche en faveur des femelles, en raison du taux de survie selon l’âge qui est plus élevé chez les femelles (Gaillard et al., 2000). La primiparité survient entre 2 et 4 ans, selon la qualité de l’environnement (Bergerud, 1971; Crête et al., 1996). La gestation dure de 215 à 230 jours (McEwan et Whitehead, 1972; Bergerud, 1975) et les femelles donnent naissance à un seul petit. Elles peuvent procréer tous les deux ans si les conditions d’alimentation sont mauvaises ou si leurs réserves corporelles de gras et de protéines sont réduites durant la lactation (Gerhart et al., 1997). La parturition est très synchronisée au sein d’une population; elle atteint son maximum entre le début et le milieu de juin dans les sous-populations de la rivière George et de la rivière aux Feuilles (Taillon et al., 2012a). La parturition survient entre le milieu de mai et le début de juin dans la sous-population du sud de la baie d’Hudson (Abraham et Thompson, 1998; Wilson, 2013; Pond et al., 2016; Abraham, comm. pers., 2016).
Les caribous sont polygynes (Kelsall, 1968; L’Italien et al., 2012). La période du rut culmine habituellement à la fin d’octobre chez les caribous ME au Québec (S. Couturier et al., données inédites), alors qu’elle s’échelonne généralement de la mi-septembre à la mi-octobre pour la sous-population du sud de la baie d’Hudson (Abraham et Thompson, 1998; Abraham, comm. pers., 2016). Chez le caribou des MT, le rut a été observé entre la mi-octobre et la mi-novembre et la mise bas, entre le 5 et le 25 juin (Schaefer et Luttich, 1998). Selon les CTA, la période du rut s’échelonne du mois d’août à l’automne (Wilson et al., 2014).
Physiologie et adaptabilité
Les réserves corporelles de gras et de protéines du caribou fluctuent de façon marquée selon les saisons, en fonction de différences dans la qualité de l’alimentation et de différents facteurs de stress énergétique, tels que la neige épaisse, le harcèlement par les insectes et la reproduction (Barboza et al,. 2004; Barboza et Parker, 2008; Vors, 2013). Durant les saisons sans neige, le caribou consomme des plantes herbacées riches en azote, essentielles à la synthèse des protéines. Les mâles peuvent perdre jusqu’à 25 % de leurs réserves de protéines pendant le rut (Barboza et al., 2004). Chez les femelles, les réserves de protéines servent à la gestation et à la lactation (Gerhart et al., 1997; Taillon et al., 2013). Le régime alimentaire hivernal des caribous est faible en azote à cause d’une dépendance accrue à l’égard des lichens. Plusieurs mécanismes physiologiques permettent cependant aux caribous de conserver les protéines pour faire face aux carences alimentaires (Taillon et al., 2013). L’espèce réduit ses besoins énergétiques durant l’hiver et absorbe alors moins de nourriture en réaction à la diminution de la qualité et de la disponibilité des aliments. Dans certaines circonstances, les caribous peuvent engraisser en hiver (Couturier et al., 2009), notamment parce qu’ils consomment des lichens terricoles qui sont hautement digestibles (Côté, 1998).
Déplacements et dispersion
Population migratrice de l’est
Le phénomène de dispersion à la naissance n’a pas été beaucoup étudié, mais les CTA et les données recueillies sur un grand nombre de caribous munis d’un collier émetteur radio ont permis de cerner des tendances migratoires saisonnières bien établies. Les caribous ME effectuent de longues migrations deux fois par année; la mise bas a lieu sur les plateaux de toundra situés en altitude ou dans les zones de toundra à végétation clairsemée; les caribous passent l’été dans des milieux ressemblant à la toundra, ils migrent dans la taïga et la forêt boréale à l’automne pour y passer l’hiver et se rendent au printemps dans les aires de mise bas. Le comportement très grégaire affiché durant les migrations signifie que les déplacements des individus ne sont pas indépendants et ne constituent pas une simple réaction à des changements d’ordre phénologique dans l’environnement ou à des signaux physiologiques (Dalziel et al., 2016). La migration des femelles gravides vers certains endroits pour la mise bas est considérée comme une stratégie de défense contre les prédateurs : comme ceux-ci sont rassasiés par l’abondance de proies, la probabilité que les femelles perdent leur petit est plus faible (Bergerud, 1996).
Les études télémétriques indiquent que les caribous des sous-populations de l’ouest migrent des zones côtières vers l’intérieur des terres chaque année; certains segments de sous-population se déplacent entre l’intérieur des terres et la côte en formant de grands cercles durant l’année (Hedman, données inédites; Berglund et al., 2014). La superficie moyenne du domaine vital annuel de 19 femelles munies d’un collier émetteur radio s’établissait à 42 039 km2 ± 3 002 km2 en 2009, et à 67 809 km2 ± 2 472 km2 pour 32 caribous suivis en 2010 (Berglund et al., 2014). Jusqu’à il y a 30 ans, la majeure partie de la sous-population du sud de la baie d’Hudson mettait bas et passait l’été dans la région des îles Pen, sur la côte de la baie d’Hudson (près de la frontière de l’Ontario et du Manitoba); elle migrait ensuite à l’intérieur des terres en novembre pour passer l’hiver, puis revenait sur la côte en février-mars (Abraham et Thompson, 1998, Magoun et al., 2005; Pond et al., 2016). La sous-population s’est aujourd’hui déplacée vers l’est, mais continue de migrer de façon saisonnière entre l’intérieur des terres et les zones côtières (Pond et al., 2016). Le chevauchement de ce territoire avec celui du caribou boréal (UD 6), plus sédentaire, est important en hiver, mais pas durant la période de reproduction, la mise bas et la période estivale (Berglund et al., 2014; Pond et al., 2016). On observe un chevauchement saisonnier similaire entre le territoire de la sous-population du cap Churchill et celui du caribou de la toundra (UD 3) (Elliot, 1998).
Les caribous des sous-populations de l’est migrent généralement selon un axe nord-sud (Figure 5). D’après les études télémétriques et les CTA, les voies migratoires et la distance parcourue peuvent varier d’une année à l’autre (Williamson, 1997; Furgal et Rochette, 2007; Taillon et al., 2013; Le Corre et al., 2014; Government of Newfoundland and Labrador, données inédites). Par exemple, les voies migratoires empruntées par la sous-population de la rivière George ont énormément changé depuis le début des années 1990, parallèlement à la variation de la taille de la population (Le Corre et al., 2014). Par le passé, les caribous de la sous-population de la rivière aux Feuilles se déplaçaient sur une distance de 200 à 300 km et restaient dans la toundra tout au long de l’année. Ils ont toutefois commencé à migrer plus loin et à utiliser la zone entourant les réservoirs du complexe La Grande durant l’hiver. La migration actuelle de la sous-population de la rivière aux Feuilles s’étend sur environ 1 000 km, ce qui correspond à la plus longue migration connue de caribous (Le Corre et al., 2014; Figure 5). Les données télémétriques montrent qu’il n’y a pas eu de regroupement des sous-populations de la rivière George et de la rivière aux Feuilles, du moins pas depuis 2009 (Caribou Ungava, données inédites; Figure 5).

Description longue de la figure 5
Deux cartes illustrant les migrations printanières et automnales de caribous suivis par satellite faisant partie de la sous population de la rivière aux Feuilles (carte a) et de la sous population de la rivière George (carte b), de 2009 à 2011.
Population des monts torngat
Les caribous de la sous-population des MT migrent en altitude (ce qui est typique de l’écotype montagnard; COSEWIC, 2011) pour passer l’été dans les hauteurs. Durant la mise bas, on observe une tendance à la dispersion plutôt qu’au rassemblement, comme c’est le cas pour l’écotype migrateur (Schaefer et Luttich, 1998). Les caribous des MT se déplacent annuellement de 4,5 km par jour en moyenne, soit deux à quatre fois moins que les caribous migrateurs (Couturier et al., 2010; Caribou Ungava, données inédites).
La quantité exacte de déplacements ou d’échanges d’individus entre la population ME et la population des MT est inconnue. On considère toutefois que cette quantité est suffisante pour produire un génotype similaire, mais qu’elle est insuffisante pour compenser le déclin continu de la sous-population des MT (Boulet et al., 2007; Schmelzer, comm. pers., 2016).
Relations interspécifiques
Une partie de l’aire d’hivernage du caribou ME chevauche l’aire de répartition de l’orignal (Alces alces), mais la densité des orignaux dans la majeure partie de l’aire de répartition des caribous ME est actuellement faible, et les interactions entre ces espèces ne sont pas considérées comme importantes. On se préoccupe de façon générale du fait qu’une augmentation de la densité des orignaux peut entraîner une augmentation de la densité des loups (Canis lupus) (Wilson et al., 2014; COSEWIC, 2015). L’évitement des zones de grands arbustes, observé chez les caribous du sud de la baie d’Hudson, a été associé à la présence des orignaux et au risque de prédation par les loups qui en découle (Berglund et al., 2014). L’aire d’estivage de la sous-population de la rivière aux Feuilles chevauche l’aire de répartition du bœuf musqué (Ovibos moschatus) qui a été introduit dans la péninsule d’Ungava. La population de bœufs musqués s’étend aujourd’hui aux zones côtières de la péninsule d’Ungava, aussi loin que la rivière aux Mélèzes (MFPP, données inédites). Des préoccupations ont été soulevées quant à la possibilité de compétition pour la nourriture entre les bœufs musqués et les caribous, mais les effets sur une population donnée n’ont pas été déterminés (Thomas et Edmonds, 1984).
Le chevauchement spatial avec les caribous de l’UD 6 est analysé dans la section Aire de répartition canadienne.
Prédation
Le caribou est une importante source de nourriture pour de nombreux prédateurs et charognards. Les loups, l’ours noir (Ursus americanus), le lynx (Lynx canadensis) et le carcajou (Gulo gulo) se nourrissent à la fois d’adultes et de faons (Bergerud, 1974; Gustine et al., 2006; Pinard et al., 2012; Leclerc et al., 2014). L’Aigle royal (Aquila chrysaetos) et lePygargue à tête blanche (Haliaeetus leucocephalus) peuvent aussi se nourrir de faons de façon opportuniste (Crête et Desrosiers, 1995;Mahoney et Weir, 2009). On suppose que le comportement migrateur des caribous leur permet de s’éloigner du territoire de la plupart des prédateurs, surtout durant les périodes où ils sont particulièrement vulnérables à la prédation, comme durant la mise bas (Bergerud et Page, 1987). Certains loups suivent les caribous migrateurs sur plusieurs centaines de kilomètres (Musiani et al., 2007). Des phénomènes semblables ont été observés dans la population de caribous ME, mais on ignore si les loups nourrissent alors des petits restés à la tanière (Caribou Ungava, données inédites). Selon les CTA, la prédation, particulièrement par les loups, est considérée comme la deuxième menace en importance pour la sous-population de caribous des MT, après la chasse excessive (Wilson et al., 2014).
Population migratrice de l’est
Les loups sont les principaux prédateurs des caribous ME, mais les ours noirs sont aussi des prédateurs, particulièrement des faons (Veitch et Krizan, 1996; Miller, 2003; Cuerrier and the Elders of Kangiqsualujjuaq, 2012). Les effectifs des loups varient probablement en fonction des effectifs des caribous, possiblement avec un décalage de quelques années (Hayes, 1995; Williamson, 1997). Les résultats préliminaires indiquent que la population de loups, dans de grandes parties de l’aire de répartition actuelle de la sous-population de la rivière George, a diminué en fonction de la gravité et de la durée du déclin des caribous (Government of Newfoundland and Labrador, données inédites). Les CTA indiquent également que l’abondance des loups a récemment diminué dans l’aire de répartition de la sous-population de la rivière George. Les ours noirs sont abondants dans le nord du Québec, particulièrement dans certaines vallées côtières du Labrador (Veitch et Krizan, 1996). Selon les CTA, l’abondance des ours noirs a récemment augmenté dans l’aire de répartition de la sous-population de la rivière George (Cuerrier and the Elders of Kangiqsualujjuaq, 2012).
Population des monts torngat
Il n’y a pas d’information sur la prédation pour la population des MT, mais il est probable que les loups étaient plus abondants au moment où les effectifs de la sous-population voisine de la rivière George étaient nombreux, au début des années 1990. L’ours noir est présent dans l’aire de répartition des caribous des MT; selon les CTA, l’ours noir est un prédateur du caribou, quoique moins efficace que le loup (Wilson et al., 2014).
Parasites
Les parasites gastro-intestinaux sont très courants chez le caribou. Ces parasites ne causent pas nécessairement de symptômes manifestes, mais ils occasionnent une dépense d’énergie (Gunn et Irvine, 2003; Kutz et al., 2012) et peuvent entraîner une baisse de fécondité (Pachkowski et al.,2013). Chez le renne du Svalbard (Scandinavie), les parasites semblent jouer un rôle dans la régulation de l’abondance (Albon et al., 2002). On ne connaît pas les tendances liées aux parasites gastro-intestinaux, mais le réchauffement climatique modifiera vraisemblablement certaines relations hôtes-parasites (Gunn et al., 2011; Altizer et al., 2013).
On trouve la douve du foie (Fascioloides magna) chez le caribou migrateur du nord du Québec et du Labrador (Lankester et Luttich, 1988; Simard et al., 2016). La prévalence des parasites F. magna, Taenia hydatigena et Cephenemyia trompe semble plus élevée chez les adultes que chez les faons (Simard et al., 2016). La prévalence et l’intensité du F. magna ainsi que la prévalence du T. hydatigena semblent augmenter avec la taille de la population. La prévalence du F. magna était plus élevée dans la sous-population de la rivière George que dans la sous-population de la rivière aux Feuilles (Simard et al., 2016).
La présence du Besnoitia tarandi est avérée dans d’autres populations de caribous et de rennes depuis près d’un siècle, mais on en sait peu sur l’épidémiologie, le cycle vital (Ducrocq et al., 2012, 2013) et la transmissibilité (Kutz et al., 2009) de ce parasite protozoaire. Il pourrait s’être manifesté récemment dans les sous-populations de l’est de la population ME, car il est apparu comme un problème important au milieu des années 2000 pour les sous-populations de la rivière George et de la rivière aux Feuilles (Kutz et al., 2009; section Menaces).
De nombreux autres parasites et agents pathogènes sont soupçonnés d’avoir une incidence sur le caribou, notamment le Toxoplasma gondii, le Neospora caninum, une espèce de Babesia et l’Erysipelothrix rhusiopathiae (Johnson et al., 2010; Kutz, comm. pers., 2016).
On a analysé des échantillons recueillis dans les deux sous-populations de caribous migrateurs du Québec et du Labrador en 2007-2009 afin de déterminer la prévalence sérologique des anticorps contre le Brucella, le Neospora caninum, le virus du Nil occidental, le Toxoplasma gondii, le virus parainfluenza de type 3, l’herpèsvirus bovin de type 1, le virus respiratoire syncytial ainsi que la diarrhée virale des bovins de types I et II. Des résultats antérieurs semblent indiquer une très faible prévalence concernant l’exposition à la plupart de ces agents pathogènes (ou à des pathogènes apparentés des Rangifer à réaction croisée) (Curry, 2012).
Tailles et tendances des populations
Activités et méthodes d’échantillonnage
Les CTA sont utiles pour documenter les changements touchant l’abondance relative et la répartition qui se produisent sur de longues périodes. Il y a généralement plus de CTA sur les sous-populations du Québec et du Labrador que sur les sous-populations de l’Ontario (Brice-Bennett, 1977; Williamson, 1997; Cuerrier and the Elders of Kangiqsualujjuaq, 2012; Wilson et al., 2014). Les caribous sont également dénombrés au moyen de relevés aériens effectués selon des axes de vol précis, et on a souvent recours à une méthode de recensement normalisée qui repose sur des photographies prises durant les périodes de rassemblement (Abraham et Thompson, 1998; Couturier et al., 2004). De façon générale, il est difficile d’estimer la taille et la composition des populations de caribous migrateurs à cause des vastes territoires qu’ils utilisent, de leurs déplacements à grande échelle et de leur comportement de rassemblement, qui peut entraîner une grande variabilité des relevés lorsque des rassemblements ne sont pas repérés au cours d’une année donnée. Pour atténuer le risque de sous-échantillonnage, on s’assure de réaliser les relevés au bon moment de l’année et de couvrir de façon systématique des axes de relevé rapprochés. Au Québec, les relevés aériens sont complétés par des observations au sol faisant appel à des dénombrements avec classification. Ces dénombrements sont habituellement effectués lorsque les caribous en migration passent devant l’observateur. Au cours des dénombrements, quelques milliers de caribous sont classés dans l’une des catégories suivantes : mâles (quatre classes de taille), femelles (avec ou sans bois) et faons. On s’efforce de répartir largement les sites de dénombrement pour obtenir une estimation fiable de la structure âge-sexe de l’ensemble de la population.
L’établissement du rapport des sexes permet de déterminer la proportion de femelles et de mâles adultes et d’estimer le recrutement (nombre de faons) dans la population chaque automne. Deux de ces indicateurs (recrutement et pourcentage de grands mâles) sont très importants pour le suivi des populations. L’utilisation du rapport d’âge pour évaluer les tendances des populations chez les ongulés a été critiquée, car ce paramètre ne rend pas compte des différences dans le taux de survie des juvéniles durant l’hiver ou du rapport entre femelles matures et femelles immatures (Bender, 2006). Le rapport d’âge, lorsqu’il demeure très faible durant plusieurs années, permet toutefois de détecter les déclins de population.
Population migratrice de l’est
Plus de 15 relevés aériens ont été effectués depuis 1979 dans la sous-population du sud de la baie d’Hudson, et le suivi s’est intensifié à partir de 2005 (Magoun et al., 2005; Newton et al., 2014). Ces estimations d’effectifs sont des estimations minimales, car la proportion de la sous-population ayant fait l’objet d’un relevé est incertaine pour certaines années (Abondance et tendances). La sous-population du sud de la baie d’Hudson a fait l’objet d’un relevé presque chaque année de 1982 à 1994, et les déplacements ont été évalués d’après les données télémétriques recueillies sur plus de 50 adultes (Abraham et Thompson, 1998). Une série de relevés aériens menés dans le nord de l’Ontario et du Manitoba durant la période 2008-2011 a servi à établir la répartition des caribous du sud de la baie d’Hudson, et 41 femelles ont été munies d’un collier émetteur radio afin qu’on puisse établir leurs migrations et leurs habitudes en matière d’utilisation de l’espace (Newton et al., 2014). Ces activités ont permis de documenter les changements concernant les tendances d’utilisation de l’espace et l’impact des caribous sur la végétation. La sous-population du cap Churchill a fait l’objet de relevés à deux reprises, et on a établi une estimation minimale de ses effectifs. Une étude télémétrique d’une durée de trois ans (2010-2012) a été réalisée sur les déplacements de 19 caribous de la sous-population du cap Churchill et de 21 caribous de la sous-population du sud de la baie d’Hudson se trouvant au Manitoba (Hedman, données inédites).
Des relevés aériens ont été effectués à douze reprises de 1965 à 2016 dans la sous-population de la rivière George, et des recensements photographiques de grande précision ont été réalisés quatre fois au cours des huit dernières années. Des relevés aériens ont été effectués à huit reprises de 1975 à 2016 dans la sous-population de la rivière aux Feuilles. Les relevés aériens menés à intervalles de quelques années ont été complétés par des dénombrements avec classification (moyenne annuelle de 2 658; écart-type de 250 au cours des dernières années au Québec) effectués durant la migration automnale, à compter de 1973 pour la sous-population de la rivière George et à compter de 1994 pour la sous-population de la rivière aux Feuilles.
De plus, un suivi intensif des sous-populations de l’est de la population ME est réalisé par télémétrie VHF, satellitaire et GPS depuis 1986 par les gouvernements de Terre-Neuve-et-Labrador et du Québec, et plusieurs études sur l’état physique des caribous ont été entreprises à partir des années 1970 (p. ex. Parker, 1980; Huot, 1989; Taillon et al., 2012b). La pose de colliers émetteurs radio et les activités de suivi se sont intensifiées après 2007. L’emplacement de certains caribous ME a été étudié dans le cadre de divers projets associés au suivi environnemental des exercices d’entraînement à basse altitude des forces aériennes durant les années 1980 et 1990, mais la plus grande partie du travail (environ 90 %) a porté sur les sous-populations des monts Red Wine et Mealy (Harrington et Veitch, 1991), qui appartiennent à une UD différente (UD 6) (COSEWIC, 2011). Les taux de survie selon le sexe des caribous du Québec et du Labrador ont été estimés d’après les données sur les caribous munis d’un collier émetteur radio. De tels colliers sont posés depuis 1986 dans la sous-population de la rivière George, et depuis 1991 dans la sous-population de la rivière aux Feuilles. Depuis 2007, des femelles âgées d’un an sont marquées chaque année pour pouvoir recueillir des données sur des individus dont l’âge est connu. En 2014, on a commencé à marquer les petits d’un an au mois d’avril plutôt qu’au mois de juin dans la sous-population de la rivière George, afin de ne pas perturber les caribous dans les aires de mise bas ou à proximité. En conséquence, sauf pour ce qui est du taux de survie des faons en hiver, on possède de bonnes données sur la dynamique des populations pour les sous-populations de l’est. En outre, les données sur les caribous munis d’un collier émetteur radio guident la conception des recensements aériens. Ces données fournissent aussi des renseignements annuels sur les tendances migratoires dans le temps et dans l’espace, l’utilisation des territoires et les changements touchant la superficie et l’emplacement des aires de mise bas (Taillon et al., 2012a).
Population des monts torngat
L’abondance et la répartition du caribou des MT ont été estimées pour la première fois dans le cadre d’un relevé de reconnaissance mené en 1980, dont la fiabilité est inconnue (Bélanger et Le Hénaff, 1985). Le premier échantillonnage par distance a été effectué au printemps 2014 durant un relevé en hélicoptère, et une estimation de la population avec intervalle de confiance a ainsi été produite (Couturier et Mitchell Foley, 2014). Le relevé réalisé en 2014 est considéré comme rigoureux selon les normes de l’industrie. Il a été mené sur un territoire de 30 689 km2 correspondant à l’aire d’hivernage traditionnelle élargie établie selon les données des années 1980 et 1990, qui s’étend depuis l’extrémité nord des péninsules de l’Ungava et du Labrador jusqu’à la région de la baie Okak (Schaeffer et Luttich, 1998) et a été divisé en 81 transects (7 057 km au total). Le relevé a été mené durant la période où les déplacements sont minimaux et où il n’y a pas de chevauchement entre les aires de répartition de la souspopulation de la rivière George et de l’UD des monts Torngat. De plus, les observateurs étaient expérimentés et sont demeurés les mêmes durant la courte période des relevés (2 semaines), et il est peu probable que des individus se soient déplacés vers des zones ayant déjà été parcourues. Les rédacteurs sont convaincus que le taux de détection était probablement élevé et non biaisé (Couturier et Mitchell Foley, 2014).
Un sommaire des CTA est présenté dans Wilson et al. (2014). La population des MT a fait l’objet d’un suivi et de recherches relativement limités. Une étude sur l’utilisation de l’espace a été réalisée dans les années 1990 (Schaefer et Luttich, 1998), et une étude sur la survie et la sélection de l’habitat fondée sur 35 individus munis d’un collier émetteur à transmission par satellite a été entamée en 2011 (Caribou Ungava, données inédites).
Abondance et tendances
Population migratrice de l’est
Sous-population de la rivière george
La souspopulation de la rivière George compterait 8 938 ± 670 individus selon la plus récente estimation (2016; tableau 1). Le nombre d’individus matures est estimé à 6 704. Les individus matures représenteraient 75 % de la souspopulation totale, selon la proportion d’individus non matures (≤ 2 ans) observée lors des relevés visant les souspopulations de la rivière aux Feuilles et de la rivière George (gouvernement de TerreNeuve-et-Labrador, gouvernement du Québec, données inédites).
| Sous-population | Année de l’estimation | Effectif estimatif (nbre + é.-t.) | Type de relevé |
|---|---|---|---|
| Rivière George | 2016 | 8 938 + 670 | Dénombrement complet; relevé photographique aérien |
| Rivière aux Feuilles | 2016 | 199 000 ± 15 920 | Dénombrement complet; relevé photographique aérien |
| Sud de la baie d’Hudson | 2011 | 16 638 | Dénombrement minimal; relevé photographique aérien |
| Cap Churchill | 2007 | 2 937 | Dénombrement minimal; relevé photographique aérien |
La première estimation de l’effectif de la souspopulation de la rivière George a été réalisée en 1954; le nombre d’individus avait alors été évalué à 5 000, mais la région visée par les relevés était restreinte, et les auteurs avaient indiqué que le dénombrement n’était que partiel (Banfield et Tener, 1958). Des modèles de simulation fondés sur des relevés plus exhaustifs réalisés au cours des années qui ont suivi ainsi que sur les taux de survie et de recrutement donnent à penser qu’il y avait au moins 60 000 individus en 1954 pour que la sous-population puisse atteindre l’effectif enregistré en 1993 (Rasiulis, 2015). Selon Desmeules et Brassard (1964), il y avait 61 800 individus en 1963, mais aucun écart-type n’a été fourni pour cette estimation. L’effectif de la sous-population de la rivière George a augmenté à partir de la fin des années 1960 et a atteint un sommet de 823 000 ± 102 000 individus en 1993 (Couturier et al., 1996), puis a commencé à diminuer (Figure 6). En 2012, l’effectif était estimé à 27 600 ± 2 760 individus d’après des relevés aériens réalisés par les gouvernements du Québec et de TerreNeuveetLabrador, et il avait poursuivi son déclin pour atteindre 14 200 ± 710 individus en 2014. Le nombre total d’individus de la souspopulation a été estimé à 8 938 ± 670 dans le cadre d’un relevé réalisé en 2016 (intervalle de confiance à 90 %) (données inédites des gouvernements de TerreNeuveetLabrador et du Québec).

Description longue de la figure 6
Diagramme illustrant le nombre d’individus de tous les âges estimé d’après des relevés aériens et soumis à une transformation logarithmique, pour les sous-populations de la rivière George et de la rivière aux Feuilles, de 1963 à 2016. Les barres représentant l’écart-type sont illustrées dans les cas où celui-ci est connu.
On ignore exactement quand l’effectif de cette sous-population a atteint son maximum, mais le nombre d’individus estimé en 2016 était de 99 % inférieur à celui estimé en 1993, et cette période de 23 ans se rapproche de la durée de 3 générations (18 à 21 ans). Le déclin sur 2 générations (12 à 14 ans) serait de 98 % si on comparait les résultats du relevé le plus récent, réalisé en 2016 (8 938 individus), à ceux du relevé précédent qui se rapproche le plus de la période correspondant à 2 générations (2002 à 2004), soit celui de 2001 (385 000 individus). Sur une génération (6 à 7 ans), le déclin serait de 88 % si on comparait les résultats du relevé de 2016 (8 938 individus) à ceux du relevé précédent qui se rapproche le plus de la période correspondant à 1 génération (2009 à 2010), soit celui de 2010 (74 000 individus).
Sous-population de la rivière aux feuilles
La sous-population de la rivière aux Feuilles compte 199 000 ± 15 920 caribous selon la plus récente estimation (2016; tableau 1). Le nombre d’individus matures serait de 149 250, soit 75 % de la sous-population totale selon la proportion d’individus non matures (≤ 2 ans) observée lors des relevés visant les sous-populations de la rivière aux Feuilles et de la rivière George (Caribou Ungava, données inédites).
La sous-population de la rivière aux Feuilles pourrait être issue d’individus s’étant séparés de la sous-population de la rivière George, et elle comptait 56 000 individus au moment du premier recensement dont elle a fait l’objet, en 1975 (Le Hénaff, 1976). Son effectif semble avoir augmenté de façon régulière et était estimé à 276 000 ± 76 000 en 1991 (Figure 6). Lors du relevé subséquent, en 2001, la population aurait atteint 1 193 000 ± 567 100 individus, sommet très élevé (Couturier et al., 2004), mais le relevé a été réalisé dans des conditions difficiles, et l’intervalle de confiance de l’estimation est très élevé, de sorte que cette estimation est moins fiable que celle obtenue lors de la plupart des relevés récents réalisés pour les deux sous-populations du Québec et du Labrador. Selon un exercice de projection de la population fondé sur les taux de survie et la productivité connus en fonction du sexe et de l’âge, cette sous-population pourrait avoir atteint son effectif maximal, soit environ 500 000 individus, en 2002 (Rasiulis, 2015) et n’a jamais compté plus de 700 000 individus (Couturier et al., 1996). Aux fins du présent rapport, la limite inférieure de l’intervalle de confiance du relevé de 2001, soit 625 900 individus, est utilisée comme la meilleure information existante. L’effectif a été estimé à 430 000 ± 98 900 en 2011 par le gouvernement du Québec, dont les données sur les dénombrements avec classification et l’utilisation de l’espace semblent indiquer que la population était stable de 2008 à 2013. Toutefois, au cours des quelques dernières années, des signes de déclin, notamment le piètre état physique des femelles en lactation, donnent à penser que la population est en déclin (Taillon et al., 2011). En 2014, le taux de recrutement automnal a été de 14 faons/100 femelles, ce qui est très faible (Taillon et al., 2016); les données sur les taux de recrutement et de survie des adultes indiquent que la sous-population a connu un important déclin démographique de 2013 à 2014 ainsi qu’un déclin plus modéré en 2014-2015, et, selon des Autochtones utilisant cette ressource, particulièrement des chasseurs inuits et cris, la sous-population de la rivière aux Feuilles a connu un déclin depuis 2011 (Taillon et al., 2016). Selon les résultats du relevé de 2016, l’effectif total est de 199 000 ± 15 920 individus (tableau 1). Le nombre d’individus matures est estimé à 149 250.
Il est problématique de dégager une tendance sur la durée de générations pour la sous-population de la rivière aux Feuilles, car celle-ci a connu des hausses et des baisses. Si on comparait l’effectif estimé lors du relevé de 2016 (199 000 individus) à celui du relevé précédent qui se rapproche le plus de la période correspondant à 3 générations (18 à 21 ans; 1990 à 1993), soit le relevé de 1991 (276 000 individus), on obtiendrait un déclin de 28 % sur 3 générations. Toutefois, la taille maximale de la population, qui a été d’environ 625 000 individus au milieu des années 2000, n’est pas prise en compte avec cette méthode (Figure 6). Si on comparait les résultats du relevé le plus récent, réalisé en 2016, à ceux du relevé précédent qui se rapproche le plus de la période de 12 à 14 ans correspondant à 2 générations (2002 à 2004), soit celui de 2001 (625 900 individus), le déclin serait de 68 %. Sur une génération (6 à 7 ans), le déclin serait de 54 % si on comparait les résultats du relevé de 2016 à ceux du relevé précédent qui se rapproche le plus de la période correspondant à 1 génération (2009 à 2010), soit celui de 2011 (430 000 individus).
Sous-populations du sud de la baie d’hudson et du cap churchill
Il n’existe aucune estimation de l’effectif total des sous-populations de l’ouest de la population ME, car certaines parties de leur aire de répartition n’ont pas fait l’objet de relevés. Cependant, selon la plus récente estimation de la population minimale, la sous-population du sud de la baie d’Hudson compterait 16 638 individus, et celle du cap Churchill, 2 937 individus (tableau 1). Aux fins du présent rapport de situation, on suppose que la proportion d’individus matures dans ces sous-populations est semblable à celle observée dans les sous-populations de l’est, c’est-à-dire de 75 %; le nombre minimal d’individus matures serait donc de 12 479 dans la sous-population du sud de la baie d’Hudson et de 2 203 dans la sous-population du cap Churchill.
En l’absence d’estimations historiques robustes des effectifs des sous-populations de l’ouest, il est difficile de quantifier les changements quant à l’abondance. Dans la sous-population du sud de la baie d’Hudson, il a semblé y avoir une tendance à la hausse de 1979 à 1994, d’après des relevés photographiques normalisés (Abraham et Thompson, 1998; Abraham, comm. pers., 2016). Selon les estimations minimales de la population, il y avait 2 300 individus en 1979, 4 660 en 1986, 7 424 en 1989 et 10 798 en 1994 (Abraham et Thompson, 1998; Newton et al., 2015). Les relevés de 2008-2011 semblent indiquer un déclin, mais on présume aujourd’hui que le déclin observé était en fait attribuable au déplacement d’individus vers l’intérieur des terres, où aucun relevé n’a été réalisé (Newton et al., 2015; Abraham, comm. pers., 2016). On ne peut pas tenir compte des résultats des relevés de 2008-2011 pour évaluer les tendances, car les relevés n’ont probablement pas été réalisés à des moments et à des emplacements optimaux après la fin des années 2000. En effet, les relevés devaient coïncider avec la principale période de rassemblement (fin juillet et début août), qui avait été déterminée selon les données recueillies précédemment (Abraham et Thompson, 1998) et aurait dû permettre le recensement de la majorité des individus. Toutefois, des données de télémesure obtenues par suivi satellite de caribous ont montré que, durant les relevés de 2008-2011, les déplacements entre la côte et l’intérieur des terres s’étaient produits plus tôt dans l’année (fin juillet et début août; Berglund et al., 2014), et un nombre inconnu d’individus n’a pas été recensé (Abraham, comm. pers., 2016). Selon la plus récente estimation minimale (2011), la population compte 16 638 individus, dont 12 166 étaient rassemblés à l’intérieur des terres (Berglund et al., 2014; tableau 1).
L’effectif de la sous-population du cap Churchill a été estimé pour la première fois à 58 individus en 1965, mais les activités de recherche étaient alors limitées, et l’effectif a par la suite été estimé à 1 800 à 2 200 individus en 1988 (Campbell, 1994). En 1997-1998, la population minimale a été estimée à 3 013 individus adultes (Elliot, 1998). La proportion d’adultes a été déterminée d’après la taille relative des adultes et des faons; cette méthode diffère de l’application de la proportion de 75 % utilisée pour d’autres sous-populations, mais cette méthode est probablement suffisante aux fins du présent rapport, car la sous-population du cap Churchill est petite comparativement aux trois autres sous-populations. Selon une analyse des photographies prises dans le cadre de trois relevés aériens réalisés en 2007, l’effectif a été estimé à 2 937 individus de tous âges (Walton et al., 2011). Le nombre d’individus matures est estimé à 2 203. On ignore la tendance pour cette sous-population, mais celle-ci est considérée comme stable car les estimations de la taille minimale de la population réalisées en 1998 et en 2007 étaient semblables.
Taille et tendances des populations
La taille minimale de la population ME s’élève à 227 513 caribous de tous âges, selon les plus récentes estimations totales effectuées pour les sous-populations de la rivière aux Feuilles (2016) et de la rivière George (2016) ainsi que les plus récentes estimations minimales effectuées pour les sous-populations du cap Churchill (2007) et du sud de la baie d’Hudson (2011). Supposant que 75 % de ces individus sont matures, le nombre estimatif de caribous matures serait de 170 636. La population ME était estimée à 1 111 698 individus il y a trois générations, dont 833 774 étaient matures. Les valeurs suivantes correspondent aux résultats des relevés ou aux estimations minimales effectuées trois générations (18 à 21 ans) ou environ trois générations avant la plus récente estimation de l’effectif des sous-populations : cap Churchill, 1 900 individus estimés en 1988, dont 1 425 matures (< 1 % de la population ME); sud de la baie d’Hudson, 10 798 individus estimés en 1994; dont 8 099 matures (1 %); rivière aux Feuilles, 276 000 individus estimés en 1991, dont 207 000 matures (25 %); rivière George, 823 000 individus estimés en 1993, dont 617 250 matures (74 %). Si on compare ces valeurs à celles des plus récentes estimations, la population ME aurait connu un déclin de 80 % sur trois générations. Les deux sous-populations de l’est représentaient environ 99 % de la population ME totale il y a trois générations, et elles en représentent environ 96 % aujourd’hui.
L’importance du déclin d’une population dépend de la mesure dans laquelle ce déclin s’explique par des fluctuations naturelles et de la probabilité que les déclins actuels soient renversés. Il semble exister des fluctuations naturelles pour les deux sous-populations du Québec-Labrador, qui ont connu d’importantes fluctuations au fil du temps (Messier et al., 1988), phénomène typique chez le caribou migrateur (Payette et al., 2004; Vors et Boyce, 2009). Les CTA font mention d’importantes fluctuations du caribou migrateur au fil du temps (Brice-Bennett, 1977; Parks Canada Agency, 2008). Morneau et Payette (2000) ont analysé les cicatrices laissées sur les racines des épinettes noires (Picea mariana) par le caribou migrateur dans trois sites le long de la rivière George, et leurs observations donnent à penser qu’un déclin de la population s’est amorcé vers 1870. Ce déclin a semblé s’accentuer durant la période 1905-1915, puis une légère augmentation a suivi en 1920-1930, et un autre déclin a été noté vers 1940 (Bergerud et al., 2008). Les cicatrices présentes sur les racines donnent à penser que le nombre de caribous a considérablement augmenté de 1950 à la fin des années 1980 (Morneau et Payette, 2000). Les sous-populations de l’ouest connaissent probablement des fluctuations, mais celles-ci n’ont pas été quantifiées.
On ignore toutefois dans quelle mesure les populations pourront se rétablir cette fois-ci. L’effectif actuel de la sous-population de la rivière George est le plus bas jamais enregistré (< 9 000 caribous de tous âges en 2016 comparativement à environ 60 000 caribous de tous âges lors du creux démographique précédent enregistré), et la récolte excessive continue de représenter une menace. Les effets de l’infrastructure associée au développement, notamment les routes d’accès aux ressources, les exploitations minières et les sentiers de VTT et de motoneiges, ont augmenté depuis le creux démographique précédent, observé dans les années 1950 (section Menaces). Les lichens sont une source d’alimentation préférée par l’espèce, mais un verdissement de la toundra semble se produire, avec l’augmentation de la couverture d’arbustes associée aux changements climatiques, et des indices laissent croire que le nombre d’ours noirs serait en hausse dans la région (section Menaces). On ignore dans quelle mesure ces changements auront un impact sur la capacité de croissance des populations de caribous.
Population des monts torngat
Selon la plus récente estimation (2014), la population des monts Torngat compte 930 individus (fourchette de 616 à 1 453 individus; Couturier et Mitchell Foley, 2014). Le nombre d’individus matures est estimé à 698.
Il est difficile d’analyser les tendances démographiques de la sous-population des MT, car seulement deux relevés ont été réalisés, à plus de 30 années d’intervalle. Le nombre d’individus a été estimé à environ 5 000 en 1980, dans le cadre d’un relevé de reconnaissance (Bélanger et Le Hénaff, 1985). Les biologistes de la Division de la faune de Terre-Neuve-et-Labrador ont constaté des déclins locaux du caribou des MT à la fin des années 1990 et au début des années 2000, et ils ont commencé à soupçonner en 2005 qu’un déclin important s’était produit, en partie à cause d’un rétrécissement de l’aire de répartition de la baie Okak jusqu’à Hebron (Blake, comm. pers., 2015). Dans la cadre d’un relevé aérien mené en mars 2014, aucun caribou n’a été observé au sud du fjord Hebron, ce qui donne à penser que la sous-population pourrait compter bien moins que 930 individus (fourchette de 616 à 1 453; Couturier et Mitchell Foley, 2014). Selon les CTA, l’abondance a fortement fluctué au fil du temps, et un creux démographique s’est produit durant la période des années 1940 à 1960 (Park Canada Agency, 2008; Wilson et al., 2014). Plus de 80 % des personnes interrogées au Nunatsiavut et 50 % de celles interrogées au Nunavik estiment que la population des MT est en déclin (Wilson et al., 2014), mais la plupart de ces personnes croient que le caribou s’est déplacé ailleurs. Cette région est vaste, mais elle a entièrement été parcourue en 2014 dans le cadre de relevés aériens comprenant de nombreuses lignes de relevés, et il est impossible que de grandes portions de la population soient passées inaperçues (Couturier et Mitchell Foley, 2014; section Taille et tendances des populations). Le déclin survenu de 1980 à 2014 est d’environ 81 %; cette période de 34 ans correspond à environ 4 à 5 générations (3 générations = 18 à 27 ans).
Survie et recrutement
Les taux de survie et de recrutement sont souvent utilisés comme indicateurs de la santé de la population de caribou. Selon Environnement Canada (Environment Canada, 2008) un taux de recrutement minimal de 29 faons pour 100 femelles à la fin de l’hiver (rapport faon/femelle de 0,29) est nécessaire à la stabilité de la population, en supposant que le taux de survie des femelles adultes est élevé et stable. Selon la politique actuelle du gouvernement du Québec, fondée sur les données concernant le caribou migrateur (Crête et al., 1996; Bergerud et al., 2008; Couturier et al., 2009), on peut s’attendre à ce que la sous-population demeure stable si le rapport faon/femelle est d’au moins 0,39 et que le taux de survie des femelles adultes est supérieur à 85 %, ou d’au moins 0,34 si le taux de survie des femelles adultes est supérieur à 87 %. La valeur de cet indicateur est toutefois discutée; de nombreuses études sur le caribou laissent croire qu’une bonne partie de la variabilité du taux de croissance de la population ne s’explique pas par la variation du taux de recrutement des faons (Gaillard et al., 2000). Toutefois, les indices vitaux tels que les taux de survie des adultes et des faons sont souvent corrélés, et il est probable que les taux de mortalité élevés chez les femelles soient associés à de faibles taux de recrutement (Bergerud et al., 2008).
Population migratrice de l’est
Au cours des 25 dernières années, le taux de survie des femelles adultes a de manière générale été plus élevé dans la sous-population de la rivière aux Feuilles que dans la sous-population de la rivière George (Figure 7). Ces écarts concordent avec les différences entre les tendances démographiques observées entre ces deux sous-populations (Figure 7). Dans la sous-population de la rivière aux Feuilles, le taux de survie des femelles adultes a été estimé à 84 % en 2014-2015 et à 85 % en 2015-2016 (Taillon et al., 2016).

Description longue de la figure 7
Diagramme illustrant les taux de survie estimatifs, avec écart-type, des femelles adultes munies d’un collier émetteur radio dans les sous-populations de caribous migrateurs de l’Est de la rivière George et de la rivière aux Feuilles, du début des années 1990 au milieu des années 2010.
En 1984, le taux de survie annuel des femelles adultes dans la sous-population de la rivière George a été estimé à 95 % (Crete et al., 1996). Depuis 1991, dans cette sous-population, le taux de survie des femelles adultes munies d’un collier émetteur a été supérieur à 80 % seulement trois années, et l’échantillon était composé de moins de 20 femelles deux de ces années. Les taux de survie obtenus pour la période 1991-2000 représentent probablement des sous-estimations, car les lourds colliers de suivi par satellite alors utilisés ont semblé artificiellement accroître le taux de mortalité (Rasiulis et al., 2014). Des colliers beaucoup plus légers sont utilisés depuis 2001, et ceux-ci sont d’un poids comparable aux colliers émetteurs VHF qui ont été utilisés de 1991 à 2000 et qui n’ont pas semblé avoir d’incidence sur le taux de survie des caribous (Rasiulis et al., 2014). Le taux de survie des femelles adultes dans la sous-population de la rivière George est demeuré inférieur à 80 % (moyenne de 68 %) presque toutes les années de 2001 à 2014. Les faibles taux de recrutement et de survie semblent indiquer que la population a connu un déclin de plus de 70 % de 2009 à 2011. En 2013-2014, le taux de survie des femelles adultes a été estimé à 84 % (MFFP, données inédites). Le taux de survie des femelles adultes de la sous-population de la rivière George est également calculé par le gouvernement de Terre-Neuve-et-Labrador, mais les femelles munies d’un collier tuées par les chasseurs sont incluses dans les données; depuis 2000-2001, le taux de survie a été inférieur à 80 % (moyenne de 55 %) toutes les années, sauf deux. Le taux de survie des femelles adultes a été estimé à 76 % pour la période 2013-2015 (gouvernement de Terre-Neuve-et-Labrador, données inédites).
Selon les données sur les mâles munis d’un collier émetteur recueillies de 2007 à 2012 dans la sous-population de la rivière aux Feuilles, le taux moyen de survie a été de 78 % (N = 135 années-mâles), puis est passé à 70 % en 2013-2014 et à 66 % en 2014-2015, mais a atteint 86 % en 2015-2016. De 2009 à 2015, le taux moyen de survie des mâles dans la sous-population de la rivière George a été de seulement 51 % (taux annuel de 31 à 64 %, N = 127 années-mâles) (Taillon et al., 2016; MFFP, données inédites).
Depuis de nombreuses années, les groupes de chasseurs des Cris, des Inuits et des Naskapis ont constaté une diminution du pourcentage de grands mâles, et ils considèrent que ce changement a une incidence considérable sur la sous-population de la rivière aux Feuilles (Smart, comm. pers., 2016). Les données de relevés ont confirmé que les deux sous-populations ont connu ce type de déclin au cours des dernières années, mais il semble que ce phénomène ait particulièrement touché la sous-population de la rivière George (Figure 8). Le pourcentage de mâles classés comme « grands » a diminué dans les deux sous-populations : il s’établissait à 10 à 20 % durant la période 1994-2006, mais à seulement 2 à 6 % à partir de 2008 (MFFP, données inédites). Ce pourcentage a semblé augmenter en 2012-2013 (Figure 8), mais il était tout de même de seulement 5 % en 2015 dans la sous-population de la rivière George. Selon les théories, ce déclin serait attribuable à la chasse excessive, à la sélection des grands mâles par les chasseurs sportifs et au rôle potentiel du Besnoitia tarandi (section Parasites) (MFFP, comm. pers., 2016; McCarthy, comm. pers., 2016).
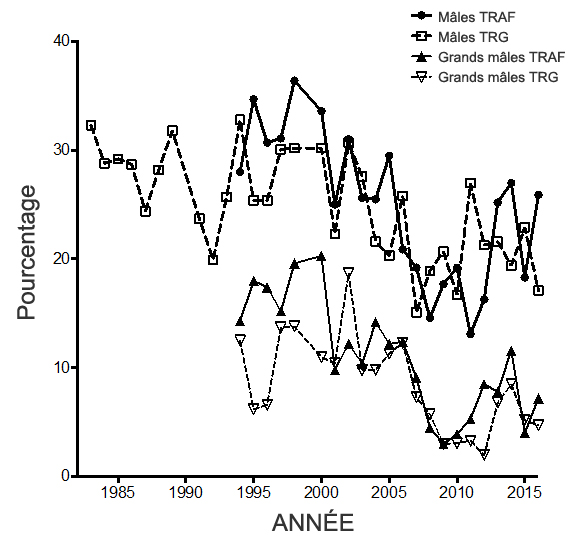
Description longue de la figure 8
Diagramme illustrant le pourcentage de mâles, toutes classes de taille confondues, et de grands mâles observés durant les dénombrements automnaux avec classification effectués dans les sous-populations de caribous migrateurs de l’Est de la rivière George et de la rivière aux Feuilles, du début des années 1980 au milieu des années 2010.
Chez les femelles d’un an munies d’un collier émetteur radio de 2005 à 2012, le taux de survie a été plus élevé dans la sous-population de la rivière aux Feuilles (77 %, N = 103) que dans la sous-population de la rivière George (63 %, N = 92). Le taux de survie des femelles d’un an n’a pas été consigné pour les autres populations de caribous migrateurs, mais le taux de survie des individus d’un an dans 16 populations d’ongulés (Gaillard et al., 2000) était d’en moyenne 87 %, ce qui donne à penser que le taux de survie des caribous femelles d’un an est faible, particulièrement dans la sous-population de la rivière George. Dans la sous-population de la rivière George, le taux de survie des femelles d’un an munies d’un collier émetteur radio a diminué au cours des dernières années et est passé de 82,5 % pour la période 2005-2008 (N = 40) à seulement 48 % pour la période 2009-2013 (N = 52). Le très faible taux de survie des individus d’un an doit être interprété à la lumière du très faible rapport faon/femelle observé au cours des récentes années (sauf en 2014) dans cette sous-population. Par exemple, selon les dénombrements effectués de 2010 à 2013, il y avait en moyenne 8,4 faons pour 100 femelles. Si on combine ces données au taux moyen de survie des femelles de un an mesuré de 2009 à 2012, le taux de recrutement des femelles de 2 ans aurait été d’au plus 4 %, ou 5 ou 6 fois inférieur taux de perte des femelles adultes (Figure 7). De plus, le taux de recrutement représente une surestimation, car il ne tient pas compte de la mortalité des faons au cours de leur premier hiver.
Les dénombrements avec classification réalisés à l’automne semblent indiquer que le taux de recrutement varie de façon considérable, mais ils montrent que le recrutement s’est récemment détérioré dans la sous-population de la rivière George (Figure 9). Il y avait 12 faons ou moins pour 100 femelles adultes de 2010 à 2013, puis ce nombre est passé à 27 en 2014 et à 34 en 2015, avant de diminuer en 2016. Depuis 2001, le taux de recrutement de faons dans la sous-population de la rivière aux Feuilles est généralement d’environ 34 faons pour 100 femelles adultes, mais ce taux a été beaucoup plus faible au cours de trois années (2004, 2007 et 2014), s’établissant à 14 à 17 faons pour 100 femelles, le taux le plus faible ayant été enregistré en 2014 (MFFP, données inédites, comm. pers. 2016) (Figure 9).

Description longue de la figure 9
Diagramme illustrant le ratio de faons pour 100 femelles adultes observé dans le cadre des dénombrements avec classification réalisés à l’automne dans les sous-populations de caribous migrateurs de l’Est de la rivière George et de la rivière aux Feuilles, du début des années 1980 au milieu des années 2010.
En Ontario et au Manitoba, le taux de survie des femelles adultes munies d’un collier émetteur radio a été estimé de 2009 à 2011 (Berglund et al., 2014). Ce taux allait de 72 à 96 % selon l’année et la région, mais il était inférieur à 85 % selon toutes les estimations pluriannuelles (Berglund et al., 2014). Le taux de recrutement de faons en Ontario et au Manitoba, estimé en fin d’hiver de 2009 à 2011, allait de 13,2 à 15,7 faons pour 100 femelles adultes (Berglund et al., 2014). Des taux de recrutement de faons légèrement plus élevés, soit de 12 à 26 faons pour 100 femelles, selon l’année et la région, ont été estimés dans le cadre de relevés des femelles munies d’un collier émetteur radio menés de février à mars de 2010 à 2012 et portant sur de plus petits échantillons (Berglund et al.,2014). Ces valeurs sont considérées comme inférieures au ratio 39:100 nécessaire au maintien d’une population stable (supposant que le taux de survie des femelles adultes est de 85 %), et ces résultats laissent croire que la population était en déclin. Toutefois, selon Berglund et al. (2014), ces taux représentent des estimations minimales, et aucun déclin n’a été établi. À l’heure actuelle, la population est considérée comme stable.
Population des monts torngat
Le taux de survie a été estimé de 2011 à 2013 d’après 35 individus des deux sexes suivis par satellite, pour un échantillon total de 47 années-individus. Le taux de survie moyen sur les trois années a été de 59,5 %. La taille de l’échantillon était insuffisante pour permettre l’estimation des taux de survie selon le sexe. Ce faible taux de survie indique clairement que la population connaît un déclin rapide. Malheureusement, on ne dispose d’aucune donnée sur le recrutement. Cependant, en mars 2014, les faons représentaient 17,2 % des individus observés (28 faons pour 100 femelles) (Couturier et Mitchell Foley, 2014).
Immigration de source externe
Les deux UD sont endémiques du Canada et sont isolées l’une de l’autre, de sorte qu’une immigration depuis des populations externes n’est pas possible.
Menaces et facteurs limitatifs
Les menaces sont présentées collectivement pour les deux UD, car plusieurs d’elles semblent semblables dans les deux UD; les différences sont toutefois signalées le cas échéant.
Facteurs limitatifs
Il est probable que les populations de caribous migrateurs sont principalement limitées par la disponibilité de nourriture en été sur de grandes échelles spatio-temporelles (Courturier et al., 1988; Bergerud et al., 2008; Manseau et al., 1996; Newton et al., 2014). Les populations de caribous peuvent être régulées par la disponibilité de lichens, car la biomasse de lichens prend plusieurs décennies à s’accumuler, et l’augmentation de la densité de caribous peut rapidement faire en sorte que la disponibilité de cette ressource devienne inférieure aux seuils nécessaires pour soutenir l’espèce (Messier et al., 1988; Crete et al., 1996). Les femelles de la sous-population de la rivière aux Feuilles sont plus petites que celles de la sous-population de la rivière George, probablement parce la nourriture dont elles disposent est de moindre qualité et moins abondante (Crête et Huot, 1993). Cette différence semble faire en sorte que le taux de croissance de la population est inférieur (Couturier et al., 2010). Les territoires où la nourriture est peu abondante peuvent être presque entièrement abandonnés, du moins durant quelques années. La présence de denses rassemblements dans certaines parties de l’aire de la sous-population du sud de la baie d’Hudson est associée à un déclin des plantes ligneuses, probablement causé par le broutage et le piétinement intensifs de la végétation (Manseau et al., 1996; Newton et al., 2014). Les déclins des effectifs coïncident souvent avec des rétrécissements de l’aire de répartition (Taillon et al., 2012a; Figure 3), la végétation des territoires abandonnés étant alors moins soumise aux effets de l’herbivorie et du piétinement. La végétation finit généralement par se rétablir dans les territoires abandonnés, et ceux-ci peuvent alors de nouveau soutenir les rassemblements de caribous, mais un tel rétablissement peut prendre des dizaines d’années (Crete et Doucet, 1998; Kumpula et al., 2011; Newton et al., 2014). De plus, la mortalité liée aux loups et à la chasse représente un important facteur limitatif (Bergerud, 2008). La disponibilité de la nourriture semble également être un facteur limitatif, du moins dans la sous-population de la rivière George, qui est celle des quatre sous-populations qui a fait l’objet des recherches les plus exhaustives (Hearn et al., 1990; Crete et al., 1996; données inédites des gouvernements de Terre-Neuve-et-Labrador et du Québec ainsi que de Caribou Ungava).
Menaces
Une évaluation a été réalisée au moyen du calculateur des menaces de l’Union internationale pour la conservation de la nature (UICN); l’impact global des menaces est considéré comme « très élevé à élevé » dans le cas de la population migratrice de l’Est, compte tenu d’une accumulation de menaces, mais principalement à cause des effets prévus de l’exploitation minière, des routes associées à cette activité et de l’amélioration de l’accès qu’elles permettront ainsi que ceux de la chasse, de l’augmentation des incendies et de la modification de la végétation associée aux changements climatiques (annexe 1). Ces menaces semblent plus élevées dans les sous-populations de l’est, qui comprennent la majeure partie de la population. L’impact global des menaces est considéré comme « élevé » dans le cas de la population des monts Torngat, compte tenu d’une accumulation de menaces, mais principalement à cause des effets prévus de la chasse et des répercussions potentielles des changements climatiques (annexe 2). Les catégories pour lesquelles il existe des préoccupations sont présentées même si leur impact est considéré comme inconnu ou négligeable, mais le manque de données limite la possibilité de quantifier la menace qu’elles représentent.
Exploitation de mines (uicn 3.2); impact négligeable pour la population des monts torngat, élevé à faible pour la population migratrice de l’est
Le caribou évite les zones minières en activité. Dans les Territoires du Nord-Ouest, on a observé que la présence des caribous migrateurs diminuait avec l’augmentation de la proximité de mines de diamants (Boulanger et al., 2012). Pour cette même sous-population, Johnson et al. (2005) ont signalé que les effets des activités minières sur la qualité de l’habitat étaient principalement observables après la mise bas; selon une modélisation des coefficients, les habitats de haute qualité ont diminué de 37 %, et les habitats de faible qualité ont augmenté de 84 %. À Terre-Neuve, Weir et al. (2007) ont observé que les caribous évitaient les zones situées dans un rayon de jusqu’à environ 6 km des sites miniers.
Une augmentation des répercussions de l’exploitation minière est prévue dans la partie est de l’aire de répartition de la population ME, et plusieurs projets hydroélectriques sont en cours. En plus de la construction de barrages, les projets hydroélectriques supposent l’inondation de vastes superficies dans l’habitat du caribou. Des recherches sont actuellement réalisées pour évaluer les effets cumulatifs de ces projets sur l’utilisation de l’espace par le caribou et le taux de survie de celui-ci ainsi que les répercussions des grands réservoirs hydroélectriques sur l’utilisation de l’espace par le caribou (Caribou Ungava, données inédites). De plus, selon les CTA concernant la population des MT, les activités de développement représentent une menace (Wilson et al., 2014). L’exploration minière s’est accentuée dans le nord du Québec au cours des dernières décennies (gouvernement du Québec, 2014). Dans l’aire de répartition de la sous-population de la rivière aux Feuilles, trois mines (Raglan, Nunavik Nickel et Éléonore) étaient en activité en 2015, et un projet de mise en valeur du minerai de fer est actuellement évalué (Hopes Advance Bay). Au Québec, quatre projets miniers sont en cours ou ont été proposés dans l’aire de répartition de la sous-population de la rivière George (Eldor, projet du lac Otelnuk, projet taconite du gisement KéMag, au nord de Schefferville, lac Brisson-lac Strange). Un autre projet de mine de fer est en cours près de Schefferville (DSO, New Millennium Iron Corp. et Tata Steel Minerals) (gouvernement du Québec, 2014). Ces activités minières pourraient avoir des répercussions sur l’accès aux aires de mise bas et d’estivage, et certains projets se trouvent sur les voies migratoires du caribou. L’expansion minière dans l’aire de répartition des sous-populations de l’ouest devrait être mineure, vu l’accès limité à cette région et l’absence de grands projets. L’impact de cette menace a été évalué comme « élevé à faible » pour la population ME, à cause de l’incertitude relative à la concrétisation du développement. L’exploitation minière est considérée comme une menace négligeable pour la population des MT, car environ 50 % de l’aire de répartition de celle-ci se trouve dans des aires protégées, et les activités minières sont mineures dans le reste de cette aire.
éléments linéaires (routes, lignes de services publics; uicn 4.1, 4.2); impact non calculé pour la population des monts torngat, faible pour la population migratrice de l’est
La mortalité routière ne constitue pas une menace importante, car il y a très peu de routes dans les aires de répartition des deux UD. Dans les aires d’hivernage, les éléments linéaires, comme les routes, les lignes électriques et les lignes sismiques, entraînent une perte de fonctionnalité de l’habitat, car le caribou semble les éviter (voir Polfus et al., 2011), ainsi qu’une hausse des risques de prédation (Latham et al., 2011). Les zones desservies par de nouvelles routes deviennent accessibles aux véhicules motorisés, ce qui entraîne des perturbations additionnelles et une présence accrue de chasseurs dans les secteurs où la chasse au caribou est permise (Boulanger et al., 2012). C’est particulièrement vrai en hiver, quand la majeure partie de la récolte de caribous dépend de l’accès par motoneige. Cet accès augmentera probablement avec l’aménagement de nouvelles routes, qui permettront la création de nouvelles aires de départ pour les motoneiges. De plus, les lignes hydroélectriques facilitent l’accès par motoneige à des zones auparavant isolées.
Il n’existe aucune projection fiable de la densité routière dans l’aire de répartition de la population ME. De nombreuses routes sont associées à des exploitations minières et aux activités forestières, mais les projets particuliers dépendent de facteurs économiques, et le moment de leur réalisation est difficile à prédire. Toutefois, on s’attend à ce qu’il y ait une croissance des activités minières et forestières dans la majeure partie de la portion est de la population ME. Dans les zones sensibles de l’habitat du caribou, comme les aires de mise bas et les voies migratoires fortement utilisées, les activités minières et les routes qui leur sont associées pourraient avoir des effets négatifs sur les caribous migrateurs. Il y a plusieurs projets de routes accessibles tout l’hiver associés à l’exploitation minière. La mine projetée au lac Brisson et la route qui la reliera à la baie Voisey couperaient le principal corridor de migration de la sous-population de la rivière George et chevaucheraient la portion sud historique des aires de mise bas. Un autre facteur laissant croire que l’aire de répartition de la population ME pourrait subir des perturbations est le Plan Nord, projet d’investissement de 80 milliards de dollars dans les routes, les aéroports, les exploitations minières et les activités forestières dans le centre et le nord du Québec (Northern Miner, 2014). Il n’y a aucun projet de construction routière connu dans la région des MT.
Chasse (uicn 5.1); impact élevé pour la population des monts torngat, moyen pour la population migratrice de l’est
La récolte par les humains est une source connue de mortalité dans chacune des sous-populations, mais le niveau de récolte est en grande partie non quantifié dans certaines sous-populations, car la déclaration des prises est très limitée (Hayes et al., 2003; Courtois et al., 2007). La récolte est une question controversée et complexe; la communication de données sur les récoltes entre les gouvernements peut être problématique pour les gestionnaires autochtones (Smart, comm. pers., 2016). Les Autochtones ont des droits prioritaires pour l’utilisation des caribous migrateurs à des fins de subsistance et pour d’autres utilisations traditionnelles. Au Québec, la majeure partie du territoire où on trouve le caribou migrateur est régi par la Convention de la Baie-James et du Nord québécois et par la Convention du Nord-Est québécois, qui prescrivent le principe de la priorité de l’exploitation par les Autochtones, conformément au principe de la conservation (Smart, comm. pers., 2016).
En 2013, les Autochtones de l’est du Québec et du Labrador, notamment ceux du Nunatsiavut, ont mis sur pied la Table ronde autochtone du caribou de la péninsule Ungava. Les autorités inuites du Nunatsiavut (nord du Labrador) et du Nunatukavut (sud du Labrador) ont demandé à leurs membres de ne pas chasser le caribou, pour une période respective de deux ans et de un an. Cette demande n’est pas contraignante, et la sous-population de la rivière George continue de faire l’objet d’un degré inconnu de récolte au Québec et au Labrador. La nation innue considère que la chasse pratiquée par ses membres a des effets négligeables, et elle continue de récolter le caribou (CBC News, 2016).
La chasse représente actuellement une cause de mortalité importante dans la sous-population de la rivière George (gouvernement de Terre-Neuve-et-Labrador, données inédites). La chasse sportive visant la sous-population de la rivière George est interdite depuis 2012 au Québec, et depuis 2013 au Labrador. En 2013, la province de Terre-Neuve-et-Labrador a décrété un moratoire de cinq ans sur la chasse visant la sous-population de la rivière George au Labrador, y compris pour les Autochtones, en se fondant sur la faible abondance de celle-ci et sur les données concernant les taux de récolte. À la suite d’un examen réalisé en 2015, la province a conclu que le moratoire devait être maintenu (gouvernement de Terre-Neuve-et-Labrador, 2016). La chasse sportive s’est poursuivie dans la sous-population de la rivière aux Feuilles (au Québec), mais le nombre de permis accordés a été fortement réduit. Par exemple, supposant que le taux de succès des chasseurs est de 80 %, la récolte sportive sera d’environ 2 100 individus dans la sous-population de la rivière aux Feuilles au cours de la saison 2016-2017, ce qui représente une diminution de 89 % par rapport aux 18 400 individus récoltés par les chasseurs sportifs en 2004-2005 (Brodeur, comm. pers., 2015). En avril 2017, le gouvernement du Québec a annoncé qu’il mettra fin à la chasse sportive dans la sous-population de la rivière aux Feuilles en février 2018 (MFFP, 2017). La notion de chasse sportive diffère entre le Québec et Terre-Neuve-et-Labrador : au Québec, la chasse sportive fait référence à toute récolte effectuée par des non-Autochtones, alors qu’au Labrador, les récoltes effectuées par les non-Autochtones résidents de la province sont considérées comme une chasse de subsistance, ou comme une récolte par des résidents (Moores, comm. pers., 2016).
Les Cris, les Inuits et les Naskapis du nord du Québec ont fait des pressions en 2010 pour que la chasse sportive soit complètement interdite dans les sous-populations de la rivière Georges et de la rivière aux Feuilles. Ces groupes estiment que la chasse sportive devrait déjà avoir été interdite et que le délai s’étant écoulé avant de cette interdiction a contribué au déclin de la sous-population de la rivière George. Ils considèrent également que le maintien de la chasse sportive dans la sous-population de la rivière aux Feuilles est la cause du déclin continu de celle-ci (Smart, comm. pers., 2016).
La sous-population du cap Churchill fait l’objet d’une chasse de subsistance par les Autochtones ainsi que d’une chasse sportive limitée, mais les taux de récolte sont inconnus, en partie parce qu’il est difficile de distinguer les caribous de cette sous-population de ceux de la sous-population de Qamanirjuaq de (UD 3) dans les statistiques, mais aussi parce que le taux de réponse aux questionnaires volontaires concernant le succès de chasse est faible (Elliot, 1998; Abraham et al., 2011).
La portion de la sous-population du sud de la baie d’Hudson qui se trouve au Manitoba est exposée à la chasse sportive ainsi qu’à la chasse de subsistance. La portion qui se trouve en Ontario est exposée à la chasse de subsistance; la chasse sportive de l’espèce est interdite en Ontario depuis 1929 (OMNR, 2008). Dans ces deux provinces, l’importance de la récolte de subsistance est inconnue. En Ontario, les récoltes ont été évaluées à environ 400 à 500 caribous par année dans les années 1980, et à plus de 700 caribous par année à la fin des années 1980 et durant les années 1990, et elles ont apparemment été en croissance au moins jusqu’à 2011 (Abraham et al., 2011). Aucune donnée plus récente n’est disponible.
Dans le cas de la population des MT, selon certaines CTA, la chasse excessive à des fins de subsistance a été le principal facteur de déclin (Wilson et al., 2014). Toutefois, ce point de vue différait entre le Nunavik, où 27 % des répondants autochtones ont indiqué que la chasse excessive était la principale menace pour la sous-population des MT, et le Nunatsiavut, où 72 % ont choisi cette réponse (Wilson et al., 2014). La sous-population des MT ne fait l’objet d’aucune chasse sportive.
La chasse au caribou est facilitée par le réseau routier et les autres éléments linéaires ainsi que par les véhicules tout-terrain, qui permettent l’accès à des zones autrefois inaccessibles. Dans l’aire de répartition de la sous-population du sud de la baie d’Hudson, l’utilisation des VTT est en grande partie associée à la chasse, plutôt qu’à des activités récréatives, et il est donc difficile de séparer les effets des VTT des risques de mortalité causée par les humains. Newton et al. (2015) ont observé que le caribou se tient à 10 à 14 km des zones où l’utilisation des VTT est intensive (selon la présence de traces de VTT durables) dans les zones côtières de l’est et de l’ouest de l’aire d’estivage, même si ces zones renfermaient des aliments nutritifs.
En résumé, la récolte non durable (excessive) par les humains représente une menace connue pour la population ME et la population des MT. Il semble que certaines questions sociopolitiques qui séparent les gouvernements feront en sorte qu’un certain degré de récolte sera maintenu. L’impact de la récolte s’accentuera à mesure que les populations de caribous diminueront.
Activités récréatives (uicn 6.1); impact négligeable pour les deux populations
Les activités récréatives, notamment la motoneige, la randonnée pédestre, le ski et l’utilisation de chalets, peuvent entraîner un déplacement des caribous, forcer ceux-ci à utiliser des habitats de moindre qualité ou modifier leur comportement (Duchesne et al., 2000; Mahant, 2013). Chacune de ces réactions peut avoir des répercussions sur l’état physique des individus, les taux de recrutement et de survie ainsi que la vulnérabilité aux prédateurs (Bergerud, 1988; Vistnes et Nelleman, 2008; Bowman et al., 2010). Vu l’éloignement des aires de répartition de la population ME et de la population des MT, les activités récréatives y sont relativement peu fréquentes. Toutefois, selon les CTA, le bruit et les activités récréatives (p. ex. circulation accrue de motoneiges) se classent au troisième rang des menaces pesant sur la sous-population des MT (Wilson et al., 2014). On ignore quelles sont les activités récréatives associées aux nouvelles aires protégées (section Protection et propriété de l’habitat) crées dans l’aire de répartition de la population des MT et dans les sous-populations de l’est de l’UD des caribous migrateurs de l’Est.
Incendies (uicn 7.1); impact non calculé pour la population des monts torngat, moyen à faible pour la population migratrice de l’est
Les incendies représentent une préoccupation dans l’aire d’hivernage du caribou ME, mais ils ont actuellement un impact limité sur la population des MT. Les changements climatiques semblent avoir une incidence sur l’écologie des feux; les CTA indiquent qu’il y a eu un assèchement des terres et une augmentation de la fréquence et de la gravité des feux de forêt, ce qui a réduit l’aire d’hivernage du caribou (Northern River Basins Study, 1996, citée dans COSEWIC, 2012, p. 99).
Les incendies ont des effets complexes sur l’occupation du caribou dans son aire d’hivernage (Schaefer et Pruitt, 1991). Les incendies réduisent initialement les habitats forestiers dont dispose le caribou, car ils entraînent la perte de peuplements conifériens matures et de lichens, en plus de faire obstacle aux déplacements (Thomas et Gray, 2002; Dalerum et al., 2007; Dzus et al., 2010). La période de régénération du lichen après les incendies a une incidence sur le temps nécessaire pour que les sites conviennent de nouveau au caribou; Morneau et Payette (1989) ont estimé que les espèces de lichen consommées par le caribou nécessiteraient 30 à 40 ans pour se rétablir après un incendie, et, dans des forêts des Territoires du Nord-Ouest situées à proximité de la frontière de la Saskatchewan, la biomasse de lichens utilisés par le caribou, comme les espèces du genre Cladina et le Cetraria nivalis, s’est stabilisée 40 à 60 ans après un incendie (Thomas et al., 1995).
Le cycle des feux dans la toundra arbustive qui constitue l’aire d’estivage de la sous-population de la rivière George est estimé à 9 320 ans (Payette et al., 1989); toute augmentation de la fréquence des incendies pourrait entraîner une diminution de la toundra contenant des lichens. Dans les régions boisées de l’est de l’aire de répartition de la population ME, la fréquence des incendies est d’environ 111 à 139 ans dans les forêts d’épinette noire à sols xériques de l’ouest et du centre du Québec, mais elle est d’environ 500 ans dans les forêts d’épinette noire à sols mésiques de l’est du Québec et du sud-est du Labrador (Bergeron et al., 2001; Bergeron et Le Goff, 2005). Selon les prédictions concernant l’impact des incendies dans le futur, la gravité des incendies augmentera de façon considérable dans certaines parties du centre et de l’ouest de l’Ontario (Colombo et al., 1998) et sera multipliée par sept dans le centre du Québec (Le Goff et al. 2009), et des effets mineurs seront observés dans les forêts boréales de l’Est (Bergeron et al., 2001).
Espèces indigènes problématiques (uicn 8.2) – prédation; impact inconnu pour la population des monts torngat, faible pour la population migratrice de l’est, car, malgré l’inquiétude croissante, l’absence de quantifications de l’impact entraîne de l’incertitude.
Selon les CTA, les populations d’ours noir ont augmenté au cours des dernières années, peut-être en raison des changements climatiques (Wilson et al., 2014). La prédation des jeunes faons par les ours peut être considérable dans les aires de mise bas (Leclerc et al., 2014), et elle se poursuit même après d’importantes diminutions de la population chez le caribou migrateur, car celui-ci continue de se rassembler dans ces aires. La prédation par l’ours noir pourrait aujourd’hui avoir une incidence importante sur les taux de survie des faons dans la sous-population de la rivière George (Caribou Ungava, données inédites).
De plus, les CTA indiquent que la présence de l’orignal a augmenté dans le sud de l’aire de répartition de la population des MT, ce qui pourrait accroître la concurrence apparente avec le Caribou (Wilson et al., 2014). Cette augmentation pourrait être attribuable à l’adoucissement des hivers associé aux changements climatiques. L’augmentation du nombre d’orignaux entraîne une hausse des taux de prédation du caribou par les loups.
Le bœuf musqué est un autre grand herbivore dont l’aire de répartition chevauche celle de la population ME et de la population des MT dans le nord du Québec, mais il est présent en faible densité et a probablement un impact limité sur la dynamique des populations de loups.
Espèces indigènes problématiques (uicn 8.2) – parasites et agents pathogènes; impact non calculé pour la population des monts torngat, faible pour la population migratrice de l’est, car, malgré l’inquiétude croissante, l’absence de données entraîne de l’incertitude.
Chez le caribou, les parasites peuvent influer sur la dynamique des populations et avoir une incidence sur la qualité et la salubrité de la viande consommée par les humains (Kutz et al., 2009). On s’attend à ce que la présence de parasites et d’agents pathogènes augmente dans l’Arctique avec le réchauffement climatique (Kutz et al., 2004). L’évolution de la répartition d’autres cervidés pourrait aussi avoir des effets négatifs, parce que ceux-ci constituent des proies pour les loups, mais aussi parce qu’ils sont des vecteurs de maladies (Pitt et Jordan, 1994; Dumont et Crête, 1996; Racey et Armstrong, 2000). Le ver des méninges (Parelaphostrongylus tenuis), qui n’est pas létal chez le cerf de Virginie (Odocoileus virginianus), peut être transmis au caribou et à l’orignal par l’entremise de gastropodes présents sur la végétation et peut causer la mort des individus chez ces espèces (Anderson et Strelive, 1968). Il est présent dans l’est du pays, depuis la Saskatchewan (Wasel et al., 2003). Les tentatives de réintroduction du caribou dans la portion sud de son aire de répartition historique ont échoué, probablement à cause de la présence de cerfs infectés (Bergerud et Mercer, 1989). Cette menace pourrait toucher les sous-populations de caribous du nord de l’Ontario dans le futur.
L’orignal peut être gravement affecté par la tique d’hiver (Dermacentor albipictus), et le caribou est également un hôte de ce parasite (Samuel, 2004). Selon Kutz et al., (2009) l’aire de répartition de la tique d’hiver est en expansion dans le Nord canadien, peut-être à cause du réchauffement des conditions printanières (Drew et Samuel, 1986).
Le Besnoitia est apparu comme agent pathogène dans les sous-populations de la rivière George et de la rivière aux Feuilles en 2007-2009 (Ducrocq et al., 2013). Cet organisme pourrait être envahissant dans le système, et il est possible que population n’avait jamais été en contact avec lui auparavant. Il a été détecté chez environ la moitié des individus échantillonnés en 2015 (MFFP, données inédites). Le Besnoitia a été trouvé dans 80 % des échantillons de peau du métatarse récoltés dans la sous-population de la rivière George en 2012. Aucune différence significative n’a été observée entre les mâles et les femelles en ce qui a trait au taux ou au degré d’infection (gouvernement de Terre-Neuve-et-Labrador, données inédites). La Division de la faune de Terre-Neuve-et-Labrador étudie actuellement les possibles effets sublétaux du Besnoitia chez le caribou. Au Québec, un examen visuel des yeux a révélé que le Besnoitia était présent chez environ 40 % des 275 caribous capturés pour l’installation d’un collier émetteur radio dans la sous-population de la rivière aux Feuilles durant la période 2010-2015. Selon les activités de suivi de la sous-population de la rivière George menées par les gouvernements du Québec et de Terre-Neuve-et-Labrador, la prévalence était de 53 % (n = 58 individus) en 2010-2012, et de 15 % en 2013-2014 (échantillon de 48 individus). Le Besnoitia pourrait réduire la mobilité des individus, y compris causer l’adoption de la position couchée, envahir les tissus testiculaires et probablement réduire la fertilité des individus (Kutz, comm. pers., 2016).
Pollution (uicn 9.2, 9.5); impact inconnu pour les deux populations, car, malgré l’inquiétude croissante, l’absence de données entraîne de l’incertitude.
Les autochtones qui utilisent le caribou ont fait part de leurs préoccupations quant aux possibles effets négatifs des polluants et autres contaminants environnementaux sur l’espèce (COSEWIC, 2012). Selon les études sur les concentrations de contaminants dans les tissus des caribous, ces concentrations ne représentent pas un risque pour la survie de l’espèce (par exemple au Yukon, voir Gamberg, 2004). Cependant, dans le cas des caribous ME et des caribous des MT, les recherches se sont limitées à l’évaluation des concentrations de métaux lourds dans la sous-population de la rivière aux Feuilles en 2007-2008 (Kwan, 2011). Il a été recommandé de mener d’autres recherches vu les préoccupations soulevées par les contaminants atmosphériques tels que le mercure et de césium, qui pourraient avoir des effets sur la santé des caribous (Moores, comm. pers., 2016).
Changements climatiques - déplacement et altération de l’habitat (uicn 11,1); impact inconnu pour les deux populations, mais les effets futurs soulèvent des inquiétudes considérables; l’impact devrait être considérable après trois générations.
La température atmosphérique moyenne dans les monts Torngat a augmenté d’environ 2 °C depuis le début des années 1990, et on prévoit qu’elle augmentera de 2 à 4 °C supplémentaires d’ici 2050 (Allard et Lemay, 2012; Finnis, 2013; Way et Viau, 2014). En outre, la durée de la saison de végétation devrait augmenter d’environ 20 jours d’ici 2050 (Allard et Leamy, 2012), et le suivi par satellite montre que ce changement est déjà amorcé (He et al., 2008; Pouliot et al., 2009).
Les changements climatiques pourraient avoir des effets directs sur le caribou, en touchant sa thermorégulation, ainsi que des effets indirects, en modifiant son habitat. En outre, de plus en plus de données indiquent qu’ils ont des effets sur la diversité des parasites, des virus, des bactéries et des autres agents pathogènes et qu’ils entraînent des modifications des interactions hôtes-parasites/pathogènes (Kutz et al., 2014). Les printemps hâtifs peuvent désynchroniser le pic d’abondance de la végétation et la mise bas, ce qui aurait des conséquences négatives sur le caribou. Au Groenland, les taux de production de faons et de survie des faons diminuent lorsque la période des naissances ne coïncide pas avec l’augmentation de la végétation, phénomène connu sous le nom de « décalage trophique » (Post et Forchhammer, 2008). De plus, un réchauffement du climat pourrait entraîner une augmentation du harcèlement des caribous par les insectes piqueurs et parasites (Toupin et al., 1996; Weladji et al., 2003). Ces insectes ont des effets négatifs sur le caribou et participent au déclin de l’efficacité de la recherche de nourriture et à la détérioration de la santé des individus (Russell et al., 1993).
Dans les compilations des CTA, les changements climatiques ont été considérés comme une menace pour les caribous des MT (Wilson et al., 2014). D’ici 50 ans, les territoires convenant en hiver, au printemps et en été aux caribous de la sous-population de la rivière George devraient se limiter à la portion nord-est de la péninsule Québec-Labrador, mais toute la péninsule pourrait continuer de convenir à l’espèce durant l’automne (Sharma et al., 2009). Selon une modélisation, les modifications touchant les dates de dégel et de gel ainsi que l’étendue de la glace auront une incidence sur les déplacements des caribous de la sous-population de la rivière aux Feuilles; elles entraîneront une hausse des distances parcourues et, par conséquent, de l’énergie dépensée durant les migrations printanières et automnales (Leblond et al., 2016).
Les changements climatiques entraînent une modification de l’habitat, principalement une invasion de la toundra par les arbustes et les épinettes (Picea spp.) à des latitudes nordiques (Sturm et al., 2001, 2005; Elmendorf et al., 2012; Tremblay et al., 2012). Les CTA indiquent qu’il y a eu une augmentation des arbustes dans les monts Torngat (Parks Canada Agency, 2008; Fraser et al., 2011; Wilson et al., 2014). De plus, une analyse des images satellites montre que la quantité de milieux dominés par les arbustes dans le centre des monts Torngat a augmenté par six de 1985 à 2014 (Fraser et al., 2011; Tremblay et al., 2012; Quirouette, 2015; Quirouette et Zorn, 2015; Figure 10). L’expansion des arbustes est observée dans la majeure partie de l’Arctique (Myers-Smith et al., 2011, 2015), mais ce changement se produit beaucoup plus rapidement dans les monts Torngat (Fraser et al., 2011; Tremblay et al., 2012). Ce phénomène pourrait être attribuable à une réponse fonctionnelle additive ou interactive des arbustes existants à l’adoucissement du climat, combinée à une importante diminution de la pression de broutage associée au déclin de la population des MT (Couturier et al., 2014; Christie et al., 2015; Wilson et al., 2014).

Description longue de la figure 10
Deux photos illustrant l’expansion de la couverture arbustive sur une période de 20 ans (1991 et 2011) dans le parc national du Canada des Monts-Torngat.
On craint que les végétaux et lichens de la toundra soient supplantés par les arbustes et que les sources de nourriture classiques du caribou se trouvent ainsi réduites (Meyers-Smith et al., 2011). Le nombre d’espèces d’arbustes consommées par le caribou varie. Le saule (Salix sp.) représentait 9 % du contenu ruminal des individus étudiés par Manseau et al. (1996); ceux-ci signalent toutefois que cette proportion pourrait être anormale parce que les sources de nourriture étaient peu abondantes en raison de la forte densité de caribous observée durant des années. Le caribou ne consomme pas les épinettes. Dans l’ensemble, l’expansion des arbustes pourrait être positive pour le caribou à court terme, car elle représenterait une augmentation de l’abondance de la nourriture, mais ses effets à long terme sur l’utilisation de l’habitat sont inconnus. Les caribous de la sous-population du sud de la baie d’Hudson évitaient les zones présentant des arbustes hauts durant et après la mise bas (section Habitat).
Le chevauchement entre l’aire de répartition du caribou et celle d’autres cervidés s’accentue avec le réchauffement climatique (Vors et Boyce, 2009), ce qui pourrait accroître la transmission interspécifique de maladies et de parasites. La présence accrue d’orignaux a été associée à une augmentation du risque de prédation pour le caribou et est considérée comme une grave menace pour le caribou non migrateur (UD 6; COSEWIC, 2015). On ignore quel est l’effet des orignaux sur les taux de prédation des caribous ME et des MT par les loups, mais il est probable que le nombre d’orignaux augmentera à la limite sud de l’aire de répartition du caribou ME, qui est davantage boisée que le reste de l’aire, ce qui pourrait accentuer les effets de la prédation sur le caribou.
En général, on prévoit que le réchauffement climatique entraînera une diminution de 89 % de l’habitat du caribou en Amérique du Nord d’ici 2080 (Yannic et al., 2014). L’impact de cette menace est considéré comme inconnu dans le cas des deux populations, car les répercussions prévues pourraient ne pas se produire au cours des 3 prochaines générations.
Nombre de localités
Population migratrice de l’est
Il y a probablement de nombreuses localités. Bien que les quatre sous-populations utilisent des aires de mise bas précises, la mortalité associée aux humains et les changements climatiques, qui sont les principales menaces, ont une intensité et des répercussions variables sur le vaste territoire de plus de 1,5 million de kilomètres carrés utilisé par cette population. De plus, des divisions ont été signalées au sein des sous-populations. Dans la sous-population du sud de la baie d’Hudson, Newton et al. (2015) ont délimité trois sous-groupes d’après leurs déplacements, et la mortalité causée par les humains varie probablement entre ceux-ci. De plus, les effets des VTT diffèrent entre ces sous-groupes (Newton et al., 2015).
Population des monts torngat
Il y a probablement de nombreuses localités. On considère que les caribous des MT forment une seule population, mais la menace la plus probable qui pèse sur celle-ci est la récolte excessive, et l’intensité de cette récolte varie dans les différentes parties de la très grande aire de répartition (28 000 km2) de cette population.
Protection, statuts et classements
Statuts et protection juridiques
Les deux unités désignables faisant l’objet du présent rapport sont limitées au Canada. Le COSEPAC a évalué la situation du caribou ME (en voie de disparition) en avril 2017, et la situation du caribou des MT (en voie de disparition) en novembre 2016. Au Québec, aucune des deux populations n’est désignée « menacée » ou « vulnérable » aux termes de la Loi sur les espèces menacées ou vulnérables (RLRQ, c E-12.01) (LEMV), mais elles sont protégées par la Loi sur la conservation et la mise en valeur de la faune (RLRQ, c. C - 61,1) (LCMVF). Aux termes de l’article 26 de la LCMVF, nul ne peut déranger, détruire ou endommager le nid ou les œufs d’un animal. Il est également interdit de capturer, de chasser et/ou de garder en captivité toute espèce indigène au Québec. Des lois semblables protègent le caribou en Ontario et à Terre-Neuve-et-Labrador.
Statuts et classements non juridiques
À l’échelle mondiale, l’UICN avait classé le caribou (Rangifer tarandus) dans la catégorie « préoccupation mineure » en 2008, mais l’a reclassé dans la catégorie « vulnérable » en 2016, car des déclins démographiques ont été signalés pour de nombreuses populations dans le monde (Vors et Boyce, 2009; Gunn, 2016). Le caribou n’a pas été classé à l’échelle des UD du COSEPAC, et les classements par province peuvent inclure plusieurs UD. Certaines sous-populations ont été classées, notamment celle de la rivière George (S5, par Terre -Neuve-et-Labrador), mais ce classement ne reflète pas les récents déclins de cette population, et dans l’ébauche du rapport de situation (2015) l’ensemble des caribous au Labrador avait été classé S1S2 (Moores, comm. pers., 2016).
Protection et propriété de l’habitat
Population migratrice de l’est
Dans l’est de l’aire de répartition de la population ME, le caribou se rencontre presque exclusivement sur des terres publiques et sur des terres inuites, cries et naskapies appartenant aux catégories 1 à 3 selon la Convention de la Baie-James et du Nord québécois, dans le nord du Québec. Au Labrador, l’aire du caribou occupe des terres de la Couronne ainsi que des terres qui appartiennent ou sont à l’usage exclusif des Inuits dans la région du règlement des Inuit du Labrador et d’autres secteurs visés par des revendications territoriales. D’autres revendications territoriales de la nation innue sont en instance dans la partie centrale de l’aire de répartition de la sous-population de la rivière George. Au Québec, les sous-populations de la rivière George et de la rivière aux Feuilles jouissent d’une certaine protection dans les parties de leurs aires de mise bas qui sont situées dans des habitats fauniques reconnus sur le plan juridique, où les perturbations sont minimisées durant la période de mise bas. Dans ces habitats fauniques, les activités qui pourraient avoir une incidence sur l’habitat du caribou sont interdites du 15 mai au 31 juillet (Québec Government, 2011). Il est toutefois possible d’avoir accès aux habitats fauniques et d’y mener des activités durant la période de protection si on obtient un permis délivré par le gouvernement du Québec. L’efficacité de ces restrictions temporelles pour favoriser le rétablissement et la persistance du caribou n’a pas été évaluée. Ces habitats fauniques sont protégés aux termes du Règlement sur les habitats fauniques (L.R.Q., c. C-61.1 r18) et du chapitre IV.1 de la Loi sur la conservation et la mise en valeur de la faune (L.R.Q., c. C-61.1) (Québec Government, 2011). La sous-population de la rivière George se déplace au fil des saisons entre des territoires relevant de trois compétences (Québec, Terre-Neuve-et-Labrador et région visée par les revendications territoriales du Nunatsiavut; Couturier et al., 2010), et les aires de mise bas ne font l’objet d’aucune protection juridique au Labrador et au Nunatsiavut. Les exigences en matière de protection de l’habitat nécessaires pour appuyer le rétablissement et la persistance du caribou ME sont conjointement évaluées par les gouvernements de Terre-Neuve-et-Labrador et du Québec, dans le cadre d’activités visant à créer des plans de gestion à long terme pour l’espèce.
Au Québec, certaines zones de l’aire d’estivage de la sous-population de la rivière aux Feuilles sont protégées dans des parcs provinciaux, dont le parc national des Pingualuit (1 134 km2) et le parc national Tursujuq (26 107 km2) ainsi que trois parcs proposés (Baie-aux-Feuilles, Monts-de-Puvirnituq, Cap-Wolstenholme, supercifies combinées de 13 378 km2). De plus, certaines parties de l’aire d’estivage et des voies migratoires de la sous-population de la rivière George sont protégées dans le parc national Kuururjuaq (4 460 km2). Le parc national Ulittaniujalik a été créé en 2016 dans l’aire de répartition de la sous-population de la rivière George. La chasse est interdite aux non-Autochtones dans ces aires protégées.
L’aire de répartition de la sous-population du cap Churchill comprend le parc national Wapusk (≈ 10 700 km2), au Manitoba, qui protège près de 50 % de cette aire contre l’extraction des ressources. L’extrémité sud du parc national Wapusk protège également une partie de l’aire de la sous-population du sud de la baie d’Hudson. La zone qui s’étend de Fort Severn jusqu’au cap Henrietta Maria vers le sud est protégée par le parc provincial Polar Bear (≈ 23 300 km2), en Ontario. Certaines parties des aires de mise bas jouissent d’une protection juridique dans l’aire de gestion de la faune Kaskatamangan (≈ 2 600 km2) (Abraham et al., 2011). Dans l’ensemble, environ 50 % de la portion côtière (jusqu’à 50 km à l’intérieur des terres) de l’aire de répartition de la sous-population du sud de la baie d’Hudson sont protégés contre l’extraction des ressources.
Population des monts torngat
Environ 50 % de l’aire de répartition de la population des MT se trouve dans le parc national du Canada des monts Torngat, du côté du Nunatsiavut, et dans le parc national Kuururjuaq (parc provincial), du côté du Québec. La récolte est autorisée aux Autochtones dans ces aires protégées, mais elle est interdite à des fins industrielles ou commerciales.
Remerciements et experts contactés
Les rédacteurs remercient Environnement Canada d’avoir financé la préparation du présent rapport de situation. Les membres du Sous-comité de spécialistes des mammifères terrestres et du Sous-comité des CTA du COSEPAC ainsi que les nombreux réviseurs des provinces et des territoires ont fourni de précieux commentaires, en particulier Vicki Trim et Vincent Brodeur. Les rédacteurs du rapport remercient Caroline Hins, pour l’aide qu’elle a fournie pour l’analyse documentaire, et Kaitlin Wilson, pour ses analyses des CTA. Ils remercient également les personnes ci-dessous pour les renseignements et les commentaires qu’elles ont fournis.
Liste des experts contactés
Nom Affiliation
Vicky Trim ministère du Développement durable du Manitoba
William Watkins ministère des Ressources naturelles du Manitoba
Dennis Brannen Direction de la faune, ministère du Développement durable du Manitoba
Michael Oldham ministère des Richesses naturelles et des Forêts de l’Ontario
Bruce Pond ministère des Richesses naturelles et des Forêts de l’Ontario
Darren Elder ministère des Richesses naturelles et des Forêts de l’Ontario
Ken Abraham biologiste du caribou (retraité), ministère des Richesses naturelles de l’Ontario
Gerry Racey ministère des Richesses naturelles et des Forêts de l’Ontario
Vivian Brownell ministère des Richesses naturelles et des Forêts de l’Ontario
Mark Basterfield Université Trent, Ontario
Serge Couturier biologiste du caribou (retraité), expert-conseil
Jennifer Mitchell Foley Torngat Wildlife, Plants and Fisheries Secretariat
Isabelle Gauthier ministère de Forêts, de la Faune et des Parcs du Québec
Julien Mainguy ministère de Forêts, de la Faune et des Parcs du Québec
Annie Paquet ministère de Forêts, de la Faune et des Parcs du Québec
Joelle Taillon ministère de Forêts, de la Faune et des Parcs du Québec
Vincent Brodeur ministère de Forêts, de la Faune et des Parcs du Québec
Alexandre Rasiulis Université Laval, Québec
Mael Le Corre Université Laval, Québec
Roderick Pachano président, Conseil de gestion des ressources fauniques de la région marine d’Eeyou
Miles Smart secrétaire général, Comité conjoint de chasse, de pêche et de piégeage
Isabelle Schmelzer Division de la faune, Terre-Neuve-et-Labrador
John Pisapio Division de la faune, Terre-Neuve-et-Labrador
John Blake Division de la faune, Terre-Neuve-et-Labrador
Sara McCarthy Division de la faune, Terre-Neuve-et-Labrador
Shelley Moores Division de la faune, Terre-Neuve-et-Labrador
Groupe de travail Comité conjoint de chasse, de pêche et de piégeage
Jamie Snook Torngat Wildlife, Plants and Fisheries Secretariat
Gilles Falardeau Environnement et Changement climatique Canada
Stéphane Légaré Environnement et Changement climatique Canada
Robert Anderson Musée canadien de la nature
Robert Bellizzi ministère de la Défense nationale
Jennifer Rowland ministère de la Défense nationale
Rachel McDonald ministère de la Défense nationale
Rich Russell Environnement et Changement climatique Canada
Ruben Boles Environnement et Changement climatique Canada
Patrick Nantel Parcs Canada
Darroch Whitaker Parcs Canada
Sources d’information
Abraham, K.F. Correspondance par courriel adressée à G. Forbes, septembre 2016.
Abraham, K.F. et J.E. Thompson. 1998. Defining the Pen Islands caribou herd of southern Hudson Bay. Rangifer, Special Issue 10:33-40.
Abraham, K.F., McKinnon, L.M., Jumean, Z., Tully, S.M., Walton, L.R. et Stewart, H.M. (lead coordinating authors and compilers). 2011. Hudson Plains Ecozone+ Status and Trends Assessment. Canadian Biodiversity: Ecosystem Status and Trends 2010, Technical Ecozone+ Report. Canadian Councils of Resource Ministers, Ottawa, Ontario. 445 pp.
Abraham, K.F., (et 6 coauteurs). 2012. Recent changes in summer distribution and numbers of migratory caribou on the southern Hudson Bay coast. Rangifer, Special Issue 20: 269–276.
Albon, S.D., (et 5 coauteurs). 2002. The role of parasites in the dynamics of a reindeer population. Proceedings of the Royal Society B-Biological Sciences 269:1625-1632.
Allard, M. et M. Lemay. 2012. Nunavik and Nunatsiavut: from science to policy, an Integrated Regional Impact Study of climate change and modernization. ArcticNet Inc., Québec, Québec.
Altizer, S., R.S. Ostfeld, P.T. Johnson, S. Kutz et C.D. Harvell. 2013. Climate change and infectious diseases: from evidence to a predictive framework. Science 341:514-519.
Anderson, R. et U. Strelive. 1968. The experimental transmission of Pneumostgrongylus tenuis to caribou (Rangifer tarandus terranovae). Canadian Journal of Zoology 46:503-510.
Banfield, A.W.F. 1961. A revision of reindeer and caribou, genus Rangifer. National Museum of Canada, Bulletin No. 177. Queen’s Printer, Ottawa, Ontario.
Banfield, A.W.F. et J.S. Tener. 1958. A preliminary study of the Ungava caribou. Journal of Mammalogy 39:560-573.
Barboza, P.S., D.W. Hartbauer, W.E. Hauer et J.E. Blakes. 2004. Polygynous mating impairs body condition and homeostasis in male reindeer (Rangifer tarandus tarandus). Journal of Comparative Physiology B 174:309-317.
Barboza, P.S. et K.L. Parker. 2008. Allocating protein to reproduction in Arctic reindeer and caribou. Physiological & Biochemical Zoology 81:835-855.
Bélanger, M. et D. Le Hénaff. 1985. Distribution, abundance and regulation of caribou hunting in Québec. McGill Subarctic Research Paper 40:3-13.
Bender, L.C. 2006. Uses of herd composition and age ratios in ungulate management. Wildlife Society Bulletin 34:1225-1230.
Bergeron, Y., S. Gauthier, V. Kafka, P. Lefort et D. Lesieur. 2001. Natural fire frequency for the eastern Canadian boreal forest: consequences for sustainable forestry. Canadian Journal of Forest Research 31:384-391.
Bergeron, Y. et E. Le Goff. 2005. Doit-on remettre en question notre façon d’aménager la forêt boréale canadienne? Vertigo – La revue en sciences de l’environnement 6:17.
Bergerud, A.T. 1971. The population dynamics of Newfoundland caribou. Wildlife Monographs 25:3-55.
Bergerud, A.T. 1974. Decline of caribou in North America following settlement. Journal of Wildlife Management 38:757-770.
Bergerud, A.T. 1975. The reproductive season of Newfoundland caribou. Canadian Journal of Zoology 53:1213-1221.
Bergerud, A.T. (1996). Evolving perspectives on caribou population dynamics, have we got it right yet? Rangifer 16:95–115.
Bergerud, A.T. 1988. Caribou, wolves and man. Trends in Ecology & Evolution 3:68-72.
Bergerud, A.T. et R.E. Page. 1987. Displacement and dispersion of parturient caribou at calving as antipredator tactics. Canadian Journal of Zoology 65:1597-1606.
Bergerud, A.T. et W.E. Mercer. 1989. Caribou introductions in eastern North America. Wildlife Society Bulletin 17:111-120.
Bergerud, A.T., S.N. Luttich et L. Camps. 2008. The Return of Caribou to Ungava . McGill-Queen’s University Press, Montréal, Québec.
Berglund, N.E., (et 4 coauteurs). 2014. Woodland caribou (Rangifer tarandus caribou) in the Far North of Ontario: Background information in support of land use planning. Ontario Ministry Natural Resources, Biodiversity and Monitoring Section Tech. Rpt. TR-147, Thunder Bay, Ontario.
Blake, J. 2015. Gouvernement de TerreNeuveetLabrador. Correspondance par courriel adressée à S. Cote.
Boudreau, S., S. Payette, C. Morneau et S. Couturier. 2003. Recent decline of the George River caribou herd as revealed by tree-ring analysis. Arctic, Antarctic et Alpine Research 35:187-195.
Boudreau, S. et S. Payette. 2004. Caribou-induced changes in species dominance of lichen woodlands: an analysis of plant remains. American Journal of Botany 91:422-429.
Boulanger, J., K.G. Poole, A. Gunn et J. Wierzchowski. 2012. Estimating the zone of influence of industrial developments on wildlife: a migratory caribou Rangifer tarandus groenlandicus and diamond mine case study. Wildlife Biology 18:164-179.
Boulet, M., S. Couturier, S.D. Côté, R.D. Otto et L. Bernatchez. 2007. Integrative use of spatial, genetic, and demographic analyses for investigating genetic connectivity between migratory, montane, and sedentary caribou herds. Molecular Ecology 16:4223-4240.
Bowman, J., J.C. Ray, A.J. Magoun, D.S. Johnson et F.N. Dawson. 2010. Roads, logging, and the large-mammal community of an eastern Canadian boreal forest. Canadian Journal of Zoology 88:454-467.
Brice-Bennett, C. 1977. Our Footprints Are Everywhere: Inuit Land Use and Occupancy. Prepared for the Labrador Inuit Association, Nain, Newfoundland and Labrador.
Brodeur, V. 2016. Ministère de la Faune et des Parcs du Québec Correspondance par courriel adressée à S. Cote.
Campbell, M.W. 1994. The Winter Ecology of Cape Churchill Caribou (Rangifer tarandus ssp.). Mémoire de maîtrise, University of Manitoba, Winnipeg, Manitoba. 216 pp.
CBC 2016. Innu ‘treated like criminals for hunting George River caribou, says Grand Chief. Julie Skinner; Canadian Broadcast News web article. August 31, 2016. [www.cbc.ca/news/canada/newfoundland-labrador/innu-nation-george-river-caribou-1.3742552].
Caribou Ungava. Unpublished data and personal communication. 2016. Université Laval, Département de biologie. http://www.caribou-ungava.ulaval.ca/en/accueil/. (Également disponible en français : Caribou Ungava. Données inédites et communications personnelles. 2016. Université Laval, Département de biologie. http://www.caribou-ungava.ulaval.ca/fr/accueil/.)
Christie, K. (et 5 coauteurs). 2015. The role of vertebrate herbivores in regulating shrub expansion in the Arctic: a synthesis. Bioscience 65:1123-1133.
Clutton-Brock, T.H. et T. Coulson. 2002. Comparative ungulate dynamics: the devil is in the detail. Philosophical Transactions of the Royal Society B 357:1285-1298.
Colombo, S.J., (et 9 coauteurs). 1998. The Impacts of Climate Change on Ontario’s Forests. Forest Research Information Paper 143, Ontario Forest Research Institute, Ontario Ministry of Natural Resources, Sault Ste. Marie, Ontario.
COSEWIC. 2002. COSEWIC assessment and update status report on the woodland caribou Rangifer tarandus caribou in Canada. Committee on the Status of Endangered Wildlife in Canada, Ottawa, Ontario. (Également disponible en français : COSEPAC. 2002. Évaluation et Rapport de situation du COSEPAC sur le caribou des bois (Rangifer tarandus caribou) au Canada. Comité sur la situation des espèces en péril au Canada, Ottawa, Ontario.)
COSEWIC. 2011. Designatable Units for caribou (Rangifer tarandus) in Canada. Committee on the Status of Endangered Wildlife in Canada, Ottawa, Ontario. (Également disponible en français : COSEPAC. 2011. Unités désignables du caribou (Rangifer tarandus) au Canada. Comité sur la situation des espèces en péril au Canada, Ottawa, Ontario.)
COSEWIC. 2012. Aboriginal Traditional Knowledge assessment report on caribou Rangifer tarandus in Canada ATK Subcommittee of COSEWIC. Environment Canada, Ottawa, Ontario.
Côté, S.D. 1998. In vitro digestibilities of summer forages utilized by the Rivière George caribou herd. Arctic 51:48-54.
Courtois, R., J.-P. Ouellet, L. Breton, A. Gingras et C. Dussault. 2007. Effects of forest disturbance on density, space use, and mortality of woodland caribou. Ecoscience 14:491-498.
Couturier, S., J. Brunelle et J. Lapointe 1988. Decline of physical condition and decrease of recruitment in the George River Caribou Herd. Proc. 3 rd N. Am.
Caribou Workshop. Alaska Dept. Fish Game, Technical Bulletin 8: 35-37.
Couturier, S., J. Brunelle, D. Vandal D, G. St-Martin. 1990. Changes in the population dynamics of the George River caribou herd, 1976–87. Arctic 43:9–20.
Couturier, S., R. Courtois, H. Crépeau, L.-P. Rivest et S. Luttich. 1996. Calving photocensus of the Rivière George caribou herd and comparison with an independent census. Rangifer, Special Issue 9:283-296.
Couturier, S., D. Jean, R. Otto et S. Rivard. 2004. Démographie des troupeaux de caribous migrateurs-toundriques (Rangifer tarandus) au Nord-du-Québec et au Labrador. Ministère des Ressources naturelles, de la Faune et des Parcs, Direction de l’aménagement de la faune du Nord-du-Québec et Direction de la recherche sur la faune, Québec, Québec.
Couturier, S., S.D. Côté, J. Huot et R.D. Otto. 2009. Body condition dynamics in a northern ungulate gaining fat in winter. Canadian Journal of Zoology 87:367-378.
Couturier, S., R.D. Otto, S.D. Côté, G. Luther et S.P. Mahoney. 2010. Body size variations in caribou ecotypes and relationships with demography. Journal of Wildlife Management 74:395-404.
Couturier, S. et J. Mitchell Foley. 2014. First scientific data on herd size and population dynamics of the Torngat Mountains caribou herd. Torngat Wildlife, Plants and Fisheries Secretariat Series 2015.
Crête, M. et A. Desrosier. 1995. Range expansion of coyotes, Canis latrans, threatens a remnant herd of caribou, Rangifer tarandus, in southeastern Québec. Canadian Field-Naturalist 109:227-235.
Crête, M. et G. Doucet. 1998. Persistent suppression in dwarf birch after
release from heavy summer browsing by caribou. Arctic Alpine Research 30:126–132.
Crête, M. et Huot, J. 1993. Regulation of a large herd of migratory caribou: Summer nutrition affects calf growth and body reserves of dams. Canadian Journal of Zoology 71:2291 – 2296.
Crête, M., J. Huot et L. Gauthier. 1990. Food selection during early lactation by caribou calving on the tundra in Québec. Arctic 43: 60-65.
Crête, M., S. Couturier, B.J. Hearn et T.E. Chubbs. 1996. Relative contribution of decreased productivity and survival to recent changes in the demographic trend of the Rivière George subpopulation. Rangifer, Special Issue 9:27-36.
Cuerrier and the Elders of Kangiqsualujjuaq. 2012. The Zoological Knowledge of the Inuit of Kangiqsualujjuaq, Nunavik. Avataq Cultural Institute, 132 p. (Également disponible en français : Cuerrier et les aînés de Kangiqsualujjuaq. 2012. Le savoir zoologique des Inuits de Kangiqsualujjuaq, Nunavik. Institut culturel Avataq, 132 p.)
Curry, P.S. 2012. Blood on filter paper for monitoring caribou health: efficacy, community-based collection, and disease ecology in circumpolar herds. Thèse de doctorat, Department of ecosystem and public health, University of Calgary, Calgary, Alberta, 308 p.
Dalerum, F., S. Boutin et J.S. Dunford. 2007. Wildfire effects on home range size and fidelity of boreal caribou in Alberta, Canada. Canadian Journal of Zoology 85:26-32.
Dalziel, B., M. Le Corre, S.D. Côté et S. Ellner. 2016. Detecting collective behavior in animal relocation data, with application to migrating caribou. Methods in Ecology and Evolution 7: 30-41.
DesMeules, P. et Brassard, J.M. 1964. Inventaire préliminaire du caribou Rangifer tarandus caribou d’un secteur de la Côte-Nord et du secteur centre de l’Ungava. Québec, Ministère du Loisir, de la chasse et de la Pêche: p.187-218.
Drew, M.L. et W.M. Samuel. 1986. Reproduction of the winter tick, Dermacentor albipictus, under field conditions in Alberta, Canada. Canadian Journal of Zoology 64:714-721.
Duchesne, M., S.D. Côté et C. Barrette. 2000. Responses of woodland caribou to winter ecotourism in the Charlevoix Biosphere Reserve, Canada. Biological Conservation 96:311-317.
Ducrocq, J., (et 12 coauteurs). 2012. Comparison of gross visual and microscopic assessment of four anatomic sites to monitor Besnoitia tarandi in barren-ground caribou (Rangifer tarandus groenlandicus). Journal of Wildlife Diseases 48:732-738.
Ducrocq, J., (et 7 coauteurs). 2013. Variables associated with Besnoitia tarandi prevalence and cyst density in barren-ground caribou (Rangifer tarandus) populations. Journal of Wildlife Diseases 49:29-38.
Dumont, A. et M. Crête. 1996. The meningeal worm, Parelaphostrongylus tenuis, a marginal limiting factor for moose, Alces alces. Canadian Field-Naturalist 110:413-418.
Dzus, E., J. Ray, I. Thompson et C. Wedeles. 2010. Caribou and the National Boreal Standard: Report of the FSC Canada Science Panel.
Elliot, C., 1998. Cape Churchill Caribou: Staus of herd and harvest. Manuscript Report 98-05w. Manitoba Natural Resources. 16 pp.
Elmendorf, S.C., (et 46 coauteurs). 2012. Plotscale evidence of tundra vegetation change and links to recent summer warming. Nature Climate Change 2:453-457.
Environment Canada. 2008. Scientific review for the identification of critical habitat for woodland caribou (Rangifer tarandus caribou), Boreal population, in Canada. Environnement Canada, Ottawa, Ontario. (Également disponible en français : Environnement Canada. 2008. Examen scientifique aux fins de la désignation de l’habitat essentiel de la population boréale du caribou des bois (Rangifer tarandus caribou) au Canada. Environnement Canada, Ottawa, Ontario.)
Environment Canada. 2011. Scientific assessment to inform the identification of critical habitat for woodland caribou (Rangifer tarandus caribou), Boreal population, in Canada–2011 Update. Environment Canada, Ottawa, Ontario. (Également disponible en français : Environnement Canada. 2011. Évaluation scientifique aux fins de la désignation de l’habitat essentiel de la population boréale du caribou des bois (Rangifer tarandus caribou) au Canada : Mise à jour 2011. Environnement Canada, Ottawa, Ontario.)
Ferguson, S.H. et P.C. Elkie. 2004. Seasonal movement patterns of woodland caribou (Rangifer tarandus caribou). Journal of Zoology 262:125-134.
Festa-Bianchet, M., J.-M. Gaillard et S.D. Côté. 2003. Variable age structure and apparent density-dependence in survival of adult ungulates. Journal of Animal Ecology 72:640-649.
Festa-Bianchet, M., J.C. Ray, S. Boutin, S.D. Côté et A. Gunn. 2011. Caribou conservation in Canada: an uncertain future. Canadian Journal of Zoology 89:419-434.
Finnis, J. 2013. Predicted impacts of climate change on the province of Newfoundland and Labrador. Rapport inédit. Depat. Geography, Memorial University, Newfoundland and Labrador.
Fraser, R.H., I. Olthof, M. Carrière, A. Deschamps et D. Pouliot. 2011. Detecting long-term changes to vegetation in northern Canada using the Landsat satellite image archive. Environmental Research Letters 6:045502.
Fraser, R.H., T.C. Lantz, L. Olthof, S.V. Kokelj et R.A. Sims. 2014. Warming-induced shrub expansion and lichen decline in the Western Canadian Arctic. Ecosystems 17(7): 1151-1168.
Furgal, C. et L. Rochette. 2007. Perception of contaminants, participation in hunting and fishing activities, and potential impacts of climate change. Institut national de santé publique du Québec and Nunavik Regional Board of Health and Social Services, Québec, Québec.
Gaillard, J.-M., M. Festa-Bianchet, N.G. Yoccoz, A. Loison et C. Toïgo. 2000. Temporal variation in fitness components and population dynamics of large herbivores. Annual Review of Ecology and Systematics 31:367-393.
Gamberg, M. 2004. Contaminants in Yukon moose and caribou –2003. Prepared for Yukon contaminants committee, and Department of Indian Afairs and Northern Development, Whitehorse, Yukon.
Gauthier, L., R. Nault et M. Crête. 1989. Variations saisonnières du régime alimentaire des caribous du troupeau de la rivière George, Québec nordique. Le Naturaliste Canadien 116:101-112.
Geist, V. 1998. Deer of the world: Their evolution, behavior, and ecology. Stackpole Books, Mechanicsburg, Pennsylvania.
Gerhart, K.L., (et 5 coauteurs). 1997. Pregnancy of adult caribou (Rangifer tarandus): evidence for lactational infertility. Journal of Zoology 242:17-30.
Gordon, B. 2003. Rangifer and man: An ancient relationship. Rangifer, Special Issue 14:15-28.
Gordon, B. C. 2005. 8000 years of caribou and human seasonal migration in the Canadian Barrenlands. Rangifer 16:155-162.
Gouvernement du Québec. 2014. Rapport sur les activités minières au Québec 2013, Direction générale de géologie Québec, secteur des opérations régionales et secteur des mines, Québec, Québec, 133 p.
Government of Newfoundland and Labrador. 2016. Provincial governmebt maintains huntin ban on George River Caribou herd. News release, 23 mars 2016. [www.releases.gov.nl.ca/releases/2016/env/0323n02.aspx].
Grayson, D.K. et F. Delpeche. 2005. Pleistocene reindeer and global warming. Conservation Biology 19:557-562.
Gunn, A. et R.J. Irvine. 2003. Subclinical parasitism and ruminant foraging stategies - a review. Wildlife Society Bulletin 31:117-126.
Gunn, A., D. Russell et J. Eamer. 2011. Northern caribou population trends in Canada. Canadian Biodiversity: Ecosystem Status and Trends 2010, Technical Thematic Report No. 10. Canadian Councils of Resource Ministers, Ottawa, Ontario. (Également disponible en français : Gunn, A., D. Russell, et J. Eamer. 2011. Tendances des populations de caribou des zones septentrionales du Canada. Biodiversité canadienne : état et tendances des écosystèmes en 2010, Rapport technique thématique no 10. Conseils canadiens des ministres des Ressources, Ottawa, Ontario.)
Gunn, A. 2016. Rangifer tarandus. IUCN Red List of Threatened Species 2016.: e.T29742A22167140. [consulté en août 2016].
Gustine D.D., K.L. Parker, R.J. Lay, M.P. Gillingham et D.C. Heard. 2006. Calf survival of woodland caribou in a multi-predator ecosystem. Wildlife Monographs 165:1-32.
Harrington, F. et A. Veitch. 1991. Short-term impact of low level jet fighter training on caribou in Labrador. Arctic 44:318-327.
Hayes, R.D. 1995. Numerical and functional responses of wolves, and regulation of moose in the Yukon. Mémoire de maîtrise. Simon Fraser University, Burnaby, British Columbia.
Hayes, R.D., (et 8 coauteurs). 2003. Experimental reduction of wolves in the Yukon: Ungulate responses and management implications. Wildlife Monographs 152:1-35.
He, Y., X. Guo, P. Dixon et J. Wilmshurst. 2008. Satellite monitoring of northern ecosystems using multi-sensors. Unpublished report. Dept. Geography, University Saskatchewan.
Hearn, B. J., S., Luttich, M. Crête et M. Berger. 1990. Survival of radio-collared caribou (Rangifer tarandus caribou) from the George River herd, Nouveau-Québec - Labrador. Canadian Journal of Zoology 68: 276-283.
Hedman, D. unpublished data. Declining Caribou; shared concerns, shared solutions. Powerpoint presentation. Manitoba Conservation. September 2012.
Hummel, M. et J.C. Ray. 2008. Caribou and the North: A Shared Future . Dundurn Press, Toronto, Ontario.
Huot, J. 1989. Body composition of the George River caribou herd (Rangifer tarandus caribou) in fall and late winter. Canadian Journal of Zoology 67:103-107.
IUCN. 2008. IUCN Red List. http://www.iucnredlist.org/details/29742/0 (consulté le 25 novembre 2014).
IUCN Standards and Petitions Subcommittee. 2013. Guidelines for Using the IUCN Red List Categories and Criteria. Version 10,1. Prepared by the Standards and Petitions Subcommittee. From http://www.iucnredlist.org/documents/RedListGuidelines.pdf. (consulté le 25 novembre 2014). (Également disponible en français : Sous-comité des normes et des pétitions de la Commission de la sauvegarde des espèces de l’UICN. 2016. Lignes directrices pour l’utilisation des Catégories et Critères de la Liste rouge de l’UICN. Version 12. Élaborées par le Sous-comité des normes et des pétitions. Disponible à l’adresse : http://cmsdocs.s3.amazonaws.com/keydocuments/RedListGuidelines_FR.pdf.)
Johnson, C.J., (et 6 coauteurs). 2005. Quantifying the cumulative effects of human developments: a regional environmental assessment for sensitive Arctic wildlife. Wildlife Monographs 160:1-36.
Johnson, D., N.J. Harms, N.C. Larter, B.T. Elkin, H. Tabe et G. Wei.. 2010. Serum biochemistry, serology, and parasitology of boreal caribou (Rangifer tarandus caribou) in the northwest territories, Canada. Journal of Wildlife Diseases 46:1096-1107.
Kelsall, J.P. 1968. The Migratory Barren-ground Caribou of Canada. Department of Indian Affairs and Northern Development. Canadian Wildlife Service, Ottawa, Ontario.
Klütsch, C.F.C., M. Manseau et P.J. Wilson. 2012. Phylogeographical analysis of mtDNA data indicatesp expansion from multiple glacial refugia in woodland caribou (Rangifer tarandus caribou). Plos One 7:e52661.
Krawchuk, M.A., M.A. Moritz, M.-A. Parisien, J. Van Dorn et K. Hayhoe. 2009. Global pyrogeography: the current and future distribution of wildfire. Plos One 4:e5102.
Kutz, S. J., 2016. Communication personnelle. Correspondance par courriel avec G. Forbes, septembre 2016. Wildlife Veterinarian, University of Calagary, Alberta.
Kutz, S.J., E.P. Hoberg, J. Nagy, L. Polley et B. Elkin. 2004. “Emerging” parasitic infections in Arctic ungulates. Integrative and Comparative Biology 44:109-118.
Kutz, S.J., (et 6 coauteurs). 2009. The Arctic as a model for anticipating, preventing, and mitigating climate change impacts on host-parasite interactions. Veterinary Parasitology 163:217-228.
Kutz, S.J., (et 8 coauteurs). 2012. Parasites of ungulates of arctic North America and Greenland: A view of contemporary diversity, ecology, and impact in a world under change. Advances in Parasitology 79:99-252.
Kutz, S.J., (et 4 coauteurs). 2014. A walk on the tundra: Host–parasite interactions in an extreme Environment. International Journal of Parasitology: Parasites and Wildlife. http://dx.doi.org/10.1016/j.ijppaw.2014.01.002
Kwan, M., 2011. Heavy Metals in Leaf River Herd Caribou and Nunavik Muskoxen. Nunavik Research Centre, Makivik Corportation. 33 pp.
Lankester, M.W. et S. Luttich. 1988. Fascioloides magna (Trematoda) in woodland caribou (Rangifer tarandus caribou) of the George River herd, Labrador. Canadian Journal of Zoology 66:475-479
Latham, D.M., M.C. Latham, M.S. Boyce et S. Boutin. 2011. Movement responses by wolves to industrial linear features and their effect on woodland caribou in northeastern Alberta. Ecological Applications 21:2854-2865.
Leblond M, St-Laurent M-H, Côté SD. 2016. Caribou, water, and ice – fine-scale movements of a migratory arctic ungulate in the context of climate change. Movement Ecology 4:14.
Leclerc, M., C. Dussault et M.-H. St-Laurent. 2014. Behavioural strategies towards human disturbances explain individual performance in woodland caribou. Oecologia 176:297-306.
Le Corre, M., C. Dussault et S.D. Côté. 2014. Detecting changes in the annual movements of migratory caribou: Using the first-passage time to assess departure and arrival of the spring migration. Movement Ecology 2:19.
Le Goff, H., M. Flannigan et Y. Bergeron. 2009. Potential changes in monthly fire risk in the eastern Canadian boreal forest under future climate change. Canadian Journal of Forest Research 39:2369-2380.
Le Hénaff, D. 1976. Inventaire aérien des terrains de vêlage du caribou dans la région nord et au nord du territoire de la municipalité de la Baie James (mai-juin 1975). Ministère du Tourisme, de la Chasse et de la Pêche, Québec, Québec.
L’Italien, L., (et 5 coauteurs). 2012. Mating group size and stability in reindeer Rangifer tarandus: the effects of male characteristics, sex ratio and male age-structure. Ethology 118:783-792.
Magoun, A.J., (et 8 coauteurs). 2005. Distribution and relative abundance of caribou in the Hudson Plains Ecozone of Ontario. Rangifer, Special Issue 16:105-121.
Mahant, S.P. 2013. Effects of snowmobile trails on woodland caribou habitat selection in Gros Morne National Park. Honours thesis, Trent University, Peterborough, Ontario.
Mahoney, S.P. et J.N. Weir. 2009. Caribou Data Synthesis--Progress Report. Overview of the status of woodland caribou in insular Newfoundland: research methodology, results, interpretations and future projections. Sustainable Development and Strategic Science, Government of Newfoundland and Labrador, St. John’s, Newfoundland and Labrador.
Manseau, M., J. Huot et M. Crête. 1996. Effects of summer grazing by caribou on composition and productivity of vegetation: community and landscape level. Journal of Ecology 84:503-513.
Mayor, S.J., J.A. Schaefer, D.C. Schneider et S.P. Mahoney. 2009. The spatial structure of habitat selection: A caribou’s-eye-view. Acta Oecologica 35:253-260.
McCarthy, S. 2016. Ecosystem Management Ecologist, NL Widlife Division. Correspondance par courriel avec G. Forbes, septembre 2016.
McEwan, E.H. et P.E. Whitehead. 1972. Reproduction in female reindeer and caribou. Canadian Journal of Zoology 50:43-46.
Messier, F., J. Huot, D. Le Henaff et S. Luttich. 1988 Demography of the George River caribou herd: evidence of population regulation by forage exploitation and range expansion. Arctic 41:279–287.
Meyers-Smith, I., (et 31 coauteurs). 2011. Shrub expansion in tundra ecosystems: dynamics, impacts, and research priorities. Environmental Research Letters 6: 2011.
Ministere du Développement Durable, de la Faune et des Parcs (MDDEFP). 2013. Projets de parc national et de territoires de mise en valuer de la faune. Québec, Québec. [www.mddep.gouv.qc.ca/parcs/projets/index.htm].
Ministère de la faune et des parcs du Québec (MFFP). 2016. Communication par courriel adressée à G. Forbes, août 2016.
Ministère de la faune et des parcs du Québec (MFFP). 2017. Migratory caribou sport hunting closure – press release. [http://mffp.gouv.qc.ca/english/press/press-release-detail.jsp?id=11881]. (Également disponible en français : ministère de la Faune et des Parcs du Québec (MFFP). 2017. Fermeture de la chasse sportive au caribou migrateur – communiqués de presse. [http://mffp.gouv.qc.ca/fermeture-de-la-chasse-sportive-au-caribou-migrateur/]).
Miller, F.L. 2003. Caribou (Rangifer tarandus). pp. 965-997 in Wild Mammals of North America: Biology, Management, and Conservation . 2003. G.A. Feldhamer, B.C. Thompson et J.A. Chapman (eds). The Johns Hopkins University Press, Baltimore, Maryland.
Mitchell, G.B., (et 7 coauteurs). 2012. Experimental oral transmission of Chronic Wasting Disease to reindeer (Rangifer tarandus tarandus). Plos One 7:e39055.
Moores, Shelley. 2016. Newfoundland and Labrador Wildlife Division. Correspondance par courriel adressée à G. Forbes, novembre 2016.
Morneau, C. et S. Payette. 1989. Postfire lichen-spruce woodland recovery at the limit of the boreal forest in northern Québec. Canadian Journal of Botany 67: 2770-2782.
Morneau, C. et S. Payette. 2000. Long-term fluctuations of a caribou population revealed by tree-ring data. Canadian Journal of Zoology 78:1784-1790.
Mosnier, A., J.-P. Ouellet, L. Sirois et N. Fournier. 2003. Habitat selection and home-range dynamics of the Gaspé caribou: a hierarchical analysis. Canadian Journal of Zoology 81:1174-1184.
Müller, D.W.H., L.B. Lackey, W.J. Streich, J.-M. Hatt et M. Clauss. 2010. Relevance of management and feeding regimens on life expectancy in captive deer. American Journal of Veterinary Research 71:275-280.
Musiani, M., J.A. Leonard, H. Cluff, C. C. Gates, S. Mariani, P.C. Paquet, C. Vilà et R.K. Wayne. 2007. Differentiation of tundra/taiga and boreal coniferous forest wolves: genetics, coat colour and association with migratory caribou. Molecular Ecology 16:4149-4170.
Myers-Smith (et 31 coauteurs). 2011. Shrub expansion in tundra ecosystems: dynamics, impacts and research priorities. Environmental Research Letters 6:045509.
Myers-Smith (et 32 coauteurs). 2015. Climate sensitivity of shrub growth across the tundra biome. Nature Climate Change 5:887-891.
Nagy, J. 2011. Use of space by caribou in northern Canada. Thèse de doctorat, University of Alberta, Edmonton, Alberta.
NatureServe. 2012. NatureServe Explorer: An online encyclopedia of life [application Web]. Version 7.1. NatureServe, Arlington, Virginia. Disponible à l’adresse :http://www.natureserve.org/explorer.
Newton, E.J., B.A. Pond, G.F. Brown, K.F. Abraham et J.A. Schaefer. 2014. Remote sensing reveals long-term effects of caribou on tundra vegetation. Polar Biology 37: 715-725.
Newton, E.J., K.F. Abraham, J.A. Schaefer, B.A. Pond, G.S. Brown et J.E. Thompson. 2015. Causes and consequences of broad-scale changes in the distribution of migratory caribou (Rangifer tarandus) of Southern Hudson Bay. Arctic 68: 472-485
Northern Miner 2014. Québec government relaunches Plan Nord. June 18, 2014. http://www.northernminer.com/news/québec-relaunches-plan-nord/1003103496/ [consulté le 25 novembre 2014].
Ontario Ministry of Natural Resources and Forestry (OMNR). 2008. Discussion Paper: Keeping Caribou in Ontario. Ontario Ministry of Natural Resources, Fish and Wildlife Branch, Species at Risk Section, Peterborough, Ontario. 41 pp.
Ontario Ministry of Natural Resources and Forestry (OMNRFa). 2014. State of the Woodland Caribou Resource Report. Species at Risk Branch, Thunder Bay, Ontario. (Également disponible en français : Ministère des Richesses naturelles et des Forêts de l’Ontario (MRNFOa). 2014. Rapport sur l’état des ressources relatives au caribou des bois sylvicole. Direction des espèces en péril, Thunder Bay, Ontario.)
Ontario Ministry of Natural Resources and Forestry (OMNRFb). 2014. Range Management Policy in Support of Woodland Caribou Conservation and Recovery. Species at Risk Branch, Thunder Bay, Ontario. 11 pp. (Également disponible en français : Ministère des Richesses naturelles et des Forêts de l’Ontario (MRNFOa). 2014. Politique de gestion des aires de distribution pour favoriser la conservation et le rétablissement du caribou des forêts. Direction des espèces en péril, Thunder Bay, Ontario. 11 p.)
Pachano, R. 2016. Chairperson, Eeyou Marine Region Wildlife Board. Lettre adressée au Secrétariat du COSEPAC, février 2016.
Pachkowski, M., M. Festa-Bianchet et S.D. Côté. 2013. Spring-loaded reproduction: effects of body condition and population size on fertility in migratory caribou (Rangifer tarandus). Canadian Journal of Zoology 91:473-479.
Parker, G.R. 1980. Physical and reproductive parameters of pre-calving caribou (Rangifer tarandus caribou) in northern Labrador. Rapport inédit disponible auprès du Service canadien de la faune, Sackville, New Brunswick. 86 p.
Parks Canada Agency. 2008. Torngat Mountains National Park of Canada: State of park report, Québec, Québec. (Également disponible en français : Agence Parcs Canada. 2008. Parc national du Canada des Monts-Torngat : rapport sur l’état du parc, Québec, Québec.)
Payette, S., S. Boudreau, C. Morneau et N. Pitre. 2004. Long-term interactions between migratory caribou, wildfires and Nunavik hunters inferred from tree rings. Ambio 33:482-486.
Payette, S., C. Morneau, L. Sirois et M. Desponts. 1989. Recent fire history of northern Québec biomes. Ecology 70:656-673.
Pinard, V., C. Dussault, J.-P. Ouellet, D. Fortin et R. Courtois. 2012. Calving rate, calf survival rate, and habitat selection of forest-dwelling caribou in a highly managed landscape. Journal of Wildlife Management 76:189-199.
Pisapio, John. 2016. Government of TerreNeuveetLabrador Widlife Division. Communication par courriel adressée à G. Forbes, novembre 2016.
Pitt, W.C. et P.A. Jordan. 1994. A survey of the nematode parasite Parelaphostrongylus tenuis in the white-tailed deer, Odocoileus virginianus, in a region proposed for caribou, Rangifer tarandus caribou, re-introduction in Minnesota. Canadian Field-Naturalist 108:341-346.
Polfus, J.L., Hebblewhite M., Heinemeyer K. 2011. Identifying indirect habitat loss and avoidance of human infrastructure by northern mountain woodland caribou. Biological Conservation 144: 2637-2646.
Polfus, J.L., (et 9 coauteurs). 2016. Łeghágots’enetę (learning together): the importance of indigenous perspectives in the identification of biological variation. Ecology and Society 21: 18. http://dx.doi.org/10.5751/ES-08284-210218.
Pond, B.A., G.S. Brown, K.S. Wilson et J.A. Schaefer. 2016. Drawing lines: Spatial behaviours reveal two ecotypes of woodland caribou. Biological Conservation 194: 139-148.
Pouliot, D., R. Latifovic et I. Olthof. 2009. Trends in vegetation NDVI from 1km AVHRR data over Canada for the period 1985-2006. International Journal of Remote Sensing 30:149-168.
Post, E. et M.C. Forchhammer. 2008. Climate change reduces reproductive success of an Arctic herbivore through trophic mismatch. Philosophical Transactions of the Royal Society B 363:2369-2375.
Québec Government. 2011. Regulation Respecting Wildlife Habitats (R.R.Q., c C-61.1, r 18) and the Conservation and Development of Wildlife Act (R.S.Q., c. C-61.1). Québec, QC. <http://www.mddep.gouv.qc.ca/publications/loisreglem-en.htm> (consulté le 16 novembre 2011). (Également disponible en français : Gouvernement du Québec. 2011. Règlement sur les habitats fauniques (R.R.Q., c C-61.1, r. 18 et la Loi sur la conservation et la mise en valeur de la faune (R.R.Q., c C-61-1, c. C-61.1). Québec, Québec, http://www.mddelcc.gouv.qc.ca/publications/lois_reglem.htm.)
Quirouette, J. 2015. Subtle Vegetation Change – Torngat Mountains. Unpublished report. Torngat Mountains National Park, Monitoring and Ecological Information Division.
Racey, G.D. et T. Armstrong. 2000. Woodland caribou range occupancy in northwestern Ontario: past and present. Rangifer, Special Issue 12:173-184.
Rasiulis, A. 2015. Survie et dynamique de population des caribous migrateurs du Québec-Labrador. Mémoire de maîtrise, Université Laval, Québec, Québec.
Rasiulis, A.L., M. Festa-Bianchet, S. Couturier et S.D. Côté. 2014. The effect of radio-collar weight on survival of migratory caribou. Journal of Wildlife Management 78:953-956.
Røed, K.H., M.A.D. Ferguson, M. Crête et T.A. Bergerud. 1991. Genetic variation in transferrin as a predictor for differentiation and evolution of caribou from eastern Canada. Rangifer 11:65-74.
Røed, K.H., S.D. Côté et G. Yannic. In press. Rangifer tarandus, classification and genetic variation. In Reindeer and caribou: health and diseases. M. Tryland, S.Kutz, A. Oksanen (eds). CRC Press, Boca Raton, California.
Rudolph, T., P. Drapeau, M.-H. St. Laurent et L. Imbeau. 2012. Situation du caribou forestier sur le territoire de la Baie James dans le region Nord-du-Québec. Montreal Québec. 77 pp.
Russell, D.E., Martell, A.M. et Nixon, W.A. 1993. The range ecology of the Porcupine Caribou herd in Canada. Rangifer Special Issue 8:1-168.
Samuel, W.M. 2004. White as a ghost: Winter ticks and moose. Natural History Series, Volume 1, Federation of Alberta Naturalists, Edmonton, Alberta.
Schaefer, J.A. et S.N. Luttich. 1998. Movements and activity of caribou, Rangifer tarandus caribou, of the Torngat Mountains, Northern Labrador and Québec. Canadian Field-Naturalist 112:486-490.
Schaefer, J.A. et W.O.J. Pruitt. 1991. Fire and woodland caribou in southeastern Manitoba. Wildlife Monographs 116:3-39.
Schmelzer, I. Communication personnelle. 2016. Correspondance adressée aux rédacteurs du rapport, automne 2016. Biologiste, governement de TerreNeuveetLabrador.
Sharma, S., S. Couturier et S.D. Côté. 2009. Impacts of climate change on the seasonal distribution of migratory caribou. Global Change Biology 15:2549-2562.
Simard, A.-A. (et 15 coauteurs). 2016. Variation in the intensity and prevalence of macroparasites in migratory Caribou: a quasi-circumpolar study. Canadian Jounral of Zoology 97:607-617.
Smart, M. 2016. Executive Secretary, Hunting, Fishing and Trapping Coordinating Committee. Lettre adressée à G. Forbes, août 2016.
Sommer, R.S., U. Fritz, H. Seppä, J. Ekström, A. Persson et R. Liljegren. 2011. When the pond turtle followed the reindeer: effect of the last extreme global warming event on the timing of faunal change in Northern Europe. Global Change Biology 17:2049-2053.
Sturm, M., C. Racine et K. Tape. 2001. Climate change - Increasing shrub abundance in the Arctic. Nature 411:546-547.
Sturm, M., (et 7 coauteurs). 2005. Winter biological processes could help convert arctic tundra to shrubland. Bioscience 55:17-26.
Taillon, J., V. Brodeur, M. Festa-Bianchet et S.D. Côté. 2011. Variation in body condition of migratory caribou at calving and weaning–which measures should we use? Ecoscience 18:295-303.
Taillon, J., V. Brodeur et S. Rivard. 2016. Biological status of migratory caribou, Leaf River herd. Ministère des Forêts, de la Faune et des Parcs, Québec, 69 pp. (Également disponible en français : Taillon, J., V. Brodeur, et S. Rivard. 2016. État de la situation biologique du caribou migrateur, troupeau de la rivière aux Feuilles, ministère des Forêts, de la Faune et des Parcs, Québec, 69 p.)
Taillon, J., M. Festa-Bianchet et S.D. Côté. 2012a. Shifting targets in the tundra: protection of migratory caribou calving grounds must account for spatial changes over time. Biological Conservation 147:163-173.
Taillon, J., V. Brodeur, M. Festa-Bianchet et S.D. Côté. 2012 b. Is mother condition related to offspring condition in migratory caribou at calving and weaning? Canadian Journal of Zoology 90:393-402.
Taillon, J., P.S. Barboza et S.D. Côté. 2013. Nitrogen allocation to offspring and milk production in a capital breeder. Ecology 94:1815-1827.
Tapscott, B. 2011. Chronic Wasting Disease - Fact sheet. Ontario Ministry of Natural Resources, Ontario. (Également disponible en français : Tapscott, B. 2011. L’encéphalopathie des cervidés. Ministère des Ressources naturelles de l’Ontario, Ontario.)
Théau, J. et C. R. Duguay. 2004. Mapping lichen changes in the summer range of the George River caribou herd (Québec-Labrador, Canada) using Landsat imagery (1976-1998). Rangifer 24:31-50.
Therrien, J., R. Verdon et R. Lalumiere. 2004. Environmental monitoring at the La Grande complex. Changes in fish communities. Summary report 1977-2000, GENIVAR groupe conseil inc. et Direction barrages et environnement, Hydro-Québec production, Québec, Québec, 129 p.
Thomas, D., S. Barry et G. Alaie. 1995. Fire-caribou-winter range relationships in northern Canada. Rangifer 16:57-67.
Thomas, D.C. et J.E. Edmonds. 1984. Competition between caribou and muskoxen, Melville Island, N.W.T., Canada. Biological Paper University of Alaska Special Report 4: 93-100.
Thomas, D.C. et H.P.L. Kiliaan. 1998. Fire-caribou relationships: (II) Fecundity and physical condition of the Beverly herd. –Technical Report Series No. 310. Canadian Wildlife Service, Prairie and Northern Region, Edmonton, Alberta.
Thomas, D.C. et D.R. Gray. 2002. Update COSEWIC status report on the woodland caribou Rangifer tarandus caribou in Canada. In COSEWIC assessment and update status report on the woodland caribou Rangifer tarandus caribou in Canada. Committee on the Status of Endangered Wildlife in Canada, Ottawa, Ontario, pp. 1-98. (Également disponible en français : Thomas, D.C., et D.R. Gray. 2002. Rapport de situation du COSEPAC sur le caribou des bois (Rangifer tarandus caribou) au Canada – Mise à jour. In Évaluation et Rapport de situation du COSEPAC sur le caribou des bois (Rangifer tarandus caribou) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada, Ottawa, Ontario, p. 1-111.)
Thompson, J. et K. Abraham. 1994. Range, seasonal distribution and population dynamics of the Pen Islands caribou herd of southern Hudson Bay. OMNR Report Moosonee, Ontario. 94 p.
Toupin, B., J. Huot et M. Manseau. 1996. Effect of insect harassment on the behaviour of the Rivière George caribou. Arctic 49:375-382.
Tremblay, B., E. Lévesque et S. Boudreau. 2012. Recent expansion of erect shrubs in the low Arctic: evidence from Eastern Nunavik. Environmental Research Letters 7:035501.
Veitch, A.M. et P.K. Krizan. 1996. Black bear predation on vertebrates in northern Labrador. Journal of Wildlife Research 1:193-194.
Vistnes, I. et C. Nellemann. 2008. The matter of spatial and temporal scales: a review of reindeer and caribou response to human activity. Polar Biology 31:399-407.
Vors, L.S. 2013. Caribou in Canada: Ecology and policy. Thèse de doctorat, University of Alberta, Edmonton, Alberta.
Vors, L.S. et M.S. Boyce. 2009. Global declines of caribou and reindeer. Global Change Biology 15:2626-2633.
Walton. L., K. Abraham, V. Crichton et H. Stewart. 2011. Caribou. Pages 176-185 in Hudson Plains Ecozone: Status and Trends Assessment (K. Abraham et al.; lead authors) Canadian Biodiversity: Ecosystem Status and Trends 2010. Technical Ecozone Report. Canadian Council of Resource Ministers, Ottawa, Ontario. 445 pp.
Wasel, S., W. Samuel et V. Crichton. 2003. Distribution and ecology of Parelaphostryongylus tenuis (Nematoda), in northcentral North America. Journal of Wildlife Diseases 39:338-346.
Way, R. et A. Viau. 2014. Natural and forced air temperature variability in the Labrador region of Canada during the past century. Theoretical and Applied Climatology 121:413-424.
Weir, J.N., S.P. Mahoney, B. McLaren et S.H. Ferguson. 2007. Effects of mine development on woodland caribou Rangifer tarandus distribution. Wildlife Biology 13: 66-74.
Weladji, R.B., Ø. Holand et T. Almøy. 2003. Use of climatic data to assess the effect of insect harassment on the autumn weight of reindeer (Rangifer tarandus) calves. Journal of Zoology 260:79-85.
Wells, J., J. Jacobs, I. Goudie et J. Feldgajer. 2011. Intact habitat landscapes and woodland caribou on the island of Newfoundland. Canadian Boreal Initiative, Ottawa, Ontario.
Williamson, T. 1997. From Sina to Sikujâluk: Our footprint, Mapping Inuit Environmental Knowledge in the Nain District of Northern Labrador. The Labrador Inuit Association, 119 p.
Wilson, K. 2013. Temporal and spatial variation in home range size for two woodland ecotypes in Ontario. MSc Thesis. Trent University, Peterborough, Ontario.
Wilson, K.S., M.W. Basterfield, C. Furgal, T. Sheldon et E. Allen. 2014. The communities of Nain and Kangiqsualujjuaq, and the Co-operative Management Board for the Torngat Mountains National Park. Torngat Mountains Caribou Herd Inuit Knowledge, Culture, and Values Study. Final Report to the Nunatsiavut Government, Makivik Corporation, Parks Canada, and the Torngat Wildlife and Plants Co-Management Board, Nain, Newfoundland and Labrador.
Yannic, G., (et 20 coauteurs). 2014. Genetic diversity in caribou linked to past and future climate change. Nature Climate Change 4:132-137.
Yannic, G., (et 7 coauteurs). 2016. Integrating ecological and genetic structure to define management units for caribou in Eastern Canada. Conservation Genetics 17:437-453.
Sommaire biographique des rédacteurs du rapport
Steeve D. Côté travaille dans le domaine de l’écologie des grands herbivores depuis 1991. Il a obtenu son doctorat de l’Université de Sherbrooke en 1999, sa thèse ayant porté sur l’écologie comportementale de la chèvre de montagne. Steeve Côté est professeur à l’Université Laval (ville de Québec) depuis 2001. Il possède des connaissances approfondies sur le caribou. Il étudie le caribou migrateur du Québec-Labrador (UD 4) depuis 1992 et dirige le groupe de recherche Caribou Ungava depuis la création de celui-ci, en 2007 (http://www.caribou-ungava.ulaval.ca/fr/accueil/).
Marco Festa-Bianchet est professeur au Département de biologie de l’Université de Sherbrooke. Il a obtenu son doctorat en écologie comportementale de l’Université de Calgary en 1987. De 1988 à 1990, il a été titulaire d’une bourse postdoctorale de l’OTAN et a fait partie du groupe de recherche sur les grands animaux de l’Université Cambridge. Il a mené des recherches approfondies sur les ongulés de montagne, le caribou et le kangourou. Il a déjà été membre et coprésident du Sous-comité de spécialistes des mammifères terrestres du COSEPAC et a été président du COSEPAC durant 4 ans.
Collections examinées
Aucune collection n’a été examinée pour la préparation du présent rapport de situation.
Annexe1. Tableau d’évaluation des menaces pour la population migratrice de l’Est (UD 4)
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème
- Caribou (population migratrice de l’Est) UD 4
- Date
- 21/01/2016
- Évaluateur(s) :
-
Membres : Graham Forbes (coprésident SCS MT), Dwayne Lepitzki (animateur du COSEPAC), Donna Hurlburt (coprésidente SC des CTA), Isabelle Gauthier (Qc), Shelley Moores (T.-N.-L.)
Rédacteurs du rapport : Steeve Cote et Marco Festa-Bianchet
Spécialistes externes : John Pisapio (T.-N.-L.), Martin Lougheed (Parcs - Torngat), Darroch Whitaker (Parcs - Torngat), Todd Copeland (Ont.), Darren Elder (Ont. - MRN), Vincent Brodeur (Qc), Allan Penter (Nation crie), Josée Brunelle (CCCPP), Natalie D’Astous (Nation Naskapi de Kawawachikamach), Jennifer Mitchell (OTCFF), Serge Couturier (expert-conseil en biologie pour l’OTCFF), Roderick Pachano (CGRFRME), Mark O’Connor (Société Makivik), Karen Timm (Secrétariat du COSEPAC) - Références :
- Ébauches du rapport du COSEPAC et du tableau d’évaluation fournies par les rédacteurs, Steeve Cote et Marco Festa-Bianchet; téléconf. tenue le 21 janvier 2016
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 1 | 0 |
| C | Moyen | 2 | 1 |
| D | Faible | 3 | 5 |
| - | Impact global des menaces calculé : | Très élevé | Élevé |
- Impact global des menaces attribué :
- B = Élevé
| Menace | Menace | Menace | Impact (calculé) | Impact (calculé) | Impact (calculé) | Portée (10 proch. années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | Développement résidentiel et commercial | cellule vide | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Modérée (peut-être à court terme, < 10 ans) | cellule vide |
| 1.1 | Zones résidentielles et urbaines | Zones résidentielles et urbaines | cellule vide | cellule vide | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Modérée - négligeable | Zones urbaines de très faible densité. L’aménagement de lots résidentiels additionnels est probablement prévu; la portée et l’immédiateté de cette menace sont inconnues, mais si celle-ci se concrétisait son impact serait extrême. |
| 1.2 | Zones commerciales et industrielles | Zones commerciales et industrielles | cellule vide | cellule vide | Négligeable | Négligeable (< 1 %) | Extrême (71-100 %) | Modérée - négligeable | L’aménagement de zones commerciales et industrielles est probablement prévu; la portée et l’immédiateté de cette menace sont inconnues, mais si celle-ci se concrétisait son impact serait extrême. |
| 1.3 | Zones touristiques et récréatives | Zones touristiques et récréatives | cellule vide | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Modérée (peut-être à court terme, < 10 ans) | La création de nouveaux parcs est prévue dans cette UD, et des travaux de planification sont en cours pour la création d’aires protégées dans les aires de répartition de la rivière George et de la rivière aux Feuilles. Toutefois, le pourcentage d’infrastructures sera négligeable dans ces parcs et aires protégées prévues, et cette menace sera négligeable dans l’ensemble. |
| 2 | Agriculture et aquaculture | Agriculture et aquaculture | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Cette UD ne devrait pas être menacée par l’agriculture et l’aquaculture au cours des 10 prochaines années. |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | Cultures annuelles et pérennes de produits autres que le bois | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.2 | Plantations pour la production de bois et de pâte | Plantations pour la production de bois et de pâte | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.3 | Élevage de bétail | Élevage de bétail | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.4 | Aquaculture en mer et en eau douce | Aquaculture en mer et en eau douce | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3 | 3 | Production d’énergie et exploitation minière | BD | Élevé - faible | Élevé - faible | Grande - petite (1-70 %) | Élevée – modérée (11-70 %) | Modérée (peut-être à court terme, < 10 ans) | cellule vide |
| 3.1 | 3.1 | Forage pétrolier et gazier | cellule vide | Négligeable | Négligeable | Négligeable (< 1 %) | Modérée – légère (1-30 %) | Faible (peut-être à long terme, > 10 ans) | Il n’y a actuellement aucun forage pétrolier ou gazier dans l’aire de répartition. Normalement, l’exploitation pétrolière et gazière dans cette région aurait une grande empreinte et ne toucherait pas seulement quelques zones éparses. Le caribou évite ce type d’activités. |
| 3.2 | 3.2 | Exploitation de mines et de carrières | BD | Élevé - faible | Élevé - faible | Grande - petite (1-70 %) | Élevée – modérée (11-70 %) | Modérée (peut-être à court terme, < 10 ans) | Le nombre de mines est actuellement faible, mais pourrait augmenter. Si une mine était créée, une proportion élevée de l’UD pourrait migrer à proximité de celle-ci durant le printemps et l’automne. Il y a quelques projets de mines, dont certaines dans des zones sensibles. On ignore si ces projets seront approuvés et, le cas échéant, quand cela se produira. Il est à signaler que l’estimation ne tient pas ici compte des routes menant aux mines. Même si des mesures d’atténuation appropriées étaient appliquées, les effets pourraient être graves pour le caribou. |
| 3.3 | 3.3 | Énergie renouvelable | D | Faible | Faible | Restreinte – petite (1-30 %) | Modérée – légère (1-30 %) | Modérée (peut-être à court terme, < 10 ans) | Il y a une éolienne dans un site minier existant. Il existe des projets de nouveaux parcs éoliens qui pourraient avoir des répercussions sur la harde de la rivière aux Feuilles. Cette technologie a des répercussions à très grande échelle dans le paysage. |
| 4 | 4 | Corridors de transport et de service | D | Faible | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (continue) | cellule vide |
| 4.1 | 4.1 | Routes et voies ferrées | D | Faible | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (continue) | Le réseau routier est limité, mais prend de l’expansion. Les routes facilitent l’accès pour les chasseurs, qui utilisent ensuite des motoneiges pour atteindre les caribous. Si une route menant à Kuujjuarapik est construite, une grande proportion de la sous-population de la rivière aux Feuilles serait exposée à cette menace. Cette route est associée à la Convention de la Baie-James et du Nord québécois. La mortalité routière et les effets de l’entretien des routes pourraient être négligeables. La mortalité routière comprend également les individus blessés qui meurent à l’écart de la route (qui pourraient être plus nombreux que ceux trouvés en bordure de la route). Des cas de myopathie ont été observés chez des animaux ayant couru sur de longues distances sur les routes (et qui pourraient eux aussi mourir à l’écart de la route), et ce phénomène pourrait réduire l’état corporel des individus et avoir une incidence sur la reproduction. La gravité se rapproche davantage de la valeur inférieure de la plage de gravité. |
| 4.2 | 4.2 | Lignes de services publics | cellule vide | Négligeable | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Inconnue | La construction de nouvelles lignes électriques est envisagée. Si le Plan Nord (plan de développement économique) se poursuit, l’impact pourrait être élevé. |
| 4.3 | 4.3 | Voies de transport par eau | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.4 | 4.4 | Corridors aériens | cellule vide | Négligeable | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Élevée (continue) | Vols commerciaux réguliers vers les collectivités. |
| 5 | 5 | Utilisation des ressources biologiques | C | Moyen | Moyen | Généralisée (71-100 %) | Modérée (11-30 %) | Élevée (continue) | cellule vide |
| 5.1 | 5.1 | Chasse et capture d’animaux terrestres | C | Moyen | Moyen | Généralisée (71-100 %) | Modérée (11-30 %) | Élevée (continue) | La chasse est encore autorisée pour la TRAF; la chasse sportive est interdite pour la TRG, mais une récolte par les Autochtones est encore possible. Aucun quota dans le cas d’au moins 3 hardes. Chasses sportive et de subsistance en cours dans les hardes en Ontario et au Manitoba. |
| 5.2 | 5.2 | Cueillette de plantes terrestres | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5.3 | 5.3 | Exploitation forestière et récolte du bois | cellule vide | Non calculé (à l’extérieur de la période d’évaluation) | Non calculé (à l’extérieur de la période d’évaluation) | Petite (1-10 %) | Modérée (11-30 %) | Faible (peut-être à long terme, > 10 ans) | La limite nord de l’exploitation forestière industrielle s’étend vers le nord, et cette activité est en partie préoccupante pour une sous-population en Ontario. |
| 5.4 | 5.4 | Pêche et récolte de ressources aquatiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6 | 6 | Intrusions et perturbations humaines | D | Faible | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (continue) | cellule vide |
| 6.1 | 6.1 | Activités récréatives | cellule vide | Négligeable | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Élevée (continue) | L’accès aux zones éloignées (p. ex. en motoneige) pour la chasse peut avoir des répercussions sur de nombreux caribous. |
| 6.2 | 6.2 | Guerre, troubles civils et exercices militaires | cellule vide | Négligeable | Négligeable | Petite (1-10 %) | Négligeable (< 1 %) | Élevée (continue) | Il y a des entraînements à basse altitude de pilotes d’avion à réaction, mais dans une moindre mesure que dans le passé; d’autres types d’exercices militaires sont en cours. Cette menace touche principalement la harde de la rivière George. Des exercices militaires au sol sont réalisés en hiver au Labrador. |
| 6.3 | 6.3 | Travail et autres activités | D | Faible | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (continue) | Des vols d’hélicoptère à basse altitude sont couramment réalisés pour l’exploration géologique, les travaux sismiques, les suivis environnementaux et les recherches, et les vols peuvent être très nombreux certaines années. |
| 7 | 7 | Modifications des systèmes naturels | CD | Moyen - Faible | Moyen - Faible | Grande (31-70 %) | Modérée – légère (1-30 %) | Élevée (continue) | cellule vide |
| 7.1 | 7.1 | Incendies et suppression des incendies | CD | Moyen - Faible | Moyen - Faible | Grande (31-70 %) | Modérée – légère (1-30 %) | Élevée (continue) | Les comportements migratoires de ces caribous font en sorte qu’ils évitent en partie les zones brûlées, mais les vastes incendies causent une perte d’habitat. L’augmentation des perturbations associées aux incendies soulève des préoccupations dans la région de la baie James. |
| 7.2 | 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | D | Faible | Faible | Généralisée (71-100 %) | Légère (1-10 %) | Élevée (continue) | La construction de nouveaux barrages est possible. Grands réservoirs hydroélectriques. La majeure partie de la sous-population de la rivière aux Feuilles passera près de barrages. |
| 7.3 | 7.3 | Autres modifications de l’écosystème | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 8 | 8 | Espèces et gènes envahissants ou autrement problématiques | D | Faible | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (continue) | cellule vide |
| 8.1 | 8.1 | Espèces exotiques (non indigènes) envahissantes | cellule vide | Inconnu | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | On ignore si le parasite du genre Besnoitia est indigène. S’il est exotique, la portée est probablement beaucoup plus élevée. On ne dispose pas actuellement d’information pour établir un lien entre celui-ci et la mortalité; un tel lien a toutefois été établi chez le bétail. Il est possible que cette information ne soit pas disponible à temps pour l’évaluation. On a signalé l’introduction de bœufs musqués en Ungava, et ceux-ci pourraient interagir avec le caribou dans son aire d’estivage; effets inconnus. |
| 8.2 | 8.2 | Espèces indigènes problématiques | D | Faible | Faible | Petite (1-10 %) | Légère (1-10 %) | Élevée (continue) | Le caribou et ses prédateurs ont coévolué, et cette menace est de faible gravité. On sait peu de choses à ce sujet actuellement. |
| 8.3 | 8.3 | Matériel génétique introduit | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Aucune différenciation génétique. Toutefois, il pourrait y avoir des rennes introduits dans les îles de la baie d’Hudson, mais on ignore si c’est le cas, et l’impact serait très faible. |
| 9 | 9 | Pollution | cellule vide | Inconnu | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 9.1 | 9.1 | Eaux usées domestiques et urbaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.2 | 9.2 | Effluents industriels et militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.3 | 9.3 | Effluents agricoles et sylvicoles | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.4 | 9.4 | Déchets solides et ordures | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.5 | 9.5 | Polluants atmosphériques | cellule vide | Inconnu | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | Les dépôts secs (mercure) soulèvent des préoccupations. |
| 9.6 | 9.6 | Apports excessifs d’énergie | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10 | 10 | Phénomènes géologiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.1 | 10.1 | Volcans | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.2 | 10.2 | Tremblements de terre et tsunamis | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.3 | 10.3 | Avalanches et glissements de terrain | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11 | 11 | Changements climatiques et phénomènes météorologiques violents | cellule vide | Inconnu | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | Signes d’augmentation des cycles de gel-dégel, diminution de la disponibilité des lichens et changements touchant la végétation. |
| 11.1 | 11.1 | Déplacement et altération de l’habitat | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Voir 11; impact considéré comme inconnu à cause des données trop limitées pour la quantification; cette menace soulève des préoccupations considérables, et on s’attend à ce qu’elle soit importante dans le futur. |
| 11.2 | 11.2 | Sécheresses | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.3 | 11.3 | Températures extrêmes | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.4 | 11.4 | Tempêtes et inondations | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
Classification des menaces d’après l’IUCN-CMP, Salafsky et al. (2008).
Annexe 2. Tableau d’évaluation des menaces pour la population des monts Torngat (UD 10)
Tableau d’évaluation des menaces
- Nom scientifique de l’espèce ou de l’écosystème
- Caribou (population des monts Torngat) – UD 10
- Date
- 08/02/2016
- Évaluateur(s) :
- Membres : Graham Forbes (coprésident SCS MT), Dwayne Lepitzki (animateur du COSEPAC), Donna Hurlburt (coprésidente SC des CTA), Isabelle Gauthier (Qc), Shelley Moores (T.-N.-L.) Rédacteurs du rapport : Steeve Cote et Marco Festa-Bianchet Spécialistes externes : Martin Lougheed (Parcs - Torngat), Darroch Whitaker (Parcs - Torngat), Vincent Brodeur (Qc), Josée Brunelle (CCCPP), Serge Couturier (expert conseil en biologie poir l’OTCFF), Karen Timm (Secrétariat du COSEPAC)
- Références :
- Les résultats de la téléconf. sur l’UD 4, tenue le 21 janvier 2016, ont été utilisés comme ébauche pour la présente UD le 8 février 2016.
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 1 | 1 |
| C | Moyen | 0 | 0 |
| D | Faible | 0 | 0 |
| - | Impact global des menaces calculé : | Élevé | Élevé |
- Impact global des menaces attribué :
- B = Élevé
| Menace | Menace | Impact (calculé) | Impact (calculé) | Portée (10 proch. années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (continue) | cellule vide |
| 1.1 | Zones résidentielles et urbaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 1.2 | Zones commerciales et industrielles | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 1.3 | Zones touristiques et récréatives | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (continue) | Au Québec, dans la région du Nunavik, il y a un grand parc dans l’aire de répartition de la harde, où quelques camps ont été aménagés dans le passé, et d’autres pourraient être ajoutés dans le futur. Au Labrador, environ 4-5 camps accessibles par avion ont été créés. |
| 2 | Agriculture & aquaculture | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.2 | Plantations pour la production de bois et de pâte | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.3 | Élevage de bétail | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.4 | Aquaculture en mer et en eau douce | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3 | Production d’énergie et exploitation minière | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Modérée (peut-être à court terme, < 10 ans) | cellule vide |
| 3.1 | Forage pétrolier et gazier | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3.2 | Exploitation de mines et de carrières | cellule vide | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Modérée (peut-être à court terme, < 10 ans) | cellule vide |
| 3.3 | Énergie renouvelable | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4 | Corridors de transport et de service | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.1 | Routes et voies ferrées | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Aucune route dans cette région |
| 4.2 | Lignes de services publics | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Aucune ligne de services publics dans cette région |
| 4.3 | Voies de transport par eau | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Sans objet. Si le corridor du détroit de Davis est développé ou augmenté à cause de l’ouverture du passage du Nord, il pourrait y avoir une hausse de l’achalandage au cours des 10 prochaines années. Cependant, cela n’aura probablement aucune incidence sur les individus, car ils ne migrent pas entre les îles. Discussion en cours concernant un port en eau profonde dans la baie d’Hudson. |
| 4.4 | Corridors aériens | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5 | Utilisation des ressources biologiques | B | Élevé | Généralisée (71-100 %) | Élevée (31-70 %) | Élevée (continue) | cellule vide |
| 5.1 | Chasse et capture d’animaux terrestres | B | Élevé | Généralisée (71-100 %) | Élevée (31-70 %) | Élevée (continue) | Selon les CTA, la chasse excessive représente le plus important facteur de déclin du caribou des MT. Les droits de chasse sont protégés dans le nord du Labrador et du Québec, mais il y a un moratoire sur la chasse à l’heure actuelle. Ce moratoire est en vigueur seulement au Labrador, et non au Québec, où les hardes sont plus accessibles durant l’hiver. On a tenu compte des taux de chasse actuels dans le calcul de la gravité. |
| 5.2 | Cueillette de plantes terrestres | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5.3 | Exploitation forestière et récolte du bois | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5.4 | Pêche et récolte de ressources aquatiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6 | Intrusions et perturbations humaines | cellule vide | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Élevée (continue) | cellule vide |
| 6.1 | Activités récréatives | cellule vide | Négligeable | Grande (31-70 %) | Négligeable (< 1 %) | Élevée (continue) | Cette harde est moins migratrice que celle de la rivière George, et elle peut donc passer l’hiver dans des localités très peu accessibles. |
| 6.2 | Guerre, troubles civils et exercices militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6.3 | Travail et autres activités | cellule vide | Négligeable | Généralisée (71-100 %) | Négligeable (< 1 %) | Élevée (continue) | Il y a des vols de recherche durant 6 semaines chaque été (4 avions Twin Otter par semaine). Certains relevés aériens sont réalisés pour estimer les effectifs, et il pourrait y avoir des projets de pose de collets au cours des 10 prochaines années, mais cela est incertain. |
| 7 | Modifications des systèmes naturels | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 7.1 | Incendies et suppression des incendies | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Il y a des incertitudes quant à l’historique des incendies. |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 7.3 | Autres modifications de l’écosystème | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 8 | Espèces et gènes envahissants ou autrement problématiques | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 8.2 | Espèces indigènes problématiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Certaines données indiquent que le nombre d’ours noirs augmente du côté du Labrador, ce qui pourrait constituer une menace sur le plan de la prédation (davantage qu’un facteur limitatif). Incertitude quant à l’impact global sur la population. |
| 8.3 | Matériel génétique introduit | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9 | Pollution | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 9.1 | Eaux usées domestiques et urbaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.2 | Effluents industriels et militaires | cellule vide | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (continue) | cellule vide |
| 9.3 | Effluents agricoles et sylvicoles | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.4 | Déchets solides et ordures | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.5 | Polluants atmosphériques | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 9.6 | Apports excessifs d’énergie | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10 | Phénomènes géologiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.1 | Volcans | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.2 | Tremblements de terre et tsunamis | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.3 | Avalanches et glissements de terrain | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | On a tenu compte des avalanches. |
| 11 | Changements climatiques et phénomènes météorologiques violents | cellule vide | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (continue) | cellule vide |
| 11.1 | Déplacement et altération de l’habitat | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Des données récentes montrent qu’il y a eu une rapide progression de l’aulne et du bouleau nain, entraînant une conversion de la toundra. Les effets sur le caribou sont inconnus, mais il pourrait y avoir des répercussions sur l’alimentation (perte d’habitat d’alimentation). Le caribou consomme le bouleau nain et le saule, mais utilise principalement les lichens. Un récent rapport de l’APC concernant un changement subtil de la végétation dans les monts Torngat (J. Quirouette, 2015) quantifie les changements survenus au cours des 10 dernières années. Des changements touchant l’habitat des MT ont été signalés en lien avec les changements climatiques. Selon les CTA, les monts Torngat verdissent (Parks Canada Agency, 2008). La couverture de végétaux, particulièrement d’arbustes, a augmenté au cours des dernières décennies. |
| 11.2 | Sécheresses | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.3 | Températures extrêmes | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.4 | Tempêtes et inondations | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | Les tempêtes de verglas et les inondations pourraient devenir plus fréquentes à cause des changements climatiques prévus dans cette région. |
Classification des menaces d’après l’IUCN-CMP, Salafsky et al. (2008).
Détails de la page
- Date de modification :