Évaluation préalable pour le Défi concernant
Archivée
le décaméthylcyclopentasiloxane
(D5)
Numéro de registre du Chemical Abstracts Service
541-02-6
Environnement Canada
Santé Canada
Novembre 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexes
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du décaméthylcyclopentasiloxane (D5), dont le numéro de registre du Chemical Abstracts Service est 541-02-6. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car il a été prouvé qu’elle répondait initialement aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque (PBiT) pour les organismes non humains et on sait qu’elle est commercialisée au Canada.
Bien que le processus de catégorisation n’ait pas déterminé que l’évaluation des risques du D5 pour la santé humaine devait être prioritaire, une évaluation de cette substance en fonction de la santé humaine a été effectuée en raison de la similarité de sa structure et de son profil d’utilisation par rapport à ceux du D4, qui est également connu sous le nom d’octaméthylcyclotétrasiloxane, une substance dont l’évaluation fait l’objet d’une priorité élevée à cause des risques qu’elle présente tant pour la santé humaine que pour l’environnement conformément à la LCPE (1999).
Le D5 est un produit chimique industriel qui n’était pas fabriqué au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé surtout à l’état pur, dans des mélanges avec d’autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. À partir des réponses reçues à la suite d’un avis publié en vertu de l’article 71 de la LCPE (1999), on a établi qu’entre 1 000 000 et 10 000 000 kg de D5 avaient été importés au Canada en 2006.
Le D5 peut être rejeté dans l’environnement lors de processus industriels utilisés dans le cadre d’opérations de mélange, de formulation et de conditionnement, et lors d’opérations de prévention de la mousse et de dégraissage. Il peut également être rejeté à la suite de l’utilisation et de l’élimination de produits d’hygiène. L’air, les eaux usées et les terres agricoles constituent les milieux naturels cibles du D5 à cause de ses propriétés physiques et chimiques et de ses profils d’utilisation.
Le D5 est persistant dans l’air avec des demi-vies atmosphériques calculées de plus de 3 jours. Le D5 pourrait être transporté sur de grandes distances dans l'atmosphère. Toutefois, il risque peu de se déposer dans l'eau ou dans le sol en régions éloignées. La demi-vie d’hydrolyse du D5 dans les eaux canadiennes varie entre 1 et 733 jours, ce qui indique que la substance est persistante dans certaines conditions dans les eaux canadiennes, notamment dans les eaux froides et neutres (5 à 10 ºC). D’après la substance analogue de composition similaire D4 qui indique une persistance probable en milieu sédimentaire, il apparaît que le D5 est également persistant dans les sédiments, avec une demi-vie allant de 49 à 588 jours estimée dans des conditions sédimentaires canadiennes réelles (température comprise entre 5 et 25 °C). Le D5 ne semble pas être persistant dans le sol selon la dégradation catalysée par l’argile, le diméthylsilanediol correspondant au produit stable de l’hydrolyse. Le D5 satisfait donc au critère de persistance tel que défini dans le Règlement sur la persistance et la bioaccumulation.
La valeur empirique du facteur de bioconcentration et la valeur modélisée du facteur de bioaccumulation se situent tous les deux au dessus de 5 000, indiquant ainsi que le D5 peut présenter un fort potentiel d’accumulation dans les organismes aquatiques. Toutefois, d’après les données d’une étude de la bioamplification dans les poissons et une étude de l’accumulation dans le biote et les sédiments chez les invertébrés, il est suggéré que le potentiel de bioaccumulation du D5 peut être plus faible et ce, probablement en raison d’une biodisponibilité réduite. Ainsi, bien que le D5 a un potentiel de bioaccumulation dans le biote, il n’est pas possible de conclure à ce moment que le D5 rencontre le critère de bioaccumulation tel que définis dans le Règlement sur la persistance et la bioaccumulation, compte tenu des preuves contradictoires issues des diverses analyses en laboratoire et des modèles prédictifs.
Des effets nocifs dus à l’exposition au D5 chez les organismes se trouvant dans les sédiments ont été observés à une concentration de 160 mg/kg. Les données expérimentales en matière de toxicité n’ont montré aucun effet nocif sur les organismes aquatiques pélagiques à des concentrations allant jusqu’à 0,015 mg/L ce qui correspond à peu près à sa limite de solubilité dans l’eau. Toutefois, il est possible que la toxicité puisse se manifester à une limite de solubilité si l’exposition est suffisante et si des espèces sensibles sont présentes. Les quotients de risque déterminés d’après différents scénarios d’exposition impliquant des rejets de D5 issus des utilisations des consommateurs et industrielles, montrent qu’un total de 65 sites (environ 6,8 %) étudiés au Canada présentent dans l’eau des concentrations environnementales prévues supérieures à 0,015 mg/L (concentration prévue sans effet sur les organismes aquatiques). Étant donné la persistance du D5 dans les eaux froides canadiennes et sa capacité de bioaccumulation dans le biote, une exposition environnementale à long terme au D5 peut engendrer des effets nocifs sur les organismes aquatiques dans certaines régions du Canada.
Principalement sur la base de l’évaluation fondée sur des preuves et réalisée par la l’Agence de protection de l’environnement du Danemark, on a pu déterminer que l’un de ses effets potentiels, en ce qui a trait à la toxicité des doses répétées, était la cancérogénicité, selon une étude de deux ans chez les rats. Dans le cadre de cette étude, des tumeurs utérines ont été observées à des concentrations d’exposition supérieures à celles correspondant à des effets établis pour les poumons et le foie selon plusieurs autres études de toxicité. On a pu observer que les poumons étaient un organe cible pour l’exposition au D5 par inhalation, et que le foie était un organe cible pour l’exposition par voie orale et par inhalation. La concentration à effet critique concernant la toxicité des doses répétées par inhalation a été estimée selon une augmentation significative de l’incidence de la minéralisation vasculaire pulmonaire lors d’une étude sur la reproduction chez les rats. D’après une comparaison entre la concentration à effet critique pour les effets des doses répétées par inhalation et la limite supérieure prudente estimée de l’exposition par inhalation pour le décaméthylcyclopentasiloxane, on obtient une marge d’exposition suffisante. La concentration à effet critique concernant la toxicité des doses répétées a été déterminée selon l’étude de l’augmentation du poids du foie chez les rats pendant 90 jours et selon la détermination des concentrations à effets critiques par voir orale pour des composés similaires, tels que l’octaméthylcyclotétrasiloxane et le dodécaméthylcyclohexasiloxane. Selon une étude indépendante sur l’évaluation précise de l’exposition concernant les produits d’hygiène, une marge d’exposition appropriée a pu être déterminée en comparant la concentration à effet critique des effets des doses répétées par voie orale et une estimation haute de l’absorption quotidienne de D5 par l’utilisation de produits d’hygiène
D’après les informations disponibles sur sa capacité à causer des effets nocifs sur l'environnement, on peut conclure que le D5 pénètre dans l’environnement en une quantité ou une concentration, ou dans des conditions de nature à avoir immédiatement ou à long terme, un effets nocif, sur l’environnement ou sur sa diversité biologique.
Selon les informations disponibles sur son potentiel d’effets nocifs sur la santé humaine, on peut conclure que le D5 ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Cette substance s’inscrira dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l'efficacité des mesures de contrôle possibles définies à l'étape de la gestion des risques.
D'après les renseignements disponibles, le D5 répond à au moins un des critères énoncés à l'article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques, et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu du classement attribué par d'autres organismes nationaux ou internationaux quant à la cancérogénicité, la génotoxicité ou la toxicité sur le plan du développement ou de la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
L'évaluation des risques que comporte le décaméthylcyclopentasiloxane (aussi connu sous le nom de D5) pour l'environnement a été jugée hautement prioritaire, car cette substance est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu'elle est commercialisée au Canada. Le volet du Défi portant sur le D5 a été lancé le 12 mai 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007). En même temps a été publié le profil de cette substance, qui présentait l’information technique et écologique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Grâce à ce Défi, plus de 100 présentations de données relatives à cette substance ont été reçues concernant ses propriétés physiques et chimiques, son potentiel de bioaccumulation, sa persistance, son écotoxicologie et les quantités disponibles dans le commerce entre autres.
Bien que le processus de catégorisation n'ait pas permis de déterminer que l'évaluation des risques du D5 pour la santé humaine devait faire l'objet d'une priorité, une évaluation de cette substance en fonction de la santé humaine a aussi été recommandée en raison de la similarité de sa structure et de son profil d'utilisation par rapport à ceux du D4, connu également sous le nom d'octaméthylcyclotétrasiloxane, une substance dont l'évaluation des risques tant pour la santé humaine que pour l'environnement a été jugée hautement prioritaire conformément à la LCPE (1999). Par conséquent, la présente évaluation porte principalement sur les informations pertinentes pour l'évaluation des risques touchant l'environnement et la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques énoncés à l'article 64 de la Loi :
« 64. [...] est toxique toute substance qui pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique;
- mettre en danger l'environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaines. »
Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données liées à l'évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et de recherches documentaires récentes (jusqu'en août 2008) ayant servi de base aux sections du présent document qui portent sur la santé humaine et l'environnement. Les études importantes ont fait l'objet d'une évaluation critique; les résultats de la modélisation ont pu être utilisés dans la formulation des conclusions. Les renseignements présentés dans des évaluations des dangers réalisées par d'autres instances ont été pris en considération lorsqu'ils étaient disponibles et pertinents. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information les plus importants en rapport avec la conclusion.
L'évaluation des risques pour la santé humaine tient compte des données qui ont trait à l'estimation de l'exposition (non professionnelle) de la population dans son ensemble et des informations relatives aux dangers pour la santé (fondées essentiellement sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l'effet critique retenu ou sur l’écart (ou marge) entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition. Elles tiennent compte de la confiance accordée à l'exhaustivité des bases de données identifiées qui portent sur l'exposition et les effets dans le contexte d'une évaluation préalable. L'évaluation préalable n'est pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'une synthèse des informations les plus importantes permettant d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel des programmes des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'un examen externes par des pairs. Des commentaires sur les parties techniques relatives à la santé humaine ont été fournis par le Toxicology Excellence for Risk Assessment (TERA). Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Les principales données et considérations sur lesquelles repose la présente évaluation sont résumés ci-après.
Aux fins du présent document, le décaméthylcyclopentasiloxane est désigné par D5, un nom abrégé dérivé de la nomenclature des siloxanes élaborée par General Electric (Hurd, 1946).
Le D5 appartient au groupe des composés cycliques volatils de type méthylsiloxane (cVMS) de poids moléculaire relativement faible (inférieur à 600 g/mol) et à pression de vapeur élevée. Ces cVMS sont des liquides à base de silicones volatiles à faible viscosité, constitués d'unités structurelles [-Si(CH3)2O-]x à configuration cyclique. Le D5 comporte cinq de ces unités structurelles [-Si(CH3)2O-] (× = 5), comme le montre la structure chimique illustrée ci-dessous (tableau 1).
| Numéro de registre du Chemical Abstracts Service (no CAS) | 541-02-6 |
|---|---|
| [1] National Chemical Inventories (NCI), 2006 : AICS (inventaire des substances chimiques de l'Australie); ASIA PAC (listes des substances de l'Asie Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); PICCS (inventaire des produits et substances chimiques des Philippines); NZIoC (inventaire des substances chimiques de la Nouvelle Zélande); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États Unis). | |
| Nom dans la Liste intérieure des substances (LIS) | Décaméthylcyclopentasiloxane |
| Noms dans les National Chemical Inventories (NCI)[1] | Cyclopentasiloxane, 2,2,4,4,6,6,8,8,10,10-decaméthyl- (TSCA); Cyclopentasiloxane, decaméthyl- (AICS, PICCS, ASIA-PAC, NZIoC); Décaméthylcyclopentasiloxane (EINECS); Decamethyl cyclopentasiloxane (ECL) |
| Autres noms | Cyclic dimethylsiloxane pentamer; Cyclo-decamethylpentasiloxane; D5; Dimethylsiloxane pentamer; Pentacyclomethicone |
| Principale classe chimique ou utilisation | Composés organosiliciés |
| Principale sous-classe chimique | Méthylsiloxanes cycliques volatils (cVMS) |
| Formule chimique | C10H30O5Si5 |
| Structure chimique |  |
| Simplified Molecular Input Line Entry System (SMILES) | C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 |
| Masse moléculaire | 370,78 g/mol |
Le D5 est également référencé sous un autre numéro de registre du Chemical Abstracts Service. Ce numéro, n° CAS 69430 24 6, désigne un mélange de cyclosiloxanes substitués par des groupes diméthyl, de structure générale [ Si(CH3)2O ]×, à configuration cyclique, où x est habituellement inférieur à 8 et plus souvent compris entre 3 et 7 (SEHSC, 2007b). Ce n° CAS est associé aux noms suivants : cyclopolydiméthylsiloxane, cyclopolydiméthylsiloxane (DX), diméthylcyclosiloxanes, diméthylcyclopolysiloxane, composés polydiméthylsiloxy cycliques, polydiméthylcyclosiloxane, cyclométhicone et mélanges de cyclosiloxanes. Dans ce rapport, on privilégiera le terme cyclométhicone couramment utilisé pour ce mélange en cosmétologie. Pour cette évaluation, les données recueillies pour le D4 ont également été utilisées étant donné la similarité structurelle entre les deux substances, telle qu'elle est illustrée dans le tableau suivant :
| D4 | D5 |
|---|---|
 |
 |
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du D5 qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | Valeur[1] | Température (°C) | Références |
|---|---|---|---|---|
| [1] Les valeurs et unités entre parenthèses représentent celles qui ont été initialement déclarées par les auteurs ou estimées au moyen des modèles. [*] Valeurs utilisées pour la modélisation aux fins de cette évaluation préalable. |
||||
| Point de fusion (ºC) |
Expérimental | -38[*] | PhysProp, 2006 | |
| Modélisé | -5,19 | MPBPWIN, 2000 | ||
| Point d'ébullition (ºC) |
Expérimental | 210[*] | PhysProp, 2006 | |
| Modélisé | 196,78 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) |
Expérimental | 954 | SEHSC, 2005a | |
| Pression de vapeur (Pa) |
Expérimental | 26,66 (0,20 mm Hg) |
25 | Flaningam, 1986 |
| 33,2[*] (0,249 mm Hg) |
25 | SEHSC, 2005a | ||
| Modélisé | 29,06 (0,22 mm Hg) |
25 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 3 350 000[*] (33,1 atm·m3/mol) |
Calculée à partir de la valeur de Kae de Xu et Kropscott, 2007 | |
| 13 444 (0,133 atm·m3/mol) |
23 | David et al., 2000 | ||
| 32 317 (0,319 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| 29 831 (0,294 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| Modélisé | 12 159 (0,12 atm·m3/mol) |
25 | HENRYWIN, 2000 | |
| Log Kae (coefficient de partage air-eau) [sans dimension] | Expérimental | 3,13[*] | 24.6 | Xu et Kropscott, 2007 |
| Log Koe (coefficient de partage octanol-eau) [sans dimension] |
Expérimental | 5,2 | Bruggeman et al., 1984 | |
| 8,03[*] | 25.3 | Kozerski, 2007 | ||
| 4,76 | 22,4 | Sible, 2006 | ||
| Modélisé | 5,71 | KOWWIN, 2000 | ||
| Log Kce (coefficient de partage carbone organique-eau) [sans dimension] |
Expérimental | 5,17 | SEHSC, 2005a | |
| Modélisé | 5,16 | PCKOCWIN, 2000 | ||
| Solubilité dans l'eau (mg/L) |
Expérimental | 0,017[*] | 23 | Varaprath et al., 1996 |
| Modélisé | 0,05 | 25 | WSKOWWIN, 2000 | |
| Log Koa (coefficient de partage octanol-air) [sans dimension] |
Expérimental | 5,06[*] | 24 | Xu, 2006 |
Récemment, les valeurs empiriques du log Koe pour D5 ont été reçues et évaluées de manière critique. Il y a peu de temps, on a déterminé une valeur expérimentale de log Koe de 8,03 pour le D5 (pureté de 99,19 %) à 25,3 °C, à l'aide de la méthode de l'agitation lente conformément à la Ligne directrice 123 de l'OCDE (Kozerski, 2007). Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. On a utilisé des récipients de borosilicate de 2 L qu'on a laissé atteindre la température d'équilibre avant d'y verser 1,6 L d'eau pure, dans laquelle on a versé avec soin 0,10 L de 1-octanol pour réduire au minimum la formation de gouttelettes. On a commencé l'essai en versant dans le récipient d'essai environ 5 mL de solution d'enrichissement (119,68 mg D5/g) dans du 1-octanol. La température a été maintenue entre 25,2 et 25,6 ºC pendant l'étude. L'équilibre a été considéré comme atteint 24 heures après le début de l'essai. La moyenne pondérée calculée de Koe était de 8,03. Il y avait un espace vide d'environ 0,3 L (15 % du volume total) dans les récipients d'essai, ce qui indique qu'il peut y avoir eu une certaine volatilisation du D5 dans l'espace vide à partir de la phase aqueuse (forte pression de vapeur, faible solubilité dans l'eau). Toutefois, une vérification du bilan massique du récipient semble indiquer que la quantité totale de D5 évaporée était inférieure à 2 %. Cette étude peut, par conséquent, être considérée acceptable et la valeur de log Koe de 8,03 sera utilisée dans le présent rapport d'évaluation préalable.
On a déterminé une valeur expérimentale de 4,76 pour le log Koe du D5 à l'aide d'une méthode d'agitation lente conforme à la Ligne directrice provisoire 123 de l'OCDE (Sible, 2006). Pour cet essai, on a utilisé du D5 radiomarqué au 14C (pureté radiochimique de 99,8 %) dilué dans du D5 non marqué (99,77 %). Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. La température a été maintenue constante à 22,4 ± 0,5 ºC tout au long de l'étude. L'équilibre a été atteint en 7 jours et on a obtenu un log Koe de 4,76, selon le log Koe moyen mesuré du jour 8 au jour 11. On a analysé du D5 radiomarqué au 14C dans l'eau et l'octanol en utilisant la méthode du comptage par scintillation en milieu liquide (CSML). Les analyses de CSML ne permettent pas de distinguer le composé parent de ses produits d'hydrolyse possibles. Étant donné que le D5 peut subir une hydrolyse lente dans les conditions d'essai (Durham, 2006), sa concentration dans l'eau peut avoir été surestimée, ce qui peut avoir causé une sous-estimation de la valeur du log Koe.
Bruggeman et al. (1984) ont obtenu une valeur de log Koe de 5,2 à l'aide de la méthode du temps de rétention en chromatographie liquide à haute performance (CLHP). Cette mesure a été effectuée sur une colonne de silice liée par de l'octadécylsilyle, avec une phase mobile méthanol-eau (90:10). Des séries homologues de n-alkylbenzènes avec des valeurs connues de log Koe ont été utilisées comme composés de référence pour étalonner la méthode. À ce jour, le protocole expérimental détaillé pour cette étude n'est pas disponible.
De récentes analyses portant sur le coefficient de partage air-eau pour D4 et D5 ont été menées par Xu (Xu et Kropscott, 2007). Durant l'expérience, l'équilibre de partage entre l'air, l'eau et la phase organique (octanol) a été atteint simultanément; la valeur obtenue pour le log Koaétait de 4,94 et de 8,07 pour le log Koe pour D5. Ces deux valeurs sont relativement cohérentes avec les valeurs expérimentales mesurées par Xu (2006, tableau 2) et Kozerski (2007, tableau 2). Cette étude peut donc être considérée acceptable, et la valeur de log Kae de 3,13 pour D5 issue de l'analyse pourra être utilisée dans le présent rapport d’évaluation préalable. Une détermination simultanée de l'équilibre de partage entre l'air, l'eau et la phase organique (octanol) a été effectuée par Xu (Xu et Kropscott, 2007). Un système de double seringue personnalisé a été conçu pour mesurer l'équilibre de partage entre les trois phases. Il est constitué de deux seringues étanches : la seringue de gauche contient environ 5 mL d'eau saturée en octanol, du D5 marqué au 14C dans de l'octanol sur la phase aqueuse et une phase gazeuse d'environ 70 à 80 cm3. La seringue de droite contient entre 60 et 80 mL d'eau saturée en octanol et entre 20 et 40 cm3 d'air. Pendant l'essai, les phases gazeuses des deux seringues étaient reliées entre elles. Grâce à un système d'agitation lente de l'eau, l'équilibre entre la phase aqueuse et la phase gazeuse a été atteint après 20 heures. La valeur moyenne de log Kae de 3,13 pour D5 à 24,6 ºC a été déterminée en fonction de la radioactivité totale de D5 dans l'air et dans l'eau. Cette valeur est cohérente avec la formule relative à l'équilibre selon laquelle log Koe= log Koa + log Kae. Pour la valeur expérimentale de Kae, on obtient la constante de la loi de Henry égale à 3 350 000 Pa·m3/mol à environ 25 °C.
Pour le D5, d'autres propriétés physiques et chimiques modélisées correspondent bien aux données expérimentales mesurées. Sauf pour les données examinées ci-dessus, on utilise les données expérimentales les plus prudentes, s'il y a lieu, pour les prévisions indiquées de divers modèles dans le présent rapport d'évaluation préalable.
Il n'existe pas de sources naturelles connues de D5.
Le D5 est un produit chimique industriel qui n'était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé surtout à l'état pur, dans des mélanges avec d'autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l'article 71 de la LCPE (1999) ont permis de déterminer qu'entre 1 000 000 et 10 000 000 kg de D5 avaient été importés au Canada en 2006 (Environnement Canada, 2007), sous forme de matière première ou dans des produits finis. Les quantités de D5 importées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988).
Le D5 est un constituant du cyclométhicone (n° CAS 69430-24-6), terme utilisé dans l'industrie cosmétique. Bien que le cyclométhicone n'ait pas été contrôlé directement conformément à l'article 71 de la LCPE (1999) par Environnement Canada et Santé Canada en 2007, on constate dans certains cas que les réponses à l'avis publié en application de cet article pour l'année 2006 contenaient des données sur les quantités de D5 utilisées ou importées sous le no CAS 69430-24-6 (Environnement Canada, 2007).
La quantité du n° CAS 69430-24-6 proposée dans le commerce au Canada, déclarée pour l'année civile 1986, était de 2 220 000 kg (Environnement Canada, 1988). En 2005, le Canada était un importateur net de 11 500 000 kg de tous les types de polymères de silicone et de siloxanes (Will et al., 2007).
Le D5 est un intermédiaire dans la production des polymères de silicone de type polydiméthylsiloxane (PDMS) et tous les polymères de type PDMS contiennent des quantités résiduelles de cyclosiloxanes volatils, notamment le D5. Les polymères à faible poids moléculaire (et par conséquent à faible viscosité) peuvent contenir moins de 0,1 à 0,5 % de cyclosiloxanes volatils tandis que les polymères à poids moléculaire plus élevé (et par conséquent à plus forte viscosité) peuvent en contenir de 1 à 3 %. La proportion des cyclosiloxanes volatils représentée par le D5 varie fortement selon les produits. L'utilisation de certains produits à base de PDMS devrait entraîner des rejets de D5 (SEHSC, 2007b).
La détection du D5 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que les sources ponctuelles et diffuses contribuent à créer des concentrations de D5 dans l'environnement (Norden, 2005; Kaj et al., 2005; communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007 [ne figure pas dans les références]). L'application de pesticides contenant du D5 sur les cultures et l'épandage des boues d'épuration sur les terres agricoles, leur incinération et leur mise en décharge entraînent le rejet de D5 dans les milieux naturels. Selon certaines indications, le D5 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols, avant leur minéralisation complète (Herner et al., 2002). Ainsi, outre les rejets de résidus de D5 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Dans d'autres pays, le D5 a été reconnu comme une substance chimique produite en grandes quantités par l'Organisation de coopération et développement économiques (OCDE, 2007), l'Agence de protection de l’environnement des États-Unis (U.S. EPA, 2007) et le Bureau européen des substances chimiques (ECB, 2007).
Aux États-Unis, l'utilisation de méthylsiloxanes volatils, notamment de D6, a tendance à augmenter car ces substances ne sont pas soumises à la législation sur les composés organiques volatils (COV) de 1994 (U.S. EPA, 1994a). Les méthylsiloxanes volatils ont été utilisés comme solution de rechange aux chlorofluorocarbures (CFC) pour réduire la teneur en COV réglementée de certains produits (en particulier pour les applications de nettoyage de précision et électronique). Selon des informations de l'Agence de protection de l’environnement des États-Unis, l'importation/la production de D5 dans ce pays atteignait 4 500 à 22 500 tonnes en 1986, 1990 et 1994. Elle se situait entre 22 500 et 45 000 tonnes en 1998 et entre 45 000 et 225 000 tonnes en 2002.
En Europe, quatre sociétés ont été identifiées comme productrices/importatrices de D5 : Bayer AG en Allemagne, Dow Corning Limited au Royaume-Uni, Rhodia Chimie en France et Amway Europe en Belgique (ECB, 2007). La quantité de D5 utilisée comme intermédiaire limité au site dans l'Union européenne entre 2003 et 2004 est une information confidentielle.
Au Canada et dans le monde entier, le D5 est principalement utilisé pour la préparation de mélanges et de formulations de produits de consommation (Environnement Canada, 2007). Le D5 est aussi utilisé comme intermédiaire dans la production de polymères de type PDMS et comme produit de nettoyage à sec par quelques nettoyeurs à sec commerciaux du Canada (Green Earth, 2008). Par ailleurs, tous les polymères de silicone contiennent des quantités résiduelles à l'état de traces de cyclosiloxanes volatils, notamment le D5. Comme il est indiqué ci-dessus, le D5 est également un constituant du composé portant le no CAS 69430-24-6, appelé cyclométhicone dans l'industrie cosmétique.
Le cyclométhicone est un mélange de siloxanes cycliques volatils à faible poids moléculaire, dont les principaux ingrédients sont l'octaméthylcyclotétrasiloxane (D4), le décaméthylcyclopentasiloxane (D5) et le dodécaméthylcyclohexasiloxane (D6), que l'on retrouve en différentes proportions. Au Canada, les principales utilisations des mélanges à faible poids moléculaire de siloxanes cycliques volatils, qui peuvent contenir un pourcentage élevé de D4 ou de D5, concernent la préparation de produits d'hygiène, notamment de produits de soins capillaires et de produits de soins de la peau, et d'antitranspirants (Environnement Canada, 2007).
Les polymères de silicone qui contiennent des quantités à l'état de traces de D5 peuvent être regroupés comme des liquides, des gommes et des résines. Les utilisations de ces polymères sont décrites ci-dessous.
Les principales utilisations de liquides à base de silicone concernent notamment les ingrédients qui entrent dans la formulation de produits de soins pour les cheveux et la peau, d'antitranspirants et de déodorants, de produits pharmaceutiques, d'adjuvants de traitement comme des antimousses, des tensioactifs et des agents de démoulage, de lubrifiants, de polis et de revêtements appliqués sur divers substrats comme les textiles, les tapis et les papiers, ainsi que de produits d'étanchéité, d'enduits pour bâtiments, de lubrifiants mécaniques, de liquides caloporteurs et diélectriques et de produits de reprographie (Will et al., 2007).
Alors qu'une utilisation importante de polymères à poids moléculaire plus élevé était attendue dans la plupart de ces applications, l'utilisation de D5 a été signalée pour les antimousses (Environnement Canada, 2007). Les antimousses sont souvent utilisés à des concentrations de l'ordre de quelques parties par million par toute une gamme d'industries de transformation, notamment les pâtes et papiers, l'alimentation, le pétrole et l'industrie pétrochimique, la fabrication de produits chimiques et le traitement de l'eau. Les silicones sont également utilisés comme antimousses dans des produits d'entretien domestique tels que les nettoyants et les détergents (Will et al., 2007).
Au Canada, l'utilisation de produits à base de silicone contenant du D5 dans certains pesticides est réglementée par la Loi sur les produits antiparasitaires (ARLA, 2007).
Des mélanges liquides et en gel à base de silicone sont utilisés pour plusieurs types de produits cosmétiques et médicaux. Les liquides à base de silicone ont été approuvés comme ingrédients actifs ou non dans des produits pharmaceutiques au Canada (BDPP, 2007), le plus souvent dans des médicaments antiflatulences. On note aussi d'autres utilisations biomédicales des liquides à base de silicone au Canada, comme les démoussants utilisés pour le sang dans les équipements de manutention du sang, les barrières protectrices, les lubrifiants et le traitement en surface des pansements.
Les gommes de silicone sont utilisées pour la production d'élastomères dans des produits d'étanchéité et des adhésifs, du caoutchouc de silicone moulé et des revêtements, ainsi que pour encapsuler des médicaments. Les élastomères à base de silicone servent à fabriquer des produits de consommation comme les sucettes. Des élastomères à base de silicone sont également utilisés dans un grand nombre d'applications biomédicales, notamment des implants et des prothèses destinés à des utilisations à court et à long terme, des cathéters, des lentilles cornéennes et des prothèses dentaires (Will et al., 2007).
Les résines de silicone sont principalement utilisées dans des revêtements spéciaux et pour la production de polymères modifiés par des silicones (Will et al., 2007). Les consommateurs peuvent être exposés au D5 s'ils utilisent ces produits et s'ils se trouvent dans des espaces fermés dans lesquels des revêtements, des produits de calfeutrage, des produits d'étanchéité et du caoutchouc de silicone sont utilisés comme matériaux de construction, ou si ces derniers sont présents dans des produits de consommation.
Le D5 n'est pas déclaré à l'Inventaire national des rejets de polluants d'Environnement Canada. Cette substance fait partie d'un groupe de produits chimiques qui peuvent être utilisés pour diverses applications industrielles et de consommation associées à d'éventuels rejets très importants.
Le D5 peut être rejeté dans l'environnement par des procédés industriels qui l'utilisent comme réactif avec d'autres substances pour former des polymères et des copolymères de silicone au cours d'opérations de mélange, de formulation et de conditionnement. Toutes ces opérations ont lieu au Canada (Environnement Canada, 2007). Des rejets industriels de D5 peuvent également se produire si des polymères de silicone sont utilisés par des industries de transformation comme démoussants, agents de démoulage ou lubrifiants, ou pour d'autres applications (Environnement Canada, 2007). L'utilisation du D5 comme produit de nettoyage à sec dans le commerce (bien que les chiffres d'utilisation actuels n'indiquent pas une forte contribution) et comme dégraissant industriel peut être source de rejets dans l'atmosphère. On pense que les rejets des procédés industriels passent dans l'atmosphère et les eaux usées. Des rejets de D5 sont également dus à l'utilisation de produits d'hygiène tels que les produits de soins capillaires et les produits de soins de la peau, les antitranspirants, et ces rejets s'effectuent dans l'air et les eaux usées. Selon les estimations, plus de 90 % du D5 utilisé dans les produits d'hygiène passe dans l'atmosphère (Allen et al., 1997). Du fait des rejets de D5 dans les eaux usées traitées par les stations d'épuration des eaux d'égout, la substance peut être associée à des boues qui peuvent ensuite être mises en décharge, incinérées ou épandues sur les sols agricoles comme engrais. L'élimination des produits de consommation et des produits industriels contenant du D5 peut aussi entraîner l'élimination de D5 dans les décharges.
La détection du D5 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que des sources ponctuelles et diffuses contribuent à créer des concentrations de D5 dans l'environnement (Norden 2005; Kaj et al., 2005). L'application de pesticides contenant du D5 sur les cultures ainsi que l'épandage des boues d'épuration sur les terres agricoles, leur incinération et leur mise en décharge entraînent le rejet de D5 dans les milieux naturels. Selon certaines indications, le D5 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols (Xu et al., 1998). Ainsi, outre les rejets de résidus de D5 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Outil de débit massique
Un outil basé sur le débit massique permet d'estimer les rejets possibles de D5 dans l'environnement à différentes étapes de son cycle de vie. Les données empiriques sur les rejets de substances spécifiques dans l'environnement sont rares. On estime donc, pour chaque type d'utilisation connue, la proportion et la quantité des rejets dans les différents milieux naturels, ainsi que la proportion de la substance qui est transformée chimiquement ou envoyée dans des lieux d'élimination des déchets. Les hypothèses et les paramètres d'entrée utilisés pour effectuer ces estimations sont fondés sur des renseignements obtenus de diverses sources dont les réponses à des enquêtes réglementaires, des données de Statistique Canada, les sites Web des fabricants et des bases de données techniques. À cette fin, les facteurs d'émission se révèlent particulièrement utiles; ils sont généralement exprimés en fraction d'une substance rejetée dans l'environnement, notamment pendant sa fabrication, sa transformation et son utilisation associées aux procédés industriels. Ces données découlent notamment de documents sur des scénarios d'émissions, souvent élaborés sous les auspices de l'Organisation de coopération et de développement économiques (OCDE), et d’hypothèses par défaut utilisées par différents organismes internationaux de réglementation des produits chimiques. Le degré d'incertitude associé à la masse de la substance en circulation et à la quantité rejetée dans l'environnement augmente généralement vers la fin du cycle de vie.
| Devenir | Proportion massique (%)[1] | Principale étape du cycle de vie[2] |
|---|---|---|
| [*] Eaux usées avant toute forme de traitement [1] Pour estimer les rejets de D5 dans l'environnement et la répartition de cette substance, comme le montre ce tableau de synthèse, des renseignements sur les scénarios d'émissions de l'OCDE ont été utilisés : OCDE 2004; id. 2006. Les valeurs présentées pour les rejets dans les milieux naturels ne tiennent pas compte des mesures possibles de limitation des rejets qui peuvent être en place à certains endroits (p. ex. leur élimination partielle par les stations d'épuration des eaux d'égout). Les hypothèses particulières utilisées pour ces estimations sont résumées dans Environnement Canada, 2008. [2] Étapes applicables : production, formulation, utilisations industrielles, utilisation par les consommateurs, durée de vie utile de l'article/du produit, élimination des déchets. |
||
| Rejets dans l'environnement | ||
| dans le sol | 0 | - |
| dans l'air | 77,5 | Utilisations industrielles et utilisation par les consommateurs |
| dans les égouts[*] | 12,2 | Formulation, utilisations industrielles et utilisation par les consommateurs |
| Transformation chimique | 0,8 | Utilisations industrielles |
| Envoi dans des lieux d'élimination des déchets (p. ex. les décharges, les incinérateurs) | 9,5 | Élimination des déchets |
D'après les informations disponibles, la substance est principalement rejetée dans l'air et les eaux usées (égouts). L'air reçoit la plus forte proportion de rejet, soit environ 77,5 %. Cette situation est due à l'utilisation de produits de consommation tels que les lotions pour la peau, les crèmes solaires ou les polis (SPIN, 2007). Les rejets dans les eaux usées attribuables aux utilisations industrielles pendant la formulation de produits et à l'utilisation de produits d'hygiène sont estimés à environ 12,2 %. En outre, 9,5 % de cette substance sont confiés à l’élimination des déchets.
Selon ses propriétés physiques et chimiques (tableau 2) et les résultats de la modélisation de la fugacité de niveau III (tableau 4, les paramètres d'entrée de modélisation sont répertoriés à l'annexe 5 de cette évaluation préalable), le D5 peut se répartir en quantités significatives dans tout milieu naturel, selon le milieu de rejet.
| Milieu de rejet de la substance | Fraction de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 100 | 0,0 | 0,0 | 0,0 |
| Eau (100 %) | 4,4 | 30,9 | 0,0 | 64,7 |
| Sol (100 %) | 71,2 | 0,0 | 28,7 | 0,0 |
D'après les informations disponibles (tableau 3), les rejets de D5 dans l'environnement s'effectuent principalement dans l'air. Selon sa pression de vapeur qui varie de 26,66 à 33,2 Pa, sa constante de la loi de Henry de 3 350 000 Pa·m3/mol et sa longue demi-vie dans l'air, le D5 devrait rester dans l'air (100 %) s'il y est rejeté (tableau 4).
Si le D5 est rejeté dans l'eau (tableau 4), on s'attend à ce qu'il soit adsorbé sur les matières en suspension, comme les boues d'épuration et les sédiments, du fait de ses fortes valeurs empiriques de log Kco (plus de 5). Les résultats de la modélisation de la fugacité de niveau III pour les rejets dans l'eau montrent qu'environ 64,7 % de ce composé restera dans la phase solide (sédiments en suspension et matériaux du lit) et 30,9 % dans la phase aqueuse (colonne d'eau). Le log Kco du composé se trouve dans la plage élevée pour la sorption, et le taux d'hydrolyse modéré de D5 dans l'eau et l'air ambiant réduit la fraction qui devrait être adsorbée sur les sédiments. Une certaine volatilisation à partir des surfaces d'eau est également attendue d'après le coefficient de partage air-eau (Kae); la fraction massique qui devrait passer dans l'air du fait de cette volatilisation à 25 °C est de 4,4 % (tableau 4).
Si le D5 est rejeté sur des sols humides, par exemple par l'application de boues d'épuration sur des terres agricoles, environ 71 % de la fraction massique devrait passer dans l'air. Cette estimation est conforme à l’observation de Xu (1999) selon laquelle la volatilisation constitue le principal processus de perte de siloxanes cycliques à partir des sols humides. Environ 28,7 % resteront dans le sol, associés à des solides pour les raisons décrites pour les sédiments. Sur un sol sec, le D5 devrait être hydrolysé rapidement par des minéraux argileux pour former du diméthylsilanediol, qui est le produit de dégradation final (Xu, 1999; Xu et Chandra, 1999).
Persistance dans l'environnement
Dégradation atmosphérique
Les résultats du modèle de fugacité de niveau III indiquent que si le D5 est rejeté dans l'air, il y restera et devrait y être oxydé lentement par une réaction en phase gazeuse avec des radicaux hydroxyles (OH) d'origine photochimique. La demi-vie calculée empiriquement pour le D5 qui réagit avec les radicaux hydroxyles en phase gazeuse est de 6,9 jours (Atkinson, 1989; voir tableau 5a), à une vitesse de réaction expérimentale de 1,55 × 10-12 cm3/mol s (Atkinson 1989), qui peut être convertie en une demi-vie estimée de 6,9 jours, en supposant une cinétique du premier ordre, une journée de 12 heures et une concentration de radicaux hydroxyles de 1,5 × 106/cm3. Le D5 ne devrait pas réagir du tout, ou très peu, avec d'autres espèces photo-oxydantes dans l'atmosphère, par exemple O3, et ne devrait pas se dégrader par photolyse directe (Atkinson, 1991). Les réactions avec les radicaux hydroxyles devraient donc constituer le principal processus régissant le devenir de cette substance dans l'atmosphère.
Des mesures sur le terrain récentes des concentrations en radicaux hydroxyles en milieu urbain (Ren et al., 2003; Kramp et Volz-Thomas, 1997; Rivett et al., 2003) semblent indiquer que les concentrations en OH sont plus élevées dans l'atmosphère urbaine que celles observées dans les atmosphères rurale et marine en raison d'une plus forte présence des précurseurs de radicaux OH dans les zones urbaines polluées (SEHSC, 2008b). Ren et al. (2003) ont mesuré pendant 34 jours la concentration en radicaux hydroxyles dans l'atmosphère en été dans la ville de New York, dans l'État de New York aux États-Unis. La concentration maximale moyenne relevée s'élève à 7 × 106 OH/cm3 et est comparable aux valeurs obtenues (1 à 10 × 106 OH/cm3) dans des milieux urbains similaires des États-Unis (Los Angeles en Californie et Nashville dans le Tennessee, SEHSC, 2008b) et dans les pays européens (Kramp et Volz-Thomas, 1997; Rivett et al., 2003). Cependant, la plupart des mesures ont été effectuées pendant l'été, lorsque la lumière solaire est forte et que la photochimie atmosphérique est active. La concentration en radicaux OH mesurée par Ren et al. (2006) en hiver à New York est environ 5 fois inférieure à celle mesurée en été au même endroit. La mesure a été effectuée sur une période de 28 jours et la concentration maximale moyenne était de 1,4 × 106 OH/cm3. Par conséquent, des demi-vies de 3 à 14,8 jours peuvent être calculées en se basant sur une cinétique du premier ordre, une journée de 12 heures et une concentration moyenne quotidienne de 3,5 × 106 OH/cm3 et 0,7 × 106 OH/cm3 (concentration moyenne quotidienne = concentration maximale/2), en été et en hiver respectivement. Il est donc conclu que le D5 pourrait se dégrader plus rapidement dans les centres urbains en été lorsque les radicaux hydroxyles atmosphériques sont des plus présents. Cependant, si l'on prend en compte une demi-vie d'élimination moyenne annuelle, elle est cohérente avec la demi-vie de 6,9 jours estimée avec la concentration en radicaux OH de 1,5 × 106 OH/cm3. La demi-vie de dégradation de 6,9 jours est considérée comme critique et sera utilisée pour le D5 dans la modélisation du devenir dans l'environnement.
Navea et al. (2007) ont étudié les effets de l'ozone, des aérosols et du rayonnement solaire sur le devenir du D4 et du D5 dans une chambre à environnement simulé. Ils sont arrivés à la conclusion que les aérosols minéraux tels que le kaolin et l'hématite peuvent accélérer de façon significative l'élimination du D4 et du D5 dans la phase gazeuse de l'atmosphère, en particulier pendant la journée. Ces résultats indiquent également que l'ozone peut encore accélérer ces processus d'élimination du D4 et du D5. Bien que les données obtenues suggèrent que les aérosols minéraux combinés à l'ozone peuvent avoir des effets significatifs sur le devenir dans l'environnement des méthylsiloxanes cycliques volatils (cVMS) présents dans l'air, il est difficile d'extrapoler de manière quantitative les résultats des simulations dans des conditions environnementales réalistes. Il convient d'abord de noter que l'étude a été effectuée avec des concentrations en cVMS, en aérosols minéraux et en ozone, d'un niveau élevé irréaliste. Par ailleurs, les échantillons de minéral et de noir de charbon utilisés dans l'étude étaient des échantillons d'analyse très purs (plus de 99 %) qui fournissaient la zone de surface maximale et par conséquent les sites d'adsorption maximale idéaux, c'est-à-dire les conditions optimales pour l'adsorption de D4/D5. On peut se demander si ces minéraux purs sont bien représentatifs des matières particulaires dans l'air. Enfin, on peut raisonnablement penser que des minéraux tels que la kaolinite et l'hématite sont présents dans les particules atmosphériques. Cependant, il est peu probable qu'il s'agisse des composants les plus courants et les plus abondants de la poussière atmosphérique. Il convient par ailleurs de souligner que l'étude a été menée dans une chambre à environnement simulé et a impliqué la réaction des aérosols minéraux avec un seul cVMS (D4 ou D5) à la fois. Dans des conditions environnementales réelles, des milliers de produits chimiques se disputent les sites d'adsorption des aérosols. Dans ces conditions, l'« efficacité » de l'élimination du D4/D5 dans l'air ambiant peut donc être largement inférieure aux résultats observés dans l'atmosphère de la chambre où se trouvait un seul composant.
On peut donc conclure que le degré d'accélération de la dégradation des cVMS dans l'air par les aérosols et l'ozone dans des conditions environnementales réalistes est incertain.
Le modèle AOPWIN (2000; voir tableau 5b) fournit également des indications du potentiel de persistance de cette substance, avec une demi-vie d'oxydation atmosphérique prévue de 3 à 15 jours. Les données empiriques et modélisées montrent donc que cette substance est persistante dans l'air (demi-vie supérieure à 2 jours) conformément au Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Références |
|---|---|---|---|---|
| Air | Réaction avec l'OH | 6,9 | Demi-vie (jours) | Atkinson, 1989 |
| Air | Réaction avec l'OH | 3,0-14,8 | Demi-vie (jours) | Ren et al. 2003; id., 2006 |
| Eau | Biodégradation | 0,14 % | Dégradation 28 j | Springborn Smithers Laboratories, 2004 |
| Eau | Hydrolyse | 0,9-733 | Demi-vie (jours) pH 6-9 5-25 °C |
Durham, 2006 Kozerski, 2008 Bidleman, 2008 |
| Eau/sédiments | Dégradation abiotique | 49-588 | Demi-vie (jours) déduite à partir du D4 pH neutre; 5-25 °C |
Xu et Miller, 2008 |
| Sol (sols Wahiawa d'Hawaï) | Hydrolyse catalysée par l'argile | Env. 2 heures (humidité relative 32 %) |
Demi-vie (heures) | Xu, 1999; Xu et Chandra, 1999 |
| Sol (sols Londo du Michigan) | Hydrolyse catalysée par l'argile | 3,54 jours (humidité relative 32 %); 5,25 jours (humidité relative 93 %) |
Demi-vie (jours) déduite à partir du D4 | Xu et Chandra, 1999 |
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Modèle |
|---|---|---|---|---|
| [1] Les résultats de la simulation de la biodégradation CATABOL indiquent que le D5 se situe dans le domaine des paramètres mondiaux et dans le domaine métabolique, mais à l'extérieur du domaine structurel. Le plus important de ces domaines est le domaine métabolique, et CATABOL semble indiquer que cette substance ne se dégrade pas étant donné la faible probabilité de l'existence d'un groupe méthyle stable et de produits d'oxydation de l'anneau aromatique. [2] Demi-vies par oxydation atmosphérique recalculées avec des concentrations en radicaux OH mesurées à New York en été et en hiver respectivement. |
||||
| Air | Oxydation atmosphérique | 7,15 | Demi-vie (jours) | AOPWIN, 2000 |
| Air | Oxydation atmosphérique | 3,1-15,3[2] | Demi-vie (jours) | AOPWIN, 2000 |
| Eau | Biodégradation | 37,5 | Demi-vie (jours) | BIOWIN, 2000, Ultimate survey |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité linéaire du MITI |
| Eau | Biodégradation | 0,0003 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité non linéaire du MITI |
| Eau | Biodégradation | 2,3 | Demande biochimique en oxygène (DBO), % (MITI 301C)[1] | CATABOL, c2000-2008 |
| Sol | Biodégradation (anaérobie) | 0,04 (biodégradation lente) | Probabilité | BIOWIN, 2000 |
Dégradation dans l'eau et les sédiments
Les données empiriques d'hydrolyse concernant le D5 (Durham, 2006) ont été soumises par des experts internes à un examen critique (Bidleman, 2008); les résultats de cet examen sont résumés ci dessous. On a déterminé la cinétique de l'hydrolyse du D5 en mesurant la disparition du décaméthylcyclopentasiloxane (D5 à une pureté de 98,9 %) radiomarqué au 14C et la formation de produits d'hydrolyse en fonction du temps, conformément à la Ligne directrice 111 de l'OCDE. Les réactions du D5 ont été étudiées dans des tubes de verre de borosilicate scellés à la flamme à des pH de 4, 5,5, 7, 8 et 9 et à des températures de 10, 25 et 35 °C. L'essai initial visait une concentration de 6 µg/L après l'enrichissement, ce qui correspond à une valeur comprise entre la moitié et le tiers de la solubilité du D5 dans l'eau. Du THF (tétrahydrofurane) à une concentration inférieure à 1 % vol./vol. a été utilisé comme agent solubilisant. Le même laboratoire a également effectué une étude semblable de la cinétique de l'hydrolyse avec de l'octaméthylcyclotétrasiloxane (D4) radiomarqué au 14C (Durham et Kozerski, 2005). Il a été constaté que les vitesses d'hydrolyse du D4 et du D5 dépendaient du pH et présentaient une cinétique du pseudo-premier ordre. On a constaté que le D4 et le D5 étaient rapidement hydrolysés dans des conditions acides (pH 4) et basiques (pH 9), avec des demi vies (t1/2) moyennes comprises entre quelques minutes et moins de 6,5 heures pour le D4, et entre quelques heures et moins de 6 jours pour le D5 à une température comprise entre 10 et 35 °C. Deux essais d'hydrolyse supplémentaires avec le D5 dans des conditions presque neutres (pH 5,5 et 8) à 25 °C ont abouti à des t1/2 d'environ 15 et 9 jours, respectivement. Les demi vies à pH neutre (pH 7) étaient considérablement plus longues pour le D4 et le D5. La t1/2 calculée à 10 25 ºC était de 3,3 à 23 jours pour le D4 et de 74 à 416 jours pour le D5. Les produits d'hydrolyse étaient des intermédiaires diméthylsiloxane alpha et des oligomères oméga diol HO(Me2SiO)nH (n = 2 4 ou 5), et le diméthylsilanediol (DMSD) était le produit d'hydrolyse final. Bien que la perte de composés parents et une faible reproductivité aient été signalées à un pH neutre, les coefficients de perte à pH neutre peuvent être estimés à l'aide des constantes de vitesse du deuxième ordre pour les réactions catalysées par un acide et une base. Les études d'hydrolyse pour le D4 et le D5 sont donc considérées comme fiables pour cette évaluation préalable. Bidleman (2008) a cependant repéré une erreur dans le calcul de la constante catalytique des hydroxydes, kOH, à des températures autres que 25 ºC. Le tableau 6 répertorie les constantes de vitesse du deuxième ordre révisées pour l'hydrolyse catalysée par l'hydronium et les hydroxydes du D5 (Kozerski, 2008).
| Constante de vitesse (M-1h-1) | Température (°C) | |||
|---|---|---|---|---|
| 5 | 10 | 25 | 35 | |
| kH | 141 | 210 | 742 | 1 600 |
| kOH | 1 360 | 1 730 | 3 170 | 5 020 |
Les constantes de vitesse du pseudo-premier ordre, kobs, pour l'hydrolyse du D5 peuvent être calculées à l'aide de l'équation de cinétique suivante (en supposant une contribution négligeable de l'hydrolyse non catalysée, comme confirmé par les expériences à un pH de 7) :
kobs = kH+[H+] + kOH-[OH-]
Les demi-vies calculées pour le D5 (tableau 7) dans des conditions environnementales réalistes au Canada (pH 6-9, température 5-25 ºC) [GEMStat, 2008; NOAA, 2008] sont comprises entre 0,9 et 733 jours.
| Température (°C) | Constante de dissociation de l'eau pKw | pH | Constant de vitesse k (h-1) |
Demi-vie (jours) |
|---|---|---|---|---|
| 25 | 14 | 6 | 7,74E-04 | 37 |
| 7 | 3,91E-04 | 74 | ||
| 8 | 3,18E-03 | 9,1 | ||
| 9 | 3,17E-02 | 0,9 | ||
| 10 | 14,52 | 6 | 2,15E-04 | 134 |
| 7 | 7,32E-05 | 395 | ||
| 8 | 5,24E-04 | 55 | ||
| 9 | 5,22E-03 | 5,5 | ||
| 5 | 14,73 | 6 | 1,44E-04 | 201 |
| 7 | 3,94E-05 | 733 | ||
| 8 | 2,54E-04 | 114 | ||
| 9 | 2,53E-03 | 11 |
De nouvelles informations obtenues sur la dégradation par les agents microbiens indiquent que le D5 n'est vraisemblablement pas biodégradé dans l'eau. L'essai de biodégradabilité immédiate de 28 jours a été effectué dans des récipients fermés hermétiquement conformément à la Ligne directrice provisoire 310 de l'OCDE et les résultats ont mis en évidence une biodégradation limitée (0,14 %) du D5 au cours des 28 jours d'essai (Springborn Smithers Laboratories, 2004). Ces données sont étayées par deux modèles du tableau 5b, qui indiquent que la probabilité de biodégradation du D5 dans l'eau est effectivement nulle. Par ailleurs, selon une conclusion générale pondérée obtenue en combinant les résultats des modèles BIOWIN3 et BIOWIN5, ce composé ne se biodégrade pas facilement.
Les données expérimentales et modélisées sur la biodégradation indiquent que le D5 présente un faible potentiel de biodégradation dans les milieux aqueux. L'hydrolyse constitue donc le principal processus de dégradation du D5 dans l'eau. Les données semblent indiquer que le D5 peut se dégrader rapidement par hydrolyse lorsque la température de l'eau est élevée. Il devrait cependant être persistant pendant des périodes relativement longues à des températures faibles, dans une eau neutre ou légèrement acide au Canada (pH 6-7, température 5-10 ºC). On arrive donc à la conclusion que le D5 répond au critère de la persistance dans l'eau (t1/2 > 182 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Aucune information sur la dégradation dans les sédiments n'était disponible pour le D5. Une étude préliminaire sur la dégradation du D4 dans le système eau/sédiments a cependant été reçue récemment (Xu et Miller, 2008). Une ligne directrice 308 modifiée de l'OCDE a été suivie. L'étude a été réalisée à température ambiante (22-25 ºC) avec des sédiments naturels (limon sableux, teneur en carbone organique élevée, environ 70 % d'eau et 11 % de matière organique, pH d'environ 7) et de l'eau prélevés en profondeur dans un lac non contaminé. Le D4 radiomarqué dans le diéthylène glycol méthyl éther a été ajouté à la seringue en 10 à 15 points des sédiments de surface dans chaque flacon après le retrait de l'eau excédentaire. L'eau excédentaire a de nouveau été ajoutée sur les sédiments enrichis avec des perturbations minimales des sédiments. L'enrichissement des sédiments plutôt que de l'eau a permis de garantir la répartition de la substance dans les sédiments. Les propriétés physiques et chimiques de la substance (volatilité élevée et hydrolyse potentielle) ont ainsi été correctement gérées et la reproductibilité de l'étude a pu être améliorée. Les concentrations de D4 mesurées entre le 6e et le 22e jour (fin de l'essai) ont indiqué qu'un équilibre avait été atteint entre l'eau et les sédiments avec plus de 95 % de D4 et la détection de radioactivité dans les sédiments. Comme l'a montré l'étude de l'hydrolyse du D4, les produits de dégradation dans les sédiments/l'eau étaient des intermédiaires des oligomères diol HO(Me2SiO)nH (n=2-4), et le diméthylsilanediol (DMSD) était le produit de dégradation final. La demi-vie calculée à 22-25 ºC pour la dégradation du D4 dans les sédiments était de 49 jours. Les mêmes produits de dégradation observés dans cette étude et dans l'étude de l'hydrolyse du D4 suggéraient que l'hydrolyse constituait le principal processus de dégradation dans le système sédiments/eau. Le manque d'autres mesures d'essai constituait aussi la principale incertitude de l'étude. Puisqu'aucune donnée n'était disponible pour les demi-vies de dégradation à faible température, une méthode fondée sur les données déduites à partir d’analogues utilisant les données d'hydrolyse du D4 a été appliquée. Les demi-vies d'hydrolyse du D4 dans l'eau étaient environ 6 à 12 fois plus longues lorsque la température de l'eau passait de 25 à 10-5 ºC. En supposant une tendance similaire à la baisse dans les sédiments, les demi-vies estimées pour le D4 dans les sédiments sont de 294 et 588 jours à 10 et 5 ºC respectivement.
Les demi-vies de dégradation du D4 dans les sédiments ont été utilisées pour le D5 d'après la similarité des deux substances. On arrive par conséquent à la conclusion que le manque de dégradation rapide du D5 dans les mêmes conditions environnementales, notamment dans les environnements plus froids du Canada, produira une demi-vie des sédiments de t1/2 > 365 jours. Le D5 est donc jugé persistant dans l'eau et les sédiments, conformément aux critères établis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). L'extrapolation de la dégradation du D4 dans les sédiments à faible température selon l'hydrolyse n'est cependant pas exempte d'incertitudes. L’hypothèse selon laquelle la perte de D4 dans les sédiments est uniquement fonction de l'hydrolyse dans l'eau de porosité ne prend pas en compte la fraction pouvant être absorbée sur la phase solide, dont les processus et la vitesse de dégradation ne sont pas connus.
Dégradation dans le sol
Bien qu'on ne dispose d'aucune donnée empirique sur sa biodégradation dans le sol, comme indiqué ci-dessus, la biodégradation du D5 dans l'eau est négligeable selon l'essai de biodégradation immédiate (Springborn Smithers Laboratories, 2004) et selon les prévisions de cinq des six modèles de biodégradation (tableau 5b).
Xu (Xu, 1999, Xu et Chandra, 1999) a étudié en détail les voies possibles de dégradation des cyclosiloxanes, notamment le D4, le D5 et le D6 dans le sol Wahiawa d'Hawaï à température ambiante avec une humidité relative de 32 %. Il a conclu que les processus de polymérisation et de déméthylation n'étaient pas significatifs dans le sol à des concentrations inférieures à 200 mg/kg en poids sec. De plus, on a observé l'hydrolyse du D5 catalysée par l'argile dans des sols Wahiawa très altérés et secs. Il semblerait que la sécheresse du sol limite fortement l'activité biologique, mais favorise des réactions abiotiques comme l'hydrolyse catalysée par des conditions acides et en surface des PDMS, un polymère qui présente le même squelette que les cyclosiloxanes (Xu, 1999). Les vitesses de dégradation des cyclosiloxanes étaient déterminées par l'humidité du sol, le type d'argile, la teneur en argile et la taille des molécules de siloxane, qui déterminent à leur tour la vitesse de diffusion vers les sites catalytiques en surface. La demi-vie de dégradation par hydrolyse du D5 dans le sol Wahiawa (teneur en argile de 55 %, teneur en eau de 2,1 %) était d'environ 2 heures à 22 ºC dans des conditions de sol sec. La vitesse de dégradation du D5 était comparable à celle du D4 dans les mêmes conditions de sol (demi-vie d'environ 1 heure) et étayait le rapport selon lequel la vitesse de dégradation des trois cyclosiloxanes devrait diminuer en raison inverse de leur poids moléculaire : D4 > D5 >> D6. La vitesse d'hydrolyse du D5 dans des sols Londo tempérés du Michigan (teneur en argile de 22 %) n'a pas été indiquée. Les demi-vies de dégradation du D4 dans le sol Londo étaient comprises entre 3,54 et 5,25 jours à une humidité relative inférieure à 93 %. Pour le D5, on prévoit des demi-vies de dégradation comparables dans des sols Londo tempérés. La majorité des données disponibles semble indiquer que le D5 subit une hydrolyse catalysée par l'argile et n'est probablement pas persistant dans des conditions de sol sec. L'absence de dégradation par hydrolyse du D4 dans des sols Londo saturés d'eau semble aussi indiquer que la dégradation du D5 est négligeable dans les mêmes conditions. En outre, dans un système ouvert et dans ces conditions pédologiques, la volatilisation devient le principal mécanisme de perte de D5.
Alors qu'ils étudiaient l'influence des types d'argile sur le potentiel de dégradation des polydiméthylsiloxanes (PDMS), Xu et al. (1998) ont démontré que les PDMS étaient dégradés par les minéraux argileux, même si leurs activités catalytiques étaient différentes. La présence répandue de ces minéraux tend à indiquer que le D5 devrait subir une dégradation catalysée par l'argile dans les divers sols tant que persisteront des conditions pédologiques critiques comme une faible humidité, et ce, malgré l'extrême diversité des sols canadiens.
Selon des études empiriques disponibles qui montrent son potentiel d'hydrolyse rapide catalysée par l'argile dans les sols de surface, le D5 n'a pas été jugé persistant dans le sol car sa demi-vie de dégradation est inférieure au critère de la t1/2 supérieure à 182 jours qui est énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Les données empiriques et modélisées disponibles indiquent que le D5 satisfait aux critères de la persistance dans l'air (demi-vie ≥ 2 jours), dans l'eau (demi-vie ≥ 182 jours) et dans les sédiments (demi-vie ≥ 365 jours), conformément au Règlement sur la persistance et la bioaccumulation(Canada, 2000), mais non au critère de la demi-vie dans le sol (demi-vie < 182 jours).
Potentiel de transport à grande distance
Le modèle régional de niveau III de transport et de persistance (TaPL3, 2000) a été utilisé pour estimer la distance de transport caractéristique (DTC) du D5. La DTC est définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé de considérer le potentiel de transport atmosphérique à grande distance comme étant élevé si la DTC est supérieure à 2 000 km, modéré si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. . D'après une estimation de la DTC de 3 447 km, le potentiel de transport atmosphérique à grande distance du D5 est considéré comme élevée. C’est donc dire que le D5 est sujet au transport atmosphérique vers des régions éloignées comme l'Arctique.
| Distance de transport caractéristique | Modèle (référence) |
|---|---|
| 3 447 km | TaPL3, v. 2.10 (TaPL3, 2000) |
| 3 438 km | Outil LRTP POPs, v.2.0, de l'OCDE (Scheringer et al., 2006) |
Le modèle de dépistage de l'OCDE (LRTP POPs) peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al., 2006). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible » car il identifie simplement la DTC sans préciser l'endroit où une substance peut être transportée (Fenner et al., 2005). Klasmeier et al. (2006) ont suggéré qu'un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le 2,2',3',4,4',5,5'-heptachlorobiphényle (PCB-180), permettrait d'identifier des substances ayant un fort potentiel de transport à grande distance. Le PCB-180 a été détecté dans des régions éloignées. La DTC calculée pour le D5 à l'aide du modèle de l'OCDE correspond à 3 438 km, ce qui indique que le D5 présente toujours un fort potentiel de transport dans l'air, mais qu’il est inférieur à la limite suggérée par Klasmeier et al. (2006) pour les polluants mondiaux.
Le modèle de dépistage de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspondant au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée du D5 est de 1,9E-06 %, ce qui est largement inférieur à la limite de 4,65E-04 % (2,4,4'-trichlorobiphényle ou PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. Une ET faible indique que le D5 présente un potentiel de transport à grande distance dans l'atmosphère sans être déposé à la surface de la Terre dans une région éloignée donnée. De plus, les valeurs de log Koa et de log Kae du D5 semblent indiquer qu'il présente également un faible potentiel de contamination arctique s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement. Les dépôts atmosphériques constituent donc la seule source significative de cVMS dans le lac (Powell, 2008). L'analyse préliminaire d'échantillons de sédiments et zooplancton portant sur les cVMS n'a pas permis de détecter de D5, ce qui semble indiquer que les dépôts atmosphériques ne constituent pas une source significative de D5 pour le lac Opeongo. Les limites de détection étaient de 15,9 ng (masse de référence corrigée) pour les sédiments et le zooplancton.
On arrive donc à la conclusion que le D5 présente un potentiel de transport dans l'atmosphère sur de longues distances. Cependant, l'ET modélisée pour le D5 est faible, ce qui tend à indiquer qu’il est peu susceptible de se déposer dans l'eau ou sur le sol dans des régions éloignées. Les résultats de surveillance du lac Opeongo viennent également appuyer la thèse du faible potentiel de dépôt atmosphérique pour le D5. Le D5 transporté dans l'atmosphère sera finalement dégradé par des radicaux hydroxyles dans l'air.
Potentiel de bioaccumulation
Les valeurs empiriques et modélisées de log Koepour le D5 (tableau 2) semblent indiquer que cette substance peut se bioaccumuler dans le biote.
Dans le milieu aquatique
De nouvelles données empiriques indiquent que le D5 peut être bioconcentré dans les organismes aquatiques. Une étude de bioconcentration pour le D5 a été effectuée sur des têtes-de-boule (Pimephales promelas) dans un système à écoulement continu (Drottar, 2005). L'absorption de D5 radiomarqué au [14C] dans les tissus des poissons à des concentrations (mesurées) de 1,1 et 15 µg/L a été étudiée pendant 35 jours et la dépuration, surveillée pendant 70 jours. Le facteur de bioconcentration à l'équilibre (FBCéq) moyen calculé était de 7 060 L/kg selon des concentrations mesurées du 14e au 35e jour. Le facteur de bioconcentration cinétique (FBCc) était de 13 300 L/kg selon les vitesses d'absorption et de dépuration (k1/k2) pour les groupes traités à 1,1 µg/L (tableau 7a). L'analyse des tissus des poissons a aussi indiqué que la demi-vie de dépuration pour le D5 radiomarqué était de 24 jours. L'atteinte d’un équilibre le jour 14 de la phase d'absorption, comme cela a été rapporté, suscite un certain degré d'incertitude. Bien qu'aucune différence importante n'ait été relevée d'un point de vue statistique dans la concentration de D5 chez les poissons les jours 14, 21, 28 et 35, les données étaient variables et les concentrations moyennes ont continué à augmenter avec le temps. Ce phénomène, combiné à l'incohérence notée entre le FBC cinétique et le FBC à l'équilibre (environ 2 fois) et la longue période radioactive due à la dépuration laisse penser que l'état d'équilibre pourrait ne pas avoir été atteint lors du jour 14. La valeur du FBC cinétique de 13 300 L/kg est donc jugée plus fiable dans le présent rapport d'évaluation préalable.
On a effectué une étude de toxicité orale distincte sur la vitesse de métabolisation du D5 radiomarqué [14C] chez la truite arc-en-ciel (Oncorhynchus mykiss) [Springer, 2007]. Trois truites d'âge mature ont reçu une dose nominale de 15 mg D5/kg (de 9,4 à 13 mg D5/kg de poids corporel mesuré) de D5 marqué au 14C (pureté radiochimique de 97,6 %) dans de l'huile de maïs sur une période de 96 heures. Chez ces poissons, la plus grande partie des métabolites a été observée dans la bile, avec moins de 1 % de la radioactivité due au composé parent, alors que dans le sac à œufs, le foie et les voies digestives, 56, 60 et 76 % de la radioactivité était attribuée respectivement au D5 parent. Un métabolisme non significatif a été observé dans les tissus adipeux et le sang des poissons. Le D5 administré était éliminé par l'urine et les fèces. Le métabolisme calculé chez la truite sur une période de 96 heures est estimé à 14 %. Il a été obtenu en divisant le métabolisme total en µg (tissus, bile et urine) par le nombre total d'équivalents en µg récupéré dans les carcasses, les tissus (y compris la bile) et l'urine. Selon cette étude, la constante de vitesse de métabolisation calculée, kM, était de 0,166 jour-1 (communication personnelle à Environnement Canada de la Dow Corning Corporation, Health and Environmental Sciences, 2008; ne figure pas dans les références). Cependant, le mode de calcul de la vitesse de métabolisation n'est pas clair car la vitesse calculée correspond à un métabolisme total de 4,2 jours, alors que le métabolisme total observé lors de l'étude était de 14 % en 4 jours.
De nouvelles données expérimentales ont également été obtenues dans une étude sur la bioaccumulation par voie alimentaire chez les organismes aquatiques (Drotter; 2006; tableau 9a). Une étude de bioaccumulation par voie alimentaire du décaméthylcyclopentasiloxane marqué au 14C (pureté radiochimique de 98,7 %, 6,09 mCi/g) chez la truite arc-en-ciel (Oncorhynchus mykiss) a été réalisée dans un système à écoulement continu (Drottar, 2007) pendant 35 jours, suivis d'une période de dépuration de 42 jours. Les poissons étaient nourris de bouillie de truite traitée avec une concentration moyenne mesurée du composé parent de 458 µg/g. Le taux d'alimentation supérieur modifié pour permettre une meilleure détection instrumentale est considéré comme justifié. Bien que la température ait chuté à moins de 8,6 °C (la valeur recommandée dans le protocole est de 12 ± 2 °C) au 15e jour de l'essai et que plusieurs lectures d'oxygène dissous aient été sous les 60 %, aucun effet nocif n'a été observé pendant toute la durée de l'étude. L'intégralité de la radioactivité extraite des tissus des poissons a été identifiée comme du D5 parent et des métabolites inconnus ont été détectés dans le foie et le tube digestif des poissons. Ce résultat indique que du D5 a été métabolisé comme on l’a observé dans le cas du FBC des poissons (Drottar, 2005) et des études sur le métabolisme (Springer, 2007), bien que les vitesses de métabolisme du D5 ne soient pas considérées comme significatives (moins de 17 % du D5 ont été métabolisés). La constante de vitesse d'élimination calculée indiquait qu'une période de 57 jours serait requise pour atteindre 90 % de l'équilibre et non la phase d’absorption de 35 jours de l'essai. Par conséquent, les données relatives à des résidus de poissons au terme de l'absorption de 57 jours ont été extrapolées et le facteur de bioamplification corrigé, FBA (normalisé pour les lipides), était de 0,82. Le FBA cinétique a été calculé à l'aide d'un modèle qui tient compte du taux de croissance des poissons pendant les phases d'absorption et de dépuration de l'étude, de la quantité de D5 dans les poissons sur la durée, de la masse des poissons sur la durée, ainsi que du taux de consommation des aliments. On a supposé une constante de vitesse de métabolisation, kM, nulle. Les taux de croissance des poissons ont été calculés à l'aide d'une expression linéaire (Domoradzki, 2008a; id., b; SEHSC, 2008c). Le FBA cinétique obtenu (normalisé pour les lipides) était de 0,91. Les valeurs de BFA étaient relativement cohérentes. On considère donc que le D5 n'a pas démontré de potentiel de bioamplification durant de l'étude alimentaire sur les poissons en laboratoire.
| Organisme | Paramètre[1] | Valeur | Références |
|---|---|---|---|
| [1] FBCéq : facteur de bioconcentration à l'équilibre; FBCc : facteur de bioconcentration cinétique; FBAmp : facteur de bioamplification; FABS : facteur d'accumulation dans le biote et les sédiments | |||
| Pimephales promelas (tête-de-boule) | FBCéq | 7 060 L/kg (p. humide) | Drottar, 2005 |
| Pimephales promelas (tête-de-boule) |
FBCc | 13 300 L/kg (p. humide) | Drottar, 2005 |
| Oncorhynchus mykiss (truite arc-en-ciel) | FBAmp | 0,82-0,91 (normalisé pour les lipides) | Drottar, 2006; Domoradzki, 2008a; id., b; SEHSC, 2008c |
| Chironomus riparius (moucheron) | FABS | 0,46-1,2 | Springborn Smithers Laboratories, 2003b |
Le modèle d'Arnot-Gobas (Arnot et Gobas, 2003) permet de prévoir le facteur de bioaccumulation (FBA) de cette substance en tenant compte de tout métabolisme potentiel, à l'aide d'une constante de vitesse de métabolisation (kM). Le FBC et le FBAmp disponibles dans les données d'essai in vivo ont été utilisés pour dériver une constante de vitesse de métabolisation in vivo (kM) selon la méthode d'Arnot et al. (2008a). Dans cette méthode, kM est dérivé d'après l'équation suivante :
kM = (k1f/FBC) – (k2 + kE + kG) (1)
où :
kM = Constante de vitesse de métabolisation (1/jours)
k1 = Constante de vitesse d'absorption (Arnot et Gobas, 2003)
f = Fraction du produit chimique dissous librement dans l'eau (Arnot et Gobas, 2003)
FBC = Facteur de bioconcentration empirique disponible
k2 = Constante de vitesse d'élimination (Arnot et Gobas, 2003)
kE = Constante de vitesse d'évacuation fécale (Arnot et Gobas, 2003)
kG = Constante de vitesse de croissance (Arnot et Gobas, 2003)
La méthode d'Arnot et al. (2008a) permet d'estimer les facteurs de confiance (FC) pour la valeur de kM afin de tenir compte de l'erreur associée aux données in vivo (variabilité des mesures, incertitude de l'estimation des paramètres et erreur du modèle). Un FC de ± 2,6 a été calculé pour les données de FBC et de FBAmp disponibles.
Puisque le potentiel métabolique peut être lié au poids corporel et à la température (voir p. ex. Hu et Layton, 2001; Nichols et al., 2007), la valeur kM a été normalisée davantage à 15 °C, puis corrigée pour le poids corporel des poissons du niveau trophique intermédiaire dans le modèle d'Arnot-Gobas (184 g) [Arnot et al., 2008b]. Des poissons du niveau trophique intermédiaire ont été utilisés pour représenter les résultats d'ensemble du modèle, comme le recommande son concepteur (Arnot, J.A, communication personnelle à M. Bonnell d’Environnement Canada, 2008; ne figure pas dans les références), et cette valeur est plus représentative du poids des poissons qui sera vraisemblablement consommé par un piscivore aviaire ou terrestre. Après la normalisation, la valeur de kM était comprise entre environ 0,001 et 0,01, avec une valeur médiane d’environ 0,004.
| kM (normalisée pour le niveau trophique intermédiaire) jour-1 | Log Koeutilisé | Modèle du FBC d'Arnot-Gobas | Modèle du FBA d'Arnot-Gobas |
|---|---|---|---|
| 1,30E-03 (2,5 %) | 8,0 | 4 265 | 2 630 268 |
| 3,90E-03 (moyenne) | 8,0 | 1 905 | 1 023 293 |
| 1,09E-02 (97,5 %) | 8,0 | 759 | 269 153 |
Les valeurs de kM basées sur des expériences in vivo semblent indiquer que la vitesse de métabolisation du D5 est relativement faible (≤ 0,01 jour-1 au mieux). L'étude expérimentale sur le FBC menée sur des têtes-de-boule (Drottar, 2005), l'étude de bioaccumulation par voie alimentaire sur des truites arc-en-ciel (Drottar, 2006) et l'étude sur le métabolisme (Springer, 2007) ont démontré le métabolisme, bien que limité, du D5. Le FBC calculé de 4 265 avec la constante de vitesse de percentile inférieur (env. 0,001) correspond approximativement à 50 % du FBC indiqué par Drottar (2005), mais il se trouve dans la plage acceptable des valeurs expérimentales. Un FBA correspondant de 2 630 268 a été calculé pour D5 pour les poissons des eaux canadiennes avec cette constante de vitesse de métabolisation.
Dans les sédiments
De nouvelles données sur les facteurs d'accumulation du D5 dans le biote et les sédiments (FABS) ont été reçues. Dans le cadre d'une étude sur le potentiel de bioaccumulation dans les sédiments au cours d'un essai de toxicité des sédiments chez le moucheron (Chironomus riparius) [Springborn Smithers Laboratories, 2003b; tableau 9a], des larves de moucheron ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 99,37 %) incorporées dans des sédiments, comprises entre 13 et 580 mg/kg (concentration moyenne mesurée entre le jour 0 et le jour 10 de l'essai). Des sédiments artificiels composés de 79 % de sable, de 4 % de limon et de 17 % d'argile ont été utilisés. Les essais ont été effectués avec des sédiments présentant une teneur en carbone organique de 2 %. Le pH mesuré dans les sédiments était compris entre 6,6 et 7,6 et la température mesurée, entre 19 et 22 °C. Le FABS pour le poids sec entier des moucherons a été calculé à 1,2, 1,1, 0,83 et 0,46 à des concentrations de traitement de 13, 30, 73 et 180 mg/kg respectivement. Les résultats indiquent que le D5 peut présenter un certain potentiel de bioaccumulation lié à l'exposition aux sédiments. Cependant, cette étude ne spécifie pas si le contenu de l'intestin des organismes soumis à l'essai a été purgé avant le calcul des valeurs de FABS. La valeur de FABS risque donc d'être surestimée en raison de la présence de D5 dans les sédiments dans l'intestin des invertébrés.
Dans le sol
Il n'existe pas d'information disponible sur la bioaccumulation du D5 dans le sol.
Dans le milieu terrestre
Le modèle de bioaccumulation à bilan massique de Gobas pour les organismes terrestres (Gobas et al., 2003) utilise les coefficients de partage octanol-air et octanol-eau (Koaet Koe) pour estimer le potentiel de bioamplification (FBAmp) des substances chimiques dans les chaînes trophiques terrestres. Selon les estimations, les substances chimiques dont la valeur de log Koa est supérieure à 5 peuvent se bioamplifier dans les chaînes trophiques terrestres si la valeur de Koe est supérieure à 2 et si la vitesse de transformation chimique ou de métabolisation est faible. Un log Koa de 5,06 indique que le D5 peut présenter un potentiel de bioamplification dans les chaînes trophiques terrestres. Toutefois, le métabolisme des cVMS qui a été démontré au cours d’études en laboratoire menées chez des mammifères peut réduire le potentiel de bioamplification dans le réseau trophique terrestre.
Synthèse du potentiel de bioaccumulation du D5
Globalement, l'étude empirique sur le FBC cinétique et à l'équilibre des poissons, bien qu'optimisée pour l'exposition dans l'eau, a démontré un potentiel élevé de bioconcentration du D5 dans l'eau (supérieur ou égal à 5 000). Bien que le log Koe du D5 suggère que l'absorption par voie alimentaire sera importante et probablement prédominante, elle se trouve toujours à la limite des valeurs log Koe pour lesquelles une bioconcentration importante a été observée pour de nombreuses substances chimiques dans le cadre d'études en laboratoire (p. ex. Arnot et Gobas, 2006). Les valeurs empiriques dépassent 5 000, ce qui semble indiquer un potentiel de forte bioconcentration dans d'autres organismes à différents niveaux trophiques ainsi que chez les poissons, notamment ceux dont les vitesses de croissance ou de métabolisme sont inférieures (autotrophes, par exemple).
Les valeurs de FBC prévues, corrigées pour le métabolisme, s'approchent de la valeur 5 000 sans toutefois l'atteindre et sont inférieures aux valeurs de FBC empiriques. Les valeurs de FBA prévues sont également élevées et dépassent 5 000. Comme pour les autres modèles, il existe des incertitudes concernant les valeurs de FBC et de FBA prévues (l'incertitude augmente pour les valeurs de log Koe supérieures car très peu de substances chimiques ont fait l'objet d'une étude de bioaccumulation dans cette plage). Un niveau de confiance supérieur est accordé à la valeur de FBA prévue lorsque la valeur de FBC prévue correspondante est le plus près des données de FBC empiriques (FBA = 2,6E06 environ). Le modèle cinétique à bilan massique utilisé est basé sur les « principes fondamentaux », dont le principal concept indique qu'une substance chimique obéit au principal mécanisme du modèle, dans ce cas une diffusion passive. Le D5 respecte ce concept, de même que les limites de log Koe et de poids moléculaire du modèle. Par conséquent, les prévisions de bioaccumulation sont jugées applicables au D5. Cependant, la correspondance entre les valeurs de FBC corrigées pour le métabolisme et les valeurs empiriques est moindre (par rapport au D4), ce qui suggère une plus grande incertitude concernant les résultats du modèle de FBC et de FBA pour le D5 du fait de l'absence relative de valeurs de FBC et de FBA empiriques dans la plage de log Koeutilisée pour le D5 dans le modèle (supérieure ou égale à 8). Par ailleurs, la possibilité que des produits chimiques superhydrophobes n’atteignent pas l'équilibre dans l'environnement (ce que suppose le modèle) rajoute une certaine incertitude (Arnot et Gobas, 2006).
Les valeurs de FABS pour le D5 semblent indiquer un niveau d'accumulation relativement faible dans les macroinvertébrés présents dans les sédiments. Comme il s'agit du seul essai de bioaccumulation dans les sédiments disponible pour les cVMS et qu'il n'existe aucun modèle prédictif pour les organismes des sédiments, des essais ou des données sur le terrain à des charges environnementales plus réalistes permettraient de vérifier ces valeurs. Les valeurs de FBA générées pour le D5 sont inférieures à 1, ce qui suggère la possibilité d'un faible potentiel de bioamplification chez les poissons pour le D5, mais aucun élément ne semble indiquer pour le moment que ce soit le cas pour d'autres niveaux trophiques. Des études de mésocosmes sur le terrain sont actuellement en cours afin d'observer le transfert trophique de cVMS dans un réseau alimentaire aquatique, mais ces données ne sont pas encore disponibles pour évaluation complète et n'ont pas été prises en compte dans cette évaluation.
Il existe enfin des indications contradictoires sur le potentiel de bioaccumulation du D5 testé en laboratoire et déterminé à partir de modèles prédictifs. Les études de FBA sur les poissons et de BAFS sur les invertébrés tendent à indiquer que le potentiel de bioaccumulation du D5 est faible, ce qui peut être attribuable à une biodisponibilité réduite. Les données d'essai optimisées dont on dispose au sujet du BFC semblent indiquer qu'il peut exister un potentiel de bioconcentration importante de D5 chez les poissons et d'un niveau plus faible dans le réseau alimentaire aquatique. Les valeurs de FBC prévues sont largement inférieures aux valeurs mesurées chez les poissons. On peut donc raisonnement conclure que le D5 présente un potentiel de bioaccumulation dans le biote. Toutefois, compte tenu des indications contradictoires, il est impossible d'en déduire qu'il satisfait au critère de la bioaccumulation (FBC ou FBA ≥ 5000) défini dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
De nouvelles données empiriques sur l'écotoxicité du D5 ont été obtenues; elles sont examinées en détail ci-dessous (tableau 10a). Ces études indiquent que cette substance ne présente pas d'effets nocifs sur les poissons et les daphnies exposés à des concentrations pouvant atteindre sa limite de solubilité dans l'eau (0,0017 mg/L).
L'étude de la toxicité du D5 en milieu aquatique pour la truite arc-en-ciel (Oncorhynchus mykiss) a été effectuée dans un système à écoulement continu (Springborn Laboratories, 2000). Des truites arc-en-ciel juvéniles (poids humide moyen, 2,3 g et longueur moyenne, 61 mm) ont été exposées à des concentrations mesurées de D5 (pureté de 99,35 %) de 2,1, 3,1, 5,0, 8,6 et 16 µg/L pendant 14 jours. Le système d'essai était fermé hermétiquement et rempli à capacité afin de réduire au minimum les pertes de D5 dues à la solution d'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisé comme agent solubilisant. Le pH était maintenu entre 6,3 et 6,9 et la température oscillait entre 13 et 15 °C. Les poissons étaient nourris à un taux d'environ 2 % de leur biomasse totale une fois par jour. La température pendant l'essai présentait un léger écart par rapport à celle du protocole de l'OCDE (12 ± 2 °C) et la concentration d'oxygène dissous a chuté sous les 60 % de saturation pendant plus de 24 heures; toutefois, ces éléments n'ont pas été jugés comme gênants pour le déroulement de l'essai. Le taux de mortalité variait de 5 à 10 % chez le groupe témoin négatif et chez le groupe témoin pour le solvant, les groupes traités à 0,005 et à 0,0086 mg/L présentaient respectivement des taux de mortalité de 10 et de 15 %. Toutefois, les taux de mortalité observés n'ont pas été jugés comme dus à la substance soumise à l'essai puisque le taux de mortalité était nul pour la plus forte concentration de traitement (0,0016 mg/L).
| Organisme | Type d'essai | Durée | Paramètre[1] | Valeur (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant 50 % d'effets sublétaux chez 50 % de la population; CSEO : concentration sans effet observé. | |||||
| Truite arc-en-ciel Oncorhynchus mykiss |
Tox. aiguë | 14 j | CL50 | > 0,016 | Springborn Laboratories, 2000 |
| Truite arc-en-ciel Oncorhynchus mykiss |
Tox. aiguë | 14 j | CSEO | 0,016 | Springborn Laboratories, 2000 |
| Puce d'eau Daphnia magna |
Tox. aiguë | 48 h | CL50 | > 0,003 | Springborn Smithers Laboratories, 2002 |
| Puce d'eau Daphnia magna |
Tox. chronique | 21 j | CSEO | 0,015 | Springborn Smithers Laboratories, 2003a |
| Algue d'eau douce Pseudokirchneriella subcapitata | Tox. aiguë | 96 h | CE50 | non concluante | Springborn Laboratories, 2001 |
Au cours d'études de toxicité aiguë et chronique du D5 chez les Daphnia magna, on a exposé des Daphnia magnajuvéniles à des concentrations de D5 (pureté de 99,35 %) de 1,6, 1,8, 2,1, 2,5 et 2,9 µg/l (mesurées) pendant 48 heures dans un système à écoulement continu (Springborn Smithers Laboratories, 2002). Le système d'exposition était conçu de façon à ne permettre qu'un minimum de volatilisation de la substance à l'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 7,7 et 8,0, la température oscillait entre 20 et 21 °C et la concentration d'oxygène dissous demeurait supérieure à 60 %. L'eau d'essai avait une dureté de 160 à 180 mg CaCO3/L. Un taux de mortalité inférieur ou égal à 10 % a été observé chez le groupe témoin et à la concentration des groupes à l'essai, ce qui correspond à une CE50 supérieure ou égale à 2,9 µg/L.
Un essai de toxicité sur cycle de vie complet du D5 a été effectué sur des Daphnia magna, dans des conditions de renouvellement statique (Springborn Smithers Laboratories, 2003a). Des Daphnia magna juvéniles ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 100 %, activité spécifique de 5,758 mCi/g) de 1,0, 1,7, 3,5, 7,2 et 15 µg/L pendant 21 jours dans des conditions de renouvellement statique, et les solutions d'essai étaient renouvelées toutes les 24 heures. Le système expérimental était conçu de façon à réduire au minimum les pertes de D5 en raison de la solution à l'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 6,6 et 8,7, la température oscillait entre 20 et 23 °C, et la concentration d'oxygène dissous demeurait supérieure à 60 %. L'eau d'essai avait une dureté de 160 à 170 mg CaCO3/L. À la fin de la période d'exposition de 21 jours, le nombre moyen de rejetons par femelle était de 150, 148, 145, 138 et 139 pour des concentrations de traitement de 1,0, 1,7, 3,5, 7,2 et 15 µg/L, respectivement. Ce nombre a diminué légèrement à des concentrations de traitement de 7,2 et de 15 µg/L par rapport au groupe témoin négatif et au groupe témoin pour le solvant (nombre moyen de rejetons de 146), mais cette différence n'a pas été jugée statistiquement significative. On n'a observé aucune mortalité ou croissance, ni aucun autre effet biologiquement significatif à la plus forte concentration d'essai de 15 µg/L (CSEO ≥ 15 µg/L). Pendant l'essai, la température présentait un léger écart par rapport à celle du protocole de l'OCDE (20 ± 1 °C), mais cela n'a pas été jugé comme gênant pour le déroulement de l'essai. Toutefois, le taux d'alimentation pendant l'essai de 0,41 mg C/daphnie/jour était plus élevé que celui de la ligne directrice de l'OCDE (0,1-0,2 mg C/daphnie/jour), mais on estime que cette différence favorise la santé des organismes expérimentaux qui résistent à des effets toxiques. Une charge de carbone plus élevée dans le système expérimental peut aussi contribuer à réduire la biodisponibilité du D5 en fournissant un substrat pour la sorption. Néanmoins, les données expérimentales ont été jugées acceptables aux fins de l'évaluation préalable, en indiquant les limites possibles des essais (voir ci dessus).
De nouveaux résultats expérimentaux ont été obtenus sur la toxicité aiguë au cours d'une étude sur l'algue d'eau douce Pseudokirchneriella subcapitata (auparavant connue sous le nom de Selenastrum capricornutum), dans des conditions statiques de 96 heures (Springborn Laboratories, 2001). L'essai de toxicité était conforme aux normes expérimentales de la TSCA et de l'OCDE pour les algues. Les algues étaient exposées à une solution saturée de D5 (99,35 % d'ingrédient actif). Le système d'essai était fermé hermétiquement et rempli à capacité afin de réduire au minimum les pertes de D5 dues à la solution d'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisé comme agent solubilisant. Toutefois, les concentrations de la solution d'essai ont diminué constamment de 12 µg/L au début de l'essai à environ 2 µg/L à la fin de l'essai de 96 heures. L'hypothèse selon laquelle les pertes de D5 pourraient être dues à la volatilisation, à l'adsorption de D5 par la biomasse des algues ou à sa consommation comme source de carbone par les algues. L'hydrolyse dans des conditions alcalines peut également contribuer à une perte rapide de D5 à mesure que le pH augmente de 7,5 au début de l'essai à 9,4 au bout de 96 heures, ce qui indique la photosynthèse a lieu et que les algues respirent. Pendant l'étude, la température était maintenue à 24 °C. Il a donc été conclu qu'aucune diminution de la densité des cellules ou de la vitesse de croissance n'avait été observée pendant l'essai. Une quantité supplémentaire de 500 mg/L de bicarbonate de sodium a été ajoutée afin d'assurer la présence d'une concentration suffisante de bicarbonate dissous pour compenser la croissance des cellules dans un système fermé. Compte tenu de la réduction significative des concentrations de D5 pendant l'essai et de tous les facteurs d'incertitude associés à l'étude, les résultats de cet essai ont été jugés comme invalides.
La toxicité aiguë et chronique du D5 a été évaluée à l'aide du modèle ECOSAR (2004). Les résultats prévus sont présentés dans le tableau 10b.
| Organisme | Type d'essai | Paramètre[1] | Durée | Concentration (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CE50 : concentration minimale causant des effets sublétaux chez 50 % de la population; ChV correspond à la moyenne géométrique de la CSEO (concentration sans effet observé) et de la CMEO (concentration minimale avec effet observé). | |||||
| Poissons | Tox. chronique | ChV | 30 j | 0,0002 | ECOSAR, 2004 |
| Daphnies | Tox. chronique | CE50 | 16 j | 0,000732 | ECOSAR, 2004 |
| Algue verte | Tox. chronique | ChV | 96 h | 0,003 | ECOSAR, 2004 |
Les résultats modélisés à l'aide d'ECOSAR pour le D5 étaient inférieurs à la limite de solubilité dans l'eau (0,017 mg/L), ce qui semble indiquer qu'il y aurait des effets aigus ou chroniques en cas de saturation aqueuse. Toutefois, la fiabilité des valeurs prévues relatives à la toxicité est jugée faible. La valeur de log Koe pour le D5 (8,03) est à peine plus élevée que le seuil de log Koerecommandé par le modèle ECOSAR (8,0) pour la prévision de la toxicité chronique à l'aide des relations structure-activité applicables aux composés organiques neutres et l'absence de données empiriques sur les siloxanes dans l’ensemble d’étalonnage du modèle restreint à leur prise en considération dans cette évaluation. De même, la fiabilité des prévisions sur la toxicité aiguë et chronique au microgramme par litre et en dessous de ce seuil devient de plus en plus incertaine, étant donné que ces prévisions se fondent uniquement sur la valeur de log Koe et la capacité empirique à quantifier les effets dans cette plage varie énormément. Les données sur la toxicité de l'eau prévues à l’aide du modèle n'ont dès lors pas été prises davantage en considération.
Les données empiriques suggèrent que le D5 ne présente aucun effet nocif chez les poissons et les daphnies à des concentrations égales ou inférieures à sa limite de solubilité (0,017 mg/L). Il convient néanmoins d'interpréter ces résultats avec précaution. Tel qu'il est mentionné dans les études de toxicité menées avec l’analogue D4 chez les truites et les daphnies, la mortalité due au D4 n'a été observée qu'après une période d'exposition de 7 à 14 jours des organismes analysés, moment auquel la concentration en D4 dans les tissus des poissons atteint l'équilibre et la charge corporelle suffisante pour produire des effets toxiques (Sousa et al., 1995). En ce qui a trait au D5, il était difficile de déterminer si les concentrations présentes dans les tissus ont atteint l’équilibre en 14 jours durant l'étude du FBC chez les têtes-de-boule (Drottar, 2005). Cette observation soulève la question à savoir si la durée de l’essai de toxicité du D5 mené durant 14 jours chez les truites (Springborn Laboratories, 2000) était assez longue pour permettre d’atteindre une charge corporelle toxique dans les tissus des poissons et donc pour établir la toxicité dans le cadre de l’étude Il a également été observé que la mortalité due au D4 n'avait été détectée que dans les truites arc-en-ciel de petite taille (≤ 1 g) et non dans les truites de plus grande taille ou d’autres espèces de poissons, indiquant ainsi que le D4 pourrait être plus toxique pour les organismes aquatiques sensibles et/ou pour les organismes aquatiques aux premiers stades sensibles de leur vie. Cependant, le D5 a été testé uniquement avec des truites plus grandes (environ 2,3 g), et aucun essai au stade précoce de l'existence n'a été réalisé. Étant donné la structure semblable du D4 et du D5, la toxicité du D5 pourrait avoir été observée si des truites plus petites avaient été utilisées. Dès lors, des questions concernant l'adéquation de la durée des tests, une absence de données empiriques comparables à celles dans lesquelles la toxicité du D4 a été notée (c.-à-d. taille des poissons comparable), ainsi qu'une absence de données empiriques pour les poissons à un stade précoce de leur existence, contribuent à l'incertitude relative à la toxicité du D5 pour les organismes aquatiques.
B – Dans d’autres milieux
Dans les sédiments
De nouvelles données empiriques sur la toxicité du D5 dans les sédiments ont été obtenues et elles ont été acceptées pour ce rapport d'évaluation préalable.
Un essai de toxicité sur cycle de vie complet du D5 dans les sédiments a été effectué avec des moucherons (Chironomus riparius), au cours d'une série d'expositions de 10 et de 28 jours dans des conditions statiques (Springborn Smithers Laboratories, 2003b). Des larves de moucheron ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 99,37 %) incorporées aux sédiments, comprises entre 13 et 580 mg/kg (concentration moyenne mesurée à partir du jour d'essai 0 et du jour d'essai 10) et entre 12 et 570 mg/kg (concentration moyenne mesurée à partir des jours d'essai 0, 10 et 28). Des sédiments artificiels composés de 79 % de sable, de 4 % de limon et de 17 % d'argile ont été utilisés. Les essais ont été effectués avec des sédiments présentant une teneur en carbone organique de 2 %. Le pH mesuré des sédiments était compris entre 6,6 et 7,6 et la température mesurée, entre 19 et 22 °C. Les taux de survie des moucherons déterminés après 10 jours d'exposition étaient de 100, 97, 98, 97 et 27 % pour des concentrations de traitement de 13, 30, 73, 180 et 580 mg/kg, respectivement. Le poids humide moyen déterminé après 10 jours d'exposition était de 5,59, 5,65, 4,77, 4,44 et 1,36 mg/moucheron pour des concentrations de traitement de 13, 30, 73, 180 et 580 mg/kg, respectivement. Une CL50 de 10 jours de 450 mg/kg en poids sec a été calculée pour la survie des moucherons et une CE50 de 410 mg/kg en poids sec a été calculée pour leur croissance (tableau 8c). Les taux d'émergence et de développement des larves de moucheron ont été déterminés après 28 jours d'exposition. Le taux d'émergence moyen pour la concentration de traitement de 470 mg/kg était notablement plus faible (18 %) que celui du groupe témoin (87 %), tout comme les taux de développement moyens des moucherons mâles pour les concentrations de traitement de 180 et de 570 mg/kg avaient notablement diminués par rapport à ceux du témoin. La diminution des taux de développement moyens obtenus pour les femelles et pour les deux sexes n'était significative qu'à une concentration de traitement de 570 mg/kg. Pour le développement des larves de moucheron, la CSEO de 28 jours était de 69 mg/kg et la CMEO, de 180 mg/kg (tableau 10c).
| Organisme | Type d'essai | Paramètre[1] | Valeur (mg/kg en poids sec) | Références |
|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant des effets sublétaux chez 50 % de la population; CSEO : concentration sans effet observé. CMEO : concentration minimale avec effet observé. | ||||
| Moucheron Chironomus riparius |
Tox. aiguë | CL50 | 450 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. aiguë | CE50 | 410 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des mâles | 69 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour le développement des mâles | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des femelles | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des deux sexes | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour l'émergence | 180 | Springborn Smithers Laboratories, 2003b |
| Oligochète Lumbriculus variegates |
Tox. chronique | CSEO | 1 272 | Krueger et al., 2007 |
| Moucheron Chironomus riparius |
Tox. chronique | CL50 | 257 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement | 70 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour le développement | 160 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour l'émergence | 160 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour l'émergence | 248 | Krueger et al., 2008 |
Une évaluation critique d'une étude de toxicité chronique récente (Krueger et al., 2007) chez un oligochète d'eau douce, Lumbriculus variegates (ver de terre), a été effectuée, puis acceptée pour cette évaluation préalable. Les vers adultes étaient exposés à des concentrations mesurées de D5 (pureté de 99,19 %) incorporées dans les sédiments, comprises entre 24 et 1 272 mg/kg (concentration moyenne mesurée à partir des jours d'essai 0, 7 et 28) pendant 28 jours, dans des conditions d'écoulement continu. On a utilisé des sédiments formulés composés de 13 % de sphaigne, de 10 % de kaolin et de 77 % de sable de quartz industriel. Le pH mesuré des sédiments était compris entre 7,9 et 8,3 et la température mesurée, entre 22,7 et 23,4 °C (protocole de l'OCDE, 20+/-2). La teneur en carbone organique des sédiments était de 3,7 % si l'on suppose que la sphaigne est la seule source de carbone organique. Étant donné que les vers se sont reproduits pendant l'essai de 28 jours et qu'il était difficile de distinguer un adulte d'un jeune, le nombre total d'organismes présents à la fin de l'essai a été utilisé comme paramètre. Le nombre moyen de vers était de 33, 30, 31, 21, 19 et 26 pour des concentrations de traitement de 24, 46, 94, 226, 495 et 1 272 mg/kg en poids sec, respectivement. Aucune mortalité n'a été observée pendant toute la durée de l'essai. Il a été conclu que les nombres moyens n'étaient pas notablement différents de ceux du groupe témoin (26). Aucun effet sur la croissance des vers survivants n'a été observé et une CSEO de 1 272 mg/kg a été déterminée.
Une autre étude prolongée sur la toxicité des sédiments chez le moucheron, Chironomus riparius, a été menée en utilisant des sédiments enrichis (Krueger et al., 2008). Les moucherons ont été exposés à des concentrations moyennes mesurées de D5 allant de 35 mg/kg à 759 mg/kg pendant 28 jours à 20 ºC. La teneur en carbone organique des sédiments formulés était de 3,2 %. L'eau de surface a été partiellement renouvelée toutes les semaines en raison de la teneur élevée en ammoniaque mesurée dans l'enceinte d'essai. On a déterminé que la CSEO observée pour le pourcentage de survie et le taux d'émergence était de 160 mg/kg (mesurée). La valeur de la CL50 calculée pour la survie était de 257 mg/kg. Les moucherons exposés à 160 mg/kg de D5 ont présenté une réduction statistiquement significative du développement. On a déterminé que la CSEO et la CMEO pour le développement des moucherons étaient respectivement de 70 mg/kg et de 160 mg/kg.
Dans le sol
Aucune étude concernant les effets du D5 ou de ses analogues sur les organismes du sol n'a été trouvée.
Dans le milieu terrestre
Aucune étude écologique pour les animaux sauvages terrestres n'a été trouvée. Les études en laboratoire sur des mammifères sont examinées dans la section « Potentiel d'effets nocifs sur la santé humaine » de la présente évaluation préalable.
Évaluation de l'exposition de l’environnement
Dans l’air
Des mesures environnementales préliminaires de méthylsiloxanes volatils, dont le D5, ont été effectuées en février et mars 2006 dans la région des Grands Lacs au Canada (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Dix-huit échantillons d'air extérieur provenant de régions rurales et urbaines de l'Ontario ont été prélevés et le D5 était présent dans presque tous ces échantillons à des concentrations de moins de 1 µg/m3, à l'exception d'une concentration relativement élevée de D5 d'environ 20,5 µg/m3 signalée dans la région urbaine de Toronto. Ce résultat concorde avec les valeurs déclarées par d'autres instances (tableau 11a).
Il est cependant possible que la détection de D5 dans l'air ambiant soit partiellement attribuable à la contamination des échantillons. Les cyclosiloxanes volatils sont présents dans une gamme étendue de produits commerciaux, et les représentants des programmes de surveillance du Canada et des pays nordiques ont indiqué qu'ils avaient eu des problèmes de concentrations élevées de cyclosiloxanes dans des blancs d'échantillons. La méthode utilisée pour mesurer et analyser les concentrations dans l'air à des valeurs comprises entre des ng/m3 et quelques µg/m3 est toujours en voie d'élaboration. Très peu de mesures effectuées en double sont disponibles pour la surveillance de l'air extérieur et les rares qui le sont ont une mauvaise reproductibilité. Selon une hypothèse, il pourrait être important de tenir compte de la phase particulaire parce qu'elle pourrait influencer les résultats dans le cas des essais en double (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Des échantillons extérieurs (n = 24) ont été recueillis dans les pays nordiques. La limite de détection était égale à 0,02 µg/m3 pour le D5. [2] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. |
|||
| Air | Région des Grands Lacs, Canada; février et mars 2006 | < 1-20,5 µg/m3 | Voir la note 2 |
| Air | Pays nordiques[1]; 2004-2005 | 0,05-19 µg/m3; | Norden, 2005 |
Dans l’eau
Au Canada, on a échantillonné l'eau de 9 stations d'épuration des eaux d'égout (SEEE), dans des grands centres urbains du sud-ouest de l'Ontario, y compris dans des lagunes et dans des installations de traitement secondaire et tertiaire de l'eau en octobre et pendant l'hiver 2005 (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures; ne figure pas dans les références). Du D5 a été détecté à des concentrations de 0,49 à 227,72 µg/L et de 1,00 à 2,92 µg/L, respectivement, dans les affluents et les effluents. Des différences saisonnières ont été remarquées dans les concentrations de D5 des affluents de SEEE; la plupart d'entre elles passaient d'une valeur comprise entre 0,49 et 57,33 µg/L en automne à une valeur comprise entre 8,04 et 227,72 µg/L en hiver. Des changements saisonniers des concentrations de D5 dans les effluents ont également été observés, mais ils n'étaient pas aussi significatifs que ceux observés dans les affluents (entre 1,00 et 1,30 en automne et entre 1,65 et 2,29 en hiver).
D'autres instances ont déclaré des résultats de surveillance semblables (tableau 11b). Aux États-Unis, du D5 a été détecté qualitativement dans des réseaux d'eau potable (Lucas, 1984, cité par l'Agence de protection de l’environment des États-Unis [U.S. EPA, 1992]). En Europe, des échantillons d'eau ont également été prélevés dans les affluents et les effluents de SEEE et en aval de celles-ci, notamment dans certains lieux associés à des installations de fabrication de silicone (Boehmer et Gerhards, 2003; voir tableau 11b). Des concentrations plus élevées de D5 ont été détectées dans les affluents et les effluents des SEEE associées à ces installations. La plupart des échantillons d'eau prélevés en aval des usines de silicone contenaient des concentrations non détectables de D5. Cependant, dans un cas, une concentration de 0,4 µg/L a été déclarée.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 28 sites d'échantillonnage excluant les affluents et les effluents de SEEE [2] 7 sites d'échantillonnage des affluents de SEEE [3] 12 sites d'échantillonnage des effluents de SEEE [4] Un total de 12 échantillons d'eau de mer recueillis à 2 emplacements [5] 7 échantillons d'affluents de SEEE recueillis [6] 4 échantillons d'effluents de SEEE recueillis [7] Un total de 5 échantillons recueillis à 2 emplacements [8] Un total de 8 échantillons recueillis à 3 emplacements [9] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. l.d. = limite de détection |
|||
| Affluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 0,49-227,72 µg/L | Voir la note 9 |
| Effluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 1,00-2,29 µg/L | Voir la note 9 |
| Eau potable | États-Unis | Détection qualitative | Lucas, 1984, cité par la U.S. EPA, 1992 |
| Eau | Sites de fond et sites urbains[1], pays nordiques | < 0,07 (l. d.) | Norden, 2005; NILU, 2007 |
| Eau | Allemagne[4]; 2000-2001 | < 0,04 µg/L (l. d.) | Boehmer et Gerhards, 2003 |
| Affluents de SEEE | Pays nordiques[2] | 0,33-26 µg/L | Norden, 2005; NILU, 2007 |
| Effluents de SEEE | Pays nordiques[2] | < 0,063-1,0 µg/L | Norden, 2005; NILU, 2007 |
| Affluents de SEEE | Allemagne[5]; 2000-2001 | 1,3-50,1 µg/L | Boehmer et Gerhards, 2003 |
| Effluents de SEEE | Allemagne[6]; 2000-2001 | 0,1-1,0 µg/L | Boehmer et Gerhards, 2003 |
| Affluents de SEEE | SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[7], 2001 | 365-3 694 µg/L | Boehmer et Gerhards, 2003 |
| Effluents de SEEE | SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[8], 2001 | < 0,02 (l. d.)- 26,7 µg/L | Boehmer et Gerhards, 2003 |
| Eau | En aval de SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[9], 2001 | < 0,02 (l. d.)-0,4 µg/L | Boehmer et Gerhards, 2003 |
Dans les sédiments
Au Canada, on a dosé le D4, le D5 et le D6 de sédiments de surface et de carottes de sédiments prélevés dans le lac Ontario en juillet 2006 (Powell et Kozerski, 2007). Les sédiments de surface étaient constitués de la couche supérieure de 5 cm de sédiments du port de Toronto et du bassin de Kingston. Les carottes de sédiments prélevées dans les bassins de Rochester, de Mississauga et de Niagara ont été découpées en strates d'une épaisseur de 5 mm. Les sédiments de surface du port de Toronto et du bassin de Kingston contiennent une teneur en carbone organique total modérée (COT = 2,1-2,4 % p. s. [poids sec]) alors que les carottes de sédiments contiennent une teneur en COT élevée (4-5 % p. s.). Une analyse de perte par calcination des sédiments a également indiqué des teneurs en eau plus faibles dans les sédiments de surface (55-70 % p. h. [poids humide]) que dans les carottes de sédiments (80-89 %). On sait que les sédiments du port de Toronto et des quatre bassins sédimentaires sont contaminés par divers composés organiques qui pénètrent dans le lac par des rejets directs d'eaux usées traitées, qui s'écoulent des Grands Lacs supérieurs (Érié, Huron et Michigan) et de la rivière Niagara ou qui proviennent du dépôt atmosphérique. Les sédiments de surface du port de Toronto contenaient les plus fortes concentrations de D5 (0,78 µg/g en poids sec). Par contre, les concentrations de siloxanes cycliques dans les sédiments de surface et les carottes de sédiments des quatre bassins sédimentaires étaient toutes inférieures à la limite de détection de la méthode analytique, qui était fixée à 0,017 µg/g pour le D5. D'autres instances ont déclaré des résultats de surveillance semblables dans lesquels du D5 était détecté dans les sédiments de surface de régions urbaines et de sources ponctuelles (tableau 11c).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire des échantillons de sédiments de surface et de carottes de sédiments n'a pas permis de détecter de D5, la limite de détection étant fixée à 15,9 ng.
Les résultats de surveillance des sédiments pour les zones du lac Opeongo et du lac Ontario semblent indiquer qu'il est plus probable de détecter une contamination au D5 à proximité des centres urbains et des sources ponctuelles.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 30 sites d'échantillonnage de sédiments [2] Un total de 11 matrices d'échantillonnage de 9 emplacements [3] Un total de 12 échantillons de sédiments marins provenant de 2 régions [4] Masse de référence corrigée telle qu’elle est mentionnée dans l’étude préliminaire p.s. = poids sec; l.d. = limite de détection; l.q. = limite de quantification |
|||
| Sédiments de surface | Port de Toronto (Canada); juillet 2006 | 0,78 µg/g p.s. | Powell et Kozerski, 2007 |
| Sédiments de surface | Bassin de Kingston (Canada); juillet 2006 | < 0,017 µg/g p.s. (l.d.) | Powell et Kozerski, 2007 |
| Carottes de sédiments | Bassins de Rochester, de Mississauga et de Niagara (Canada); juillet 2006 | < 0,017 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Sédiments de surface | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | 15,9 ng (l.d.)[4] | Powell, 2008 |
| Carottes de sédiments | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | 15,9 ng (l.d.) [4] | Powell, 2008 |
| Sédiments | Pays nordiques[1] | < l. d. (variations entre les échantillons) – 0,92 µg/g p.s. |
Norden, 2005; NILU, 2007 |
| Sédiments de cours d'eau | Allemagne[2] | < 0,003 (l.q.)-0,042 µg/g p.s. | Boehmer et Gerhards, 2003 |
| Sédiments marins | Allemagne[3] | 0,033-0,28 µg/g p.s. | Boehmer et Gerhards, 2003 |
Dans le sol
Le D5 peut pénétrer dans le sol par l'application de boues d'épuration sur les terres agricoles. Aucune donnée de surveillance n'a été relevée au Canada concernant la présence du D5 dans les boues d'épuration. En Europe, le D5 est présent dans les boues d'épuration à des concentrations allant de quelques mg/kg à 130 mg/kg en poids sec (Norden, 2005; Kaj et al., 2005; NILU, 2007).
Aucune donnée de surveillance n'est disponible à propos du D5 dans le sol au Canada. Les concentrations de D5 dans deux échantillons de sol des îles Féroé étaient inférieures à la limite de détection (< 5 ng/g p. s.) [Norden, 2005].
Dans le biote
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire d'échantillons de zooplancton n'a pas permis de mettre en évidence la présence de D5. Les échantillons représentatifs de zooplancton ont été regroupés en un échantillon unique pour chacun des deux emplacements sans être classés par espèce. La limite de détection était de 15,9 ng (masse de référence corrigée).
En Europe, le D5 était le cyclosiloxane prédominant dans le foie des poissons et chez les mammifères marins, selon les résultats du programme d'évaluation préalable des pays nordiques. Ce produit a été détecté chez les poissons d'eau douce et de mer dans les sites d'échantillonnage des régions urbaines et voisines des SEEE, dans une fourchette de concentrations allant de moins de 5 à 84 ng/g en poids humide, sauf pour un échantillon de foie de morue (composé de neuf foies) recueilli à proximité d'un centre-ville, en Norvège, qui présentait une concentration extrêmement élevée de D5 (2 200 ng/g en poids humide). Le programme de suivi des effets sur l'environnement mené par le gouvernement norvégien a permis de confirmer les concentrations de D5 initiales rapportées pour les foies de morue (NILU, 2007; voir tableau 11d). Dans le cadre du même programme de suivi, du D5 a également été détecté dans des moules communes, dans les foies et les filets de limandes à queue jaune et dans le contenu de l'estomac de morues de Norvège. Les concentrations variaient selon les espèces, le sexe et l'âge. Du D5 a également été détecté dans le petit lard de phoques et de globicéphales à des concentrations comprises entre moins de 5 et 24 ng/g en poids humide (Norden, 2005). Du D5 a par ailleurs été identifié dans des échantillons de poissons en Allemagne à des concentrations comprises entre 0,15 et 2,6 mg/kg (SEHSC, 2005a). Il n'a en revanche pas été détecté en Suède dans des échantillons de muscles de poissons (Kaj et al., 2005).
La présence de D5 dans le biote en Europe indique que malgré les faibles concentrations détectées, voire la non-détection, de la substance dans l'habitat des poissons ou à proximité, le D5 est présent dans l'environnement pour l'absorption par le biote et l'accumulation dans celui-ci.
| Organisme | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 11 matrices d'échantillonnage pour les poissons d'eau de mer [2] Un total de 10 matrices d'échantillonnage pour les poissons d'eau douce [3] Un total de 7 matrices d'échantillonnage pour les mammifères marins [4] Un total de 17 matrices d'échantillonnage pour les œufs d'oiseaux de mer [5] Un total de 3 matrices d'échantillonnage pour les moules [6] Un total de 2 matrices d'échantillonnage pour la limande à queue jaune [7] Un total de 3 matrices d'échantillonnage pour la morue [8] Un total de 5 matrices de poisson a été prélevé dans le Rhin; un saumon danois provenant d’un emplacement non spécifié ne présentait pas de quantité détectable de D5 p. h. = poids humide; l. d. = limite de détection; l. q. = limite de quantification |
|||
| Zooplancton | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | < 15,9 ng/g (l.d.) | Powell, 2008 |
| Foie de poissons d'eau de mer | Pays nordiques[1], 2002-2004 |
< 5 (l. d.)-2 200 ng/g p.h. | Norden, 2005 |
| Foie de poissons d'eau douce | Pays nordiques[2]; 2002 | < 5 (l. d.)-84 ng/g p.h. | Norden, 2005 |
| Mammifères marins | Pays nordiques[3]; 2002 | < 5 (l. d.)-24 ng/g p.h. | Norden, 2005 |
| Œufs d'oiseaux de mer | Pays nordiques[4], 2000-2005 |
< 5 ng/g p. h. (l.d.) | Norden, 2005 |
| Moules communes | Norvège[5]; 2006 | 3,3-8,7 ng/g p.h. | NILU, 2007 |
| Foies de limandes à queue jaune | Norvège[6]; 2006 | 27,1 ng/g p.h. | NILU, 2007 |
| Filets de limandes à queue jaune | Norvège[6]; 2006 | 3,4 ng/g p.h. | NILU, 2007 |
| Contenu de l'estomac de morues | Norvège[7]; 2006 | 22,9-149,3 ng/g p.h. | NILU, 2007 |
| Foies de morues | Norvège[7]; 2006 | 1 490,8-1978,5 ng/g p.h. | NILU, 2007 |
| Poissons | Fleuve Rhin[8], en Allemagne | 150-2600 ng/g p.h. | SEHSC, 2005b |
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable a consisté à examiner les divers renseignements à l’appui de la caractérisation et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence prévus à l’article 76.1 de la LCPE (1999). Une attention particulière a été accordée à l'analyse du quotient de risque, à la persistance, au potentiel de bioaccumulation, à la toxicité, aux sources et au devenir dans l'environnement.
Selon les renseignements disponibles, le D5 a été identifié comme très persistant dans l'eau et comme présentant un potentiel de bioaccumulation dans les organismes aquatiques. Une évaluation quantitative du quotient de risque de l'exposition et des effets écologiques a donc été réalisée dans le cadre de l'évaluation de l’ensemble des données concernant le potentiel d'effets nocifs du D5.
Dans le milieu aquatique, les résultats de deux études expérimentales acceptables sur la toxicité chronique chez des Daphnia magna et des truites arc-en-ciel indiquent que le D5 n'a eu aucun effet nocif significatif à des concentrations pouvant atteindre 0,015 mg/L, cette valeur étant très proche de la limite de solubilité dans l'eau de la substance (env. 0,017 mg/L). Aucun facteur d'application n’a été appliqué à la CSEO chronique de 0,015 mg/L. La concentration estimée sans effet (CESE) est donc de 0,015 mg/L. On considère que l'exposition au D5 chez les organismes aquatiques peut atteindre un niveau supérieur à sa solubilité dans l'eau mesurée dans des conditions environnementales réalistes.
Le D5 a été soumis à une analyse du quotient de risque (QR) qui intègre le niveau d'exposition et un seuil de toxicité. Pour tenir compte du risque du D5 à l'échelle du Canada, on a déterminé une distribution établissant le profil des quotients de risque dans l'eau au niveau de plusieurs sites de rejet de la substance par l'industrie ou les consommateurs (c.-à-d. des stations municipales d’épuration des eaux d’égout). Ce type d'analyse fournit des éléments utiles à l'évaluation des risques d'une substance lorsqu’il est impossible d’établir totalement l'ensemble des emplacements géographiques des rejets effectués par l'activité industrielle et les consommateurs de cette substance.
En particulier, lorsque divers secteurs industriels utilisent une substance sans qu’on puisse identifier les installations effectivement impliquées, on peut alors estimer l'exposition en milieu aquatique pour tous les emplacements des installations ayant un lien avec ces secteurs. Par ailleurs, des informations concernant des rejets potentiels attribuables à une utilisation par les consommateurs peuvent être intégrées aux calculs. Une concentration environnementale estimée (CEE) pour le milieu aquatique est déterminée en fonction des quantités utilisées déterminées à partir des réponses à l'enquête menée en application de l’article 71 et des estimations concernant les rejets effectués par l'activité industrielle et les consommateurs. Les eaux réceptrices sont un cours d'eau ou un lac, et un facteur de dilution basé sur la superficie des eaux réceptrices (10 au maximum) est utilisé pour estimer la CEE. Le quotient de risque propre à chacun des sites est ensuite déterminé pour la colonne d'eau. La distribution indique non seulement la proportion ou le nombre de sites dépassant le seuil, mais également l'ordre de grandeur de ce dépassement pour chaque site. Des informations complémentaires sur la méthode utilisée figurent dans le rapport d'Environnement Canada (2008b).
L'analyse des rejets des consommateurs se fonde sur une base de données répertoriant près de 1 000 lieux (ou sites) d'élimination municipaux représentant environ les deux tiers de la population canadienne. L'analyse des rejets industriels a été effectuée pour 64 sites liés à 87 installations industrielles identifiées par leur code NAICS comme des utilisateurs potentiels de D5. Au total, dans ces scénarios, 65 (env. 6,8 %) des lieux d'élimination municipaux évalués au Canada présentent un risque pour les organismes aquatiques, avec des QR supérieurs à 1 (voir la figure 1). L'équation et les paramètres utilisés pour calculer la CEE dans les cours d'eau récepteurs sont décrits dans le rapport d'Environnement Canada (2008c).


Figure 1. Distribution du risque du D5 pour le milieu aquatique (Environnement Canada, 2008b; id., 2008c)
Bien qu'une analyse du quotient de risque ait été effectuée pour le D5, les données empiriques relatives à l'écotoxicité laissent penser que le seuil auquel des effets nocifs sur le biote pélagique sont censés se produire n'a pas été observé durant les essais de toxicité dont on dispose. Dès lors, les QR calculés dans le scénario ci-dessus sont essentiellement « sans limite » et peuvent ne pas représenter les effets observables « réels » prévus aux sites susmentionnés.
La valeur de log Koe élevée pour le D5 tend à indiquer que celui-ci se trouve dans la classe des produits chimiques « superhydrophobes » qui sont souvent associés à une biodisponibilité faible pour le biote pélagique et benthique. Toutefois, étant donné que la valeur de log Koe pour le D5 n'est pas supérieure à environ 8,0 et qu'une valeur seuil pour les effets dans le biote benthique a été observée, on prévoit un certain degré de biodisponibilité dans l'environnement, en particulier pour les expositions à plus long terme. Les données de laboratoire sur la bioconcentration, bien qu'elles soient optimisées, ainsi que des données prouvant la détection dans le biote prélevé sur le terrain suggèrent que la possibilité pour que la charge corporelle atteigne des niveaux internes critiques peut ne pas être limitée par la biodisponibilité prévue du D5, en particulier près des émissaires d'évacuation des stations d’épuration des des eaux d’égout.
Le profil du D5 en matière de propriétés physiques et chimiques, de bioconcentration et d'écotoxicité ne fournit pas de base consensuelle à l’établissement d’une conclusion définitive. Il existe certaines incertitudes quant à savoir si le D5 présente un potentiel d’effets nocifs sur l’environnement. Le D5, dont de grandes quantités sont importées au Canada, est considéré comme persistant dans l’environnement. Selon les informations disponibles, les quantités de D5 importées et utilisées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988). La tendance étant à une augmentation de son utilisation, ses rejets dans l'environnement et le potentiel d'exposition de l’environnement pourront augmenter également.
Compte tenu de ce qui précède, il faut donc appliquer de manière acceptable le principe de prudence. C’est pourquoi il est conclu que le D5 présente un potentiel d'effets nocifs sur l'environnement lorsqu’il est rejeté dans l’environnement au Canada, notamment pour des périodes d’exposition à long terme près des lieux d’élimination.
Incertitudes dans l'évaluation des risques pour l’environnement
Le D5 est l'un des principaux composants du no CAS 69430-24-6 et est également présent dans les PDMS dans des proportions pouvant atteindre 3 %. Or, le n° CAS 69430-24-6 (ou cyclométhicone représentant le mélange) et les PDMS ne figurent pas sur la liste des substances contrôlées dans le cadre du Défi du gouvernement canadien lancé à l'industrie et aux autres parties intéressées (Canada, 2007). Bien qu'il soit établi que certaines sociétés ont déclaré divers cVMS dans le mélange dans le cadre de l'enquête, les quantités de ces substances importées au Canada et leurs utilisations en 2006 ne sont pas totalement connues, et leurs rejets dans l'environnement au pays ne sont pas entièrement pris en compte dans le présent rapport d'évaluation préalable.
Plusieurs facteurs contribuent à l'incertitude de l'évaluation de la toxicité dans le milieu aquatique. Figurent parmi ceux-ci une absence d'études de toxicité avec des poissons d'une taille comparable à celle des poissons pour lesquels la toxicité a été prouvée avec les mêmes quantités de composés volatils de type méthylsiloxane (cVMS) et de D4, une absence d'études de toxicité avec des poissons à des stades précoces de leur existence, une absence d’essais où les expositions sont quelque peu supérieures à la limite d'hydrosolubilité et des préoccupations selon lesquelles la durée d'exposition était insuffisante pour atteindre des concentrations tissulaires stables. Pour l'analyse de distribution du risque, la CSEO a été calculée à partir d'une étude de toxicité chronique du D5 sur des Daphnia magnaà une concentration très proche de sa limite de solubilité dans l'eau (env. 0,017 mg/L). Cette CSEO étant la concentration maximale (sans limite) de l’essai, aucun facteur d'application n’a été employé pour extrapoler des données sur le terrain à partir de données de laboratoire en raison de l'absence d'effets nocifs significatifs observés à cette concentration. Des effets nocifs chroniques pourraient se produire étant donné la variabilité probable de la solubilité dans l'eau dans des conditions environnementales réalistes et l’ingestion possible du D5 par des organismes aquatiques du fait de sa fixation à des matières organiques en suspension provenant de SEEE (susceptibles de contenir une concentration de D5 supérieure à la solubilité de la substance dans l'eau [voir tableau 9b]). Puisqu'on ne disposait d'aucune information relative aux rejets liés aux activités industrielles pour l'analyse de distribution du risque, il est considéré que les rejets dans les eaux usées sont répartis de manière uniforme entre les 64 sites industriels évalués. En réalité, certains sites industriels peuvent utiliser davantage de D5 que d'autres, ce qui génère des rejets plus importants dans les lieux d'élimination municipaux associés à ces sites et donc un risque supérieur aux prévisions. Dans l'analyse, on a appliqué, aux concentrations de distribution, une dilution instantanée des effluents des SEEE dans les eaux réceptrices. Toutefois, dans des conditions environnementales réalistes, la dilution instantanée ne peut pas être obtenue au-delà d'une certaine distance du point de rejet et la zone proche du point de rejet d'une SEEE peut présenter un risque supérieur aux prévisions.
Les sédiments sont un sujet de préoccupation important concernant le D5. Les études de dégradation du D4 dans les sédiments qui ont été utilisées pour le D5 comportaient des incertitudes. L'extrapolation des demi-vies à faible température dans les sédiments selon les données d'hydrolyse peut également contribuer à l'incertitude globale concernant la persistance dans les sédiments. Les données limitées relatives au potentiel de bioaccumulation dans ce milieu ajoutent également à l'incertitude globale de l'évaluation écologique.
Les données disponibles concernant la bioconcentration ainsi que les valeurs du facteur de bioamplification et d'accumulation dans les sédiments pour le D5 sont contradictoires. On note un manque de données de terrain sur le potentiel de bioaccumulation par la chaîne alimentaire et chez les organismes non aquatiques.
Les prévisions des modèles ont également été intégrées à la présente évaluation préalable. Il existe des incertitudes concernant les valeurs prévues car seuls quelques siloxanes ou produits chimiques avec des valeurs de log Koe élevées (> 8) ont été étudiés et intégrés aux modèles. La toxicité inhérente prévue des organismes aquatiques peut constituer une source supplémentaire d'incertitude lorsque les concentrations dépassent la solubilité dans l'eau de la substance chimique. Puisque les concentrations pour la toxicité et la solubilité dans l'eau dans des conditions environnementales réalistes sont souvent incertaines (écart par rapport aux conditions en laboratoire optimales), les valeurs de toxicité qui dépassent les estimations de solubilité jusqu'à un facteur de 1 000 ont été acceptées au cours de la catégorisation.
Les données de surveillance environnementale au Canada et ailleurs sont limitées. La contamination des échantillons est un problème possible pour la surveillance environnementale en raison des nombreuses utilisations du D5. Les données disponibles sur les concentrations environnementales de D5 dans le biote et dans les eaux de surface au Canada sont limitées et peu de concentrations environnementales ont été signalées pour des régions à l'extérieur des zones urbaines du Canada. Pour ces raisons, le présent rapport utilise des données de surveillance de pays européens. La surveillance a cependant également été identifiée comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et le D5 a été pris en compte pour la surveillance environnementale dans le cadre de ce plan. La surveillance environnementale contribuera à une meilleure compréhension de la présence environnementale et du potentiel réel d'accumulation de la substance dans l'environnement.
Évaluation de l'exposition
La section « Évaluation de l'exposition de l’environnement » de ce rapport présente les données sur les concentrations de D5 détectées dans les milieux naturels, notamment dans l'air ambiant à proximité et à distance des sources ponctuelles, des eaux de surface, des sédiments, des boues d'épuration et du biote. Les données non publiées du Canada incluent des mesures des biogaz dans les décharges (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références), des mesures dans l'air à proximité et à distance de sources ponctuelles (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références), des mesures dans l'air et les affluents et effluents de stations d'épuration des eaux usées (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures; ne figure pas dans les références) ainsi que des mesures dans les sédiments des Grands Lacs (Powell et Kozerski, 2007). De nombreuses analyses de siloxanes volatils ont généré des résultats incohérents en raison de la contamination des échantillons pendant la collecte et l'analyse, responsable de la détection de siloxanes dans les blancs, à des concentrations dans certains cas comparables à celles des échantillons prélevés à proximité de sources ponctuelles. De 2002 à 2004, une enquête a été menée sur les composés organiques volatils dans l'air des habitations, notamment sur les siloxanes décelés dans des maisons à Syracuse (État de New York), aux États-Unis (NYIEQ, 2005). Le Conseil des ministres des pays nordiques et l'Institut de recherche environnementale de la Suède ont publié les résultats de vastes campagnes d'échantillonnage et de mesure des siloxanes dans les milieux naturels en Scandinavie (Norden, 2005; Kaj et al., 2005). Les données de ces rapports, considérées comme fiables, ont été utilisées pour calculer les limites supérieures estimées de l'exposition aux siloxanes dans l'air, l'eau et le sol pour la population du Canada.
L'annexe 1 présente les limites supérieures estimées de l'absorption quotidienne de D5 pour six groupes d'âge de la population canadienne. Les valeurs estimées de l'absorption à partir des milieux naturels et du régime alimentaire sont comprises entre 68,7 et 208 µg/kg p. c./j. (kilogramme de poids corporel par jour) respectivement pour les adultes âgés de 60 ans et plus et les enfants de 6 mois à 4 ans. Selon une étude portant sur quelque 130 habitations menée à Syracuse (New York), au cours de laquelle du D5 a été détecté dans 85 % des maisons, la contribution la plus significative à l'absorption quotidienne due aux milieux naturels est l'inhalation d'air intérieur. Au cours de cette étude, la concentration maximale de D5 dans l'air intérieur mesurée dans les habitations était de 1 560 µg/m3 (moyenne de 136 µg/m3) [NYIEQ, 2005]. Pour caractériser une limite supérieure estimée plus représentative, le 90e percentile a été estimé à partir des données disponibles. On a ainsi obtenu une concentration approximative de 393 µg/m3 (courrier électronique de Santé Canada, Division des statistiques biologiques, janvier 2008; ne figure pas dans les références) qui a été utilisée dans le tableau des valeurs d'absorption (annexe 1).
La confiance dans la limite supérieure estimée de l'exposition au D5 dans les milieux naturels et dans le régime alimentaire est modérée. Aucune donnée canadienne n'a été utilisée, mais des données d'études effectuées en Scandinavie et aux États-Unis étaient disponibles pour l'air ambiant et intérieur, l'eau et le sol. Le calcul du 90e percentile à partir de l'étude sur l'air intérieur était fondé sur les données disponibles et sur l'hypothèse d'une distribution normale, bien que les données disponibles indiquent que la distribution des données pourrait ne pas être normale. L'utilisation d'une limite réglementaire pour le diméthylpolysiloxane dans un quart des produits laitiers et la moitié des aliments transformés peut causer une surestimation de la contribution alimentaire à l'exposition totale, mais la contribution estimée de tous les aliments à l'exposition de la population due aux milieux naturels et au régime alimentaire est inférieure à 1 % de celle de l'air.
À l’aide de la version 4.1 du logiciel ConsExpo, qui est conçu pour estimer l'exposition aux produits de consommation, la dose systémique possible de D5 due à l'utilisation de produits d'hygiène a été estimée pour les femmes qui utilisent des produits de soins de la peau, des produits capillaires et des antitranspirants (RIVM, 2006). Les fabricants de produits d'hygiène doivent signaler à Santé Canada les concentrations de siloxanes, au sein de vastes plages, notamment pour le D5 et les polydiméthylcyclosiloxanes, appelés cyclométhicone dans l'industrie des produits d'hygiène[1]. Santé Canada a été informé qu’environ 3 000 produits cosmétiques contenaient du D5 comme seul siloxane ou mélangé à d'autres siloxanes et qu’environ 6 000 contenaient du cyclométhicone ou des mélanges de ce dernier (SDC, 2007). Les données sur la concentration de D5 dans les produits d'hygiène ont été obtenues principalement à partir des renseignements fournis par l'industrie canadienne (Environnement Canada, 2007; SDC, 2007) et complétées par des renseignements issus d'autres sources indiquées dans l'annexe 2. Les données relatives aux parts de marché n'ont pas été utilisées pour déterminer la concentration de D5 dans les produits dominants pour chacune des catégories d'utilisation. Si l'une des concentrations déclarées en réponse à l'avis publié en application de l'article 71 de la LCPE (1999) pour une catégorie de produits était supérieure à celles du SDC, une concentration inférieure de D5 concordant avec la plage des valeurs déclarées au SDC a été utilisée pour cette catégorie de produits afin d'estimer la dose systémique (Environnement Canada, 2007; SDC, 2007).
On a supposé que 80 % d'un produit appliqué sur la peau s'évaporaient au cours de l'utilisation et n'étaient donc pas disponibles pour l'absorption cutanée. Cette valeur se base sur une observation expérimentale selon laquelle 80 à 91 % du D5 s'évaporent de la peau en 24 heures (Jovanovic et al,. 2008). On fait une distinction entre les produits qui sont retirés de la peau par lavage et ceux qui restent sur le corps.
À des fins de modélisation de l'absorption des produits d'hygiène, il a été décidé d'utiliser les taux d'absorption pour l'exposition par inhalation et par ingestion établis pour le D4, ce qui concorde avec une approche prudente pour évaluer la dose. Pour l'absorption cutanée, on a utilisé la valeur de 0,17 % établie expérimentalement pour la peau des rats par Jovanovic et al. (2008). D'autres hypothèses sont signalées dans l'annexe 2.
L'annexe 2 présente les résultats d'un exemple de calcul pour l'application d'une lotion corporelle et le tableau 1, une synthèse relative à la dose systémique estimée due à l'utilisation de produits d'hygiène par les femmes adultes. Pour celles-ci, la limite supérieure estimée de la dose systémique quotidienne pour les produits d'hygiène modélisés, cumulée pour l'exposition par inhalation et par voie cutanée et orale, est de 0,17 mg/kg p. c./j. L'évaluation préalable de l'octaméthylcyclotétrasiloxane (D4) a montré que pour les femmes qui utilisent des produits d'hygiène, la dose systémique est supérieure à celle absorbée par les hommes, ce qui devrait aussi être le cas pour le D5.
Une évaluation de l'exposition au D5, notamment pour les utilisations de produits d'hygiène, a été présentée au gouvernement du Canada dans le cadre du Défi (SEHSC, 2008a). La méthodologie est différente de celle utilisée dans le tableau 1 de l'annexe 2 car elle fait appel à une analyse probabiliste (Monte Carlo) et regroupe les expositions de la population à toutes les sources (notamment les produits d'hygiène) et voies d'exposition (par inhalation, par voie cutanée et par ingestion). On a caractérisé la contribution de l'utilisation des produits d'hygiène à l'exposition totale par plusieurs voies (par inhalation, voie cutanée et ingestion), puis calculé le total pour obtenir une estimation de l'exposition cumulée. Une étude indépendante de l'évaluation probabiliste présentée a conclu que cette évaluation portait sur l'exposition pour les groupes d'utilisateurs et de non-utilisateurs (voir annexe 4). Les données ont été réanalysées en fonction des groupes d'utilisateurs afin de comparer les résultats à ceux de l'évaluation déterministe de l'exposition au cours de cette évaluation préalable. Les valeurs probabilistes d'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, étaient 10 à 16 fois inférieures aux valeurs déterministes présentées dans le tableau 1 de l'annexe 2. Il est à noter qu'en raison des exigences relatives à l'analyse détaillée et à la validation des valeurs obtenues au cours d’évaluations probabilistes de l’exposition, ces valeurs se situent normalement hors de portée pour la composante « exposition » d'une évaluation préalable.
Les valeurs probabilistes d'exposition pour les enfants de 0 à 6 mois (le groupe d'enfants le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, se situaient dans la plage de 0,016 à 0,032 mg/kg p. c./j. (voir annexe 4). La comparaison avec une évaluation déterministe de l'exposition pour les enfants était impossible en raison du manque de données sur l'utilisation du produit, qui étaient nécessaires à la modélisation de l'exposition pour les enfants lors d'une évaluation déterministe de l'exposition. Les valeurs probabilistes d'exposition pour les enfants sont 5 à 10 fois inférieures aux valeurs déterministes d'exposition pour les femmes adultes.
La contribution d'autres types de produits de consommation comme les revêtements de surface, les produits de calfeutrage et les nettoyants à l'exposition quotidienne due aux utilisations quotidiennes a été jugée beaucoup plus faible; ces produits n'ont donc pas été pris en compte pour la modélisation de la dose quotidienne dans les scénarios d'exposition des consommateurs. Les produits d'hygiène et d'autres produits de consommation comme les revêtements de surface, les produits de calfeutrage et les nettoyants contribuent aux concentrations de D5 dans l'air intérieur et ambiant, et ainsi à l'exposition par inhalation. La contribution de tous les produits de consommation à l'exposition totale des personnes exposées à des sources hors du milieu de travail a été évaluée à partir de l'air intérieur avec le modèle d'exposition de l’environnement à plusieurs milieux examiné ci-dessus dans cette section.
Le niveau de confiance dans la dose systémique estimée pour le D5 absorbé par l'utilisation des produits d'hygiène est faible. Toutes les valeurs estimées ont été obtenues à l'aide de modèles et de données sur les profils d'utilisation provenant d'études réalisées dans d'autres pays que le Canada. Les valeurs de l'étendue de l'utilisation du D5 dans les produits d'hygiène et de la concentration de D5 dans les produits qui sont commercialisés actuellement peuvent être plus faibles que celles utilisées pour estimer la dose systémique déclarée ci-dessus et dans l'annexe 2 (Environnement Canada, 2007; SEHSC, 2007a). Par conséquent, ces valeurs devraient être supérieures à celles de l'exposition au D5 due aux produits d'hygiène.
Évaluation des effets sur la santé
L'annexe 3 présente une synthèse des renseignements disponibles concernant les effets sur la santé du décaméthylcyclopentasiloxane (D5).
Aucun organisme international n'a classé le D5 dans une catégorie ou un groupe de substances présentant des propriétés de cancérogénicité, génotoxicité ou toxicité sur le plan de la reproduction ou du développement. Une seule étude nationale concernant les effets sur la santé des cyclosiloxanes a été identifiée à ce jour. Elle émane de l'Agence de protection de l'environnement du Danemark, qui a étudié les effets sur la santé du D4 et du D5 (Lassen et al., 2005).
Selon l'évaluation de l'Agence de protection de l'environnement du Danemark, la cancérogénicité est un effet potentiel de la toxicité de doses répétées. Cette conclusion était fondée sur l'observation de tumeurs utérines au cours d'une étude d'inhalation de 2 ans chez les rats (Lassen et al., 2005). Dans une fiche technique sur le D5 utilisé pour le nettoyage à sec, l'Agence de protection de l’environnement des États-Unis a aussi noté ce résultat et indiqué qu'elle allait déterminer s'il était approprié d'effectuer une évaluation des risques pour le D5 quand l'analyse de son mode d'action serait terminée (U.S. EPA, 2005). Cet organisme n'a pas fourni d'autres renseignements sur le D5.
Dans une étude de toxicité chronique et de cancérogénicité, des rats ont été exposés à des concentrations de vapeur de 0, 10, 40 ou 160 ppm de D5 pendant 6 heures par jour et 5 jours par semaine sur une période de 24 mois. Dans le groupe subissant la dose la plus élevée, on a constaté une augmentation statistiquement significative des tumeurs utérines (adénocarcinomes endométriaux) observées chez les rats femelles et une incidence accrue d'inclusions hyalines dans l'épithélium nasal des voies respiratoires ou olfactives pour les deux sexes. De plus, dans un sous-groupe exposé aux mêmes concentrations pendant 12 mois, après une période de récupération de 12 mois, on a observé une augmentation de l'incidence des inclusions hyalines dans l'épithélium nasal des voies respiratoires ou olfactives pour les deux sexes à 40 et 160 ppm (Dow Corning, 2005). Le décaméthylcyclopentasiloxane (D5) n'est pas génotoxique selon plusieurs essais in vitro et in vivo (voir l'annexe 3). Les résultats limités sur sa génotoxicité semblent indiquer que les tumeurs observées au cours de l'étude de toxicité chronique et de cancérogénicité pourraient être dues à des effets de seuil.
Bien qu'une analyse poussée du mode d'action du décaméthylcyclopentasiloxane n'entre pas dans le cadre de la présente évaluation préalable, on reconnaît que le D5 agit peut-être comme un agoniste de la dopamine, contribuant ainsi aux effets tumorigènes observés chez les rats femelles (SEHSC, 2008a). Bien que le SEHSC (2008a) ait déclaré que ce mode d'action n'était pas pertinent pour les humains, d'autres organismes de réglementation n'ont pas adopté cette position en raison de l'absence d'analyses complètes du mode d'action (évaluation de l'Agence de protection de l'environnement du Danemark, par exemple).
L'évaluation de l'Agence de protection de l'environnement du Danemark a déterminé que le poumon était le principal organe cible (Lassen et al., 2005). La plus faible concentration à laquelle des effets sur les poumons ont été observés était de 450 mg/m3 (30 ppm), selon une augmentation significative de l'incidence de la minéralisation vasculaire pulmonaire observée au cours d'une étude sur la reproduction (exposition par inhalation) [Siddiqui et al., 2007; voir ci-dessous]. Toutefois, d'autres effets sur les voies respiratoires ont été observés à des doses moins élevées. La concentration minimale avec effet observé (CMEO) pour l'exposition par inhalation à des doses répétées au D5 était de 10 ppm (150 mg/m3), selon des effets sur les fosses nasales (augmentation de l'incidence et de la sévérité de la prolifération des cellules calciformes dans le niveau 1 des fosses nasales pour les deux sexes) au cours d'une étude de 28 jours chez les rats (Burns-Naas et al., 1998a). À des concentrations plus élevées (≥ 380 mg/m3, ≥ 25 ppm) au cours d'études à court et à long terme chez les rats, on a observé des effets supplémentaires, notamment l'augmentation du poids du foie et des poumons, des changements réversibles dans le poids du thymus et d'autres effets dans les fosses nasales, des effets pulmonaires, ainsi que des effets de chimie clinique (Burns-Naas et al., 1998a; id., 1998b; TNO, 1984). On a calculé une CMEO de 700 mg/m3(46 ppm) au cours d'une étude de 3 mois, selon une augmentation du poids du foie chez les rats (TNO, 1984) et une CMEO de 600 mg/m3 (40 ppm) au cours d'une étude de 2 ans chez les rats, selon une augmentation de l'incidence d'inclusions hyalines dans l'épithélium des voies nasales, respiratoires et olfactives (Dow Corning, 2005).
Pour l'exposition à des doses répétées par voie orale, la CMEO était de 5 mg/kg p. c./j. selon une augmentation de l'activité enzymatique du foie (CYP2B1/2 et EROD) au cours d'une étude de 4 jours chez les rats (Zhang et al., 2000). À des doses supérieures (≥ 20 mg/kg p. c./j.) au cours d'études d'absorption orale à court terme chez les rats, les autres effets observés incluaient notamment une augmentation du poids du foie (Zhang et al., 2000; Jager et Hartmann, 1991).
On a observé des effets sur le foie au cours d'études d'absorption par voie orale et par inhalation pour le D5. Par exemple, on a noté une augmentation significative du poids du foie au cours d'une étude d'absorption orale de 3 mois chez les rats (Jager et Hartmann, 1991) et une augmentation du poids du foie au cours d'une étude d'absorption par inhalation de 3 mois chez les rats (CMEO de 700 mg/m3 selon Burns-Naas, 1998b), ce qui indique un effet commun dû aux voies d'exposition orale et par inhalation pour la même durée. Bien que l'Agence de protection de l'environnement du Danemark (Lassen et al., 2005) n'ait pas rapporté d'effets sur le foie aussi critiques pour le D5, elle a déclaré que le D5 avait un profil d'induction des enzymes semblable à celui du D4 et que le foie était un organe cible pour l'exposition au D4. Le D4 a été décrit comme un inducteur des enzymes hépatocellulaires et pour cette raison, d'après la similarité des profils d'induction enzymatique du foie de ces deux composés, on estime que le foie est un organe cible pour l'exposition au D5 par voie orale et par inhalation. Zhang (2000) a noté que l'augmentation de l'induction de l'enzyme hépatique CYP3A1/2 due au D5 était plus élevée que celle causée par le phénobarbital au cours d'une étude d’absorption orale de 4 jours chez les rats; en outre, l’auteur a conclu que, malgré le type d'induction semblable à celle due au phénobarbital qui est causée par la série des enzymes CYP2B, il peut y avoir d'importantes différences mécanistes dans l'induction causée par le D5. Toutefois, dans le cas du D4, Falany et Li (2005) ont aussi noté une augmentation de l'induction de l'enzyme du foie CYP3A1/2 au cours d'une étude de 8 jours chez les rats, mais suggèrent que ce phénomène fait partie de l'induction de type phénobarbital due à l'induction connexe des enzymes CYP2B et PROD. Par conséquent, il n'a pas été jugé utile de déterminer des concentrations à effet nocif fondées sur la seule induction des enzymes.
Au cours d'une étude sur 2 générations, des rats Sprague-Dawley ont été exposés à des concentrations de vapeur de 0, 450, 1 050 ou 2 400 mg/m3 (0, 30, 70 ou 160 ppm) de D5 pendant 6 heures par jour par inhalation en milieu confiné. Les paramètres de la reproduction (nombre de jours entre la formation de couples et l'accouplement, indices d'accouplement et de fertilité, durée de la gestation et parturition) et de la spermatogenèse (numération des follicules primordiaux ovariens et des corpus luteus chez les parents F0 et F1) dans tous les groupes d'exposition n'étaient pas notablement différents de ceux du groupe témoin. Le nombre total de nouveau-nés des générations F1 et F2, la taille moyenne de la portée (petits vivants), la proportion de mâles et de femelles par portée, le poids corporel et le taux de survie postnatal des petits n'étaient pas touchés par l'exposition au D5. Toutefois, on a observé une augmentation significative de l'incidence des cas de minéralisation vasculaire pulmonaire chez tous les rats F0 et F1 à 450 mg/m3(30 ppm) et plus, ainsi que des incidences notablement plus élevées de cas de faible histiocytose alvéolaire à la concentration la plus élevée chez les femelles F0 et F1 (Siddiqui et al., 2007).
Les activités œstrogènes, androgènes et progestagènes ont été évaluées au cours de plusieurs essais biologiques in vitro et in vivo. Des études in vivo chez les rats (exposition par inhalation de 16 heures par jour pendant 3 jours à 160 ppm de D5) n'ont mis en évidence aucune augmentation du poids (humide ou sec) de l'utérus ou des organes reproducteurs chez les mâles. De plus, le D5 ne liait ni les récepteurs des œstrogènes humains a et ß, ni les récepteurs de la progestérone, et les résultats étaient négatifs pour les épreuves de gènes rapporteurs ERa et PRß (Quinn et al., 2007).
Il n'a pas pu être déterminé avec certitude si l'augmentation du poids du foie due au traitement par le D5 était une réaction d'adaptation ou un effet nocif. Selon un document d'orientation rédigé par la Health Effects Division de l'Agence de protection de l’environnement des États-Unis (U.S. EPA, 2002), l'augmentation du poids du foie ou l'hypertrophie hépatocellulaire devrait être associée aux concentrations sériques notablement plus élevées ou plus faibles d'au moins deux des enzymes du foie (alanine aminotransférase, aspartate aminotransférase, phosphatase alcaline et gamma-glutamyl transférase), avant d'être attribuée à un problème de toxicité pour le foie. Au cours d'une étude d'inhalation d'un mois à 2 400 mg/m3(160 ppm) chez les rats, les poids relatifs du foie augmentaient notablement pour les deux sexes et la phosphatase alcaline sérique diminuait chez les femelles, même après une période de rétablissement de 14 jours (on observait aussi une augmentation du poids des poumons et une accumulation des macrophages alvéolaires focaux dans les poumons des deux sexes) [Burns-Naas et al., 1998a]. L'étude d'inhalation de 3 mois chez les rats a montré une augmentation significative des rapports pondéraux foie/cerveau, ainsi que de la gamma-glutamyl transférase (γ-GT) chez les femelles à 700 mg/m3(46 ppm) et plus (Burns-Naas et al., 1998b). Une étude d'inhalation d'un an chez les rats a quant à elle montré une augmentation notable du poids absolu et du poids relatif du foie (rapports pondéraux foie/corps entier et foie/cerveau) et de la γ-GT chez les femelles à 2 400 mg/m3 (160 ppm) (Dow Corning, 2005).
Toutefois, on n'a relevé aucune donnée sur les changements dans les concentrations des enzymes hépatiques après l'administration de doses orales. Comme le montre l'annexe 3, le poids du foie passait à 100, 330 et 1 000 mg/kg p. c./j. de D5 au cours d'une étude de toxicité orale de 3 mois chez les rats (Jager et Hartmann, 1991). Bien qu'aucun autre effet n'ait été observé, la valeur de 100 mg/kg p. c./j. est considérée comme la concentration à effet critique pour le D5 d'après les CMEO orales critiques établies pour des composés semblables, le D4 et le D6. Dans le cas du D4, on a déterminé une CMEO orale de 100 mg/kg p. c./j. fondée sur une diminution de l'œstradiol sérique au cours d'une étude de 7 jours chez les souris et une diminution du poids corporel et du poids relatif du foie chez les fœtus au cours d'une étude de 8 jours chez les rats (D4 administré à des femelles gravides). Dans le cas du D6, on a déterminé une CMEO orale de 100 mg/kg p. c./j. fondée sur une augmentation du poids du foie et sur des cas de lipidose périportale dans le foie des femelles, ainsi que sur une hypertrophie des cellules folliculaires de la thyroïde chez les rats des deux sexes au cours d'une étude d’absorption orale de 28 jours.
Des études toxicocinétiques chez les rats ont indiqué que 0,17 % du D5 marqué au 14C appliqué topiquement était absorbé par la peau et qu'environ 30 % du D5 absorbé atteignait la circulation systémique (Jovanovic et al., 2008), avant d'être métabolisé et éliminé dans l'urine) [Varaprath et al., 2003]. Une étude d'inhalation par le nez uniquement de 6 heures menée chez les rats a indiqué que 1 à 2 % du D5 marqué au 14C était conservé dans le corps, que 69 à 80 % du D5 absorbé était déposé dans les tissus et que la voie d'élimination principale était l'air expiré (Tobin et al., 2008).
La confiance dans la base de données sur la toxicité est faible à modérée car les informations disponibles étaient suffisantes pour examiner les effets qui peuvent être préoccupants et déterminer les paramètres critiques d'après les données sur l'exposition par inhalation, ainsi que des renseignements complémentaires pertinents. Toutefois, on note un manque d'études par voie cutanée ou d'études par voie orale pour plusieurs paramètres (cancérogénicité/toxicité subchronique et chronique, études sur la reproduction et sur le développement).
Caractérisation des risques pour la santé humaine
En se fondant en grande partie sur l’évaluation réalisée par l'Agence de protection de l'environnement du Danemark selon la méthode du poids de la preuve, il a été déterminé que l'un des effets potentiels de la toxicité des doses répétées de D5 est la cancérogénicité, selon une étude de deux ans chez les rats (Lassen et al., 2005). Comme mentionné ci-dessus, l'absence d'effets génotoxiques pour le D5, selon des données limitées sur la génotoxicité, semble indiquer que les tumeurs utérines observées au cours de l'étude de toxicité chronique et de cancérogénicité pourraient être dues à des effets de seuil. Il faut également remarquer que ces tumeurs avaient été observées à des concentrations d'exposition plus élevés que celles qui correspondent aux effets signalés pour les poumons et le foie décrits ci-dessous.
L'Agence de protection de l'environnement du Danemark a également établi que le poumon était un organe cible pour les expositions au D5. Ainsi, on estime que l'organe cible critique est le poumon et que la concentration à effet critique pour la toxicité des doses répétées est de 450 mg/m3(30 ppm) par inhalation selon une augmentation significative de l'incidence de la minéralisation vasculaire pulmonaire observée chez deux générations de rats au cours d'une étude sur la reproduction (Siddiqui et al., 2007). Bien qu'une concentration moins élevée entraînant un effet ait été obtenue au cours d'une autre étude à doses répétées (150 mg/m3 durant une étude de 28 jours chez les rats), l'effet observé (augmentation de l'incidence et de la sévérité de la prolifération des cellules calciformes dans le niveau 1 des fosses nasales) n'a pas été jugé critique parce que l'étude d'inhalation de 2 ans chez les rats n'a mis en évidence aucun effet à cette même concentration; toutefois, à la concentration supérieure suivante (600 mg/m3), des effets dans les fosses nasales ont été observés (même si l'Agence de protection de l'environnement du Danemark n'avait pas déterminé que les fosses nasales étaient des organes cibles).
Selon une comparaison entre la concentration à effet critique pour les effets des doses répétées par inhalation (450 mg/m3) et la limite supérieure estimée de l'exposition par inhalation (valeurs du 90e percentile de l'étude sur l'air intérieur) pour le décaméthylcyclopentasiloxane (393 µg/m3), on obtient une marge d'exposition d'environ 1 150. On estimait que l'utilisation du 90e percentile plutôt que la concentration maximale obtenue dans l'enquête sur l'air intérieur (1 560 µg/m3) pour le calcul de la marge d'exposition représentait une amélioration approprié de la caractérisation des risques, étant donné qu'on obtient ainsi des estimations de l'exposition qui se situent à la limite supérieure. Ainsi, la marge d'exposition pour les effets des doses répétées par inhalation et pour l'exposition de la population générale à des concentrations atmosphériques ambiantes est adéquate pour tenir compte des incertitudes dans la base de données sur l'exposition et les effets. Cette marge d'exposition protège aussi le public d'effets cancérogènes possibles étant donné que les tumeurs endométriales ont été observées au cours d'une étude de toxicité chronique et de cancérogénicité à une dose beaucoup plus élevée (2 400 mg/m3).
L'Agence de protection de l'environnement du Danemark ne faisait pas de distinction entre les voies d'exposition. Ainsi, on considère qu'il est prudent d'établir une concentration à effet critique pour l'exposition par voie orale étant donné que seule une quantité limitée de données sur la toxicité par voie orale était disponible. La concentration à effet critique pour la toxicité des doses répétées est de 100 mg/kg p. c./j. par voie orale. Cette valeur est fondée sur une augmentation du poids du foie au cours d'une étude de 90 jours chez les rats, ainsi que sur l'extrapolation pour le D5 des effets et des concentrations critiques selon les données sur l'absorption orale de composés semblables, le D4 et le D6 (voir « Évaluation des effets sur la santé »).
À cause d'effets semblables observés dans le foie pour l'exposition par voie orale et par inhalation, on estime qu'il convient de comparer les effets critiques par voie orale aux valeurs estimées de l'absorption due à l'exposition qui regroupent les trois principales voies d'exposition (voie orale, inhalation et voie cutanée). La comparaison entre la concentration à effet critique pour les doses répétées par voie orale (100 mg/kg p. c./j.) et la limite supérieure estimée pour l'absorption quotidienne de D5 par la population canadienne donne une marge d'exposition d'environ 17 200. Cette valeur est fondée sur l'ajustement de la contribution de l'inhalation à l'absorption quotidienne par une valeur d'absorption par inhalation de 2 %, ce qui donne une valeur d'exposition systémique de 5,8 µg/kg p. c./j. Cette marge d'exposition est considérée adéquate pour prendre en compte les incertitudes dans la base de données sur l'exposition et les effets.
La dose systémique de 0,16 mg/kg p. c./j. pour l'utilisation des produits d'hygiène comporte des facteurs d'absorption pour l'absorption par inhalation et par voies cutanée et orale (tableau 1, annexe 2). Pour calculer la dose orale équivalente, cette dose systémique de 0,16 mg/kg p. c./j. a été corrigée à l'aide de la réciproque du facteur oral et une dose systémique équivalente de 0,21 mg/kg p. c./j. a été obtenue. Si on utilise cette limite supérieure estimée calculée de 0,21 mg/kg p. c./j., la comparaison avec la concentration à effet critique pour les effets des doses répétées par voie orale (100 mg/kg p. c./j.) donne une marge d'exposition d'environ 480 pour l'utilisation des produits d'hygiène. Toutefois, on considère que les estimations de l'exposition présentées ci-dessus surestiment l'exposition réelle, d'après une étude indépendante de l'évaluation probabiliste présentée et des renseignements selon lesquels le pourcentage des produits d'hygiène commercialisés au Canada contenant du D5 pourrait être plus faible que supposé pour estimer les valeurs d'exposition. D'après les valeurs dérivées de l'étude indépendante de l'évaluation probabiliste de l'exposition, il semble que la marge d'exposition pour l'utilisation des produits d'hygiène serait au moins 10 fois plus élevée chez les adultes et au moins 5 fois plus élevée chez les enfants que la marge indiquée ci-dessus (c'est-à-dire > 2 000). D'après les facteurs présentés ci-dessus, notamment le facteur lié à l'étendue de sa base de données, on estime que le D5 ne répond pas aux critères de l'alinéa 64c) de la LCPE (1999).
Incertitudes dans l'évaluation des risques pour la santé humaine
L’analyse complète du mécanisme d'action du décaméthylcyclopentasiloxane et les différences possibles entre la sensibilité des humains et celle des animaux de laboratoire aux effets de cette substance n'entrent pas dans le cadre de cette évaluation préalable. Le mécanisme de la cancérogénicité après une exposition par inhalation est incertain. Le mécanisme d'action qui cause des effets sur le foie après une exposition par inhalation ou par voie orale est lui aussi incertain.
Les effets nocifs possibles du D5 absorbé par voie orale ont été déterminés par l'utilisation du D4 et du D6 en tant que composés analogues. Les limites de la méthode de l'extrapolation du D4 et du D6 pour estimer les effets du D5 sont également incertaines.
Malgré la publication de données sur l'absorption cutanée obtenues par modélisation pharmacocinétique des effets physiologiques (Reddy et al., 2007), seules des données expérimentales sur l'absorption ont été utilisées pour la présente évaluation.
L'estimation de l'exposition et de la dose systémique est incertaine en raison de l'utilisation de la modélisation et du manque de données canadiennes. L'utilisation de modèles et le choix des variables liées à l'utilisation de produits de consommation, notamment la quantité et la fréquence de leur utilisation, la fraction absorbée et les paramètres environnementaux sont également incertains.
La présente évaluation n'examine pas les effets des expositions cumulatives aux cyclosiloxanes dans les polydiméthylsiloxanes (PDMS), mais d'autres évaluations le font pour le D4 et le D6.
D'après les informations contenues dans la présente évaluation préalable sur le potentiel d’effets nocifs du D5 sur l'environnement, on conclut que le décaméthylcyclopentasiloxane pénètre dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif, sur l'environnement ou sur la diversité biologique.
Selon les informations disponibles sur son potentiel d'effets nocifs sur la santé humaine, on conclut que le décaméthylcyclopentasiloxane ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut donc que le décaméthylcyclopentasiloxane correspond à la définition de « substance toxique » au sens de l'alinéa 64a) de la LCPE (1999). De même, on conclut que le D5 répond aux critères de la persistance énoncés dans le Règlement sur la persistance et la bioaccumulation, mais non au critère de la bioaccumulation en raison des données contradictoires présentées dans ce rapport d’évaluation préalable.
La conclusion de cette évaluation préalable est basée sur les informations disponibles à l'heure actuelle et tient compte du fait que des incertitudes sont liées à cette évaluation. Des recherches sur les cVMS sont actuellement menées pour surmonter ces incertitudes, mais certaines de ces recherches ne sont pas encore terminées. Dans le cadre du Défi, toute nouvelle information fournie après l'évaluation préalable finale peut être prise en compte lors de l’étape de la gestion des risques.
La surveillance a également été établie comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et la possibilité que le D5 fasse l’objet d’une surveillance environnementale dans le cadre de ce plan est actuellement envisagée. On considère que les données de concentration in situ contribueront à faire mieux comprendre la distribution du D5 dans l'environnement et son potentiel de bioaccumulation dans les réseaux trophiques appropriés.
Allen, R.B., Kochs, P., Chandra, G. 1997. Industrial organic materials, their environmental entry and predicted fate. In : Organosilicon Materials, Hutzinger, O., éd., Handbook of Environmental Chemistry. Berlin : Springer-Verlag. P. 1-25.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : Liste des produits de formulation de l'ARLA [Internet]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté en septembre 2008].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci. 22(3):337-345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., MacKay, D., Parkerton, T., Bonnell, M. 2008b. A database of fish biotransformation rate constants. Environ. Sci. Technol. (sous presse).
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organics compounds. J. Phys. Chem. Ref. Data. Monograph No. 1.
Atkinson, R. 1991. Kinetics of the gas-phase reactions of a series of organosilicon compounds with OH and NO3 radicals and O3 at 297 ± 2 K. Environ. Sci. Technol. 25(5):863-866.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing Long-Range Transport Potential of Persistent Organic Pollutants. Environ. Sci. Technol. 34(4):699-703.
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
Bidleman, T.F. 2008. Review of the Dow-Corning Health & Environmental Sciences Technical Reports: "Hydrolysis of Octamethylcyclopentasiloxane (D4)" and "Hydrolysis of Decamethylcyclopentasiloxane (D5)". Centre des recherches atmosphériques (Egbert, Ont.). Direction générale des sciences et de la technologie, Environment Canada.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Exposure Assessment Tools and Models.
Boehmer, T., Gerhards, R. 2003. Decamethylcyclopentasiloxane (D5) a compilation of environmental data. Centre européen des silicones (CES).
Bruggeman, W.A., Weber-Fung, D., Opperhuizen, A., Van Der Steen, J., Wijbenga, A., Hutzinger, O. 1984. Absorption and retention of polydimethylsiloxanes (silicones) in fish: preliminary experiments. Toxicol. Environ. Chem. 7:287-296.
Burns-Naas, L.A., Mast, R.W., Klykken, P.C., McCay, J.A., White, K.L. Jr., Mann, P.C., Naas, D.J. 1998a. Toxicology and humoral immunity assessment of decamethylcyclopentasiloxane (D5) following a 1-month whole body inhalation exposure in Fischer 344 rats. Toxicol. Sci. 43(1):28-38.
Burns-Naas, L.A., Mast, R.W., Meeks, R.G., Mann P.C., Thevenaz, P. 1998b. Inhalation toxicology of decamethylcyclopentasiloxane (D5) following a 3-month nose-only exposure in Fischer 344 rats. Toxicol. Sci. 43(2):230-40.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada, Partie II, vol. 134, n° 7.
Canada, Ministère de l'Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49.
Canada, Ministère de l'Environnement, ministère de la Santé. 2007. Loi canadienne sur la protection de l'environnement, 1999 : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 141, n° 19.
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatorov University, Laboratory of Mathematical Chemistry. [consulté le 4 février 2008]. OASIS Software.
David, M., Fendinger, N., Hand, V. 2000. Determination of Henry's Law Constants for organosilicones in actual and simulated wastewater. Environ Sci Technol 34(21) :4554-4559.
Domoradzki, J. 2008a. Refinement in the determination of the BMF value for D4 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Domoradzki, J. 2008b. Refinement in the determination of the BMF value for D5 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Dow Corning. 1990a. A 14-day subchronic oral gavage study with D5 in rats. Report No. 1990-I0000-35074. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2008].
Dow Corning. 1990b. A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats. Report No. 1990-I0000-35105. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1990c. A 28-day dermal toxicity study of decamethylcyclopentasiloxane (D5) in rats. Report No. 1990-I0000-35172-11, Dow Corning Corporation, 12 mars 1990. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1990d. A 90-day inhalation study of decamethylcyclopentasiloxane (D5) in rats. Report No. 1990-I0000-35190, Dow Corning Corporation, 19 mars 1990. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1994. 4-Hour acute inhalation toxicity study with decamethylcyclopentasiloxane in rats. Report No. 1994-I0000-39167. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning Corporation. 1998. An oral gavage study to compare the absorption potential of 14C-D4 in Fischer rats when delivered in various carriers. Report No. 1998-10000-44815. [cité dans SCCP, 2005, réf. 35].
Dow Corning. 2004a. Analysis of the genotoxic potential of decamethylcyclopentasiloxane (D5) in fischer-344 rats following whole body vapor inhalation for 7 days. Report No. 2003-I0000-53252. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 2004b. In vitro chromosome aberration test in Chinese hamster V79 cells with decamethylcyclopentasiloxane (D5). Report No. 2003-I0000-52921. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), n° CAS 541-02-6. 13 février 2007].
Dow Corning. 2004c. Salmonella Typhimurium and Escherichia Coli reverse mutation assay with decamethylcyclopentasiloxane (D5). Report No. 2003-I0000-52921. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning Corporation. 2005. Decamethylcyclopentasiloxane (D5): A 24-month combined chronic toxicity and carcinogenicity whole body vapor inhalation study in Fischer 344 rats. Study No. 9346, Report No. 2003-I0000-53252.
Drottar, K. 2006. 14C-Octamethylcyclotetrasiloxane (14C-D4): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K. 2007. 14C-Decamethylcyclopentasiloxane (14C-D5): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K.R. 2005. 14C- Decamethylcyclohexasiloxane (14C-D5): Bioconcentration in the fathead minnow (Pimephales promelas) under flow-through test conditions. Dow Corning Corporation. Health and Safety Council. Study No. 9882-102.
Durham, J., 2006. Hydrolysis of octamethylcyclotetrasiloxane (D5). Silicones Environment, Health and Safety Council. Study No. 10040-102.
Durham, J., Kozerski, G. 2005. Hydrolysis of octamethylcyclotetrasiloxane (D4). Silicones Environment, Health and Safety Council. Study No. 10000-102.
[ECB] Bureau européen des substances chimiques. 2007.
[ESIS] European Chemical Substances Information System, Version 4.60. [consulté en décembre 2007].
[ECOSAR] Ecological Structural Activity Relationships [Internet]. [2004] Version 0.99g. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances (LIS) 1984-1986, recueillies en vertu du par. 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : Guide du déclarant, 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2007. Données sur les substances du lot 2 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2008a. Assumptions, limitations and uncertainties of the Mass Flow Tool for decamethylcyclopentasiloxane, CAS RN 541-02-6. Ébauche de document interne. Gatineau (Qc) : Environnement Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008b. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series, technical guidance module: Overview of Aquatic Risk Distribution Methodology. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008c. Aquatic risk distribution summary for decamethylcyclopentasiloxane, CAS RN 541-02-6. 2008-09-08. Document non publié. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02 Peterborough (Ont.) : Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - EQC Model.
Fackler, P.H., Dionne, E., Hartley, D.A., Hamelink, J.L. 1995. Bioconcentration by fish of a highly volatile silicone compound in a totally enclosed aquatic exposure system. Environ. Toxicol. Chem. 14(10):1649-1656.
Falany, C.N., Li, G. 2005. Effects of age and pregnancy on cytochrome P450 induction by octamethyltetracyclosiloxane in female Sprague-Dawley rats. J. Biochem. Mol. Toxicol.19(2):129-138.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J. et al. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39(7):1932-1942.
Flaningam, O.L. 1986. Vapor pressure of poly (dimethylsiloxane) oligomers. J Chem Eng Data 31(3):266-272.
[GEMStat] Global Water Quality Data and Statistics [base de données sur Internet]. 2008. Burlington (Ont.) : Organisation des Nations Unies, Programme de l'eau du Système mondial de surveillance continue de l'environnement (GEMS). [consulté en septembre 2008].
Gobas, F.A.P.C., Kelly, B.C., Arnot, J.A. 2003. Quantitative Structure Activity Relationship for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb Sci 22(3): 329-335.
Green Earth, 2008.
Han, X., Nabb, D.L., Mingoia, R.T., Yang, C.-H. 2007. Determination of xenobiotic intrinsic clearance in freshly isolated hepatocytes from rainbow trout (Oncorhynchus mykiss) and rat and its application in bioaccumulation assessment. Environ. Sci. Technol. 41:3269 -3276.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Herner, A.V., Flassbeck, D., Gruemping, R. 2002. Organosilicon compounds in the environment. In : Craig, P.J., éd., Organometallic Compounds in the Environment. 2nd ed. New York. Wiley. p. 324.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. 3(4), article 29. [consulté en octobre 2008].
Huntingdon Research Center. 1979. Twenty-one day repeated dermal in the rabbit of material SF-1202. Project No. 792048. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Hurd, C.B. 1946. Studies on siloxanes: 1. The specific volume and viscosity in relation to temperature and constitution. .J Am. Chem. Soc. 68(3):364.
Isquith, A., Matheson, D., Slesinski, R. 1988. Genotoxicity studies on selected organosilicon compounds: in vitro assays. Food Chem. Toxicol. 26(3):255-61.
Jager, R., Hartmann, E. 1991. Subchronische toxikologische untersuchungen an ratten (magensondenapplikation uber13 Wochen oral gavage study with D5 in rats. Report No. 20204. [cité dans SEHSC (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Jovanovic, M.L., McMahaon, J.M., McNett, D.A., Tobin, J.M., Plotzke, K.P. 2008. In vitro and in vivopercutaneous absorption of 14C-octmethylcyclotetrasiloxane (14C-D4) and 14C-decamethylcyclopentasiloxane (14C-D5). Regul. Toxicol. Pharmacol. 50(2): 239-248.
Kaj, L., Andersson, J., Palm Cousins, A., Remberger, M., Ekheden, Y., Dusan, B., Brorström-Lundén, E. 2005. Results from the Swedish National Screening Programme 2004: Subreport 4: Siloxanes. IVL.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of Long-Range Transport Potential and overall persistence, Environ. Sci. Technol. 40(1):53-60.
Kochetkov, A., Smith, J.S., Ravikrishna, R., Valsaraj, K.T., Thibodeaux, L.J. 2001. Air-water partition constants for volatile methyl siloxanes. Environ. Toxicol. Chem. 20(10):2184-2188.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Kozerski, G. 2007. Determination of the 1-Octanol/Water Partition Coefficient of Decamethylcyclopentasiloxane (D5) by the Slow-Stirring Method Using Gas Chromatography and Mass Spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC).
Kozerski, G. 2008. SEHSC response to Dr. Bidleman's review on hydrolysis studies of D4 and D5. Dow Corning Corporation. Juillet 2008.
Kramp, F., Volz-Thomas, A. 1997. On the budget of OH radicals and ozone in an urban plume from the decay of C5-C8 hydrocarbons and NOx. J Atmos Chem. 28(1-3):263-282.
Krötlinger, F. 1988. Subakute toxikolische Untersuchungen an Kanninchen. Bayer AG. Report No. R 4374, 13 avril 1988. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2007. D5: a prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Centre européen des silicones (CES).
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2008. D5: a prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International, LTD. Project No. 570A-108. Silicones Environmental, Health, and Safety Council (SEHSC).
Lassen, C., Hansen, C.L., Mikkelson, S.J., Maag, J. 2005. Siloxanes – consumption, toxicity and alternatives. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Environmental Project No. 1031.
Litton Bionetics, Inc. 1978. Project No. 20893; Mutagenicity evaluation of decamethylcyclopentasiloxane (Me2SiO)5, Rapport final, avril 1978. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007.]
Löser, E. 1984. Untersuchungen zur akuten oralen toxizitat an mannlichen und weblichen Wistar ratten. [cité dans SEHSC (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Lucas, S.V. 1984. GC/MS analysis of organics in drinking water concentrates and advanced waste treatment concentrates. Vol. 1. Analysis results for 17 drinking water and 16 advanced waste treatment and 3 process blank concentrate. EPA-600/1-84-020A. (NTIS P85-128221). Columbus (OH) : Columbus Labs, Health Effects Research Laboratory. P. 45, 46, 147 et 150.
Maxim, L.D. 1998. D4, D5, and D6 Exposure in the manufacture and use of personal care products: an interim assessment. Dow Corning Corporation.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Navea, J.G., Stanier, C.O., Young, M.A., Grassian, V.H. 2007. A laboratory and modeling study at the University of Iowa designed to better understand the atmospheric fate of D4 and D5. Rapport technique annuel (août 2006-juillet 2007). Iowa City (IA) : University of Iowa, Department of Chemistry, and Chemical and Biochemical Engineering.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consulté le 11 octobre 2006]. National Chemical Inventories (NCI) on CD.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26(6):1304-1319.
[NILU] Norsk institutt for luftforskning. 2007. Siloxanes in the Environment of the Inner Oslofjord. Report No.986/2007. Kjeller (Norvège) : Norwegian Institute for Air Research.
[NMI] Non-Medicinal Ingredients [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[NOAA] National Oceanic and Atmospheric Administration. 2008. NOAA CoastWatch Great Lakes Program. NOAA Great Lakes Environmental Research Laboratory. [consulté en septembre 2008].
Norden. 2005. Siloxanes in the Nordic Environment. TemaNord 2005:593. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
[NYIEQ] New York Indoor Environmental Quality Center. 2005. Indoor Environmental Quality: Assessing and Mitigating the Impact of Exposure to Multiple Indoor Contaminants. Project No. R828605-01.
[OCDE] Organisation de coopération et de développement économiques 2004. Emission Scenario Document on Plastics Additives [Internet]. Paris (France) : Direction de l’environnement de l’OCDE, Division de l’hygiène et de la sécurité de l’environnement. [consulté en septembre 2004].
[OCDE] Organisation de coopération et de développement économiques 2006. Draft Emission Scenario Document on Transport and Storage of Chemicals. Préparé par l’Environment Agency (Royaume-Uni). Disponible sur demande auprès de : Environnement Canada, Division des substances existantes, Ottawa, K1A 0H3.
[OCDE] Organisation de coopération et de développement économiques 2007. Manual for investigation of HPV chemicals. OECD Secretariat, July 2007. [consulté en janvier 2008].
Pauluhn, J. 1984. Untersuchungen zur akuten inhalationstoxizität. Bayer AG. Report No. 13142, 18 décembre 1984. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. [consulté en mars 2006].
Powell, D., Kozerski, G. 2007. Cyclic methylsiloxane (cVMS) materials in surface sediments and cores for Lake Ontario. Centre européen des silicones (CES). Rapport préliminaire.
Powell, D.E. 2008. Interim update on cyclic methylsiloxane (cVMS) materials in surface sediment, cores, and zooplankton for Lake Opeongo, Ontario, Canada. Centre européen des silicones (CES), 14 juillet 2008.
Quinn, A.L., Regan, J.M., Tobin, J.M., Marinik, B.J., McMahon, J.M., McNett, D.A., Sushynski, C.M., Crofoot, S.D., Jean, P.A., Plotzke, K.P. 2007. In vitro and in vivo evaluation of the estrogenic, androgenic, and progestagenic potential of two cyclic siloxanes. Toxicol Sci 96(1):145-53.
RCC Group. 1995. One-month repeated dose inhalation toxicity with D5 in rats. Report No. 1995-I0000-40185, 13 mars 1995. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Reddy, M.B., Looney, R.J., Utell, M.J., Plotzke, K.P., Andersen, M.E. 2007. Modeling of human dermal absorption of octamethylcyclotetrasiloxane (D4) and decamethylcyclopentasiloxane (D5). Toxicol. Sci. 99(2):422-431.
Ren, X., Brune, W.H., Mao, J., Mitchell, M.J., Lesher, R.L., Simpas, J.B., Metcalf, A.R., Schwab, J.J., Cai, C., Li, Y., et al. 2006. Behaviour of OH and HO2 in the winter atmosphere in New York City. Atmos. Environ. 40:S252-S263.
Ren, X., Harder, H., Martinez, M., Lesher, R.L., Oliger, A., Shirley, T., Adams, J., Simpas, J.B., Brune, W.H. 2003. HOx concentrations and OH reactivity observations in New York City during PMTACS-NY2001. Atmos. Environ. 37(26):3627-3637.
Rivett, A.C., Martin, D., Gray, D.J., Price, C.S., Nickless, G., Simmonds, P.G., O'Doherty, S.J., Greally, B.R., Knights, A., Shallcross, D.E. 2003. The role of volatile organic compounds in the polluted urban atmosphere of Bristol, UK. Atmos. Chem. Phys. Discuss. 3:769-796.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo 4.1) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Document non publié. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu. Disponible sur demande.
[SBSC] Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : Santé et Bien-être social Canada. [cité dans Santé Canada, 1998].
[SCCP] Scientific Committee on Consumer Products. 2005. Opinion on octamethylcyclotetrasiloxane (D4) cyclomethicone (INCI name). (Adopted by the SCCP during the 6th plenary meeting of 13th December 2005). European Commission, Health & Consumer Protection Directorate–General (Directorate C – Public Health and Risk Assessment). SCCP/0893/05.
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool [Internet]. Version 2.0. Distribué lors de l’atelier OCDE-PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada), du 31 mai au 3 juin 2006. [consulté en février 2008].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[SEHSC] Silicones Environmental, Health and Safety Council. 2005a. IUCLID Dataset for CAS No. 541-05-9. Submitted by Silicones Environmental, Health and Safety Council, Herndon, VA. Septembre 2005.
[SEHSC] Silicones Environmental, Health and Safety Council. 2005b. Degussa Corporation/Goldschmidt GmbH: TSCA 8(e): Notification of Substantial Risk; Detection of decamethylcyclopentasiloxane and octamethylcyclotetrasiloxane in the tissue of fish from the Rhine River in Germany, October 10, 2005. Données présentées à Environnement Canada par le SEHSC, Herndon (VA), 20 décembre 2005. Environnement Canada, présentation no s70-2006-007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007a. Présentations du SEHSC à Environnement Canada et Santé Canada le 2 octobre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007b. Communication du SEHSC à Environnement Canada et Santé Cand sur le no CAS 69430-24-6, 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008a. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), CAS No. 541-02-6. 13 novembre 2007 (mis à jour le 13 février 2008).
[SEHSC] Silicones Environmental, Health and Safety Council. 2008b. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D5: Special pattern of cVMS environmental release and its effects on their half-lives in the atmosphere. 16 juillet 2008.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008c. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D5. 16 juillet 2008.
Sible, V. 2006. Determination of n-octanol/water partition coefficient of 14C-decamethylcyclopentasiloxane (14C-D5) by Liquid Scintillation Counting. SEHSC Study Report No. 9803-102. 2 août 2006.
Siddiqui, W.H., Stump, D.G., Reynolds, V.L., Plotzke, K.P., Holson, J.F., Meeks, R.G. 2007. A two-generation reproductive toxicity study of decamethylcyclopentasiloxane (D5) in rats exposed by whole-body vapor inhalation. Reprod. Toxicol.23(2):216-225.
Sousa, J.V., McNamara, P.C., Putt, A.E., Machado, M.W., Surprenant, D.C., Hamelink, J.L., Kent, D.J., Silberhorn, E.M., Hobson, J.F. 1995. Effects of octamethylcyclotetrasiloxane (OMCTS) on freshwater and marine organisms. Environ. Toxicol. Chem. 14(10):1639-1647.
[SPIN] Substances in Preparations in Nordic Countries [base de données sur Internet]. 2007. Copenhague (Danemark) : Conseil des ministres des pays nordiques. [consulté en février 2007].
Springborn Laboratories. 2000. Decamethylcyclopentasiloxane – 14-day prolonged acute toxicity to rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Report No. 12023.6125. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Laboratories. 2001. Decamethylcyclopentasiloxane (D5) – toxicity to the freshwater green alga, Pseudokirchneriella subcapitata. Report No. 12023.6126. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2002. Decamethylcyclopentasiloxane – acute toxicity to daphnids (Daphnia magna) under static conditions. Report No. 12023.6129. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2003a. Decamethylcyclopentasiloxane (D5) – full life-cycle toxicity with water fleas (Daphnia magna) under static-renewal conditions. Report No. 12023.6141. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2003b. Decamethylcyclopentasiloxane (D5) – the full life-cycle toxicity to midge (Chironomous riparius) under static conditions. Report No. 12023.6140. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2004. Cyclopentasiloxane, decamethyl-(D5) and cyclotrisiloxane, hexamethyl-(D3) – determination of the biodegradability of a test substance. Study No. 12023.6142. Silicones Environmental, Health and Safety Council (SEHSC).
Springer, T. 2007. Decamethylcyclopentasiloxane (D5): a 96-hour study of the elimination and metabolism of orally gavaged 14C-D5 in rainbow trout (Oncorhynchus mykiss). HES Study Number 10218-101. Centre européen des silicones (CES).
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (Ont.) : Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - TaPL3.
TNO. 1984. Sub-acute inhalation toxicity study of silicone oil KF995 in rats. Report No. V84.389/231262. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of octamethylcyclotetrasiloxane (D4), no CAS 556-67-2. 13 février 2007].
Tobin, J.M., McNett, D.A., Durham, J.A., Plotzke, K.P. 2008. Disposition of decamethylcyclopentasiloxane in Fischer 344 rats following single or repeated inhalation exposure to 14C-decamethylcyclopentasiloxane (14C-D5). Inhal Toxicol20:513-531.
[U.S. EPA] United States Environmental Protection Agency. 1992. Thirtieth report of the Interagency Agency Testing committee to the Administrator, receipt of report and request for comments regarding Priority Testing List of chemicals. 9 juillet 1992. Federal Register. 57(132):30603-30618.
[U.S. EPA] United States Environmental Protection Agency. 1994. Air quality: revision to definition of volatile organic compounds–exclusion of volatile methyl siloxanes and parachlorobenzotrifluoride. [consulté en février 2008].
[U.S. EPA] United States Environmental Protection Agency. 2002. Hepatocellular hypertrophy: HED Guidance Document#G2002.01. Document non publié. Washington (DC) : U.S. EPA, Health Effects Division, Toxicology Science Advisory Council. 21 octobre 2002.
[U.S. EPA] United States Environmental Protection Agency. 2005. Siloxane D5 in Drycleaning Applications. Fact Sheet.
[U.S. EPA] United States Environmental Protection Agency. 2007.High Production Volume (HPV) Challenge Program: Sponsored Chemicals. Septembre 2007. [consulté en février 2008].
Varaprath, S., Frye, C.L., Hamelink, J. 1996. Aqueous solubility of permethylsiloxanes (silicones), Short Communication. Environ. Toxicol. Chem. 15(8):1263-1265.
Varaprath, S, McMahon, J.M., Plotzke, K.P. 2003. Metabolites of hexamethyldisiloxane and decamethylcyclopentasiloxane in Fischer 344 rat urine: a comparison of a linear and a cyclic siloxane. Drug. Metab. Dispos. 31(2):206-14.
Wania, F. 2003. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37(7):1344-1351.
Wania, F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40(2):569-577.
Will, R., Löchner, U., Masahiro, Y. 2007. CEH Marketing Research Report Siloxanes. Menlo Park (CA) : SRI Consulting.
WIL Research Laboratories Inc. 1996. An inhalation range finding reproductive toxicity study of D5 in the rat. Report No. 1996-I0000-41336, 27 août 1996. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of octamethylcyclotetrasiloxane (D4), CAS No. 556-67-2. 13 février 2007].
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Xu, S., Lehmann, R.G., Miller, J.R., Chandra, G. 1998. Degradation of polydimethylsiloxanes (silicones) as influenced by clay minerals. Environ. Sci. Technol. 32(9):1199-1206.
Xu, S. 1999. Fate of cyclic methylsiloxanes in soils. 1. The degradation pathway. Environ. Sci. Technol.33(4):603-608.
Xu, S., Chandra, G. 1999. Fate of cyclic methylsiloxanes in soils. 2. Rates of degradation and volatilization. Environ. Sci. Technol. 33(22):4034-4039.
Xu, S. 2006. 1-Octanol/air partitioning coefficients of octamethylcyclotetrasiloxane (D4), decamethylcyclopentasiloxane (D5) and dodecamethylcyclohexasiloxane (D6) at different temperatures. Centre européen des silicones (CES). Rapport CES, 27 décembre 2006.
Xu, S., Kropscott, G. 2007. Simultaneous determination of partition coefficients for octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane. Rapport préliminaire. Dow Corning, rapport technique non réglementé. DCC Study No. 10336-101.
Xu, S., Miller, J.A. 2008. Aerobic transformation of octamethylcyclotetrasiloxane (D4) in water/sediment system. Centre européen des silicones (CES). Rapport intérimaire.
Zhang, J., Falany, J.L., Xie, X., Falany, C.N. 2000. Induction of rat hepatic drug metabolizing enzymes by dimethylcyclosiloxanes. Chem. Biol. Interact. 124(2):133-47.
Annexes de l'évaluation préalable
- Annexe 1 : Limites supérieures estimées de l'absorption quotidienne de D5 pour la population canadienne (µg/kg p. c./j. pour divers groupes d'âge)
- Annexe 2 : Modélisation de l’exposition des consommateurs
- Annexe 3 : Récapitulatif des informations concernant les effets du décaméthylcyclopentasiloxane (D5) sur la santé
- Annexe 4 : Étude de l'évaluation probabiliste de l'exposition au D5
- Annexe 5 : Paramètres d'entrée de la modélisation dans divers milieux applicable au D5 aux fins de l'évaluation écologique préalable
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
le décaméthylcyclopentasiloxane
(D5)
Numéro de registre du Chemical Abstracts Service
541-02-6
Environnement Canada
Santé Canada
Novembre 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexes
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du décaméthylcyclopentasiloxane (D5), dont le numéro de registre du Chemical Abstracts Service est 541-02-6. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car il a été prouvé qu’elle répondait initialement aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque (PBiT) pour les organismes non humains et on sait qu’elle est commercialisée au Canada.
Bien que le processus de catégorisation n’ait pas déterminé que l’évaluation des risques du D5 pour la santé humaine devait être prioritaire, une évaluation de cette substance en fonction de la santé humaine a été effectuée en raison de la similarité de sa structure et de son profil d’utilisation par rapport à ceux du D4, qui est également connu sous le nom d’octaméthylcyclotétrasiloxane, une substance dont l’évaluation fait l’objet d’une priorité élevée à cause des risques qu’elle présente tant pour la santé humaine que pour l’environnement conformément à la LCPE (1999).
Le D5 est un produit chimique industriel qui n’était pas fabriqué au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé surtout à l’état pur, dans des mélanges avec d’autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. À partir des réponses reçues à la suite d’un avis publié en vertu de l’article 71 de la LCPE (1999), on a établi qu’entre 1 000 000 et 10 000 000 kg de D5 avaient été importés au Canada en 2006.
Le D5 peut être rejeté dans l’environnement lors de processus industriels utilisés dans le cadre d’opérations de mélange, de formulation et de conditionnement, et lors d’opérations de prévention de la mousse et de dégraissage. Il peut également être rejeté à la suite de l’utilisation et de l’élimination de produits d’hygiène. L’air, les eaux usées et les terres agricoles constituent les milieux naturels cibles du D5 à cause de ses propriétés physiques et chimiques et de ses profils d’utilisation.
Le D5 est persistant dans l’air avec des demi-vies atmosphériques calculées de plus de 3 jours. Le D5 pourrait être transporté sur de grandes distances dans l'atmosphère. Toutefois, il risque peu de se déposer dans l'eau ou dans le sol en régions éloignées. La demi-vie d’hydrolyse du D5 dans les eaux canadiennes varie entre 1 et 733 jours, ce qui indique que la substance est persistante dans certaines conditions dans les eaux canadiennes, notamment dans les eaux froides et neutres (5 à 10 ºC). D’après la substance analogue de composition similaire D4 qui indique une persistance probable en milieu sédimentaire, il apparaît que le D5 est également persistant dans les sédiments, avec une demi-vie allant de 49 à 588 jours estimée dans des conditions sédimentaires canadiennes réelles (température comprise entre 5 et 25 °C). Le D5 ne semble pas être persistant dans le sol selon la dégradation catalysée par l’argile, le diméthylsilanediol correspondant au produit stable de l’hydrolyse. Le D5 satisfait donc au critère de persistance tel que défini dans le Règlement sur la persistance et la bioaccumulation.
La valeur empirique du facteur de bioconcentration et la valeur modélisée du facteur de bioaccumulation se situent tous les deux au dessus de 5 000, indiquant ainsi que le D5 peut présenter un fort potentiel d’accumulation dans les organismes aquatiques. Toutefois, d’après les données d’une étude de la bioamplification dans les poissons et une étude de l’accumulation dans le biote et les sédiments chez les invertébrés, il est suggéré que le potentiel de bioaccumulation du D5 peut être plus faible et ce, probablement en raison d’une biodisponibilité réduite. Ainsi, bien que le D5 a un potentiel de bioaccumulation dans le biote, il n’est pas possible de conclure à ce moment que le D5 rencontre le critère de bioaccumulation tel que définis dans le Règlement sur la persistance et la bioaccumulation, compte tenu des preuves contradictoires issues des diverses analyses en laboratoire et des modèles prédictifs.
Des effets nocifs dus à l’exposition au D5 chez les organismes se trouvant dans les sédiments ont été observés à une concentration de 160 mg/kg. Les données expérimentales en matière de toxicité n’ont montré aucun effet nocif sur les organismes aquatiques pélagiques à des concentrations allant jusqu’à 0,015 mg/L ce qui correspond à peu près à sa limite de solubilité dans l’eau. Toutefois, il est possible que la toxicité puisse se manifester à une limite de solubilité si l’exposition est suffisante et si des espèces sensibles sont présentes. Les quotients de risque déterminés d’après différents scénarios d’exposition impliquant des rejets de D5 issus des utilisations des consommateurs et industrielles, montrent qu’un total de 65 sites (environ 6,8 %) étudiés au Canada présentent dans l’eau des concentrations environnementales prévues supérieures à 0,015 mg/L (concentration prévue sans effet sur les organismes aquatiques). Étant donné la persistance du D5 dans les eaux froides canadiennes et sa capacité de bioaccumulation dans le biote, une exposition environnementale à long terme au D5 peut engendrer des effets nocifs sur les organismes aquatiques dans certaines régions du Canada.
Principalement sur la base de l’évaluation fondée sur des preuves et réalisée par la l’Agence de protection de l’environnement du Danemark, on a pu déterminer que l’un de ses effets potentiels, en ce qui a trait à la toxicité des doses répétées, était la cancérogénicité, selon une étude de deux ans chez les rats. Dans le cadre de cette étude, des tumeurs utérines ont été observées à des concentrations d’exposition supérieures à celles correspondant à des effets établis pour les poumons et le foie selon plusieurs autres études de toxicité. On a pu observer que les poumons étaient un organe cible pour l’exposition au D5 par inhalation, et que le foie était un organe cible pour l’exposition par voie orale et par inhalation. La concentration à effet critique concernant la toxicité des doses répétées par inhalation a été estimée selon une augmentation significative de l’incidence de la minéralisation vasculaire pulmonaire lors d’une étude sur la reproduction chez les rats. D’après une comparaison entre la concentration à effet critique pour les effets des doses répétées par inhalation et la limite supérieure prudente estimée de l’exposition par inhalation pour le décaméthylcyclopentasiloxane, on obtient une marge d’exposition suffisante. La concentration à effet critique concernant la toxicité des doses répétées a été déterminée selon l’étude de l’augmentation du poids du foie chez les rats pendant 90 jours et selon la détermination des concentrations à effets critiques par voir orale pour des composés similaires, tels que l’octaméthylcyclotétrasiloxane et le dodécaméthylcyclohexasiloxane. Selon une étude indépendante sur l’évaluation précise de l’exposition concernant les produits d’hygiène, une marge d’exposition appropriée a pu être déterminée en comparant la concentration à effet critique des effets des doses répétées par voie orale et une estimation haute de l’absorption quotidienne de D5 par l’utilisation de produits d’hygiène
D’après les informations disponibles sur sa capacité à causer des effets nocifs sur l'environnement, on peut conclure que le D5 pénètre dans l’environnement en une quantité ou une concentration, ou dans des conditions de nature à avoir immédiatement ou à long terme, un effets nocif, sur l’environnement ou sur sa diversité biologique.
Selon les informations disponibles sur son potentiel d’effets nocifs sur la santé humaine, on peut conclure que le D5 ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Cette substance s’inscrira dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l'efficacité des mesures de contrôle possibles définies à l'étape de la gestion des risques.
D'après les renseignements disponibles, le D5 répond à au moins un des critères énoncés à l'article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques, et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu du classement attribué par d'autres organismes nationaux ou internationaux quant à la cancérogénicité, la génotoxicité ou la toxicité sur le plan du développement ou de la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
L'évaluation des risques que comporte le décaméthylcyclopentasiloxane (aussi connu sous le nom de D5) pour l'environnement a été jugée hautement prioritaire, car cette substance est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu'elle est commercialisée au Canada. Le volet du Défi portant sur le D5 a été lancé le 12 mai 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007). En même temps a été publié le profil de cette substance, qui présentait l’information technique et écologique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Grâce à ce Défi, plus de 100 présentations de données relatives à cette substance ont été reçues concernant ses propriétés physiques et chimiques, son potentiel de bioaccumulation, sa persistance, son écotoxicologie et les quantités disponibles dans le commerce entre autres.
Bien que le processus de catégorisation n'ait pas permis de déterminer que l'évaluation des risques du D5 pour la santé humaine devait faire l'objet d'une priorité, une évaluation de cette substance en fonction de la santé humaine a aussi été recommandée en raison de la similarité de sa structure et de son profil d'utilisation par rapport à ceux du D4, connu également sous le nom d'octaméthylcyclotétrasiloxane, une substance dont l'évaluation des risques tant pour la santé humaine que pour l'environnement a été jugée hautement prioritaire conformément à la LCPE (1999). Par conséquent, la présente évaluation porte principalement sur les informations pertinentes pour l'évaluation des risques touchant l'environnement et la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques énoncés à l'article 64 de la Loi :
« 64. [...] est toxique toute substance qui pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique;
- mettre en danger l'environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaines. »
Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données liées à l'évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et de recherches documentaires récentes (jusqu'en août 2008) ayant servi de base aux sections du présent document qui portent sur la santé humaine et l'environnement. Les études importantes ont fait l'objet d'une évaluation critique; les résultats de la modélisation ont pu être utilisés dans la formulation des conclusions. Les renseignements présentés dans des évaluations des dangers réalisées par d'autres instances ont été pris en considération lorsqu'ils étaient disponibles et pertinents. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information les plus importants en rapport avec la conclusion.
L'évaluation des risques pour la santé humaine tient compte des données qui ont trait à l'estimation de l'exposition (non professionnelle) de la population dans son ensemble et des informations relatives aux dangers pour la santé (fondées essentiellement sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l'effet critique retenu ou sur l’écart (ou marge) entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition. Elles tiennent compte de la confiance accordée à l'exhaustivité des bases de données identifiées qui portent sur l'exposition et les effets dans le contexte d'une évaluation préalable. L'évaluation préalable n'est pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'une synthèse des informations les plus importantes permettant d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel des programmes des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'un examen externes par des pairs. Des commentaires sur les parties techniques relatives à la santé humaine ont été fournis par le Toxicology Excellence for Risk Assessment (TERA). Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Les principales données et considérations sur lesquelles repose la présente évaluation sont résumés ci-après.
Aux fins du présent document, le décaméthylcyclopentasiloxane est désigné par D5, un nom abrégé dérivé de la nomenclature des siloxanes élaborée par General Electric (Hurd, 1946).
Le D5 appartient au groupe des composés cycliques volatils de type méthylsiloxane (cVMS) de poids moléculaire relativement faible (inférieur à 600 g/mol) et à pression de vapeur élevée. Ces cVMS sont des liquides à base de silicones volatiles à faible viscosité, constitués d'unités structurelles [-Si(CH3)2O-]x à configuration cyclique. Le D5 comporte cinq de ces unités structurelles [-Si(CH3)2O-] (× = 5), comme le montre la structure chimique illustrée ci-dessous (tableau 1).
| Numéro de registre du Chemical Abstracts Service (no CAS) | 541-02-6 |
|---|---|
| [1] National Chemical Inventories (NCI), 2006 : AICS (inventaire des substances chimiques de l'Australie); ASIA PAC (listes des substances de l'Asie Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); PICCS (inventaire des produits et substances chimiques des Philippines); NZIoC (inventaire des substances chimiques de la Nouvelle Zélande); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États Unis). | |
| Nom dans la Liste intérieure des substances (LIS) | Décaméthylcyclopentasiloxane |
| Noms dans les National Chemical Inventories (NCI)[1] | Cyclopentasiloxane, 2,2,4,4,6,6,8,8,10,10-decaméthyl- (TSCA); Cyclopentasiloxane, decaméthyl- (AICS, PICCS, ASIA-PAC, NZIoC); Décaméthylcyclopentasiloxane (EINECS); Decamethyl cyclopentasiloxane (ECL) |
| Autres noms | Cyclic dimethylsiloxane pentamer; Cyclo-decamethylpentasiloxane; D5; Dimethylsiloxane pentamer; Pentacyclomethicone |
| Principale classe chimique ou utilisation | Composés organosiliciés |
| Principale sous-classe chimique | Méthylsiloxanes cycliques volatils (cVMS) |
| Formule chimique | C10H30O5Si5 |
| Structure chimique |  |
| Simplified Molecular Input Line Entry System (SMILES) | C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 |
| Masse moléculaire | 370,78 g/mol |
Le D5 est également référencé sous un autre numéro de registre du Chemical Abstracts Service. Ce numéro, n° CAS 69430 24 6, désigne un mélange de cyclosiloxanes substitués par des groupes diméthyl, de structure générale [ Si(CH3)2O ]×, à configuration cyclique, où x est habituellement inférieur à 8 et plus souvent compris entre 3 et 7 (SEHSC, 2007b). Ce n° CAS est associé aux noms suivants : cyclopolydiméthylsiloxane, cyclopolydiméthylsiloxane (DX), diméthylcyclosiloxanes, diméthylcyclopolysiloxane, composés polydiméthylsiloxy cycliques, polydiméthylcyclosiloxane, cyclométhicone et mélanges de cyclosiloxanes. Dans ce rapport, on privilégiera le terme cyclométhicone couramment utilisé pour ce mélange en cosmétologie. Pour cette évaluation, les données recueillies pour le D4 ont également été utilisées étant donné la similarité structurelle entre les deux substances, telle qu'elle est illustrée dans le tableau suivant :
| D4 | D5 |
|---|---|
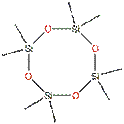 |
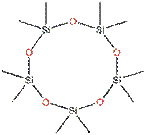 |
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du D5 qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | Valeur[1] | Température (°C) | Références |
|---|---|---|---|---|
| [1] Les valeurs et unités entre parenthèses représentent celles qui ont été initialement déclarées par les auteurs ou estimées au moyen des modèles. [*] Valeurs utilisées pour la modélisation aux fins de cette évaluation préalable. |
||||
| Point de fusion (ºC) |
Expérimental | -38[*] | PhysProp, 2006 | |
| Modélisé | -5,19 | MPBPWIN, 2000 | ||
| Point d'ébullition (ºC) |
Expérimental | 210[*] | PhysProp, 2006 | |
| Modélisé | 196,78 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) |
Expérimental | 954 | SEHSC, 2005a | |
| Pression de vapeur (Pa) |
Expérimental | 26,66 (0,20 mm Hg) |
25 | Flaningam, 1986 |
| 33,2[*] (0,249 mm Hg) |
25 | SEHSC, 2005a | ||
| Modélisé | 29,06 (0,22 mm Hg) |
25 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Expérimental | 3 350 000[*] (33,1 atm·m3/mol) |
Calculée à partir de la valeur de Kae de Xu et Kropscott, 2007 | |
| 13 444 (0,133 atm·m3/mol) |
23 | David et al., 2000 | ||
| 32 317 (0,319 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| 29 831 (0,294 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| Modélisé | 12 159 (0,12 atm·m3/mol) |
25 | HENRYWIN, 2000 | |
| Log Kae (coefficient de partage air-eau) [sans dimension] | Expérimental | 3,13[*] | 24.6 | Xu et Kropscott, 2007 |
| Log Koe (coefficient de partage octanol-eau) [sans dimension] |
Expérimental | 5,2 | Bruggeman et al., 1984 | |
| 8,03[*] | 25.3 | Kozerski, 2007 | ||
| 4,76 | 22,4 | Sible, 2006 | ||
| Modélisé | 5,71 | KOWWIN, 2000 | ||
| Log Kce (coefficient de partage carbone organique-eau) [sans dimension] |
Expérimental | 5,17 | SEHSC, 2005a | |
| Modélisé | 5,16 | PCKOCWIN, 2000 | ||
| Solubilité dans l'eau (mg/L) |
Expérimental | 0,017[*] | 23 | Varaprath et al., 1996 |
| Modélisé | 0,05 | 25 | WSKOWWIN, 2000 | |
| Log Koa (coefficient de partage octanol-air) [sans dimension] |
Expérimental | 5,06[*] | 24 | Xu, 2006 |
Récemment, les valeurs empiriques du log Koe pour D5 ont été reçues et évaluées de manière critique. Il y a peu de temps, on a déterminé une valeur expérimentale de log Koe de 8,03 pour le D5 (pureté de 99,19 %) à 25,3 °C, à l'aide de la méthode de l'agitation lente conformément à la Ligne directrice 123 de l'OCDE (Kozerski, 2007). Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. On a utilisé des récipients de borosilicate de 2 L qu'on a laissé atteindre la température d'équilibre avant d'y verser 1,6 L d'eau pure, dans laquelle on a versé avec soin 0,10 L de 1-octanol pour réduire au minimum la formation de gouttelettes. On a commencé l'essai en versant dans le récipient d'essai environ 5 mL de solution d'enrichissement (119,68 mg D5/g) dans du 1-octanol. La température a été maintenue entre 25,2 et 25,6 ºC pendant l'étude. L'équilibre a été considéré comme atteint 24 heures après le début de l'essai. La moyenne pondérée calculée de Koe était de 8,03. Il y avait un espace vide d'environ 0,3 L (15 % du volume total) dans les récipients d'essai, ce qui indique qu'il peut y avoir eu une certaine volatilisation du D5 dans l'espace vide à partir de la phase aqueuse (forte pression de vapeur, faible solubilité dans l'eau). Toutefois, une vérification du bilan massique du récipient semble indiquer que la quantité totale de D5 évaporée était inférieure à 2 %. Cette étude peut, par conséquent, être considérée acceptable et la valeur de log Koe de 8,03 sera utilisée dans le présent rapport d'évaluation préalable.
On a déterminé une valeur expérimentale de 4,76 pour le log Koe du D5 à l'aide d'une méthode d'agitation lente conforme à la Ligne directrice provisoire 123 de l'OCDE (Sible, 2006). Pour cet essai, on a utilisé du D5 radiomarqué au 14C (pureté radiochimique de 99,8 %) dilué dans du D5 non marqué (99,77 %). Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. La température a été maintenue constante à 22,4 ± 0,5 ºC tout au long de l'étude. L'équilibre a été atteint en 7 jours et on a obtenu un log Koe de 4,76, selon le log Koe moyen mesuré du jour 8 au jour 11. On a analysé du D5 radiomarqué au 14C dans l'eau et l'octanol en utilisant la méthode du comptage par scintillation en milieu liquide (CSML). Les analyses de CSML ne permettent pas de distinguer le composé parent de ses produits d'hydrolyse possibles. Étant donné que le D5 peut subir une hydrolyse lente dans les conditions d'essai (Durham, 2006), sa concentration dans l'eau peut avoir été surestimée, ce qui peut avoir causé une sous-estimation de la valeur du log Koe.
Bruggeman et al. (1984) ont obtenu une valeur de log Koe de 5,2 à l'aide de la méthode du temps de rétention en chromatographie liquide à haute performance (CLHP). Cette mesure a été effectuée sur une colonne de silice liée par de l'octadécylsilyle, avec une phase mobile méthanol-eau (90:10). Des séries homologues de n-alkylbenzènes avec des valeurs connues de log Koe ont été utilisées comme composés de référence pour étalonner la méthode. À ce jour, le protocole expérimental détaillé pour cette étude n'est pas disponible.
De récentes analyses portant sur le coefficient de partage air-eau pour D4 et D5 ont été menées par Xu (Xu et Kropscott, 2007). Durant l'expérience, l'équilibre de partage entre l'air, l'eau et la phase organique (octanol) a été atteint simultanément; la valeur obtenue pour le log Koaétait de 4,94 et de 8,07 pour le log Koe pour D5. Ces deux valeurs sont relativement cohérentes avec les valeurs expérimentales mesurées par Xu (2006, tableau 2) et Kozerski (2007, tableau 2). Cette étude peut donc être considérée acceptable, et la valeur de log Kae de 3,13 pour D5 issue de l'analyse pourra être utilisée dans le présent rapport d’évaluation préalable. Une détermination simultanée de l'équilibre de partage entre l'air, l'eau et la phase organique (octanol) a été effectuée par Xu (Xu et Kropscott, 2007). Un système de double seringue personnalisé a été conçu pour mesurer l'équilibre de partage entre les trois phases. Il est constitué de deux seringues étanches : la seringue de gauche contient environ 5 mL d'eau saturée en octanol, du D5 marqué au 14C dans de l'octanol sur la phase aqueuse et une phase gazeuse d'environ 70 à 80 cm3. La seringue de droite contient entre 60 et 80 mL d'eau saturée en octanol et entre 20 et 40 cm3 d'air. Pendant l'essai, les phases gazeuses des deux seringues étaient reliées entre elles. Grâce à un système d'agitation lente de l'eau, l'équilibre entre la phase aqueuse et la phase gazeuse a été atteint après 20 heures. La valeur moyenne de log Kae de 3,13 pour D5 à 24,6 ºC a été déterminée en fonction de la radioactivité totale de D5 dans l'air et dans l'eau. Cette valeur est cohérente avec la formule relative à l'équilibre selon laquelle log Koe= log Koa + log Kae. Pour la valeur expérimentale de Kae, on obtient la constante de la loi de Henry égale à 3 350 000 Pa·m3/mol à environ 25 °C.
Pour le D5, d'autres propriétés physiques et chimiques modélisées correspondent bien aux données expérimentales mesurées. Sauf pour les données examinées ci-dessus, on utilise les données expérimentales les plus prudentes, s'il y a lieu, pour les prévisions indiquées de divers modèles dans le présent rapport d'évaluation préalable.
Il n'existe pas de sources naturelles connues de D5.
Le D5 est un produit chimique industriel qui n'était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé surtout à l'état pur, dans des mélanges avec d'autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l'article 71 de la LCPE (1999) ont permis de déterminer qu'entre 1 000 000 et 10 000 000 kg de D5 avaient été importés au Canada en 2006 (Environnement Canada, 2007), sous forme de matière première ou dans des produits finis. Les quantités de D5 importées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988).
Le D5 est un constituant du cyclométhicone (n° CAS 69430-24-6), terme utilisé dans l'industrie cosmétique. Bien que le cyclométhicone n'ait pas été contrôlé directement conformément à l'article 71 de la LCPE (1999) par Environnement Canada et Santé Canada en 2007, on constate dans certains cas que les réponses à l'avis publié en application de cet article pour l'année 2006 contenaient des données sur les quantités de D5 utilisées ou importées sous le no CAS 69430-24-6 (Environnement Canada, 2007).
La quantité du n° CAS 69430-24-6 proposée dans le commerce au Canada, déclarée pour l'année civile 1986, était de 2 220 000 kg (Environnement Canada, 1988). En 2005, le Canada était un importateur net de 11 500 000 kg de tous les types de polymères de silicone et de siloxanes (Will et al., 2007).
Le D5 est un intermédiaire dans la production des polymères de silicone de type polydiméthylsiloxane (PDMS) et tous les polymères de type PDMS contiennent des quantités résiduelles de cyclosiloxanes volatils, notamment le D5. Les polymères à faible poids moléculaire (et par conséquent à faible viscosité) peuvent contenir moins de 0,1 à 0,5 % de cyclosiloxanes volatils tandis que les polymères à poids moléculaire plus élevé (et par conséquent à plus forte viscosité) peuvent en contenir de 1 à 3 %. La proportion des cyclosiloxanes volatils représentée par le D5 varie fortement selon les produits. L'utilisation de certains produits à base de PDMS devrait entraîner des rejets de D5 (SEHSC, 2007b).
La détection du D5 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que les sources ponctuelles et diffuses contribuent à créer des concentrations de D5 dans l'environnement (Norden, 2005; Kaj et al., 2005; communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007 [ne figure pas dans les références]). L'application de pesticides contenant du D5 sur les cultures et l'épandage des boues d'épuration sur les terres agricoles, leur incinération et leur mise en décharge entraînent le rejet de D5 dans les milieux naturels. Selon certaines indications, le D5 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols, avant leur minéralisation complète (Herner et al., 2002). Ainsi, outre les rejets de résidus de D5 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Dans d'autres pays, le D5 a été reconnu comme une substance chimique produite en grandes quantités par l'Organisation de coopération et développement économiques (OCDE, 2007), l'Agence de protection de l’environnement des États-Unis (U.S. EPA, 2007) et le Bureau européen des substances chimiques (ECB, 2007).
Aux États-Unis, l'utilisation de méthylsiloxanes volatils, notamment de D6, a tendance à augmenter car ces substances ne sont pas soumises à la législation sur les composés organiques volatils (COV) de 1994 (U.S. EPA, 1994a). Les méthylsiloxanes volatils ont été utilisés comme solution de rechange aux chlorofluorocarbures (CFC) pour réduire la teneur en COV réglementée de certains produits (en particulier pour les applications de nettoyage de précision et électronique). Selon des informations de l'Agence de protection de l’environnement des États-Unis, l'importation/la production de D5 dans ce pays atteignait 4 500 à 22 500 tonnes en 1986, 1990 et 1994. Elle se situait entre 22 500 et 45 000 tonnes en 1998 et entre 45 000 et 225 000 tonnes en 2002.
En Europe, quatre sociétés ont été identifiées comme productrices/importatrices de D5 : Bayer AG en Allemagne, Dow Corning Limited au Royaume-Uni, Rhodia Chimie en France et Amway Europe en Belgique (ECB, 2007). La quantité de D5 utilisée comme intermédiaire limité au site dans l'Union européenne entre 2003 et 2004 est une information confidentielle.
Au Canada et dans le monde entier, le D5 est principalement utilisé pour la préparation de mélanges et de formulations de produits de consommation (Environnement Canada, 2007). Le D5 est aussi utilisé comme intermédiaire dans la production de polymères de type PDMS et comme produit de nettoyage à sec par quelques nettoyeurs à sec commerciaux du Canada (Green Earth, 2008). Par ailleurs, tous les polymères de silicone contiennent des quantités résiduelles à l'état de traces de cyclosiloxanes volatils, notamment le D5. Comme il est indiqué ci-dessus, le D5 est également un constituant du composé portant le no CAS 69430-24-6, appelé cyclométhicone dans l'industrie cosmétique.
Le cyclométhicone est un mélange de siloxanes cycliques volatils à faible poids moléculaire, dont les principaux ingrédients sont l'octaméthylcyclotétrasiloxane (D4), le décaméthylcyclopentasiloxane (D5) et le dodécaméthylcyclohexasiloxane (D6), que l'on retrouve en différentes proportions. Au Canada, les principales utilisations des mélanges à faible poids moléculaire de siloxanes cycliques volatils, qui peuvent contenir un pourcentage élevé de D4 ou de D5, concernent la préparation de produits d'hygiène, notamment de produits de soins capillaires et de produits de soins de la peau, et d'antitranspirants (Environnement Canada, 2007).
Les polymères de silicone qui contiennent des quantités à l'état de traces de D5 peuvent être regroupés comme des liquides, des gommes et des résines. Les utilisations de ces polymères sont décrites ci-dessous.
Les principales utilisations de liquides à base de silicone concernent notamment les ingrédients qui entrent dans la formulation de produits de soins pour les cheveux et la peau, d'antitranspirants et de déodorants, de produits pharmaceutiques, d'adjuvants de traitement comme des antimousses, des tensioactifs et des agents de démoulage, de lubrifiants, de polis et de revêtements appliqués sur divers substrats comme les textiles, les tapis et les papiers, ainsi que de produits d'étanchéité, d'enduits pour bâtiments, de lubrifiants mécaniques, de liquides caloporteurs et diélectriques et de produits de reprographie (Will et al., 2007).
Alors qu'une utilisation importante de polymères à poids moléculaire plus élevé était attendue dans la plupart de ces applications, l'utilisation de D5 a été signalée pour les antimousses (Environnement Canada, 2007). Les antimousses sont souvent utilisés à des concentrations de l'ordre de quelques parties par million par toute une gamme d'industries de transformation, notamment les pâtes et papiers, l'alimentation, le pétrole et l'industrie pétrochimique, la fabrication de produits chimiques et le traitement de l'eau. Les silicones sont également utilisés comme antimousses dans des produits d'entretien domestique tels que les nettoyants et les détergents (Will et al., 2007).
Au Canada, l'utilisation de produits à base de silicone contenant du D5 dans certains pesticides est réglementée par la Loi sur les produits antiparasitaires (ARLA, 2007).
Des mélanges liquides et en gel à base de silicone sont utilisés pour plusieurs types de produits cosmétiques et médicaux. Les liquides à base de silicone ont été approuvés comme ingrédients actifs ou non dans des produits pharmaceutiques au Canada (BDPP, 2007), le plus souvent dans des médicaments antiflatulences. On note aussi d'autres utilisations biomédicales des liquides à base de silicone au Canada, comme les démoussants utilisés pour le sang dans les équipements de manutention du sang, les barrières protectrices, les lubrifiants et le traitement en surface des pansements.
Les gommes de silicone sont utilisées pour la production d'élastomères dans des produits d'étanchéité et des adhésifs, du caoutchouc de silicone moulé et des revêtements, ainsi que pour encapsuler des médicaments. Les élastomères à base de silicone servent à fabriquer des produits de consommation comme les sucettes. Des élastomères à base de silicone sont également utilisés dans un grand nombre d'applications biomédicales, notamment des implants et des prothèses destinés à des utilisations à court et à long terme, des cathéters, des lentilles cornéennes et des prothèses dentaires (Will et al., 2007).
Les résines de silicone sont principalement utilisées dans des revêtements spéciaux et pour la production de polymères modifiés par des silicones (Will et al., 2007). Les consommateurs peuvent être exposés au D5 s'ils utilisent ces produits et s'ils se trouvent dans des espaces fermés dans lesquels des revêtements, des produits de calfeutrage, des produits d'étanchéité et du caoutchouc de silicone sont utilisés comme matériaux de construction, ou si ces derniers sont présents dans des produits de consommation.
Le D5 n'est pas déclaré à l'Inventaire national des rejets de polluants d'Environnement Canada. Cette substance fait partie d'un groupe de produits chimiques qui peuvent être utilisés pour diverses applications industrielles et de consommation associées à d'éventuels rejets très importants.
Le D5 peut être rejeté dans l'environnement par des procédés industriels qui l'utilisent comme réactif avec d'autres substances pour former des polymères et des copolymères de silicone au cours d'opérations de mélange, de formulation et de conditionnement. Toutes ces opérations ont lieu au Canada (Environnement Canada, 2007). Des rejets industriels de D5 peuvent également se produire si des polymères de silicone sont utilisés par des industries de transformation comme démoussants, agents de démoulage ou lubrifiants, ou pour d'autres applications (Environnement Canada, 2007). L'utilisation du D5 comme produit de nettoyage à sec dans le commerce (bien que les chiffres d'utilisation actuels n'indiquent pas une forte contribution) et comme dégraissant industriel peut être source de rejets dans l'atmosphère. On pense que les rejets des procédés industriels passent dans l'atmosphère et les eaux usées. Des rejets de D5 sont également dus à l'utilisation de produits d'hygiène tels que les produits de soins capillaires et les produits de soins de la peau, les antitranspirants, et ces rejets s'effectuent dans l'air et les eaux usées. Selon les estimations, plus de 90 % du D5 utilisé dans les produits d'hygiène passe dans l'atmosphère (Allen et al., 1997). Du fait des rejets de D5 dans les eaux usées traitées par les stations d'épuration des eaux d'égout, la substance peut être associée à des boues qui peuvent ensuite être mises en décharge, incinérées ou épandues sur les sols agricoles comme engrais. L'élimination des produits de consommation et des produits industriels contenant du D5 peut aussi entraîner l'élimination de D5 dans les décharges.
La détection du D5 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que des sources ponctuelles et diffuses contribuent à créer des concentrations de D5 dans l'environnement (Norden 2005; Kaj et al., 2005). L'application de pesticides contenant du D5 sur les cultures ainsi que l'épandage des boues d'épuration sur les terres agricoles, leur incinération et leur mise en décharge entraînent le rejet de D5 dans les milieux naturels. Selon certaines indications, le D5 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols (Xu et al., 1998). Ainsi, outre les rejets de résidus de D5 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Outil de débit massique
Un outil basé sur le débit massique permet d'estimer les rejets possibles de D5 dans l'environnement à différentes étapes de son cycle de vie. Les données empiriques sur les rejets de substances spécifiques dans l'environnement sont rares. On estime donc, pour chaque type d'utilisation connue, la proportion et la quantité des rejets dans les différents milieux naturels, ainsi que la proportion de la substance qui est transformée chimiquement ou envoyée dans des lieux d'élimination des déchets. Les hypothèses et les paramètres d'entrée utilisés pour effectuer ces estimations sont fondés sur des renseignements obtenus de diverses sources dont les réponses à des enquêtes réglementaires, des données de Statistique Canada, les sites Web des fabricants et des bases de données techniques. À cette fin, les facteurs d'émission se révèlent particulièrement utiles; ils sont généralement exprimés en fraction d'une substance rejetée dans l'environnement, notamment pendant sa fabrication, sa transformation et son utilisation associées aux procédés industriels. Ces données découlent notamment de documents sur des scénarios d'émissions, souvent élaborés sous les auspices de l'Organisation de coopération et de développement économiques (OCDE), et d’hypothèses par défaut utilisées par différents organismes internationaux de réglementation des produits chimiques. Le degré d'incertitude associé à la masse de la substance en circulation et à la quantité rejetée dans l'environnement augmente généralement vers la fin du cycle de vie.
| Devenir | Proportion massique (%)[1] | Principale étape du cycle de vie[2] |
|---|---|---|
| [*] Eaux usées avant toute forme de traitement [1] Pour estimer les rejets de D5 dans l'environnement et la répartition de cette substance, comme le montre ce tableau de synthèse, des renseignements sur les scénarios d'émissions de l'OCDE ont été utilisés : OCDE 2004; id. 2006. Les valeurs présentées pour les rejets dans les milieux naturels ne tiennent pas compte des mesures possibles de limitation des rejets qui peuvent être en place à certains endroits (p. ex. leur élimination partielle par les stations d'épuration des eaux d'égout). Les hypothèses particulières utilisées pour ces estimations sont résumées dans Environnement Canada, 2008. [2] Étapes applicables : production, formulation, utilisations industrielles, utilisation par les consommateurs, durée de vie utile de l'article/du produit, élimination des déchets. |
||
| Rejets dans l'environnement | ||
| dans le sol | 0 | - |
| dans l'air | 77,5 | Utilisations industrielles et utilisation par les consommateurs |
| dans les égouts[*] | 12,2 | Formulation, utilisations industrielles et utilisation par les consommateurs |
| Transformation chimique | 0,8 | Utilisations industrielles |
| Envoi dans des lieux d'élimination des déchets (p. ex. les décharges, les incinérateurs) | 9,5 | Élimination des déchets |
D'après les informations disponibles, la substance est principalement rejetée dans l'air et les eaux usées (égouts). L'air reçoit la plus forte proportion de rejet, soit environ 77,5 %. Cette situation est due à l'utilisation de produits de consommation tels que les lotions pour la peau, les crèmes solaires ou les polis (SPIN, 2007). Les rejets dans les eaux usées attribuables aux utilisations industrielles pendant la formulation de produits et à l'utilisation de produits d'hygiène sont estimés à environ 12,2 %. En outre, 9,5 % de cette substance sont confiés à l’élimination des déchets.
Selon ses propriétés physiques et chimiques (tableau 2) et les résultats de la modélisation de la fugacité de niveau III (tableau 4, les paramètres d'entrée de modélisation sont répertoriés à l'annexe 5 de cette évaluation préalable), le D5 peut se répartir en quantités significatives dans tout milieu naturel, selon le milieu de rejet.
| Milieu de rejet de la substance | Fraction de la substance répartie dans chaque milieu | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 100 | 0,0 | 0,0 | 0,0 |
| Eau (100 %) | 4,4 | 30,9 | 0,0 | 64,7 |
| Sol (100 %) | 71,2 | 0,0 | 28,7 | 0,0 |
D'après les informations disponibles (tableau 3), les rejets de D5 dans l'environnement s'effectuent principalement dans l'air. Selon sa pression de vapeur qui varie de 26,66 à 33,2 Pa, sa constante de la loi de Henry de 3 350 000 Pa·m3/mol et sa longue demi-vie dans l'air, le D5 devrait rester dans l'air (100 %) s'il y est rejeté (tableau 4).
Si le D5 est rejeté dans l'eau (tableau 4), on s'attend à ce qu'il soit adsorbé sur les matières en suspension, comme les boues d'épuration et les sédiments, du fait de ses fortes valeurs empiriques de log Kco (plus de 5). Les résultats de la modélisation de la fugacité de niveau III pour les rejets dans l'eau montrent qu'environ 64,7 % de ce composé restera dans la phase solide (sédiments en suspension et matériaux du lit) et 30,9 % dans la phase aqueuse (colonne d'eau). Le log Kco du composé se trouve dans la plage élevée pour la sorption, et le taux d'hydrolyse modéré de D5 dans l'eau et l'air ambiant réduit la fraction qui devrait être adsorbée sur les sédiments. Une certaine volatilisation à partir des surfaces d'eau est également attendue d'après le coefficient de partage air-eau (Kae); la fraction massique qui devrait passer dans l'air du fait de cette volatilisation à 25 °C est de 4,4 % (tableau 4).
Si le D5 est rejeté sur des sols humides, par exemple par l'application de boues d'épuration sur des terres agricoles, environ 71 % de la fraction massique devrait passer dans l'air. Cette estimation est conforme à l’observation de Xu (1999) selon laquelle la volatilisation constitue le principal processus de perte de siloxanes cycliques à partir des sols humides. Environ 28,7 % resteront dans le sol, associés à des solides pour les raisons décrites pour les sédiments. Sur un sol sec, le D5 devrait être hydrolysé rapidement par des minéraux argileux pour former du diméthylsilanediol, qui est le produit de dégradation final (Xu, 1999; Xu et Chandra, 1999).
Persistance dans l'environnement
Dégradation atmosphérique
Les résultats du modèle de fugacité de niveau III indiquent que si le D5 est rejeté dans l'air, il y restera et devrait y être oxydé lentement par une réaction en phase gazeuse avec des radicaux hydroxyles (OH) d'origine photochimique. La demi-vie calculée empiriquement pour le D5 qui réagit avec les radicaux hydroxyles en phase gazeuse est de 6,9 jours (Atkinson, 1989; voir tableau 5a), à une vitesse de réaction expérimentale de 1,55 × 10-12 cm3/mol s (Atkinson 1989), qui peut être convertie en une demi-vie estimée de 6,9 jours, en supposant une cinétique du premier ordre, une journée de 12 heures et une concentration de radicaux hydroxyles de 1,5 × 106/cm3. Le D5 ne devrait pas réagir du tout, ou très peu, avec d'autres espèces photo-oxydantes dans l'atmosphère, par exemple O3, et ne devrait pas se dégrader par photolyse directe (Atkinson, 1991). Les réactions avec les radicaux hydroxyles devraient donc constituer le principal processus régissant le devenir de cette substance dans l'atmosphère.
Des mesures sur le terrain récentes des concentrations en radicaux hydroxyles en milieu urbain (Ren et al., 2003; Kramp et Volz-Thomas, 1997; Rivett et al., 2003) semblent indiquer que les concentrations en OH sont plus élevées dans l'atmosphère urbaine que celles observées dans les atmosphères rurale et marine en raison d'une plus forte présence des précurseurs de radicaux OH dans les zones urbaines polluées (SEHSC, 2008b). Ren et al. (2003) ont mesuré pendant 34 jours la concentration en radicaux hydroxyles dans l'atmosphère en été dans la ville de New York, dans l'État de New York aux États-Unis. La concentration maximale moyenne relevée s'élève à 7 × 106 OH/cm3 et est comparable aux valeurs obtenues (1 à 10 × 106 OH/cm3) dans des milieux urbains similaires des États-Unis (Los Angeles en Californie et Nashville dans le Tennessee, SEHSC, 2008b) et dans les pays européens (Kramp et Volz-Thomas, 1997; Rivett et al., 2003). Cependant, la plupart des mesures ont été effectuées pendant l'été, lorsque la lumière solaire est forte et que la photochimie atmosphérique est active. La concentration en radicaux OH mesurée par Ren et al. (2006) en hiver à New York est environ 5 fois inférieure à celle mesurée en été au même endroit. La mesure a été effectuée sur une période de 28 jours et la concentration maximale moyenne était de 1,4 × 106 OH/cm3. Par conséquent, des demi-vies de 3 à 14,8 jours peuvent être calculées en se basant sur une cinétique du premier ordre, une journée de 12 heures et une concentration moyenne quotidienne de 3,5 × 106 OH/cm3 et 0,7 × 106 OH/cm3 (concentration moyenne quotidienne = concentration maximale/2), en été et en hiver respectivement. Il est donc conclu que le D5 pourrait se dégrader plus rapidement dans les centres urbains en été lorsque les radicaux hydroxyles atmosphériques sont des plus présents. Cependant, si l'on prend en compte une demi-vie d'élimination moyenne annuelle, elle est cohérente avec la demi-vie de 6,9 jours estimée avec la concentration en radicaux OH de 1,5 × 106 OH/cm3. La demi-vie de dégradation de 6,9 jours est considérée comme critique et sera utilisée pour le D5 dans la modélisation du devenir dans l'environnement.
Navea et al. (2007) ont étudié les effets de l'ozone, des aérosols et du rayonnement solaire sur le devenir du D4 et du D5 dans une chambre à environnement simulé. Ils sont arrivés à la conclusion que les aérosols minéraux tels que le kaolin et l'hématite peuvent accélérer de façon significative l'élimination du D4 et du D5 dans la phase gazeuse de l'atmosphère, en particulier pendant la journée. Ces résultats indiquent également que l'ozone peut encore accélérer ces processus d'élimination du D4 et du D5. Bien que les données obtenues suggèrent que les aérosols minéraux combinés à l'ozone peuvent avoir des effets significatifs sur le devenir dans l'environnement des méthylsiloxanes cycliques volatils (cVMS) présents dans l'air, il est difficile d'extrapoler de manière quantitative les résultats des simulations dans des conditions environnementales réalistes. Il convient d'abord de noter que l'étude a été effectuée avec des concentrations en cVMS, en aérosols minéraux et en ozone, d'un niveau élevé irréaliste. Par ailleurs, les échantillons de minéral et de noir de charbon utilisés dans l'étude étaient des échantillons d'analyse très purs (plus de 99 %) qui fournissaient la zone de surface maximale et par conséquent les sites d'adsorption maximale idéaux, c'est-à-dire les conditions optimales pour l'adsorption de D4/D5. On peut se demander si ces minéraux purs sont bien représentatifs des matières particulaires dans l'air. Enfin, on peut raisonnablement penser que des minéraux tels que la kaolinite et l'hématite sont présents dans les particules atmosphériques. Cependant, il est peu probable qu'il s'agisse des composants les plus courants et les plus abondants de la poussière atmosphérique. Il convient par ailleurs de souligner que l'étude a été menée dans une chambre à environnement simulé et a impliqué la réaction des aérosols minéraux avec un seul cVMS (D4 ou D5) à la fois. Dans des conditions environnementales réelles, des milliers de produits chimiques se disputent les sites d'adsorption des aérosols. Dans ces conditions, l'« efficacité » de l'élimination du D4/D5 dans l'air ambiant peut donc être largement inférieure aux résultats observés dans l'atmosphère de la chambre où se trouvait un seul composant.
On peut donc conclure que le degré d'accélération de la dégradation des cVMS dans l'air par les aérosols et l'ozone dans des conditions environnementales réalistes est incertain.
Le modèle AOPWIN (2000; voir tableau 5b) fournit également des indications du potentiel de persistance de cette substance, avec une demi-vie d'oxydation atmosphérique prévue de 3 à 15 jours. Les données empiriques et modélisées montrent donc que cette substance est persistante dans l'air (demi-vie supérieure à 2 jours) conformément au Règlement sur la persistance et la bioaccumulation (Canada, 2000).
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Références |
|---|---|---|---|---|
| Air | Réaction avec l'OH | 6,9 | Demi-vie (jours) | Atkinson, 1989 |
| Air | Réaction avec l'OH | 3,0-14,8 | Demi-vie (jours) | Ren et al. 2003; id., 2006 |
| Eau | Biodégradation | 0,14 % | Dégradation 28 j | Springborn Smithers Laboratories, 2004 |
| Eau | Hydrolyse | 0,9-733 | Demi-vie (jours) pH 6-9 5-25 °C |
Durham, 2006 Kozerski, 2008 Bidleman, 2008 |
| Eau/sédiments | Dégradation abiotique | 49-588 | Demi-vie (jours) déduite à partir du D4 pH neutre; 5-25 °C |
Xu et Miller, 2008 |
| Sol (sols Wahiawa d'Hawaï) | Hydrolyse catalysée par l'argile | Env. 2 heures (humidité relative 32 %) |
Demi-vie (heures) | Xu, 1999; Xu et Chandra, 1999 |
| Sol (sols Londo du Michigan) | Hydrolyse catalysée par l'argile | 3,54 jours (humidité relative 32 %); 5,25 jours (humidité relative 93 %) |
Demi-vie (jours) déduite à partir du D4 | Xu et Chandra, 1999 |
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Modèle |
|---|---|---|---|---|
| [1] Les résultats de la simulation de la biodégradation CATABOL indiquent que le D5 se situe dans le domaine des paramètres mondiaux et dans le domaine métabolique, mais à l'extérieur du domaine structurel. Le plus important de ces domaines est le domaine métabolique, et CATABOL semble indiquer que cette substance ne se dégrade pas étant donné la faible probabilité de l'existence d'un groupe méthyle stable et de produits d'oxydation de l'anneau aromatique. [2] Demi-vies par oxydation atmosphérique recalculées avec des concentrations en radicaux OH mesurées à New York en été et en hiver respectivement. |
||||
| Air | Oxydation atmosphérique | 7,15 | Demi-vie (jours) | AOPWIN, 2000 |
| Air | Oxydation atmosphérique | 3,1-15,3[2] | Demi-vie (jours) | AOPWIN, 2000 |
| Eau | Biodégradation | 37,5 | Demi-vie (jours) | BIOWIN, 2000, Ultimate survey |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité linéaire du MITI |
| Eau | Biodégradation | 0,0003 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité non linéaire du MITI |
| Eau | Biodégradation | 2,3 | Demande biochimique en oxygène (DBO), % (MITI 301C)[1] | CATABOL, c2000-2008 |
| Sol | Biodégradation (anaérobie) | 0,04 (biodégradation lente) | Probabilité | BIOWIN, 2000 |
Dégradation dans l'eau et les sédiments
Les données empiriques d'hydrolyse concernant le D5 (Durham, 2006) ont été soumises par des experts internes à un examen critique (Bidleman, 2008); les résultats de cet examen sont résumés ci dessous. On a déterminé la cinétique de l'hydrolyse du D5 en mesurant la disparition du décaméthylcyclopentasiloxane (D5 à une pureté de 98,9 %) radiomarqué au 14C et la formation de produits d'hydrolyse en fonction du temps, conformément à la Ligne directrice 111 de l'OCDE. Les réactions du D5 ont été étudiées dans des tubes de verre de borosilicate scellés à la flamme à des pH de 4, 5,5, 7, 8 et 9 et à des températures de 10, 25 et 35 °C. L'essai initial visait une concentration de 6 µg/L après l'enrichissement, ce qui correspond à une valeur comprise entre la moitié et le tiers de la solubilité du D5 dans l'eau. Du THF (tétrahydrofurane) à une concentration inférieure à 1 % vol./vol. a été utilisé comme agent solubilisant. Le même laboratoire a également effectué une étude semblable de la cinétique de l'hydrolyse avec de l'octaméthylcyclotétrasiloxane (D4) radiomarqué au 14C (Durham et Kozerski, 2005). Il a été constaté que les vitesses d'hydrolyse du D4 et du D5 dépendaient du pH et présentaient une cinétique du pseudo-premier ordre. On a constaté que le D4 et le D5 étaient rapidement hydrolysés dans des conditions acides (pH 4) et basiques (pH 9), avec des demi vies (t1/2) moyennes comprises entre quelques minutes et moins de 6,5 heures pour le D4, et entre quelques heures et moins de 6 jours pour le D5 à une température comprise entre 10 et 35 °C. Deux essais d'hydrolyse supplémentaires avec le D5 dans des conditions presque neutres (pH 5,5 et 8) à 25 °C ont abouti à des t1/2 d'environ 15 et 9 jours, respectivement. Les demi vies à pH neutre (pH 7) étaient considérablement plus longues pour le D4 et le D5. La t1/2 calculée à 10 25 ºC était de 3,3 à 23 jours pour le D4 et de 74 à 416 jours pour le D5. Les produits d'hydrolyse étaient des intermédiaires diméthylsiloxane alpha et des oligomères oméga diol HO(Me2SiO)nH (n = 2 4 ou 5), et le diméthylsilanediol (DMSD) était le produit d'hydrolyse final. Bien que la perte de composés parents et une faible reproductivité aient été signalées à un pH neutre, les coefficients de perte à pH neutre peuvent être estimés à l'aide des constantes de vitesse du deuxième ordre pour les réactions catalysées par un acide et une base. Les études d'hydrolyse pour le D4 et le D5 sont donc considérées comme fiables pour cette évaluation préalable. Bidleman (2008) a cependant repéré une erreur dans le calcul de la constante catalytique des hydroxydes, kOH, à des températures autres que 25 ºC. Le tableau 6 répertorie les constantes de vitesse du deuxième ordre révisées pour l'hydrolyse catalysée par l'hydronium et les hydroxydes du D5 (Kozerski, 2008).
| Constante de vitesse (M-1h-1) | Température (°C) | |||
|---|---|---|---|---|
| 5 | 10 | 25 | 35 | |
| kH | 141 | 210 | 742 | 1 600 |
| kOH | 1 360 | 1 730 | 3 170 | 5 020 |
Les constantes de vitesse du pseudo-premier ordre, kobs, pour l'hydrolyse du D5 peuvent être calculées à l'aide de l'équation de cinétique suivante (en supposant une contribution négligeable de l'hydrolyse non catalysée, comme confirmé par les expériences à un pH de 7) :
kobs = kH+[H+] + kOH-[OH-]
Les demi-vies calculées pour le D5 (tableau 7) dans des conditions environnementales réalistes au Canada (pH 6-9, température 5-25 ºC) [GEMStat, 2008; NOAA, 2008] sont comprises entre 0,9 et 733 jours.
| Température (°C) | Constante de dissociation de l'eau pKw | pH | Constant de vitesse k (h-1) |
Demi-vie (jours) |
|---|---|---|---|---|
| 25 | 14 | 6 | 7,74E-04 | 37 |
| 7 | 3,91E-04 | 74 | ||
| 8 | 3,18E-03 | 9,1 | ||
| 9 | 3,17E-02 | 0,9 | ||
| 10 | 14,52 | 6 | 2,15E-04 | 134 |
| 7 | 7,32E-05 | 395 | ||
| 8 | 5,24E-04 | 55 | ||
| 9 | 5,22E-03 | 5,5 | ||
| 5 | 14,73 | 6 | 1,44E-04 | 201 |
| 7 | 3,94E-05 | 733 | ||
| 8 | 2,54E-04 | 114 | ||
| 9 | 2,53E-03 | 11 |
De nouvelles informations obtenues sur la dégradation par les agents microbiens indiquent que le D5 n'est vraisemblablement pas biodégradé dans l'eau. L'essai de biodégradabilité immédiate de 28 jours a été effectué dans des récipients fermés hermétiquement conformément à la Ligne directrice provisoire 310 de l'OCDE et les résultats ont mis en évidence une biodégradation limitée (0,14 %) du D5 au cours des 28 jours d'essai (Springborn Smithers Laboratories, 2004). Ces données sont étayées par deux modèles du tableau 5b, qui indiquent que la probabilité de biodégradation du D5 dans l'eau est effectivement nulle. Par ailleurs, selon une conclusion générale pondérée obtenue en combinant les résultats des modèles BIOWIN3 et BIOWIN5, ce composé ne se biodégrade pas facilement.
Les données expérimentales et modélisées sur la biodégradation indiquent que le D5 présente un faible potentiel de biodégradation dans les milieux aqueux. L'hydrolyse constitue donc le principal processus de dégradation du D5 dans l'eau. Les données semblent indiquer que le D5 peut se dégrader rapidement par hydrolyse lorsque la température de l'eau est élevée. Il devrait cependant être persistant pendant des périodes relativement longues à des températures faibles, dans une eau neutre ou légèrement acide au Canada (pH 6-7, température 5-10 ºC). On arrive donc à la conclusion que le D5 répond au critère de la persistance dans l'eau (t1/2 > 182 jours) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Aucune information sur la dégradation dans les sédiments n'était disponible pour le D5. Une étude préliminaire sur la dégradation du D4 dans le système eau/sédiments a cependant été reçue récemment (Xu et Miller, 2008). Une ligne directrice 308 modifiée de l'OCDE a été suivie. L'étude a été réalisée à température ambiante (22-25 ºC) avec des sédiments naturels (limon sableux, teneur en carbone organique élevée, environ 70 % d'eau et 11 % de matière organique, pH d'environ 7) et de l'eau prélevés en profondeur dans un lac non contaminé. Le D4 radiomarqué dans le diéthylène glycol méthyl éther a été ajouté à la seringue en 10 à 15 points des sédiments de surface dans chaque flacon après le retrait de l'eau excédentaire. L'eau excédentaire a de nouveau été ajoutée sur les sédiments enrichis avec des perturbations minimales des sédiments. L'enrichissement des sédiments plutôt que de l'eau a permis de garantir la répartition de la substance dans les sédiments. Les propriétés physiques et chimiques de la substance (volatilité élevée et hydrolyse potentielle) ont ainsi été correctement gérées et la reproductibilité de l'étude a pu être améliorée. Les concentrations de D4 mesurées entre le 6e et le 22e jour (fin de l'essai) ont indiqué qu'un équilibre avait été atteint entre l'eau et les sédiments avec plus de 95 % de D4 et la détection de radioactivité dans les sédiments. Comme l'a montré l'étude de l'hydrolyse du D4, les produits de dégradation dans les sédiments/l'eau étaient des intermédiaires des oligomères diol HO(Me2SiO)nH (n=2-4), et le diméthylsilanediol (DMSD) était le produit de dégradation final. La demi-vie calculée à 22-25 ºC pour la dégradation du D4 dans les sédiments était de 49 jours. Les mêmes produits de dégradation observés dans cette étude et dans l'étude de l'hydrolyse du D4 suggéraient que l'hydrolyse constituait le principal processus de dégradation dans le système sédiments/eau. Le manque d'autres mesures d'essai constituait aussi la principale incertitude de l'étude. Puisqu'aucune donnée n'était disponible pour les demi-vies de dégradation à faible température, une méthode fondée sur les données déduites à partir d’analogues utilisant les données d'hydrolyse du D4 a été appliquée. Les demi-vies d'hydrolyse du D4 dans l'eau étaient environ 6 à 12 fois plus longues lorsque la température de l'eau passait de 25 à 10-5 ºC. En supposant une tendance similaire à la baisse dans les sédiments, les demi-vies estimées pour le D4 dans les sédiments sont de 294 et 588 jours à 10 et 5 ºC respectivement.
Les demi-vies de dégradation du D4 dans les sédiments ont été utilisées pour le D5 d'après la similarité des deux substances. On arrive par conséquent à la conclusion que le manque de dégradation rapide du D5 dans les mêmes conditions environnementales, notamment dans les environnements plus froids du Canada, produira une demi-vie des sédiments de t1/2 > 365 jours. Le D5 est donc jugé persistant dans l'eau et les sédiments, conformément aux critères établis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). L'extrapolation de la dégradation du D4 dans les sédiments à faible température selon l'hydrolyse n'est cependant pas exempte d'incertitudes. L’hypothèse selon laquelle la perte de D4 dans les sédiments est uniquement fonction de l'hydrolyse dans l'eau de porosité ne prend pas en compte la fraction pouvant être absorbée sur la phase solide, dont les processus et la vitesse de dégradation ne sont pas connus.
Dégradation dans le sol
Bien qu'on ne dispose d'aucune donnée empirique sur sa biodégradation dans le sol, comme indiqué ci-dessus, la biodégradation du D5 dans l'eau est négligeable selon l'essai de biodégradation immédiate (Springborn Smithers Laboratories, 2004) et selon les prévisions de cinq des six modèles de biodégradation (tableau 5b).
Xu (Xu, 1999, Xu et Chandra, 1999) a étudié en détail les voies possibles de dégradation des cyclosiloxanes, notamment le D4, le D5 et le D6 dans le sol Wahiawa d'Hawaï à température ambiante avec une humidité relative de 32 %. Il a conclu que les processus de polymérisation et de déméthylation n'étaient pas significatifs dans le sol à des concentrations inférieures à 200 mg/kg en poids sec. De plus, on a observé l'hydrolyse du D5 catalysée par l'argile dans des sols Wahiawa très altérés et secs. Il semblerait que la sécheresse du sol limite fortement l'activité biologique, mais favorise des réactions abiotiques comme l'hydrolyse catalysée par des conditions acides et en surface des PDMS, un polymère qui présente le même squelette que les cyclosiloxanes (Xu, 1999). Les vitesses de dégradation des cyclosiloxanes étaient déterminées par l'humidité du sol, le type d'argile, la teneur en argile et la taille des molécules de siloxane, qui déterminent à leur tour la vitesse de diffusion vers les sites catalytiques en surface. La demi-vie de dégradation par hydrolyse du D5 dans le sol Wahiawa (teneur en argile de 55 %, teneur en eau de 2,1 %) était d'environ 2 heures à 22 ºC dans des conditions de sol sec. La vitesse de dégradation du D5 était comparable à celle du D4 dans les mêmes conditions de sol (demi-vie d'environ 1 heure) et étayait le rapport selon lequel la vitesse de dégradation des trois cyclosiloxanes devrait diminuer en raison inverse de leur poids moléculaire : D4 > D5 >> D6. La vitesse d'hydrolyse du D5 dans des sols Londo tempérés du Michigan (teneur en argile de 22 %) n'a pas été indiquée. Les demi-vies de dégradation du D4 dans le sol Londo étaient comprises entre 3,54 et 5,25 jours à une humidité relative inférieure à 93 %. Pour le D5, on prévoit des demi-vies de dégradation comparables dans des sols Londo tempérés. La majorité des données disponibles semble indiquer que le D5 subit une hydrolyse catalysée par l'argile et n'est probablement pas persistant dans des conditions de sol sec. L'absence de dégradation par hydrolyse du D4 dans des sols Londo saturés d'eau semble aussi indiquer que la dégradation du D5 est négligeable dans les mêmes conditions. En outre, dans un système ouvert et dans ces conditions pédologiques, la volatilisation devient le principal mécanisme de perte de D5.
Alors qu'ils étudiaient l'influence des types d'argile sur le potentiel de dégradation des polydiméthylsiloxanes (PDMS), Xu et al. (1998) ont démontré que les PDMS étaient dégradés par les minéraux argileux, même si leurs activités catalytiques étaient différentes. La présence répandue de ces minéraux tend à indiquer que le D5 devrait subir une dégradation catalysée par l'argile dans les divers sols tant que persisteront des conditions pédologiques critiques comme une faible humidité, et ce, malgré l'extrême diversité des sols canadiens.
Selon des études empiriques disponibles qui montrent son potentiel d'hydrolyse rapide catalysée par l'argile dans les sols de surface, le D5 n'a pas été jugé persistant dans le sol car sa demi-vie de dégradation est inférieure au critère de la t1/2 supérieure à 182 jours qui est énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Les données empiriques et modélisées disponibles indiquent que le D5 satisfait aux critères de la persistance dans l'air (demi-vie ≥ 2 jours), dans l'eau (demi-vie ≥ 182 jours) et dans les sédiments (demi-vie ≥ 365 jours), conformément au Règlement sur la persistance et la bioaccumulation(Canada, 2000), mais non au critère de la demi-vie dans le sol (demi-vie < 182 jours).
Potentiel de transport à grande distance
Le modèle régional de niveau III de transport et de persistance (TaPL3, 2000) a été utilisé pour estimer la distance de transport caractéristique (DTC) du D5. La DTC est définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé de considérer le potentiel de transport atmosphérique à grande distance comme étant élevé si la DTC est supérieure à 2 000 km, modéré si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. . D'après une estimation de la DTC de 3 447 km, le potentiel de transport atmosphérique à grande distance du D5 est considéré comme élevée. C’est donc dire que le D5 est sujet au transport atmosphérique vers des régions éloignées comme l'Arctique.
| Distance de transport caractéristique | Modèle (référence) |
|---|---|
| 3 447 km | TaPL3, v. 2.10 (TaPL3, 2000) |
| 3 438 km | Outil LRTP POPs, v.2.0, de l'OCDE (Scheringer et al., 2006) |
Le modèle de dépistage de l'OCDE (LRTP POPs) peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al., 2006). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible » car il identifie simplement la DTC sans préciser l'endroit où une substance peut être transportée (Fenner et al., 2005). Klasmeier et al. (2006) ont suggéré qu'un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le 2,2',3',4,4',5,5'-heptachlorobiphényle (PCB-180), permettrait d'identifier des substances ayant un fort potentiel de transport à grande distance. Le PCB-180 a été détecté dans des régions éloignées. La DTC calculée pour le D5 à l'aide du modèle de l'OCDE correspond à 3 438 km, ce qui indique que le D5 présente toujours un fort potentiel de transport dans l'air, mais qu’il est inférieur à la limite suggérée par Klasmeier et al. (2006) pour les polluants mondiaux.
Le modèle de dépistage de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspondant au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée du D5 est de 1,9E-06 %, ce qui est largement inférieur à la limite de 4,65E-04 % (2,4,4'-trichlorobiphényle ou PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. Une ET faible indique que le D5 présente un potentiel de transport à grande distance dans l'atmosphère sans être déposé à la surface de la Terre dans une région éloignée donnée. De plus, les valeurs de log Koa et de log Kae du D5 semblent indiquer qu'il présente également un faible potentiel de contamination arctique s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement. Les dépôts atmosphériques constituent donc la seule source significative de cVMS dans le lac (Powell, 2008). L'analyse préliminaire d'échantillons de sédiments et zooplancton portant sur les cVMS n'a pas permis de détecter de D5, ce qui semble indiquer que les dépôts atmosphériques ne constituent pas une source significative de D5 pour le lac Opeongo. Les limites de détection étaient de 15,9 ng (masse de référence corrigée) pour les sédiments et le zooplancton.
On arrive donc à la conclusion que le D5 présente un potentiel de transport dans l'atmosphère sur de longues distances. Cependant, l'ET modélisée pour le D5 est faible, ce qui tend à indiquer qu’il est peu susceptible de se déposer dans l'eau ou sur le sol dans des régions éloignées. Les résultats de surveillance du lac Opeongo viennent également appuyer la thèse du faible potentiel de dépôt atmosphérique pour le D5. Le D5 transporté dans l'atmosphère sera finalement dégradé par des radicaux hydroxyles dans l'air.
Potentiel de bioaccumulation
Les valeurs empiriques et modélisées de log Koepour le D5 (tableau 2) semblent indiquer que cette substance peut se bioaccumuler dans le biote.
Dans le milieu aquatique
De nouvelles données empiriques indiquent que le D5 peut être bioconcentré dans les organismes aquatiques. Une étude de bioconcentration pour le D5 a été effectuée sur des têtes-de-boule (Pimephales promelas) dans un système à écoulement continu (Drottar, 2005). L'absorption de D5 radiomarqué au [14C] dans les tissus des poissons à des concentrations (mesurées) de 1,1 et 15 µg/L a été étudiée pendant 35 jours et la dépuration, surveillée pendant 70 jours. Le facteur de bioconcentration à l'équilibre (FBCéq) moyen calculé était de 7 060 L/kg selon des concentrations mesurées du 14e au 35e jour. Le facteur de bioconcentration cinétique (FBCc) était de 13 300 L/kg selon les vitesses d'absorption et de dépuration (k1/k2) pour les groupes traités à 1,1 µg/L (tableau 7a). L'analyse des tissus des poissons a aussi indiqué que la demi-vie de dépuration pour le D5 radiomarqué était de 24 jours. L'atteinte d’un équilibre le jour 14 de la phase d'absorption, comme cela a été rapporté, suscite un certain degré d'incertitude. Bien qu'aucune différence importante n'ait été relevée d'un point de vue statistique dans la concentration de D5 chez les poissons les jours 14, 21, 28 et 35, les données étaient variables et les concentrations moyennes ont continué à augmenter avec le temps. Ce phénomène, combiné à l'incohérence notée entre le FBC cinétique et le FBC à l'équilibre (environ 2 fois) et la longue période radioactive due à la dépuration laisse penser que l'état d'équilibre pourrait ne pas avoir été atteint lors du jour 14. La valeur du FBC cinétique de 13 300 L/kg est donc jugée plus fiable dans le présent rapport d'évaluation préalable.
On a effectué une étude de toxicité orale distincte sur la vitesse de métabolisation du D5 radiomarqué [14C] chez la truite arc-en-ciel (Oncorhynchus mykiss) [Springer, 2007]. Trois truites d'âge mature ont reçu une dose nominale de 15 mg D5/kg (de 9,4 à 13 mg D5/kg de poids corporel mesuré) de D5 marqué au 14C (pureté radiochimique de 97,6 %) dans de l'huile de maïs sur une période de 96 heures. Chez ces poissons, la plus grande partie des métabolites a été observée dans la bile, avec moins de 1 % de la radioactivité due au composé parent, alors que dans le sac à œufs, le foie et les voies digestives, 56, 60 et 76 % de la radioactivité était attribuée respectivement au D5 parent. Un métabolisme non significatif a été observé dans les tissus adipeux et le sang des poissons. Le D5 administré était éliminé par l'urine et les fèces. Le métabolisme calculé chez la truite sur une période de 96 heures est estimé à 14 %. Il a été obtenu en divisant le métabolisme total en µg (tissus, bile et urine) par le nombre total d'équivalents en µg récupéré dans les carcasses, les tissus (y compris la bile) et l'urine. Selon cette étude, la constante de vitesse de métabolisation calculée, kM, était de 0,166 jour-1 (communication personnelle à Environnement Canada de la Dow Corning Corporation, Health and Environmental Sciences, 2008; ne figure pas dans les références). Cependant, le mode de calcul de la vitesse de métabolisation n'est pas clair car la vitesse calculée correspond à un métabolisme total de 4,2 jours, alors que le métabolisme total observé lors de l'étude était de 14 % en 4 jours.
De nouvelles données expérimentales ont également été obtenues dans une étude sur la bioaccumulation par voie alimentaire chez les organismes aquatiques (Drotter; 2006; tableau 9a). Une étude de bioaccumulation par voie alimentaire du décaméthylcyclopentasiloxane marqué au 14C (pureté radiochimique de 98,7 %, 6,09 mCi/g) chez la truite arc-en-ciel (Oncorhynchus mykiss) a été réalisée dans un système à écoulement continu (Drottar, 2007) pendant 35 jours, suivis d'une période de dépuration de 42 jours. Les poissons étaient nourris de bouillie de truite traitée avec une concentration moyenne mesurée du composé parent de 458 µg/g. Le taux d'alimentation supérieur modifié pour permettre une meilleure détection instrumentale est considéré comme justifié. Bien que la température ait chuté à moins de 8,6 °C (la valeur recommandée dans le protocole est de 12 ± 2 °C) au 15e jour de l'essai et que plusieurs lectures d'oxygène dissous aient été sous les 60 %, aucun effet nocif n'a été observé pendant toute la durée de l'étude. L'intégralité de la radioactivité extraite des tissus des poissons a été identifiée comme du D5 parent et des métabolites inconnus ont été détectés dans le foie et le tube digestif des poissons. Ce résultat indique que du D5 a été métabolisé comme on l’a observé dans le cas du FBC des poissons (Drottar, 2005) et des études sur le métabolisme (Springer, 2007), bien que les vitesses de métabolisme du D5 ne soient pas considérées comme significatives (moins de 17 % du D5 ont été métabolisés). La constante de vitesse d'élimination calculée indiquait qu'une période de 57 jours serait requise pour atteindre 90 % de l'équilibre et non la phase d’absorption de 35 jours de l'essai. Par conséquent, les données relatives à des résidus de poissons au terme de l'absorption de 57 jours ont été extrapolées et le facteur de bioamplification corrigé, FBA (normalisé pour les lipides), était de 0,82. Le FBA cinétique a été calculé à l'aide d'un modèle qui tient compte du taux de croissance des poissons pendant les phases d'absorption et de dépuration de l'étude, de la quantité de D5 dans les poissons sur la durée, de la masse des poissons sur la durée, ainsi que du taux de consommation des aliments. On a supposé une constante de vitesse de métabolisation, kM, nulle. Les taux de croissance des poissons ont été calculés à l'aide d'une expression linéaire (Domoradzki, 2008a; id., b; SEHSC, 2008c). Le FBA cinétique obtenu (normalisé pour les lipides) était de 0,91. Les valeurs de BFA étaient relativement cohérentes. On considère donc que le D5 n'a pas démontré de potentiel de bioamplification durant de l'étude alimentaire sur les poissons en laboratoire.
| Organisme | Paramètre[1] | Valeur | Références |
|---|---|---|---|
| [1] FBCéq : facteur de bioconcentration à l'équilibre; FBCc : facteur de bioconcentration cinétique; FBAmp : facteur de bioamplification; FABS : facteur d'accumulation dans le biote et les sédiments | |||
| Pimephales promelas (tête-de-boule) | FBCéq | 7 060 L/kg (p. humide) | Drottar, 2005 |
| Pimephales promelas (tête-de-boule) |
FBCc | 13 300 L/kg (p. humide) | Drottar, 2005 |
| Oncorhynchus mykiss (truite arc-en-ciel) | FBAmp | 0,82-0,91 (normalisé pour les lipides) | Drottar, 2006; Domoradzki, 2008a; id., b; SEHSC, 2008c |
| Chironomus riparius (moucheron) | FABS | 0,46-1,2 | Springborn Smithers Laboratories, 2003b |
Le modèle d'Arnot-Gobas (Arnot et Gobas, 2003) permet de prévoir le facteur de bioaccumulation (FBA) de cette substance en tenant compte de tout métabolisme potentiel, à l'aide d'une constante de vitesse de métabolisation (kM). Le FBC et le FBAmp disponibles dans les données d'essai in vivo ont été utilisés pour dériver une constante de vitesse de métabolisation in vivo (kM) selon la méthode d'Arnot et al. (2008a). Dans cette méthode, kM est dérivé d'après l'équation suivante :
kM = (k1f/FBC) – (k2 + kE + kG) (1)
où :
kM = Constante de vitesse de métabolisation (1/jours)
k1 = Constante de vitesse d'absorption (Arnot et Gobas, 2003)
f = Fraction du produit chimique dissous librement dans l'eau (Arnot et Gobas, 2003)
FBC = Facteur de bioconcentration empirique disponible
k2 = Constante de vitesse d'élimination (Arnot et Gobas, 2003)
kE = Constante de vitesse d'évacuation fécale (Arnot et Gobas, 2003)
kG = Constante de vitesse de croissance (Arnot et Gobas, 2003)
La méthode d'Arnot et al. (2008a) permet d'estimer les facteurs de confiance (FC) pour la valeur de kM afin de tenir compte de l'erreur associée aux données in vivo (variabilité des mesures, incertitude de l'estimation des paramètres et erreur du modèle). Un FC de ± 2,6 a été calculé pour les données de FBC et de FBAmp disponibles.
Puisque le potentiel métabolique peut être lié au poids corporel et à la température (voir p. ex. Hu et Layton, 2001; Nichols et al., 2007), la valeur kM a été normalisée davantage à 15 °C, puis corrigée pour le poids corporel des poissons du niveau trophique intermédiaire dans le modèle d'Arnot-Gobas (184 g) [Arnot et al., 2008b]. Des poissons du niveau trophique intermédiaire ont été utilisés pour représenter les résultats d'ensemble du modèle, comme le recommande son concepteur (Arnot, J.A, communication personnelle à M. Bonnell d’Environnement Canada, 2008; ne figure pas dans les références), et cette valeur est plus représentative du poids des poissons qui sera vraisemblablement consommé par un piscivore aviaire ou terrestre. Après la normalisation, la valeur de kM était comprise entre environ 0,001 et 0,01, avec une valeur médiane d’environ 0,004.
| kM (normalisée pour le niveau trophique intermédiaire) jour-1 | Log Koeutilisé | Modèle du FBC d'Arnot-Gobas | Modèle du FBA d'Arnot-Gobas |
|---|---|---|---|
| 1,30E-03 (2,5 %) | 8,0 | 4 265 | 2 630 268 |
| 3,90E-03 (moyenne) | 8,0 | 1 905 | 1 023 293 |
| 1,09E-02 (97,5 %) | 8,0 | 759 | 269 153 |
Les valeurs de kM basées sur des expériences in vivo semblent indiquer que la vitesse de métabolisation du D5 est relativement faible (≤ 0,01 jour-1 au mieux). L'étude expérimentale sur le FBC menée sur des têtes-de-boule (Drottar, 2005), l'étude de bioaccumulation par voie alimentaire sur des truites arc-en-ciel (Drottar, 2006) et l'étude sur le métabolisme (Springer, 2007) ont démontré le métabolisme, bien que limité, du D5. Le FBC calculé de 4 265 avec la constante de vitesse de percentile inférieur (env. 0,001) correspond approximativement à 50 % du FBC indiqué par Drottar (2005), mais il se trouve dans la plage acceptable des valeurs expérimentales. Un FBA correspondant de 2 630 268 a été calculé pour D5 pour les poissons des eaux canadiennes avec cette constante de vitesse de métabolisation.
Dans les sédiments
De nouvelles données sur les facteurs d'accumulation du D5 dans le biote et les sédiments (FABS) ont été reçues. Dans le cadre d'une étude sur le potentiel de bioaccumulation dans les sédiments au cours d'un essai de toxicité des sédiments chez le moucheron (Chironomus riparius) [Springborn Smithers Laboratories, 2003b; tableau 9a], des larves de moucheron ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 99,37 %) incorporées dans des sédiments, comprises entre 13 et 580 mg/kg (concentration moyenne mesurée entre le jour 0 et le jour 10 de l'essai). Des sédiments artificiels composés de 79 % de sable, de 4 % de limon et de 17 % d'argile ont été utilisés. Les essais ont été effectués avec des sédiments présentant une teneur en carbone organique de 2 %. Le pH mesuré dans les sédiments était compris entre 6,6 et 7,6 et la température mesurée, entre 19 et 22 °C. Le FABS pour le poids sec entier des moucherons a été calculé à 1,2, 1,1, 0,83 et 0,46 à des concentrations de traitement de 13, 30, 73 et 180 mg/kg respectivement. Les résultats indiquent que le D5 peut présenter un certain potentiel de bioaccumulation lié à l'exposition aux sédiments. Cependant, cette étude ne spécifie pas si le contenu de l'intestin des organismes soumis à l'essai a été purgé avant le calcul des valeurs de FABS. La valeur de FABS risque donc d'être surestimée en raison de la présence de D5 dans les sédiments dans l'intestin des invertébrés.
Dans le sol
Il n'existe pas d'information disponible sur la bioaccumulation du D5 dans le sol.
Dans le milieu terrestre
Le modèle de bioaccumulation à bilan massique de Gobas pour les organismes terrestres (Gobas et al., 2003) utilise les coefficients de partage octanol-air et octanol-eau (Koaet Koe) pour estimer le potentiel de bioamplification (FBAmp) des substances chimiques dans les chaînes trophiques terrestres. Selon les estimations, les substances chimiques dont la valeur de log Koa est supérieure à 5 peuvent se bioamplifier dans les chaînes trophiques terrestres si la valeur de Koe est supérieure à 2 et si la vitesse de transformation chimique ou de métabolisation est faible. Un log Koa de 5,06 indique que le D5 peut présenter un potentiel de bioamplification dans les chaînes trophiques terrestres. Toutefois, le métabolisme des cVMS qui a été démontré au cours d’études en laboratoire menées chez des mammifères peut réduire le potentiel de bioamplification dans le réseau trophique terrestre.
Synthèse du potentiel de bioaccumulation du D5
Globalement, l'étude empirique sur le FBC cinétique et à l'équilibre des poissons, bien qu'optimisée pour l'exposition dans l'eau, a démontré un potentiel élevé de bioconcentration du D5 dans l'eau (supérieur ou égal à 5 000). Bien que le log Koe du D5 suggère que l'absorption par voie alimentaire sera importante et probablement prédominante, elle se trouve toujours à la limite des valeurs log Koe pour lesquelles une bioconcentration importante a été observée pour de nombreuses substances chimiques dans le cadre d'études en laboratoire (p. ex. Arnot et Gobas, 2006). Les valeurs empiriques dépassent 5 000, ce qui semble indiquer un potentiel de forte bioconcentration dans d'autres organismes à différents niveaux trophiques ainsi que chez les poissons, notamment ceux dont les vitesses de croissance ou de métabolisme sont inférieures (autotrophes, par exemple).
Les valeurs de FBC prévues, corrigées pour le métabolisme, s'approchent de la valeur 5 000 sans toutefois l'atteindre et sont inférieures aux valeurs de FBC empiriques. Les valeurs de FBA prévues sont également élevées et dépassent 5 000. Comme pour les autres modèles, il existe des incertitudes concernant les valeurs de FBC et de FBA prévues (l'incertitude augmente pour les valeurs de log Koe supérieures car très peu de substances chimiques ont fait l'objet d'une étude de bioaccumulation dans cette plage). Un niveau de confiance supérieur est accordé à la valeur de FBA prévue lorsque la valeur de FBC prévue correspondante est le plus près des données de FBC empiriques (FBA = 2,6E06 environ). Le modèle cinétique à bilan massique utilisé est basé sur les « principes fondamentaux », dont le principal concept indique qu'une substance chimique obéit au principal mécanisme du modèle, dans ce cas une diffusion passive. Le D5 respecte ce concept, de même que les limites de log Koe et de poids moléculaire du modèle. Par conséquent, les prévisions de bioaccumulation sont jugées applicables au D5. Cependant, la correspondance entre les valeurs de FBC corrigées pour le métabolisme et les valeurs empiriques est moindre (par rapport au D4), ce qui suggère une plus grande incertitude concernant les résultats du modèle de FBC et de FBA pour le D5 du fait de l'absence relative de valeurs de FBC et de FBA empiriques dans la plage de log Koeutilisée pour le D5 dans le modèle (supérieure ou égale à 8). Par ailleurs, la possibilité que des produits chimiques superhydrophobes n’atteignent pas l'équilibre dans l'environnement (ce que suppose le modèle) rajoute une certaine incertitude (Arnot et Gobas, 2006).
Les valeurs de FABS pour le D5 semblent indiquer un niveau d'accumulation relativement faible dans les macroinvertébrés présents dans les sédiments. Comme il s'agit du seul essai de bioaccumulation dans les sédiments disponible pour les cVMS et qu'il n'existe aucun modèle prédictif pour les organismes des sédiments, des essais ou des données sur le terrain à des charges environnementales plus réalistes permettraient de vérifier ces valeurs. Les valeurs de FBA générées pour le D5 sont inférieures à 1, ce qui suggère la possibilité d'un faible potentiel de bioamplification chez les poissons pour le D5, mais aucun élément ne semble indiquer pour le moment que ce soit le cas pour d'autres niveaux trophiques. Des études de mésocosmes sur le terrain sont actuellement en cours afin d'observer le transfert trophique de cVMS dans un réseau alimentaire aquatique, mais ces données ne sont pas encore disponibles pour évaluation complète et n'ont pas été prises en compte dans cette évaluation.
Il existe enfin des indications contradictoires sur le potentiel de bioaccumulation du D5 testé en laboratoire et déterminé à partir de modèles prédictifs. Les études de FBA sur les poissons et de BAFS sur les invertébrés tendent à indiquer que le potentiel de bioaccumulation du D5 est faible, ce qui peut être attribuable à une biodisponibilité réduite. Les données d'essai optimisées dont on dispose au sujet du BFC semblent indiquer qu'il peut exister un potentiel de bioconcentration importante de D5 chez les poissons et d'un niveau plus faible dans le réseau alimentaire aquatique. Les valeurs de FBC prévues sont largement inférieures aux valeurs mesurées chez les poissons. On peut donc raisonnement conclure que le D5 présente un potentiel de bioaccumulation dans le biote. Toutefois, compte tenu des indications contradictoires, il est impossible d'en déduire qu'il satisfait au critère de la bioaccumulation (FBC ou FBA ≥ 5000) défini dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
De nouvelles données empiriques sur l'écotoxicité du D5 ont été obtenues; elles sont examinées en détail ci-dessous (tableau 10a). Ces études indiquent que cette substance ne présente pas d'effets nocifs sur les poissons et les daphnies exposés à des concentrations pouvant atteindre sa limite de solubilité dans l'eau (0,0017 mg/L).
L'étude de la toxicité du D5 en milieu aquatique pour la truite arc-en-ciel (Oncorhynchus mykiss) a été effectuée dans un système à écoulement continu (Springborn Laboratories, 2000). Des truites arc-en-ciel juvéniles (poids humide moyen, 2,3 g et longueur moyenne, 61 mm) ont été exposées à des concentrations mesurées de D5 (pureté de 99,35 %) de 2,1, 3,1, 5,0, 8,6 et 16 µg/L pendant 14 jours. Le système d'essai était fermé hermétiquement et rempli à capacité afin de réduire au minimum les pertes de D5 dues à la solution d'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisé comme agent solubilisant. Le pH était maintenu entre 6,3 et 6,9 et la température oscillait entre 13 et 15 °C. Les poissons étaient nourris à un taux d'environ 2 % de leur biomasse totale une fois par jour. La température pendant l'essai présentait un léger écart par rapport à celle du protocole de l'OCDE (12 ± 2 °C) et la concentration d'oxygène dissous a chuté sous les 60 % de saturation pendant plus de 24 heures; toutefois, ces éléments n'ont pas été jugés comme gênants pour le déroulement de l'essai. Le taux de mortalité variait de 5 à 10 % chez le groupe témoin négatif et chez le groupe témoin pour le solvant, les groupes traités à 0,005 et à 0,0086 mg/L présentaient respectivement des taux de mortalité de 10 et de 15 %. Toutefois, les taux de mortalité observés n'ont pas été jugés comme dus à la substance soumise à l'essai puisque le taux de mortalité était nul pour la plus forte concentration de traitement (0,0016 mg/L).
| Organisme | Type d'essai | Durée | Paramètre[1] | Valeur (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant 50 % d'effets sublétaux chez 50 % de la population; CSEO : concentration sans effet observé. | |||||
| Truite arc-en-ciel Oncorhynchus mykiss |
Tox. aiguë | 14 j | CL50 | > 0,016 | Springborn Laboratories, 2000 |
| Truite arc-en-ciel Oncorhynchus mykiss |
Tox. aiguë | 14 j | CSEO | 0,016 | Springborn Laboratories, 2000 |
| Puce d'eau Daphnia magna |
Tox. aiguë | 48 h | CL50 | > 0,003 | Springborn Smithers Laboratories, 2002 |
| Puce d'eau Daphnia magna |
Tox. chronique | 21 j | CSEO | 0,015 | Springborn Smithers Laboratories, 2003a |
| Algue d'eau douce Pseudokirchneriella subcapitata | Tox. aiguë | 96 h | CE50 | non concluante | Springborn Laboratories, 2001 |
Au cours d'études de toxicité aiguë et chronique du D5 chez les Daphnia magna, on a exposé des Daphnia magnajuvéniles à des concentrations de D5 (pureté de 99,35 %) de 1,6, 1,8, 2,1, 2,5 et 2,9 µg/l (mesurées) pendant 48 heures dans un système à écoulement continu (Springborn Smithers Laboratories, 2002). Le système d'exposition était conçu de façon à ne permettre qu'un minimum de volatilisation de la substance à l'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 7,7 et 8,0, la température oscillait entre 20 et 21 °C et la concentration d'oxygène dissous demeurait supérieure à 60 %. L'eau d'essai avait une dureté de 160 à 180 mg CaCO3/L. Un taux de mortalité inférieur ou égal à 10 % a été observé chez le groupe témoin et à la concentration des groupes à l'essai, ce qui correspond à une CE50 supérieure ou égale à 2,9 µg/L.
Un essai de toxicité sur cycle de vie complet du D5 a été effectué sur des Daphnia magna, dans des conditions de renouvellement statique (Springborn Smithers Laboratories, 2003a). Des Daphnia magna juvéniles ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 100 %, activité spécifique de 5,758 mCi/g) de 1,0, 1,7, 3,5, 7,2 et 15 µg/L pendant 21 jours dans des conditions de renouvellement statique, et les solutions d'essai étaient renouvelées toutes les 24 heures. Le système expérimental était conçu de façon à réduire au minimum les pertes de D5 en raison de la solution à l'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 6,6 et 8,7, la température oscillait entre 20 et 23 °C, et la concentration d'oxygène dissous demeurait supérieure à 60 %. L'eau d'essai avait une dureté de 160 à 170 mg CaCO3/L. À la fin de la période d'exposition de 21 jours, le nombre moyen de rejetons par femelle était de 150, 148, 145, 138 et 139 pour des concentrations de traitement de 1,0, 1,7, 3,5, 7,2 et 15 µg/L, respectivement. Ce nombre a diminué légèrement à des concentrations de traitement de 7,2 et de 15 µg/L par rapport au groupe témoin négatif et au groupe témoin pour le solvant (nombre moyen de rejetons de 146), mais cette différence n'a pas été jugée statistiquement significative. On n'a observé aucune mortalité ou croissance, ni aucun autre effet biologiquement significatif à la plus forte concentration d'essai de 15 µg/L (CSEO ≥ 15 µg/L). Pendant l'essai, la température présentait un léger écart par rapport à celle du protocole de l'OCDE (20 ± 1 °C), mais cela n'a pas été jugé comme gênant pour le déroulement de l'essai. Toutefois, le taux d'alimentation pendant l'essai de 0,41 mg C/daphnie/jour était plus élevé que celui de la ligne directrice de l'OCDE (0,1-0,2 mg C/daphnie/jour), mais on estime que cette différence favorise la santé des organismes expérimentaux qui résistent à des effets toxiques. Une charge de carbone plus élevée dans le système expérimental peut aussi contribuer à réduire la biodisponibilité du D5 en fournissant un substrat pour la sorption. Néanmoins, les données expérimentales ont été jugées acceptables aux fins de l'évaluation préalable, en indiquant les limites possibles des essais (voir ci dessus).
De nouveaux résultats expérimentaux ont été obtenus sur la toxicité aiguë au cours d'une étude sur l'algue d'eau douce Pseudokirchneriella subcapitata (auparavant connue sous le nom de Selenastrum capricornutum), dans des conditions statiques de 96 heures (Springborn Laboratories, 2001). L'essai de toxicité était conforme aux normes expérimentales de la TSCA et de l'OCDE pour les algues. Les algues étaient exposées à une solution saturée de D5 (99,35 % d'ingrédient actif). Le système d'essai était fermé hermétiquement et rempli à capacité afin de réduire au minimum les pertes de D5 dues à la solution d'essai. De l'acétone à une concentration de 0,1 mL/L a été utilisé comme agent solubilisant. Toutefois, les concentrations de la solution d'essai ont diminué constamment de 12 µg/L au début de l'essai à environ 2 µg/L à la fin de l'essai de 96 heures. L'hypothèse selon laquelle les pertes de D5 pourraient être dues à la volatilisation, à l'adsorption de D5 par la biomasse des algues ou à sa consommation comme source de carbone par les algues. L'hydrolyse dans des conditions alcalines peut également contribuer à une perte rapide de D5 à mesure que le pH augmente de 7,5 au début de l'essai à 9,4 au bout de 96 heures, ce qui indique la photosynthèse a lieu et que les algues respirent. Pendant l'étude, la température était maintenue à 24 °C. Il a donc été conclu qu'aucune diminution de la densité des cellules ou de la vitesse de croissance n'avait été observée pendant l'essai. Une quantité supplémentaire de 500 mg/L de bicarbonate de sodium a été ajoutée afin d'assurer la présence d'une concentration suffisante de bicarbonate dissous pour compenser la croissance des cellules dans un système fermé. Compte tenu de la réduction significative des concentrations de D5 pendant l'essai et de tous les facteurs d'incertitude associés à l'étude, les résultats de cet essai ont été jugés comme invalides.
La toxicité aiguë et chronique du D5 a été évaluée à l'aide du modèle ECOSAR (2004). Les résultats prévus sont présentés dans le tableau 10b.
| Organisme | Type d'essai | Paramètre[1] | Durée | Concentration (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CE50 : concentration minimale causant des effets sublétaux chez 50 % de la population; ChV correspond à la moyenne géométrique de la CSEO (concentration sans effet observé) et de la CMEO (concentration minimale avec effet observé). | |||||
| Poissons | Tox. chronique | ChV | 30 j | 0,0002 | ECOSAR, 2004 |
| Daphnies | Tox. chronique | CE50 | 16 j | 0,000732 | ECOSAR, 2004 |
| Algue verte | Tox. chronique | ChV | 96 h | 0,003 | ECOSAR, 2004 |
Les résultats modélisés à l'aide d'ECOSAR pour le D5 étaient inférieurs à la limite de solubilité dans l'eau (0,017 mg/L), ce qui semble indiquer qu'il y aurait des effets aigus ou chroniques en cas de saturation aqueuse. Toutefois, la fiabilité des valeurs prévues relatives à la toxicité est jugée faible. La valeur de log Koe pour le D5 (8,03) est à peine plus élevée que le seuil de log Koerecommandé par le modèle ECOSAR (8,0) pour la prévision de la toxicité chronique à l'aide des relations structure-activité applicables aux composés organiques neutres et l'absence de données empiriques sur les siloxanes dans l’ensemble d’étalonnage du modèle restreint à leur prise en considération dans cette évaluation. De même, la fiabilité des prévisions sur la toxicité aiguë et chronique au microgramme par litre et en dessous de ce seuil devient de plus en plus incertaine, étant donné que ces prévisions se fondent uniquement sur la valeur de log Koe et la capacité empirique à quantifier les effets dans cette plage varie énormément. Les données sur la toxicité de l'eau prévues à l’aide du modèle n'ont dès lors pas été prises davantage en considération.
Les données empiriques suggèrent que le D5 ne présente aucun effet nocif chez les poissons et les daphnies à des concentrations égales ou inférieures à sa limite de solubilité (0,017 mg/L). Il convient néanmoins d'interpréter ces résultats avec précaution. Tel qu'il est mentionné dans les études de toxicité menées avec l’analogue D4 chez les truites et les daphnies, la mortalité due au D4 n'a été observée qu'après une période d'exposition de 7 à 14 jours des organismes analysés, moment auquel la concentration en D4 dans les tissus des poissons atteint l'équilibre et la charge corporelle suffisante pour produire des effets toxiques (Sousa et al., 1995). En ce qui a trait au D5, il était difficile de déterminer si les concentrations présentes dans les tissus ont atteint l’équilibre en 14 jours durant l'étude du FBC chez les têtes-de-boule (Drottar, 2005). Cette observation soulève la question à savoir si la durée de l’essai de toxicité du D5 mené durant 14 jours chez les truites (Springborn Laboratories, 2000) était assez longue pour permettre d’atteindre une charge corporelle toxique dans les tissus des poissons et donc pour établir la toxicité dans le cadre de l’étude Il a également été observé que la mortalité due au D4 n'avait été détectée que dans les truites arc-en-ciel de petite taille (≤ 1 g) et non dans les truites de plus grande taille ou d’autres espèces de poissons, indiquant ainsi que le D4 pourrait être plus toxique pour les organismes aquatiques sensibles et/ou pour les organismes aquatiques aux premiers stades sensibles de leur vie. Cependant, le D5 a été testé uniquement avec des truites plus grandes (environ 2,3 g), et aucun essai au stade précoce de l'existence n'a été réalisé. Étant donné la structure semblable du D4 et du D5, la toxicité du D5 pourrait avoir été observée si des truites plus petites avaient été utilisées. Dès lors, des questions concernant l'adéquation de la durée des tests, une absence de données empiriques comparables à celles dans lesquelles la toxicité du D4 a été notée (c.-à-d. taille des poissons comparable), ainsi qu'une absence de données empiriques pour les poissons à un stade précoce de leur existence, contribuent à l'incertitude relative à la toxicité du D5 pour les organismes aquatiques.
B – Dans d’autres milieux
Dans les sédiments
De nouvelles données empiriques sur la toxicité du D5 dans les sédiments ont été obtenues et elles ont été acceptées pour ce rapport d'évaluation préalable.
Un essai de toxicité sur cycle de vie complet du D5 dans les sédiments a été effectué avec des moucherons (Chironomus riparius), au cours d'une série d'expositions de 10 et de 28 jours dans des conditions statiques (Springborn Smithers Laboratories, 2003b). Des larves de moucheron ont été exposées à des concentrations mesurées de D5 radiomarqué au 14C (pureté radiochimique de 99,37 %) incorporées aux sédiments, comprises entre 13 et 580 mg/kg (concentration moyenne mesurée à partir du jour d'essai 0 et du jour d'essai 10) et entre 12 et 570 mg/kg (concentration moyenne mesurée à partir des jours d'essai 0, 10 et 28). Des sédiments artificiels composés de 79 % de sable, de 4 % de limon et de 17 % d'argile ont été utilisés. Les essais ont été effectués avec des sédiments présentant une teneur en carbone organique de 2 %. Le pH mesuré des sédiments était compris entre 6,6 et 7,6 et la température mesurée, entre 19 et 22 °C. Les taux de survie des moucherons déterminés après 10 jours d'exposition étaient de 100, 97, 98, 97 et 27 % pour des concentrations de traitement de 13, 30, 73, 180 et 580 mg/kg, respectivement. Le poids humide moyen déterminé après 10 jours d'exposition était de 5,59, 5,65, 4,77, 4,44 et 1,36 mg/moucheron pour des concentrations de traitement de 13, 30, 73, 180 et 580 mg/kg, respectivement. Une CL50 de 10 jours de 450 mg/kg en poids sec a été calculée pour la survie des moucherons et une CE50 de 410 mg/kg en poids sec a été calculée pour leur croissance (tableau 8c). Les taux d'émergence et de développement des larves de moucheron ont été déterminés après 28 jours d'exposition. Le taux d'émergence moyen pour la concentration de traitement de 470 mg/kg était notablement plus faible (18 %) que celui du groupe témoin (87 %), tout comme les taux de développement moyens des moucherons mâles pour les concentrations de traitement de 180 et de 570 mg/kg avaient notablement diminués par rapport à ceux du témoin. La diminution des taux de développement moyens obtenus pour les femelles et pour les deux sexes n'était significative qu'à une concentration de traitement de 570 mg/kg. Pour le développement des larves de moucheron, la CSEO de 28 jours était de 69 mg/kg et la CMEO, de 180 mg/kg (tableau 10c).
| Organisme | Type d'essai | Paramètre[1] | Valeur (mg/kg en poids sec) | Références |
|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant des effets sublétaux chez 50 % de la population; CSEO : concentration sans effet observé. CMEO : concentration minimale avec effet observé. | ||||
| Moucheron Chironomus riparius |
Tox. aiguë | CL50 | 450 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. aiguë | CE50 | 410 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des mâles | 69 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour le développement des mâles | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des femelles | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement des deux sexes | 180 | Springborn Smithers Laboratories, 2003b |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour l'émergence | 180 | Springborn Smithers Laboratories, 2003b |
| Oligochète Lumbriculus variegates |
Tox. chronique | CSEO | 1 272 | Krueger et al., 2007 |
| Moucheron Chironomus riparius |
Tox. chronique | CL50 | 257 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour le développement | 70 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour le développement | 160 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CSEO pour l'émergence | 160 | Krueger et al., 2008 |
| Moucheron Chironomus riparius |
Tox. chronique | CMEO pour l'émergence | 248 | Krueger et al., 2008 |
Une évaluation critique d'une étude de toxicité chronique récente (Krueger et al., 2007) chez un oligochète d'eau douce, Lumbriculus variegates (ver de terre), a été effectuée, puis acceptée pour cette évaluation préalable. Les vers adultes étaient exposés à des concentrations mesurées de D5 (pureté de 99,19 %) incorporées dans les sédiments, comprises entre 24 et 1 272 mg/kg (concentration moyenne mesurée à partir des jours d'essai 0, 7 et 28) pendant 28 jours, dans des conditions d'écoulement continu. On a utilisé des sédiments formulés composés de 13 % de sphaigne, de 10 % de kaolin et de 77 % de sable de quartz industriel. Le pH mesuré des sédiments était compris entre 7,9 et 8,3 et la température mesurée, entre 22,7 et 23,4 °C (protocole de l'OCDE, 20+/-2). La teneur en carbone organique des sédiments était de 3,7 % si l'on suppose que la sphaigne est la seule source de carbone organique. Étant donné que les vers se sont reproduits pendant l'essai de 28 jours et qu'il était difficile de distinguer un adulte d'un jeune, le nombre total d'organismes présents à la fin de l'essai a été utilisé comme paramètre. Le nombre moyen de vers était de 33, 30, 31, 21, 19 et 26 pour des concentrations de traitement de 24, 46, 94, 226, 495 et 1 272 mg/kg en poids sec, respectivement. Aucune mortalité n'a été observée pendant toute la durée de l'essai. Il a été conclu que les nombres moyens n'étaient pas notablement différents de ceux du groupe témoin (26). Aucun effet sur la croissance des vers survivants n'a été observé et une CSEO de 1 272 mg/kg a été déterminée.
Une autre étude prolongée sur la toxicité des sédiments chez le moucheron, Chironomus riparius, a été menée en utilisant des sédiments enrichis (Krueger et al., 2008). Les moucherons ont été exposés à des concentrations moyennes mesurées de D5 allant de 35 mg/kg à 759 mg/kg pendant 28 jours à 20 ºC. La teneur en carbone organique des sédiments formulés était de 3,2 %. L'eau de surface a été partiellement renouvelée toutes les semaines en raison de la teneur élevée en ammoniaque mesurée dans l'enceinte d'essai. On a déterminé que la CSEO observée pour le pourcentage de survie et le taux d'émergence était de 160 mg/kg (mesurée). La valeur de la CL50 calculée pour la survie était de 257 mg/kg. Les moucherons exposés à 160 mg/kg de D5 ont présenté une réduction statistiquement significative du développement. On a déterminé que la CSEO et la CMEO pour le développement des moucherons étaient respectivement de 70 mg/kg et de 160 mg/kg.
Dans le sol
Aucune étude concernant les effets du D5 ou de ses analogues sur les organismes du sol n'a été trouvée.
Dans le milieu terrestre
Aucune étude écologique pour les animaux sauvages terrestres n'a été trouvée. Les études en laboratoire sur des mammifères sont examinées dans la section « Potentiel d'effets nocifs sur la santé humaine » de la présente évaluation préalable.
Évaluation de l'exposition de l’environnement
Dans l’air
Des mesures environnementales préliminaires de méthylsiloxanes volatils, dont le D5, ont été effectuées en février et mars 2006 dans la région des Grands Lacs au Canada (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Dix-huit échantillons d'air extérieur provenant de régions rurales et urbaines de l'Ontario ont été prélevés et le D5 était présent dans presque tous ces échantillons à des concentrations de moins de 1 µg/m3, à l'exception d'une concentration relativement élevée de D5 d'environ 20,5 µg/m3 signalée dans la région urbaine de Toronto. Ce résultat concorde avec les valeurs déclarées par d'autres instances (tableau 11a).
Il est cependant possible que la détection de D5 dans l'air ambiant soit partiellement attribuable à la contamination des échantillons. Les cyclosiloxanes volatils sont présents dans une gamme étendue de produits commerciaux, et les représentants des programmes de surveillance du Canada et des pays nordiques ont indiqué qu'ils avaient eu des problèmes de concentrations élevées de cyclosiloxanes dans des blancs d'échantillons. La méthode utilisée pour mesurer et analyser les concentrations dans l'air à des valeurs comprises entre des ng/m3 et quelques µg/m3 est toujours en voie d'élaboration. Très peu de mesures effectuées en double sont disponibles pour la surveillance de l'air extérieur et les rares qui le sont ont une mauvaise reproductibilité. Selon une hypothèse, il pourrait être important de tenir compte de la phase particulaire parce qu'elle pourrait influencer les résultats dans le cas des essais en double (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Des échantillons extérieurs (n = 24) ont été recueillis dans les pays nordiques. La limite de détection était égale à 0,02 µg/m3 pour le D5. [2] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. |
|||
| Air | Région des Grands Lacs, Canada; février et mars 2006 | < 1-20,5 µg/m3 | Voir la note 2 |
| Air | Pays nordiques[1]; 2004-2005 | 0,05-19 µg/m3; | Norden, 2005 |
Dans l’eau
Au Canada, on a échantillonné l'eau de 9 stations d'épuration des eaux d'égout (SEEE), dans des grands centres urbains du sud-ouest de l'Ontario, y compris dans des lagunes et dans des installations de traitement secondaire et tertiaire de l'eau en octobre et pendant l'hiver 2005 (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures; ne figure pas dans les références). Du D5 a été détecté à des concentrations de 0,49 à 227,72 µg/L et de 1,00 à 2,92 µg/L, respectivement, dans les affluents et les effluents. Des différences saisonnières ont été remarquées dans les concentrations de D5 des affluents de SEEE; la plupart d'entre elles passaient d'une valeur comprise entre 0,49 et 57,33 µg/L en automne à une valeur comprise entre 8,04 et 227,72 µg/L en hiver. Des changements saisonniers des concentrations de D5 dans les effluents ont également été observés, mais ils n'étaient pas aussi significatifs que ceux observés dans les affluents (entre 1,00 et 1,30 en automne et entre 1,65 et 2,29 en hiver).
D'autres instances ont déclaré des résultats de surveillance semblables (tableau 11b). Aux États-Unis, du D5 a été détecté qualitativement dans des réseaux d'eau potable (Lucas, 1984, cité par l'Agence de protection de l’environment des États-Unis [U.S. EPA, 1992]). En Europe, des échantillons d'eau ont également été prélevés dans les affluents et les effluents de SEEE et en aval de celles-ci, notamment dans certains lieux associés à des installations de fabrication de silicone (Boehmer et Gerhards, 2003; voir tableau 11b). Des concentrations plus élevées de D5 ont été détectées dans les affluents et les effluents des SEEE associées à ces installations. La plupart des échantillons d'eau prélevés en aval des usines de silicone contenaient des concentrations non détectables de D5. Cependant, dans un cas, une concentration de 0,4 µg/L a été déclarée.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 28 sites d'échantillonnage excluant les affluents et les effluents de SEEE [2] 7 sites d'échantillonnage des affluents de SEEE [3] 12 sites d'échantillonnage des effluents de SEEE [4] Un total de 12 échantillons d'eau de mer recueillis à 2 emplacements [5] 7 échantillons d'affluents de SEEE recueillis [6] 4 échantillons d'effluents de SEEE recueillis [7] Un total de 5 échantillons recueillis à 2 emplacements [8] Un total de 8 échantillons recueillis à 3 emplacements [9] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. l.d. = limite de détection |
|||
| Affluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 0,49-227,72 µg/L | Voir la note 9 |
| Effluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 1,00-2,29 µg/L | Voir la note 9 |
| Eau potable | États-Unis | Détection qualitative | Lucas, 1984, cité par la U.S. EPA, 1992 |
| Eau | Sites de fond et sites urbains[1], pays nordiques | < 0,07 (l. d.) | Norden, 2005; NILU, 2007 |
| Eau | Allemagne[4]; 2000-2001 | < 0,04 µg/L (l. d.) | Boehmer et Gerhards, 2003 |
| Affluents de SEEE | Pays nordiques[2] | 0,33-26 µg/L | Norden, 2005; NILU, 2007 |
| Effluents de SEEE | Pays nordiques[2] | < 0,063-1,0 µg/L | Norden, 2005; NILU, 2007 |
| Affluents de SEEE | Allemagne[5]; 2000-2001 | 1,3-50,1 µg/L | Boehmer et Gerhards, 2003 |
| Effluents de SEEE | Allemagne[6]; 2000-2001 | 0,1-1,0 µg/L | Boehmer et Gerhards, 2003 |
| Affluents de SEEE | SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[7], 2001 | 365-3 694 µg/L | Boehmer et Gerhards, 2003 |
| Effluents de SEEE | SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[8], 2001 | < 0,02 (l. d.)- 26,7 µg/L | Boehmer et Gerhards, 2003 |
| Eau | En aval de SEEE associées à des usines de silicone en Allemagne, en France et au Royaume-Uni[9], 2001 | < 0,02 (l. d.)-0,4 µg/L | Boehmer et Gerhards, 2003 |
Dans les sédiments
Au Canada, on a dosé le D4, le D5 et le D6 de sédiments de surface et de carottes de sédiments prélevés dans le lac Ontario en juillet 2006 (Powell et Kozerski, 2007). Les sédiments de surface étaient constitués de la couche supérieure de 5 cm de sédiments du port de Toronto et du bassin de Kingston. Les carottes de sédiments prélevées dans les bassins de Rochester, de Mississauga et de Niagara ont été découpées en strates d'une épaisseur de 5 mm. Les sédiments de surface du port de Toronto et du bassin de Kingston contiennent une teneur en carbone organique total modérée (COT = 2,1-2,4 % p. s. [poids sec]) alors que les carottes de sédiments contiennent une teneur en COT élevée (4-5 % p. s.). Une analyse de perte par calcination des sédiments a également indiqué des teneurs en eau plus faibles dans les sédiments de surface (55-70 % p. h. [poids humide]) que dans les carottes de sédiments (80-89 %). On sait que les sédiments du port de Toronto et des quatre bassins sédimentaires sont contaminés par divers composés organiques qui pénètrent dans le lac par des rejets directs d'eaux usées traitées, qui s'écoulent des Grands Lacs supérieurs (Érié, Huron et Michigan) et de la rivière Niagara ou qui proviennent du dépôt atmosphérique. Les sédiments de surface du port de Toronto contenaient les plus fortes concentrations de D5 (0,78 µg/g en poids sec). Par contre, les concentrations de siloxanes cycliques dans les sédiments de surface et les carottes de sédiments des quatre bassins sédimentaires étaient toutes inférieures à la limite de détection de la méthode analytique, qui était fixée à 0,017 µg/g pour le D5. D'autres instances ont déclaré des résultats de surveillance semblables dans lesquels du D5 était détecté dans les sédiments de surface de régions urbaines et de sources ponctuelles (tableau 11c).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire des échantillons de sédiments de surface et de carottes de sédiments n'a pas permis de détecter de D5, la limite de détection étant fixée à 15,9 ng.
Les résultats de surveillance des sédiments pour les zones du lac Opeongo et du lac Ontario semblent indiquer qu'il est plus probable de détecter une contamination au D5 à proximité des centres urbains et des sources ponctuelles.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 30 sites d'échantillonnage de sédiments [2] Un total de 11 matrices d'échantillonnage de 9 emplacements [3] Un total de 12 échantillons de sédiments marins provenant de 2 régions [4] Masse de référence corrigée telle qu’elle est mentionnée dans l’étude préliminaire p.s. = poids sec; l.d. = limite de détection; l.q. = limite de quantification |
|||
| Sédiments de surface | Port de Toronto (Canada); juillet 2006 | 0,78 µg/g p.s. | Powell et Kozerski, 2007 |
| Sédiments de surface | Bassin de Kingston (Canada); juillet 2006 | < 0,017 µg/g p.s. (l.d.) | Powell et Kozerski, 2007 |
| Carottes de sédiments | Bassins de Rochester, de Mississauga et de Niagara (Canada); juillet 2006 | < 0,017 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Sédiments de surface | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | 15,9 ng (l.d.)[4] | Powell, 2008 |
| Carottes de sédiments | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | 15,9 ng (l.d.) [4] | Powell, 2008 |
| Sédiments | Pays nordiques[1] | < l. d. (variations entre les échantillons) – 0,92 µg/g p.s. |
Norden, 2005; NILU, 2007 |
| Sédiments de cours d'eau | Allemagne[2] | < 0,003 (l.q.)-0,042 µg/g p.s. | Boehmer et Gerhards, 2003 |
| Sédiments marins | Allemagne[3] | 0,033-0,28 µg/g p.s. | Boehmer et Gerhards, 2003 |
Dans le sol
Le D5 peut pénétrer dans le sol par l'application de boues d'épuration sur les terres agricoles. Aucune donnée de surveillance n'a été relevée au Canada concernant la présence du D5 dans les boues d'épuration. En Europe, le D5 est présent dans les boues d'épuration à des concentrations allant de quelques mg/kg à 130 mg/kg en poids sec (Norden, 2005; Kaj et al., 2005; NILU, 2007).
Aucune donnée de surveillance n'est disponible à propos du D5 dans le sol au Canada. Les concentrations de D5 dans deux échantillons de sol des îles Féroé étaient inférieures à la limite de détection (< 5 ng/g p. s.) [Norden, 2005].
Dans le biote
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire d'échantillons de zooplancton n'a pas permis de mettre en évidence la présence de D5. Les échantillons représentatifs de zooplancton ont été regroupés en un échantillon unique pour chacun des deux emplacements sans être classés par espèce. La limite de détection était de 15,9 ng (masse de référence corrigée).
En Europe, le D5 était le cyclosiloxane prédominant dans le foie des poissons et chez les mammifères marins, selon les résultats du programme d'évaluation préalable des pays nordiques. Ce produit a été détecté chez les poissons d'eau douce et de mer dans les sites d'échantillonnage des régions urbaines et voisines des SEEE, dans une fourchette de concentrations allant de moins de 5 à 84 ng/g en poids humide, sauf pour un échantillon de foie de morue (composé de neuf foies) recueilli à proximité d'un centre-ville, en Norvège, qui présentait une concentration extrêmement élevée de D5 (2 200 ng/g en poids humide). Le programme de suivi des effets sur l'environnement mené par le gouvernement norvégien a permis de confirmer les concentrations de D5 initiales rapportées pour les foies de morue (NILU, 2007; voir tableau 11d). Dans le cadre du même programme de suivi, du D5 a également été détecté dans des moules communes, dans les foies et les filets de limandes à queue jaune et dans le contenu de l'estomac de morues de Norvège. Les concentrations variaient selon les espèces, le sexe et l'âge. Du D5 a également été détecté dans le petit lard de phoques et de globicéphales à des concentrations comprises entre moins de 5 et 24 ng/g en poids humide (Norden, 2005). Du D5 a par ailleurs été identifié dans des échantillons de poissons en Allemagne à des concentrations comprises entre 0,15 et 2,6 mg/kg (SEHSC, 2005a). Il n'a en revanche pas été détecté en Suède dans des échantillons de muscles de poissons (Kaj et al., 2005).
La présence de D5 dans le biote en Europe indique que malgré les faibles concentrations détectées, voire la non-détection, de la substance dans l'habitat des poissons ou à proximité, le D5 est présent dans l'environnement pour l'absorption par le biote et l'accumulation dans celui-ci.
| Organisme | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 11 matrices d'échantillonnage pour les poissons d'eau de mer [2] Un total de 10 matrices d'échantillonnage pour les poissons d'eau douce [3] Un total de 7 matrices d'échantillonnage pour les mammifères marins [4] Un total de 17 matrices d'échantillonnage pour les œufs d'oiseaux de mer [5] Un total de 3 matrices d'échantillonnage pour les moules [6] Un total de 2 matrices d'échantillonnage pour la limande à queue jaune [7] Un total de 3 matrices d'échantillonnage pour la morue [8] Un total de 5 matrices de poisson a été prélevé dans le Rhin; un saumon danois provenant d’un emplacement non spécifié ne présentait pas de quantité détectable de D5 p. h. = poids humide; l. d. = limite de détection; l. q. = limite de quantification |
|||
| Zooplancton | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | < 15,9 ng/g (l.d.) | Powell, 2008 |
| Foie de poissons d'eau de mer | Pays nordiques[1], 2002-2004 |
< 5 (l. d.)-2 200 ng/g p.h. | Norden, 2005 |
| Foie de poissons d'eau douce | Pays nordiques[2]; 2002 | < 5 (l. d.)-84 ng/g p.h. | Norden, 2005 |
| Mammifères marins | Pays nordiques[3]; 2002 | < 5 (l. d.)-24 ng/g p.h. | Norden, 2005 |
| Œufs d'oiseaux de mer | Pays nordiques[4], 2000-2005 |
< 5 ng/g p. h. (l.d.) | Norden, 2005 |
| Moules communes | Norvège[5]; 2006 | 3,3-8,7 ng/g p.h. | NILU, 2007 |
| Foies de limandes à queue jaune | Norvège[6]; 2006 | 27,1 ng/g p.h. | NILU, 2007 |
| Filets de limandes à queue jaune | Norvège[6]; 2006 | 3,4 ng/g p.h. | NILU, 2007 |
| Contenu de l'estomac de morues | Norvège[7]; 2006 | 22,9-149,3 ng/g p.h. | NILU, 2007 |
| Foies de morues | Norvège[7]; 2006 | 1 490,8-1978,5 ng/g p.h. | NILU, 2007 |
| Poissons | Fleuve Rhin[8], en Allemagne | 150-2600 ng/g p.h. | SEHSC, 2005b |
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable a consisté à examiner les divers renseignements à l’appui de la caractérisation et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence prévus à l’article 76.1 de la LCPE (1999). Une attention particulière a été accordée à l'analyse du quotient de risque, à la persistance, au potentiel de bioaccumulation, à la toxicité, aux sources et au devenir dans l'environnement.
Selon les renseignements disponibles, le D5 a été identifié comme très persistant dans l'eau et comme présentant un potentiel de bioaccumulation dans les organismes aquatiques. Une évaluation quantitative du quotient de risque de l'exposition et des effets écologiques a donc été réalisée dans le cadre de l'évaluation de l’ensemble des données concernant le potentiel d'effets nocifs du D5.
Dans le milieu aquatique, les résultats de deux études expérimentales acceptables sur la toxicité chronique chez des Daphnia magna et des truites arc-en-ciel indiquent que le D5 n'a eu aucun effet nocif significatif à des concentrations pouvant atteindre 0,015 mg/L, cette valeur étant très proche de la limite de solubilité dans l'eau de la substance (env. 0,017 mg/L). Aucun facteur d'application n’a été appliqué à la CSEO chronique de 0,015 mg/L. La concentration estimée sans effet (CESE) est donc de 0,015 mg/L. On considère que l'exposition au D5 chez les organismes aquatiques peut atteindre un niveau supérieur à sa solubilité dans l'eau mesurée dans des conditions environnementales réalistes.
Le D5 a été soumis à une analyse du quotient de risque (QR) qui intègre le niveau d'exposition et un seuil de toxicité. Pour tenir compte du risque du D5 à l'échelle du Canada, on a déterminé une distribution établissant le profil des quotients de risque dans l'eau au niveau de plusieurs sites de rejet de la substance par l'industrie ou les consommateurs (c.-à-d. des stations municipales d’épuration des eaux d’égout). Ce type d'analyse fournit des éléments utiles à l'évaluation des risques d'une substance lorsqu’il est impossible d’établir totalement l'ensemble des emplacements géographiques des rejets effectués par l'activité industrielle et les consommateurs de cette substance.
En particulier, lorsque divers secteurs industriels utilisent une substance sans qu’on puisse identifier les installations effectivement impliquées, on peut alors estimer l'exposition en milieu aquatique pour tous les emplacements des installations ayant un lien avec ces secteurs. Par ailleurs, des informations concernant des rejets potentiels attribuables à une utilisation par les consommateurs peuvent être intégrées aux calculs. Une concentration environnementale estimée (CEE) pour le milieu aquatique est déterminée en fonction des quantités utilisées déterminées à partir des réponses à l'enquête menée en application de l’article 71 et des estimations concernant les rejets effectués par l'activité industrielle et les consommateurs. Les eaux réceptrices sont un cours d'eau ou un lac, et un facteur de dilution basé sur la superficie des eaux réceptrices (10 au maximum) est utilisé pour estimer la CEE. Le quotient de risque propre à chacun des sites est ensuite déterminé pour la colonne d'eau. La distribution indique non seulement la proportion ou le nombre de sites dépassant le seuil, mais également l'ordre de grandeur de ce dépassement pour chaque site. Des informations complémentaires sur la méthode utilisée figurent dans le rapport d'Environnement Canada (2008b).
L'analyse des rejets des consommateurs se fonde sur une base de données répertoriant près de 1 000 lieux (ou sites) d'élimination municipaux représentant environ les deux tiers de la population canadienne. L'analyse des rejets industriels a été effectuée pour 64 sites liés à 87 installations industrielles identifiées par leur code NAICS comme des utilisateurs potentiels de D5. Au total, dans ces scénarios, 65 (env. 6,8 %) des lieux d'élimination municipaux évalués au Canada présentent un risque pour les organismes aquatiques, avec des QR supérieurs à 1 (voir la figure 1). L'équation et les paramètres utilisés pour calculer la CEE dans les cours d'eau récepteurs sont décrits dans le rapport d'Environnement Canada (2008c).
Figure 1. Distribution du risque du D5 pour le milieu aquatique (Environnement Canada, 2008b; id., 2008c)
Bien qu'une analyse du quotient de risque ait été effectuée pour le D5, les données empiriques relatives à l'écotoxicité laissent penser que le seuil auquel des effets nocifs sur le biote pélagique sont censés se produire n'a pas été observé durant les essais de toxicité dont on dispose. Dès lors, les QR calculés dans le scénario ci-dessus sont essentiellement « sans limite » et peuvent ne pas représenter les effets observables « réels » prévus aux sites susmentionnés.
La valeur de log Koe élevée pour le D5 tend à indiquer que celui-ci se trouve dans la classe des produits chimiques « superhydrophobes » qui sont souvent associés à une biodisponibilité faible pour le biote pélagique et benthique. Toutefois, étant donné que la valeur de log Koe pour le D5 n'est pas supérieure à environ 8,0 et qu'une valeur seuil pour les effets dans le biote benthique a été observée, on prévoit un certain degré de biodisponibilité dans l'environnement, en particulier pour les expositions à plus long terme. Les données de laboratoire sur la bioconcentration, bien qu'elles soient optimisées, ainsi que des données prouvant la détection dans le biote prélevé sur le terrain suggèrent que la possibilité pour que la charge corporelle atteigne des niveaux internes critiques peut ne pas être limitée par la biodisponibilité prévue du D5, en particulier près des émissaires d'évacuation des stations d’épuration des des eaux d’égout.
Le profil du D5 en matière de propriétés physiques et chimiques, de bioconcentration et d'écotoxicité ne fournit pas de base consensuelle à l’établissement d’une conclusion définitive. Il existe certaines incertitudes quant à savoir si le D5 présente un potentiel d’effets nocifs sur l’environnement. Le D5, dont de grandes quantités sont importées au Canada, est considéré comme persistant dans l’environnement. Selon les informations disponibles, les quantités de D5 importées et utilisées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988). La tendance étant à une augmentation de son utilisation, ses rejets dans l'environnement et le potentiel d'exposition de l’environnement pourront augmenter également.
Compte tenu de ce qui précède, il faut donc appliquer de manière acceptable le principe de prudence. C’est pourquoi il est conclu que le D5 présente un potentiel d'effets nocifs sur l'environnement lorsqu’il est rejeté dans l’environnement au Canada, notamment pour des périodes d’exposition à long terme près des lieux d’élimination.
Incertitudes dans l'évaluation des risques pour l’environnement
Le D5 est l'un des principaux composants du no CAS 69430-24-6 et est également présent dans les PDMS dans des proportions pouvant atteindre 3 %. Or, le n° CAS 69430-24-6 (ou cyclométhicone représentant le mélange) et les PDMS ne figurent pas sur la liste des substances contrôlées dans le cadre du Défi du gouvernement canadien lancé à l'industrie et aux autres parties intéressées (Canada, 2007). Bien qu'il soit établi que certaines sociétés ont déclaré divers cVMS dans le mélange dans le cadre de l'enquête, les quantités de ces substances importées au Canada et leurs utilisations en 2006 ne sont pas totalement connues, et leurs rejets dans l'environnement au pays ne sont pas entièrement pris en compte dans le présent rapport d'évaluation préalable.
Plusieurs facteurs contribuent à l'incertitude de l'évaluation de la toxicité dans le milieu aquatique. Figurent parmi ceux-ci une absence d'études de toxicité avec des poissons d'une taille comparable à celle des poissons pour lesquels la toxicité a été prouvée avec les mêmes quantités de composés volatils de type méthylsiloxane (cVMS) et de D4, une absence d'études de toxicité avec des poissons à des stades précoces de leur existence, une absence d’essais où les expositions sont quelque peu supérieures à la limite d'hydrosolubilité et des préoccupations selon lesquelles la durée d'exposition était insuffisante pour atteindre des concentrations tissulaires stables. Pour l'analyse de distribution du risque, la CSEO a été calculée à partir d'une étude de toxicité chronique du D5 sur des Daphnia magnaà une concentration très proche de sa limite de solubilité dans l'eau (env. 0,017 mg/L). Cette CSEO étant la concentration maximale (sans limite) de l’essai, aucun facteur d'application n’a été employé pour extrapoler des données sur le terrain à partir de données de laboratoire en raison de l'absence d'effets nocifs significatifs observés à cette concentration. Des effets nocifs chroniques pourraient se produire étant donné la variabilité probable de la solubilité dans l'eau dans des conditions environnementales réalistes et l’ingestion possible du D5 par des organismes aquatiques du fait de sa fixation à des matières organiques en suspension provenant de SEEE (susceptibles de contenir une concentration de D5 supérieure à la solubilité de la substance dans l'eau [voir tableau 9b]). Puisqu'on ne disposait d'aucune information relative aux rejets liés aux activités industrielles pour l'analyse de distribution du risque, il est considéré que les rejets dans les eaux usées sont répartis de manière uniforme entre les 64 sites industriels évalués. En réalité, certains sites industriels peuvent utiliser davantage de D5 que d'autres, ce qui génère des rejets plus importants dans les lieux d'élimination municipaux associés à ces sites et donc un risque supérieur aux prévisions. Dans l'analyse, on a appliqué, aux concentrations de distribution, une dilution instantanée des effluents des SEEE dans les eaux réceptrices. Toutefois, dans des conditions environnementales réalistes, la dilution instantanée ne peut pas être obtenue au-delà d'une certaine distance du point de rejet et la zone proche du point de rejet d'une SEEE peut présenter un risque supérieur aux prévisions.
Les sédiments sont un sujet de préoccupation important concernant le D5. Les études de dégradation du D4 dans les sédiments qui ont été utilisées pour le D5 comportaient des incertitudes. L'extrapolation des demi-vies à faible température dans les sédiments selon les données d'hydrolyse peut également contribuer à l'incertitude globale concernant la persistance dans les sédiments. Les données limitées relatives au potentiel de bioaccumulation dans ce milieu ajoutent également à l'incertitude globale de l'évaluation écologique.
Les données disponibles concernant la bioconcentration ainsi que les valeurs du facteur de bioamplification et d'accumulation dans les sédiments pour le D5 sont contradictoires. On note un manque de données de terrain sur le potentiel de bioaccumulation par la chaîne alimentaire et chez les organismes non aquatiques.
Les prévisions des modèles ont également été intégrées à la présente évaluation préalable. Il existe des incertitudes concernant les valeurs prévues car seuls quelques siloxanes ou produits chimiques avec des valeurs de log Koe élevées (> 8) ont été étudiés et intégrés aux modèles. La toxicité inhérente prévue des organismes aquatiques peut constituer une source supplémentaire d'incertitude lorsque les concentrations dépassent la solubilité dans l'eau de la substance chimique. Puisque les concentrations pour la toxicité et la solubilité dans l'eau dans des conditions environnementales réalistes sont souvent incertaines (écart par rapport aux conditions en laboratoire optimales), les valeurs de toxicité qui dépassent les estimations de solubilité jusqu'à un facteur de 1 000 ont été acceptées au cours de la catégorisation.
Les données de surveillance environnementale au Canada et ailleurs sont limitées. La contamination des échantillons est un problème possible pour la surveillance environnementale en raison des nombreuses utilisations du D5. Les données disponibles sur les concentrations environnementales de D5 dans le biote et dans les eaux de surface au Canada sont limitées et peu de concentrations environnementales ont été signalées pour des régions à l'extérieur des zones urbaines du Canada. Pour ces raisons, le présent rapport utilise des données de surveillance de pays européens. La surveillance a cependant également été identifiée comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et le D5 a été pris en compte pour la surveillance environnementale dans le cadre de ce plan. La surveillance environnementale contribuera à une meilleure compréhension de la présence environnementale et du potentiel réel d'accumulation de la substance dans l'environnement.
Évaluation de l'exposition
La section « Évaluation de l'exposition de l’environnement » de ce rapport présente les données sur les concentrations de D5 détectées dans les milieux naturels, notamment dans l'air ambiant à proximité et à distance des sources ponctuelles, des eaux de surface, des sédiments, des boues d'épuration et du biote. Les données non publiées du Canada incluent des mesures des biogaz dans les décharges (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références), des mesures dans l'air à proximité et à distance de sources ponctuelles (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références), des mesures dans l'air et les affluents et effluents de stations d'épuration des eaux usées (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures; ne figure pas dans les références) ainsi que des mesures dans les sédiments des Grands Lacs (Powell et Kozerski, 2007). De nombreuses analyses de siloxanes volatils ont généré des résultats incohérents en raison de la contamination des échantillons pendant la collecte et l'analyse, responsable de la détection de siloxanes dans les blancs, à des concentrations dans certains cas comparables à celles des échantillons prélevés à proximité de sources ponctuelles. De 2002 à 2004, une enquête a été menée sur les composés organiques volatils dans l'air des habitations, notamment sur les siloxanes décelés dans des maisons à Syracuse (État de New York), aux États-Unis (NYIEQ, 2005). Le Conseil des ministres des pays nordiques et l'Institut de recherche environnementale de la Suède ont publié les résultats de vastes campagnes d'échantillonnage et de mesure des siloxanes dans les milieux naturels en Scandinavie (Norden, 2005; Kaj et al., 2005). Les données de ces rapports, considérées comme fiables, ont été utilisées pour calculer les limites supérieures estimées de l'exposition aux siloxanes dans l'air, l'eau et le sol pour la population du Canada.
L'annexe 1 présente les limites supérieures estimées de l'absorption quotidienne de D5 pour six groupes d'âge de la population canadienne. Les valeurs estimées de l'absorption à partir des milieux naturels et du régime alimentaire sont comprises entre 68,7 et 208 µg/kg p. c./j. (kilogramme de poids corporel par jour) respectivement pour les adultes âgés de 60 ans et plus et les enfants de 6 mois à 4 ans. Selon une étude portant sur quelque 130 habitations menée à Syracuse (New York), au cours de laquelle du D5 a été détecté dans 85 % des maisons, la contribution la plus significative à l'absorption quotidienne due aux milieux naturels est l'inhalation d'air intérieur. Au cours de cette étude, la concentration maximale de D5 dans l'air intérieur mesurée dans les habitations était de 1 560 µg/m3 (moyenne de 136 µg/m3) [NYIEQ, 2005]. Pour caractériser une limite supérieure estimée plus représentative, le 90e percentile a été estimé à partir des données disponibles. On a ainsi obtenu une concentration approximative de 393 µg/m3 (courrier électronique de Santé Canada, Division des statistiques biologiques, janvier 2008; ne figure pas dans les références) qui a été utilisée dans le tableau des valeurs d'absorption (annexe 1).
La confiance dans la limite supérieure estimée de l'exposition au D5 dans les milieux naturels et dans le régime alimentaire est modérée. Aucune donnée canadienne n'a été utilisée, mais des données d'études effectuées en Scandinavie et aux États-Unis étaient disponibles pour l'air ambiant et intérieur, l'eau et le sol. Le calcul du 90e percentile à partir de l'étude sur l'air intérieur était fondé sur les données disponibles et sur l'hypothèse d'une distribution normale, bien que les données disponibles indiquent que la distribution des données pourrait ne pas être normale. L'utilisation d'une limite réglementaire pour le diméthylpolysiloxane dans un quart des produits laitiers et la moitié des aliments transformés peut causer une surestimation de la contribution alimentaire à l'exposition totale, mais la contribution estimée de tous les aliments à l'exposition de la population due aux milieux naturels et au régime alimentaire est inférieure à 1 % de celle de l'air.
À l’aide de la version 4.1 du logiciel ConsExpo, qui est conçu pour estimer l'exposition aux produits de consommation, la dose systémique possible de D5 due à l'utilisation de produits d'hygiène a été estimée pour les femmes qui utilisent des produits de soins de la peau, des produits capillaires et des antitranspirants (RIVM, 2006). Les fabricants de produits d'hygiène doivent signaler à Santé Canada les concentrations de siloxanes, au sein de vastes plages, notamment pour le D5 et les polydiméthylcyclosiloxanes, appelés cyclométhicone dans l'industrie des produits d'hygiène[1]. Santé Canada a été informé qu’environ 3 000 produits cosmétiques contenaient du D5 comme seul siloxane ou mélangé à d'autres siloxanes et qu’environ 6 000 contenaient du cyclométhicone ou des mélanges de ce dernier (SDC, 2007). Les données sur la concentration de D5 dans les produits d'hygiène ont été obtenues principalement à partir des renseignements fournis par l'industrie canadienne (Environnement Canada, 2007; SDC, 2007) et complétées par des renseignements issus d'autres sources indiquées dans l'annexe 2. Les données relatives aux parts de marché n'ont pas été utilisées pour déterminer la concentration de D5 dans les produits dominants pour chacune des catégories d'utilisation. Si l'une des concentrations déclarées en réponse à l'avis publié en application de l'article 71 de la LCPE (1999) pour une catégorie de produits était supérieure à celles du SDC, une concentration inférieure de D5 concordant avec la plage des valeurs déclarées au SDC a été utilisée pour cette catégorie de produits afin d'estimer la dose systémique (Environnement Canada, 2007; SDC, 2007).
On a supposé que 80 % d'un produit appliqué sur la peau s'évaporaient au cours de l'utilisation et n'étaient donc pas disponibles pour l'absorption cutanée. Cette valeur se base sur une observation expérimentale selon laquelle 80 à 91 % du D5 s'évaporent de la peau en 24 heures (Jovanovic et al,. 2008). On fait une distinction entre les produits qui sont retirés de la peau par lavage et ceux qui restent sur le corps.
À des fins de modélisation de l'absorption des produits d'hygiène, il a été décidé d'utiliser les taux d'absorption pour l'exposition par inhalation et par ingestion établis pour le D4, ce qui concorde avec une approche prudente pour évaluer la dose. Pour l'absorption cutanée, on a utilisé la valeur de 0,17 % établie expérimentalement pour la peau des rats par Jovanovic et al. (2008). D'autres hypothèses sont signalées dans l'annexe 2.
L'annexe 2 présente les résultats d'un exemple de calcul pour l'application d'une lotion corporelle et le tableau 1, une synthèse relative à la dose systémique estimée due à l'utilisation de produits d'hygiène par les femmes adultes. Pour celles-ci, la limite supérieure estimée de la dose systémique quotidienne pour les produits d'hygiène modélisés, cumulée pour l'exposition par inhalation et par voie cutanée et orale, est de 0,17 mg/kg p. c./j. L'évaluation préalable de l'octaméthylcyclotétrasiloxane (D4) a montré que pour les femmes qui utilisent des produits d'hygiène, la dose systémique est supérieure à celle absorbée par les hommes, ce qui devrait aussi être le cas pour le D5.
Une évaluation de l'exposition au D5, notamment pour les utilisations de produits d'hygiène, a été présentée au gouvernement du Canada dans le cadre du Défi (SEHSC, 2008a). La méthodologie est différente de celle utilisée dans le tableau 1 de l'annexe 2 car elle fait appel à une analyse probabiliste (Monte Carlo) et regroupe les expositions de la population à toutes les sources (notamment les produits d'hygiène) et voies d'exposition (par inhalation, par voie cutanée et par ingestion). On a caractérisé la contribution de l'utilisation des produits d'hygiène à l'exposition totale par plusieurs voies (par inhalation, voie cutanée et ingestion), puis calculé le total pour obtenir une estimation de l'exposition cumulée. Une étude indépendante de l'évaluation probabiliste présentée a conclu que cette évaluation portait sur l'exposition pour les groupes d'utilisateurs et de non-utilisateurs (voir annexe 4). Les données ont été réanalysées en fonction des groupes d'utilisateurs afin de comparer les résultats à ceux de l'évaluation déterministe de l'exposition au cours de cette évaluation préalable. Les valeurs probabilistes d'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, étaient 10 à 16 fois inférieures aux valeurs déterministes présentées dans le tableau 1 de l'annexe 2. Il est à noter qu'en raison des exigences relatives à l'analyse détaillée et à la validation des valeurs obtenues au cours d’évaluations probabilistes de l’exposition, ces valeurs se situent normalement hors de portée pour la composante « exposition » d'une évaluation préalable.
Les valeurs probabilistes d'exposition pour les enfants de 0 à 6 mois (le groupe d'enfants le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, se situaient dans la plage de 0,016 à 0,032 mg/kg p. c./j. (voir annexe 4). La comparaison avec une évaluation déterministe de l'exposition pour les enfants était impossible en raison du manque de données sur l'utilisation du produit, qui étaient nécessaires à la modélisation de l'exposition pour les enfants lors d'une évaluation déterministe de l'exposition. Les valeurs probabilistes d'exposition pour les enfants sont 5 à 10 fois inférieures aux valeurs déterministes d'exposition pour les femmes adultes.
La contribution d'autres types de produits de consommation comme les revêtements de surface, les produits de calfeutrage et les nettoyants à l'exposition quotidienne due aux utilisations quotidiennes a été jugée beaucoup plus faible; ces produits n'ont donc pas été pris en compte pour la modélisation de la dose quotidienne dans les scénarios d'exposition des consommateurs. Les produits d'hygiène et d'autres produits de consommation comme les revêtements de surface, les produits de calfeutrage et les nettoyants contribuent aux concentrations de D5 dans l'air intérieur et ambiant, et ainsi à l'exposition par inhalation. La contribution de tous les produits de consommation à l'exposition totale des personnes exposées à des sources hors du milieu de travail a été évaluée à partir de l'air intérieur avec le modèle d'exposition de l’environnement à plusieurs milieux examiné ci-dessus dans cette section.
Le niveau de confiance dans la dose systémique estimée pour le D5 absorbé par l'utilisation des produits d'hygiène est faible. Toutes les valeurs estimées ont été obtenues à l'aide de modèles et de données sur les profils d'utilisation provenant d'études réalisées dans d'autres pays que le Canada. Les valeurs de l'étendue de l'utilisation du D5 dans les produits d'hygiène et de la concentration de D5 dans les produits qui sont commercialisés actuellement peuvent être plus faibles que celles utilisées pour estimer la dose systémique déclarée ci-dessus et dans l'annexe 2 (Environnement Canada, 2007; SEHSC, 2007a). Par conséquent, ces valeurs devraient être supérieures à celles de l'exposition au D5 due aux produits d'hygiène.
Évaluation des effets sur la santé
L'annexe 3 présente une synthèse des renseignements disponibles concernant les effets sur la santé du décaméthylcyclopentasiloxane (D5).
Aucun organisme international n'a classé le D5 dans une catégorie ou un groupe de substances présentant des propriétés de cancérogénicité, génotoxicité ou toxicité sur le plan de la reproduction ou du développement. Une seule étude nationale concernant les effets sur la santé des cyclosiloxanes a été identifiée à ce jour. Elle émane de l'Agence de protection de l'environnement du Danemark, qui a étudié les effets sur la santé du D4 et du D5 (Lassen et al., 2005).
Selon l'évaluation de l'Agence de protection de l'environnement du Danemark, la cancérogénicité est un effet potentiel de la toxicité de doses répétées. Cette conclusion était fondée sur l'observation de tumeurs utérines au cours d'une étude d'inhalation de 2 ans chez les rats (Lassen et al., 2005). Dans une fiche technique sur le D5 utilisé pour le nettoyage à sec, l'Agence de protection de l’environnement des États-Unis a aussi noté ce résultat et indiqué qu'elle allait déterminer s'il était approprié d'effectuer une évaluation des risques pour le D5 quand l'analyse de son mode d'action serait terminée (U.S. EPA, 2005). Cet organisme n'a pas fourni d'autres renseignements sur le D5.
Dans une étude de toxicité chronique et de cancérogénicité, des rats ont été exposés à des concentrations de vapeur de 0, 10, 40 ou 160 ppm de D5 pendant 6 heures par jour et 5 jours par semaine sur une période de 24 mois. Dans le groupe subissant la dose la plus élevée, on a constaté une augmentation statistiquement significative des tumeurs utérines (adénocarcinomes endométriaux) observées chez les rats femelles et une incidence accrue d'inclusions hyalines dans l'épithélium nasal des voies respiratoires ou olfactives pour les deux sexes. De plus, dans un sous-groupe exposé aux mêmes concentrations pendant 12 mois, après une période de récupération de 12 mois, on a observé une augmentation de l'incidence des inclusions hyalines dans l'épithélium nasal des voies respiratoires ou olfactives pour les deux sexes à 40 et 160 ppm (Dow Corning, 2005). Le décaméthylcyclopentasiloxane (D5) n'est pas génotoxique selon plusieurs essais in vitro et in vivo (voir l'annexe 3). Les résultats limités sur sa génotoxicité semblent indiquer que les tumeurs observées au cours de l'étude de toxicité chronique et de cancérogénicité pourraient être dues à des effets de seuil.
Bien qu'une analyse poussée du mode d'action du décaméthylcyclopentasiloxane n'entre pas dans le cadre de la présente évaluation préalable, on reconnaît que le D5 agit peut-être comme un agoniste de la dopamine, contribuant ainsi aux effets tumorigènes observés chez les rats femelles (SEHSC, 2008a). Bien que le SEHSC (2008a) ait déclaré que ce mode d'action n'était pas pertinent pour les humains, d'autres organismes de réglementation n'ont pas adopté cette position en raison de l'absence d'analyses complètes du mode d'action (évaluation de l'Agence de protection de l'environnement du Danemark, par exemple).
L'évaluation de l'Agence de protection de l'environnement du Danemark a déterminé que le poumon était le principal organe cible (Lassen et al., 2005). La plus faible concentration à laquelle des effets sur les poumons ont été observés était de 450 mg/m3 (30 ppm), selon une augmentation significative de l'incidence de la minéralisation vasculaire pulmonaire observée au cours d'une étude sur la reproduction (exposition par inhalation) [Siddiqui et al., 2007; voir ci-dessous]. Toutefois, d'autres effets sur les voies respiratoires ont été observés à des doses moins élevées. La concentration minimale avec effet observé (CMEO) pour l'exposition par inhalation à des doses répétées au D5 était de 10 ppm (150 mg/m3), selon des effets sur les fosses nasales (augmentation de l'incidence et de la sévérité de la prolifération des cellules calciformes dans le niveau 1 des fosses nasales pour les deux sexes) au cours d'une étude de 28 jours chez les rats (Burns-Naas et al., 1998a). À des concentrations plus élevées (≥ 380 mg/m3, ≥ 25 ppm) au cours d'études à court et à long terme chez les rats, on a observé des effets supplémentaires, notamment l'augmentation du poids du foie et des poumons, des changements réversibles dans le poids du thymus et d'autres effets dans les fosses nasales, des effets pulmonaires, ainsi que des effets de chimie clinique (Burns-Naas et al., 1998a; id., 1998b; TNO, 1984). On a calculé une CMEO de 700 mg/m3(46 ppm) au cours d'une étude de 3 mois, selon une augmentation du poids du foie chez les rats (TNO, 1984) et une CMEO de 600 mg/m3 (40 ppm) au cours d'une étude de 2 ans chez les rats, selon une augmentation de l'incidence d'inclusions hyalines dans l'épithélium des voies nasales, respiratoires et olfactives (Dow Corning, 2005).
Pour l'exposition à des doses répétées par voie orale, la CMEO était de 5 mg/kg p. c./j. selon une augmentation de l'activité enzymatique du foie (CYP2B1/2 et EROD) au cours d'une étude de 4 jours chez les rats (Zhang et al., 2000). À des doses supérieures (≥ 20 mg/kg p. c./j.) au cours d'études d'absorption orale à court terme chez les rats, les autres effets observés incluaient notamment une augmentation du poids du foie (Zhang et al., 2000; Jager et Hartmann, 1991).
On a observé des effets sur le foie au cours d'études d'absorption par voie orale et par inhalation pour le D5. Par exemple, on a noté une augmentation significative du poids du foie au cours d'une étude d'absorption orale de 3 mois chez les rats (Jager et Hartmann, 1991) et une augmentation du poids du foie au cours d'une étude d'absorption par inhalation de 3 mois chez les rats (CMEO de 700 mg/m3 selon Burns-Naas, 1998b), ce qui indique un effet commun dû aux voies d'exposition orale et par inhalation pour la même durée. Bien que l'Agence de protection de l'environnement du Danemark (Lassen et al., 2005) n'ait pas rapporté d'effets sur le foie aussi critiques pour le D5, elle a déclaré que le D5 avait un profil d'induction des enzymes semblable à celui du D4 et que le foie était un organe cible pour l'exposition au D4. Le D4 a été décrit comme un inducteur des enzymes hépatocellulaires et pour cette raison, d'après la similarité des profils d'induction enzymatique du foie de ces deux composés, on estime que le foie est un organe cible pour l'exposition au D5 par voie orale et par inhalation. Zhang (2000) a noté que l'augmentation de l'induction de l'enzyme hépatique CYP3A1/2 due au D5 était plus élevée que celle causée par le phénobarbital au cours d'une étude d’absorption orale de 4 jours chez les rats; en outre, l’auteur a conclu que, malgré le type d'induction semblable à celle due au phénobarbital qui est causée par la série des enzymes CYP2B, il peut y avoir d'importantes différences mécanistes dans l'induction causée par le D5. Toutefois, dans le cas du D4, Falany et Li (2005) ont aussi noté une augmentation de l'induction de l'enzyme du foie CYP3A1/2 au cours d'une étude de 8 jours chez les rats, mais suggèrent que ce phénomène fait partie de l'induction de type phénobarbital due à l'induction connexe des enzymes CYP2B et PROD. Par conséquent, il n'a pas été jugé utile de déterminer des concentrations à effet nocif fondées sur la seule induction des enzymes.
Au cours d'une étude sur 2 générations, des rats Sprague-Dawley ont été exposés à des concentrations de vapeur de 0, 450, 1 050 ou 2 400 mg/m3 (0, 30, 70 ou 160 ppm) de D5 pendant 6 heures par jour par inhalation en milieu confiné. Les paramètres de la reproduction (nombre de jours entre la formation de couples et l'accouplement, indices d'accouplement et de fertilité, durée de la gestation et parturition) et de la spermatogenèse (numération des follicules primordiaux ovariens et des corpus luteus chez les parents F0 et F1) dans tous les groupes d'exposition n'étaient pas notablement différents de ceux du groupe témoin. Le nombre total de nouveau-nés des générations F1 et F2, la taille moyenne de la portée (petits vivants), la proportion de mâles et de femelles par portée, le poids corporel et le taux de survie postnatal des petits n'étaient pas touchés par l'exposition au D5. Toutefois, on a observé une augmentation significative de l'incidence des cas de minéralisation vasculaire pulmonaire chez tous les rats F0 et F1 à 450 mg/m3(30 ppm) et plus, ainsi que des incidences notablement plus élevées de cas de faible histiocytose alvéolaire à la concentration la plus élevée chez les femelles F0 et F1 (Siddiqui et al., 2007).
Les activités œstrogènes, androgènes et progestagènes ont été évaluées au cours de plusieurs essais biologiques in vitro et in vivo. Des études in vivo chez les rats (exposition par inhalation de 16 heures par jour pendant 3 jours à 160 ppm de D5) n'ont mis en évidence aucune augmentation du poids (humide ou sec) de l'utérus ou des organes reproducteurs chez les mâles. De plus, le D5 ne liait ni les récepteurs des œstrogènes humains a et ß, ni les récepteurs de la progestérone, et les résultats étaient négatifs pour les épreuves de gènes rapporteurs ERa et PRß (Quinn et al., 2007).
Il n'a pas pu être déterminé avec certitude si l'augmentation du poids du foie due au traitement par le D5 était une réaction d'adaptation ou un effet nocif. Selon un document d'orientation rédigé par la Health Effects Division de l'Agence de protection de l’environnement des États-Unis (U.S. EPA, 2002), l'augmentation du poids du foie ou l'hypertrophie hépatocellulaire devrait être associée aux concentrations sériques notablement plus élevées ou plus faibles d'au moins deux des enzymes du foie (alanine aminotransférase, aspartate aminotransférase, phosphatase alcaline et gamma-glutamyl transférase), avant d'être attribuée à un problème de toxicité pour le foie. Au cours d'une étude d'inhalation d'un mois à 2 400 mg/m3(160 ppm) chez les rats, les poids relatifs du foie augmentaient notablement pour les deux sexes et la phosphatase alcaline sérique diminuait chez les femelles, même après une période de rétablissement de 14 jours (on observait aussi une augmentation du poids des poumons et une accumulation des macrophages alvéolaires focaux dans les poumons des deux sexes) [Burns-Naas et al., 1998a]. L'étude d'inhalation de 3 mois chez les rats a montré une augmentation significative des rapports pondéraux foie/cerveau, ainsi que de la gamma-glutamyl transférase (γ-GT) chez les femelles à 700 mg/m3(46 ppm) et plus (Burns-Naas et al., 1998b). Une étude d'inhalation d'un an chez les rats a quant à elle montré une augmentation notable du poids absolu et du poids relatif du foie (rapports pondéraux foie/corps entier et foie/cerveau) et de la γ-GT chez les femelles à 2 400 mg/m3 (160 ppm) (Dow Corning, 2005).
Toutefois, on n'a relevé aucune donnée sur les changements dans les concentrations des enzymes hépatiques après l'administration de doses orales. Comme le montre l'annexe 3, le poids du foie passait à 100, 330 et 1 000 mg/kg p. c./j. de D5 au cours d'une étude de toxicité orale de 3 mois chez les rats (Jager et Hartmann, 1991). Bien qu'aucun autre effet n'ait été observé, la valeur de 100 mg/kg p. c./j. est considérée comme la concentration à effet critique pour le D5 d'après les CMEO orales critiques établies pour des composés semblables, le D4 et le D6. Dans le cas du D4, on a déterminé une CMEO orale de 100 mg/kg p. c./j. fondée sur une diminution de l'œstradiol sérique au cours d'une étude de 7 jours chez les souris et une diminution du poids corporel et du poids relatif du foie chez les fœtus au cours d'une étude de 8 jours chez les rats (D4 administré à des femelles gravides). Dans le cas du D6, on a déterminé une CMEO orale de 100 mg/kg p. c./j. fondée sur une augmentation du poids du foie et sur des cas de lipidose périportale dans le foie des femelles, ainsi que sur une hypertrophie des cellules folliculaires de la thyroïde chez les rats des deux sexes au cours d'une étude d’absorption orale de 28 jours.
Des études toxicocinétiques chez les rats ont indiqué que 0,17 % du D5 marqué au 14C appliqué topiquement était absorbé par la peau et qu'environ 30 % du D5 absorbé atteignait la circulation systémique (Jovanovic et al., 2008), avant d'être métabolisé et éliminé dans l'urine) [Varaprath et al., 2003]. Une étude d'inhalation par le nez uniquement de 6 heures menée chez les rats a indiqué que 1 à 2 % du D5 marqué au 14C était conservé dans le corps, que 69 à 80 % du D5 absorbé était déposé dans les tissus et que la voie d'élimination principale était l'air expiré (Tobin et al., 2008).
La confiance dans la base de données sur la toxicité est faible à modérée car les informations disponibles étaient suffisantes pour examiner les effets qui peuvent être préoccupants et déterminer les paramètres critiques d'après les données sur l'exposition par inhalation, ainsi que des renseignements complémentaires pertinents. Toutefois, on note un manque d'études par voie cutanée ou d'études par voie orale pour plusieurs paramètres (cancérogénicité/toxicité subchronique et chronique, études sur la reproduction et sur le développement).
Caractérisation des risques pour la santé humaine
En se fondant en grande partie sur l’évaluation réalisée par l'Agence de protection de l'environnement du Danemark selon la méthode du poids de la preuve, il a été déterminé que l'un des effets potentiels de la toxicité des doses répétées de D5 est la cancérogénicité, selon une étude de deux ans chez les rats (Lassen et al., 2005). Comme mentionné ci-dessus, l'absence d'effets génotoxiques pour le D5, selon des données limitées sur la génotoxicité, semble indiquer que les tumeurs utérines observées au cours de l'étude de toxicité chronique et de cancérogénicité pourraient être dues à des effets de seuil. Il faut également remarquer que ces tumeurs avaient été observées à des concentrations d'exposition plus élevés que celles qui correspondent aux effets signalés pour les poumons et le foie décrits ci-dessous.
L'Agence de protection de l'environnement du Danemark a également établi que le poumon était un organe cible pour les expositions au D5. Ainsi, on estime que l'organe cible critique est le poumon et que la concentration à effet critique pour la toxicité des doses répétées est de 450 mg/m3(30 ppm) par inhalation selon une augmentation significative de l'incidence de la minéralisation vasculaire pulmonaire observée chez deux générations de rats au cours d'une étude sur la reproduction (Siddiqui et al., 2007). Bien qu'une concentration moins élevée entraînant un effet ait été obtenue au cours d'une autre étude à doses répétées (150 mg/m3 durant une étude de 28 jours chez les rats), l'effet observé (augmentation de l'incidence et de la sévérité de la prolifération des cellules calciformes dans le niveau 1 des fosses nasales) n'a pas été jugé critique parce que l'étude d'inhalation de 2 ans chez les rats n'a mis en évidence aucun effet à cette même concentration; toutefois, à la concentration supérieure suivante (600 mg/m3), des effets dans les fosses nasales ont été observés (même si l'Agence de protection de l'environnement du Danemark n'avait pas déterminé que les fosses nasales étaient des organes cibles).
Selon une comparaison entre la concentration à effet critique pour les effets des doses répétées par inhalation (450 mg/m3) et la limite supérieure estimée de l'exposition par inhalation (valeurs du 90e percentile de l'étude sur l'air intérieur) pour le décaméthylcyclopentasiloxane (393 µg/m3), on obtient une marge d'exposition d'environ 1 150. On estimait que l'utilisation du 90e percentile plutôt que la concentration maximale obtenue dans l'enquête sur l'air intérieur (1 560 µg/m3) pour le calcul de la marge d'exposition représentait une amélioration approprié de la caractérisation des risques, étant donné qu'on obtient ainsi des estimations de l'exposition qui se situent à la limite supérieure. Ainsi, la marge d'exposition pour les effets des doses répétées par inhalation et pour l'exposition de la population générale à des concentrations atmosphériques ambiantes est adéquate pour tenir compte des incertitudes dans la base de données sur l'exposition et les effets. Cette marge d'exposition protège aussi le public d'effets cancérogènes possibles étant donné que les tumeurs endométriales ont été observées au cours d'une étude de toxicité chronique et de cancérogénicité à une dose beaucoup plus élevée (2 400 mg/m3).
L'Agence de protection de l'environnement du Danemark ne faisait pas de distinction entre les voies d'exposition. Ainsi, on considère qu'il est prudent d'établir une concentration à effet critique pour l'exposition par voie orale étant donné que seule une quantité limitée de données sur la toxicité par voie orale était disponible. La concentration à effet critique pour la toxicité des doses répétées est de 100 mg/kg p. c./j. par voie orale. Cette valeur est fondée sur une augmentation du poids du foie au cours d'une étude de 90 jours chez les rats, ainsi que sur l'extrapolation pour le D5 des effets et des concentrations critiques selon les données sur l'absorption orale de composés semblables, le D4 et le D6 (voir « Évaluation des effets sur la santé »).
À cause d'effets semblables observés dans le foie pour l'exposition par voie orale et par inhalation, on estime qu'il convient de comparer les effets critiques par voie orale aux valeurs estimées de l'absorption due à l'exposition qui regroupent les trois principales voies d'exposition (voie orale, inhalation et voie cutanée). La comparaison entre la concentration à effet critique pour les doses répétées par voie orale (100 mg/kg p. c./j.) et la limite supérieure estimée pour l'absorption quotidienne de D5 par la population canadienne donne une marge d'exposition d'environ 17 200. Cette valeur est fondée sur l'ajustement de la contribution de l'inhalation à l'absorption quotidienne par une valeur d'absorption par inhalation de 2 %, ce qui donne une valeur d'exposition systémique de 5,8 µg/kg p. c./j. Cette marge d'exposition est considérée adéquate pour prendre en compte les incertitudes dans la base de données sur l'exposition et les effets.
La dose systémique de 0,16 mg/kg p. c./j. pour l'utilisation des produits d'hygiène comporte des facteurs d'absorption pour l'absorption par inhalation et par voies cutanée et orale (tableau 1, annexe 2). Pour calculer la dose orale équivalente, cette dose systémique de 0,16 mg/kg p. c./j. a été corrigée à l'aide de la réciproque du facteur oral et une dose systémique équivalente de 0,21 mg/kg p. c./j. a été obtenue. Si on utilise cette limite supérieure estimée calculée de 0,21 mg/kg p. c./j., la comparaison avec la concentration à effet critique pour les effets des doses répétées par voie orale (100 mg/kg p. c./j.) donne une marge d'exposition d'environ 480 pour l'utilisation des produits d'hygiène. Toutefois, on considère que les estimations de l'exposition présentées ci-dessus surestiment l'exposition réelle, d'après une étude indépendante de l'évaluation probabiliste présentée et des renseignements selon lesquels le pourcentage des produits d'hygiène commercialisés au Canada contenant du D5 pourrait être plus faible que supposé pour estimer les valeurs d'exposition. D'après les valeurs dérivées de l'étude indépendante de l'évaluation probabiliste de l'exposition, il semble que la marge d'exposition pour l'utilisation des produits d'hygiène serait au moins 10 fois plus élevée chez les adultes et au moins 5 fois plus élevée chez les enfants que la marge indiquée ci-dessus (c'est-à-dire > 2 000). D'après les facteurs présentés ci-dessus, notamment le facteur lié à l'étendue de sa base de données, on estime que le D5 ne répond pas aux critères de l'alinéa 64c) de la LCPE (1999).
Incertitudes dans l'évaluation des risques pour la santé humaine
L’analyse complète du mécanisme d'action du décaméthylcyclopentasiloxane et les différences possibles entre la sensibilité des humains et celle des animaux de laboratoire aux effets de cette substance n'entrent pas dans le cadre de cette évaluation préalable. Le mécanisme de la cancérogénicité après une exposition par inhalation est incertain. Le mécanisme d'action qui cause des effets sur le foie après une exposition par inhalation ou par voie orale est lui aussi incertain.
Les effets nocifs possibles du D5 absorbé par voie orale ont été déterminés par l'utilisation du D4 et du D6 en tant que composés analogues. Les limites de la méthode de l'extrapolation du D4 et du D6 pour estimer les effets du D5 sont également incertaines.
Malgré la publication de données sur l'absorption cutanée obtenues par modélisation pharmacocinétique des effets physiologiques (Reddy et al., 2007), seules des données expérimentales sur l'absorption ont été utilisées pour la présente évaluation.
L'estimation de l'exposition et de la dose systémique est incertaine en raison de l'utilisation de la modélisation et du manque de données canadiennes. L'utilisation de modèles et le choix des variables liées à l'utilisation de produits de consommation, notamment la quantité et la fréquence de leur utilisation, la fraction absorbée et les paramètres environnementaux sont également incertains.
La présente évaluation n'examine pas les effets des expositions cumulatives aux cyclosiloxanes dans les polydiméthylsiloxanes (PDMS), mais d'autres évaluations le font pour le D4 et le D6.
D'après les informations contenues dans la présente évaluation préalable sur le potentiel d’effets nocifs du D5 sur l'environnement, on conclut que le décaméthylcyclopentasiloxane pénètre dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif, sur l'environnement ou sur la diversité biologique.
Selon les informations disponibles sur son potentiel d'effets nocifs sur la santé humaine, on conclut que le décaméthylcyclopentasiloxane ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut donc que le décaméthylcyclopentasiloxane correspond à la définition de « substance toxique » au sens de l'alinéa 64a) de la LCPE (1999). De même, on conclut que le D5 répond aux critères de la persistance énoncés dans le Règlement sur la persistance et la bioaccumulation, mais non au critère de la bioaccumulation en raison des données contradictoires présentées dans ce rapport d’évaluation préalable.
La conclusion de cette évaluation préalable est basée sur les informations disponibles à l'heure actuelle et tient compte du fait que des incertitudes sont liées à cette évaluation. Des recherches sur les cVMS sont actuellement menées pour surmonter ces incertitudes, mais certaines de ces recherches ne sont pas encore terminées. Dans le cadre du Défi, toute nouvelle information fournie après l'évaluation préalable finale peut être prise en compte lors de l’étape de la gestion des risques.
La surveillance a également été établie comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et la possibilité que le D5 fasse l’objet d’une surveillance environnementale dans le cadre de ce plan est actuellement envisagée. On considère que les données de concentration in situ contribueront à faire mieux comprendre la distribution du D5 dans l'environnement et son potentiel de bioaccumulation dans les réseaux trophiques appropriés.
Allen, R.B., Kochs, P., Chandra, G. 1997. Industrial organic materials, their environmental entry and predicted fate. In : Organosilicon Materials, Hutzinger, O., éd., Handbook of Environmental Chemistry. Berlin : Springer-Verlag. P. 1-25.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d’estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : Liste des produits de formulation de l'ARLA [Internet]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté en septembre 2008].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci. 22(3):337-345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., MacKay, D., Parkerton, T., Bonnell, M. 2008b. A database of fish biotransformation rate constants. Environ. Sci. Technol. (sous presse).
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organics compounds. J. Phys. Chem. Ref. Data. Monograph No. 1.
Atkinson, R. 1991. Kinetics of the gas-phase reactions of a series of organosilicon compounds with OH and NO3 radicals and O3 at 297 ± 2 K. Environ. Sci. Technol. 25(5):863-866.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing Long-Range Transport Potential of Persistent Organic Pollutants. Environ. Sci. Technol. 34(4):699-703.
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
Bidleman, T.F. 2008. Review of the Dow-Corning Health & Environmental Sciences Technical Reports: "Hydrolysis of Octamethylcyclopentasiloxane (D4)" and "Hydrolysis of Decamethylcyclopentasiloxane (D5)". Centre des recherches atmosphériques (Egbert, Ont.). Direction générale des sciences et de la technologie, Environment Canada.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Exposure Assessment Tools and Models.
Boehmer, T., Gerhards, R. 2003. Decamethylcyclopentasiloxane (D5) a compilation of environmental data. Centre européen des silicones (CES).
Bruggeman, W.A., Weber-Fung, D., Opperhuizen, A., Van Der Steen, J., Wijbenga, A., Hutzinger, O. 1984. Absorption and retention of polydimethylsiloxanes (silicones) in fish: preliminary experiments. Toxicol. Environ. Chem. 7:287-296.
Burns-Naas, L.A., Mast, R.W., Klykken, P.C., McCay, J.A., White, K.L. Jr., Mann, P.C., Naas, D.J. 1998a. Toxicology and humoral immunity assessment of decamethylcyclopentasiloxane (D5) following a 1-month whole body inhalation exposure in Fischer 344 rats. Toxicol. Sci. 43(1):28-38.
Burns-Naas, L.A., Mast, R.W., Meeks, R.G., Mann P.C., Thevenaz, P. 1998b. Inhalation toxicology of decamethylcyclopentasiloxane (D5) following a 3-month nose-only exposure in Fischer 344 rats. Toxicol. Sci. 43(2):230-40.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada, Partie II, vol. 134, n° 7.
Canada, Ministère de l'Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49.
Canada, Ministère de l'Environnement, ministère de la Santé. 2007. Loi canadienne sur la protection de l'environnement, 1999 : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 141, n° 19.
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatorov University, Laboratory of Mathematical Chemistry. [consulté le 4 février 2008]. OASIS Software.
David, M., Fendinger, N., Hand, V. 2000. Determination of Henry's Law Constants for organosilicones in actual and simulated wastewater. Environ Sci Technol 34(21) :4554-4559.
Domoradzki, J. 2008a. Refinement in the determination of the BMF value for D4 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Domoradzki, J. 2008b. Refinement in the determination of the BMF value for D5 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Dow Corning. 1990a. A 14-day subchronic oral gavage study with D5 in rats. Report No. 1990-I0000-35074. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2008].
Dow Corning. 1990b. A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats. Report No. 1990-I0000-35105. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1990c. A 28-day dermal toxicity study of decamethylcyclopentasiloxane (D5) in rats. Report No. 1990-I0000-35172-11, Dow Corning Corporation, 12 mars 1990. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1990d. A 90-day inhalation study of decamethylcyclopentasiloxane (D5) in rats. Report No. 1990-I0000-35190, Dow Corning Corporation, 19 mars 1990. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 1994. 4-Hour acute inhalation toxicity study with decamethylcyclopentasiloxane in rats. Report No. 1994-I0000-39167. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning Corporation. 1998. An oral gavage study to compare the absorption potential of 14C-D4 in Fischer rats when delivered in various carriers. Report No. 1998-10000-44815. [cité dans SCCP, 2005, réf. 35].
Dow Corning. 2004a. Analysis of the genotoxic potential of decamethylcyclopentasiloxane (D5) in fischer-344 rats following whole body vapor inhalation for 7 days. Report No. 2003-I0000-53252. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning. 2004b. In vitro chromosome aberration test in Chinese hamster V79 cells with decamethylcyclopentasiloxane (D5). Report No. 2003-I0000-52921. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), n° CAS 541-02-6. 13 février 2007].
Dow Corning. 2004c. Salmonella Typhimurium and Escherichia Coli reverse mutation assay with decamethylcyclopentasiloxane (D5). Report No. 2003-I0000-52921. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Dow Corning Corporation. 2005. Decamethylcyclopentasiloxane (D5): A 24-month combined chronic toxicity and carcinogenicity whole body vapor inhalation study in Fischer 344 rats. Study No. 9346, Report No. 2003-I0000-53252.
Drottar, K. 2006. 14C-Octamethylcyclotetrasiloxane (14C-D4): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K. 2007. 14C-Decamethylcyclopentasiloxane (14C-D5): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K.R. 2005. 14C- Decamethylcyclohexasiloxane (14C-D5): Bioconcentration in the fathead minnow (Pimephales promelas) under flow-through test conditions. Dow Corning Corporation. Health and Safety Council. Study No. 9882-102.
Durham, J., 2006. Hydrolysis of octamethylcyclotetrasiloxane (D5). Silicones Environment, Health and Safety Council. Study No. 10040-102.
Durham, J., Kozerski, G. 2005. Hydrolysis of octamethylcyclotetrasiloxane (D4). Silicones Environment, Health and Safety Council. Study No. 10000-102.
[ECB] Bureau européen des substances chimiques. 2007.
[ESIS] European Chemical Substances Information System, Version 4.60. [consulté en décembre 2007].
[ECOSAR] Ecological Structural Activity Relationships [Internet]. [2004] Version 0.99g. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances (LIS) 1984-1986, recueillies en vertu du par. 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : Guide du déclarant, 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2007. Données sur les substances du lot 2 recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2008a. Assumptions, limitations and uncertainties of the Mass Flow Tool for decamethylcyclopentasiloxane, CAS RN 541-02-6. Ébauche de document interne. Gatineau (Qc) : Environnement Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008b. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series, technical guidance module: Overview of Aquatic Risk Distribution Methodology. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008c. Aquatic risk distribution summary for decamethylcyclopentasiloxane, CAS RN 541-02-6. 2008-09-08. Document non publié. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02 Peterborough (Ont.) : Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - EQC Model.
Fackler, P.H., Dionne, E., Hartley, D.A., Hamelink, J.L. 1995. Bioconcentration by fish of a highly volatile silicone compound in a totally enclosed aquatic exposure system. Environ. Toxicol. Chem. 14(10):1649-1656.
Falany, C.N., Li, G. 2005. Effects of age and pregnancy on cytochrome P450 induction by octamethyltetracyclosiloxane in female Sprague-Dawley rats. J. Biochem. Mol. Toxicol.19(2):129-138.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J. et al. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39(7):1932-1942.
Flaningam, O.L. 1986. Vapor pressure of poly (dimethylsiloxane) oligomers. J Chem Eng Data 31(3):266-272.
[GEMStat] Global Water Quality Data and Statistics [base de données sur Internet]. 2008. Burlington (Ont.) : Organisation des Nations Unies, Programme de l'eau du Système mondial de surveillance continue de l'environnement (GEMS). [consulté en septembre 2008].
Gobas, F.A.P.C., Kelly, B.C., Arnot, J.A. 2003. Quantitative Structure Activity Relationship for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb Sci 22(3): 329-335.
Green Earth, 2008.
Han, X., Nabb, D.L., Mingoia, R.T., Yang, C.-H. 2007. Determination of xenobiotic intrinsic clearance in freshly isolated hepatocytes from rainbow trout (Oncorhynchus mykiss) and rat and its application in bioaccumulation assessment. Environ. Sci. Technol. 41:3269 -3276.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Herner, A.V., Flassbeck, D., Gruemping, R. 2002. Organosilicon compounds in the environment. In : Craig, P.J., éd., Organometallic Compounds in the Environment. 2nd ed. New York. Wiley. p. 324.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. 3(4), article 29. [consulté en octobre 2008].
Huntingdon Research Center. 1979. Twenty-one day repeated dermal in the rabbit of material SF-1202. Project No. 792048. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Hurd, C.B. 1946. Studies on siloxanes: 1. The specific volume and viscosity in relation to temperature and constitution. .J Am. Chem. Soc. 68(3):364.
Isquith, A., Matheson, D., Slesinski, R. 1988. Genotoxicity studies on selected organosilicon compounds: in vitro assays. Food Chem. Toxicol. 26(3):255-61.
Jager, R., Hartmann, E. 1991. Subchronische toxikologische untersuchungen an ratten (magensondenapplikation uber13 Wochen oral gavage study with D5 in rats. Report No. 20204. [cité dans SEHSC (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Jovanovic, M.L., McMahaon, J.M., McNett, D.A., Tobin, J.M., Plotzke, K.P. 2008. In vitro and in vivopercutaneous absorption of 14C-octmethylcyclotetrasiloxane (14C-D4) and 14C-decamethylcyclopentasiloxane (14C-D5). Regul. Toxicol. Pharmacol. 50(2): 239-248.
Kaj, L., Andersson, J., Palm Cousins, A., Remberger, M., Ekheden, Y., Dusan, B., Brorström-Lundén, E. 2005. Results from the Swedish National Screening Programme 2004: Subreport 4: Siloxanes. IVL.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of Long-Range Transport Potential and overall persistence, Environ. Sci. Technol. 40(1):53-60.
Kochetkov, A., Smith, J.S., Ravikrishna, R., Valsaraj, K.T., Thibodeaux, L.J. 2001. Air-water partition constants for volatile methyl siloxanes. Environ. Toxicol. Chem. 20(10):2184-2188.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Kozerski, G. 2007. Determination of the 1-Octanol/Water Partition Coefficient of Decamethylcyclopentasiloxane (D5) by the Slow-Stirring Method Using Gas Chromatography and Mass Spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC).
Kozerski, G. 2008. SEHSC response to Dr. Bidleman's review on hydrolysis studies of D4 and D5. Dow Corning Corporation. Juillet 2008.
Kramp, F., Volz-Thomas, A. 1997. On the budget of OH radicals and ozone in an urban plume from the decay of C5-C8 hydrocarbons and NOx. J Atmos Chem. 28(1-3):263-282.
Krötlinger, F. 1988. Subakute toxikolische Untersuchungen an Kanninchen. Bayer AG. Report No. R 4374, 13 avril 1988. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2007. D5: a prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Centre européen des silicones (CES).
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2008. D5: a prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International, LTD. Project No. 570A-108. Silicones Environmental, Health, and Safety Council (SEHSC).
Lassen, C., Hansen, C.L., Mikkelson, S.J., Maag, J. 2005. Siloxanes – consumption, toxicity and alternatives. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Environmental Project No. 1031.
Litton Bionetics, Inc. 1978. Project No. 20893; Mutagenicity evaluation of decamethylcyclopentasiloxane (Me2SiO)5, Rapport final, avril 1978. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007.]
Löser, E. 1984. Untersuchungen zur akuten oralen toxizitat an mannlichen und weblichen Wistar ratten. [cité dans SEHSC (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Lucas, S.V. 1984. GC/MS analysis of organics in drinking water concentrates and advanced waste treatment concentrates. Vol. 1. Analysis results for 17 drinking water and 16 advanced waste treatment and 3 process blank concentrate. EPA-600/1-84-020A. (NTIS P85-128221). Columbus (OH) : Columbus Labs, Health Effects Research Laboratory. P. 45, 46, 147 et 150.
Maxim, L.D. 1998. D4, D5, and D6 Exposure in the manufacture and use of personal care products: an interim assessment. Dow Corning Corporation.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Navea, J.G., Stanier, C.O., Young, M.A., Grassian, V.H. 2007. A laboratory and modeling study at the University of Iowa designed to better understand the atmospheric fate of D4 and D5. Rapport technique annuel (août 2006-juillet 2007). Iowa City (IA) : University of Iowa, Department of Chemistry, and Chemical and Biochemical Engineering.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consulté le 11 octobre 2006]. National Chemical Inventories (NCI) on CD.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26(6):1304-1319.
[NILU] Norsk institutt for luftforskning. 2007. Siloxanes in the Environment of the Inner Oslofjord. Report No.986/2007. Kjeller (Norvège) : Norwegian Institute for Air Research.
[NMI] Non-Medicinal Ingredients [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[NOAA] National Oceanic and Atmospheric Administration. 2008. NOAA CoastWatch Great Lakes Program. NOAA Great Lakes Environmental Research Laboratory. [consulté en septembre 2008].
Norden. 2005. Siloxanes in the Nordic Environment. TemaNord 2005:593. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
[NYIEQ] New York Indoor Environmental Quality Center. 2005. Indoor Environmental Quality: Assessing and Mitigating the Impact of Exposure to Multiple Indoor Contaminants. Project No. R828605-01.
[OCDE] Organisation de coopération et de développement économiques 2004. Emission Scenario Document on Plastics Additives [Internet]. Paris (France) : Direction de l’environnement de l’OCDE, Division de l’hygiène et de la sécurité de l’environnement. [consulté en septembre 2004].
[OCDE] Organisation de coopération et de développement économiques 2006. Draft Emission Scenario Document on Transport and Storage of Chemicals. Préparé par l’Environment Agency (Royaume-Uni). Disponible sur demande auprès de : Environnement Canada, Division des substances existantes, Ottawa, K1A 0H3.
[OCDE] Organisation de coopération et de développement économiques 2007. Manual for investigation of HPV chemicals. OECD Secretariat, July 2007. [consulté en janvier 2008].
Pauluhn, J. 1984. Untersuchungen zur akuten inhalationstoxizität. Bayer AG. Report No. 13142, 18 décembre 1984. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. [consulté en mars 2006].
Powell, D., Kozerski, G. 2007. Cyclic methylsiloxane (cVMS) materials in surface sediments and cores for Lake Ontario. Centre européen des silicones (CES). Rapport préliminaire.
Powell, D.E. 2008. Interim update on cyclic methylsiloxane (cVMS) materials in surface sediment, cores, and zooplankton for Lake Opeongo, Ontario, Canada. Centre européen des silicones (CES), 14 juillet 2008.
Quinn, A.L., Regan, J.M., Tobin, J.M., Marinik, B.J., McMahon, J.M., McNett, D.A., Sushynski, C.M., Crofoot, S.D., Jean, P.A., Plotzke, K.P. 2007. In vitro and in vivo evaluation of the estrogenic, androgenic, and progestagenic potential of two cyclic siloxanes. Toxicol Sci 96(1):145-53.
RCC Group. 1995. One-month repeated dose inhalation toxicity with D5 in rats. Report No. 1995-I0000-40185, 13 mars 1995. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), no CAS 541-02-6. 13 février 2007].
Reddy, M.B., Looney, R.J., Utell, M.J., Plotzke, K.P., Andersen, M.E. 2007. Modeling of human dermal absorption of octamethylcyclotetrasiloxane (D4) and decamethylcyclopentasiloxane (D5). Toxicol. Sci. 99(2):422-431.
Ren, X., Brune, W.H., Mao, J., Mitchell, M.J., Lesher, R.L., Simpas, J.B., Metcalf, A.R., Schwab, J.J., Cai, C., Li, Y., et al. 2006. Behaviour of OH and HO2 in the winter atmosphere in New York City. Atmos. Environ. 40:S252-S263.
Ren, X., Harder, H., Martinez, M., Lesher, R.L., Oliger, A., Shirley, T., Adams, J., Simpas, J.B., Brune, W.H. 2003. HOx concentrations and OH reactivity observations in New York City during PMTACS-NY2001. Atmos. Environ. 37(26):3627-3637.
Rivett, A.C., Martin, D., Gray, D.J., Price, C.S., Nickless, G., Simmonds, P.G., O'Doherty, S.J., Greally, B.R., Knights, A., Shallcross, D.E. 2003. The role of volatile organic compounds in the polluted urban atmosphere of Bristol, UK. Atmos. Chem. Phys. Discuss. 3:769-796.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo 4.1) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Document non publié. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu. Disponible sur demande.
[SBSC] Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : Santé et Bien-être social Canada. [cité dans Santé Canada, 1998].
[SCCP] Scientific Committee on Consumer Products. 2005. Opinion on octamethylcyclotetrasiloxane (D4) cyclomethicone (INCI name). (Adopted by the SCCP during the 6th plenary meeting of 13th December 2005). European Commission, Health & Consumer Protection Directorate–General (Directorate C – Public Health and Risk Assessment). SCCP/0893/05.
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool [Internet]. Version 2.0. Distribué lors de l’atelier OCDE-PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada), du 31 mai au 3 juin 2006. [consulté en février 2008].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[SEHSC] Silicones Environmental, Health and Safety Council. 2005a. IUCLID Dataset for CAS No. 541-05-9. Submitted by Silicones Environmental, Health and Safety Council, Herndon, VA. Septembre 2005.
[SEHSC] Silicones Environmental, Health and Safety Council. 2005b. Degussa Corporation/Goldschmidt GmbH: TSCA 8(e): Notification of Substantial Risk; Detection of decamethylcyclopentasiloxane and octamethylcyclotetrasiloxane in the tissue of fish from the Rhine River in Germany, October 10, 2005. Données présentées à Environnement Canada par le SEHSC, Herndon (VA), 20 décembre 2005. Environnement Canada, présentation no s70-2006-007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007a. Présentations du SEHSC à Environnement Canada et Santé Canada le 2 octobre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007b. Communication du SEHSC à Environnement Canada et Santé Cand sur le no CAS 69430-24-6, 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008a. Additional toxicity and exposure information for a screening health assessment of decamethylcyclopentasiloxane (D5), CAS No. 541-02-6. 13 novembre 2007 (mis à jour le 13 février 2008).
[SEHSC] Silicones Environmental, Health and Safety Council. 2008b. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D5: Special pattern of cVMS environmental release and its effects on their half-lives in the atmosphere. 16 juillet 2008.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008c. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D5. 16 juillet 2008.
Sible, V. 2006. Determination of n-octanol/water partition coefficient of 14C-decamethylcyclopentasiloxane (14C-D5) by Liquid Scintillation Counting. SEHSC Study Report No. 9803-102. 2 août 2006.
Siddiqui, W.H., Stump, D.G., Reynolds, V.L., Plotzke, K.P., Holson, J.F., Meeks, R.G. 2007. A two-generation reproductive toxicity study of decamethylcyclopentasiloxane (D5) in rats exposed by whole-body vapor inhalation. Reprod. Toxicol.23(2):216-225.
Sousa, J.V., McNamara, P.C., Putt, A.E., Machado, M.W., Surprenant, D.C., Hamelink, J.L., Kent, D.J., Silberhorn, E.M., Hobson, J.F. 1995. Effects of octamethylcyclotetrasiloxane (OMCTS) on freshwater and marine organisms. Environ. Toxicol. Chem. 14(10):1639-1647.
[SPIN] Substances in Preparations in Nordic Countries [base de données sur Internet]. 2007. Copenhague (Danemark) : Conseil des ministres des pays nordiques. [consulté en février 2007].
Springborn Laboratories. 2000. Decamethylcyclopentasiloxane – 14-day prolonged acute toxicity to rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Report No. 12023.6125. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Laboratories. 2001. Decamethylcyclopentasiloxane (D5) – toxicity to the freshwater green alga, Pseudokirchneriella subcapitata. Report No. 12023.6126. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2002. Decamethylcyclopentasiloxane – acute toxicity to daphnids (Daphnia magna) under static conditions. Report No. 12023.6129. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2003a. Decamethylcyclopentasiloxane (D5) – full life-cycle toxicity with water fleas (Daphnia magna) under static-renewal conditions. Report No. 12023.6141. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2003b. Decamethylcyclopentasiloxane (D5) – the full life-cycle toxicity to midge (Chironomous riparius) under static conditions. Report No. 12023.6140. Silicones Environmental, Health and Safety Council (SEHSC).
Springborn Smithers Laboratories. 2004. Cyclopentasiloxane, decamethyl-(D5) and cyclotrisiloxane, hexamethyl-(D3) – determination of the biodegradability of a test substance. Study No. 12023.6142. Silicones Environmental, Health and Safety Council (SEHSC).
Springer, T. 2007. Decamethylcyclopentasiloxane (D5): a 96-hour study of the elimination and metabolism of orally gavaged 14C-D5 in rainbow trout (Oncorhynchus mykiss). HES Study Number 10218-101. Centre européen des silicones (CES).
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (Ont.) : Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - TaPL3.
TNO. 1984. Sub-acute inhalation toxicity study of silicone oil KF995 in rats. Report No. V84.389/231262. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of octamethylcyclotetrasiloxane (D4), no CAS 556-67-2. 13 février 2007].
Tobin, J.M., McNett, D.A., Durham, J.A., Plotzke, K.P. 2008. Disposition of decamethylcyclopentasiloxane in Fischer 344 rats following single or repeated inhalation exposure to 14C-decamethylcyclopentasiloxane (14C-D5). Inhal Toxicol20:513-531.
[U.S. EPA] United States Environmental Protection Agency. 1992. Thirtieth report of the Interagency Agency Testing committee to the Administrator, receipt of report and request for comments regarding Priority Testing List of chemicals. 9 juillet 1992. Federal Register. 57(132):30603-30618.
[U.S. EPA] United States Environmental Protection Agency. 1994. Air quality: revision to definition of volatile organic compounds–exclusion of volatile methyl siloxanes and parachlorobenzotrifluoride. [consulté en février 2008].
[U.S. EPA] United States Environmental Protection Agency. 2002. Hepatocellular hypertrophy: HED Guidance Document#G2002.01. Document non publié. Washington (DC) : U.S. EPA, Health Effects Division, Toxicology Science Advisory Council. 21 octobre 2002.
[U.S. EPA] United States Environmental Protection Agency. 2005. Siloxane D5 in Drycleaning Applications. Fact Sheet.
[U.S. EPA] United States Environmental Protection Agency. 2007.High Production Volume (HPV) Challenge Program: Sponsored Chemicals. Septembre 2007. [consulté en février 2008].
Varaprath, S., Frye, C.L., Hamelink, J. 1996. Aqueous solubility of permethylsiloxanes (silicones), Short Communication. Environ. Toxicol. Chem. 15(8):1263-1265.
Varaprath, S, McMahon, J.M., Plotzke, K.P. 2003. Metabolites of hexamethyldisiloxane and decamethylcyclopentasiloxane in Fischer 344 rat urine: a comparison of a linear and a cyclic siloxane. Drug. Metab. Dispos. 31(2):206-14.
Wania, F. 2003. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37(7):1344-1351.
Wania, F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40(2):569-577.
Will, R., Löchner, U., Masahiro, Y. 2007. CEH Marketing Research Report Siloxanes. Menlo Park (CA) : SRI Consulting.
WIL Research Laboratories Inc. 1996. An inhalation range finding reproductive toxicity study of D5 in the rat. Report No. 1996-I0000-41336, 27 août 1996. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2008. Additional toxicity and exposure information for a screening health assessment of octamethylcyclotetrasiloxane (D4), CAS No. 556-67-2. 13 février 2007].
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Xu, S., Lehmann, R.G., Miller, J.R., Chandra, G. 1998. Degradation of polydimethylsiloxanes (silicones) as influenced by clay minerals. Environ. Sci. Technol. 32(9):1199-1206.
Xu, S. 1999. Fate of cyclic methylsiloxanes in soils. 1. The degradation pathway. Environ. Sci. Technol.33(4):603-608.
Xu, S., Chandra, G. 1999. Fate of cyclic methylsiloxanes in soils. 2. Rates of degradation and volatilization. Environ. Sci. Technol. 33(22):4034-4039.
Xu, S. 2006. 1-Octanol/air partitioning coefficients of octamethylcyclotetrasiloxane (D4), decamethylcyclopentasiloxane (D5) and dodecamethylcyclohexasiloxane (D6) at different temperatures. Centre européen des silicones (CES). Rapport CES, 27 décembre 2006.
Xu, S., Kropscott, G. 2007. Simultaneous determination of partition coefficients for octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane. Rapport préliminaire. Dow Corning, rapport technique non réglementé. DCC Study No. 10336-101.
Xu, S., Miller, J.A. 2008. Aerobic transformation of octamethylcyclotetrasiloxane (D4) in water/sediment system. Centre européen des silicones (CES). Rapport intérimaire.
Zhang, J., Falany, J.L., Xie, X., Falany, C.N. 2000. Induction of rat hepatic drug metabolizing enzymes by dimethylcyclosiloxanes. Chem. Biol. Interact. 124(2):133-47.
Annexes de l'évaluation préalable
- Annexe 1 : Limites supérieures estimées de l'absorption quotidienne de D5 pour la population canadienne (µg/kg p. c./j. pour divers groupes d'âge)
- Annexe 2 : Modélisation de l’exposition des consommateurs
- Annexe 3 : Récapitulatif des informations concernant les effets du décaméthylcyclopentasiloxane (D5) sur la santé
- Annexe 4 : Étude de l'évaluation probabiliste de l'exposition au D5
- Annexe 5 : Paramètres d'entrée de la modélisation dans divers milieux applicable au D5 aux fins de l'évaluation écologique préalable
Note de bas de page
Détails de la page
- Date de modification :