Évaluation - Groupe des aldéhydes
Numéros de registre du Chemical Abstracts Service :
- 100-52-7
- 124-13-0
- 124-19-6
- 1334-78-7
- 8024-06-4
Environnement et Changement climatique Canada
Santé Canada
Mai 2024
No de cat. : En84-375/2024F-PDF
ISBN : 978-0-660-71121-8
Sommaire
En vertu des articles 77 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont procédé à une évaluation de 5 substances désignées collectivement dans le Plan de gestion des produits chimiques comme le « groupe des aldéhydes ». Les 5 substances sont énumérées dans le tableau ci-dessous avec leur numéro de registre du Chemical Abstracts Service (n° CASNote de bas de page 1), leurs noms sur la Liste intérieure (LI) et leurs noms communs.
| No CAS | Nom dans la LI | Nom commun |
|---|---|---|
| 100-52-7 | Benzaldéhyde | s.o. |
| 124-13-0 | Octanal | s.o. |
| 124-19-6 | Nonanal | s.o. |
| 1334-78-7 | Tolualdéhyde | Méthylbenzaldéhyde |
| 8024-06-4a | Essences de vanille | Extrait de vanille |
Abréviation : s.o., sans objet
a Ce produit est un UVCB (substance de composition inconnue ou variable, produits de réaction complexes ou matières biologiques).
La présence naturelle de benzaldéhyde, d’octanal, de nonanal et de méthylbenzaldéhyde est signalée dans une variété d’aliments. Les essences de vanille sont également présentes à l’état naturel et sont définies comme les produits extraits et les dérivés physiquement modifiés de Vanilla planifolia. Les 5 substances du groupe des aldéhydes ont été visées par des enquêtes menées en vertu de l’article 71 de la LCPE. Selon les renseignements fournis, l’octanal et le méthylbenzaldéhyde n’ont pas été importés ou fabriqués au Canada au-delà du seuil de déclaration de 100 kg en 2011. Le benzaldéhyde, le nonanal et les essences de vanille ont été importés au Canada dans des quantités comprises entre 123 et 9075 kg, tandis que 3086 kg de benzaldéhyde ont été fabriqués la même année. Les utilisations déclarées comprennent l’assainissement d’air, le nettoyage et l’entretien mobilier, les lubrifiants et les graisses, ainsi que les produits de soins personnels.
Au Canada, les substances du groupe des aldéhydes sont utilisées comme ingrédients dans les cosmétiques, formulants dans les produits antiparasitaires, ingrédients non médicinaux dans les produits de santé naturels, et peuvent être utilisées comme aromatisants alimentaires et composants dans la fabrication de certains matériaux d’emballage alimentaire. Par ailleurs, les substances du groupe des aldéhydes sont présentes dans de nombreux autres produits disponibles pour les consommateurs, notamment les désodorisants.
Les risques pour l’environnement des substances du groupe des aldéhydes a été caractérisée à l’aide de la classification du risque écologique des substances organiques (CRE), une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération de plusieurs éléments de preuve pour obtenir une classification du risque. Les profils de danger reposent principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, aux seuils de toxicité interne dérivés du réseau tropique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, on retrouve la vitesse d’émission potentielle, la persistance globale et le potentiel de transport à grande distance. Une matrice de risques est utilisée pour assigner un niveau faible, modéré ou élevé d’inquiétude potentielle, basé sur les profils de risque et d’exposition des substances. D’après les résultats de la CRE, les substances du groupe des aldéhydes sont considérées comme jugées peu susceptible de causer des effets nocifs sur l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation, le risque d’effets nocifs du benzaldéhyde, de l’octanal, du nonanal, du méthylbenzaldéhyde et d’essences de vanille sur l’environnement a été jugé faible. Il a été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne répondent pas aux critères des paragraphes 64a) ni b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l’environnement essentiel pour la vie.
Concernant la population générale du Canada, les scénarios qui entraînent les niveaux d’exposition les plus élevés ont été utilisés pour caractériser l’exposition potentielle des Canadiens aux substances du groupe des aldéhydes par l’utilisation de produits de consommation, les milieux environnementaux et les aliments.
D’après les informations disponibles, la population générale devrait être exposée au benzaldéhyde par l’utilisation de divers produits disponibles pour les consommateurs (tels que les hydratants corporels et les désodorisants), les milieux environnementaux, son utilisation potentielle comme aromatisant alimentaire et sa présence naturelle dans les aliments. D’après les études de laboratoire, les effets critiques du benzaldéhyde sur la santé sont la toxicité du foie lors de l’administration par inhalation et la diminution du taux de survie lorsqu’il est administré par voie orale.
L’exposition de la population générale à l’octanal devrait provenir de l’utilisation de divers produits disponibles pour les consommateurs (tels que les produits de santé naturels), des milieux environnementaux, de son utilisation potentielle comme aromatisant alimentaire et de sa présence naturelle dans les aliments. Les effets potentiels sur la santé par voie orale ont été renseignés par la lecture croisée du butanal, qui aurait provoqué des lésions de l’estomac. Les effets potentiels sur la santé par voie cutanée ont été renseignés par lecture croisée avec le nonanal.
L’exposition de la population générale à le nonanal devrait provenir de l’utilisation de divers produits disponibles pour les consommateurs (tels que les assainisseurs d’air et les écrans solaires en vaporisateur), des milieux environnementaux, de son utilisation potentielle comme agent aromatisant alimentaire et de sa présence naturelle dans les aliments. Les effets potentiels sur la santé par voie orale ont été renseignés par la lecture croisée avec le butanal, qui a été signalé comme provoquant des lésions de l’estomac. Administré par voie cutanée, le nonanal a provoqué une irritation de la peau, mais aucun effet systémique indésirable.
En raison du manque de données sur les effets sur la santé causés par l’exposition à l’octanal et au nonanal par inhalation, le butanal et l’isobutanal ont été choisis comme analogues pour appuyer la caractérisation des dangers liés aux expositions par inhalation. Ces substances se sont révélées être des irritants respiratoires provoquant des lésions nasales légères à modérées chez les animaux de laboratoire, mais sans toxicité systémique apparente.
L’exposition de la population générale au méthylbenzaldéhyde devrait provenir de son utilisation potentielle comme aromatisant alimentaire et de sa présence naturelle dans les aliments. L’effet critique sur la santé pour cette substance est la réduction du poids relatif de l’hypophyse en cas d’administration orale.
Selon les comparaisons des niveaux d’exposition au benzaldéhyde, à l’octanal, au nonanal et au méthylbenzaldéhyde provenant des milieux environnementaux, des aliments et/ou de l’utilisation de produits disponibles pour les consommateurs aux niveaux auxquels des effets sur la santé se produisent, il y a des marges jugées adéquates pour compenser des incertitudes dans les bases de données sur les effets sur la santé et l’exposition.
L’exposition de la population générale aux essences de vanille devrait provenir de sa présence naturelle dans les aliments, son utilisation potentielle comme aromatisant alimentaire et l’utilisation de divers produits disponibles pour les consommateurs tels que les hydratants corporels, les baumes à lèvres et les produits pour le bain. Aucune information sur les effets sur la santé des essences de vanille n’était disponible; par conséquent, son principal composant, la vanilline, a été utilisé pour déterminer les effets des essences de vanille sur la santé. Dans plusieurs études à doses répétées à court et à long terme, la vanilline n’a produit aucun effet indésirable jusqu’à la dose limite et a présenté des résultats de génotoxicité et de cancérogénicité négatifs. Il n’y avait aucune preuve d’effets sur le développement ou la reproduction basée sur la lecture croisée avec l’analogue éthylvanilline. Compte tenu des données disponibles, les essences de vanille auraient un faible potentiel de danger et, par conséquent, un faible risque pour la santé humaine.
L’évaluation des effets sur la santé humaine prenait en compte ces groupes de personnes de la population canadienne qui, en raison d’une plus grande sensibilité ou d’une exposition plus importante, pourraient être plus vulnérables à subir des effets nocifs pour leur santé. Pour les substances du groupe des aldéhydes, ces sous-populations présentant un potentiel d'exposition plus élevé, et celles qui sont potentiellement plus sensibles, ont été prises en compte dans les résultats de l'évaluation des risques.
À la lumière des renseignements contenus dans la présente évaluation, il a été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent ou ne peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Il a été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu des articles 77 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont procédé à une évaluation de 5 parmi 6 substances, désignées collectivement dans le Plan de gestion des produits chimiques comme le groupe des aldéhydes, pour déterminer si ces substances présentent ou pourraient présenter un risque pour l’environnement ou la santé humaine. 7 substances de ce groupe ont été jugées prioritaires aux fins d’évaluation, car elles satisfaisaient aux critères de catégorisation énoncés par ECCC et SC (modifié 2017).
La substance restante, le 5-nonylsalicylaldéhyde-oxime ramifié, (numéro de registre du Chemical Abstracts Service [no CAS] 174333-80-3) a été prise en compte dans le Document sur l’approche scientifique (ECCC 2016a) de la Classification du risque écologique des substances organiques (CRE) et de l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016), et elle a été jugée peu préoccupante pour la santé humaine et l’environnement. Par conséquent, elle n’est pas traitée plus en détail dans le présent rapport. Les conclusions concernant cette substance sont fournies dans le document de l’Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC 2018). Les 5 substances visées par la présente évaluation seront ci-après dénommées « groupe des aldéhydes ».
Le risque écologique des substances du groupe des aldéhydes a été caractérisé à l’aide de l’approche de classification du risque écologique (CRE) (ECCC 2016a). La CRE permet de décrire les risques posés par une substance en utilisant des paramètres clés parmi lesquels le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. Elle tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, basée sur des facteurs incluant les taux d’émission potentiels, la persistance globale et le potentiel de transport atmosphérique à grande distance.
Du benzaldéhyde et des essences de vanille ont été détectés dans des produits de vapotage (FS 2010a, 2010b, 2012a, 2013, 2014, 2015a, 2016a). Les produits de vapotage (également connus sous le nom de cigarettes électroniques) peuvent représenter une source supplémentaire d’exposition à ces substances. Il est proposé de ne pas autoriser le benzaldéhyde et les essences de vanille comme aromatisants dans les produits de vapotage au Canada (Canada 2021). L’évaluation du risque pour la population générale lié à cette utilisation, y compris le risque relatif associé aux cigarettes conventionnelles, et les options possibles pour atténuer le risque associé à ces produits sont abordés dans un cadre législatif distinct (Santé Canada [modifié 2020]).
Les substances du groupe des aldéhydes et leurs analogues ont été examinés à l’échelle mondiale par l’Organisation de coopération et de développement économiques (OCDE), et les rapports d’évaluation initiale des ensembles de données d’évaluation sont disponibles. Ces évaluations sont soumises à un examen rigoureux (y compris par des pairs) et à des processus d’approbation par des autorités gouvernementales internationales. Santé Canada et Environnement et Changement climatique participent activement à ces processus et considèrent que ces évaluations sont fiables. De plus, les effets sur la santé des substances du groupe des aldéhydes ont été évalués par l’Agence de protection de l’environnement des États-Unis (EPA), l’Agence européenne de sécurité des aliments (EFSA), le Comité d’experts sur les additifs alimentaires de l’Organisation des Nations Unies pour l’alimentation et l’agriculture et de l’Organisation mondiale de la santé (JECFA) et le ministère de la Santé du gouvernement australien (AGDH). Ces évaluations ont été utilisées pour étayer la caractérisation des effets sur la santé de certaines substances dans la présente évaluation.
La présente évaluation prend en compte les données sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et les expositions. Nous avons relevé des données pertinentes jusqu’en mars 2019. Pour formuler nos conclusions, nous nous sommes basés sur les données empiriques tirées d’études clés ainsi que les résultats obtenus par modélisation. Lorsqu’elles étaient pertinentes, les données contenues dans les évaluations effectuées ailleurs dans le monde ont été prises en compte.
La présente évaluation a été préparée par le personnel du Programme d’évaluation des risques, de la LCPE, travaillant à Santé Canada et à Environnement et Changement climatique Canada. Elle comprend l’apport d’autres programmes de ces ministères. Les parties de la présente évaluation qui portent sur l’environnement et la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Des commentaires sur les parties techniques pertinentes pour la santé humaine ont été reçus de la part de mesdames Theresa Lopez, Jennifer Flippin et Joan Garey, de Tetra Tech. Le volet environnemental de la présente évaluation est basé sur le document d’approche sur l’approche scientifique du CEE (publié le 30 juillet 2016), qui a fait l’objet d’un examen externe ainsi que d’une période de commentaires publics de 60 jours. De plus, l’ébauche de l’évaluation (publiée le 8 octobre 2022) a, elle aussi, fait l’objet d’une période de commentaires publics de 60 jours. Même si les commentaires de l’extérieur ont été pris en considération, Santé Canada et Environnement et Changement climatique Canada assument l’entière responsabilité du contenu final et des conclusions de la présente évaluation.
La présente évaluation est fondée sur des renseignements essentiels pour déterminer si les substances répondent aux critères énoncés à l’article 64 de la LCPE, en examinant des données scientifiques sur les sous-populations susceptibles d’être plus sensibles ou exposées, sur les environnements vulnérables et sur les effets cumulatifs, le cas échéant, et en suivant une approche basée sur le poids de la preuve et le principe de précaution.Note de bas de page 2 Dans la présente évaluation, nous présentons les données et les considérations essentielles sur lesquelles sont basées les conclusions.
2. Identité des substances
Le tableau 2-1 contient les no CAS, les noms figurant sur la Liste intérieure (LI) et les noms communs des substances individuelles du groupe des aldéhydes.
| No CAS | Nom dans la LI (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 100-52-7 | Benzaldéhyde |  C7H6O C7H6O
|
106,12 |
| 124-13-0 | Octanal |  C8H16O C8H16O
|
128,21 |
| 124-19-6 | Nonanal |  C9H18O C9H18O
|
142,24 |
| 1334-78-7a | Tolualdéhyde (méthylbenzaldéhyde) |  C8H8O C8H8O
|
121,16 |
|
8024-06-4b Composant principal : 121-33-5 |
Essences de vanille (extrait de vanille) Composant principal : vanilline |
s.o. Composant principal :  C8H8O3 C8H8O3
|
s.o. Composant principal : 152,15 |
Abréviation : s.o., sans objet
a La structure chimique présentée est la structure générale, où le groupe méthyle peut être situé à n’importe quelle autre position dans le cycle phényle.
b Cette substance est un UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques). Ces matières sont dérivées de sources naturelles ou de réactions complexes. Un UVCB n’est pas un mélange intentionnel de substances précises et on le considère comme étant une substance unique. La complexité et la variabilité de leurs compositions peuvent les rendre difficiles à caractériser de manière complète et cohérente.
Le méthylbenzaldéhyde a été classé comme une substance distincte en vertu de la LCPE (ECCC, HC [modifié en 2017]); toutefois, il est reconnu que cette substance possède certaines caractéristiques de type composition inconnue ou variable, produits de réaction complexes ou matières biologiques (UVCB), car le groupe méthyle peut être situé en ortho, méta ou para du groupe fonctionnel aldéhyde.
Les essences de vanille sont classées comme UVCB. Bien que les essences de vanille puissent provenir de Vanilla planifolia ou de Vanilla tahitensis, le National Chemical Inventory (NCI 2020) définit les essences de vanille comme les extraits et les dérivés physiquement modifiés de V. planifolia. De plus, la Base de données sur l’identification des ingrédients cosmétiques du Personal Care Product Council (PCPC CIID) associe les extraits de V. planifolia au no CAS 8024-06-4, tandis que les extraits de V. tahitensis sont associées aux no CAS 94167-14-3 (V. tahitensis extract) et 953789-39-4 (essences de V. tahitensis) (PCPC 2020). Ainsi, seules les essences de vanille de V. planifolia, à savoir le no CAS 8024-06-4, sont prises en compte dans la présente évaluation.
Les essences de vanille sont principalement produites à partir de V. planifolia Les essences de vanille sont principalement produites à partir de V. planifolia comme extraits de fruits de vanille macérés et séchés (également connus sous le nom de gousses de vanille) par une méthode de percolation ou d’oléorésine, en utilisant soit de l’éthanol/eau, soit de l’éthanol seul comme solvant d’extraction, dont la concentration d’éthanol n’est pas inférieure à 35 % et la teneur en arômes volatils représente jusqu’à 4 % de la composition totale de l’extrait sur une base de poids sec (CIR 2020). La teneur en arômes volatils contient principalement des composés phénoliques qui évoquent la saveur et le parfum distincts de la vanille, la vanilline étant la plus importante, représentant environ 80 % de la teneur en arômes volatils et jusqu’à 3,6 % de la composition totale de l’extrait sur une base de poids sec (Brunschwig et coll. 2009; CIR 2020). Les essences de vanille peuvent également être produites par extraction au CO2 supercritique, ce qui permet d’obtenir des extraits sans solvant dont la composition en vanilline peut atteindre 97 % de la teneur en arômes volatils (Sinha et coll. 2007). Une compilation des composés volatils et semi-volatils détectés dans les fruits de V. planifolia et/ou leurs extraits permet d’identifier la vanilline comme le composant principal (Havkin-Frenkel et Belanger 2018). Il a été déterminé que les extraits de fruits de V. planifolia peuvent contenir, en poids sec, jusqu’à 2,4 % d’acides gras (Brunschwig et coll. 2009). Les données sur la composition du composant non volatil des extractibles de V. planifolia sont limitées; les constituants non volatils du fruit de la vanille sont les tanins, les polyphénols, les résines et les acides aminés libres (Ramachandra Rao et Ravishankar 2000. Les essences de vanille peuvent également être associées aux graines de vanille (qui sont disponibles sous forme de poudre) ou aux extraits de cellules de feuilles. Les téguments des graines sont principalement constitués de polymères de lignine insolubles dans l’acide et de cellulose, et les feuilles contiennent surtout des glucosides, de la chlorophylle et des caroténoïdes (CIR 2020); cependant, la proportion exacte du contenu en arômes volatils dans ces parties de la plante n’est pas connue. Étant donné la faible biodisponibilité de la lignine lors de son ingestion par l’homme (Holloway et coll. 1978), la rareté des données précises sur la composition des extraits de cellules foliaires, et la composition bien caractérisée des extraits de fruits de vanille, les extraits du fruit de vanille, plutôt que la poudre de graines ou les extraits de cellules foliaires de V. planifolia, sont considérés comme la source principale des essences de vanille aux fins de la présente évaluation. Les substances d’intérêt toxicologique (environnement et santé humaine) sont considérées comme étant dans la portion d’arôme volatile des extraits de fruits, où la vanilline est le composant principal.
2.1 Sélection d’analogues et utilisation de modèles R(Q)SA
Une approche de lecture croisée tirant parti des données sur les analogues et des résultats de modèles de relation (quantitative) structure-activité [R(Q)SA] a été employée, au besoin, pour les volets environnement et santé humaine de l’évaluation. n a sélectionné des analogues qui étaient structurellement similaires aux substances de ce groupe (c’est-à-dire de propriétés physico-chimiques et toxicocinétiques similaires) et pour lesquels on disposait de données empiriques pertinentes pouvant être utilisées pour effectuer une lecture croisée avec des substances pour lesquelles les données empiriques sont limitées. Les propriétés physico-chimiques et toxicocinétiques ont également été prises en compte. Ainsi, on a déterminé l’applicabilité des modèles RQSA au cas par cas. Les détails des données de références croisées et des modèles (Q)SAR choisis pour informer les évaluations écologiques et de santé humaine du groupe des aldéhydes sont étudiés plus en détail dans les sections pertinentes du présent rapport.
Le benzoate de sodium a été utilisé comme analogue pour servir d’information sur les effets du benzaldéhyde sur le développement et la reproduction dans le cadre de l’évaluation de la santé humaine. Le benzoate de sodium est structurellement similaire au benzaldéhyde et est métabolisé dans l’estomac en acide benzoïque, qui est l’un des principaux métabolites du benzaldéhyde.
Pour étayer la caractérisation des dangers de l’octanal et du nonanal après une exposition par inhalation, le butanal et l’isobutanal ont été sélectionnés comme analogues pour l’évaluation de la santé humaine en utilisant une approche de lecture croisée. Les 2 substances analogues sont des aldéhydes aliphatiques qui devraient avoir un profil métabolique commun avec l’octanal et le nonanal.
La vanilline est considérée comme le principal composant des essences de vanille qui présente un intérêt toxicologique; elle représente jusqu’à 3,6 % en poids sec de la composition totale de l’extrait de V. planifolia et 80 % de la teneur en arômes volatils (Brunschwig et coll. 2009; CIR 2020). Pour cette raison, l’information sur les effets sur la santé humaine de la vanilline a été utilisée pour informer les effets sur la santé humaine des essences de vanille. Cependant, les données empiriques sur la toxicité de la vanilline sont limitées et l’éthylvanilline a donc été utilisée comme analogue afin de renseigner la caractérisation des dangers de la vanilline.
Le tableau 2-2 contient des données sur l’identité et la structure chimique des analogues utilisés dans le cadre de la présente évaluation. D’autres données sont disponibles à l’annexe A.
| No CAS | Nom dans la LI (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 532-32-1 | benzoate de sodium | ![c1(ccccc1)C(=O)[O-].[Na+]](/content/dam/eccc/images/pded/aldehydes/20220819-t22a.jpg) C7H5O2.Na C7H5O2.Na
|
144,1 |
| 123-72-8 | Butyraldéhyde (butanal) |  C4H8O C4H8O
|
72,1 |
| 78-84-2 | Isobutyraldéhyde (aldéhyde isobutyriquel) |  C4H8O C4H8O
|
72,1 |
| 121-32-4 | 3-Éthoxy-4-hydroxybenzaldéhyde (éthylvanillin) |  C9H10O3 C9H10O3
|
166,18 |
3. Propriétés physiques et chimiques
Un résumé des données sur les propriétés physiques et chimiques des substances du groupe des aldéhydes est présenté dans le tableau 3-1. D’autres propriétés physiques et chimiques sont indiquées dans ECCC (2016b).
| Propriété | Benzaldéhyde | Octanal | Nonanal | Méthylbenzaldéhydea | Essences de vanillec | Références |
|---|---|---|---|---|---|---|
| État physique | Liquide | Liquide | Liquide | Liquide | s.o. | ECHA c2007-2019 |
| Point de fusion (°C) | -26 | -20 | -18,8 | -6 | s.o. | ECHA c2007-2019 |
| Pression de vapeur (Pa) | 169 | 148 | 49 | 33 | s.o. | ECHA c2007-2019, PubChem 2004- |
| Constante de Henry (Pa·m3/mol) | 2.7 | 52,1 | 74,4 | 5,1b | s.o. | ChemIDplus 1993-, PubChem 2004-, EPI Suite c2000-2012 |
| Solubilité dans l’eau (mg/L) | 6950 | 560 | 96 | 250 | s.o. | ECHA, HSDB 1983-, PubChem 2004- |
| Log Koe (sans dimension) | 1,48 | 3,50 | 3,40 | 2,25 | s.o. | ECHA c2007-2019 |
Abréviations : s.o., sans objet; Koe, coefficient de partage octanol-eau
a Le 4-Méthylbenzaldéhyde est utilisé comme structure représentative.
b Ce paramètre a été modélisé à l’aide de HENRYWIN v3.20 (EPI Suite c2000-2012).
c Consulter l’annexe A pour les données sur les propriétés physiques et chimiques de la vanilline et de l’éthylvanilline, respectivement principal composant et analogue de cet UVCB.
4. Sources et utilisations
Le benzaldéhyde est présent à l’état naturel, souvent sous des formes combinées comme les glycosides, dans plusieurs plantes et/ou aliments, notamment les pleurotes, les amandes, les abricots, les cerises et les pêches, la confiture de fraises, les fromages et les thés noirs (Andersen 2006; Beltran-Garcia 1997; Burdock 2010; Opgrande et coll. 2000). L’octanal est présent à l’état naturel dans diverses plantes et/ou produits alimentaires, notamment les mandarines, les limes, le lait, les viandes et les fruits (Burdock 2010; Chisholm et coll. 2003a, 2003b; Verzera et coll. 2000). Le nonanal est naturellement présent dans les huiles essentielles, notamment l’huile de cannelle, l’huile de citronnelle et l’huile d’agrumes. On le trouve également dans les aliments, notamment le lait, les viandes et les fruits (Burdock 2010). Le méthylbenzaldéhyde est présent naturellement dans divers produits alimentaires, notamment les noix grillées, les tomates, le bœuf cuit et le café (Burdock 2010). Les essences de vanille sont définies comme les extraits et les dérivés physiquement modifiés de V. planifolia (NCI 2020), qui est une espèce d’orchidée vanille, et sont donc naturellement présentes. De plus, dans le CIID du PCPC (CIR 2020; PCPC 2020), le no CAS 8024-06-4 pour la substance des essences de vanille est associé à l’extrait de fleur de V. planifolia au fruit de V. planifolia à l’extrait de fruit de V. planifolia, à l’essence de fruit de V. planifolia, à l’eau de fruit de V. planifolia, à l’extrait de cellules de feuilles de V. planifolia, aux graines de V. planifolia et à la poudre de graines de V. planifolia. Ainsi, toutes les formes d’extraits et autres dérivés physiquement modifiés provenant de V. planifolia ont été prises en compte dans le contexte de la présente évaluation. Le Règlement sur les aliments et drogues indique que l’extrait de vanille, l’essence de vanille ou la saveur de vanille doit être l’essence, l’extrait ou la saveur préparée à partir de la gousse de vanille, du fruit sec et séché de V. planifolia ou de V. tahitensis (Canada 1978). Cependant, les essences de vanille provenant de V. tahitensis sont en dehors de la portée de la présente évaluation, car elles sont considérées comme distinctes de la substance représentée par le no CAS 8024-06-4 et ont leurs propres no CAS correspondants (par exemple, les no CAS 94167-14-3 et 953789-39-4).
Les substances du groupe des aldéhydes ont fait l’objet d’une enquête réalisée en vertu de l’article 71 de la LCPE pour l’année de déclaration 2011 (Environnement Canada 2012). Aucune déclaration de fabrication ou d’importation d’octanal ou de méthylbenzaldéhyde au Canada n’a dépassé le seuil de déclaration de 100 kg. Le tableau 4-1 présente un résumé des renseignements déclarés sur les quantités totales fabriquées et importées pour le groupe des aldéhydes.
| Nom commun | Production totalea (kg) | Importation totalea (kg) |
|---|---|---|
| Benzaldéhyde | 3086 | 9075 |
| Octanal | NDb | NDb |
| Nonanal | NDb | 3030 |
| Méthylbenzaldéhyde | NDb | NDb |
| Essences de vanille | NDb | 123 |
Abréviation : ND = Valeur non déclarée
a Les valeurs reflètent les quantités rapportées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour des inclusions ou des exclusions spécifiques (Annexes 2 et 3).
b Aucune quantité fabriquée et/ou importée de cette substance au-dessus du seuil de déclaration de 100 kg n’a été signalée pour l’année de déclaration 2011.
Le tableau 4-2 présente un résumé des principales utilisations commerciales ainsi que des utilisations par les consommateurs des substances du groupe des aldéhydes au Canada, d’après les renseignements fournis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2012). D’autres utilisations ont également été déclarées, mais elles ont été identifiées comme des renseignements commerciaux confidentiels. Ces autres utilisations, bien que non présentées dans cette évaluation, ont été prises en considération dans l’évaluation des risques.
| Principales utilisationsa | Benzaldéhyde | Octanal | Nonanal | Méthylbenzaldéhyde | Essences de vanille |
|---|---|---|---|---|---|
| Assainissement de l’air | O | N | N | N | N |
| Vêtements et chaussures | O | N | N | N | N |
| Entretien d’automobile | O | N | N | N | N |
| Nettoyage et entretien de mobilier | O | N | N | N | N |
| Lessive et lavage de vaisselle | O | N | N | N | N |
| Lubrifiants et graisses | O | N | O | N | N |
| Soins personnels | O | O | O | N | O |
| Soin des animaux de compagnie | O | N | N | N | N |
Abréviations : O = oui, utilisation déclarée pour cette substance; N = non, utilisation non déclarée pour cette substance ou son utilisation est considérée comme information confidentielle.
a Utilisations non confidentielles déclarées en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Voir l’enquête pour les inclusions et exclusions spécifiques (annexes 2 et 3)
Selon les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques, 4 parmi 5 des substances du groupe des aldéhydes ont été déclarées présentes dans les cosmétiques, y compris les produits de soins capillaires (par exemple revitalisant pour cheveux), de soins de la peau (par exemple hydratant corporel) et de soins des lèvres contenant du benzaldéhyde; les baumes à lèvres contenant de l’octanal; les baumes à lèvres contenant du nonanal; et les produits de soins de la peau, les baumes à lèvres, les produits parfumés et les dentifrices non fluorés contenant des essences de vanille. Le méthylbenzaldéhyde n’a pas été déclaré présent dans les cosmétiques (communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux (DSPCPD), Santé Canada, au Bureau d’évaluation des risques pour les substances existantes (BERSE), Santé Canada, 2018, 2020; source non citée).
Les substances du groupe des aldéhydes, à l’exception du méthylbenzaldéhyde, sont présentes comme formulants dans des produits antiparasitaires actuellement homologués au Canada. Aucune de ces substances n’est actuellement inscrite sur la Liste des ingrédients actifs des pesticides de l’ARLA (communication personnelle, courriels de l’ARLA, Santé Canada, au BERSE, Santé Canada, 2018; source non citée).
Le benzaldéhyde peut être utilisé comme composant dans la formulation d’un agent clarifiant utilisé dans la fabrication de certains emballages alimentaires ayant un contact direct avec les aliments, et peut également être un composant dans des additifs accessoires utilisés dans les établissements de transformation des aliments (par exemple, les nettoyants de surface, les nettoyants pour les mains), sans contact alimentaire prévu puisque l’utilisation des nettoyants est suivie d’un rinçage à l’eau potable. Les essences de vanille sont naturellement présentes dans les aliments (par exemple, les gousses de vanille) et sont autorisées dans les aliments comme préparation aromatisante (sous forme d’extrait de vanille, d’essence de vanille ou d’arôme de vanille) conformément au Règlement sur les aliments et drogues (Canada 1978; communication personnelle, courriels de la Direction des aliments (DA), Santé Canada, au BERSE, Santé Canada, 2018; source non citée). Aucune information précise n’est disponible concernant l’utilisation potentielle des 4 autres substances du groupe des aldéhydes comme agents aromatisants dans les aliments vendus au Canada. Cependant, puisque ces 4 substances sont connues pour être utilisées comme agents aromatisants alimentaires à l’échelle internationale, il est possible qu’elles soient présentes en tant que telles dans les aliments vendus au Canada (communication personnelle, courriels de la DA, Santé Canada, au CCERS, Santé Canada, 2018; source non citée).
Le benzaldéhyde figure dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) comme produit non médicinal pour usage topique jusqu’à 0,5 % comme dénaturant ou ingrédient de parfum, ou pour usage oral comme rehausseur de goût. L’octanal, le nonanal et le méthylbenzaldéhyde sont répertoriés dans la BDIPSN avec un usage non médicinal pour une utilisation orale comme rehausseur de goût. V. planifolia et les ingrédients connexes, tels que la vanille, l’extrait de vanille, l’huile essentielle de V. planifolia, le fruit de V. planifolia, l’extrait de fruit de V. planifolia, l’essence de fruit de V. planifolia et la poudre de vanille, sont également mentionnés dans la BDIPSN en tant qu’ingrédients médicinaux ou non médicinaux. À l’exception du méthylbenzaldéhyde, les substances du groupe des aldéhydes sont répertoriées dans la Base de données sur les produits de santé naturels homologués comme étant présentes - principalement en tant qu’ingrédients non médicinaux - dans les produits de santé naturels (BDPSN [modifiée en 2021]; BDPSN [modifiée en 2021]; communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance (DPSNSO), Santé Canada, au BERSE, Santé Canada, 2018, 2019; source non citée).
Le benzaldéhyde et les essences de vanille sont présents comme ingrédients non médicinaux dans divers produits pharmaceutiques commercialisés actuellement autorisés (communication personnelle, courriels de la Direction des produits thérapeutiques, Santé Canada, au BERSE, Santé Canada, 2018, 2019; source non citée).
Sur la base de renseignements accessibles au public, d’autres utilisations ont été recensées pour certaines substances du groupe des aldéhydes au Canada. Le benzaldéhyde a été repéré dans les assainisseurs d’air, les encres pour timbre et les nettoyants pour automobiles (FS 2012b, 2016b, 2019), l’octanal a été repéré dans les assainisseurs d’air et de lave-vaisselle (FS 2008a, 2008b, 2010c, 2015b) et le nonanal a été repéré dans les assainisseurs d’air pour automobiles et les écrans solaires en aérosol (FS 2008c, 2016c). Du benzaldéhyde et des essences de vanille ont également été repérés dans des liquides aromatisés pour cigarettes électroniques (FS 2010a, 2010b, 2012a, 2013, 2014, 2015a, 2016a), et de l’octanal et/ou du nonanal ont également été repéré dans des revêtements de sol en caoutchouc à base de pneus recyclés et des granules de remplissage de gazon synthétique aux États-Unis (É.-U.) (CalRecycle 2010, 2011; Moretto 2007). Par ailleurs, le benzaldéhyde a été repéré en tant que substance à la fois directement émise et formée par des réactions atmosphériques secondaires des émissions d’essence (OEHHA 2018).
Des analyses de benzaldéhyde, d’octanal et de nonanal ont également été effectuées lors d’essais en chambre à petite échelle (0.05 m3) effectués sur des matériaux de construction (par exemple panneaux en bois, calfeutrage, isolation) et des produits disponibles pour les consommateurs (par exemple bâtons d’encens, assainisseurs d’air) (Won et Yang 2012; Won et coll. 2013, 2014; Won 2015).
5. Potentiel de causer des effets nocifs sur l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques pour l’environnement associés aux substances du groupe des aldéhydes ont été caractérisés à l’aide de la classification du risque écologique (CRE) des substances organiques. (ECCC 2016a). La CRE est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les divers éléments de preuve sont combinés afin de pouvoir distinguer les substances présentant un pouvoir faible ou élevé et un potentiel d’exposition faible ou élevé dans divers milieux. Cette approche permet de réduire l’incertitude associée à la caractérisation des risques, contrairement à une approche qui serait basée sur un seul paramètre mesuré dans un seul milieu (par exemple, la concentration létale médiane) pour la caractérisation. Comme les essences de vanille constituent une substance UVCB et ne peuvent pas être représentées de manière appropriée par une structure chimique unique, une approche manuelle basée sur le jugement pour la classification a été utilisée. Voici un résumé de l’approche, qui est décrite en détail dans ECCC (2016a).
Les données sur les propriétés physico-chimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage, bioconcentration dans les poissons), l’écotoxicité aigüe pour les poissons et le volume d’importation et de production au Canada ont été collectées dans la littérature scientifique, dans des bases de données empiriques (par exemple boîte à outils QSAR de l’OCDE), dans les réponses à des enquêtes menées en vertu de l’article 71 de la LCPE ou ont été générées grâce à des modèles choisis de QSAR (relation quantitative structure-activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme intrants dans d’autres modèles de bilan massique ou pour compléter les profils de risque et d’exposition à cette substance.
Les profils de danger reposent principalement sur les paramètres que sont le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dans le réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition ont aussi été calculés à partir de plusieurs paramètres, dont les taux de rejet potentiels, la persistance globale et le potentiel de transport à grande distance. Les profils de danger et d’exposition ont été comparés aux critères de décision afin de classer les potentiels de risque et d’exposition de chaque substance comme faible, moyen ou élevé. Des règles supplémentaires ont été appliquées (par exemple régularité de la classification, marge d’exposition) pour raffiner les classifications préliminaires du risque et de l’exposition. Cependant, dans le cas des essences de vanille, le profil de danger et d’exposition n’a pu être entièrement établi en raison de l’absence d’une structure représentative permettant d’estimer les propriétés nécessaires et du manque de données empiriques pour ces propriétés. Par conséquent, la classification manuelle du danger et de l’exposition a été effectuée par l’analyse des constituants de l’UVCB et de l’information fournie en réponse à une enquête menée en vertu de l’article 71 de la LCPE, la prise de décisions selon l’examen de substances similaires et/ou l’application un jugement d’expert.
Une matrice de risques a été utilisée pour assigner une classification faible, modérée ou élevée au risque potentiel posé par chaque substance, basée sur ses classifications du risque et de l’exposition. Les classifications du risque potentiel au moyen de la CRE ont été vérifiées en suivant une approche en 2 étapes. La première étape servait à ajuster les résultats de la classification du risque de moyen ou élevé à faible pour les substances présentant une faible vitesse d’émission estimée dans l’eau après traitement des eaux usées, représentant un faible potentiel d’exposition. La deuxième étape servait à revoir les résultats d’une classification du potentiel de risque faible ou moyen de scénarios de risque relativement prudents, d’échelle locale (c’est-à-dire dans la zone à proximité du point de rejet), conçus pour protéger l’environnement, afin de déterminer si la classification du risque potentiel devrait être accrue.
La CRE est basée sur une approche pondérée afin de réduire au minimum le potentiel d’une classification supérieure ou inférieure du danger et de l’exposition et du risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites dans plus de détails dans le document ECCC (2016a). La section suivante décrit 2 des zones d’incertitude les plus importantes. Les erreurs dans les valeurs de toxicité aigüe empiriques ou modélisées pourraient conduire à des changements de classification du risque, en particulier en ce qui a trait aux paramètres reposant sur des valeurs de résidus dans les tissus (c’est-à-dire mode d’action toxique), dont de nombreux sont des valeurs prédites à partir de modèles QSAR (boîte à outils QSAR de l’OCDE 2014). Toutefois, l’incidence de ce type d’erreur est atténuée par le fait qu’une surestimation de la létalité médiane donnera une valeur prudente (protectrice) de résidus dans les tissus qui servira à l’analyse critique des résidus corporels. Les modifications ou les erreurs de quantité de composés chimiques pourraient conduire à des classifications différentes de l’exposition, les classifications du risque et de l’exposition étant hautement sensibles à la vitesse d’émission et à la quantité utilisée. Changes or errors in chemical quantity could result in differences in classification of exposure as the exposure and risk classifications are highly sensitive to emission rate and use quantity. Les classifications obtenues au moyen de la CRE représentent donc l’exposition et le risque au Canada compte tenu des quantités utilisées actuellement (déterminées par estimations), mais pourraient ne pas rendre compte des tendances futures.
Les données et les considérations critiques utilisées pour élaborer les profils spécifiques aux substances du groupe des aldéhydes, ainsi que les résultats de la classification des dangers, de l’exposition et des risques, sont présentés dans ECCC (2016b).
Les classifications de danger et d’exposition pour les 5 substances du groupe des aldéhydes sont résumées dans le tableau 5-1.
| Substance | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| Benzaldéhyde | faible | faible | faible |
| Octanal | faible | faible | faible |
| Nonanal | faible | faible | faible |
| Méthylbenzaldéhyde | faible | faible | faible |
| Essences de vanille | élevée | faible | faible |
Compte tenu du faible danger et de la faible exposition relevés à l’aide des données examinées lors de la CRE, le benzaldéhyde, l’octanal, le nonanal et le méthylbenzaldéhyde ont été classées comme présentant un faible potentiel de risque pour l’environnement. Il est peu probable que ces substances soient préoccupantes pour l’environnement au Canada.
Selon les données provenant de la CRE, le potentiel d’exposition des essences de vanille a été classé comme faible. Les essences de vanille ont été classées comme ayant un potentiel élevé de risque pour l’environnement par une classification manuelle prudente selon les incertitudes des résultats du modèle pour cette substance. Les essences de vanille ont été classées comme ayant un faible potentiel de risque pour l’environnement. Les effets potentiels et leur manifestation possible dans l’environnement n’ont pas été étudiés en profondeur étant donné la faible exposition à cette substance. Il est improbable que cette substance cause des préoccupations pour l’environnement au Canada.
6. Potentiel de causer des effets nocifs pour la santé humaine
6.1 Évaluation des expositions
Les expositions potentielles aux substances du groupe des aldéhydes provenant des milieux naturels, des aliments et des produits disponibles pour les consommateurs sont présentées dans la présente section. Comme le risque potentiel des essences de vanille est considéré faible (voir section 6.2), des estimations quantitatives de l’exposition de la population générale n’ont pas été calculées pour cette substance. Pour le benzaldéhyde, l’octanal, le nonanal et le méthylbenzaldéhyde, des scénarios d’exposition entraînant les expositions les plus élevées pour chaque groupe d’âge ont été sélectionnés pour caractériser le risque. Des détails supplémentaires concernant les scénarios d’exposition sont résumés à l’annexe B.
6.1.1 Milieux naturels
Ni le méthylbenzaldéhyde ni les essences de vanille n’ont été identifiés ou mesurés dans aucun milieu de l’environnement au Canada ou ailleurs. Étant donné que la présence de méthylbenzaldéhyde dans le commerce n’a pas été déclarée au-dessus du seuil de déclaration de l’enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada 2013) et qu’aucun produit disponible pour les consommateurs n’a été repéré aucune exposition de la population générale canadienne au méthylbenzaldéhyde provenant des milieux environnementaux n’est prévu.
Étant donné que le potentiel de danger des essences de vanille pour la santé humaine est considéré faible, les concentrations prédites dans l’environnement n’ont pas été calculées pour cette substance.
Air
Des concentrations de benzaldéhyde ont été mesurées dans l’air intérieur et extérieur (ambiant) au Canada, tandis que celle d’octanal et de nonanal ont été mesurées dans l’air intérieur au Canada et dans l’air ambiant aux États-Unis. Dans les études canadiennes sur l’air intérieur, des échantillons d’air ont été prélevés à l’intérieur et à l’extérieur de foyers résidentiels dans des villes du Canada (Santé Canada, 2010a, 2010b, 2012, 2013; Li et coll. 2019). Le nombre de foyers participant à chaque étude canadienne était compris entre 50 et environ 3500. Les fréquences de détection du benzaldéhyde, de l’octanal et du nonanal étaient entre 97 % et 100 %. Une étude sur l’air ambiant menée aux États-Unis a analysé les constituants des aérosols atmosphériques recueillis dans le site rural de Niwot Ridge, au Colorado (EPA des États-Unis 2001). Les concentrations mesurées de ces substances dans l’air canadien sont présentées dans le tableau 6-1.
| Substance | Concentration moyenne (μg/m3) | Concentration du 95e percentile (μg/m3) | Milieu | Emplacement | Référence |
|---|---|---|---|---|---|
| Benzaldéhyde | 4,20 | 9,33 | Air intérieur | Regina (Sask.) | Santé Canada 2010a |
| Benzaldéhyde | 0,54 | 1,108 | Air ambiant | Regina (Sask.) | Santé Canada 2010a |
| Benzaldéhyde | 8,25 | 15,71 | Air intérieur | Windsor (Ont.) | Santé Canada 2010b |
| Benzaldéhyde | 0,49 | 1,206 | Air ambiant | Windsor (Ont.) | Santé Canada 2010b |
| Benzaldéhyde | 3,15 | 7,512 | Air intérieur | Halifax (N.-É.) | Santé Canada 2012 |
| Benzaldéhyde | 0,40 | 0,82 | Air ambiant | Halifax (N.-É.) | Santé Canada 2012 |
| Benzaldéhyde | 3,64 | 10,56 | Air intérieur | Edmonton (Alb.) | Santé Canada 2013 |
| Benzaldéhyde | 0,48 | 0,899 | Air ambiant | Edmonton (Alb.) | Santé Canada 2013 |
| Benzaldéhyde | 3,60 | 8,88 | Air intérieur | 16 sites à travers le Canada | Li et coll. 2019 |
| Octanal | 4.06 | 11.0 | Indoor air | 16 sites à travers le Canada | Li et coll. 2019 |
| Nonanal | 10.50 | 30.6 | Indoor air | 16 sites à travers le Canada | Li et coll. 2019 |
Abréviations : Alb. : Alberta; N.-É. : Nouvelle-Écosse; Ont. : Ontario; Sask. – Saskatchewan
Lorsque des données canadiennes étaient disponibles,les estimations de l’absorption humaine de benzaldéhyde, d’octanal et de nonanal dans l’air ont été calculées en utilisant les concentrations mesurées les plus élevées du 95e percentile dans le tableau 6-1. Les expositions les plus élevées obtenues par rapport au poids corporel ont été identifiées pour les tout-petits (1 an). Pour l’air intérieur, cela correspondait à des expositions quotidiennes estimées à 1,0 x 10-2, 7,0 x 10-3, et 1,9 x 10-2 mg/kg p.c./jour pour le benzaldéhyde, l’octanal et le nonanal, respectivement. Pour l’air ambiant, cela correspondait à des expositions quotidiennes estimées à 1,1 x 10-4, 1,0 x 10-3, et 2,8 x 10-3 mg/kg p.c./jour pour le benzaldéhyde, l’octanal et le nonanal, respectivement. La concentration dans l’air intérieur au Canada a été utilisée comme substitut pour calculer les estimations de l’exposition par l’air ambiant pour l’octanal et le nonanal. Voir l’annexe C pour plus de détails
Il a également été rapporté par des essais en chambre à petite échelle (0,05 m3) que le benzaldéhyde, l’octanal et le nonanal sont émis par les matériaux de construction (Won et Yang 2012; Won et coll. 2013, 2014; Won 2015). Nous considérons que cette source d’exposition est prise en compte par la caractérisation de l’exposition provenant d’autres scénarios du tableau 6-5 (c’est-à-dire les assainisseurs d’air et les écrans solaires en aérosol) qui sont à l’origine de concentrations probablement plus élevées que celles émises par les matériaux de construction.
Eau
Les substances du groupe des aldéhydes n’ont pas été repérées ni mesurées dans les échantillons d’eau au Canada. Étant donné l’utilisation limitée et de l’octanal et de nonanal, et du faible niveau d’activité industrielle impliquant ces substances, d’après les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), on ne devrait pas s’attendre à une exposition à ces 2 substances par l’eau. Le benzaldéhyde a été relevé dans les eaux souterraines et de surface aux États-Unis jusqu’à 10 et 5,1 μg/L, respectivement (NWQMC 2019). Toutefois, compte tenu de l’absence de données de surveillance de l’eau de surface et de l’eau potable au Canada, la concentration de benzaldéhyde dans les eaux de surface a été estimée à l’aide du modèle de fugacité de niveau III ChemCAN v6.00 (ChemCAN 2003) et utilisée comme substitut de l’eau potable. La concentration environnementale prévue ainsi obtenue pour le benzaldéhyde dans les eaux de surface était de 7,9 x 10-4 μg/L. L’exposition quotidienne au benzaldéhyde provenant de l’eau potable pour le groupe d’âge présentant l’exposition la plus élevée par rapport au poids corporel (nourrissons nourris au lait maternisé, 0 à 0,5 mois) a été estimée à 1,0 x 10-7 mg/kg p.c./jour. Voir l’annexe C pour plus de détails.
Sol
Aucune donnée de concentration mesurée dans le sol n’a été obtenue pour les substances du groupe des aldéhydes. Étant donné l’utilisation limitée de l’octanal et du nonanal et des activités industrielles qui s’y rapportent, selon les renseignements soumis en réponse à une enquête menée en vertu de l’article 71 de la LCPE (Environnement Canada, 2013), on ne s’attend pas à une exposition à ces 2 substances par le sol. À l’aide du modèle de fugacité de niveau III ChemCAN v6.00 (ChemCAN 2003), la concentration de benzaldéhyde dans le sol a été prévue à 2,8 x 10-2 μg/kg. Compte tenu de cette valeur, l’exposition quotidienne potentielle au benzaldéhyde provenant du sol devrait être négligeable. Voir l’annexe C pour plus de détails.
6.1.2 Aliments
Le benzaldéhyde peut être utilisé comme composant de la formulation d’un agent clarifiant utilisé dans la fabrication de certains emballages alimentaires en contact direct avec les aliments; toutefois, l’exposition alimentaire due à cette utilisation est jugée négligeable (communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2018; source non citée).
Le JECFA a évalué le benzaldéhyde, le méthylbenzaldéhyde, le nonanal et l’octanal pour leur utilisation en tant qu’aromatisants alimentaires, et a évalué les apports par habitant pour la population américaine de ces substances sur la base des volumes de production annuels déclarés par l’industrie alimentaire (OMS 1999, 2002).
Les essences de vanille sont autorisées dans les aliments comme préparation aromatisante (sous forme d’extrait de vanille, d’essence de vanille ou d’arôme de vanille) selon le Règlement sur les aliments et drogues (Canada 1978; communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2018; source non citée). Étant donné que le potentiel de danger des essences de vanille est considéré faible, les apports alimentaires n’ont pas été estimés pour cette substance.
En l’absence de données sur l’utilisation réelle eventuelle du méthylbenzaldéhyde, du nonanal ou de l’octanal comme agents aromatisants dans les aliments vendus au Canada, les estimations de l’apport par habitant pour la population américaine ont été utilisées comme estimations de l’exposition alimentaire possible des Canadiens à ces substances due à leur présence dans les aliments (tableau 6-2; communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2019; source non citée).
| Substance | Absorption (μg par jour) | Estimation de l’exposition (μg/kg bw/day)a | Référence |
|---|---|---|---|
| Benzaldéhyde | 36000 | 600 | OMS 2002 |
| Méthylbenzaldéhyde | 1100 | 18 | OMS 2002 |
| Nonanal | 90 | 1.5 | OMS 1999 |
| Octanal | 17 | 0.29 | OMS 1999 |
a Exposition basée sur une personne de 60 kg (OMS 1999, 2002; Burdock 2010). En l’absence d’estimations d’exposition spécifiques aux groupes d’âge, ces expositions ont été supposées être identiques dans tous les groupes d’âge pertinents (1 an et plus). Les apports ajustés en fonction du poids corporel en utilisant un poids corporel de 60 kg sont considérés comme suffisamment prudents pour représenter l’ensemble de la population âgée de 1 an et plus (communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2019 et 2020; source non citée).
La présence naturelle du benzaldéhyde, du nonanal et de l’octanal a également été établie dans divers produits alimentaires (VCF 1992-2019; Burdock 2010). Sur la base des volumes de production et des ratios de consommation tirés des données de consommation américaines (Stofberg et Grundschober 1987), toute exposition potentielle au benzaldéhyde provenant de sa présence naturelle dans les aliments devrait être inférieure à celle provenant de son utilisation comme agent aromatisant alimentaire (communication personnelle, courriels de la DA, Santé Canada, au CCERS, Santé Canada, 2019; source non citée) et n’a donc pas été évaluée. Selon l’examen de l’octanal et du nonanal en tant qu’aromatisants alimentaires effectué par le JECFA (OMS 1999), l’exposition alimentaire à ces substances aux États-Unis due à leur présence naturelle dans les aliments devrait dépasser l’exposition à ces substances due à leur utilisation en tant qu’aromatisants alimentaires, dans des rapports de consommation de 8,6 et 1900 pour l’octanal et le nonanal, respectivement (Stofberg et Grundschober 1987), ce qui indique leur présence naturelle prédominante dans les aliments (communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2018; source non citée). En raison de l’incertitude importante liée à l’estimation de l’exposition alimentaire à l’octanal et au nonanal présents naturellement dans les aliments (par exemple en raison de la présence des substances à de faibles concentrations dans des centaines d’aliments et de la variabilité des données sur les concentrations dans les aliments et les habitudes de consommation au Canada, etc.), le calcul de l’exposition alimentaire provenant de cette source n’a pas été jugé significatif; ces expositions n’ont donc pas été quantifiées.
La présence naturelle du méthylbenzaldéhyde a été établie, mais dans un nombre limité d’aliments, avec peu d’informations sur ses concentrations. Par conséquent, les absorptions estimées provenant de son utilisation comme agent aromatisant alimentaire ont été considérées comme la principale source d’exposition alimentaire pour cette substance (communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2019; source non citée).
Les essences de vanille sont également présentes naturellement dans les aliments (par exemple, les gousses de vanille). Bien qu’aucune estimation de l’apport alimentaire n’ait été faite pour cette pour cette substance, il a été noté que l’exposition alimentaire aux essences de vanille due à leur présence naturelle dans les gousses de vanille utilisées comme ingrédients dans les aliments devrait être faible comparativement à l’exposition provenant des utilisations de ces substances comme aromatisants alimentaires (communication personnelle, courriels de la DA, Santé Canada, au BERSE, Santé Canada, 2020; source non citée).
6.1.3 Produits disponibles pour les consommateurs
Nous avons évalué l’exposition potentielle de la population générale canadienne aux substances du groupe des aldéhydes provenant de produits offerts aux consommateurs. Les tableaux 6-3, 6-4, et 6-5 présentent les scénarios de produits qui ont donné lieu aux niveaux les plus élevés d’exposition potentielle à chaque substance par voie orale, par voie cutanée et par inhalation, respectivement. Pour l’octanal, l’exposition par voie cutanée due à l’utilisation de produits connus disponibles pour les consommateurs devrait être faible et n’a donc pas été quantifiée. Ce sont les estimations de l’exposition quotidienne dues à ces scénarios de produits qui se sont avérées plus élevées que les expositions potentielles dues à l’utilisation ponctuelle ou intermittente d’autres produits. Par conséquent, seules les expositions quotidiennes sont présentées.
Les estimations des expositions potentielles ont été réalisées sur la base d’hypothèses prudentes et en utilisant les valeurs par défaut des scénarios d’exposition sentinelle; voir l’annexe B pour plus de détails.
| Substance | Scénario d’exposition au produit | Concentration | Groupe d’âge | Exposition générale quotidienne (mg/kg p.c./jour) |
|---|---|---|---|---|
| Benzaldéhyde | Baume à lèvres | 3 %a | Tout-petit (de 2 à 3 ans) | 0.044 |
| Octanal | Supplément de vitamines et de minéraux en comprimés | 0,0 3%b | Enfant (de 9 à 13 ans) | 0.023 |
| Nonanal | Supplément de vitamines et de minéraux en comprimés | 0,03 %b | Enfant (de 9 à 13 ans) | 0.023 |
a Les concentrations sont fondées sur les déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques (communication personnelle, courriels de la DSPCPD, Santé Canada, au BERSE, Santé Canada, 2018 et 2020; source non citée).
b L’octanal et le nonanal, ensemble, constituent jusqu’à 1 % du mélange d’arômes qui, à son tour, représente 95 mg par comprimé de 3052 mg (communication personnelle, courriels de la DSPSPD, Santé Canada, au BERSE, Santé Canada, 2018; source non citée).
| Substance | Scénario d’exposition au produit | Concentration | Groupe d’âge | Exposition générale quotidienne (mg/kg p.c./jour) |
|---|---|---|---|---|
| Benzaldéhyde | Hydratant corporel | 0,83 %a | Toddler (2 to 3 years)b | 1.8c |
| Nonanal | Écran solaire en aérosol | 1 % (FS 2016c) | Toddler (2 to 3 years) | 2.3c |
a Les concentrations sont établies selon les avis soumis à Santé Canada conformément au Règlement sur les cosmétiques (communication personnelle, courriels de la DSPCPD, Santé Canada, au BERSE, Santé Canada, 2018 et 2020; source non citée).
b D’après les données disponibles sur le produit, l’utilisation sur les nourrissons n’est pas prévue.
c L’absorption cutanée a été considérée équivalente à l’absorption orale.
| Substance | Scénario d’exposition au produit | Concentration (reference) | Groupe d’âge | Exposition systémique quotidienne (mg/kg p.c./jour)a | Exposition générale quotidienne (mg/m3) | concentration moyenne pondérée dans le temps (mg/m3) |
|---|---|---|---|---|---|---|
| Benzaldéhyde | Assainisseurs d’air | 50 % (FS 2019) | Tout-petit (1 an) | 0,88 | s.o. | s.o. |
| Octanal | Assainisseurs d’air | 5 % (FS 2015b) | Tout-petit (1 an)b | 0,073 | 0,1 | s.o. |
| Nonanal | Écran solaire en aérosol | 1 % (FS 2016c) | Adolescents (14 à 18 ans)b | 0,11 | 4,4 | 0,03c |
Abréviation : s.o., sans objet
a On suppose une absorption de 100 % par la voie de l’inhalation pour l’exposition systémique.
b Le groupe d’âge est applicable uniquement à l’exposition quotidienne sur une base de mg/kg p.c,/jour. Les concentrations dans l’air sont applicables à tous les groupes d’âge.
c La concentration moyenne pondérée dans le temps (MPT) de 10 minutes a été calculée pour correspondre à la durée d’exposition ajustée de l’étude des effets critiques utilisée pour caractériser le risque, qui représente une exposition continue. MPT de 10 minutes = concentration moyenne de l’évènement x durée d’exposition / 24 heures.
Aucun produit disponible pour les consommateurs contenant du méthylbenzaldéhyde n’a été identifié. Par conséquent, l’exposition de la population générale canadienne au méthylbenzaldéhyde par l’utilisation de tels produits ne devrait pas avoir lieu.
Pour les essences de vanille, l’exposition par voie orale ou cutanée peut provenir de l’utilisation d’ingrédients connexes comme ingrédients non médicinaux dans des produits de santé naturels destinés à un usage oral ou topique, respectivement. Les expositions par ces voies peuvent également provenir de l’utilisation de ces ingrédients dans les cosmétiques (par exemple, les hydratants corporels, les produits de soins capillaires, les dentifrices et les déodorants). Comme les essences de vanille sont considérées comme ayant un faible potentiel de danger, des estimations quantitatives de ces expositions potentielles n’ont pas été calculées
6.2 Évaluation des effets sur la santé
6.2.1 Benzaldéhyde
Le benzaldéhyde a déjà été évalué par l’AGDH (2016), l’EFSA (2005, 2012), l’EPA des É.-U. (2010, 2015), l’OCDE (2002) et le JECFA (OMS 1967, 1996, 2002). Le JECFA a établi une dose journalière admissible (DJA) de 0 à 5 mg/kg p.c. (exprimée en équivalents d’acide benzoïque) lors de son utilisation en tant qu’agent aromatisant et n’a pas relevé de problème de sécurité aux niveaux actuels d’absorption pour cette utilisation spécifique. Un dossier sur l’enregistrement, l’évaluation, l’autorisation et les restrictions de produits chimiques (REACH) est également disponible (ECHA c2007-2019).
Toxicocinétique
Le benzaldéhyde est facilement absorbé par les voies respiratoires et gastro-intestinales. Il ne reste que 1,2 % dans les voies respiratoires 1,5 minute après l’inhalation et près de 80 % sont excrétés dans l’urine après une ingestion orale (AGDH 2016). Il peut également être absorbé intacte par la peau, et il est rapidement éliminé après avoir atteint le pic de concentration, avec une demi-vie d’environ 10 minutes (EPA des É.-U. 2015; AGDH 2016). En cas d’inhalation, une demi-vie dans le sang de 8 minutes a été établie (AGDH 2016). Il est métabolisé dans le foie principalement en acide benzoïque (libre et conjugués glucuroniques) et en acide hippurique. En plus d’autres conjugués benzoyles ou benzyl glucuroniques, il peut également être excrété sous forme inchangée. La formation d’acide hippurique repose sur la conjugaison de l’acide benzoïque avec la glycine, une étape qui peut limiter la vitesse (OMS 1997). En cas d’administration par voie orale ou par inhalation, l’excrétion des métabolites du benzaldéhyde se fait principalement par voie urinaire (OCDE 2002)
Toxicité à doses répétées
Dans une étude à court terme sur l’exposition du corps entier par inhalation, des rats Sprague-Dawley (14/sexe/concentration) ont été exposés à 0, 500, 750 et 1000 ppm (0, 2170, 3260 ou 4341 mg/m3) de benzaldéhyde 6 heures/jour pendant 14 jours consécutifs (Laham et coll. 1991 Parmi les effets observés sur la santé, on note une augmentation significative du poids absolu et du poids relatif du foie chez les femelles de tous les groupes d’essai et une diminution significative du gain de poids corporel chez les mâles de tous les groupes d’essai. De plus, les femelles de tous les groupes d’essai ont présenté une augmentation significative des taux de sérum aspartate aminotransférases (ASAT) (49 % à 152 %) et une diminution significative des taux d’albumine (8 % à 11 %), de protéines totales (5 % à 8 %) et de cholinestérase (26 % à 35 %). Les femelles du groupe 750 ppm ont également présenté une augmentation significative de 34 % des niveaux de sérum d’alanine aminotransférase. Les mâles n’ont présenté qu’une augmentation significative des niveaux de sérum ASAT (31 % à 58 %). D’autres changements biochimiques ont été observés dans tous les groupes testés; cependant, nous avons jugé qu’ils se situaient dans la fourchette historique normale des colonies d’animaux utilisées par les auteurs de l’étude et aucune signification biologique ne leur a donc été attribuée. Bien que le poids du foie et les paramètres de biochimie des sérums aient été modifiés, aucune modification histopathologique du foie n’a été observée, ce qui suggère que les effets sur le foie peuvent être adaptatifs. Le résultat histopathologique le plus significatif était une métaplasie légère des cellules caliciformes, observée dans l’épithélium respiratoire tapissant la cloison nasale chez les mâles, dont la gravité ne différait pas entre les groupes de 500 et 1000 ppm, ainsi que des changements moins prononcés dans la morphologie du tissu nasal chez les femelles. La mortalité et les signes cliniques de toxicité (démarche anormale, agressivité, tremblements, convulsions) ont été observés à la plus forte dose testée. Compte tenu des lésions observées dans les tissus nasaux, de la réduction des taux de sérum cholinestérase et des modifications du poids et des enzymes du foie, une concentration minimale avec effet nocif observé (CMENO) de 500 ppm (2170 mg/m3), la plus faible concentration testée, est établie pour tenir compte des effets à la porte d’entrée et des effets systémiques.
Dans une étude de l’exposition subchronique par inhalation peu détaillée (OCDE 2002), des rats ont été exposés au benzaldéhyde à des concentrations comprises entre 6 et 26 mg/m3 à raison de 5 heures/jour, pendant 4 mois. Des modifications des paramètres sanguins et du poids corporel sont apparues à 26 mg/m3 et se sont inversées après l’arrêt du traitement.
Dans 2 études à court terme sur l’exposition par voie orale (Kluwe et coll., 1983; NTP, 1990), des souris B6C3F1 (5/sexe/dose) ont reçu 0, 200, 400, 800, 1600 ou 3200 mg/kg p.c./jour de benzaldéhyde, tandis que des rats Fischer 344 (5/sexe/dose) ont reçu 0, 100, 200, 400, 800 ou 1600 mg/kg p.c./jour de benzaldéhyde dissous dans de l’essence de maïs, par gavage, 5 jours par semaine pendant 16 jours, suivis d’une période de récupération de 2 jours. Des diminutions significatives du poids corporel des mâles (14 %) et des femelles (11 %) sont observées chez les rats exposés à 800 mg/kg p. c. par jour, mais les changements de poids corporel dans les autres groupes se sont produits dans les 10 % du groupe témoin. Un effet similaire n’a pas été observé chez les souris. À 800 mg/kg p.c./jour, 2 rats de chaque sexe et une souris mâle sont décédés, tandis que tous les rats et toutes les souris sont décédés dans les 2 ou 3 jours suivant l’exposition à 1600 mg/kg p.c./jour et à 3200 mg/kg p.c./jour, respectivement. Des incidences d’hyperexcitabilité, de tremblements et d’inactivité pendant toute la durée de l’étude à 800 et 1600 mg/kg p.c./jour ont été signalées chez les rats dans une étude (Kluwe et coll. 1983) et non pas dans l’autre (NTP 1990). Une dose sans effet nocif observé (DSENO) de 400 mg/kg p.c./jour est établie sur la base d’une diminution du taux de survie chez les rats et les souris, et d’une diminution du poids corporel et d’une augmentation de la fréquence des signes cliniques chez les rats à des doses de 800 mg/kg p.c./jour et plus.
Dans des études de l’exposition subchronique par voie orale (Kluwe et coll., 1983; NTP, 1990), des souris B6C3F1 (10/sexe/dose) ont reçu 0, 75, 150, 300, 600 ou 1200 mg/kg p.c./jour de benzaldéhyde, tandis que des rats Fischer 344 (10/sexe/dose) ont reçu 0, 50, 100, 200, 400 ou 800 mg/kg p.c./jour de benzaldéhyde par gavage dans de l’essence de maïs 5 jours/semaine pendant 13 semaines. À 1 200 mg/kg p.c./jour, 1 souris femelle et 9 souris mâles sont mortes au cours des 4 premières semaines de traitement, avec une dégénérescence légère à modérée des tubules rénaux ayant été observée chez les mâles. Chez les rats mâles et femelles exposés à 800 mg/kg p.c./jour, une croissance significative de l’incidence de l’hyperplasie épithéliale légère ou de l’hyperkératose du préestomac, de la dégénérescence et/ou de la nécrose du foie et des reins, et des lésions nécrotiques et dégénératives du cervelet et de l’hippocampiques ont été observées. Par ailleurs, 6 rats et 4 rates sont décédés à 800 mg/kg p.c./jour. Une réduction du poids absolu et relatif ( au cerveau) du thymus et des testicules des rats mâles, et une augmentation du poids du foie, du thymus, des reins et du cœur chez les rates ont été rapportées. Une légère hyperplasie épithéliale et une hyperkératose du préestomac ont été rapportées pour 2 rats mâles exposés à 400 mg/kg p.c./jour dans une étude (Kluwe et coll. 1983), ce qui n’a pas été rapporté à cette dose dans l’autre étude (NTP 1990). À la lumière de ces résultats, une CMENO de 400 mg/kg p.c./jour est établie chez les rats en fonction de l’incidence de diverses lésions des tissus et de la diminution du taux de survie à 800 mg/kg p.c./jour (qui est la dose la plus élevée testée chez les rats). La DSENO est établie à 600 mg/kg p.c./jour chez les souris sur la base de la baisse du taux de survie et de la dégénérescence des tubules rénaux à la dose suivante (soit 1200 mg/kg p.c./jour, qui est la dose la plus élevée testée chez les souris). L’EPA des É.-U. a établi la dose sans effet observé (DSEO) de 200 mg/kg p.c./jour chez le rat en se basant sur l’hyperplasie et l’hyperkératose du préestomac observées à 400 mg/kg p.c./jour et à 600 mg/kg p.c./jour chez la souris en se basant sur des effets sur les reins (Kluwe et coll. 1983) afin d’établir la dose de référence pour une exposition chronique par voie orale (EPA des É.-U. 1988, 2015). Cependant, cette dose a été calculée avant la publication des études de 13 semaines et de 2 ans du National Toxicology Program (décrites ci-dessous) (NTP 1990, 2015).
Dans 2 études sur l’exposition à long terme par voie alimentaire, (Hagan et coll. 1967), des rats Osborne-Mendel (5/sexe/dose et 10/sexe dans le groupe témoin) ont reçu du benzaldéhyde à 0, 1000 ou 10 000 ppm (soit 0,70 ou 870 mg/kg p.c./jour pour les mâles et 0,77 ou 950 mg/kg p.c./jour pour les femelles, selon les estimations de l’US EPA 2015) pendant 16 à 28 semaines. Aucun effet indésirable lié aux paramètres examinés n’a été rapporté à l’une ou l’autre des doses testées.
Aucune étude sur la toxicité de l’exposition au benzaldéhyde à doses répétées par voie cutanée n’a été identifiée.
Génotoxicité et cancérogénicité
Les essais de mutagénicité du benzaldéhyde ont produit des résultats équivoques. Plusieurs essais de mutation inverse sur bactéries se sont révélés négatifs, avec et sans activation métabolique (EPA des É.-U. 2015). Une étude (EPA des É.-U. 2015) utilisant des souches à l’essai propres à la base de Salmonella typhimurium en présence d’une activation métabolique a donné un résultat positif uniquement pour la souche TA7005. Cette souche présente des mutations de G:C à A:T. Sur 2 études de mutagénicité effectuées sur des cellules cultivées de lymphomes de souris L5178Y (TK+/-), l’une a produit des résultats positifs à des concentrations avoisinant les valeurs cytotoxiques (EPA des É.-U. 2015), tandis que l’autre a produit des résultats négatifs à des concentrations similaires (EPA des É.-U. 2015).
Il existe des rapports contradictoires sur la capacité du benzaldéhyde in vitro à provoquer des dommages à l’ADN. Des aberrations chromosomiques ont été observées dans des cellules B241 (avec et sans activation métabolique) et des cellules pulmonaires (uniquement avec activation métabolique), mais non pas dans des cellules ovariennes de hamster chinois (EPA des É.-U. 2015). Des résultats positifs ont été rapportés pour les tests d’échange de chromatides sœurs dans les cellules pulmonaires de hamster chinois et les lymphocytes humains en l’absence d’activation métabolique (EPA des É.-U. 2015). Le benzaldéhyde a causé des dommages à l’ADN, comme en témoigne l’augmentation des moments de queue et de la longueur dans les essais de Comet d’ADN utilisant des lymphocytes humains et des hémocytes de Drosophila melanogaster (EPA des É.-U. 2015). Quant aux dommages causés à l’ADN par le benzaldéhyde, les tests de réparation de l’ADN effectués sur des souches de Bacillus subtilis ont produit des résultats négatifs ou équivoques (EPA des É.-U. 2015).
Dans l’ensemble, l’AGDH (2016) et l’EFSA (2005) ont conclu que le potentiel génotoxique du benzaldéhyde ne posait aucune préoccupation en termes de sécurité.
Dans une étude de cancérogénicité de l’exposition par voie orale (NTP 1990) des rats Fischer 344 et des souris B6C3F1 (50/sexe/dose), du benzaldéhyde dissous dans de l’essence de maïs a été administré par gavage à diverses doses (0, 200 ou 400 mg/kg p.c./jour aux souris et aux rats mâles et femelles; 0, 300 ou 600 mg/kg p.c./jour aux rates) pendant 103 ou 104 semaines. L’étude n’a porté que sur le poids corporel, l’autopsie macroscopique et les évaluations histopathologiques. Les rats mâles ont montré une baisse significative du taux de survie à la dose de 400 mg/kg p.c./jour au cours de la deuxième année de l’étude (21/50 animaux ont survécu à la fin de l’étude contre 37/50 dans le groupe témoin; les jours de survie à la dose élevée étaient de 608 contre 698 chez les témoins). Les rats mâles du groupe recevant 400 mg/kg p.c./jour ont présenté une hausse significative des lésions prénéoplasiques sous forme d’hyperplasie pancréatique (12/48 contre 6/49 chez les témoins) et une hausse significative des adénomes pancréatiques (7/48 par rapport à 3/49), qui ont été considérés par les auteurs de l’étude comme étant dans la fourchette historique (0/49 à 11/50) et non liés au traitement. Les souris femelles ont manifesté, à chacune des 2 doses, une hausse significative de l’hyperplasie focale et des papillomes des cellules squameuses dans le préestomac, témoin d’une tendance statistiquement significative liée à la dose. Les souris mâles, quant à elles, ont présenté des effets similaires seulement à la dose la plus élevée, qui n’étaient pas statistiquement significatifs. Dans tous les cas, la progression vers le carcinome n’a pas été détectée. Les auteurs ont conclu qu’il n’existait aucune preuve évidente de cancérogénicité chez les rats, tandis qu’il existait certaines preuves de cancérogénicité chez les souris. Cependant, il est connu que le développement de lésions prolifératives du préestomac est dû à des lésions causées par la méthode d’administration par gavage, particulièrement avec l’utilisation de concentrations élevées d’essence de maïs (10 mL/kg), qui peuvent être cytotoxiques. Compte tenu de la localisation des lésions prolifératives du préestomac et de l’absence de progression vers des carcinomes, les auteurs de l’étude considèrent que le potentiel cancérigène du benzaldéhyde est incertain. L’EPA des É.-U. (2015) a établi une limite de confiance inférieure de la dose repère pour un risque supplémentaire de 10 % (BMDL10) en se basant sur l’incidence du papillome spinocellulaire dans le préestomac chez les souris femelles. Cependant, l’AGDH (2016), le JECFA (OMS 1996) et l’EFSA (2005) ont considéré que cet effet n’était pas pertinent ou n’était pas lié au traitement ont déterminé qu’il n’y avait aucune préoccupation concernant le potentiel cancérogène du benzaldéhyde par exposition orale. Dans la logique de l’AGDH (2016), du JECFA (OMS 1996) et de l’EFSA (2005), on considère que le benzaldéhyde n’a pas de potentiel cancérogène. Le paramètre d’effet de santé critique de cette étude était basé sur un taux de survie plus faible chez les rats mâles à 400 mg/kg p.c./jour, et ainsi, une DSENO de 200 mg/kg p.c./jour a été établie pour la toxicité systémique.
Toxicité pour la reproduction et le développement
Dans une étude de toxicité pour la reproduction sur une génération, ne suivant pas les lignes directrices (OCDE 2002; ECHA c2007-2019), des rates gestantes (10/dose) ont reçu du benzaldéhyde à des doses de 0 ou 5 mg/kg p.c./jour par gavage tous les 2 jours à partir de 75 jours avant l’accouplement et pendant 2 cycles de gravidité, pour un total de 32 semaines. Les paramètres examinés comprenaient le nombre de femelles gravides, le nombre de petits nés, le poids corporel des nouveau-nés aux jours 7 et 21 postpartums, et la viabilité des petits. Aucun effet indésirable n’a été signalé par les auteurs de l’étude, ni chez les mères ni chez les nouveau-nés. Cependant, il est probable que la dose de la substance administrée dans le cadre de l’étude n’était pas suffisamment élevée.
Aucune autre étude de toxicité de l’exposition au benzaldéhyde pour la reproduction ou le développement n’a été recensée.
Les données sur la toxicité du benzoate de sodium en tant que substance analogue ont également été utilisées pour étayer l’évaluation des effets du benzaldéhyde sur le développement et la reproduction. Le benzoate de sodium est ionisé dans l’estomac en acide benzoïque, qui est l’un des principaux métabolites du benzaldéhyde. Le benzoate de sodium a été utilisé par le JECFA (OMS 1996) et l’EFSA (2012) pour caractériser la toxicité de l’exposition aux dérivés du benzyle, y compris le benzaldéhyde, pour le développement.
Dans une étude de toxicité pour le développement (ECHA C2007-2019), des rates Wistar gravides ont été nourries avec un régime alimentaire contenant du benzoate de sodium. Aucun effet indésirable sur le développement n’a été observé à des doses allant jusqu’à 1306 mg/kg p.c./jour, ce qui dépasse la dose limite de 1000 mg/kg p.c./jour. Dans une deuxième étude (ECHA C2007-2019), aucun effet indésirable sur le développement n’a été observé sur les animaux jusqu’à la dose la plus élevée testée pour chaque espèce (175 mg/kg p.c./jour pour les rats Wistar et les souris CD-1, 300 mg/kg p.c./jour pour les hamsters dorés et 250 mg/kg p.c./jour pour les lapins Dutch belted).
Selon les conclusions de l’AGDH (2016), du JECFA (OMS 1996) et de l’EFSA (2012), le benzaldéhyde ne présente pas de potentiel de toxicité pour la reproduction ou le développement.
6.2.2 Octanal
L’octanal a été évalué par l’EFSA (2013, 2017) et le JECFA (OMS 1967, 1979, 1981, 1984, 1999). Le JECFA a établi une DJA de 0 à 0,1 mg/kg p.c. lorsque cette substance est utilisée comme aromatisant et n’a pas relevé de problème de sécurité aux niveaux actuels d’absorption pour cette utilisation spécifique. Un dossier d’enregistrement REACH pour l’octanal est également disponible).
Toxicocinétique
Les données toxicocinétiques disponibles pour cette substance sont limitées. L’octanal devrait s’oxyder rapidement en acide octanoïque, probablement via l’enzyme aldéhyde déshydrogénase (ECHA c2007-2019). Il est ensuite métabolisé par les voies des acides gras et des acides tricarboxyliques (OMS 1999).
Toxicité à doses répétées
Dans une étude de l’exposition subchronique par voie alimentaire, des rats sevrés mâles et femelles (12/sexe/dose) ont été nourris avec un mélange de 6 aldéhydes aliphatiques pendant 12 semaines, fournissant une dose quotidienne de 13 mg/kg p.c./jour d’octanal (dose totale du mélange = 112 mg/kg p.c./jour). À cette dose unique de 13 mg/kg p.c./jour, aucun effet indésirable n’a été observé sur les paramètres étudiés : apparence, comportement, croissance, consommation d’aliments, taux de sucre ou d’albumine dans l’urine, hémoglobine dans le sang, poids du foie et des reins et pathologie générale (OMS 1979).
Aucune étude de Toxicité à doses répétées par voie cutanée ou par inhalation n’a été recensée.
Afin d’étayer la caractérisation des dangers liés aux expositions par voies cutanée et respiratoire, et compléter les données limitées sur les effets sur la santé des expositions par voie orale, nous avons choisi le nonanal, le butanal et l’isobutanal comme substances analogues. Les substances analogues sont des aldéhydes aliphatiques qui devraient avoir un profil métabolique commun avec l’octanal. Le butanal et l’isobutanal ont été évalués par l’OCDE (1996a, 1996b) et ont fait l’objet de dossiers d’enregistrement REACH (ECHA c2007-2019).
Dans une étude dermique à court terme du nonanal chez des lapins néo-zélandais (Biodynamics Inc. 1981, ECHA c2007-2019), aucun effet systémique n’a été rapporté à la dose unique de 500 mg/kg p.c./jour. Voir la section Toxicité à doses répétées du nonanal (section 6.2.3) pour une description de cette étude.
Dans des études d’exposition orale à court terme (ECHA c2007-2019), des rats F344 et des souris, B6C3F1 (10/sexe/dose) ont reçu 0, 156, 313, 625, 1250 ou 2500 mg/kg p.c./jour de butanal par gavage pendant 14 jours. Parmi les effets rapportés, on note des lésions nasales et stomacales à partir de 625 mg/kg p.c./jour chez le rat, et à partir de 1250 mg/kg p.c./jour chez la souris. Par ailleurs, a enregistré de la mortalité aux mêmes doses; toutefois, les rats semblaient plus sensibles. Les auteurs ont déterminé une DSENO de 313 mg/kg p.c./jour chez les rats et une DSENO de 625 mg/kg p.c./jour chez les souris, sur la base de lésions locales dans les tissus nasaux et stomacaux et d’une mortalité accrue à des doses plus élevées.
Dans une étude de l’exposition subchronique par voie orale (ECHA c2007-2019; OCDE 1996a), des rats F344 et des souris B6C3F1 (10/sexe/dose) ont reçu 0, 75, 150, 300, 600 ou 1200 mg/kg p.c./jour de butanal par gavage pendant 13 semaines. Parmi les effets rapportés figurent des lésions nasales à toutes les doses chez le rat et à des doses de 300 mg/kg p.c./jour et plus chez la souris, des lésions gastriques à des doses de 600 mg/kg p.c./jour et plus chez le rat et à des doses de 1200 mg/kg p.c./jour chez la souris, une diminution du gain de poids corporel à des doses de 1200 mg/kg p.c./jour chez le rat et la souris, ainsi que de la mortalité. Les auteurs ont établi des doses minimales avec effet nocif observé (DMENO) de 75 mg/kg p.c./jour pour les rats et de 150 mg/kg p.c /jour pour les souris par sur la base de lésions nasales survenues à la plus faible dose testée pour les rats et à 300 mg/kg p.c./jour pour les souris.
Dans une étude de l’exposition subchronique par inhalation (OCDE 1996a), des rats Sprague-Dawley (20/sexe/concentration) et des chiens Beagle mâles (4/concentration) ont été exposés au butanal à 0, 117, 462 ou 1852 ppm (soit 0, 345, 1362 ou 5461 mg/m3) 6 heures/jour, 5 jours/semaine pendant 13 à 14 semaines. Chez les rats, on a constaté de l’hyperplasie des cellules caliciformes de l’épithélium nasal, de la rhinite légère à grave et de la métaplasie spinocellulaire de l’épithélium respiratoire dans tous les groupes de traitement, avec une fréquence et une gravité qui diminuaient avec la baisse de la concentration. L’atrophie des cellules caliciformes s’est produite principalement dans le groupe recevant la plus forte concentration. Des effets similaires ont été observés chez le chien; une hyperplasie des cellules caliciformes de la muqueuse nasale s’est produite dans les groupes recevant les concentrations faibles ou moyennes, en plus de la rhinite marquée, de l’hyperplasie des cellules de la muqueuse, de l’inflammation et de la métaplasie malpighienne à la concentration la plus élevée. Aucune toxicité systémique ou spécifique à un organe n’a été observée. Sur la base de ces observations, une CMENO de 117 ppm (345 mg/m3), qui est la plus faible concentration testée, est établie sur la base des effets de voie d’entrée.
Dans une autre étude de l’exposition subchronique par inhalation (OCDE 1996a), des rats Fischer 344 (15/sexe/concentration) ont été exposés à 0, 1, 10 ou 51 ppm (0, 2,9, 29 ou mg/m3) de de butanal 6 heures/jour, 5 jours/semaine pendant 13 semaines. Aucun effet indésirable local ou systémique n’a été observé jusqu’à la plus forte concentration testée de 150 mg/m3.
Dans une étude d’exposition chronique de 2 ans par inhalation (OCDE 1996b), des rats Fischer 344 (50/sexe/concentration) et des souris B6C3F1 (50/sexe/concentration) ont été exposés à des concentrations de 0, 500, 1000 ou 2000 ppm (0, 1474, 2949 ou 5898 mg/m3) d’isobutanal 6 heures/jour, 5 jours/semaine. Des métaplasies malpighiennes légères à modérées de l’épithélium respiratoire ont été observées chez les rates exposés à 500 ppm et chez les rats et souris mâles et femelles exposés à 1000 ou 2000 ppm. Des rhinites et des dégénérescence mineures à légères de l’épithélium olfactif ont été observées chez les rats et les souris exposés à 1000 ou 2000 ppm. De plus, la survie des souris mâles exposées à 2000 ppm était inférieure à celle des souris témoins, tandis que les souris femelles exposées à 1000 ou 2000 ppm avaient un poids corporel moyen inférieur à celui des souris témoins au cours de la deuxième année de l’étude. Ainsi, la CMENO a été établie à de 500 ppm (1474 mg/m3) sur la base des effets de la porte d’entrée chez les rates.
Génotoxicité et cancérogénicité
Les tests de mutagénicité de l’octanal ont donné des résultats négatifs dans un essai de mutation inverse sur bactéries en présence et en l’absence d’activation métabolique (Florin 1980).
On n’a pas identifié d’études de cancérogénicité portant sur l’octanal; par conséquent, les données d’une étude d’exposition par inhalation de 2 ans utilisant son analogue, l’isobutanal ont été utilisées pour la lecture croisée (OCDE 1996b). Des rats Fischer 344 (50/sexe/concentration) et des souris B6C3F1 (50/sexe/concentration) ont été exposés à 0, 500, 1000, ou 2000 ppm (0, 1474, 2949, ou 5898 mg/m3) 6 heures/jour, 5 jours/semaine. Aucune lésion néoplasique n’a été observée chez aucune des 2 espèces. Les lésions non néoplasiques comprenaient des métaplasies malpighiennes légères à modérées de l’épithélium respiratoire chez les 2 espèces à toutes les concentrations. Aucune activité cancérigène n’a été identifiée jusqu’à 2000 ppm (5898 mg/m3), la plus haute concentration testée (OCDE 1996b).
Toxicité pour la reproduction et le développement
On n’a recensé aucune étude sur la toxicité de l’octanal pour la reproduction et le développement; par conséquent, les données sur l’isobutanal ont été utilisées dans une approche de lecture croisée. Dans une étude de toxicité de l’exposition par inhalation à doses répétées (OCDE 1996b), des rats Fischer 344 mâles et femelles et des souris B6C3F1 ont été exposés à l’isobutanal jusqu’à 4000 ppm (11 796 mg/m3; pour les rats) et 2000 ppm (5898 mg/m3 pour les souris) 6 heures/jour, 5 jours/semaine pendant 13 semaines. Aucun effet indésirable n’a été observé dans les paramètres de reproduction examinés (cytologie des spermatozoïdes et poids des organes de reproduction mâles). Les mâles du groupe ayant reçu la concentration la plus élevée ont présenté une baisse à la fois du poids corporel et une baisse de la prise de poids. Les auteurs de l’étude ont conclu que la diminution de la motilité des spermatozoïdes chez les rats n’était pas liée au traitement en raison d’une relation dose-réponse variable. Aucun effet indésirable sur la densité et la morphologie des spermatozoïdes ni sur le poids des testicules n’a été observé ni chez les rats ni chez les souris, malgré une diminution du poids absolu de l’épididyme caudal droit et du poids absolu et relatif de l’épididyme droit chez les rats exposés à 4000 ppm.
Dans une étude sur le développement (OCDE 1996b), des rates Wistar gravides (25/concentration) ont été exposées à des doses de 0, 1000, 2500 ou 4000 ppm (0, 1474, 7372 ou 11 796 mg/m3) d’isobutanal 6 heures/jour du 6ème au 15ème jour de gestation (JG). Une diminution du gain de poids corporel et des lésions de la muqueuse nasale ont été observées chez les mères à 2500 et 4000 ppm. Aucun effet indésirable n’a été observé chez la progéniture. Par conséquent, la concentration sans effet nocif observé (CSENO) de la toxicité maternelle a été établie à 1000 ppm (1474 mg/m3). Aucune toxicité fœtale n’a été observée à des concentrations allant jusqu’à 4000 ppm (11 796 mg/m3), la plus haute concentration testée.
6.2.3 Nonanal
Le nonanal a été évalué par l’EFSA (2013, 2017) et le JECFA (OMS 1967, 1979, 1984, 1999, 2002). Le JECFA a établi une DJA de 0 à 0,1 mg/kg p.c. lors de l’utilisation de cette substance en tant qu’aromatisant et n’a pas constaté de problème de sécurité aux niveaux actuels d’absorption pour cette utilisation spécifique. Un dossier d’enregistrement REACH pour le nonanal est également disponible (ECHA c2007-2019).
Toxicocinétique
Les données toxicocinétiques disponibles sont limitées. On s’attend à ce que le nonanal s’oxyde rapidement en acide nonanoïque, qui est ensuite métabolisé par les voies des acides gras et des acides tricarboxyliques (OMS 1999).
Toxicité à doses répétées
Dans une étude d’exposition par voie cutanée (Biodynamics Inc.1981; ECHA c2007-2019), des lapins néo-zélandais mâles et femelles (5/sexe/dose) ont été traités avec 0 ou 500 mg/kg p.c./jour de nonanal dissous dans de l’essence minérale, 5 jours par semaine pendant 2 semaines. Le nonanal a été appliqué sans occlusion sur une peau abrasée et intacte. Des modifications mineures du poids corporel et de la consommation alimentaire sont survenues pendant le traitement, mais ces effets se sont complètement inversés pendant la période de récupération. L’examen histopathologique a révélé une irritation de la peau au site d’application sous forme de nécrose épidermique, d’hyperplasie et d’hyperkératose au cours de la deuxième semaine d’exposition. Cependant, la peau semblait guérie à la fin de la période de récupération. Aucun autre effet n’a été signalé par les auteurs de l’étude. Ainsi, malgré des effets locaux et réversibles, aucun effet systémique n’a été observé à la dose unique de 500 mg/kg p.c./jour.
Dans une étude de l’exposition subchronique alimentaire, des rats sevrés mâles et femelles (12/sexe) ont été nourris avec un mélange de 6 aldéhydes aliphatiques pendant 12 semaines, fournissant une dose quotidienne de 29 mg/kg p.c./jour de nonanal (dose totale du mélange = 112 mg/kg p.c./jour). À cette dose unique de 29 mg/kg p.c./jour, aucun effet indésirable n’a été observé sur aucun des paramètres examinés : apparence, comportement, croissance, consommation de nourriture, taux de sucre ou d’albumine dans l’urine, hémoglobine dans le sang, poids du foie et des reins et pathologie générale (OMS 1979).
Aucune étude de toxicité par inhalation à doses répétées n’a été recensée.
Pour étayer la caractérisation des dangers liés à l’exposition par inhalation et compléter les données limitées sur les effets sur la santé liés à l’exposition par voie orale, le butanal et l’isobutanal ont été choisis comme analogues. Cela permet de renseigner les effets du nonanal sur la santé qui sont spécifiques à ces voies, en utilisant une approche de lecture croisée. Les 2 substances analogues sont des aldéhydes aliphatiques qui devraient avoir un mode d’action et un profil toxicocinétique communs avec le nonanal. Les 2 substances ont été évaluées par l’OCDE (1996a, 1996b).
Voir la section Toxicité à doses répétées pour l’octanal (section 6.2.2) pour une description des études de toxicité de l’exposition au butanal et à l’isobutanal par voies orale et respiratoire.
Génotoxicité et cancérogénicité
Les résultats des tests de mutagénicité du nonanal sont équivoques. Dans 4 tests d’Ames, le nonanal n’a pas causé de mutations inverses dans plusieurs souches de Salmonella typhimurium (TA97, TA98, TA100, TA102, TA104, TA1535, TA1537 ou TA1538), avec et sans activation métabolique (Marnett et coll. 1985; Florin et coll. 1980; Jagannath et coll. 1980; Mortelmans et coll. 1986). Un essai de mutation directe de la thymidine kinase sans activation métabolique dans des cellules de lymphome de souris a donné des résultats négatifs, et des résultats faiblement positifs pour la mutagénicité avec activation métabolique, bien que cela se soit produit à des concentrations cytotoxiques (Myhr et coll. 1981). Dans un autre essai de mutation directe de la thymidine kinase sur des cellules de hamster chinois V79, le nonanal a causé une mutagénicité sans activation métabolique (Brambilla et coll., 1989).
Les résultats des tests de clastogénicité du nonanal sont équivoques. Le nonanal n’a pas provoqué d’augmentation de la synthèse non programmée d’ADN dans les hépatocytes du rat et de l’humain (Martelli et coll. 1994). Dans plusieurs essais menés dans le même laboratoire, le nonanal a provoqué un échange de chromatides soeurs mais n’a causé ni d’augmentation de l’indice mitotique, ni d’aberrations chromosomiques ni de micronoyaux dans les hépatocytes du rat (Esterbauer et coll. 1990; Eckl 1993; Eckl 1994).
Aucune étude sur les effets cancérigènes du nonanal n’a été recensée. Une étude de 2 ans de la cancérogénicité par inhalation de l’isobutanal est utilisée pour étayer le potentiel cancérogène de cette substance en utilisant une approche de lecture croisée. Voir la section sur la cancérogénicité de l’octanal (section 6.2.2) pour une description de cette étude sur l’isobutanal.
Toxicité pour la reproduction et le développement
Aucune étude de toxicité de l’isobutanal pour la reproduction ou le développement n’a été recensée.
Voir la section sur la toxicité de l’octanal pour la reproduction et le développement (section 6.2.2) pour une description des études utilisées pour décrire la toxicité potentielle de l’isobutanal pour la reproduction et le développement, qui sont également utilisées pour définir ces paramètres dans le cas du nonanal.
6.2.4 Méthylbenzaldéhyde
Comme indiqué à la section 2, le méthylbenzaldéhyde existe sous la forme d’un mélange des isomères ortho, para et méta. Il a été évalué par l’EFSA (2005, 2009) et le JECFA (OMS 2002). Aucune DJA n’a été établie, toutefois le JECFA n’a identifié aucun problème de sécurité aux niveaux d’absorption actuels de méthylbenzaldéhyde lorsqu’il est utilisé comme aromatisant.
Toxicocinétique
Les 3 isomères du méthylbenzaldéhyde s’oxydent in vivo, probablement par des enzymes microsomales hépatiques, pour produire leurs acides correspondants (BIBRA 1990; OMS 2002), (Watanabe et coll. 1995).
Toxicité à doses répétées
Dans une étude de la toxicité subchronique (Brantom et coll. 1972), des rats (15/sexe/dose) ont reçu du méthylbenzaldéhyde (isomères méta et para en proportions égales) dissous dans de l’essence de maïs par gavage à des doses de 0, 50, 250 ou 500 mg/kg p.c./jour pendant 13 semaines. Le seul effet significatif a été une réduction du poids relatif de l’hypophyse (14 % de moins que les témoins) chez les femelles à la plus forte dose testée et à la semaine 13; toutefois, aucun effet histopathologique associé n’a été observé. Quelques changements dans le poids des intestins grêles ont été notés; cependant, selon les auteurs de l’étude ces changement n’étaient pas liés au traitement. Les auteurs de l’étude ont établi une DSENO de 250 mg/kg p.c./jour sur la base des changements du poids relatif de l’hypophyse chez les femelles à 500 mg/kg p.c./jour.
Dans une autre étude de l’exposition subchronique (Oser et coll., 1965), des rats FDRL (15/sexe/dose) ont reçu du méthylbenzaldéhyde (proportions d’isomères non précisées) dissous dans de l’essence de coton dans leur alimentation à des doses de 0, 36 (mâles) et 43 (femelles) mg/kg p.c./jour pendant 90 jours. Les auteurs de l’étude n’ont rapporté aucun effet sur les paramètres examinés chez les mâles et les femelles.
Aucune étude de toxicité à doses répétées par voies cutanée ou respiratoire n’a été recensée.
Génotoxicité et cancérogénicité
Les tests de mutagénicité du méthylbenzaldéhyde (proportions des isomères non précisées) ont donné des résultats négatifs dans plusieurs essais de mutation inverse et directe, avec et sans activation métabolique (Aeschbacher et coll. 1989; Florin et coll. 1980; Heck et coll. 1989; Marnett et coll. 1989; Zeiger et coll. 1988). Par ailleurs, le méthylbenzaldéhyde n’a pas provoqué de synthèse non programmée de l’ADN dans les hépatocytes de rat (Heck et coll., 1989).
Aucune étude sur le pouvoir cancérigène du méthylbenzaldéhyde n’a été recensée.
Toxicité pour la reproduction et le développement
Aucune étude de toxicité de l’exposition au méthylbenzaldéhyde pour la reproduction et le développement n’a été recensée.
6.2.5 Essences de vanille
Les données existantes concernant la toxicité des essences de vanille en soi sont limitées. Comme décrit dans la section 2, les essences de vanille sont définies comme les matières dérivées par extraction et physiquement modifiées de V. planifolia (NCI 2020, et le CIID de la PCPC associe le numéro de CAS 8024-06-4 aux essences de vanille provenant d’extraits de fleurs de V. planifolia, de fruits de, V. planifolia, d’extraits de fruits de V. planifolia, d’essence de fruits de V. planifolia, d’eau de fruits de V. planifolia, d’extraits de cellules de feuilles de V. planifolia, de graines de V. planifolia, et de poudre de graines de V. planifolia. Cependant, il a été déterminé que les matières extractibles du fruit de V. planifolia constituaient la principale source d’essences de vanille aux fins de la présente évaluation, et les substances d’intérêt toxicologique devraient se trouver dans la portion d’arôme volatil qu’elles contiennent. La teneur en arôme volatil de l’extrait représente 4 % de sa composition totale (l’éthanol et l’eau constituant la partie restante), la vanilline étant la substance la plus abondante dans cette partie volatile de l’UVCB, représentant environ 80 % (ou jusqu’à 3,6 % de la composition totale de l’extrait) sur une base de poids sec (Brunschwig et coll. 2009; CIR 2020). La vanilline est donc considérée comme le principal composant d’intérêt toxicologique, et les données sur les effets de la vanilline sur la santé ont été utilisées pour évaluer les essences de vanille.
La vanilline a été évalué par l’EPA des É.-U. (2010), l’OCDE (1996c), l’EFSA (2005) et le JECFA (OMS 1967, 2002)). Le JECFA a établi la DJA à 0 à 0,1 mg/kg p.c. pour l’utilisation de cette substance comme aromatisant et n’a pas constaté de problème de sécurité aux niveaux actuels d’absorption pour cette utilisation spécifique. Un dossier d’enregistrement REACH pour le nonanal est également disponible (ECHA c2007-2019).
Vanilline
Toxicocinétique
La vanilline est métabolisée in vivo en formes libres et conjuguées, principalement en acide vanillique, ainsi qu’en catéchol. Parmi les autres métabolites figurent les formes conjuguées de la vanilline et de l’alcool vanillique, ainsi que des traces de formaldéhyde (OCDE 1996c). Les métabolites conjugués sont principalement des glucuronides, des sulfates et des glycines (OCDE 1996). Les métabolites de la vanilline sont presqu’entièrement excrétés par l’urine dans les 24 heures chez les rats, les lapins et les humains, ce qui indique une courte demi-vie (OCDE 1996c).
Toxicité à doses répétées
Dans plusieurs études de toxicité subchronique et à long terme, la vanilline n’a produit aucun effet nocif jusqu’aux doses les plus élevées testées par les voies orale et cutanée chez les rats, les souris et les chiens (OCDE 1996c). Certaines de ces études sont décrites ci-dessous à titre d’exemple; elles ne constituent pas la totalité de la base de données des effets sur la santé.
Dans une étude de 90 jours sur l’exposition par voie orale (OCDE 1996c), des rats (10/sexe/dose) auxquels on a administré de la vanilline à 3000, 10 000 ou 50 000 ppm (150, 500 ou 2500 mg/kg p.c./jour) dans leur alimentation ont présenté quelques effets indésirables légers à la dose moyenne, une dépression de la croissance ainsi qu’une hypertrophie du foie, de la rate et des reins à la plus forte dose testée. Aucune donnée sur l’utilisation de groupes témoins n’a été rapportée et la nature des effets indésirables légers à 500 mg/kg p.c./jour n’a pas été examinée.
Dans plusieurs études d’exposition à long terme par voie orale réalisées par le même laboratoire (Hagan et coll., 1967), des rats Osborne-Mendel (5 à 12/sexe/dose) ont reçu des doses de vanilline comprises entre 1000 et 20 000 ppm (50 à 1000 mg/kg p.c./jour) dans leur alimentation pendant 16 à 104 semaines. Aucun effet indésirable sur la croissance, l’hématologie ou les tissus organiques n’a été observé, quelle que soit la dose, comparativement aux groupes témoins. Dans une étude d’un an sur l’alimentation de rats Osborne-Mendel mâles (5/dose) auxquels on a administré de la vanilline jusqu’à 50 000 ppm (2 500 mg/kg p.c./jour), des résultats similaires ont été rapportés (Hagan et coll.1967).
Dans une étude d’exposition alimentaire (OCDE 1996c), des chiens (1/sexe/dose) ont reçu des doses de 0, 25 ou 100 mg/kg p.c./jour de vanilline dans une capsule 5 jours par semaine pendant 26 à 27 semaines. Les auteurs de l’étude n’ont rapporté aucun effet indésirable sur la croissance, le comportement, l’hématologie, la biochimie, l’analyse d’urine ou les tissus organiques, quelle que soit la dose.
Dans une étude de 26 semaines (OCDE 1996c), des rats mâles (10/dose) ont reçu des doses de 0, 1000, 5000, ou 10 000 ppm (0, 50, 250, ou 500 mg/kg p.c./jour) de vanilline dans leur alimentation pendant 26 semaines. Aucun effet indésirable n’a été rapporté sur la croissance ou l’histopathologie des tissus examinés, et ce, à toutes les doses.
Aucune étude de toxicité de l’exposition à la vanilline par inhalation n’a été identifiée.
Génotoxicité et cancérogénicité
Les résultats de plusieurs tests in vitro de génotoxicité de la vanilline ont été négatifs dans plusieurs expériences utilisant des cellules bactériennes ou mammaliennes, en présence et en l’absence d’activation métabolique (OCDE 1996c). Certains signes de dommages à l’ADN ont été observés dans des essais d’échange de chromatides sœurs sur des lymphocytes humains; cependant, des expériences in vivo sur des souris n’ont révélé aucun signe de micronoyaux jusqu’à 500 mg/kg p.c. (OCDE 1996c).
Dans une étude d’exposition alimentaire de 2 ans, des rats Osborne-Mendel (12/sexe/dose) ont reçu 0, 5000, 10 000 ou 20 000 ppm de vanilline (0, 250, 500 ou 1000 mg/kg p.c./jour). Aucun signe de cancérogénicité des tissus examinés (cœur, foie, reins, rate, testicules, moelle osseuse, muscles) n’a été rapporté (Hagan et coll.1967).
Plusieurs autres études sur l’exposition orale à doses répétées chez le rat entre 16 semaines et un an n’ont révélé aucun signe de formation de tumeurs ni de potentiel cancérogène à des doses jusqu’à 2500 mg/kg p.c./jour (Hagan et coll.1967).
Des souris (20/dose) ont été exposées par voie cutanée à des doses de 0 ou 3000 mg/kg p.c./jour de vanilline dissoute dans l’acétone 3 fois par semaine pendant 3 semaines, pour un total de 10 applications. Aucune preuve de cancérogénicité n’a été observée dans les poumons ni dans la peau (les seuls organes examinés) (OCDE 1996c), bien qu’il y ait eu des limites à l’étude (par exemple durée de l’étude, fréquence des doses, organes examinés, et).
Toxicité pour la reproduction et le développement
Un rapport non publié sur la toxicité de la vanilline pour la reproduction et le développement (EFSA 2005) montre que des rates gravides (10/dose) ayant reçu des doses de 0, 125, 250 ou 500 mg/kg p.c./jour de vanilline par gavage entre la semaine précédant l’accouplement et le quatrième jour postnatal n’ont pas présenté d’effets indésirables sur la reproduction ou le développement jusqu’à la plus forte dose testée. Cependant, cette étude n’a pas été rapportée adéquatement.
Aucun effet indésirable sur le poids ou le tissu des testicules n’a été relevé après examen dans plusieurs études sur l’exposition alimentaire à doses répétées chez le rat, entre 16 semaines et un an d’exposition (OCDE 1996c).
Dans 2 études ne suivant pas les lignes directrices sur la toxicité pour le développement, aucune toxicité maternelle ou fœtale n’a été signalée après l’administration de vanilline par gavage ou par injection intrapéritonéale à des doses uniques de 500 mg/kg p.c. maximum au JD 10 ou 11 (OCDE 1996c; Imanishi et coll. 1990).
En raison de l’absence de données de qualité suffisante sur la toxicité potentielle de cette substance pour la reproduction et le développement, une approche par lecture croisée utilisant l’éthylvanilline comme analogue a été utilisée pour établir ces paramètres. L’éthylvanilline possède une structure similaire à celle de la vanilline, le principal composant des essences de vanille, et présente des propriétés physico-chimiques et un profil toxicocinétique similaires (EFSA 2005). Cette substance a été examinée par l’EFSA (2005) et le JECFA (OMS 2002). Un dossier d’enregistrement REACH est également disponible (ECHA c2007-2019).
Dans un essai d’évaluation de la toxicité pour la reproduction et le développement (ECHA c2007-2019), des doses de 0, 250, 500 ou 1000 mg/kg p.c./jour d’éthylvanilline dissoute dans du propylène glycol a été administrée à des rats Wistar (10/sexe/dose) par gavage oral. Les mâles ont été traités pendant 31 jours, y compris pendant les périodes d’avant l’accouplement, d’accouplement et jusqu’à un jour avant l’autopsie, tandis que les femelles ont été traitées également pendant la gestation et au moins 13 jours après la parturition jusqu’au jour précédant l’autopsie. Chez les adultes, 5 femelles du groupe recevant 1000 mg/kg p.c./jour ont présenté des signes cliniques transitoires liés au traitement pendant la période précédant l’accouplement, à savoir une baisse de l’activité et/ou une respiration anormale, de la piloérection et une baisse de la température du corps. Une diminution de l’activité chez les mâles du même groupe a également été signalée. Ces effets sont survenus principalement au cours de la première semaine de la période d’avant l’accouplement. La moyenne de la prise de poids corporel des adultes mâles et femelles recevant des doses de 1000 mg/kg p.c./jour était inférieure à celle des animaux témoins pendant les périodes d’avant l’accouplement et de gestation. Aucun autre effet systémique lié au traitement n’a été observé sur les autres paramètres examinés. Aucun effet indésirable lié au traitement sur les paramètres de reproduction ou de développement n’a été rapporté jusqu’à la plus forte dose testée. Ainsi, les auteurs ont établi la DSENO systémique parentale à 500 mg/kg p.c./jour sur la base de la baisse de la prise de poids chez les rats adultes. Aucune toxicité sur la reproduction ou le développement n’a été observée jusqu’à 1000 mg/kg p.c./jour, soit la plus forte dose testée.
Dans une étude de toxicité pour le développement prénatal (ECHA c2007-2019), des rates Wistar gravides (22/dose) ont reçu des doses de 0, 250, 500 ou 1000 mg/kg p.c./jour d’éthylvanilline dissoute dans du propylène glycol par gavage entre le 6e et le 20e jour de gestation. Les mères exposées à 1000 mg/kg p.c./jour ont présenté des signes cliniques d’effets transitoires, mais nocifs tels que la respiration irrégulière et/ou rapide, la baisse de l’activité et la respiration sifflante peu après la première ou la deuxième dose. Le gain de poids corporel moyen a été transitoirement plus faible chez les mères exposées à 1000 mg/kg p.c./jour du JG 6 à 9 par rapport aux animaux témoins. Cet effet était accompagné d’une réduction transitoire de la consommation d’aliments du JG 6 à 12. Cependant, les gains de poids corporel moyens et la consommation d’aliments étaient comparables tout au long de la période de traitement (du JG 6 au JG 21. Des incidences de malformations externes des tissus mous et du squelette ont été observées chez 7 sur les 240 fœtus examinés dans 6 portées de mères exposées à la dose limite de 1000 mg/kg p.c./jour. Parmi ces malformations figurent des anomalies du cœur, du crâne, de la queue, de la mandibule et du sternèbre. Globalement, les auteurs ont établi la DSENO maternelle et la DSENO du développement embryonnaire et fœtal à 500 mg/kg p.c./jour sur la base des observations à la dose limite.
Cette étude de toxicité pour le développement a révélé une faible incidence de malformations chez les fœtus des mères exposées à 1000 mg/kg p.c./jour d’éthylvanilline, cependant ces effets sont survenus conjointement avec la toxicité maternelle et à la dose limite. De plus, dans une autre étude de toxicité d’éthylvanilline pour le développement des rats Wistar, aucune malformation externe n’a été observée à des doses similaires et aucun effet sur le développement n’a été observé chez la progéniture dans plusieurs études utilisant des doses relativement élevées de vanilline. Ainsi, l’éthylvanilline et la vanilline ne sont pas considérées tératogènes.
Les essences de vanille sont donc considérées comme ayant un faible potentiel de danger (Santé Canada 2017), étant donné qu’aucun effet nocif n’a été observé chez le rat et la souris après l’exposition orale ou cutanée à la vanilline et à l’éthylvanilline jusqu’à la dose limite, notamment des effets sur la reproduction et des effets génotoxiques ou mutagènes. Les données disponibles indiquent également un faible potentiel de toxicité de la vanilline et de l’éthylvanilline pour le développement.
6.3 Caractérisation des risques pour la santé humaine
Tableaux 6-6 to 6-9 contiennent toutes les valeurs pertinentes d’exposition et de danger liées aux substances du groupe des aldéhydes, ainsi que les marges d’exposition (ME) obtenues afin de déterminer le risque des scénarios sentinelles pour les expositions par voies orale, cutanée et d’inhalation, selon le cas.
| Scénario d’exposition | Exposition estimée | Dose avec effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Milieux naturels et aliments (utilisation d’arômes alimentaires a), toutes les voies d’exposition, quotidien, tout-petit (1 an) | 0,61 mg/kg p.c./jour | DSENO = 200 mg/kg p.c./jour (étude de l’exposition par voie orale 2 ans chez le rat) | Diminution du taux de survie chez les rats mâles à 400 mg/kg p.c./jour | 328d |
| Hydratant corporel, voie cutanée, quotidien, tout-petit (âgés de 2 à 3 ans) | 1,8 mg/kg p.c./jourb | DSENO = 200 mg/kg p.c./jour (étude de l’exposition par voie orale 2 ans chez le rat) | Diminution du taux de survie chez les rats mâles à 400 mg/kg p.c./jour | 111d |
| Air freshener, inhalation, daily, tout-petit (1 an) | 0,88 mg/kg p.c./jour | DMENOaju = 512c mg/kg p.c./jour (étude de l’exposition par voie orale 14 jours chez le rat) | Changements du poids et des enzymes du foie et changements morphologiques dans les tissus nasaux chez le rat à la dose ajustée de 512c mg/kg p.c./jour | 582e |
Abréviations : ME : Marge d’exposition; DSENO = dose sans effet nocif observé; DMENOaju = dose minimale entraînant un effet nocif observé, valeur ajustée
a Les absorptions dues à des utilisations comme ingrédient d’arôme alimentaire sont des apports par personne représentant l’ensemble de la population âgée d’un an et plus
b L’absorption cutanée a été considérée comme équivalente à l’absorption orale.
c La dose avec effet critique est calculée en convertissant les en convertissant les concentrations sans effet nocif observé (CSENO) ou les concentrations minimales entraînant un effet nocif observé (CMENO) d’après les études de toxicité par inhalation en doses internes qui tiennent compte du taux d’inhalation des animaux (m3/jour), du poids corporel (kg) et des facteurs d’ajustement temporel (durée de l’exposition en heures/24; jours d’exposition dans une semaine/7) sauf indication contraire.
d ME cible = 100 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique)
e ME e = 300 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique; x3 pour l’utilisation d’une DMENO)
La DSENO de 200 mg/kg p.c./jour, basée sur un taux de survie inférieur chez le rat mâle (par rapport aux animaux témoins) à la dose suivante de 400 mg/kg p.c./jour, a été considérée le critère le plus pertinent pour la caractérisation des risques pour la santé humaine dus à une exposition quotidienne au benzaldéhyde par voie orale et cutanée. Il convient de noter que la diminution du taux de survie a été observée vers la fin de la durée de l’étude de 2 ans et uniquement chez les rats, alors que les rates et les souris mâles et femelles n’ont pas présenté le même effet. Par ailleurs, l’estimation de l’exposition cutanée au benzaldéhyde due à l’utilisation d’hydratants corporels est jugée prudente, car elle repose sur l’hypothèse que 100 % du benzaldéhyde contenu dans la crème appliquée est absorbé par la peau. Ainsi, les ME obtenues pour les voies orale et cutanée sont considérées adéquates.
La DMENO corrigée de 512 mg/kg p.c./jour établie par une étude de l’exposition par inhalation à court terme a été retenue comme le critère le plus pertinent pour caractériser le risque lié à l’exposition au benzaldéhyde par les assainisseurs d’air. Compte tenu de la courte demi-vie du benzaldéhyde lors de l’exposition par inhalation et de la nature légère et réversible de l’irritation des tissus nasaux par la porte d’entrée observée dans l’étude, les effets systémiques ont été considérés les plus pertinents pour caractériser le risque pour la santé humaine lié à l’inhalation. Parmi les effets, on a noté des changements dans le poids absolu et relatif du foie et des changements dans les paramètres sériques et les enzymes hépatiques; cependant, il n’y a pas eu de changements histopathologiques connexes dans le foie. D’autre part, la marge entre l’estimation de l’exposition par inhalation et le critère d’évaluation pertinent le plus bas pour l’exposition systémique par voie orale (DSENO de 200 mg/kg p.c./jour issu d’une étude de l’exposition par voie orale de 2 ans chez le rat) serait supérieure à 200. Sur la base des données ci-dessus, la ME obtenue est jugée adéquate pour l’exposition par l’inhalation.
| Scénario d’exposition | Exposition estimée | Dose avec effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Comprimé de supplément de vitamines et de minéraux, voie orale, quotidienne, enfant (9 à 13 ans) | 0,023 mg/kg p.c./jour | DSENO = 300 mg/kg p.c./jour (étude de l’exposition par gavage de 13 semaines chez le rat, lecture croisée avec le butanal) | Lésions de l’estomac à 600 mg/kg p.c./jour | 13000b |
| Milieux naturels (air), par inhalation, quotidien, tous les groupes d’âge | 0,011 mg/m3 |
DSENOaju = 27a mg/m3 (étude de l’exposition par gavage de 13 semaines chez le rat, lecture croisée avec le butanal) |
Hyperplasie des cellules caliciformes et métaplasie de l’épithélium malpighien du tissu nasal chez le rat et le chien exposés à une concentration ajustée de 62a mg/m3 pendant 13 semaines | 2450b |
| Assainisseur d’air, par inhalation, quotidien, tous les groupes d’âge | 0,1 mg/m3 |
DSENOaju = 27a mg/m3 (étude de l’exposition par gavage de 13 semaines chez le rat, lecture croisée avec le butanal) |
Hyperplasie des cellules caliciformes et métaplasie de l’épithélium malpighien du tissu nasal chez le rat et le chien exposés à une concentration ajustée de 62a mg/m3 pendant 13 semaines | 270b |
Abréviations : ME = marge d’exposition; DSENO = Doses sans effet nocif observé; CSENOaju,= dose sans effet nocif observé, avec valeur ajustée.
a La DSENO de 150 mg/m3 et la DMENO de 345 mg/m3 issues des études sur l’exposition au butanal pendant 13 semaines ont été ajustées pour être comparées à une concentration moyenne d’exposition à l’octanal pondérée dans le temps sur 24 heures à partir d’estimations de l’absorption d’air continue en tenant compte de la durée et des jours d’exposition équivalents de l’étude (150 x 6/24 heures x 5/7 jours = 27 mg/m3 ou 345 x 6/24 heures x 5/7 jours = 62 mg/m3).
b ME cible = 100 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique)
Pour caractériser le risque lié à l’exposition à l’octanal par voie orale, on a jugé qu’il n’y avait pas d’effets indésirables chez les rats nourris avec un mélange d’aldéhydes aliphatiques comprenant 13 mg/kg p.c./jour de la substance, pendant 12 semaines. Toutefois, en raison des limites de cette étude (par exemple, dose unique, mélange de composés), une approche de lecture croisée est appliquée. L’EFSA (2013) s’est appuyée sur une étude de 11 semaines sur l’eau potable chez les rats utilisant l’acétaldéhyde comme analogue pour effectuer une lecture croisée avec une large catégorie d’aldéhydes aliphatiques, dont l’octanal, mais le butanal est un analogue plus approprié, car il est plus similaire à l’octanal que l’acétaldéhyde. Les données suggèrent que le butanal présente une toxicité locale lorsqu’il est administré par voie orale à des rats et des souris dans les tissus nasaux (à partir de 75 mg/kg p.c./jour) et stomacaux (à partir de 600 mg/kg p.c./jour). Les effets dans les tissus nasaux et stomacaux sont probablement dus aux propriétés de solvant du butanal (OCDE 1996a). Étant donné que la pression de vapeur de l’octanal est beaucoup plus faible (148 Pa) que celle du butanal (1,44 × 104 Pa), il est peu probable que l’octanal provoque des lésions nasales lorsqu’il est pris par voie orale, comme cela a été observé dans les études sur le butanal par voie orale. Par conséquent, la DSENO a été établie à 300 mg/kg p.c./jour, sur la base de lésions gastriques à 600 mg/kg p.c./jour. La ME obtenue est jugée adéquate pour traiter le risque d’exposition à l’octanal par voie orale lors de son utilisation comme ingrédient non médicinal dans un comprimé de supplément de vitamines et de minéraux homologué comme produit de santé naturel.
L’exposition orale à l’octanal devrait se produire par le biais de l’alimentation à cause de son utilisation potentielle comme aromatisant alimentaire et sa présence naturelle dans les aliments. L’exposition alimentaire due à sa présence naturelle dans les aliments devrait être supérieure à celle due à son utilisation en tant qu’aromatisant alimentaire. Les estimations quantitatives de l’exposition à l’octanal présent naturellement dans les aliments n’ont pas été jugées significatives et n’ont donc pas été calculées. Étant donné qu’aucun effet nocif n’a été observé à la suite de l’absorption orale d’octanal, ainsi que la DSENO de 300 mg/kg p.c./jour établie pour le butanal analogue chez le rat et la souris, l’absorption alimentaire d’octanal présent naturellement dans les aliments ne devrait pas être préoccupante pour la santé humaine. Par conséquent, le calcul d’une marge d’exposition à partir de cette source n’a pas été jugé pertinent. L’absorption alimentaire d’octanal provenant de son utilisation potentielle en tant qu’aromatisant alimentaire donne lieu à une exposition orale plus faible que son utilisation en tant qu’ingrédient non médicinal dans des comprimés de supplément de vitamines et de minéraux autorisés en tant que produit de santé naturel, comme le montre le tableau 6-7 ci-dessus.
Pour l’exposition par inhalation, une DSENO ajustée de 27mg/m3 (convertie d’une DSENO de 150mg/m3) a été établie sur la base de l’absence d’effets chez les rats exposés à la substance analogue, le butanal, par inhalation pendant 13 semaines. Une autre étude sur l’exposition au butanal par inhalation a révélé des effets de voie d’entrée dans l’épithélium nasal de rats et de chiens exposés pendant 13 semaines à 345 mg/m3 de butanal, la plus faible concentration testée dans cette étude. Compte tenu du fait qu’aucun effet indésirable au niveau de la voie d’entrée ou du système n’a été observé chez les rats à des concentrations de butanal inférieures à 150 mg/m3 of butanal et de la nature réversible des effets au niveau de la voie d’entrée observés à 345 mg/m3, les ME obtenues sont considérées adéquates pour tenir compte du risque lié à l’exposition à l’octanal par inhalation.
| Scénario d’exposition | Exposition estimée | Dose avec effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Comprimé de supplément de vitamines et de minéraux, voie orale, quotidienne, enfant (9 à 13 ans) | 0,023 mg/kg p.c./jour | DSENO = 300 mg/kg p.c./jour (étude de l’exposition par gavage de 13 semaines chez le rat, lecture croisée à partir du butanal) | Lésions dans l’estomac à 600 mg/kg p.c./jour | 13000c |
| Écran solaire en aérosol, voie cutanée, quotidienne (2 à 3 ans) | 2,3 mg/kg p.c./jour | DSENO = 500 mg/kg p.c./jour (étude de l’exposition par voie cutanée de 2 semaines chez le lapin) | Aucun effet systémique observé | 217c |
| Milieux naturels (air), par inhalation, quotidien, tous les groupes d’âge | 0,03 mg/m3 | CSENOaju = 27b mg/m3 (étude de l’exposition par inhalation de 13 semaines chez le rat, lecture croisée à partir du butanal) | Hyperplasie des cellules caliciformes et métaplasie de l’épithélium malpighien du tissu nasal chez le rat et le chien exposés pendant 13 semaines à une concentration ajustée de 62b mg/m3 | 900c |
| Écran solaire en aérosol, par inhalation quotidienne, tous les groupes d’âge | 0,03 mg/m3 a | CSENOaju = 27b mg/m3 (étude de l’exposition par inhalation de 13 semaines chez le rat, lecture croisée à partir du butanal) | Hyperplasie des cellules caliciformes et métaplasie de l’épithélium malpighien du tissu nasal chez le rat et le chien exposés pendant 13 semaines à une concentration ajustée de 62b mg/m3 | 900c |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé; CSENOaju,= dose sans effet nocif observé, avec valeur ajustée
a La concentration moyenne pondérée dans le temps (MPT) sur 10 minutes a été calculée pour correspondre à la durée d’exposition de l’étude des effets critiques utilisée pour caractériser le risque, qui représente une exposition continue. MPT de 10 minutes = concentration moyenne de l’évènement x durée d’exposition / 24 heure.
b La CSENO de 150 mg/m3 et la CMENO de 345 mg/m3 tirées des études sur l’exposition par inhalation de butanal pendant 13 semaines ont été ajustées pour une comparaison avec une concentration MPT de 24 heures d’exposition au nonanal tirée d’estimations de l’absorption d’air continue en tenant compte de la durée et des jours d’exposition équivalents de l’étude (150 x 6/24 heures x 5/7 jours = 27 mg/m3 ou 345 x 6/24 heures x 5/7 jours = 62 mg/m3).
c ME cible = 100 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique)
Lors de la caractérisation de risque lié à l’exposition au butanal par voie orale, on constate une absence d’effets indésirables chez le rat nourri avec un mélange d’aldéhydes aliphatiques contenant 29 mg/kg p.c./jour de la substance, pendant 12 semaines. Cependant, comme dans le cas de l’octanal, le butanal est utilisé comme analogue en raison des limites de l’étude sur le mélange. Étant donné que la pression de vapeur du nonanal est nettement inférieure (49 Pa) à celle du butanal (1,44 × 104 Pa), il est peu probable que le nonanal provoque des lésions nasales comme celles observées dans les études sur l’exposition orale au butanal. Par conséquent, la DSENO a été établie à 300 mg/kg p.c./jour, sur la base de lésions gastriques à 600 mg/kg p.c./jour. La ME ainsi obtenue est jugée adéquate pour tenir compte du risque d’exposition au nonanal par voie orale lié à son utilisation comme ingrédient non médicinal dans des comprimés de suppléments de vitamines et de minéraux homologués comme produits de santé naturels (tableau 6-8).
L’exposition orale au nonanal devrait se produire par le biais de l’alimentation en raison de son utilisation potentielle comme aromatisant alimentaire et de sa présence naturelle dans les aliments. Dietary exposure from its natural occurrence in foods is expected to exceed that from its use as a food flavouring agent. Quantitative estimates of exposure from naturally occurring nonanal in foods were not considered to be meaningful and thus not derived. Étant donné qu’aucun effet nocif lié à l’absorption orale de nonanal n’a été identifié, tout comme la DSENO de 300 mg/kg p.c./jour identifiée chez le rat et la souris pour son analogue, le butanal, l’absorption alimentaire de nonanal présent naturellement dans les aliments ne devrait pas être préoccupante pour la santé humaine. Par conséquent, le calcul de la marge d’exposition associée à cette source n’a pas été jugé utile. L’absorption alimentaire de nonanal due à son utilisation comme aromatisant alimentaire entraîne une exposition plus faible par voie orale que son utilisation comme ingrédient non médicinal dans les comprimés de suppléments de vitamines et de minéraux homologués comme produit de santé naturel, comme le montre le tableau 6-8 ci-dessus.
Pour l’exposition par voie cutanée, la DSENO a été établie à 500 mg/kg p.c./jour sur la base d’une étude de 2 semaines sur l’exposition cutanée au nonanal chez le lapin, où l’on a constaté l’absence de toxicité systémique. La ME ainsi obtenue est considérée adéquate pour tenir compte du risque lié à l’exposition cutanée au nonanal.
Pour l’exposition par inhalation, la CSENO ajustée a été établie à 27 mg/m3 (convertie d’une CSENO de 150mg/m3) sur la base de l’absence d’effets chez les rats exposés à la substance analogue, le butanal, par inhalation pendant 13 semaines. Une autre étude sur l’inhalation de butanal a révélé des effets de voie d’entrée dans l’épithélium nasal de rat et de chien exposés pendant 13 semaines à 345 mg/m3, la plus faible concentration testée dans cette étude. Compte tenu de l’absence d’effets nocifs au niveau de la voie d’entrée et d’effets systémiques chez le rat à des concentrations de butanal de maximum 150 mg/m3, et de la nature réversible des effets de la voie d’entrée observés à 345 mg/m3, les ME obtenues sont considérées adéquates pour prendre en compte le risque lié à l’exposition au butanal par inhalation.
| Scénario d’exposition | Exposition estimée | Dose avec effet critique | Paramètre d’effet critique pour la santé | ME |
|---|---|---|---|---|
| Alimentation (utilisation d’arômes alimentairesa), voie orale, quotidien, tout-petit (1 an et plus) | 0,02 mg/kg p.c./jour | DSENO = 250 mg/kg p.c./jour (étude d’exposition orale de 13 semaines chez le rat) | Baisse du poids relatif de l’hypophyse chez les rates à 500 mg/kg p.c./jour | 12500b |
Abréviations : ME = marge d’exposition; DSENO = dose sans effet nocif observé
a Les absorptions provenant des utilisations comme ingrédient d’arôme alimentaire représentent les absorptions par habitant de l’ensemble de la population âgée de 1 an et plus.
b ME cible = 100 (x10 pour la variation interspécifique; x10 pour la variation intraspécifique)
La DSENO de 250 mg/kg p.c./jour a été retenue comme le critère le plus pertinent pour caractériser le risque lié à l’exposition au méthylbenzaldéhyde, sur la base d’une réduction du poids relatif de l’hypophyse chez des rates ayant reçu la substance par voie orale pendant 13 semaines. La ME ainsi obtenue est considérée adéquate pour prendre en compte le risque lié à l’exposition par voie alimentaire.
Le potentiel de danger des essences de vanille est jugé faible. À ce titre, aucune estimation quantitative de l’exposition n’a été calculée pour les essences de vanille et le risque pour la santé humaine est jugé faible (Santé Canada 2017).
L’évaluation des effets sur la santé humaine prenait en compte ces groupes de personnes de la population canadienne qui, en raison d’une plus grande sensibilité ou d’une exposition plus importante, pourraient être plus vulnérables à subir des effets nocifs pour leur santé. Des estimations de l’exposition en fonction de l’âge sont systématiquement calculées et les études sur la toxicité pour le développement et la reproduction sont évaluées pour déterminer les effets nocifs potentiels sur la santé.
6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitude sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Incidence |
|---|---|
| En l’absence de données sur l’occurrence au Canada, les estimations de l’exposition liée à l’utilisation d’arômes alimentaires ont été fondées sur les absorptions par la population américaine. | +/- |
| Il n’existe pas d’étude de toxicité subchronique ou chronique de l’exposition au benzaldéhyde par inhalation à doses répétées. | +/- |
| Il n’existe aucune étude de toxicité chronique de l’exposition à l’octanal, au nonanal et au méthylbenzaldéhyde par voie orale ou par inhalation à doses répétées. | +/- |
| Il n’existe aucune étude de toxicité de méthylbenzaldéhyde pour la reproduction ou le développement. | +/- |
| Il n’existe aucune étude spécifique sur les paramètres toxicologiques des essences de vanille (comme l’UVCB). | +/- |
| La sélection d’extraits de fruits de vanille comme source principale des essences de vanille alors qu’ils peuvent ne pas être représentatifs de toutes les méthodes possibles d’extraction et de modification physique qui seraient à l’origine d’essences de vanille. Il reste donc une part d’incertitude dans la sélection de la vanilline comme principal composant d’intérêt toxicologique. | +/- |
| Il n’existe aucune étude sur l’exposition à l’éthylvanilline ou à la vanilline par inhalation. | +/- |
+ = incertitude liée au potentiel de surestimation de l’exposition/risque; - = incertitude liée au risque de causer une sous-estimation de l’exposition ou du risque; +/- potentiel inconnu de sous-estimation ou de surestimation du risque.
7. Conclusion
Compte tenu de tous les éléments de preuve avancés dans la présente évaluation, le risque d’effets nocifs dus au benzaldéhyde, à l’octanal, au nonanal, au méthylbenzaldéhyde et aux essences de vanille sur l’environnement a été jugé faible. Il a été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de tous les renseignements présentés dans la présente évaluation, il a été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne satisfont pas aux critères énoncés à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Il a donc été conclu que le benzaldéhyde, l’octanal, le nonanal, le méthylbenzaldéhyde et les essences de vanille ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Références
Aeschbacher H, Wolleb U, Löliger J, Spadone J, Liardon R. 1989. Contribution of coffee aroma constituents to the mutagenicity of coffee. Food Chem Toxicol, 27(4):227-32. (Disponible en anglais seulement).
[AGDH] Australian Government Department of Health. 2016. Tier II Human Health Assessments Inventory Multi-Tiered Assessment and Prioritisation (IMAP) Framework [PDF]. Sydney (AU) : Department of Health, National Industrial Chemicals Notification and Assessment Scheme. [Consulté le 12 mars 2024]. (Disponible en anglais seulement).
Andersen A. 2006. Final report on the safety assessment of benzaldehyde. Int J Toxicol. 25( Suppl 1):11–27. (Disponible en anglais seulement).
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données] [modifieé le 7 déc. 2021]. Ottawa (Ontario) : gouvernement du Canada. [consulté le 22 fév. 2022].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données]. [modifieé le 8 sept. 2021]. Ottawa (Ontario) : gouvernement du Canada. [consulté le 22 fév. 2022].
Beltran-Garcia MJ, Estarron-Espinosa M, Ogura T. 1997. Volatile Compounds Secreted by the Oyster Mushroom (Pleurotus ostreatus) and Their Antibacterial Activities. J Agric Food Chem. 45(10):4049-4052. (Disponible en anglais seulement).
BIBRA. 1990. Toxicity profile: Tolualdehydes. TNO BIBRA International Ltd. (Disponible en anglais seulement).
Bide RW, Armour SJ, Yee E. 2000. Allometric respiration/body mass data for animals to be used for estimates of inhalation toxicity to young adult humans. J Appl Toxicol. 20(4):273-290. (Disponible en anglais seulement).
Biodynamics Inc. 1981. A 28-day dermal toxicity study in rabbits (final report) on nonanal with attachments and cover letter dated 112291. Dallas (TX): Hoechst Celanese Corp. Report No. OTS0534473. Available from: NTIS, Springfield, VA, USA. (Disponible en anglais seulement).
Boîte à outils QSAR de l’OCDE [outil de lecture croisée]. 2014. Version 3.3. Paris (France), Organisation de coopération et de développement économiques, Laboratory of Mathematical Chemistry. (Disponible en anglais seulement).
Brambilla G, Cajelli E, Canonero R, Martelli A, Marinari U. 1989. Mutagenicity in V79 Chinese hamster cells of n-alkanals produced by lipid peroxidation. Mutagenesis. 4(4):277-279. (Disponible en anglais seulement).
Brantom P, Gaunt I, Grasso P, Lansdown A, Gangolli S. 1972. Short-term toxicity of tolualdehyde in rats. Food Cosmet Toxicol. 10(5):637-647. (Disponible en anglais seulement).
Brunschwig C, Collard FX, Bianchini JP, Raharivelomanana P. 2009. Evaluation of chemical variability of cured vanilla beans (Vanilla tahitensis and Vanilla planifolia). Nat Prod Commun. 4(10):1393-1400. (Disponible en anglais seulement).
Burdock GA. 2010. Fenaroli’s handbook of flavor ingredients. 6th ed. Orlando (FL): Burdock Group. (Disponible en anglais seulement).
CalRecycle. 2010. Safety Study of Artificial Turf Containing Crumb Rubber Infill Made from Recycled Tires: Rubber Infill Made from Recycled Tires: Measurements of Chemicals and Particulates in the Air, Bacteria in the Turf, and Skin Abrasions Caused by Contact with the Surface [Internet]. Publication # DRRR-2010-009. Sacramento (CA) : California Department of Resources Recycling and Recovery (CalRecycle). (Disponible en anglais seulement).
CalRecycle. 2011. Tire-derived Rubber Flooring Chemical Emissions Study: Laboratory Study Report. [Internet]. Publication # DRRR-2011-002. Sacramento (CA) : California Department of Resources Recycling and Recovery (CalRecycle). (Disponible en anglais seulement).
Canada. [1978]. Règlement sur les aliments et drogues. (C.R.C., ch. 870.)
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999) (L.C. 1999, ch. 33). Gazette du Canada. Partie III, vol. 22, no 3.
Canada. 2021. Décret modifiant les annexes 2 et 3 de la Loi sur le tabac et les produits de vapotage (arômes). Gazette du Canada. Partie I, vol. 155, no. 25.
ChemCAN [level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (ON) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. (Disponible en anglais seulement).
ChemIDplus [base de données]. 1993- . Bethesda (MD): US National Library of Medicine. [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
Chisholm MG, Jell JA, Cass Jr DM. 2003a. Characterization of the major odorants found in the peel oil of Citrus reticulata Blanco cv. Clementine using gas chromatography–olfactometry. Flavour Fragr J. 18:275-281. (Disponible en anglais seulement).
Chisholm MG, Wilson MA, Gaskey GM. 2003b. John Wiley & Sons, Ltd. Characterization of aroma volatiles in key lime essential oils (Citrus aurantifolia Swingle). Flavour Fragr J. 18:106-115.c (Disponible en anglais seulement).
[CIR] Cosmetic Ingredient Review. 2020. Safety Assessment of Vanilla-Derived Ingredients as Used in Cosmetics [PDF]. Washington (DC) : CIR. [consulté le 20 août 2020]. (Disponible en anglais seulement).
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [modifiée le 17 juil. 2015]. Ottawa (Ont.) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques . Ottawa (Ontario) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Supporting documentation: data used to create substance-specific hazard and exposure profiles and assign risk classifications. Gatineau (QC) : ECCC. Information in support of the science approach document: ecological risk classification of organic substances. Disponible sur demande à : substances@ec.gc.ca.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Categorization. Ottawa (Ontario) : gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ontario) : gouvernement du Canada.
[ECHA] Agence européenne des produits chimiques. c2007-2019 Base de données sur les substances enregistrées; résultats de la recherche pour les nº CAS 100-52-7, 121-33-5, 124-13-0, 124-19-6, 1334-78-7, 8024-06-4. Helsinki (Finlande) : ECHA. [consulté en fév. 2019]. (Disponible en anglais seulement).
Eckl PM, Ortner A, Esterbauer H. 1993. Genotoxic properties of 4-hydroxyalkenals and analogous aldehydes. Mutat Res. 290(2):183-192. (Disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments. 2005. Flavouring group evaluation 52 (FGE.52): Consideration of hydroxy- and alkoxy-substituted benzyl derivatives evaluated by JECFA (57th meeting) structurally related to benzyl alcohols, benzaldehydes, a related acetal, benzoic acids, and related esters evaluated by EFSA in FGE.20. EFSA Journal. 637:1-69. (Disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments. 2009. Scientific opinion. Flavouring group evaluation 54, revision 1 (FGE.54Rev1): Consideration of benzyl derivatives evaluated by JECFA (57th meeting) structurally related to benzyl alcohols, benzaldehydes, a related acetal, benzoic acids and related esters evaluated by EFSA in FGE.20Rev1 (2009). EFSA Journal. 1025:1-73. (Disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments. 2012. Scientific opinion on flavouring group evaluation 20, revision 4 (FGE.20Rev4): Benzyl alcohols, benzaldehydes, a related acetal, benzoic acids, and related esters from chemical groups 23 and 301. Parme, Italie : Autorité européenne de sécurité des aliments. Rapport no. 2994. (Disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments. 2013. Scientific Opinion on the safety and efficacy of straight‐chain primary aliphatic alcohols/aldehydes/acids, acetals and esters with esters containing saturated alcohols and acetals containing saturated aldehydes (chemical group 1) when used as flavourings for all animal species. EFSA Journal. 11(4): 3169. (Disponible en anglais seulement).
[EFSA] Autorité européenne de sécurité des aliments. 2017. Scientific opinion of flavouring group evaluation 502 (FGE.502): Grill flavour ‘Grillin’ 5078’. EFSA Journal. 15(9). (Disponible en anglais seulement).
Environnement Canada. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, Vol. 146, no 48, Supplément.
Environnement Canada. 2013. Données de la mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances inanimées inscrites sur la Liste intérieure; Données préparées par : Environnement Canada, Santé Canada, Programme des substances existantes.
[EPA DES É.-U.] United States Environmental Protection Agency. 1988. Integrated Risk Information System (IRIS). Chemical Assessment Summary for benzaldehyde (CAS RN 100-52-7). Washington (DC) : National Center for Environmental Assessment. (Disponible en anglais seulement).
[EPA DES É.-U.] United States Environmental Protection Agency. 2001. Air quality criteria for particulate matter, volume I. Washington (DC): Office of Research and Development, EPA DES É.-U.. (EPA 600/P-99/002aB). (Disponible en anglais seulement).
[EPA DES É.-U.] United States Environmental Protection Agency. 2010. Benzyl derivatives category screening level hazard characterization. Washington (DC): US EPA. (Disponible en anglais seulement).
[EPA DES É.-U.] United States Environmental Protection Agency. 2011. Exposure Factors Handbook 2011 Edition (Final). Washington (DC): US EPA. EPA/600/R-09/052F. (Disponible en anglais seulement).
[EPA DES É.-U.] United States Environmental Protection Agency. 2015. Provisional peer-reviewed toxicity values for benzaldehyde (CASRN 100-52-7). Washington (DC): US EPA. Report No. EPA/690/R-15/001F. (Disponible en anglais seulement).
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [modèle d’évaluationl]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. (Disponible en anglais seulement).
Esterbauer H, Eckl P, Ortner A. 1990. Possible mutagens derived from lipids and lipid precursors. Mutat Res. 238(3):223-233. (Disponible en anglais seulement).
[FDA des É.-U.] Food and Drug Administration des États-Unis. 2019. Code of Federal Regulations. Title 21: Volume 2. Sec. 169.175 Vanilla extract. PART 169 – food dressings and flavorings. [21CFR169.175]. Washington (DC): FDA des É.-U. (Disponible en anglais seulement).
Florin I, Rutberg L, Curvall M, Enzell CR. 1980. Screening of tabacco smoke constituents for mutagenicity using the ames' test. Toxicology. 15(3):219-232. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2008a. Airwick air freshener liquid bottle (wick). Winplus North America. [consulté le 29 janv. 2016]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2008b. Airwick air freshener vent membrane. Winplus North America. [consulté le 29 janv. 2016]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2008c. Type-s oval air freshener, white, summer breeze. Givaudan France Fragrances SAS. [consulté le 27 déc. 2018]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2010a. Menthol flavor e-liquid. Changning Dekang Biotechnology Co., Ltd. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2010b. DK-Tab flavor e-liquid. Changning Dekang Biotechnology Co., Ltd. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2010c. Finish dishwasher freshener odor stop fresh. Reckitt Benckiser Inc. [consulté le 29 janv. 2016]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2012a. NJOY updated assessment 2/9/12. NJOY. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2012b. Stamp pad ink. Horizon Group. [consulté le 22 août 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2013. Desert ship flavor e-liquid. Hangsen Holding Co., Ltd. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2014. Cherry 1.8%. Tobacco Technology, Inc. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2015a. Chocolate flavor e-liquid. Hangsen Holding Co., Ltd. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2015b. Febreze Noticeables Air Freshener - Gain Island Fresh (1 of 2). Procter and Gamble. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2016a. Cherry Crush. Alternative Ingredients, Inc. [consulté le 23 oct. 2019].
[FS] Fiche signalétique. 2016b. R-O PRPK 24TRIM/24HEADLIGT WN BIL. Rustom-Oleum Consumber Brands Canada. [consulté le 22 août 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2016c. Very emollient sunscreen kid spray broad spectrum SPF 40. The Hain Celestial Group, In. Alba Botanica. [consulté le 23 oct. 2019]. (Disponible en anglais seulement).
[FS] Fiche signalétique. 2019. California Scents Spillproof Coronado Cherry. Energizer Manufacturing Inc. [consulté le 30 sept. 2019]. (Disponible en anglais seulement).
Hagan E, Hansen W, Fitzhugh O, Jenner P, Jones W, Taylor JM, Long EL, Nelson A, Brouwer J. 1967. Food flavourings and compounds of related structure. II. subacute and chronic toxicity. Food Cosmet Toxicol. 5:141-157. (Disponible en anglais seulement).
Havkin-Frenkel D, Belanger FC. 2018. Handbook of Vanilla Science and Technology. 2nd ed. Hoboken (NJ): Wiley & Sons Ltd. (Disponible en anglais seulement).
Holloway WD, Tasman-Jones C, Lee SP. 1978. Digestion of certain fractions of dietary fiber in humans. Am J Clin Nutr. 31(6):927-930. (Disponible en anglais seulement).
[HSDB] Hazardous Substances Data Bank [database]. 1983- . Bethesda (MD): National Library of Medicine (US). [consulté en fév. 2019]. (Disponible en anglais seulement).
Imanishi H, Sasaki Y, Matsumoto K, Watanabe M, Ohta T, Shirasu Y, Tutikawa K. 1990. Suppression of 6-TG-resistant mutations in V79 cells and recessive spot formations in mice by vanillin. Mutat Res. 243(2):151-158. (Disponible en anglais seulement).
Jagannath DR. 1980. Mutagenic evaluation of C-192 in the Ames salmonella/microsome plate test. Project no. 20988. Rapport non publié [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
Kluwe W, Montgomery C, Giles H, Prejean J. 1983. Encephalopathy in rats and nephropathy in rats and mice after subchronic oral exposure to benzaldehyde. Food Chem Toxicol. 21(3):245-50. (Disponible en anglais seulement).
Laham S, Broxup B, Robinet M, Potvin M, Schrader K. 1991. Subacute inhalation toxicity of benzaldehyde in the sprague-dawley rat. Am Ind Hyg Assoc J. 52(12):503-10. (Disponible en anglais seulement).
Li Y, Cakmak S, Zhu J. 2019. Profiles and monthly variations of selected volatile organic compounds in indoor air in Canadian homes: Results of Canadian national indoor air survey 2012-2013. Environ Int. 126:134-144. (Disponible en anglais seulement).
Lucas CD, Putnam JM, Hallagan JB & the Flavor and Extract Manufacturers’ Association of the United States Flavor Ingredients Committee. 1999. 1995 Poundage and Technical Effects Update Survey, Washington (DC): Flavor and Extract Manufacturers’ Association of the United States. (Disponible en anglais seulement).
Marnett LJ, Hurd HK, Hollstein MC, Levin DE, Esterbauer H, Ames BN. 1985. Naturally occurring carbonyl compounds are mutagens salmonella tester strain TA104. Mutat Res. 148(1-2):25-34. (Disponible en anglais seulement).
Martelli A, Canonero R, Cavanna M, Ceradello M, Marinari UM. 1994. Cytotoxic and genotoxic effects of five n-alkanals in primary cultures of rat and human hepatocytes. Mutat Res. 323(3):121-126. (Disponible en anglais seulement).
Meek ME, Newhook R, Liteplo RG, Armstrong VC. 1994. Approach to assessment of risk to human health for priority substances under the Canadian Environmental Protection Act. J Environ Sci Health C. 12(2):105-134. (Disponible en anglais seulement).
Moretto R. 2007. Environmental and health evaluation of the use of elastomer granulates (virgin and from used tyres) as filling in third-generation artificial turf [Internet] [PDF]. ADEME/ALIAPUR/FIELDTURF TARKETT. (Disponible en anglais seulement).
Mortelmans K, Haworth S, Lawlor T, Speck W, Tainer B, Zeiger E. 1986. Salmonella mutagenicity tests: II. results from the testing of 270 chemicals. Environ Mutagen. 8(S7 S7):56-119. (Disponible en anglais seulement).
Myhr B. 1981. Mutagenic an evaluation of nonanal in the mouse lymphoma forward mutation assay. LBI Project No. 20989. Rapport non publié [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
[NCI] National Chemical Inventories Global [database]. [modifié en 2020]. Columbus (OH): American Chemical Society, Chemical Abstracts Service. [consulté le 28 sept. 2020]. (Disponible en anglais seulement).
[NTP] National Toxicology Program (US). 1990. Toxicology and carcinogenesis studies of benzaldehyde in F344/N rats and B6C3F1 mice (gavage studies). Research Triangle Park, NC: US Department of Health and Human Services, National Toxicology Program. Report No. 378. (Disponible en anglais seulement).
[NWQMC] National Water Quality Monitoring Council. 2019. Water quality portal. USGS, US EPA, and NWQMC: United States. [consulté le 2019 Aug 26]. (Disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques. 1996a. SIDS initial assessment report: butyraldehyde: CAS No. 123-72-8. Paris, France : SIAM [SIDS Initial Assessment Meeting] 5. [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques. 1996b. SIDS initial assessment report: isobutanal: CAS No. 78-84-2. Paris, France : SIAM [SIDS Initial Assessment Meeting] 5. [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques. 1996c. SIDS initial assessment report: vanillin: CAS No. 121-33-5. Paris, France : SIAM [SIDS Initial Assessment Meeting] 5. [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques.. 2002. SIDS initial assessment report: benzaldehyde: CAS No. 100-52-7. Paris, France : SIAM [SIDS Initial Assessment Meeting] 2. [consulté le 23 sept. 2019]. (Disponible en anglais seulement).
[OCDE] Organisation de coopération et de développement économiques.. 2009. Emission scenario document on coating industry (paints, lacquers and varnishes) [PDF]. Paris (France) : OECD, Environment Directorate. (Series on Emission Scenario Documents No. 22; Report No.: ENV/JM/MONO(2009)24, JT03267833). (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1967. Toxicological evaluation of some flavouring substances and non-nutritive sweetening agents. Genève : Organisation mondiale de la Santé. Rapport no. 44A. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1979. Octanal (WHO food additives series 14). Genève : Organisation mondiale de la Santé. Rapport no. 482. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1981. Evaluation of certain food additives. twenty-fifth report of the joint FAO/WHO expert committee on food additives. Genève : Organisation mondiale de la Santé. Rapport no 669. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1984. Evaluation of certain food additives and contaminants. twenty-eighth report of the joint FAO/WHO expert committee on food additives. Genève : Organisation mondiale de la Santé. Rapport no 710. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1996. Evaluation of certain food additives and contaminants. forty-sixth report of the joint FAO/ WHO expert committee on food additives. Genève : Organisation mondiale de la Santé. Rapport no WHO Technical Report Series 868. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 1999. Evaluation of certain food additives and contaminants. forty-ninth report of the joint FAO/WHO expert committee on food additives. Genève : Organisation mondiale de la Santé. Rapport no 884. (Disponible en anglais seulement).
[OMS] Organisation mondiale de la santé. 2002. Evaluation of certain food additives and contaminants. fifty-seventh report of the joint FAO/WHO expert committee on food additives. Genève : Organisation mondiale de la Santé. Rapport no WHO Technical Report Series 909. (Disponible en anglais seulement).
[OEHHA] Office of Environmental Health Hazard Assessment. 2018. Gasoline-related air pollutants in California – trends in exposure and health risk 1996 to 2014 [PDF]. California Environmental Protection Agency, Sacramento, SA. [consulté en déc. 2019]. (Disponible en anglais seulement).
Opgrande JL, Dobratz CJ, Brown E, Liang J, Conn GS, Shelton FJ, With J. 2000. Benzaldehyde. Kirk‐Othmer Encyclopedia of Chemical Technology. Online version. New York (NY): John Wiley and Sons, Inc. (Disponible en anglais seulement).
Oser B, Carson S, Oser M. 1965. Toxicological tests on flavouring matters. Food Cosmet Toxicol. 3:563-9. (Disponible en anglais seulement).
[PCPC] Personal Care Products Council. 2020. Cosmetic Ingredient Identification Database (International Cosmetic Ingredient Dictionary (INCI)). [consulté le 9 sept. 2020]. (Disponible en anglais seulement).
PubChem [base de données]. 2004- . Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information. [consulté en fév. 2019]. (Disponible en anglais seulement).
Ramachandra Rao S, Ravishankar GA. 2000. Vanilla flavour: production by conventional and biotechnological routes. J Sci Food Agric. 80(3):289-304. (Disponible en anglais seulement).
Santé Canada. 2010a. Étude d’évaluation de la qualité de l’air intérieur à Regina (2007) : Sommaire des données d’échantillonnage des composés organiques volatils. Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2010b. Étude d’évaluation de l’exposition à Windsor (2005-2006) : Sommaire des données d’échantillonnage des composés organiques volatils. Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2012. Étude de la qualité de l’air intérieur à Halifax (2009) : Sommaire des données d’échantillonnage des composés organiques volatils (COV). Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2013. Étude de la qualité de l’air intérieur à Edmonton (2010). Sommaire des données d’échantillonnage des composés organiques volatils (COV). Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. [modifié 14 déc. 2015]. Liste critique des ingrédients de cosmétiques. Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2015. Tableau de la consommation alimentaire obtenu à l’aide de Statistique Canada, Enquête sur la santé dans les collectivités canadiennes, Cycle 2.2, Nutrition (2004). Fichier de partage. Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2016. Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ontario) : gouvernement du Canada.
Santé Canada. 2017. Science Approach Document. L’approche scientifique concernant les substances présentant un faible danger pour la santé humaine. Ottawa (Ontario) : gouvernement du Canada.
Sinha A, Sharma U, Sharma N. 2007. A comprehensive review on vanilla flavor: Extraction, isolation and quantification of vanillin and others constituents. Int J Food Sci Nutr. 59(4):299-326. (Disponible en anglais seulement).
Stofberg J, Grundschober F. 1987. Consumption ratio and food predominance of flavoring materials. Perfumer an Florist. 12(4):27-68. (Disponible en anglais seulement).
[VCF] Volatile Compounds in Foods [base de données]. 1992-2019. Version 16.6.1. Zeist, (Pays-Bas) : Triskelion. [updated continually; consulté le 2019 May 31]. (Disponible en anglais seulement).
Verzera A, Trozzi A, Cotroneo A, Lorenzo D, Dellacassa E. 2000. Uruguayan Essential Oil. 12. Composition of Nova and Satsuma Mandarin Oils. J Agric Food Chem. 48(7):2903-2909.
Watanabe K, Matsunaga T, Yamamoto I, Yashimura H. 1995. Oxidation of tolualdehydes to toluic acids catalyzed by cytochrome P450-dependent aldehyde oxygenase in the mouse liver. Drug Metab Dispos. 23(2):261-5. (Disponible en anglais seulement).
Won D. 2015. VOC emissions from evaporative sources in residential garages. Ottawa (Ontario): NRC-CNRC. 221 p. Report No.: A1-000342-03. (Disponible en anglais seulement).
Won D, Nong G, Yang W, Collins W. 2014. Material emissions testing: VOCs from wood, paint, and insulation materials. Ottawa (Ontario): NRC-CNRC. 154 p. Report No.: A1-000342.2. (Disponible en anglais seulement).
Won D, Nong G, Yang W, Schleibinger H. 2013. Material emissions data: 52 building materials tested for 124 compounds. Ottawa (Ontario): NRC-CNRC. 286 p. Rapport no.: A1-000342. (Disponible en anglais seulement).
Won D, Yang W. 2012. Material emission information from 105 building materials and consumer products. Ottawa (Ontario): NRC-CNRC. 151 p. Rapport no.: B3341.1. (Disponible en anglais seulement).
Zeiger E, Andersn B, Haworth S, Lawlor T, Mortelmans K. 1992. Salmonella mutagenicity tests: V. results from the testing of 311 chemicals. Environ Mol Mutagen. 19(S21):2-141. (Disponible en anglais seulement).
Annexe A. Tableaux sommaires de la lecture croisée pour les paramètres des effets sur la santé
| Propriété | Benzaldéhyde (cible) | Benzoate de sodium (analogue) |
|---|---|---|
| Structure |  |
![c1(ccccc1)C(=O)[O-].[Na+]](/content/dam/eccc/images/pded/aldehydes/20220819-a1b.jpg) |
| État physique | Liquide | Solide |
| Point de fusion (°C)a | -26 | 436 |
| Pression de vapeur (Pa)a,b | 15 | 4.89 x 10-7 |
| Constante de la loi de Henry (Pa·m3/mol)b | 2,7 | n.d. |
| Solubilité dans l’eau (mg/L)a | 6950 | 5,56 x 105 |
| Log Koe (sans dimension)a | 1,48 | 1,88 |
| Genotoxicité | Négative | s.o. |
| Exposition à court terme par voie orale | DSENO = 400 mg/kg p.c./jour (étude d’exposition par voie orale de 2 semaines chez la souris et le rat) | s.o. |
| Exposition à court terme par inhalation |
CMENO = 2170 mg/m3 DMENOaju = 512 mg/kg p.c./jour (étude d’exposition par inhalation de 14 jours chez le rat) |
s.o. |
| Exposition à court terme par voie cutanée | s.o. | s.o. |
| Exposition subchronique par voie orale | DSENO = 400-600 mg/kg p.c./jour (étude d’exposition orale de 13 semaines chez la souris et le rat) | s.o. |
| Exposition subchronique par inhalation | s.o. | s.o. |
| Exposition subchronique par voie cutanée | s.o. | s.o. |
| Exposition chronique par voie orale | DSENO = 200 mg/kg p.c./jour (étude d’exposition par voie orale de 2 semaines chez la souris et le rat) | s.o. |
| Exposition chronique par inhalation | s.o. | s.o. |
| Exposition chronique par voie cutanée | s.o. | s.o. |
| Carcinogénicité | DSENO = 400-600 mg/kg p.c./jour (étude d’exposition par voie orale de 2 semaines chez la souris et le rat; aucun effet cancérogène) | s.o. |
| Toxicité pour la reproduction ou le développement | DSENO = 1306 mg/kg p.c./jour (étude d’effets de l’exposition par voie alimentaire sur le développement chez le rat) ( lecture croisée avec le benzoate de sodium) | DSENO = 1306 mg/kg p.c./jour (étude d’effets de l’exposition par voie alimentaire sur le développement chez le rat) |
Abréviations : DMENO, dose minimale avec effet nocif observé; s.o., sans objet; n.d., non disponible; DSENO, dose sans effet nocif observé.
a ECHA c2007-2019
b ChemIDplus 1993-
| Propriété | Octanal (cible 1) | Nonanal (cible 2) | Butanal (analogue 1) | Isobutanal (analogue 2) |
|---|---|---|---|---|
| Structure |  |
 |
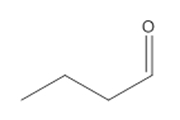 |
 |
| État physique | Liquide | Liquide | Liquide | Liquide |
| Point de fusion (°C)a,b | -20 | -18,8 | -99 | -65,9 |
| Pression de vapeur (Pa)a | 148 | 49 | 1,44 × 104 | 2,31 × 104 |
| Constante de la loi de Henry (Pa·m3/mol)b | 52,1 | 74,4 | 11,7 | 18,2 |
| Solubilité dans l’eau (mg/L)a | 560 | 96 | 5 × 105 | 6 × 105 |
| Log Koe (sans dimension)a | 3,50 | 3,40 | 1,3 | 0,77 |
| Genotoxicité | Négative | Équivoque | s.o. | s.o. |
| Exposition à court terme par voie orale | DSENO = 313 mg/kg p.c./jour (étude d’exposition par gavage de 14 jours chez le rat (lecture croisée avec le butanal) | DSENO = 313 mg/kg p.c./jour (étude d’exposition par gavage de 14 jours chez le rat (lecture croisée avec le butanal) | DSENO = 313 mg/kg p.c./jour (étude d’exposition par gavage de 14 jours chez le rat | s.o. |
| Exposition à court terme par inhalation | NA | NA | s.o. | s.o. |
| Exposition à court terme par voie cutanée | DSENO = 500 mg/kg p.c./jour (étude d’exposition par voie cutanée de 2 semaines chez le rat )(lecture croisée avec le nonanal) | DSENO = 500 mg/kg p.c./jour (étude d’exposition par voie cutanée de 2 semaines chez le rat) | s.o. | s.o. |
| Exposition subchronique par voie orale | DSENO = 13 mg/kg p.c./jour (étude d’exposition par voie alimentaire de 2 semaines chez le rat) | DSENO = 29 mg/kg p.c./jour (étude d’exposition par voie alimentaire de 12 semaines chez le rat) | DSENO = 300 mg/kg p.c./jour (étude de l’exposition par gavage de 13 semaines chez le rat) | s.o. |
| Exposition subchronique par inhalation | DSENO = 150 mg/m3; DSENOaju = 27a mg/m3 (étude de l’exposition par inhalation de 13 semaines chez le rat) (lecture croisée avec le butanal) | DSENO = 150 mg/m3; DSENOaju = 27a mg/m3 (étude de l’exposition par inhalation de 13 semaines chez le rat) (lecture croisée avec le butanal) | DSENO = 150 mg/m3; DSENOaju = 27a mg/m3 (étude de l’exposition par inhalation de 13 semaines chez le rat) | s.o. |
| Exposition subchronique par voie cutanée | n.d. | n.d. | s.o. | s.o. |
| Exposition chronique par voie orale | n.d. | n.d. | s.o. | s.o. |
| Exposition chronique par inhalation | CMENO = 1474 mg/m3 (étude de l’exposition par inhalation de 2 ans chez le rat et la souris; lésions de l’épithélium respiratoire chez les rats femelles) (lecture croisée avec l’isobutanal) | CMENO = 1474 mg/m3 étude de l’exposition par inhalation de 2 ans chez le rat et la souris; lésions de l’épithélium respiratoire chez les rats femelles) (lecture croisée avec l’isobutanal) | s.o. | CMENO = 1474 mg/m3 (étude de l’exposition par inhalation de 2 ans chez le rat et la souris; lésions de l’épithélium respiratoire chez les rats femelles) |
| Exposition chronique par voie cutanée | n.d. | n.d. | s.o. | s.o. |
| Carcinogénicité | DSENO = 5898 mg/m3 (étude de 2 ans sur la cancérogénicité par inhalation chez le rat et la souris; aucun effet cancérogène) (lecture croisée avec l’isobutanal) | DSENO = 5898 mg/m3 (étude de 2 ans sur la cancérogénicité par inhalation chez le rat et la souris; aucun effet cancérogène) (lecture croisée avec l’isobutanal) | s.o. | DSENO = 5898 mg/m3 (étude de 2 ans sur la cancérogénicité par inhalation chez le rat et la souris; aaucun effet cancérogène) |
| Toxicité pour la reproduction ou le développement | DSENO = 11 796 mg/m3 (étude d’effets de l’exposition par voie respiratoire sur la reproduction et le développement chez le rat; aucun effet négatif sur le fœtus) (lecture croisée avec l’isobutanal) | DSENO = 11 796 mg/m3 (inhalation reproductive and developmental studies in rats; no adverse fetal effects) (lecture croisée avec l’isobutanal) | s.o. | DSENO = 11 796 mg/m3 (étude d’effets de l’exposition par voie respiratoire sur la reproduction et le développement chez le rat; aucun effet négatif sur le fœtus) |
Abréviations : s.o., sans objet; n.d., non disponible; DSENO, dose sans effet nocif observé.
a ECHA c2007-2019
b ChemIDplus 1993-
| Propriété | Essences de vanille | Vanilline (cible) | Éthylvanilline (analogue) |
|---|---|---|---|
| Structure | s.o. |  |
 |
| État physique | s.o.c | Solide | Solide |
| Point de fusion (°C)a | s.o.c | 80 | 65 |
| Pression de vapeur (Pa)a | s.o.c | 0,3 | 0,03 |
| Constante de la loi de Henry (Pa·m3/mol)b | s.o.c | 2,18 × 10-4 | 1,11 × 10-5 |
| Solubilité dans l’eau (mg/L)a | s.o.c | 9 × 103 | 2,8 × 103 |
| Log Koe (sans dimension)a | s.o.c | 1,21 | 1,58 |
| Genotoxicité | Négative (lecture croisée avec la vanilline) | Négative | s.o. |
| Exposition à court terme par voie orale | n.d. | s.o. | s.o. |
| Exposition à court terme par inhalation | n.d. | s.o. | s.o. |
| Exposition à court terme par voie cutanée | n.d. | s.o. | s.o. |
| Exposition subchronique par voie orale | DSENO = 1000 mg/kg p.c./jour (étude de l’exposition par voie alimentaire de 16 semaines chez le rat; aucun effet négatif (lecture croisée avec la vanilline) | DSENO = 1000 mg/kg p.c./jour (étude de l’exposition par voie alimentaire de 16 semaines chez le rat; aucun effet négatif | s.o. |
| Exposition subchronique par inhalation | n.d. | s.o. | s.o. |
| Exposition subchronique par voie cutanée | s.o. | s.o. | s.o. |
| Exposition chronique par voie orale | DSENO = 2500 mg/kg p.c./jour (étude de 1an sur l’exposition par voie alimentaire chez le rat; aucun effet négatif) (lecture croisée avec la vanilline) | DSENO = 2500 mg/kg p.c./jour (étude de 1an sur l’exposition par voie alimentaire chez le rat; aucun effet négatif) | s.o. |
| Exposition chronique par inhalation | s.o. | s.o. | s.o. |
| Exposition chronique par voie cutanée | s.o. | s.o. | s.o. |
| Carcinogénicité | DSENO = 2500 mg/kg p.c./jour (étude de 1an sur l’exposition par voie alimentaire chez le rat; aucun effet cancérogène) (lecture croisée avec la vanilline) | DSENO = 2500 mg/kg p.c./jour (étude de 1an sur l’exposition par voie alimentaire chez le rat; aucun effet cancérogène) | s.o. |
| Toxicité pour la reproduction ou le développement | DSENO = 1000 mg/kg p.c./jour (étude d’effets de l’exposition par voie orale sur la reproduction et le développement chez le rat; aucun effet négatif sur le fœtus) (lecture croisée avec la vanilline) | DSENO = 1000 mg/kg p.c./jour (étude d’effets de l’exposition par voie orale sur la reproduction et le développement chez le rat; aucun effet négatif sur le fœtus) (lecture croisée avec la vanilline) | DSENO = 1000 mg/kg p.c./jour (étude d’effets de l’exposition par voie orale sur la reproduction et le développement chez le rat; aucun effet négatif sur le fœtus) |
Abréviations : s.o., sans objet; n.d., non disponible
a ECHA c2007-2019
b ChemIDplus 1993-
c Ce produit est un UVCB
Annexe B. Estimations de l’exposition humaine aux substances du groupe des aldéhydes
Les estimations de l’exposition humaine dues à l’utilisation de produits disponibles pour les consommateurs ont été estimées à l’aide de ConsExpo Web (2018). En l’absence de données sur l’absorption cutanée, les niveaux d’exposition systémique quotidienne ont été présumés à 100 %; une absorption de 100 % par inhalation a également été présumée. Les paramètres utilisés dans l’estimation des expositions par voie orale, par inhalation et par voie cutanée sont décrits dans le tableau B-2. Sauf indication contraire, on a utilisé les valeurs par défaut de la fiche d’information ConsExpo pertinente pour le scénario.
Les taux d’inhalation et les poids corporels des utilisateurs sont précisés dans Santé Canada (2015) et sont résumés dans le tableau B-1.
| Groupe d’âge | Taux d’inhalation (m3/day) | Poids corporel (kg) |
|---|---|---|
| 19 ans et plus | 15,1 | 74 |
| 14 à 18 ans | 15,9 | 62 |
| 9 à 13 ans | 13,9 | 42 |
| 4 à 8 ans | 11,1 | 23 |
| 2 à 3 ans | 9,2 | 15 |
| 1 an | 8,0 | 11 |
| 6 à 11 mois | 5,4 | 9,1 |
| 0 à 5 mois | 3,7 | 6,3 |
| Scénario d’exposition | Paramètres et hypothèses du modèle |
|---|---|
| Assainisseur d’air, benzaldéhyde et octanal, inhalation, exposition quotidienne |
Pour l’exposition par inhalation : Produit libéré (g/h) = quantité initiale de produit (g)/durée d’élimination du produita (h) Modèle : Exposition à la vapeur - libération instantanée |
| Hydratant pour le corps, benzaldéhyde, dermique, quotidien, tout-petit ( 2 à 3 ans) |
Pour une exposition par voie cutanée : Quantité de produit × fraction pondérale × fréquence/poids corporel × conversion des unités |
| Baume à lèvres, benzaldéhyde, oral, quotidien, tout-petit (2 à 3 ans) |
Pour une exposition par voie orale : Quantité de produit × fraction pondérale × fréquence/poids corporel × conversion des unités |
| Comprimé de suppléments de vitamines et minéraux, octanal et nonanal, oral, quotidien, enfant (9 à13 ans) |
Pour une exposition par voie orale : Quantité de produit × fraction pondérale × fréquence/poids corporel × conversion des unités |
| Écran solaire en aérosol, nonanal, cutané et par inhalation, quotidien, nourrisson (6 à 11 mois) et adolescent (14 à 18 ans) |
Pour une exposition par inhalation (14 à 18 ans) : Pour l’exposition cutanée ( 6 à 11 mois) : Quantité de produit × fraction pondérale × fréquence/poids corporel × conversion des unités |
a Basé sur la durée de vie annoncée du produit.
b Basé sur la surface du visage, car le produit est commercialisé comme un produit à vaporiser pour « réveiller » et on s’attend à ce que le produit soit vaporisé vers le visage.
Annexe C. Estimations de l’absorption quotidienne par groupe d’âge au sein de la population générale du Canada
| Voie d’exposition | 0 à 5 mois a (lait maternel)b | 0 à 5 moisa (Nourris au lait maternisé)c | 6 à 11 moisd | 1 ane | 2 à 3 ansf | 4 à 8 ansg | 9 à 13 ansh | 14 à 18 ansi | 19 ans ou plusj |
|---|---|---|---|---|---|---|---|---|---|
| Air ambiantk | 8,85×10-2 | 8,85×10-2 | 8,95×10-2 | 1,10×10-1 | 9,25×10-2 | 7,28×10-2 | 4,99×10-2 | 3,87×10-2 | 3,08×10-2 |
| Air intérieurl | 8,07 | 8,07 | 8,16 | 1,00×101 | 8,43 | 6,63 | 4,55 | 3,53 | 2,80 |
| l’eau potablem | s.o. | 1,04×10-4 | 6,63×10-5 | 2,59×10-5 | 2,26×10-5 | 1,82×10-5 | 1,39×10-5 | 1,39×10-5 | 1,63×10-5 |
| Soln | s.o. | s.o. | 2,25×10-8 | 2,24×10-8 | 1,16×10-8 | 1,06×10-8 | 4,60×10-9 | 6,32×10-10 | 6,05×10-10 |
| Nourriture et boissonso | s.o. | s.o. | s.o. | 6,00×102 | 6,00×102 | 6,00×102 | 6,00×102 | 6,00×102 | 6,00×102 |
| Absorption totale | 8,16 | 8,16 | 8,25 | 6,10×102 | 6,09×102 | 6,07×102 | 6,05×102 | 6,04×102 | 6,03×102 |
Abréviation : s.o., sans objet.
a On présume que le nourrisson pèse 6,3 kg (Santé Canada, 2015), respire 3,7 m³ d’air par jour (EPA des É.-U. 2011 [modifié], et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume qu’aucune ingestion de sol n’a lieu sur la base des pratiques courantes des personnes qui s’occupent des nourrissons.
b On présume que les nourrissons exclusivement allaités consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
c On présume que les nourrissons exclusivement nourris à la préparation consomment 0,826 L d’eau par jour (Santé Canada 2018), qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015), respire 5,4 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]). On présume que les nourrissons nourris au lait maternel consomment 0,632 L de lait maternel par jour (Santé Canada 2018) que les nourrissons nourris au lait maternisé consomment 0,764 L d’eau par jour (Santé Canada 2018), lorsque l’eau est utilisée pour reconstituer le lait maternisé. Voir la note de bas de page sur l’eau potable pour plus de détails.
e On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (EPA des É.-U. 2011 modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
f On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
g On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié, boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 (30.6 µg/m3) a été utilisé comme substitut pour le calcul des estimations de la limite supérieure de l’absorption quotidienne pour l’exposition à l’air ambiant, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 3 heures à l’extérieur chaque jour (Santé Canada 1998).
l Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 µg/m3) a été utilisé pour calculer les estimations de la limite supérieure de l’apport quotidien pour l’exposition à l’air intérieur, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
m Aucune donnée de surveillance de l’eau potable au Canada n’a été relevée. Based on an estimate of 7.9x10-4 µg/L on the basis of a 100% release scenario to water from ChemCAN v6.00 where the simulations conservatively assumed that total quantities were released into a single region of Canada, i.e., the Ontario Mixed-Wood Plain region, at a 100% emission factor and assuming 0% removal for wastewater treatment processes (for water releases).
n Aucune donnée de surveillance du sol au Canada n’a été recensée. D’après une estimation de 0,03 ng/g selon un scénario de rejet à 100 % dans le sol tiré de ChemCAN v6.00, où les simulations ont supposé, de façon prudente, que les quantités totales étaient rejetées dans une seule région du Canada, c’est-à-dire la région de la Plaine à forêts mixtes de l’Ontario.
o On ne possède aucune information définitive sur l’utilisation potentielle du benzaldéhyde comme aromatisant alimentaire au Canada. L’estimation de l’absorption par habitant calculée par le JECFA pour les États-Unis (fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur le tonnage) a été utilisée pour calculer l’absorption quotidienne de benzaldéhyde en tant qu’aromatisant alimentaire (voir section 6.1). En l’absence d’estimations de l’absorption par groupe d’âge, les expositions basées sur une personne de 60 kg (OMS 2002) ont été utilisées pour tous les groupes d’âge pertinents (1 an et plus). L’absorption ajustée en fonction du poids corporel utilisant un poids corporel de 60 kg est considérée suffisamment prudente pour représenter l’ensemble de la population âgée d’un an et plus (communication personnelle, courriels de la DA, Santé Canada, à ESRAB, Santé Canada, 2019; source non citée.
| Voie d’exposition | 0 à 5 mois a (lait maternel)b | 0 à 5 moisa (Nourris au lait maternisé)c | 6 à 11 moisd | 1 ane | 2 à 3 ansf | 4 à 8 ansg | 9 à 13 ansh | 14 à 18 ansi | 19 ans ou plusj |
|---|---|---|---|---|---|---|---|---|---|
| Air ambiantk | 8,08×10-1 | 8,08×10-1 | 8,16×10-1 | 1,00 | 8,43×10-1 | 6,64×10-1 | 4,55×10-1 | 3,53×10-1 | 2,81×10-1 |
| Air intérieurl | 5,65 | 5,65 | 5,71 | 7,00 | 5,90 | 4,65 | 3,19 | 2,47 | 1,96 |
| Nourriture et boissonsm | s.o. | s.o. | s.o. | 2,90×10-1 | 2,90×10-1 | 2,90×10-1 | 2,90×10-1 | 2,90×10-1 | 2,90×10-1 |
| Absorption totale | 6,46 | 6,46 | 6,53 | 8,29 | 7,04 | 5,60 | 3,93 | 3,11 | 2,53 |
Abréviations : s.o., sans objet.
a On présume que le nourrisson pèse 6,3 kg (Santé Canada, 2015), respire 3,7 m³ d’air par jour (EPA des É.-U. 2011 [modifié], et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume qu’aucune ingestion de sol n’a lieu sur la base des pratiques courantes des personnes qui s’occupent des nourrissons.
b On présume que les nourrissons exclusivement allaités consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
c On présume que les nourrissons exclusivement nourris à la préparation consomment 0,826 L d’eau par jour (Santé Canada 2018), qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015), respire 5,4 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]). On présume que les nourrissons nourris au lait maternel consomment 0,632 L de lait maternel par jour (Santé Canada 2018) que les nourrissons nourris au lait maternisé consomment 0,764 L d’eau par jour (Santé Canada 2018), lorsque l’eau est utilisée pour reconstituer le lait maternisé. Voir la note de bas de page sur l’eau potable pour plus de détails.
e On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (EPA des É.-U. 2011 modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
f On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
g On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié, boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 (30.6 µg/m3) a été utilisé comme substitut pour le calcul des estimations de la limite supérieure de l’absorption quotidienne pour l’exposition à l’air ambiant, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 3 heures à l’extérieur chaque jour (Santé Canada 1998).
l Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 µg/m3) a été utilisé pour calculer les estimations de la limite supérieure de l’apport quotidien pour l’exposition à l’air intérieur, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
m Aucune donnée validée n’existe concernant l’utilisation potentielle du nonanal comme aromatisant dans les aliments au Canada. L’estimation établie par le JECFA de l’absorption par habitant pour les États-Unis (fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur le poids) a été utilisée pour calculer l’absorption quotidienne de l’octanal comme aromatisant alimentaire (voir la section 6.1). En l’absence d’estimations de l’absorption par groupe d’âge, les expositions basées sur une personne de 60 kg (OMS 2002) ont été appliquées à tous les groupes d’âge pertinents. L’apport ajusté en fonction du poids corporel utilisant un poids corporel de 60 kg est considéré comme suffisamment prudent pour représenter l’ensemble de la population âgée de 1 an et plus (communication personnelle, courriels de la DA, Santé Canada, à ESRAB, Santé Canada, 2019; source non citée).
| Voie d’exposition | 0 à 5 mois a (lait maternel)b | 0 à 5 moisa (Nourris au lait maternisé)c | 6 à 11 moisd | 1 ane | 2 à 3 ansf | 4 à 8 ansg | 9 à 13 ansh | 14 à 18 ansi | 19 ans ou plusj |
|---|---|---|---|---|---|---|---|---|---|
| Air ambiantk | 2,25 | 2,25 | 2,27 | 2,78 | 2,35 | 1,85 | 1,27 | 9,81×10-1 | 7,81×10-1 |
| Air intérieurl | 1,57×101 | 1,57×101 | 1,59×101 | 1,95×101 | 1,64×101 | 1,29×101 | 8,86 | 6,87 | 5,46 |
| Nourriture et boissonsm | s.o. | s.o. | s.o. | 1,50 | 1,50 | 1,50 | 1,50 | 1,50 | 1,50 |
| Absorption totale | 1,80×101 | 1,80×101 | 1,82×101 | 2,38×101 | 2,03×101 | 1,63×101 | 1,16×101 | 9,35 | 7,74 |
Abréviation : s.o., sans objet.
a On présume que le nourrisson pèse 6,3 kg (Santé Canada, 2015), respire 3,7 m³ d’air par jour (EPA des É.-U. 2011 [modifié], et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume qu’aucune ingestion de sol n’a lieu sur la base des pratiques courantes des personnes qui s’occupent des nourrissons.
b On présume que les nourrissons allaités exclusivement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
c On présume que les nourrissons exclusivement nourris à la préparation consomment 0,826 L d’eau par jour (Santé Canada 2018), qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015), respire 5,4 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]). On présume que les nourrissons nourris au lait maternel consomment 0,632 L de lait maternel par jour (Santé Canada 2018) que les nourrissons nourris au lait maternisé consomment 0,764 L d’eau par jour (Santé Canada 2018), lorsque l’eau est utilisée pour reconstituer le lait maternisé. Voir la note de bas de page sur l’eau potable pour plus de détails.
e On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (EPA des É.-U. 2011 modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
f On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
g On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
i On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié, boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
j On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 (30.6 µg/m3) a été utilisé comme substitut pour le calcul des estimations de la limite supérieure de l’absorption quotidienne pour l’exposition à l’air ambiant, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 3 heures à l’extérieur chaque jour (Santé Canada 1998).
l Le 95e percentile de la concentration dans l’air intérieur des maisons canadiennes (30,6 µg/m3) a été utilisé pour calculer les estimations de la limite supérieure de l’apport quotidien pour l’exposition à l’air intérieur, à titre d’estimation prudente (Li et coll., 2019). On suppose que les Canadiens passent 21 heures à l’intérieur chaque jour (Santé Canada 1998).
m Aucune donnée validée n’existe concernant l’utilisation potentielle du nonanal comme aromatisant dans les aliments au Canada. L’estimation établie par le JECFA de l’absorption par habitant pour les États-Unis (fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur le poids) a été utilisée pour calculer l’absorption quotidienne de l’octanal comme aromatisant alimentaire (voir la section 6.1). En l’absence d’estimations de l’absorption par groupe d’âge, les expositions basées sur une personne de 60 kg (OMS 2002) ont été appliquées à tous les groupes d’âge pertinents. L’apport ajusté en fonction du poids corporel utilisant un poids corporel de 60 kg est considéré comme suffisamment prudent pour représenter l’ensemble de la population âgée de 1 an et plus (communication personnelle, courriels de la DA, Santé Canada, à ESRAB, Santé Canada, 2019; source non citée).
| Voie d’exposition | 0 à 5 mois a (lait maternel)b | 0 à 5 moisa (Nourris au lait maternisé)c | 6 à 11 moisd | 1 ane | 2 à 3 ansf | 4 à 8 ansg | 9 à 13 ansh | 14 à 18 ansi | 19 ans ou plusj |
|---|---|---|---|---|---|---|---|---|---|
| Nourriture et boissonsk | s.o. | s.o. | s.o. | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 |
| Absorption totale | s.o. | s.o. | s.o. | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 | 1,80×101 |
Abréviation : s.o., sans objet.
a On présume que le nourrisson pèse 6,3 kg (Santé Canada, 2015), respire 3,7 m³ d’air par jour (EPA des É.-U. 2011 [modifié], et ingère 21,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]). On présume qu’aucune ingestion de sol n’a lieu sur la base des pratiques courantes des personnes qui s’occupent des nourrissons.
b On présume que les nourrissons allaités exclusivement consomment 0,744 L de lait maternel par jour (Santé Canada 2018), et on présume que le lait maternel constitue la seule source alimentaire.
c On présume que les nourrissons nourris à la préparation exclusivement consomment 0,826 L d’eau par jour (Santé Canada 2018), qui est utilisée pour reconstituer la préparation. Pour plus de renseignements, veuillez consulter la note de bas de page sur l’eau potable.
d On présume que le nourrisson pèse 9,1 kg (Santé Canada 2015), respire 5,4 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0 L d’eau par jour (Santé Canada 2017), ingère 7,3 mg de sol par jour et ingère 27,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]). On présume que les nourrissons nourris au lait maternel consomment 0,632 L de lait maternel par jour (Santé Canada 2018) que les nourrissons nourris au lait maternisé consomment 0,764 L d’eau par jour (Santé Canada 2018), lorsque l’eau est utilisée pour reconstituer le lait maternisé. Voir la note de bas de page sur l’eau potable pour plus de détails.
e On présume que l’enfant pèse 11,0 kg (Santé Canada 2015b), respire 8,0 m³ d’air par jour (EPA des É.-U. 2011 modifié]), boit 0,36 L d’eau par jour (Santé Canada 2017), ingère 8,8 mg de sol par jour et ingère 35,0 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
f On présume que l’enfant pèse 15 kg (Santé Canada 2015b), respire 9,2 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,43 L d’eau par jour (Santé Canada 2017), ingère 6,2 mg de sol par jour et ingère 21,4 mg de poussière par jour (Wilson and Meridian 2015 [modifié]).
g On présume que l’enfant pèse 23 kg (Santé Canada 2015b), respire 11,1 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,53 L d’eau par jour (Santé Canada 2017), ingère 8,7 mg de sol par jour et ingère 24,4 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
h On présume que l’enfant pèse 42 kg (Santé Canada 2015b), respire 13,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié]), boit 0,74 L d’eau par jour (Santé Canada 2017), ingère 6,9 mg de sol par jour et ingère 23,8 mg de poussière par jour (Wilson et Meridian 2015 [modifié])..
i On présume que l’adolescent pèse 62 kg (Santé Canada 2015b), respire 15,9 m³ d’air par jour (EPA des É.-U. 2011 [modifié, boit 1,09 L d’eau par jour (Santé Canada 2017), ingère 1,4 mg de sol par jour et ingère 2,1 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).]).
j On présume que l’adulte pèse 74 kg (Santé Canada 2015b), respire 15,1 m3 d’air par jour (EPA des É.-U. 2011 [modifié]), boit 1,53 L d’eau par jour (Santé Canada 2017), ingère 1,6 mg de sol par jour et ingère 2,6 mg de poussière par jour (Wilson et Meridian 2015 [modifié]).
k Aucune donnée validée n’existe concernant l’utilisation potentielle du méthylbenzaldéhyde comme aromatisant dans les aliments au Canada. L’estimation établie par le JECFA de l’absorption par habitant pour les États-Unis (fondée sur les volumes de production annuelle déclarés par l’industrie alimentaire dans les enquêtes sur le poids) a été utilisée pour calculer l’absorption quotidienne de méthylbenzaldéhyde comme aromatisant alimentaire (voir la section 6.1). En l’absence d’estimations de l’absorption par groupe d’âge, les expositions basées sur une personne de 60 kg (OMS 2002) ont été appliquées à tous les groupes d’âge pertinents. L’apport ajusté en fonction du poids corporel utilisant un poids corporel de 60 kg est considéré comme suffisamment prudent pour représenter l’ensemble de la population âgée de 1 an et plus (communication personnelle, courriels de la DA, Santé Canada, à ESRAB, Santé Canada, 2019; source non citée).
Détails de la page
- Date de modification :
