Ébauche d’évaluation préalable - Groupe des amines aliphatiques
Titre officiel : Ébauche d’évaluation préalable - Groupe des amines aliphatiques
Environnement et Changement climatique Canada
Santé Canada
Mars 2021
Sommaire
En vertu de l’article 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), les ministres de l’Environnement et de la Santé ont mené l’évaluation préalable de 13 des 19 substances appelées collectivement, dans le cadre du Plan de gestion des produits chimiques, substances du groupe des amines aliphatiques. Ces 19 substances ont été désignées prioritaires pour l’évaluation, car elles satisfont aux critères de catégorisation énoncés au paragraphe 73(1) de la LCPE ou suscitent des préoccupations pour la santé humaine. On a déterminé par d’autres approches que quatre des 19 substances étaient peu préoccupantes, et les décisions concernant ces substances sont fournies dans des rapports distinctsNote de bas de page 1 Note de bas de page 2. En outre, deux des 19 substances ont été retirées du groupe des amines aliphatiques et ajoutées dans d’autres groupes du Plan de gestion des produits chimiquesNote de bas de page 3. Par conséquent, la présente évaluation préalable vise les 13 substances énumérées dans le tableau ci‑dessous et ci-après appelées substances du groupe des amines aliphatiques. Les numéros de registre du Chemical Abstracts Service (nos CASNote de bas de page 4), leur nom sur la Liste intérieure des substances (LIS) et leur nom commun (et abréviation, s’il y a lieu) sont présentés dans le tableau ci-dessous.
| No CAS | Nom de la LIS | Nom commun (abréviations) | Sous-groupe |
|---|---|---|---|
| 103-83-3a | Benzyldiméthylamine | N,N-Diméthylbenzylamine | À chaîne courte |
| 107-15-3 | Éthylènediamine | Éthane-1,2-diamine | À chaîne courte |
| 111-40-0 | 2,2’-Iminodi(éthylamine) | 3-Azapentane-1,5-diamine | À chaîne courte |
| 112-69-6 | Hexadécyldiméthylamine | N,N-Diméthylhexadécanamine | À chaîne longue |
| 124-30-1 | Octadécylamine | Octadécanamine | À chaîne longue |
| 124-40-3 | Diméthylamine | N-Méthylméthanamine | À chaîne longue |
| 61788-46-3b | Amines alkyles de coco | Alcanamines de coco | À chaîne longue |
| 61789-79-5a,b | Amines, bis(alkyle de suif hydrogéné) | N-(Alkyl de suif hydrogéné)alcanamines de suif hydrogénées (NASAS) | À chaîne longue |
| 61790-59-8b | Amines alkyles de suif hydrogéné, acétates | Acétates d’alcanamines de suif hydrogénées (AAASH) | À chaîne longue |
| 61790-60-1b | Amines alkyles de suif, acétates | Acétates d’alcanamines de suif (AAAS) | À chaîne longue |
| 61791-55-7b | Amines, N-suif alkyltriméthylènedi- | N-(Alkyl de suif)propane-1,3‑diamine (ASPDA) | À chaîne longue |
| 68479-04-9b | N-[3‑(Tridécyloxy)propyl] propane-1,3-diamine ramifiée | N-[3-(Tridécyloxy ramifié)propyl]propane-1,3‑diamine (TDPDA) | À chaîne longue |
| 68783-25-5b | Amines, N,N,N’-triméthylsuif N’-alkyltriméthylènedi- | N-(Alkyl de suif)-N,N’,N’-triméthylpropane-1,3-diamine (ASTMPDA) | À chaîne longue |
a Cette substance n’a pas été visée par le paragraphe 73(1) de la LCPE, mais elle fait partie de la présente évaluation, car elle a été jugée prioritaire parce qu’elle suscite des préoccupations pour la santé humaine.
b La substance de ce no CAS est un UVCB (substance de composition inconnue ou variable, produit de réaction complexe ou matière biologique ou, en anglais, unknown or variable composition, complex reaction products, or biological materials).
Les 13 substances du groupe des amines aliphatiques ont été réunies en deux sous‑groupes par la longueur de leur chaîne de carbones : les amines aliphatiques à chaîne(s) courte(s) (chaîne(s) alkyle(s) < 8 atomes de carbone) et les amines aliphatiques à chaîne(s) longue(s) (chaîne(s) alkyle(s) ≥ 8 atomes de carbone). Sur le plan fonctionnel, les amines aliphatiques à chaîne(s) longue(s), et non les amines aliphatiques à chaîne(s) courte(s), sont des composés tensioactifs (surfactants).
D’après les renseignements présentés en réponse à une enquête menée conformément à l’article 71 de la LCPE, pour l’année de déclaration 2011, quatre substances du groupe des amines aliphatiques (amines alkyles de coco, NASAS, AAASH, et AAAS) ont été fabriquées au Canada en quantités variant de 10 000 à 170 000 kg, tandis que l’ASPDA a été fabriquée en quantités variant de 100 000 à 1 000 000 kg. Les huit autres substances du groupe des amines aliphatiques n’ont pas été fabriquées au Canada en quantités supérieures au seuil de déclaration de 100 kg. En 2011, la diméthylamine a été importée au Canada en quantité supérieure à 10 millions de kg. L’éthylènediamine, la 2,2’-iminodi(éthylamine), l’octadécylamine, les amines alkyles de coco et la TDPDA ont été importées au Canada en quantités variant de 100 000 à 1 000 000 kg. En 2011, la benzyldiméthylamine, l’hexadécyldiméthylamine, la NASAS et l’ASPDA ont été importées au Canada en quantités variant de 10 000 à 100 000 kg/an, tandis que 7 900 kg d’ASTMPDA ont été importés. Les autres amines aliphatiques (AAASH et AAAS) n’ont pas été déclarées être importées en quantités supérieures à 100 kg.
Les principales utilisations industrielles des amines aliphatiques à chaîne(s) longue(s) comprennent la production de mousse de polyuréthane, la formulation de produits de nettoyage et de soins personnels, la flottation dans l’extraction minérale et la formulation d’émulsions d’asphalte. Les amines aliphatiques sont également utilisées comme intermédiaires dans la production de divers autres produits chimiques avec différentes applications. Selon les renseignements présentés en réponse à une enquête menée conformément à l’article 71 de la LCPE, les amines aliphatiques sont utilisées dans un vaste éventail de produits de consommation, de produits commerciaux et de produits industriels au Canada. Ces produits de consommation sont utilisés entre autres dans les soins d’entretien automobile, la lutte antiparasitaire, les matériaux de construction, les produits de nettoyage et d’entretien du mobilier, les soins personnels, les peintures et enduits, les secteurs de l’automobile, de l’aviation et des transports, les détergents à lessive et à vaisselle, et les produits pharmaceutiques. Au Canada, l’éthylènediamine, la 2,2’-iminodi(éthylamine), la diméthylamine et la NASAS peuvent être utilisées comme composants dans les matériaux d’emballage d’aliments, tandis que l’octadécylamine et les amines alkyles de coco peuvent être employées dans des additifs indirects utilisés dans les établissements de transformation des aliments. L’éthylènediamine et l’octadécylamine ont été trouvés comme ingrédients dans des produits pharmaceutiques destinés aux humains au Canada. L’hexadécyldiméthylamine a été trouvé comme ingrédient non médicinal dans des produits de santé naturels au Canada, tandis que l’octadécylamine et les amines alkyles de coco ont été déclarées présentes dans des cosmétiques au Canada. L’éthylènediamine, la diméthylamine, l’hexadécyldiméthylamine, les amines alkyles de coco, l’AAASH et l’ASPDA ont été trouvés comme formulants dans des produits antiparasitaires homologués au Canada.
Les risques pour l’environnement des quatre amines aliphatiques à chaîne(s) courte(s) ont été caractérisés séparément à l’aide de la Classification du risque écologique des substances organiques (CRE), une approche fondée sur les risques qui tient compte de plusieurs paramètres liés à la fois au danger et à l’exposition, et de la pondération de plusieurs données probantes. D’après les résultats de l’analyse de CRE, il est peu probable que la benzyldiméthylamine, l’éthylènediamine, la 2,2’‑iminodi(éthylamine) et la diméthylamine causent des effets nocifs pour l’environnement.
Les risques pour l’environnement associés aux neuf amines aliphatiques à chaîne(s) longue(s) ont été évalués à l’aide de l’approche fondée sur les catégories, qui tient compte de toutes les amines aliphatiques à chaîne(s) longue(s) qui appartiennent aux sous-catégories des monoamines et des diamines. L’approche fondée sur les catégories est appropriée, car les amines aliphatiques à chaîne(s) longue(s) sont des surfactants cationiques dont la réactivité et l’écotoxicité sont similaires, qui peuvent être présents en même temps dans l’environnement et avoir collectivement des effets nocifs pour l’environnement.
Sous-catégorie des monoamines :
- monoamines comprenant un ou deux alkyles à chaîne longue (C8‑C22 linéaire(s) ou ramifiée(s), saturée ou insaturée) liés à l’azote, l’autre ou les deux autres substituants étant toute combinaison d’atomes d’hydrogène ou de groupes méthyle;
- éthers de 1-propanamine, de N-méthyl-1-propanamine ou de N,N-diméthyl-1‑propanamine comprenant un alkyle à chaîne longue (C8-C22 linéaire ou ramifiée, saturée ou insaturée).
Sous-catégorie des diamines :
- 1,3-propanediamines et propane-1,3-diamines N,N’-méthylées comprenant un alkyle à chaîne longue (C8-C22 linéaire ou ramifiée, saturée ou insaturée);
- éthers de 1,3-propanediamine et de propane-1,3-diamines N,N’-méthylées comprenant un alkyle à chaîne longue (C8-C22 linéaire ou ramifiée, saturée ou insaturée).
La description de la longueur de la chaîne alkyle dans la définition ci-dessus se rapporte au nombre d’atomes de carbone dans la ou les chaînes alkyles longues (après le dernier groupe fonctionnel dans le cas des diamines et des éthers). Cette définition comprend les amines aliphatiques à chaîne(s) longue(s) seules ou faisant partie d’un sel.
Les amines aliphatiques à chaîne(s) longue(s) peuvent être libérées dans l’environnement canadien par la formulation de ces substances, et par la fabrication et l’utilisation par les consommateurs de produits contenant ces substances, ainsi que par leur utilisation dans différents procédés industriels. Les rejets en milieux aquatiques et environnementaux devraient provenir de sources diffuses et ponctuelles. Les amines aliphatiques à chaîne(s) longue(s) devraient être chargées positivement aux valeurs de pH mesurées dans l’environnement. Lorsque rejetées en milieu aquatique, les amines aliphatiques à chaîne(s) longue(s) sont généralement sorbées par les solides dissous et en suspension. Par conséquent, ces substances pourraient être transportées dans la colonne d’eau ou se déposer dans les sédiments du lit. Les amines aliphatiques à chaîne(s) longue(s) ne persistent pas dans l’eau, les sédiments et le sol. Les amines aliphatiques à chaîne(s) longue(s) dont les chaînes alkyles font moins de C14 ont un potentiel d’accumulation modéré dans les organismes aquatiques et celles dont les chaînes alkyles sont de C14 et plus ont un potentiel d’accumulation élevé.
Selon les données expérimentales sur la toxicité des amines aliphatiques à chaîne(s) longue(s) pour l’environnement, celles-ci, à concentrations faibles, ont le potentiel de causer des effets nocifs pour les organismes aquatiques et les organismes vivant dans les sédiments ou le sol. Des scénarios quantitatifs d’exposition de l’environnement ont été élaborés pour les utilisations les plus pertinentes et les rejets potentiels des amines aliphatiques à chaîne(s) longue(s), comprenant la production et la transformation, la production de mousse de polyuréthane, le rejet à l’égout de dérivés des amines, l’utilisation comme agent de flottation pour l’extraction minérale et l’épandage de biosolides sur les terres. Les scénarios qualitatifs d’exposition de l’environnement ont été élaborés pour les émulsions d’asphalte et l’application et la formulation d’engrais. Les concentrations d’exposition prévues ont été adaptées pour la sorption par la matière organique dans la colonne d’eau. On a mené des analyses du quotient de risque pour comparer les concentrations estimées en milieu aquatique et dans les sols avec les concentrations causant un effet nocif pour les organismes aquatiques et ceux vivant dans le sol. Les scénarios de production, de transformation, de production de mousse de polyuréthane (mélange de polyalcools), de rejet à l’égout de dérivés d’amines, de traitement par flottation dans l’extraction minérale, de formulation d’émulsions d’asphalte et de formulation d’engrais indiquent que les amines aliphatiques à chaîne(s) longue(s) posent un risque pour les organismes aquatiques, tandis que dans le scénario de production de mousse de polyuréthane (mousse de polyuréthane souple), il est peu probable qu’elles en présentent. Dans le scénario d’épandage de biosolides sur des terres, il est peu probable que les amines aliphatiques à chaîne(s) longue(s) posent un risque pour les organismes vivant dans le sol.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les amines aliphatiques à chaîne(s) longue(s) posent un risque de causer des effets nocifs pour l’environnement. Il est proposé de conclure que les amines aliphatiques à chaîne(s) longue(s), notamment les neuf amines aliphatiques à chaîne(s) longue(s) visées par la présente évaluation, satisfont au critère énoncé à l’alinéa 64a) de la LCPE, car elles pénètrent ou peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. Cependant, il est proposé de conclure que les amines aliphatiques à chaîne(s) longue(s), notamment les neuf amines aliphatiques à chaîne(s) longue(s) de cette évaluation, ne satisfont pas au critère énoncé à l’alinéa 64b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l’environnement essentiel pour la vie. Il est également proposé de conclure que les amines aliphatiques à chaîne(s) courte(s) que sont la benzyldiméthylamine, la 2,2’‑iminodi(éthylamine), la diméthylamine et l’éthylènediamine ne satisfont pas aux critères énoncés aux alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
Dans le présent rapport, l’évaluation de la toxicité pour la santé humaine prend en compte séparément chaque amine aliphatique à chaîne(s) courte(s) et longue(s) du groupe des amines aliphatiques en raison des différences dans les effets critiques observés sur la santé. Les ensembles de données sur les effets sur la santé de certaines des amines aliphatiques à chaîne(s) courte(s) étant limités, des méthodes d’extrapolation ont été utilisées. Il a été déterminé que la toxicité générale (p. ex., diminution significative du poids corporel et de la consommation de nourriture, salivation) était l’effet critique associé à l’exposition à la benzyldiméthylamine et à la diméthylamine. En ce qui concerne l’éthylènediamine, des effets critiques sur le foie, les reins, les poumons et les surrénales, ainsi que des effets sur les paramètres chimiques du sang ont été constatés. En ce qui a trait à la 2,2’ iminodi(éthylamine), les effets critiques sont une augmentation de la durée de la gestation et une perte post-implantation. Pour l’ensemble des amines aliphatiques à chaîne(s) courte(s), une comparaison des concentrations auxquelles la population générale pourrait être exposée par les sources, comme les produits disponibles pour les consommateurs, la nourriture et/ou les milieux environnementaux, avec des concentrations causant un effet critique a donné lieu à des marges d’exposition qui sont considérées comme suffisantes pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
Les ensembles de données sur les effets sur la santé de certaines des amines aliphatiques à chaîne(s) longue(s) étant limités, on a utilisé des méthodes d’extrapolation. Les effets sur certains ganglions lymphatiques se sont révélés être les effets critiques de l’hexadécyldiméthylamine et de la NASAS. En ce qui concerne l’octadécylamine et les amines alkyles de coco, ces effets étaient également accompagnés d’une toxicité générale et d’effets sur le tube digestif. Outre les effets mentionnés ci-dessus (p. ex. sur les ganglions lymphatiques, de toxicité générale, sur le tube digestif), on a également constaté des effets inflammatoires liés à la TDPDA.
Les Canadiens pourraient être exposés à l’hexadécyldiméthylamine, à l’octadécylamine, aux amines alkyles de coco et à la NASAS en utilisant des produits pharmaceutiques sans ordonnance, des cosmétiques, des produits de santé naturels, des produits disponibles pour les consommateurs, des matières contenant la substance et par le milieu environnemental, des additifs indirects et des matériaux d’emballage d’aliments. La comparaison entre l’exposition estimative à chaque substance et les concentrations causant un effet critique a donné lieu à des marges d’exposition qui sont jugées suffisantes pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
En ce qui a trait à la TDPDA, la comparaison entre l’exposition potentielle estimative des Canadiens à un produit adhésif à l’époxy en deux composants à usage marin, disponible pour les consommateurs, et la concentration causant un effet critique a donné lieu à une marge d’exposition qui est jugée potentiellement insuffisante pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
Quant aux amines aliphatiques à chaîne(s) longue(s) que sont l’AAASH, l’AAAS, l’ASPDA et l’ASTMPDA, leur potentiel de causer des effets nocifs pour la santé humaine a été évalué par l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances, qui repose sur le danger potentiel de structures chimiques similaires, ainsi que sur les données de génotoxicité des substances chimiques, lorsqu’elles étaient accessibles. Les concentrations d’exposition estimatives produites pour l’AAASH, l’AAAS, l’ASPDA et l’ASTMPDA étaient plus faibles que les valeurs de SPT, indiquant une faible probabilité de risque pour la santé humaine. Par conséquent, l’AAASH, l’AAAS, l’ASPDA et l’ASTMPDA sont jugés peu préoccupantes pour la santé humaine aux concentrations d’exposition actuelles.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la TDPDA satisfait au critère énoncé à l’alinéa 64c) de la LCPE, car elle pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la benzyldiméthylamine, l’éthylènediamine, la 2,2’-iminodi(éthylamine), la diméthylamine, l’hexadécyldiméthylamine, l’octadécylamine, les amines alkyles de coco, la NASAS, l’AAASH, l’AAAS, l’ASPDA et l’ASTMPDA ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que toutes les amines aliphatiques à chaîne(s) longue(s), dont l’hexadécyldiméthylamine, l’octadécylamine, les amines alkyles de coco, la NASAS, l’AAASH, l’AAAS, l’ASPDA, la TDPDA et l’ASTMPDA, satisfont à un ou à plusieurs critères énoncés à l’article 64 de la LCPE, et que les quatre amines aliphatiques à chaîne(s) courte(s), soit la benzyldiméthylamine, l’éthylènediamine, la 2,2’‑Iminodi(éthylamine) et la diméthylamine, ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que les amines aliphatiques à chaîne(s) longue(s), dont la chaîne alkyle est composée d’au moins C14, satisfont au critère de bioaccumulation énoncé dans le Règlement sur la persistance et la bioaccumulation de la LCPE, mais que celles dont la chaîne alkyle est composée de moins de C14 n’y satisfont pas, et que les amines aliphatiques à chaîne(s) longue(s) ne satisfont pas au critère de persistance énoncé dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
1. Introduction
En vertu des articles 68 ou 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE) (Canada 1999), les ministres de l’Environnement et de la Santé ont réalisé l’évaluation préalable de 13 des 19 substances appelées collectivement, dans le Plan de gestion des produits chimiques, le groupe des amines aliphatiques, afin de déterminer si ces 13 substances présentent ou peuvent présenter un risque pour l’environnement ou la santé humaine. Les 19 substances ont été désignées prioritaires pour l’évaluation, car elles satisfaisaient au critère de catégorisation énoncé au paragraphe 73(1) de la LCPE ou ont été jugées prioritaires en raison d’autres préoccupations pour la santé humaine (ECCC, SC [modifié en 2017]).
Deux des 19 substances, la cyclohexanamine (no CASNote de bas de page 5 108-91-8) et le 1,3,5,7‑tétraazatricyclo[3.3.1.1,7]décane, chlorhydrate (1:1) (no CAS 58713-21-6), ont été retirés du groupe des amines aliphatiques et ajoutées au groupe du N‑cyclohexylsulfamate de sodium et de la cyclohexanamine (anciennement appelé groupe des sels d’acide cyclohexylsulfamique) et au groupe des hexanamines, respectivement. Ces substances ne sont pas examinées plus en détail dans le présent rapport d’évaluation préalable.
Quatre autres substances des 19 substances (voir les nos CAS dans le tableau 1-1) ont été prises en compte dans l’Approche de classification du risque écologique des substances organiques (CRE) (ECCC 2016a) ainsi que dans l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016) ou l’approche appliquée dans le cadre de l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC 2018a) et ont été trouvées peu préoccupantes pour la santé humaine et l’environnement. Les conclusions concernant ces quatre substances sont fournies dans le document intitulé Évaluation préalable des substances jugées comme étant peu préoccupantes au moyen de l’approche de Classification du risque écologique des substances organiques et de l’Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (ECCC, SC 2018b) et l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (ECCC, SC 2018a). Par conséquent, ces quatre substances ne sont pas examinées plus en profondeur dans le présent rapport, bien que les substances des nos CAS 112-90-3 et 68955-53-3 soient employées pour extrapolation dans l’évaluation des risques pour l’environnement et examinées sur le plan de leur contribution potentielle aux risques associés aux amines aliphatiques à chaîne(s) longue(s).
| No CAS | Nom dans la Liste intérieure des substances (LIS) | Méthode utilisée pour évaluer la substance | Références |
|---|---|---|---|
| 112-90-3 | (Z)-Octadéc-9-énylamine | CRE/ Évaluation préalable rapide | ECCC, SC 2018a |
| 68955-53-3 | Amines tert-alkyles en C12-14 | CRE/SPT | ECCC, SC 2018b |
| 80939-62-4 | Amines alkyles ramifiées en C11-14, phosphates de monohexyle et de dihexyle | CRE/ Évaluation préalable rapide | ECCC, SC 2018a |
| 90367-27-4 | 2,2’‑({3‑[(2‑Hydroxyéthyl)amino]propyl}imino)diéthanol, dérivés N-alkylés de suif | CRE/ Évaluation préalable rapide | ECCC, SC 2018a |
Les 13 substances évaluées dans la présente évaluation préalable seront ci-après appelées substances du groupe des amines aliphatiques. Ce groupe est composé de deux sous-groupes : les amines aliphatiques à chaîne(s) courte(s) et les amines aliphatiques à chaîne(s) longue(s). Pour les besoins de l’évaluation des substances du groupe des amines aliphatiques, les amines aliphatiques à chaîne(s) courte(s) sont considérées comme celles dont aucun substituant alkyle ne dépasse sept atomes de carbone, tandis que les amines aliphatiques à chaîne(s) longue(s) possèdent au moins une chaîne alkyle d’au moins huit atomes de carbone.
Certaines substances du groupe des amines aliphatiques (c.‑à‑d., l’éthylènediamine et la diméthylamine) ont été évaluées à l’étranger dans le cadre du Programme d’évaluation coopératif des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE), et ont fait l’objet d’un rapport d’évaluation initiale (SIAR) d’un ensemble de données d’évaluation (SIDS) et/ou de profils d’évaluation initiale de l’ensemble de données d’évaluation préalable (SIDS) réalisés par l’OCDE. Ces évaluations ont été soumises à un examen rigoureux (y compris par des pairs) et à des processus d’approbation par les autorités gouvernementales d’autres pays. Santé Canada et Environnement et Changement climatique Canada participent activement à ce processus et jugent que ces évaluations sont fiables. L’Union européenne a également évalué certaines substances du groupe des amines aliphatiques (c.‑à‑d., l’octadécylamine et les amines alkyles de coco). Les données provenant de ces évaluations ont été prises en compte dans la présente évaluation préalable.
Quatre des 13 substances du groupe des amines aliphatiques sont des amines aliphatiques à chaîne(s) courte(s) (benzyldiméthylamine, éthylènediamine, 2,2’‑iminodi(éthylamine) et diméthylamine) dont le potentiel de causer des effets nocifs pour l’environnement a été jugé faible par l’approche de CRE (ECCC 2016a; annexe A). Ces résultats sont pris en compte dans les conclusions formulées conformément à l’article 64 de la LCPE dans la présente évaluation préalable.
Quatre autres substances du groupe des amines aliphatiques (AAASH, AAAS, ASPDA et ASTMPDA) ont été incluses dans le Document sur l’approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances (Santé Canada 2016). Dans l’approche fondée sur le SPT, Santé Canada a utilisé un arbre de décision fondé sur la structure et des données sur la génotoxicité propres à la substance chimique (p. ex., test d’Ames), si disponibles, afin d’attribuer une valeur seuil pour l’exposition humaine relativement à un produit chimique, valeur sous laquelle la probabilité de risque pour la santé humaine est faible (c.‑à‑d., la valeur du SPT). Pour chaque substance examinée par l’approche fondée sur le SPT, l’exposition potentielle de la population générale du Canada a été caractérisée et comparée à la valeur obtenue par l’approche fondée sur le SPT attribuée à la substance. L’AAASH, l’AAAS, l’ASPDA et l’ASTMPDA ont été associées à une exposition plus faible que la valeur de SPT qui leur a été attribuée. Par conséquent, ces substances sont jugées peu préoccupantes pour la santé humaine aux concentrations d’exposition actuelles. Ces résultats sont pris en compte dans les conclusions formulées conformément à l’article 64 de la LCPE dans la présente évaluation préalable.
L’approche fondée sur les catégories a été prise pour l’évaluation des risques pour l’environnement associés aux neuf amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques. Cette approche considère que toutes les amines aliphatiques à chaîne(s) longue(s) visées par la définition formulée à la section 2.1, appartiennent à la catégorie des amines aliphatiques à chaîne(s) longue(s), parce que leur réactivité et leur écotoxicité sont similaires et qu’elles peuvent être présentes en même temps dans l’environnement et causer collectivement des effets nocifs pour l’environnement. Par conséquent, on considère que toutes les amines aliphatiques à chaîne(s) longue(s) contribuent collectivement aux risques pour l’environnement et on les évalue en tant que catégorie plutôt que comme des substances distinctes définies par un no CAS.
En ce qui concerne l’évaluation de la santé humaine, les substances du groupe des amines aliphatiques ont été évaluées séparément par leur no CAS, car on a observé des différences entre les types d’effets critiques causés sur la santé.
La présente ébauche d’évaluation préalable comprend l’examen des données sur les propriétés chimiques, le devenir environnemental, les dangers, les utilisations et les expositions, y compris d’autres renseignements présentés par les intervenants. Les données pertinentes ont été recensées jusqu’en novembre 2019. Des données empiriques tirées d’études clés ainsi que des résultats obtenus au moyen de modèles ont été utilisés pour arriver aux conclusions proposées. Lorsqu’elles étaient pertinentes, les données des évaluations effectuées par d’autres instances ont été utilisées.
La présente ébauche d’évaluation préalable a été préparée par le personnel du Programme d’évaluation des risques de la LCPE à Santé Canada et à Environnement et Changement climatique Canada et comprend des observations provenant du personnel d’autres programmes appartenant à ces ministères. Les parties de la présente évaluation qui portent sur l’environnement et la santé humaine ont fait l’objet d’un examen et/ou de consultations externes. Les commentaires portant sur les parties techniques proviennent de James Armitage (AES Armitage Environmental Services, Inc.) et de Steven Droge (Université d’Amsterdam). Les commentaires portant sur les parties techniques concernant la santé humaine proviennent de Jennifer Flippin, de Theresa Lopez et de Joan Garey, toutes affiliées à Tetra Tech. Les substances évaluées dans les documents sur le SPT ou l’approche de CRE (Santé Canada 2016; ECCC 2016a) ont fait l’objet d’un examen externe et d’une consultation publique de 60 jours. L’ébauche de l’Évaluation préalable rapide des substances pour lesquelles l’exposition de la population générale est limitée (publiée le 10 juin 2017) a aussi été soumise à une consultation publique de 60 jours. Même si les commentaires de l’externe ont été pris en compte, le contenu définitif et la conclusion de l’évaluation préalable demeurent la responsabilité de Santé Canada et d’Environnement et Changement climatique Canada.
La présente ébauche d’évaluation préalable repose sur des données essentielles permettant de déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des données scientifiques ont été examinées, et une approche du poids de la preuve et le principe de prudence ont été adoptésNote de bas de page 6. Le rapport de cette ébauche d’évaluation préalable présente les données essentielles et les considérations sur lesquelles les conclusions proposées s’appuient.
2. Identité des substances
Les amines aliphatiques sont des produits chimiques organiques composés d’un ou plusieurs groupes fonctionnels amines, chacun substitué par une à trois chaînes aliphatiques (alkylesNote de bas de page 7) fixées directement à un atome d’azote (voir l’annexe B pour une autre description chimique des amines aliphatiques). Les chaînes aliphatiques varient en longueur et peuvent être cycliques, ramifiées ou linéaires. Elles peuvent également comprendre un groupe fonctionnel éther, auquel cas elles peuvent aussi s’appeler « éther-amines ».
Aux fins de l’évaluation des substances du groupe des amines aliphatiques, on suppose que les amines aliphatiques à chaîne(s) courte(s) sont celles dont le substituant alkyle ne dépasse pas les sept atomes de carbone, tandis que les amines aliphatiques à chaîne(s) longue(s) possèdent au moins une chaîne alkyle d’au moins huit atomes de carbone. La base de ce regroupement en sous-groupe est que les amines aliphatiques à chaîne(s) longue(s), et non celles à chaîne(s) courte(s), sont des composés tensioactifs (surfactants).
On peut également décrire les amines aliphatiques selon le nombre de groupes fonctionnels amines (p. ex., monoamines, diamines ou triamines) ou le nombre de substituants organiques associés avec le groupe fonctionnel amine (p. ex., amine primaire, secondaire ou tertiaire). Lorsque les substituants sont des groupes alkyles, l’amine peut être de type monoalkylamine, dialkylamine ou trialkylamine (annexe B). Dans la présente évaluation, les dialkylamines comprenant deux chaînes alkyles d’égales longueurs sont décrites comme étant « 2 × Cnombre », où Cnombre est le nombre de carbones que possède la chaîne alkyle (p. ex., un dialkyle comportant deux chaînes alkyles de huit atomes de carbone chacune s’écrit 2 × C8). Il est cependant possible qu’une dialkylamine ait ses deux longues chaînes alkyles de longueurs différentes.
L’identité des substances pour les 13 substances du groupe des amines aliphatiques est présentée dans les tableaux 2-1 et 2-2 (amines aliphatiques à chaîne[s] courte[s] et longue[s], respectivement).
| No CAS | Nom dans la LIS (nom commun) | Structure chimique et formule moléculaire | Poids moléculaire (g/mol) |
|---|---|---|---|
| 103-83-3 | Benzyldiméthylamine (N,N-diméthyl-benzylamine)a |  C9H13N C9H13N | 135 |
| 107-15-3 | Éthylènediamine (éthane-1,2-diamine)a |  C2H8N2 C2H8N2 | 60 |
| 111-40-0 | 2,2’-Iminodi(éthylamine)(3-azapentane-1,5‑diamine)a |  C4H13N3 C4H13N3 | 103 |
| 124-40-3 | Diméthylamine (N-méthyl-méthanamine)a |  C2H7N C2H7N | 45 |
a Substance évaluée dans le présent rapport d’évaluation produit par Santé Canada et antérieurement jugée comme peu préoccupante pour l’environnement par l’approche de CRE (ECCC 2016a).
Sept des amines aliphatiques à chaîne(s) longue(s) (tableau 2-2) sont des UVCB (substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques; unknown or variable composition complex reaction products and biological material). Ces substances sont de sources naturelles ou le résultat de réactions complexes et ne peuvent être caractérisées par leurs constituants chimiques en raison de leur composition trop complexe ou variable. Un UVCB n’est pas un mélange intentionnel de substances distinctes, mais aux fins de la présente évaluation, il est considéré comme une seule substance. Deux structures représentatives possibles pour les longueurs de chaînes d’alkyles les plus répandues des UVCB sont présentées au tableau 2-2. Pour de plus amples renseignements sur l’identité des amines aliphatiques à chaîne(s) longue(s), veuillez consulter le document d’ECCC de 2021.
| No CAS | Nom dans la LIS (nom commun) | Structure chimique et formule moléculairea | Longueur de la chaîne alkyle |
|---|---|---|---|
| 112-69-6 | 1-Hexadécanamine, N,N‑dimethyl-(hexadécyldiméthylamine)c |  C18H39N (270 g/mol) C18H39N (270 g/mol) | C16 |
| 124-30-1 | Octadécylamine(octadécanamine)c |  C18H39N (270 g/mol) C18H39N (270 g/mol) | C18 |
| 61788-46-3 | Amines alkyles de coco(alcanamines de coco)c |   Structures représentatives (UVCB) Structures représentatives (UVCB) | C8-C18 |
| 61789-79-5 | Amines, bis(alkyle de suif hydrogéné)(NASAS)c |   Structures représentatives (UVCB) Structures représentatives (UVCB) | 2 × C14-C18 |
| 61790-59-8 | Amines alkyles de suif hydrogéné, acétates(AAASH)d,e | 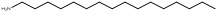  Structures représentatives (UVCB)e Structures représentatives (UVCB)e | C14-C18 |
| 61790-60-1 | Amines alkyles de suif, acétates(AAAS)d,e |  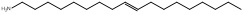 Structures représentatives (UVCB)e Structures représentatives (UVCB)e | C14-C18 |
| 61791-55-7 | Amines, N-suif alkyltriméthylènedi-(ASPDA)d |   Structures représentatives (UVCB) Structures représentatives (UVCB) | C14-C18 |
| 68479-04-9 | N‑[3‑(Tridécyloxy)propyl] propane-1,3-diamine ramifiée(TDPDA)c |   Structures représentatives (UVCB) Structures représentatives (UVCB) | C11-C14 |
| 68783-25-5 | Amines, N,N,N’-triméthylsuif N’-alkyltriméthylènedi- (ASTMPDA)d |   Structures représentatives (UVCB) Structures représentatives (UVCB) | C16-C18 |
a D’autres structures représentatives que celles données pour les UVCB peuvent exister et être utilisées dans certaines modélisations.
b En ce qui concerne les UVCB, la longueur de la ou des chaînes alkyles est indiquée pour exprimer toutes les structures représentatives possibles, tandis que les illustrations représentent les longueurs de chaînes les plus répandues.
c Substance évaluée dans le présent rapport d’évaluation d’Environnement et Changement climatique Canada et de Santé Canada.
d Substance évaluée dans le présent rapport d’évaluation d’Environnement et Changement climatique Canada et de Santé Canada; antérieurement jugée peu préoccupante pour la santé humaine.
e Veuillez noter que les structures chimiques montrées ne comprennent par le contre-ion acétate.
Une approche fondée sur les catégories a été suivie pour l’évaluation des effets de ces substances sur l’environnement, substances comprenant les neuf amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques présentées au tableau 2-2. Cette approche examine toutes les amines aliphatiques à chaîne(s) longue(s) appartenant aux deux sous-catégories ci-dessous de la catégorie des amines aliphatiques à chaîne(s) longue(s). Une définition reposant sur la formule chimique est présentée à l’annexe B.
Sous-catégorie des monoamines :
- monoamines comprenant un ou deux alkyles à chaîne(s) longue(s) (C8-C22 linéaire ou ramifiée, saturée ou insaturée) liés à l’azote, l’autre ou les deux autres substituants étant toute combinaison d’atomes d’hydrogènes ou de groupes méthyles;
- éthers de 1-propanamine, de N-méthyl-1-propanamine ou de N,N-diméthyl-1‑propanamine comprenant un alkyle à chaîne(s) longue(s) (C8-C22 linéaire ou ramifiée, saturée ou insaturée).
Sous-catégorie des diamines :
- 1,3-propanediamines et propane-1,3-diamines N,N’-méthylées comprenant un alkyle à chaîne(s) longue(s) (C8-C22 linéaire ou ramifiée, saturée ou insaturée);
- éthers de 1,3-propanediamine et de propane-1,3-diamines N,N’-méthylées comprenant un alkyle à chaîne(s) longue(s) (C8-C22 linéaire ou ramifiée, saturée ou insaturée).
La description de la longueur de la chaîne alkyle dans la définition ci-dessus se rapporte au nombre d’atomes de carbone dans la ou les longues chaînes alkyles (après le dernier groupe fonctionnel dans le cas des diamines et des éthers). Cette définition comprend les amines aliphatiques à chaîne(s) longue(s) seules ou faisant partie d’un sel. Une liste non exhaustive des substances inscrites sur la Liste intérieure des substances qui satisfont à la définition de cette catégorie est fournie à l’annexe C.
Concernant l’évaluation des effets des substances sur la santé humaine, les substances du groupe des amines aliphatiques ont été évaluées séparément, par leur no CAS, car il existe des différences dans le type d’effets critiques observés pour la santé. Pour certaines des substances, les données sur les effets sur la santé étaient limitées ou inexistantes. Dans ces cas, on a appliqué une approche d’extrapolation où des produits chimiques similaires (par leur structure chimique, leurs propriétés physicochimiques, leur toxicocinétique et leur réactivité) ont été pris en compte et utilisés pour alimenter l’évaluation.
2.1 Sélection des analogues et utilisation des modèles (Q)SAR
Une approche d’extrapolation faisant appel aux données d’analogues et aux résultats de la relation structure-activité (quantitative) (modèles [Q]SAR), s’il y a lieu, a été employée pour alimenter les évaluations des effets des substances sur l’environnement et la santé humaine. Les analogues ont été choisis par leur structure et/ou fonction similaires aux substances de ce groupe (p. ex., d’après leurs propriétés physico‑chimiques, toxicocinétique, réactivité) et par les données empiriques pertinentes pouvant être utilisées pour extrapolation avec les substances dont les données empiriques sont limitées. L’applicabilité des modèles (Q)SAR a été déterminée au cas par cas. Pour de plus amples renseignements sur les données d’extrapolation et les modèles (Q)SAR choisis pour alimenter l’évaluation des effets des substances du groupe des amines aliphatiques sur l’environnement et la santé humaine, voir ci‑dessous.
2.1.1 Analogues utilisés pour l’évaluation des effets des substances sur l’environnement
L’identité des substances analogues utilisées dans l’évaluation des effets des amines aliphatiques à chaîne(s) longue(s) sur l’environnement est présentée au tableau 2-3, tandis que l’identité des amines aliphatiques à chaîne(s) longue(s) qui ont été utilisées pour l’extrapolation est répertoriée dans le document d’ECCC de 2021.
| No CAS | Longueur de la chaîne alkyle | Nom de la substance (groupe chimique) | Devenir | Écotoxicité |
|---|---|---|---|---|
| 1125503-33-4 | C12-14 | Chlorure de N-(2-hydroxyéthyl)-N,N‑diméthylalcanaminium en C12-14 | N | O |
| 71808-53-2 | C12-18 | Chlorures d’(alkyl en C12‑18)bis(hydroxyéthyl)méthylammonium | O | N |
| 57-09-5 | C16 | Bromure d’hexadécyl(triméthyl)ammonium | O | N |
| s.o. | C16-18 | Chlorures d’(alkyl en C16‑18)triméthylammonium | O | N |
| 107-64-2 | C18 | Chlorure de N,N-diméthyl-N‑octadécyloctadécan-1-aminium | O | N |
| 7173-51-5 | 2 × C10 | Chlorure de N-décyl-N,N‑diméthyldécan-1-aminium | O | O |
| 68607-24-9 | C20-22 | Chlorures d’(alkyl en C20‑22)triméthylammonium | N | O |
| s.o. | C22 | Chlorure d’(alkyl en C22)triméthylammonium | O | N |
Abréviations : O, oui; N, non; s.o., sans objet
2.1.2 Analogues utilisés pour l’évaluation des effets des substances sur la santé humaine
Nous avons appliqué une méthode d’extrapolation avec les données d’analogues pour alimenter l’évaluation des effets de l’hexadécyldiméthylamine, de l’octadécylamine et de la TDPDA sur la santé humaine. Pour de plus amples renseignements sur les facteurs examinés dans le choix d’analogues, veuillez consulter l’annexe D. La liste des analogues utilisés pour la présente évaluation de l’hexadécyldiméthylamine, de l’octadécylamine et de la TDPDA est présentée dans les tableaux 2-4 à 2-6, respectivement. Pour de plus amples renseignements sur les propriétés physico‑chimiques des analogues, veuillez consulter l’annexe E. Pour des précisions sur les effets de ces analogues sur la santé, veuillez vous reporter aux sections concernées du présent rapport.
| No CAS | Nom commun | Structure chimique et formule moléculaire |
|---|---|---|
| 112-18-5 | N,N‑Diméthyl-dodécanamine |  C14H31N C14H31N |
| 21542-96-1 | N,N-Diméthyl-docosanamine |  C24H51N C24H51N |
| No CAS | Nom commun | Structure chimique et formule moléculaire |
|---|---|---|
| 112-90-3 | (9Z)-Octadéc-9-énamine |  C18H37N C18H37N |
| 61790-33-8a | Alcanamines de suif |  R = alkyle de suif R = alkyle de suif |
| 68037-92-3a | Alcanamines en C16-22 | Structure représentative :  C19H41N C19H41N |
a Cette substance est un UVCB.
| No CAS | Nom commun | Structure chimique et formule moléculaire |
|---|---|---|
| No CAS inconnu Numéro EC 931‑295‑2a | Acétate de N‑[3‑((alkyl ramifié en C11-14 riche en C13)oxypropyl) propane-1,3‑diamine | Structure représentative :  C19H42N2O·C2H4O2
C19H42N2O·C2H4O2 |
a Cette substance est un UVCB.
3. Propriétés physiques et chimiques
Les données sur les propriétés physiques et chimiques pour chaque substance du groupe des amines aliphatiques ont été obtenues à des températures variant de 20 à 25 °C, sauf si indiqué autrement. Lorsque les données expérimentales étaient insuffisantes ou manquantes pour une propriété, nous avons utilisé les données provenant d’analogues pour l’extrapolation et/ou des modèles (Q)SAR pour produire des valeurs prédites pour la substance.
3.1 Amines aliphatiques à chaîne(s) courte(s)
Un résumé des valeurs pour les propriétés chimiques des amines aliphatiques à chaîne(s) courte(s) du groupe des amines aliphatiques est présenté au tableau 3-1.
| Propriété | Benzyldiméthylamine | Éthylènediamine | 2,2’‑Iminodi(éthylamine) | Diméthylamine |
|---|---|---|---|---|
| État physique | Liquida | Liquid | Liquid | Gas |
| Pression de vapeur (Pa) | 214b | 1,61 × 103b | 30,93b | 2,03 × 106b |
| Solubilité dans l’eau (mg/L) | 12 000c | 1,0 × 106 b | « miscible »b | 1,63×106b,d |
| log Koe | 1,98b | -2,04b | -1,58 e | -0,38b |
| pKa | 8,91c | 7,6-10,7b,f | 4,9-10,1f,g | 10,73b |
| Point de fusion (°C) | -75 | 8,5b | -39f | -92,2b |
| Point d’ébullition (°C) | 181 | 117b | 207f | 6,8b |
Abréviations : Koe, coefficient de partage octanol-eau; pKa, constante de dissociation
a ECHA c2007-2018a, no CAS 103-83-3
b PubChem 2004-2020
c PhysProp c2013
d Température à 40 °C
e ECHA c2007-2018b, no CAS 111-40-0
f pKa1 (la constante de dissociation du premier proton) ou pKa2 (deuxième proton), pas le pKa global
g pKa1 (la constante de dissociation du premier proton), pKa2 (deuxième proton) ou pKa3 (troisième proton), pas le pKa global
3.2 Amines aliphatiques à chaîne(s) longue(s)
Un résumé des valeurs des propriétés physiques et chimiques des amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques est présenté dans les tableaux 3-2 et 3-3. Les données sur la pression de vapeur, le point de fusion et le point d’ébullition sont fournis dans le document d’ECCC (2021).
3.2.1 Constantes de dissociation
Toutes les amines aliphatiques à chaîne(s) longue(s) ont au moins une constante de dissociation (pKa) de 10 ou plus (tableau 3-3), ce qui indique qu’à un pH normal dans l’environnement, elles seront surtout présentes sous forme de protons.
3.2.2 Solubilité dans l’eau et concentration critique pour la formation de micelles
En général, les amines aliphatiques à chaîne(s) longue(s) ont une solubilité dans l’eau modérée. Cependant, la solubilité dans l’eau des amines aliphatiques à chaîne(s) longue(s) varie avec le pH, la solubilité dans l’eau des espèces chargées étant plus élevée que celles des espèces neutres. Les valeurs expérimentales et modélisées de la solubilité dans l’eau des amines aliphatiques à chaîne(s) longue(s) sont présentées au tableau 3-3.
La concentration critique pour la formation de micelles est une propriété utile des surfactants comme les amines aliphatiques à chaîne(s) longue(s). Au-dessus de la concentration critique pour la formation de micelles, la concentration de molécules séparées libres dissoutes en solution est presque constante (Gecol 2006). Par conséquent, on peut considérer la concentration critique pour la formation de micelles comme une limite de la solubilité dans l’eau (ECHA 2017). Les concentrations critiques pour la formation de micelles de quatre amines aliphatiques à chaîne(s) longue(s), dont les chaînes alkyles étaient longues de C8 à C12, variaient de 0,000 3 à 0,4 mol/L (Hoffman et coll. 1942; Hoerr et Ralston 1943; Thorsteinsdóttir et coll. 1995). Ces concentrations sont semblables aux concentrations critiques pour la formation de micelles observées chez les composés d’ammonium quaternaire dont la longueur des chaînes alkyles variait de C8 à C18 (concentrations critiques pour la formation de micelles variant de 0,001 à 0,1 mol/L; Rosen et Kunjappu 2012). D’après les concentrations critiques pour la formation de micelles de Rosen et Kunjappu (2012), les concentrations micellaires critiques calculées des amines aliphatiques à chaîne(s) longue(s) donnent 40 mg/L ou plus.
3.2.3 Coefficients de distribution
Les amines aliphatiques à chaîne(s) longue(s) sont des surfactants et, en tant que telles, leur répartition entre les phases octanol et eau n’est pas bien définie. Elles s’accumulent généralement à l’interface de ces phases et créent une émulsion (Miller et McWilliams 2010, 2012). Par conséquent, ce paramètre ne sera pas pris en compte dans l’évaluation des amines aliphatiques à chaîne(s) longue(s), car il n’y a aucune valeur expérimentale ou modélisée fiable de Koe. Nous avons plutôt utilisé le coefficient de distribution solides-eau (Kd), un coefficient de distribution carbone organique-eau propre aux cations (Kco-cation), un coefficient de distribution pour les interactions ioniques avec les argiles (KCEC) et le coefficient de partage membrane-eau (Kme) pour caractériser la distribution des amines aliphatiques à chaîne(s) longue(s) dans l’environnement.
Pour illustrer les différences entre les coefficients de distribution, les sous-catégories monoamines et diamines ont été divisées selon la longueur de leur(s) chaîne(s) alkyle(s) : C8-C14, C15-C18, C19-C22 et C22 et plus. Aux fins de la description de l’incidence de la longueur de la chaîne alkyle sur le devenir, nous avons supposé que les monoamines ayant deux chaînes alkyles en C8 ou plus longues ont une longueur de chaîne alkyle correspondant à la somme des deux groupes alkyles à chaîne longueNote de bas de page 8 .
3.2.3.1 Coefficients de distribution solides-eau, carbone organique-eau et argiles
Les cations organiques qui sont chargés à un pH normal pour l’environnement, comme les amines aliphatiques, sont sorbés au moyen d’interactions ioniques et non ioniques avec des sites d’échange de cations chargés négativement dans la matière organique et l’argile (Droge et Goss 2013a, 2013b). On a élaboré des modèles fondés sur le volume et la surface de contact de la charge pour estimer les coefficients de partage entre les cations organiques et le carbone organique (Kco-cationique, en L/kg) et entre les cations organiques et l’argile (KCECargile, en L/molCharge) (Droge et Goss 2013a, 2013b, 2013c). Les valeurs estimatives de Kco-cationique et KCEC peuvent servir à estimer le coefficient de distribution, KdNote de bas de page 9, pour le sol ou les sédiments, conformément à la formule suivante (Droge et Goss 2013b) :
Kd = KCEC,argile ∙(CECmilieu – 3,4 ∙ fco) + Kco-cationique ∙ foc
où CECmillieu est la capacité d’échange cationique (CEC) du milieu (p. ex., sol ou sédiments), CECargile est la capacité d’échange cationique de l’argile présente dans le milieu et fco est la fraction de carbone organique dans le milieu.
Les valeurs estimatives de log Kco-cationique, de log KCEC et de log Kd de différentes monoamines C8 à C36 et diamines C8 à C22 déterminées à l’aide de sol naturel normal LUFA2.2 sont présentées au tableau 3-2.
| Nombre d’amines | Catégorie de longueur de chaîne alkyle | log Kco‑cationiquea | log KCECargileb | log Kdc,d |
|---|---|---|---|---|
| Monoamines | C8-C14 | 2,5-4,0 | 2,1–4,1 | 1,1–2,7 |
| Monoamines | C15-C18 | 4,0-4,9 | 3,3–4,8 | 2,6–3,5 |
| Monoamines | C19-C22 | 4,9-5,8 | 4,0–5,4 | 3,4–4,2 |
| Monoamines | C23 to C36d | 5,9-8,4 | 5,0–7,1 | 4,2–6,7 |
| Diamines | C8-C14 | 3,5-5,0 | 2,7–3,9 | 1,9–3,3 |
| Diamines | C15-C18 | 5,0-5,8 | 3,9–5,4 | 3,3–4,2 |
| Diamines | C19-C22e | 5,9-6,7 | 4,6–5,3 | 4,2–4,9 |
a Droge et Goss 2013a
b Droge et Goss 2013 b
c Du sol LUFA2.2 est du loam sableux doté des propriétés physiques suivantes utilisées pour la modélisation : 1,7 % de CO et capacité d’échange cationique de 0,092 molC/kg en poids sec (p.s.) (LUFA Speyer 2018).
d Les longueurs de chaînes alkyles en C24 à C36 représentant les dialkylamines en C12 à C18 comme la somme des deux chaînes alkyles sont prises en compte dans les catégories de longueur de chaînes alkyles. Il existe des incertitudes dans les valeurs calculées de log K, car aucune dialkylamine à chaîne longue n’a été utilisée dans l’élaboration du modèle et seule la structure représentative en C24 (c.-à-d., une dialkylamine avec deux chaînes alkyles en C12) cadrait dans le domaine en ce qui concerne le volume et la surface de contact de la charge du modèle.
e Il existe quelques incertitudes dans les valeurs calculées de log K pour la catégorie des diamines en C19-22, car une seule structure représentative en C19 se trouvait dans le domaine du modèle pour le volume et la superficie de charge.
Les données au tableau 3-2 montrent que les diamines ont une capacité de sorption légèrement plus élevée en général (c.-à-d., des coefficients de partage plus élevés) que les monoamines ayant des longueurs de chaînes alkyles similaires et que la sorption augmente avec l’augmentation de la longueur de la ou des chaînes alkyles. En outre, les valeurs calculées de Kco-cationique indiquent que les dialkylmonoamines (c.-à-d., deux chaînes alkyles longues liées à une amine) ont des valeurs de log Kco-cationique similaires lorsque la somme des deux chaînes alkyles est comparable à celle d’une monoamine à une seule chaîne alkyle similaire (ECCC 2021).
3.2.3.2 Coefficients de partage membrane
Les amines aliphatiques à chaîne(s) longue(s) peuvent se sorber sur des membranes biologiques et avoir une affinité relativement élevée pour la membrane des cellules par rapport aux lipides de réserve, en raison de leurs interactions électrostatiques et hydrophobes favorables dans la double couche de phospholipides de la membrane cellulaire (Droge 2017). Afin d’examiner les interactions ioniques de l’amine aliphatique cationique avec des groupes phosphate anioniques dans la membrane cellulaire (Timmer et Droge 2017), nous avons utilisé le coefficient de partage membrane-eau (Kme). Cela peut se faire expérimentalement à l’aide d’un essai de membrane de phospholipides sur substrat solide (solid supported phospholipid membrane assay ou SSLM) (Timmer et Droge 2017) ou par modélisation à l’aide du modèle de chimie quantique COSMOmic (Bitterman et coll. 2014, 2016; COSMOmic c2015-2018). Les valeurs de log Kme pour les monoamines aliphatiques à chaîne(s) longue(s) en C8 à C12 obtenues expérimentalement à l’aide d’essais SSLM variaient de 2,35 à 5,58 (Timmer et Droge 2017) et augmentaient avec l’augmentation de la longueur de la ou des chaînes alkyles (ECCC 2021), mais diminuaient avec l’augmentation de la méthylation du groupe amine (p. ex., diminution de log Kme selon l’ordre : amine primaire > secondaire > tertiaire, voir l’annexe B).
En ce qui concerne le modèle COSMOmic, le KDMPC-e (coefficient de partage L-α-bis(tétradécanoyl)phospatidylcholine-eau) a été choisi comme substitut pour Kme. Les valeurs de log KDMPC-e ont été déterminées pour plusieurs des amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques (voir le tableau 3-3) (Droge 2017). Timmer et Droge (2017) ont également rapporté des valeurs de log KDMPC‑e pour plusieurs amines aliphatiques primaires, secondaires et tertiaires à chaîne(s) longue(s) en C8 à C18, y compris pour une dialkyle monoamine (ECCC 2021). La valeur de log KDMPC‑e de la dialkylamine 2 × C8 était plus faible que celle d’une amine aliphatique en C16, probablement en raison des effets stériques sur le partage de la dialkylamine dans la membrane (Timmer et Droge 2017).
| Nom chimique (longueur de la chaîne alkyle) | pKaa | État physique | Solubilité dans l’eau expérimentale (mg/L) | Solubilité dans l’eau modélisée (mg/L)a | Log KDMPC-eb |
|---|---|---|---|---|---|
| Hexadécyldiméthylamine (C16) | 10,0 | Liquidec | 18d | 5,1 | 8,22 |
| Octadécylamine (C18) | 10,6 | Solidee | s.o. | 1,6 | 8,56 |
| Cocamine (C8-C18) | 10,6 | Liquidef | (C8-C10) 200-550; (C12-C14) 42-78; (C16-C18) 1,6 -6g | (C8-C18) 1,6–19 000 | 5,35 |
| NASAS (2 × C14-C18) | 10,6 | Solideh | < 0,1 i | s.o. | s.o. |
| AAASH (C14-C18) | 10,6 | Solidej | 130k | (C14-C18) 1,6‑42 | 7,65 |
| AAAS (C14-C18) | 10,6 | Solidel,m | 540n | (C14-C18) 42‑130 | 7,43 |
| ASPDA (C14-C18) | 8,7, 10,7d | Pâtel | s.o. | (C18) 850‑9 700 | 6,44‑7,85 |
| TDPDA (C11-C14) | 8,4, 10,3d | Liquiden | 1 300o | (C9-C11) 6900‑19 000 | 3,94‑6,30 |
| ASTMPDA (C16-C18) | 7,8, 9,7d | Liquidem | s.o. | (C14-C18) 60‑850 | 7,64‑8,34 |
Abréviations : pKa, constante de dissociation; s.o., sans objet
a ACD/Percepta c1997-2012 (modélisation réalisée avec des structures représentatives à pH 8). Les valeurs de pKa dans le tableau proviennent d’ACD/Percepta et sont la moyenne de deux valeurs.
b Déterminé à l’aide de COSMOmic c2015-2018, comme indiqué dans Droge 2017.
c SDS 2014a
d ECHA c2007-2018d, no CAS 124-30-1 (test de solubilité dans l’eau réalisé à pH 7,1)
e SDS 2019
f CE 2008
g ECHA c2007-2018e, no CAS 111-86-4 (réalisé à pH 7-11); Christie et Crisp 1967 (pH inconnu)
h ECHA c2007-2018e, no CAS 111-86-4
i ECHA c2007-2018c, no CAS 112-69-6 (pH inconnu)
j SDS 2017a
k SDS 2014b (pH inconnu)
l Akzo Nobel 2010
m SDS 2014c
n ECHA c2007-2018f, no CAS 1273322-47-6 (le pH auquel la solubilité dans l’eau a été évaluée n’est pas connu)
o ECHA c2007-2018g, EC 931-295-2 (réalisé à pH 7)
4. Sources et utilisations
Toutes les substances du groupe des amines aliphatiques ont été visées par les enquêtes réalisées conformément à l’avis émis en vertu de l’article 71 de la LCPE (Canada 2012). Les tableaux 4-1 et 4-2 présentent un résumé des données rapportées sur les quantités totales fabriquées et importées d’amines aliphatiques à chaîne(s) courte(s) et à chaîne(s) longue(s) du groupe des amines aliphatiques, respectivement. Les données sur les neuf amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques ont servi à décrire les sources et les utilisations de ces amines aliphatiques à chaîne(s) longue(s) en particulier. Ces données, ensemble avec les données d’autres sources, ont également été utilisées pour décrire les utilisations de la catégorie des amines aliphatiques à chaîne(s) longue(s) en général. Les quantités fabriquées d’amines aliphatiques variaient d’une valeur inférieure au seuil de déclaration de 100 kg/an à 1 000 000 kg/an. Les quantités importées variaient d’une valeur inférieure au seuil de déclaration de 100 kg/an à 1 000 000 kg/an. Selon d’autres données de suivi sur les volumes d’importation de diméthylamine, les volumes d’importation étaient supérieurs à 10 000 000 kg en 2011 (communication personnelle, collecte de données volontaire sur les amines aliphatiques, Bureau de l’évaluation des risques pour les substances existantes, Santé Canada 2018; sans référence).
| Nom chimique | Qté totale fabriquée (kg)a | Qté totale importée (kg)a |
|---|---|---|
| Benzyldiméthylamine | ND | 77 317 |
| Éthylènediamine | ND | 100 000‑1 000 000 |
| 2,2’-Iminodi(éthylamine) | ND | 100 000‑1 000 000 |
| Diméthylamine | ND | [31 305]1,9 × 107b |
Abréviations : ND, quantité non déclarée
a Les valeurs représentent les quantités déclarées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour connaître les inclusions et les exclusions (annexes 2 et 3). Les valeurs exactes sont fournies lorsqu’elles ne sont pas confidentielles. Les quantités confidentielles sont présentées par une fourchette de valeurs.
b La valeur mise à jour remplaçant la quantité importée originale qui a été déclarée dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (collecte facultative de données sur les amines aliphatiques, Santé Canada 2018; sans référence).
| Nom chimique | Qté totale fabriquée (kg)a | Qté totale importée (kg)a |
|---|---|---|
| Hexadécyldiméthylamine | ND | 58 884 |
| Octadécylamine | ND | [100 000‑1 000 000] 1 000‑10 000b |
| Amines alkyles de coco | 38 000 | 125 329 |
| NASAS | 170 000 | 55‑000 |
| AAASH | 120 000 | ND |
| AAAS | 29 000 | ND |
| ASPDA | 100 000‑1 000 000 | 10 000‑100 000 |
| TDPDA | ND | 100 000‑1 000 000 |
| ASTMPDA | ND | 7 900 |
Abréviations : ND, quantité non déclarée
a Les valeurs représentent les quantités déclarées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour connaître les inclusions et les exclusions (annexes 2 et 3). Les valeurs exactes sont fournies lorsqu’elles ne sont pas confidentielles. Les quantités confidentielles sont présentées par une fourchette de valeurs.
b La valeur mise à jour remplaçant la quantité importée originale qui a été déclarée dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (collecte facultative de données sur les amines aliphatiques, Santé Canada 2018; sans référence).
Le tableau 4-3 présente un résumé des principales utilisations des amines aliphatiques à chaîne(s) courte(s) et longue(s), établi d’après les renseignements présentés dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013).
| Principales utilisationsa | Amines aliphatiques à chaîne(s) courte(s) | Amines aliphatiques à chaîne(s) longue(s) |
|---|---|---|
| Adhésifs et enduits | 2,2’‑Iminodi (éthylamine), benzyldiméthylamine | AAASH, AAAS, ASPDA |
| Peintures et enduits | 2,2’‑iminodi (éthylamine), benzyldiméthylamine, éthylènediamine | NASAS, amines alkyles de coco, AAASH, ASPDA |
| Traitement de l’eau | Diméthylamine, éthylènediamine | NASAS, amines alkyles de coco, AAASH, ASPDA |
| Produits de nettoyage et d’entretien du mobilier | s.o. | Amines alkyles de coco, octadécylamine, ASPDA |
| Détergents à lessive et à vaisselle | Éthylènediamine | Hexadécyldiméthylamine |
| Produits d’entretien automobile | s.o. | Amines alkyles de coco, hexadécyldiméthylamine |
| Soins personnels | s.o. | hexadécyldiméthylamine |
| Lutte antiparasitaire | Diméthylamine,éthylènediamine | s.o. |
| Produits de soins pour les tissus, textiles et cuirs | s.o. | NASAS, amines alkyles de coco, hexadécyldiméthylamine,AAASH, ASPDA |
| Lubrifiants et graisses | Éthylènediamine | NASAS, amines alkyles de coco, AAASH, octadécylamine, ASPDA |
| Matériaux de construction | Benzyldiméthylamine | Amines alkyles de coco, hexadécyldiméthylamine, ASPDA, ASTMPDA |
| Produits agricoles, mélanges ou articles manufacturés (autres que les pesticides) | s.o. | Amines alkyles de coco, octadécylamine |
| Extraction de pétrole et de gaz naturel | 2,2’‑iminodi (éthylamine), benzyldiméthylamine | Amines alkyles de coco, ASPDA |
| Combustibles et produits connexes, mélanges ou articles manufacturés | Éthylènediamine | Hexadécyldiméthylamine |
| Matières plastiques et en caoutchouc | s.o. | Hexadécyldiméthylamine |
| Mousse utilisée dans les sièges et les produits de literie | s.o. | Hexadécyldiméthylamine |
| Meubles et articles d’ameublement | s.o. | Hexadécyldiméthylamine |
| Matériaux métalliques | s.o. | TDPDA |
| Produits pharmaceutiques | Éthylènediamine | s.o. |
| Secteur de l’automobile, de l’aviation et des transports | Éthylènediamine | s.o. |
Abréviations : s.o., sans objet (aucune utilisation n’a été déclarée)
a Utilisations non confidentielles, d’après les codes de produits à usage domestique ou commercial, déclarées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Veuillez consulter l’enquête pour connaître les inclusions et les exclusions (annexes 2 et 3).
Le tableau 4-4 présente d’autres données sur l’utilisation des amines aliphatiques à chaîne(s) courte(s) et à chaîne(s) longue(s) au Canada, d’après d’autres sources.
| Utilisation | Amines aliphatiques à chaîne(s) courte(s) | Amines aliphatiques à chaîne(s) longue(s) |
|---|---|---|
| Matériaux d’emballage d’alimentsa | 2,2’-Iminodi(éthylamine), diméthylamine, éthylènediamine | NASAS |
| Additifs indirectsa,b | s.o. | Amines alkyles de coco, octadécylamine |
| Ingrédients médicinaux ou non médicinaux dans des désinfectants, ou des produits pharmaceutiques à usage humain ou vétérinairec | Éthylènediamine | Octadécylamine |
| Ingrédients médicinaux ou non médicinaux dans des produits de santé naturels homologuésd,e | s.o. | Hexadécyldiméthylamine |
| Présents dans des cosmétiques, d’après les déclarations présentées conformément au Règlement sur les cosmétiquesf | s.o. | Amines alkyles de coco, octadécylamine |
| Formulants dans des produits antiparasitaires homologuésg | Diméthylamine, éthylènediamine | Amines alkyles de coco, hexadécyldiméthylamine, AAASH, ASPDA |
Abréviations : s.o., sans objet (aucune utilisation n’a été déclarée pour ces substances)
a Communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 10 janvier 2017; sans référence.
b Même s’ils ne sont pas définis dans la Loi sur les aliments et drogues, les additifs indirects peuvent être considérés, aux fins administratives, comme ces substances qui sont utilisées dans les usines de transformation des aliments et qui pourraient devenir des résidus accidentels dans les aliments (p. ex., nettoyants, désinfectants) (Santé Canada 2010).
c Base de données sur les produits pharmaceutiques (BDPP) [modifiée en2017]; communication personnelle, courriel de la Direction des produits thérapeutiques de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 16 décembre 2016; sans référence.
d BDIPSN [modifié en 2019]
e BDPSNH [modifié en 2016]
f Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés du 14 décembre 2016 et du 14 décembre 2017; sans référence.
g Communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, datés du 21 décembre 2016 et du 27 janvier 2020; sans référence.
4.1 Amines aliphatiques à chaîne(s) courte(s)
Les principales utilisations des amines aliphatiques à chaîne(s) courte(s) sont énumérées dans les tableaux 4-3 et 4-4. En outre, la benzyldiméthylamine est utilisée dans des applications de mousse de polyuréthane (MPU) au Canada (Environnement Canada 2013). Plus particulièrement, il a été déclaré que la benzyldiméthylamine est utilisée comme catalyseur dans les systèmes faisant appel à la MPU (Havermans et Houtzager 2014). La benzyldiméthylamine a été détectée dans l’air intérieur de voitures, dont les sièges à base de mousse pourraient être une source (Rampfl et coll. 2008). Un produit à l’époxy en deux composants à usage marin vendu au Canada s’est révélé contenir de la benzyldiméthylamine (SDS 2014d). La benzyldiméthylamine a été trouvée, qualitativement, dans le thé noir naturel (Vitzthum et coll. 1975).
Dams les utilisations décrites au tableau 4-3, les fonctions de l’éthylènediamine comme inhibiteur de corrosion, agent de placage, agent de traitement de surface, additif et agent de blanchiment (Environnement Canada 2013). L’éthylènediamine est également utilisée comme intermédiaire réactionnel (PubChem 2004-2020). L’éthylènediamine est décrite comme un ingrédient interdit dans la Liste critique des ingrédients des cosmétiques de Santé Canada (Santé Canada [modifiée en 2018]). Au Canada, l’éthylènediamine est utilisée comme ingrédient dans un promédicament sur ordonnance, relaxant les muscles lisses respiratoires, administré par intraveineuse, l’aminophylline (communication personnelle, courriel de la Direction des produits thérapeutiques, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 16 décembre 2016; sans référence). L’éthylènediamine est un formulant de produits antiparasitaires homologués au Canada. L’Agence canadienne d’inspection des aliments (ACIA) surveille les résidus de pesticide et les métabolites dans les aliments, y compris l’éthylènediamine (ACIA 2019).
Outre les utilisations décrites au tableau 4-3, la 2,2’-iminodi(éthylamine) a été trouvée dans une colle à l’époxy en deux composants et un apprêt à l’époxy en deux composants à usage marin disponibles pour les consommateurs au Canada (SDS 2015; SDS 2018a).
La diméthylamine est présente naturellement dans un grand nombre d’aliments, comme les fruits, légumes, viandes, poissons et produits laitiers (VCF 2018; Pfundstein et coll. 1991) et serait ubiquiste dans l’eau et l’urine humaine. En outre, la diméthylamine est naturellement présente dans la fumée de cigarette et les déchets d’origine animale (PubChem 2004-2020). La présence de diméthylamine dans l’urine découle de la formation endogène de la substance par voies biochimiques ou de sources exogènes comme l’alimentation (Zhang et coll. 1995).
La diméthylamine est un ingrédient interdit inscrit sur la Liste critique des ingrédients des cosmétiques de Santé Canada (Santé Canada [modifié en 2018]).
4.2 Amines aliphatiques à chaîne(s) longue(s)
Les données sur les utilisations des amines aliphatiques à chaîne(s) longue(s) au Canada ont été obtenues en partie au moyen d’une enquête réalisée conformément à un avis émis en vertu de l’article 71 de la LCPE (Canada 2012) et d’un questionnaire soumis à certaines entreprises et associations industrielles (ECCC 2016b). L’évaluation des effets des amines aliphatiques à chaîne(s) longue(s) sur l’environnement prend également en compte les données sur les utilisations provenant d’autres sources, dont les utilisations rapportées d’autres administrations et dans des publications.
Une grande partie des amines aliphatiques à chaîne(s) longue(s) servent d’intermédiaires dans la formation d’autres substances chimiques, comme les éthoxylates d’amines aliphatiques ou les amides (BUA 1994; CE 2008), qui ont un vaste éventail d’utilisations industrielles et commerciales (p. ex., agents antistatiques pour la formulation de matières plastiques, agents auxiliaires dans l’industrie du textile, additifs dans les détergents à lessive et à vaisselle). Les produits chimiques issus des amines aliphatiques à chaîne(s) longue(s) contiennent des résidus d’amines aliphatiques à chaîne(s) longue(s) qui n’ont pas réagi, qui peuvent être libérés dans l’environnement lors de l’utilisation de produits qui en contiennent. Par exemple, les éthoxylates d’amines aliphatiques et les diamines produites à partir de monoamines primaires peuvent contenir environ 0,2 % à 2,2 % et environ 7,5 %, respectivement, de monoamines primaires n’ayant pas réagi (CE 2008). Des amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques, les amines alkyles de coco et la NASAS sont utilisées comme intermédiaires au Canada. En Europe, l’octadécylamine, les amines alkyles de coco, l’alkylamine de suif, l’alkylamine de suif hydrogénée (no CAS 61790-33-8) et la (9Z)-9-octadécén-1-amine (no CAS 112-90-3) sont utilisées comme intermédiaires (CE 2008). En outre, Roose et coll. (2015) ont trouvé des amines secondaires qui sont principalement utilisées comme intermédiaires.
L’hexadécyldiméthylamine est importée au Canada en tant que régulateur de procédés ou d’aide à la production de mousse de polyuréthane, surtout dans la production de sièges et de literies en mousse (p. ex., sièges d’automobiles) (ECCC 2016b). On ne sait pas si d’autres amines aliphatiques à chaîne(s) longue(s) sont utilisées dans des applications similaires.
Plusieurs amines aliphatiques à chaîne(s) longue(s) sont utilisées comme agents de flottation pour l’extraction de minéraux (p. ex., minerai de fer, potasse, feldspath, oxyde de zinc, kaolin, etc.) (Akzo Nobel 2010; Nouryon 2019). Plus particulièrement, la TDPDA est utilisée comme agent de flottation au Canada (SDS 2017b; Evonik 2019). Selon Akzo Nobel (2010) et Nouryon (2019; anciennement Akzo Nobel Specialty Chemicals), les amines alkyles de coco et l’AAASH du groupe des amines aliphatiques, ainsi que les alkylamines de suif hydrogénées (no CAS 61788-45-2), l’alkylamine de suif (no CAS 61790-33-8), la (9Z)-9-octadécén-1-amine (no CAS 112-90-3), la N ((Z) octadéc-9-ènyl)propane-1,3-diamine (no CAS 7173-62-8) et les distillats de N‑((Z)-octadéc-9-ènyl)propane-1,3-diamine (no CAS 61790-59-8) sont également employés comme agents de flottation. Deux propanediamine-éthers semblables à la TDPDA, appelés N-(3-(tridécyloxy)propyl)propane-1,3-diamine et acétate de N‑(3‑(tridécyloxy)propyl)propane-1,3-diamine, sont utilisées comme agents de flottation (Olsvik et coll. 2015). En Europe, les amines alkyles de coco, l’alkylamine de suif, l’alkylamine de suif hydrogénée (no CAS 61788-45-2) et l’octadécènamine sont utilisées dans la flottation des minéraux (CE 2008).
Les diamines et les éther-amines primaires à longue(s) chaîne(s) servent à émulsifier l’asphalte. Les amines aliphatiques à longue(s) chaîne(s) sont utilisées à faibles concentrations (0,2 % à 2,0 % en poids de l’émulsion) pour les émulsions d’asphalte cationiques à prise lente, modérée et rapide (Roose et coll. 2015).
Certaines amines primaires à chaîne(s) longue(s) sont utilisées comme agents anti-agtglémérants dans les engrais, tandis que d’autres le sont dans des produits minéraux (Roose et coll. 2015). Au Canada, l’octadécylamine est employée comme agent anti-agglomérant (ECCC 2016b), à l’instar des amines alkyles de coco, de l’alkylamine de suif et de l’alkylamine de suif hydrogénée (Akzo Nobel 2010; Nouryon 2019; CE 2008; Strathdee et coll. 1982).
En Amérique du Nord, monoamines et diamines aliphatiques à chaîne(s) longue(s) sont disponibles comme inhibiteurs de corrosion, dont l’octadécylamine et les amines alkyles de coco du groupe des amines aliphatiques. D’autres amines aliphatiques ayant cette utilisation sont la N,N-diméthyl-1-octadécanamine (no CAS 124-28-7), l’(alkyl de suif hydrogéné)-N-méthylméthanamine (no CAS 61788-95-2), la N-(alkyl de coco)alkylamine de coco (no CAS 61789-76-2), et la N-((Z)-octadéc-9-ènyl)propane-1,3-diamine (no CAS 7173‑62‑8) (Nouryon c2019).
Au Canada, diverses utilisations domestiques ont été trouvées pour les amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques. L’hexadécyldiméthylamine (aussi appelée N,N-diméthyl-1-hexadécanamine) figure dans la Base de données d’ingrédients de produits de santé naturels (BDIPSN [modifié en 2019])) comme ingrédient non médicinal avec une fonction d’agent antistatique, et dans la Base de données sur les produits de santé naturels homologués (BDPSNH [modifié en 2018]) comme ingrédient non médicinal dans deux nettoyants faciaux topiques antiacnéiques à rincer. L’octadécylamine (appellation INCI : stéaramine) et les amines alkyles de coco auraient des utilisations dans les cosmétiques, d’après les déclarations présentées à Santé Canada conformément au Règlement sur les cosmétiques (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 14 décembre 2016; sans référence). L’octadécylamine serait un additif indirect, et serait utilisé comme additif pour l’eau de chaudière. Les amines alkyles de coco peuvent être utilisées comme additif indirect dans les nettoyants et les lubrifiants utilisés dans les usines de transformation des aliments. La NASAS est utilisée comme composant dans les stabilisants pour le polypropylène et le polyéthylène haute densité destiné à des applications d’emballage des aliments (communication personnelle, courriel de la Direction des aliments, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, daté du 10 janvier 2017; sans référence). L’hexadécyldiméthylamine, les amines alkyles de coco, l’AAASH et l’ASPDA ont été trouvés comme formulants au Canada (communication personnelle, courriels de l’Agence de réglementation de la lutte antiparasitaire, Santé Canada, au Bureau de l’évaluation des risques pour les substances existantes, Santé Canada, datés du 21 décembre 2016 et du 27 janvier 2020; sans référence). De la TDPDA a été déclarée dans le durcisseur d’un adhésif à l’époxy en deux composants à usage marin disponible pour la population générale au Canada (communication personnelle, collecte de données volontaire sur les amines aliphatiques, Bureau de l’évaluation des risques pour les substances existantes, Santé Canada 2018; sans référence).
5. rejets dans l’environnement
En raison de la diversité des utilisations des amines aliphatiques à chaîne(s) courte(s) et à chaîne(s) longue(s), il devrait y avoir des rejets de sources ponctuelles et non ponctuelles dans l’environnement canadien. Les rejets de sources ponctuelles (p. ex., d’installations industrielles) peuvent se produire lors des étapes de fabrication, de formulation ou d’utilisation industrielle. Les amines aliphatiques à chaîne(s) courte(s) devraient être rejetées dans l’environnement par les eaux usées et dans l’air par les industries lorsqu’utilisées comme intermédiaires et agents technologiques. En ce qui concerne la plupart des amines aliphatiques à chaîne(s) longue(s), les rejets dans l’environnement devraient s’effectuer principalement dans l’eau par les usines de traitement des eaux usées (UTEU)Note de bas de page 10, avec des rejets dans l’eau directement des sites industriels. Les amines aliphatiques à chaîne(s) longue(s) peuvent être rejetées dans le sol par l’épandage de biosolides provenant d’UTEU ou par l’utilisation d’amines aliphatiques primaires à chaîne(s) longue(s) dans les préparations d’engrais.
6. Devenir et comportement dans l’environnement
D’après la CRE, les amines aliphatiques à chaîne(s) courte(s) du groupe des amines aliphatiques ont un potentiel faible de causer des effets nocifs pour l’environnement en raison de sa faible persistance globale, des volumes d’utilisation faibles déclarés et du potentiel faible de transport atmosphérique à grande distance (ECCC 2016b). Par conséquent, la présente section porte sur les amines aliphatiques à chaîne(s) longue(s) en tant que catégorie.
6.1 Répartition dans l’environnement
Comme les modèles de fugacité actuels ne sont généralement pas appropriés pour les substances ionisantes et tensioactives (Mackay et coll. 2009), ils n’ont pas été utilisés pour décrire la répartition des amines aliphatiques à chaîne(s) longue(s) entre les différents milieux environnementaux (air, eau, sol, sédiments et biotes). Nous avons plutôt décrit le devenir et le comportement des amines aliphatiques à chaîne(s) longue(s) par leurs propriétés physiques et chimiques, notamment par leur coefficient de partage.
Les amines aliphatiques à chaîne(s) longue(s) ne devraient pas être rejetées dans l’air étant donné leurs utilisations prévues et leurs propriétés physico-chimiques. La forme neutre de ces substances a une pression de vapeur très faible à modérée. Sous forme de cations, forme prévue à pH normal dans l’environnement (pH 6 à 9), les amines aliphatiques à chaîne(s) longue(s) ne devraient pas se volatiliser (Trapp et coll. 2010). Par conséquent, la constante d’Henry des amines aliphatiques à chaîne(s) longue(s) (ECCC 2021) n’est pas jugée utile et le potentiel de transport atmosphérique à longue distance devrait être très faible. Cette affirmation est davantage étayée par les demi‑vies estimatives pour la réaction avec les radicaux OH et l’ozone, ce qui indique que même si ces substances se répartissent dans l’air, elles n’y demeureraient pas longtemps (voir la section 6.2.4).
Étant donné les utilisations déclarées des amines aliphatiques à chaîne(s) longue(s), on s’attend à ce que ces substances puissent être rejetées à l’eau de surface, généralement après traitement des eaux usées. D’après des études réalisées avec des composés d’ammonium quaternaire (CAQ), on s’attend à ce que les amines aliphatiques à chaîne(s) longue(s) soient éliminées soit par sorption aux boues d’épuration soit par dégradation lors du traitement des eaux usées, la sorption rivalisant avec la biodégradation (Tezel et coll. 2006). Des études sur la sorption des CAQ aux boues d’épuration indiquent que la sorption est rapide (en quelques heures à peine) et s’accélère avec l’augmentation de la longueur de la chaîne alkyle (Ismail et coll. 2010). Cependant, les amines aliphatiques sorbées par les matières organiques des boues qui sont rejetées dans les eaux réceptrices peuvent également se désorber, selon l’ampleur de la désorption prévue diminuer avec l’augmentation de la longueur de la chaîne alkyle (Ismail et coll. 2010). Ismail et coll. (2010) ont constaté que le chlorure de N,N,N‑triméthyl-1-dodécanaminium, un CAQ en C12 semblable à la 1-dodécanamine, n’était sorbé qu’à 13 % aux boues, tandis que le chlorure de N,N,N-triméthyl-1‑hexadécanaminium, un CAQ en C16 semblable au 1-hexadécanamine, était sorbée à 88 %. Cependant, 40 % du CAQ en C12 se sont désorbés des boues en 10 jours, par comparaison à seulement 5 % du CAQ en C16.
Une fois que les amines aliphatiques à chaîne(s) longue(s) sont libérées dans les eaux de surface, leurs valeurs élevées de pKa (10,0 à 10,7; voir le tableau 3-3) indiquent que la forme cationique sera l’espèce la plus abondante dans l’eau. Lorsque de faibles concentrations sont rejetées dans l’eau, les amines aliphatiques à chaîne(s) longue(s) devraient se dissoudre dans l’eau, étant donné leurs valeurs de solubilité faibles à modérées dans l’eau et leurs concentrations micellaires critiques estimées à 40 mg/L ou plus. Dans l’eau, ces amines aliphatiques devraient également être sorbées par divers sorbants, comme les solides en suspension, le carbone organique dissous et particulaire, et les sédiments, ce qui réduira leur biodisponibilité. La sorption s’effectue par des interactions ioniques et non ioniques aux sites d’échanges de cations sur les sorbants et non pas dans les régions hydrophobes des matières organiques. Bien que la densité molaire des sites d’échange des ions détermine la capacité de sorption maximale des sorbants, les propriétés hydrophobes du surfactant (p. ex., longueur de la chaîne alkyle) déterminent en grande partie les affinités de sorption globales pour ces sites (Droge et Goss 2013a). L’affinité de sorption par les matières organiques dans l’eau est décrite par KCO-cationique, comme mentionné dans la section 3.2.5. Puisque la longueur des chaînes alkyles influe sur l’affinité de sorption et, par conséquent, sur le comportement dans l’environnement, les amines aliphatiques à chaîne(s) longue(s) ont été divisées en catégories de chaînes alkyles plus petites permettant de décrire leur comportement dans l’environnement. Ces catégories comprennent : les chaînes alkyles en C8-C14 (comprenant les amines aliphatiques à chaîne(s) longue(s) plus courtes et les composants les plus abondants des amines alkyles de coco); en C15-C18 (comprenant les composants les plus abondants des amines dérivées du suif et du soja); en C19-C22 (comprenant les composants les plus abondants des amines dérivées de colza); et en C24 et plus. Les amines aliphatiques comprenant deux chaînes alkyles longues ont été placées dans la catégorie correspondant à la somme des nombres d’atomes de carbone de leurs deux longues chaînes alkyles (p. ex., une dialkylamine 2 × C8 a été placée parmi les monoamines en C16), car leurs propriétés de sorption ont été plus semblables aux autres de la catégorie de chaîne alkyle de même longueur. À l’aide de KCO-cationique et du contenu médian de carbone organique total (COT) dans les voies navigables canadiennes, la fraction des amines aliphatiques à chaîne(s) longue(s) dissoutes libres a été déterminée pour 43 monoamines représentatives et 26 diamines représentatives (tableau 6-1). La fraction dissoute libre (fdissoute) est calculée comme ceci :
où KCO-cation est le coefficient de partage carbone organique estimatif et COT est la concentration de carbone organique total en kg/L. Le calcul de la concentration de COT (1,305 × 10-5 kg/L = 13,05 mg/L) est décrit dans le document d’ECCC de 2021.
Une seule valeur du pourcentage d’amines aliphatiques à chaîne(s) longue(s) dissoutes libres de chaque catégorie de longueur de la chaîne alkyle a été établie comme la médiane des valeurs de ces amines aliphatiques dissoutes libres la plus faible et la plus élevée calculées pour une fourchette de structures représentatives. Le pourcentage de ces amines aliphatiques dissoutes libres dans l’eau ayant une valeur de COT de 13,05 mg/L est présenté dans le tableau 6-1. Pour de plus amples renseignements, veuillez consulter le document d’ECCC de 2021.
| Nombre d’amines | Catégorie de longueur de chaîne d’alkyle | Fourchette du % des amines dissoutes (médiane)a |
|---|---|---|
| Monoamines | C8-C14 | 87,8-99,6 (93,7) |
| Monoamines | C15-C18 | 50,1-87,6 (68,8) |
| Monoamines | C19-C22 | 11,9-49,3 (30,6) |
| Monoamines | C24 (2xC12) | 9,5 |
| Monoamines | C26 (2xC13) | 3,7 |
| Monoamines | C28 (2xC14) and C36 (2xC18) | 1,4 ou moins |
| Diamines | C8-C14 | 45,5-95,7 (70,6) |
| Diamines | C15-C18 | 10,2-41 (25,6) |
| Diamines | C19-C22 | 1,5-8,7 (5,1) |
Abréviations : COT, carbone organique total.
a La médiane est la moyenne des valeurs la plus faible et la plus élevée des structures représentatives de la fourchette.
Bien que la fraction des amines aliphatiques dissoutes libres puisse être assez élevée parmi les chaînes alkyles plus courtes, elle diminue à mesure que la chaîne alkyle s’allonge, de sorte que les amines ayant les chaînes alkyles les plus longues sont principalement sorbées. Pour une longueur donnée de chaîne alkyl, les diamines sont généralement sorbées davantage que les monoamines. Le devenir des amines aliphatiques à chaîne(s) longue(s) dans les sédiments et les sols sera déterminé par leurs caractéristiques de sorption. Le coefficient de partage solides-eau (Kd) modélisé dans le sol comprend à la fois la sorption dans l’argile (KCEC) et la matière organique (KCO-cationique) et, par conséquent, est lié à la capacité d’échange cationique (p. ex., le type et la quantité d’argile), la fraction de carbone organique, la salinité du système et certaines amines aliphatiques. En général, les diamines ont un Kd légèrement supérieur aux monoamines, et leur sorption augmente avec l’allongement de la chaîne d’alkyle (tableau 3-2, section 3.2.3). Les amines aliphatiques à chaîne(s) longue(s) les plus courtes devraient être plus mobiles que celles à chaîne(s) longue(s) très longues, qui devraient être immobiles. Les amines aliphatiques à chaîne(s) longue(s) devraient également être beaucoup moins sorbées par le sol argileux riche en carbone organique et les sédiments.
Les amines aliphatiques à chaîne(s) longue(s) devraient sortir de la colonne d’eau et se déposer sur les sédiments lorsqu’elles sont sorbées par le carbone organique ou l’argile dans la colonne d’eau, et être sorbées par les sédiments de fond directement. Comme mentionné, cela variera grandement selon la longueur de la chaîne alkyle et les caractéristiques des sédiments. Si l’apport dans un plan d’eau est continu, comme près de sites de rejet des eaux usées, ces substances peuvent s’accumuler dans les sédiments en fonction du débit vers les sédiments par comparaison avec les pertes dues à la biodégradation. Dans les sols, les amines aliphatiques à chaîne(s) longue(s) seront surtout sous forme de protons. Par conséquent, lorsque rejetées dans le sol (p. ex., par l’épandage de boues ou de biosolides, ou d’engrais de potassium minéral sur des terres agricoles), les amines aliphatiques à chaîne(s) longue(s) seront sorbées par la matière organique et l’argile des sols au moyen d’interactions ioniques et non ioniques aux sites d’échange cationique (Droge et Goss 2013a, 2013b).
En plus d’être sorbées par le carbone organique et l’argile dans la colonne d’eau, les sédiments et les sols, les amines aliphatiques se répartiront également dans les organismes. Les amines aliphatiques à chaîne(s) longue(s) ont des coefficients de partage membrane-eau empiriques et modélisés élevés, indiquant une sorption élevée par les membranes (voir la section 3.2.3). Certains organismes, comme les algues, ont des parois cellulaires chargées négativement qui peuvent augmenter la sorption (van Wijk et coll. 2009; Zhang et coll. 2015).
6.2 Persistance dans l’environnement
6.2.1 Biodégradation dans l’eau
Les données de biodégradabilité pour les amines aliphatiques à chaîne(s) longue(s) sont obtenues au moyen de tests de dépistage réalisés d’après l’essai 301 des lignes directrices de l’OCDE pour la biodégradabilité immédiate. Les données de biodégradabilité de 22 amines aliphatiques à chaîne(s) longue(s) variaient de 3 % à 91 % (ECCC 2021), où le pourcentage représente la quantité biodégradée de la substance à l’essai après 28 jours. On détermine la biodégradation dans l’eau en évaluant des paramètres tels que la production de COD, l’évolution du CO2 ou la consommation d’O2. Les tests de biodégradabilité immédiate présentant une quantité biodégradée de 40 % ou plus indiquent qu’il y a un degré de certitude élevé que les demi-vies soient inférieures à 182 jours, signifiant qu’il est peu probable que la substance à l’essai persiste dans l’eau.
Le document d’ECCC de 2021 présente les résultats de 40 études avec des tests de biodégradabilité immédiate, où neuf de ces études ont obtenu des quantités biodégradées inférieures à 40 %. Certaines études dont les substances ayant le groupe fonctionnel éther montrent une faible biodégradabilité, qui pourrait être due au groupe fonctionnel éther et/ou la concentration de la substance à l’essai utilisée (2 à 100 mg/L). Les concentrations supérieures à 0,3 mg/L d’un analogue des CAQ, le bromure d’hexadécyltriméthylammonium (CAQ en C16), affectent la dégradation du composé de référence, l’aniline (Timmer et coll. 2019), et EC (2008) a déterminé la concentration estimée sans effet (CESE) à 0,55 mg/L pour l’activité microbienne, ce qui semble indiquer que les concentrations des amines aliphatiques à chaîne(s) longue(s) de 2 mg/L ou plus pourraient inhiber la biodégradation. Cependant, certaines amines aliphatiques montrent un degré élevé de biodégradation à des concentrations supérieures à 2 mg/L. Donc, la raison pour laquelle le taux de biodégradabilité varie n’est pas claire. Les prédictions de demi-vies de biodégradation ultime pour 44 structures représentatives d’amines aliphatiques à chaîne(s) longue(s) variaient de 13 à 269 jours pour toutes les structures sauf une dont la valeur était inférieure à 150 jours (CATALOGIC 2014), ce qui indique que les amines aliphatiques à chaîne(s) longue(s) ne persisteront probablement pas dans l’eau. Si les tert-alcanamines et les éthers-amines aliphatiques étaient comprises dans la modélisation, les structures représentatives des éther-amines ne seraient pas très ramifiées. Par conséquent, les résultats de CATALOGIC pourraient n’être pas comparables aux données expérimentales des éthers-amines aliphatiques (ECCC 2021).
Bon nombre des tests réalisés avec des amines aliphatiques primaires à chaîne(s) longue(s) ont commencé par une phase de latence de plusieurs jours, puis la dégradation a rapidement augmenté, allant jusqu’à 50 % à 60 % de minéralisation totale, suivie d’une troisième phase où la dégradation a continué à augmenter plutôt lentement. L’hypothèse formulée était que l’augmentation lente de la dégradation à la troisième phase était causée par la diminution de la biodisponibilité des substances à l’essai aux microorganismes en raison de l’adsorption des amines aliphatiques sur les articles de laboratoire en verre (CE 2008) ou les boues, réduisant ainsi la biodisponibilité des substances pour la biodégradation. En outre, le haut degré de toxicité des amines aliphatiques pour les microorganismes pourrait causer une biodégradation plus faible que prévu. La toxicité et l’inhibition résultante de la dégradation peuvent diminuer à mesure que les amines aliphatiques se biodégradent, ce qui pourrait expliquer pourquoi la phase de latence allant jusqu’à 7 jours était suivie d’une augmentation de la dégradation (Timmer et coll. 2019).
En ce qui concerne les voies métaboliques, CE (2008) a présenté les résultats de Yoshimura et coll. (1980) qui semblent indiquer que les alkylamines primaires se biodégradent selon deux voies : 1) désamination oxydative (produisant l’acide gras correspondant et de l’ammoniac) ou 2) ω-oxydation du groupe méthyle terminal (produisant l’acide gras ω-aminé), suivie d’une β-oxydation dans les deux cas. La première étape de la réaction que ce soit par désamination oxydative ou par ω‑oxydation mènerait à une perte des propriétés tensioactives et, par conséquent, à une perte de toxicité, tandis qu’une autre dégradation faisant appel à la β‑oxydation mènerait à une minéralisation totale (van Ginkel 1996). Ratledge (1994) a confirmé que les chaînes alkyles insaturées se dégradent par des réactions similaires.
Les résultats obtenus empiriquement et par modélisation indiquent que les amines aliphatiques à chaîne(s) longue(s) ne sont pas persistantes dans l’eau. Même s’il existe des incertitudes quant aux amines aliphatiques à chaîne(s) longue(s) ayant pour groupe fonctionnel l’éther ou l’alkylamine tertiaire, le modèle CATALOGIC (2014) indique qu’il est peu probable que ces amines aliphatiques persistent en milieu aquatique.
6.2.2 Biodégradation dans les sols
Nous avons trouvé des données sur la dégradation de l’hexadécanamine radiomarquée au 14C et de deux substances analogues radiomarquées au 14C (toutes deux étant des composés d’ammonium quaternaire) dans les sols (ECHA c2007-2018c, c2007-2018d). Nous avons déterminé la formation de dioxyde de carbone radioactif (14CO2) et avons calculé les valeurs du TD50Note de bas de page 11 (c.-à-d., le temps requis pour réduire de 50 % la concentration initiale du composé d’origine) (tableau 6-2). Le pourcentage relativement élevé de la formation de 14CO2 radioactif indique que la biodégradation est un processus répandu dans la dissipation de ces substances et que, par conséquent, les microorganismes du sol sont capables de dégrader les amines aliphatiques à chaîne(s) longue(s). Cela, plus les faibles valeurs de TD50 calculées, indique que les amines aliphatiques à chaîne(s) longue(s) ne persistent pas dans les sols. Cela indique également que les fractions d’amines aliphatiques sorbées en relativement grande partie dans ces sols étaient immédiatement bioaccessibles.
| Nom commun | 14CO2 formation (%)a | DT50 (jours) |
|---|---|---|
| [14C] 1-Hexadécanamine | 55-59 | 8,1-9,0b |
| [14C] Composés d’ammonium quaternaire, chlorures de [14C]-(alkyl en C12-18) (hydroxyéthyl)diméthylammoniums | 55-59 | 6,0-13,6b |
| [14C] 1-Hexadécanamine | 44-48 | 8,7-9,9c |
| Chlorure de triméthylammonium en [14C]C22 | 63-73 | 23-41d |
a Formation de 14CO2 radioactif (% de la radioactivité appliquée trouvée dans les sols vers la fin de l’étude)
b Les sols sont composés de loam limono-argileux, de loam et de loam sableux.
c Les sols sont composés de loam limoneux et de loam sableux.
d Les sols sont composés de loam limoneux, d’argile et de loam.
Des demi-vies de 16 à 150 jours ont été modélisées pour les amines aliphatiques dans l’eau (voir la section 6.2.1). Les demi-vies dans le sol devraient être les mêmes d’après le ratio d’extrapolation de 1:1:4 pour l’eau, le sol et les sédiments, selon Boethling et coll. (1995).
6.2.3 Biodégradation dans les sédiments
Aucune étude sur la biodégradation aérobie des amines aliphatiques dans les sédiments n’a été trouvée. Par conséquent, les résultats sur la biodégradation des amines aliphatiques à chaîne(s) longue(s) dans les sols en aérobie (voir la section 6.2.2) peuvent être extrapolés à la couche supérieure des sédiments. Par conséquent, en conditions aérobies, les amines aliphatiques à chaîne(s) longue(s) ne devraient pas persister dans les sédiments frais.
Aucun test sur la biodégradation des amines aliphatiques à chaîne(s) longue(s) dans les sédiments en aérobie n’existe. Dans des études sur des AQ alkyliques similaires, la biodégradation était faible à nulle en conditions anaérobies (Zhang et coll. 2015; Tezel et coll. 2006) et les concentrations élevées des CAQ dans la couche superficielle hypoxique des sédiments (Lara-Martin et coll. 2010). Par conséquent, il est présumé que les amines aliphatiques à chaîne(s) longue(s) sont persistantes dans les sédiments en conditions anaérobies.
6.2.4 Dégradation abiotique
Il est peu probable que les amines aliphatiques à chaîne(s) longue(s) subissent une dégradation photolytique dans l’eau (y compris le traitement de l’eau dans les lagunes ouvertes) en raison du manque de cycles aromatiques, d’hétéroatomes et d’autres groupes fonctionnels chromophores pouvant absorber l’énergie lumineuse directement ou par réactions avec des espèces transitoires photogénérées. De plus, il ne devrait pas non plus y avoir de dégradation hydrolytique, parce que les substances n’ont pas de groupe hydrolysable.
Dans l’atmosphère, les amines aliphatiques à chaîne(s) longue(s) sont probablement dégradées en raison de réactions avec des radicaux hydroxyles et de l’ozone. Les demi-vies des amines aliphatiques à chaîne(s) longue(s) dans l’air sont d’au plus 3,2 heures et d’au plus 2,1 heures pour les réactions avec des radicaux hydroxyles et de l’ozone, respectivement (EPI Suite c2000-2012). Cependant, les amines aliphatiques à chaîne(s) longue(s) devraient avoir une présence limitée dans l’atmosphère (voir la section 6.1).
6.3 Potentiel de bioaccumulation
6.3.1 Bioaccumulation dans les organismes aquatiques
Les amines aliphatiques à chaîne(s) longue(s) peuvent interagir de façon ionique et non ionique avec la matière organique, y compris les organismes. Leur groupe fonctionnel amine cationique peut être sorbé fortement par les charges négatives sur les surfaces, comme les membranes cellulaires (Gecol 2006; Droge 2017), tandis que leurs chaînes aliphatiques hydrophobes peuvent interagir de façon non ionique avec les membranes (Droge 2017). La sorption par les algues s’est révélée être un puits important pour les amines aliphatiques à chaîne(s) longue(s) dans un essai de toxicité statique (ECHA c2007-2018h), et les concentrations mesurées de 1-hexadécanamine ont été relativement élevées dans les muqueuses et les écailles de poisson lors d’une étude d’exposition chronique de 11 mois (Akzo Nobel 2006). Cette sorption par les surfaces est particulièrement importante pour les petits organismes comme les daphnies et les algues unicellulaires, qui ont un ratio surface-volume plus grand que celui des organismes plus grands comme les poissons. En effet, les amines aliphatiques à chaîne(s) longue(s) affectent les daphnies et les algues à des concentrations beaucoup plus faibles que les poissons (voir la section 7.1.2).
Même si les amines aliphatiques à chaîne(s) longue(s) sont sorbées par les surfaces, elles peuvent pénétrer dans l’organisme, comme indiqué par une recherche commanditée par le Conseil européen de l’industrie chimique (CEFIC) sur la bioaccumulation des surfactants comprenant les amines aliphatiques à chaîne(s) longue(s) en C9 à C16. Dans le cadre de cette recherche, une étude sur l’absorption des surfactants par la truite arc-en-ciel et la répartition tissulaire dans cette espèce a été réalisée (McLachlan 2018). Dans cette étude, des spécimens de truite arc-en-ciel ont été exposés pendant sept jours à des concentrations constantes de deux mélanges d’amines aliphatiques à chaîne(s) longue(s) et de CAQ et la concentration de chaque substance dans le mélange a été mesurée dans les muqueuses, la peau, les branchies, le foie et les muscles. Les concentrations d’essai nominales de chaque substance du mélange variaient de 2,5 à 50 µg/L. Les résultats indiquent que les amines aliphatiques à chaîne(s) longue(s) sont réparties dans tous les tissus examinés. Les concentrations de chaque substance ont été les plus élevées dans le foie des poissons, puis dans les branchies et ensuite dans la peau. Dans les tissus musculaires, qui comprennent une grande partie des graisses sous-cutanées, les concentrations étaient généralement faibles (McLachlan 2018), ce qui indique que les tissus adipeux ne sont pas un puits important pour ces substances. En pourcentage de la base de la charge corporelle totale, l’abondance des amines aliphatiques à chaîne(s) longue(s) sur ou dans les branchies, la peau et les muqueuses était généralement la plus élevée (40 % à 70 %) (McLachlan 2018), ce qui montre l’importance de la sorption sur ou dans les tissus superficiels. Les facteurs de bioconcentration (FBC) de sept jours pour chaque amine aliphatique ont varié d’environ 3 à 1000 L/kg en poids frais (p.f.) (McLachlan 2018). Plus récemment, McLachlan et coll. (2019) ont présenté des données préliminaires d’une étude de 14 jours sur les FBC réalisée dans la portée de ce projet. Des FBC supérieurs à 5 000 L/kg p.f. ont été déterminés pour des amines primaires et secondaires en C16 et une amine tertiaire en C14, tandis que pour les amines primaires et tertiaires en C13, les FBC étaient supérieurs à 1 000 L/kg p.f., indiquant que certaines amines aliphatiques à chaîne(s) plus longue(s) ont un potentiel élevé de bioaccumulation. On ne connaît pas le potentiel de bioaccumulation des amines aliphatiques possédant des chaînes alkyles plus longues que C16, mais comme les FBC sur 14 jours ont augmenté avec l’augmentation de la longueur des chaînes alkyles (McLachlan et coll. 2019), on suppose qu’elles s’accumulent.
Une seule étude de bioaccumulation à l’état d’équilibre a été trouvée sur la bioaccumulation des amines aliphatiques à chaîne(s) longue(s) chez les poissons. Les valeurs du FBC pour la 1-hexadécanamine (amine primaire en C16) ont été déterminées empiriquement dans une étude à long terme de 11 mois (dans laquelle l’équilibre a été atteint) qui a été menée par Akzo Nobel (2006) et qui est décrite brièvement dans EC (2008). Des spécimens de carpe commune (Cyprinus carpio) ont été exposés à une concentration nominale de 3 µg/L de 1-hexadécanamine dans l’eau, les concentrations mesurées variant de 50 % à 80 % de la concentration nominale. Après une exposition de 11 mois, la charge corporelle des poissons entiers variait de 1 500 à 3 600 μg/kg, tandis que dans les muqueuses et les écailles, les concentrations de 1‑hexadécanamine variaient de 8 000 à 15 000 μg/kg. Après avoir retiré les muqueuses et les écailles et lavé les poissons avec du chloroforme (pour éliminer la 1‑hexadécanamine physiquement adsorbée; ECHA 2011), les concentrations résiduelles dans les organismes variaient de 650 à 850 μg/kg. Après un deuxième rinçage avec du méthanol acidifié (pour éliminer la 1-hexadécanamine liée ioniquement; ECHA 2011), les concentrations ont chuté à 280 à 600 μg/kg. Ces résultats d’analyse indiquent qu’il y a eu une adsorption physique et une liaison ionique à la surface de l’organisme. Étant donné que les concentrations d’exposition mesurées (50 % des concentrations nominales) de la 1-hexadécanamine et de la charge corporelle des poissons entiers, le FBC expérimental était de 2 400 L/kg (c.-à-d., log FBC = 3,4), indiquant un potentiel modéré de bioaccumulation. Les FBC calculés seraient plus faibles si certains tissus n’étaient pas inclus (p. ex., muqueuses et/ou écailles) (CE 2008). C’est plus faible que les FBC de 14 jours déterminés par McLachlan et coll. (2019) pour une amine primaire en C16. Cependant, il est indiqué que la dilution par croissance ne semble pas prise en compte dans la détermination du FBC de l’organisme entier même si les poissons devaient se développer pendant l’essai de 11 mois (ECHA 2011). La dilution par croissance entraînerait une diminution de la concentration de 1-hexadécanamine au fil du temps, d’où une sous-estimation du FBC.
Il existe des études expérimentales de bioaccumulation pour les composés dialkyles d’ammonium quaternaire, qui impliquent une extrapolation pour les dialkylamines aliphatiques à chaîne(s) longue(s). Ces études indiquent un potentiel faible de bioaccumulation, les FBC étant de 256 L/kg ou moins (ECCC 2021), valeurs comparables aux FBC faibles pour une exposition de 14 jours pour les CAQ monoalkyles en C10 et en C14 (< 100 L/kg p.f.) déterminés par McLachlan et coll. (2019). Aucune donnée comparable pour les dialkylamines aliphatiques à longue(s) chaîne(s) n’a été trouvée. Krop et de Voogt (2007) montrent que les CAQ triméthyle monoalkyles, de chaîne alkyle en C12 ou moins, ont un FBC d’environ 100 L/kg ou moins (Versteeg et Shorter 1992; Schlechtriem et coll. 2014), ce qui est semblable aux FBC faibles pour 14 jours (< 60 L/kg) rapporté pour les CAQ triméthyle monoalkyles en C10 et en C14 par McLachlan et coll. (2019). Schlechtriem et coll. (2014) a estimé le FBC pour un CAQ triméthyle monoalkyle en C16-18 à 1 960 L/kg, ce qui, par comparaison avec les résultats de McLachlan et coll. (2019), est beaucoup plus élevé que le FBC pour un CAQ en C14, mais plus faible que les FBC des amines aliphatiques en C16. Les résultats préliminaires de McLachlan et coll. (2019) semblent indiquer que la bioaccumulation de CAQ se produit surtout par sorption à la surface, ce qui diffère de l’absorption observée avec les amines aliphatiques à chaîne(s) longue(s). Étant donné que de plus longs CAQ (p. ex., en C15 ou plus) n’ont pas été étudiés par McLachlan et coll. (2019), il est difficile de comparer ces valeurs de FBC avec celles estimées par Schlechtriem et coll. (2014). Le manque de données comparables et les différences possibles dans l’absorption des CAQ par rapport aux amines aliphatiques entraînent des incertitudes quant à la mesure dans laquelle les données de bioaccumulation des CAQ peuvent être extrapolées aux amines aliphatiques.
Des essais S9 in vitro sur des foies de truites arc-en-ciel ont montré que les amines aliphatiques peuvent être facilement biotransformées, bien qu’à des taux beaucoup plus faibles pour les amines primaires (Chen et coll. 2016). Cette étude comprenait une dialkylamine 2 × C6 comme substance à l’essai, laquelle, même s’il ne s’agit pas techniquement d’une amine aliphatique à longue(s) chaîne(s), a montré la capacité des foies de ces truites à métaboliser les structures de type dialkylamine. Les données semblent indiquer que la N-désalkylation est une voie importante de biotransformation chez la truite, avec une déméthylation entraînant la transformation d’amines tertiaires en amines secondaires, qui, à leur tour, sont transformées en amines primaires (Chen et coll. 2016). Les amines aliphatiques primaires peuvent passer par une voie métabolique plus complète chez les mammifères : 1) désamination oxydative par la monoamine oxydase pour former de l’ammoniac et l’alkylamine aldéhyde correspondante, 2) oxydation de l’aldéhyde par l’aldéhyde déshydrogénase en acides carboxyliques, suivie de 3) β-oxydation des acides carboxyliques en dioxyde de carbone (CE 2008).
Même si certaines études sur les amines aliphatiques à chaîne(s) longue(s) et les CAQ analogues indiquent un potentiel faible ou modéré de bioaccumulation des amines aliphatiques à chaîne(s) longue(s), les résultats préliminaires d’une étude de 14 jours sur les FBC indiquent que les amines aliphatiques possédant des chaînes alkyles en C14-16 peuvent avoir un potentiel de bioaccumulation élevé avec des FBC supérieurs à 5 000 L/kg p.f. On suppose que les amines aliphatiques à plus longues chaînes ont également un FBC supérieur à 5 000 L/kg p.f. Les études réalisées avec des CAQ dialkyles laissent entendre que les dialkylamines pourraient de même avoir un potentiel de bioaccumulation faible. Cependant, il reste certaines incertitudes quant à savoir si les CAQ s’accumulent de manière similaire à celle des amines aliphatiques.
En résumé, les données disponibles montrent que les amines aliphatiques à chaîne(s) longue(s) dont les chaînes alkyles sont plus courtes que C14 ont un potentiel faible ou modéré de bioaccumulation dans les organismes aquatiques et celles dont les chaînes alkyles sont en C14 et plus longues ont un potentiel élevé de bioaccumulation.
6.3.2 Bioaccumulation chez les organismes vivant dans les sédiments
En ce qui concerne les organismes vivant dans les sédiments, on n’a trouvé aucune donnée de bioaccumulation pour les amines aliphatiques. Cependant, il existe des données pour l’analogue chlorure de diméthyldioctadécylammonium (CDMDOA; 2 × C16‑18). Comber et coll. (2008) ont mesuré la voie d’absorption du CDMDOA chez Lumbriculus variegatus (un oligochète) et montré l’importance relative de l’absorption par ingestion (86 %) par comparaison avec un contact direct avec des sédiments et l’eau interstitielle (14 %). La tendance générale du CDMDOA à se bioaccumuler, en poids sec, était faible, les facteurs d’accumulation biote‑sédiments (FABS) mesurés étant de 0,22 pour L. variegatus et de 0,78 pour Tubifex tubifex (un oligochète) (Comber et coll. 2008). Cela est semblable au faible potentiel de bioaccumulation des CAQ dialkyles constatés avec les poissons. Cependant, il existe une certaine incertitude quant à la mesure dans laquelle les données de bioaccumulation des CAQ peuvent être extrapolées aux amines aliphatiques. Comme d’autres amines aliphatiques (p. ex., celles présentant des chaînes alkyles en C14 et plus longues) auraient un potentiel élevé de se bioaccumuler chez les poissons, on suppose que la bioaccumulation de ces amines aliphatiques sera tout aussi élevée chez les organismes vivant dans les sédiments.
7. Potentiel de causer des effets nocifs pour l’environnement
7.1 Évaluation des effets pour l’environnement
Étant donné qu’il a été déterminé, par la CRE, que les amines aliphatiques à chaîne(s) courte(s) du groupe des amines aliphatiques ont un potentiel faible de causer des effets nocifs pour l’environnement, cette section met l’accent sur les amines aliphatiques à chaîne(s) longue(s) en tant que catégorie.
7.1.1 Mode/mécanisme d’action
Certaines données expérimentales probantes semblent indiquer que les amines aliphatiques à chaîne(s) longue(s) ont un mode d’action narcotique non spécifique. Par exemple, Bernhard et Dyer (2005) ont trouvé que des concentrations résiduelles dans les cellules pour plusieurs surfactants, seuls et en mélanges, correspondaient étroitement aux charges corporelles in vivo (2 à 8 mmol/kg) associées à des composés organiques non polaires ou à des composés agissant comme un narcotique sur les cellules d’une lignée de cellules hépatiques de poisson, laissant entendre que les amines aliphatiques à chaîne(s) longue(s) agissent par un mode d’action narcotique. Toutefois, un mode d’action narcotique ferait appel à la rupture de la membrane cellulaire. Wood et coll. (1996) n’ont trouvé aucune rupture externe macroscopique des lamelles des branchies en étudiant l’influence du CAQ chlorure de didécyldiméthylammonium (CDDDMA) sur la physiologie des spécimens de truite arc‑en‑ciel.
Les prédictions modélisées structure-propriété semblent généralement indiquer que les amines aliphatiques sont des produits chimiques narcotiques ayant des modes d’action non spécifiques. Par exemple, divers modèles, Verhaar et coll. (1992), TEST (2016), ASTER (1999), l’outil de profilage de modes d’action OASIS (Dimitrov et coll. 2003), et le MOATox de l’US EPA (Barron et coll. 2015), classent les amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques comme des substances narcotiques. Cependant, il existe des exceptions : les alkylamines de suif (nos CAS 61790-59-8 et 61790-60-1) sont classées parmi les substances plus réactives (c.-à-d., substances réactives non spécifiées) par OASIS. Il existe d’autres incertitudes, car ces modèles examinent les données de toxicité aiguë en milieu aquatique pour alimenter leurs prédictions, et on ignore s’il est possible d’extrapoler les résultats à ceux d’études de toxicité chronique ou à ceux d’organismes tels que les algues.
En ce qui concerne la toxicité chez les algues, Rieb et Grimme (1993) ont cherché à déterminer si les effets de surfactants sur les algues varient selon un mode d’action commun faisant appel à Chlorella fusca. Les auteurs ont trouvé que la toxicité des surfactants non ioniques et cationiques pour C. fusca était due à un mode d’action non spécifique, même si le CAQ chlorure d’hexadécyltriméthylammonium a montré un mode d’action plus spécifique en interférant avec les processus de reproduction cellulaire. En effet, les amines aliphatiques devraient interagir à la fois de manière ionique et de manière non ionique avec les membranes, et il existe des incertitudes quant à la manière dont ces interactions distinctes sont liées à une narcose chez les espèces algales.
Même si des données probantes semblent indiquer que les amines aliphatiques à chaîne(s) longue(s) ont un mode d’action narcotique non spécifique, il existe des incertitudes quant à savoir si ce mode d’action pourrait s’appliquer à tous les organismes ou si certains organismes pourraient être plus sensibles à ces substances en raison d’interactions ioniques spécifiques.
7.1.2 Effets sur les organismes aquatiques
7.1.2.1 Facteurs influant sur la toxicité aquatique
Il existe quelques études dans les publications sur l’écotoxicité des amines aliphatiques à chaîne(s) longue(s). Cependant, l’European Chemicals Agency (ECHA) présente de nombreux résumés d’études non publiées de toxicité aiguë et chronique en milieu aquatique réalisées sur des poissons, des invertébrés et des algues pour un grand nombre d’amines aliphatiques à chaîne(s) longue(s). Ces substances sont difficiles à étudier en raison de leurs propriétés tensioactives, qui donnent lieu à des molécules migrant aux interfaces air-eau et solides-eau (y compris à la surface des contenants à l’essai) et à des concentrations plus élevées, formant des micelles (Karsa 2006). D’après la concentration molaire critique pour la formation de micelles présentée à la section 3.2.2, la concentration critique pour la formation de micelles peut être aussi faible que 40 mg/L, concentration utilisée comme limite de solubilité. En outre, le groupe fonctionnel amine cationique s’adsorbera sur les surfaces chargées négativement (Gecol 2006), notamment les matières organiques dissoutes et particulaires qui sont présentes dans l’eau de l’essai, ainsi que dans les membranes cellulaires.
Les données d’écotoxicité en milieu aquatique ont été trouvées dans des études réalisées avec de l’eau de laboratoire et de l’eau de cours d’eau naturelle. L’eau naturelle de cours d’eau contient des matières organiques dissoutes et particulaires et, comme on le mentionne à la section 6.1, les amines aliphatiques à chaîne(s) longue(s) peuvent être sorbées par de telles matières, réduisant ainsi leur biodisponibilité aux organismes à l’essai. Par conséquent, pour les mêmes espèces, les valeurs de toxicité des essais réalisés avec de l’eau de laboratoire devraient être plus faibles (c.-à-d., toxicité apparente supérieure) que celles des essais réalisés avec l’eau naturelle de cours d’eau, et cela a été observé de façon générale. En outre, on a constaté que la toxicité de l’amine aliphatique à chaîne(s) longue(s) (9Z)-9-octadécén-1-amine diminuait avec l’ajout d’acides humiques (ECHA c2007-2018c). Cependant, Chen et coll. (2014) ont déterminé que bien que la toxicité d’un CAQ monoalkyle en C12 pour Daphnia magna ait diminué avec l’augmentation de la concentration d’acide humide, la toxicité sur une base dissoute librement demeure constante. On s’attend donc à ce que la toxicité des amines aliphatiques à chaîne(s) longue(s) demeure également constante sur une base dissoute librement.
7.1.2.2 Valeurs de toxicité nominales ou mesurées
Très peu d’études sur les amines aliphatiques à chaîne(s) longue(s) ont des valeurs de toxicité reposant sur des concentrations mesurées par analyse. Plusieurs études ont mesuré par analyse certaines concentrations d’essai, mais n’ont pas utilisé ces concentrations mesurées pour déterminer la valeur de la toxicité. Les valeurs de toxicité ont été plutôt déterminées à l’aide des concentrations nominales fondées sur l’approche systématique proposée par ECETOC (2003). ECETOC (2003) prétend que la toxicité des substances fortement adsorbantes, comme les amines aliphatiques à chaîne(s) longue(s), devrait être déterminée dans des essais d’écotoxicité modifiés réalisés à l’aide d’acide humique, d’eau naturelle (contenant des matières organiques dissoutes et particulaires) ou d’effluents afin de simuler le devenir de la substance dans l’environnement. La valeur de toxicité résultante devrait alors être fondée sur la concentration totale ou « globale » (c.-à-d., la concentration nominale comprenant la substance dissoute et sorbée).
Cependant, cette approche pour évaluer les amines aliphatiques à chaîne(s) longue(s) est préoccupante. Les amines aliphatiques sorbées par les matières organiques présentes dans l’eau d’essai et les contenants/verrerie ne sont pas biodisponibles pour les organismes à l’essai. Par conséquent, les concentrations nominales ne représenteront pas la fraction biodisponible, et les valeurs de toxicité fondées sur la concentration nominale sous-estimeront la toxicité réelle. De même, dans certaines études sur les amines aliphatiques à chaîne(s) longue(s), on admet que les valeurs de toxicité devraient être fondées sur les concentrations mesurées ou, lorsque les valeurs de toxicité mesurées sont inexistantes, devrait indiquer que les valeurs de toxicité nominales ne sont pas fiables (ECHA c2007-2018c, c2007-2018d). En outre, les valeurs de toxicité fondées sur les concentrations nominales dans l’eau d’essai dans des conditions particulières (p. ex., concentration de matières organiques) ne peuvent être extrapolées dans l’eau dans des conditions différentes.
On suppose que les concentrations mesurées d’amines aliphatiques à chaîne(s) longue(s) sont une approximation de leurs concentrations sous forme dissoute libre dans l’eau d’essai. Cette hypothèse est fondée sur les descriptions des résumés d’études qui indiquent que moins de 100 % des amines aliphatiques nominales récupérées de l’eau et de la verrerie sont dues à la forte sorption de ces substances par les matières organiques (ECHA c2007-2018d). Même si cette hypothèse pourrait ne pas être entièrement vraie, elle procure une valeur de toxicité plus exacte qu’une autre fondée sur les concentrations nominales.
Par conséquent, dans le présent rapport d’évaluation, lorsqu’on calcule les concentrations estimées sans effet (CESE), les valeurs de toxicité données comme concentrations nominales ont été converties en concentrations mesurées dans la mesure du possible d’après les données d’analyse disponibles. Ces conversions supposent que la courbe de perte d’une substance à l’essai est linéaire. Comme cela peut ne pas être le cas, il existe des incertitudes dans les valeurs d’exposition moyennes calculées. Il est noté que dans certains cas, les résultats d’analyse sont très variables.
Pour effectuer ces conversions, les concentrations moyennes d’analyse récupérées (c.-à-d., les concentrations mesurées en pourcentage des concentrations nominales) ont été calculées d’après les concentrations à l’essai au début et à la fin d’une étude (ou à la fin d’une période de renouvellement pour des essais semi-statiques). Par conséquent, toutes les concentrations moyennes récupérées ont été calculées comme des moyennes arithmétiques. Les concentrations récupérées n’étaient pas disponibles pour toutes les concentrations nominales, ce qui pourrait causer d’autres incertitudes à l’égard des valeurs de toxicité pour lesquelles les concentrations mesurées ne sont pas monotones (p. ex., aucune augmentation constante avec l’augmentation des concentrations à l’essai). Par exemple, une étude a fourni des données d’analyse pour toutes les concentrations à l’essai, mais les concentrations mesurées au début de l’essai n’étaient pas liées à la dose, variant de 7 % de la concentration nominale pour la concentration la plus faible, de 83 % de la concentration nominale pour la deuxième concentration la plus faible, et de 23 % de la concentration nominale pour la concentration la plus élevée (ECHA c2007-2018d). Même si les concentrations récupérées au début et à la fin de l’essai peuvent varier de façon importante — dans la mesure où la variation est incertaine dans la plupart des essais — une approche de correction de la valeur de toxicité a été considérée comme plus raisonnable que l’utilisation des concentrations nominales pour les calculs de CESE. Cependant, comme seules certaines valeurs de toxicité pouvaient être corrigées faute de mesures d’analyse, le présent rapport contient un résumé des valeurs de toxicité nominales et corrigées pour les poissons, les invertébrés et les algues (voir le tableau 7-2).
7.1.2.3 Toxicité pour les organismes aquatiques
Des données de toxicité pour un large éventail d’espèces aquatiques (poissons, invertébrés et algues) et d’amines aliphatiques à chaîne(s) longue(s) de différentes longueurs de chaînes (C8-C34Note de bas de page 12) ont été trouvées (voir ECCC 2021). Les données étaient plutôt variables, même pour la même amine aliphatique, et l’ensemble de données était surtout représenté par des monoalkylmonoamines et des diméthylmonoamines. Cependant, une analyse de l’ensemble de données a montré un chevauchement des fourchettes des valeurs de toxicité rapportées pour les monoamines et les diamines de sorte qu’il est approprié d’examiner les deux ensemble dans l’analyse des dangers.
En outre, la toxicité devrait augmenter avec l’augmentation de la longueur de la chaîne alkyle (Rosen and Kunjappu 2012), comme observé par Brust (2001) avec des embryons de poissons et étayé par l’augmentation générale des coefficients de partage membrane-eau, comme mentionné dans la section 3.2.2. Cependant, cette augmentation n’a pas été observée dans l’ensemble de données, en raison peut-être de la grande variabilité des données des différentes études et/ou de l’utilisation répandue des valeurs de toxicité fondées sur les concentrations nominales, et de différents types d’eau, qui ne prend pas en compte la sorption des amines aliphatiques et de la diminution subséquente de leur biodisponibilité. Par conséquent, la longueur des chaînes alkyles n’est pas étudiée plus en profondeur dans la détermination du danger.
Des études ont été réalisées à la fois sur des substances du groupe des amines aliphatiques et d’autres amines aliphatiques à chaîne(s) longue(s). Lorsque plus d’un critère d’évaluation était pris en compte dans une étude, la valeur la plus faible a été utilisée. En outre, lorsque plus d’une concentration entraînant un effet faible ou aucun effet a été rapportée pour un critère d’évaluation (p. ex., une concentration sans effet nocif observé [CSENO], une concentration minimale entraînant un effet observé [CMEO], une concentration entraînant un effet sur 10 % de la population [CE10], une concentration entraînant un effet sur 20 % de la population [CE20]), la CE10 a été privilégiée à la CE20, laquelle a été privilégiée à la CSENO. La CMEO était la moins privilégiée.
Toxicité pour les poissons
Un résumé des données de toxicité pour les poissons est présenté au tableau 7-1. Les données montrent que la toxicité des amines aliphatiques à chaîne(s) longue(s) varie de modérée à élevée pour les poissons, la plupart des valeurs étant inférieures à 1000 µg/L. La courbe dose-réponse pour la létalité est très abrupte pour les amines aliphatiques à chaîne(s) longue(s), souvent avec des concentrations d’essai adjacentes entraînant une mortalité nulle et une mortalité totale. Par conséquent, les valeurs de CL50 étaient parfois considérées comme la moyenne géométrique des deux concentrations d’essai (p. ex., ECHA c2007-2018d). Outre la mortalité, certaines études de toxicité aiguë chez les poissons décrivent des anomalies marquées dans le comportement, la morphologie et la physiologie à des concentrations d’exposition inférieures aux CL50. La valeur de toxicité la plus faible qui a été déterminée est uneCL50 de 60 µg/L établie sur des concentrations mesurées.
Les données d’un essai à long terme sur les premiers stades de la vie avec Oncorhynchus mykiss ont été trouvées. Dans cette étude, une CSENO nominale de 78 µg/L a été déterminée pour la vitesse de croissance. La CSENO mesurée devrait, par conséquent, être inférieure à la valeur nominale.
Toxicité pour les invertébrés aquatiques
Les invertébrés aquatiques sont plus sensibles aux amines aliphatiques à chaîne(s) longue(s) que les poissons. Les valeurs de toxicité aiguë CL/CE50 à 48 h ou à 96 h pour D. magna et Ceriodaphnia dubia dans l’eau de laboratoire et l’eau de cours d’eau variaient de 11 à 2 500 µg/L en concentration nominale de 9 à 822 µg/L en concentration corrigée (tableau 7-1). Une espèce marine, Mysidopsis bahia, a également été examinée, la CL50 nominale à 96 h étant de 74 µg/L, ce qui s’inscrit dans la fourchette observée avec D. magna (US EPA 2003a). Toutes les valeurs de CL50 sauf quatre étaient inférieures à 1 000 µg/L, indiquant que les amines aliphatiques à chaîne(s) longue(s) sont très toxiques pour les invertébrés. Les études de toxicité aiguë et de toxicité chronique avec D. magna dans de l’eau de laboratoire ou de l’eau de cours d’eau rapportent des valeurs sans effet ou des valeurs avec peu d’effet variant de 5,6 à 1 300 µg/L en concentration nominale et inférieure à 60 µg/L d’après les concentrations mesurées (tableau 7-1). La valeur nominale la plus élevée (1 300 µg/L) est une valeur de CMEO accompagnée d’une mortalité de 20 % de la population. Par conséquent, la CSENO serait plus faible. Une seule autre valeur est supérieure à 1 000 µg/L.
Toxicité pour les algues
Les données de toxicité pour les algues, résumées au tableau 7-1, étaient disponibles pour un grand éventail d’amines aliphatiques à chaîne(s) longue(s) (ECCC 2021). Ces données indiquent que les algues sont généralement plus sensibles aux amines aliphatiques à chaîne(s) longue(s) que les poissons ou les invertébrés aquatiques. Les valeurs sans effet ou entraînant un effet faible chez les algues varient de 0,21 à 150 µg/L en concentration nominale et de 0,43 à 77 µg/L en concentration corrigée, démontrant ainsi la toxicité élevée des amines aliphatiques à chaîne(s) longue(s) pour les algues.
| Organisme d’essai | Critère d’évaluation | Type d’eau | Valeur de toxicité nominale (µg/L) | Valeur de toxicité corrigée (µg/L) |
|---|---|---|---|---|
| Poisson | CL50 96 h | Laboratoire | 80-25 500 | 60 (mesurée) |
| Poisson | CL50 96 h | Cours d’eau | 256-9300 | 125-1 890 |
| Poisson (Oncorhynchus mykiss au premier stade de vie) | CSENO 96 h vitesse de croissance | Laboratoire | 78; n = 1 | s.o. |
| Daphnia magna | CE50 immobilisation | Laboratoire | 11-2 500 | 9-83 |
| Daphnia magna | CE50 immobilisation | Cours d’eau | 55,8-1 910 | 24,8-823 |
| Daphnia magna | Aucun effet ou effet faiblea | Laboratoire | 5,6-1 300 (immobilisation) | < 60 |
| Daphnia magna | Aucun effet ou effet faiblea | Cours d’eau | 40-200 (immobilisation) 13-738 (reproduction) | s.o. |
| Algues | Aucun effet ou effet faiblea 72 h ou 96 h; biomasse ou croissance | Laboratoire | 0,21-50 | 0,431-17 |
| Algues | Aucun effet ou effet faiblea 72 h ou 96 h; biomasse ou croissance | Cours d’eau | 0,52-150 | 0,79-77 |
Abréviations : CE10, concentration causant l’effet chez 10 % des organismes; CE50, concentration médiane entraînant un effet; CL50, concentration létale médiane (effet); CMEO, concentration minimale entraînant un effet observé; n, nombre de valeurs de toxicité; s.o., sans objet; CSENO, concentration sans effet nocif observé.
a Les valeurs de concentrations entraînant un effet nul ou faible sont les valeurs de CSENO, CMEO, CE0, CE10 et CE20.
7.1.2.4 Calcul de la concentration estimée sans effet (CESE)
Comme les données de toxicité aquatique indiquent en général une toxicité similaire de divers types d’amines aliphatiques à chaîne(s) longue(s), une seule CESE a été calculée pour décrire toutes les amines aliphatiques à chaîne(s) longue(s).
Sélection d’une valeur critique de toxicité (VCT)
La valeur la plus fiable de l’ensemble des données de toxicité provient d’une étude réalisée avec l’algue Desmodesmus subspicatus et l’hexadécyldiméthylamine (no CAS 112-69-6), qui rapporte une CE10 pour la biomasse de 0,43 µg/L (mesurée) (ECHA c2007-2018c). Cette valeur est retenue comme la VCT pour le calcul de la CESE.
Un facteur d’évaluation a été appliqué à la VCT pour le calcul de la CESE. Puisque la VCT représente une valeur de toxicité sublétale sans effet à long terme pour les algues, aucune autre extrapolation de toxicité aiguë à chronique n’a été nécessaire. Comme les ensembles de données sur les effets comptent plus de sept espèces provenant de trois différentes catégories d’organismes (producteurs primaires, invertébrés et vertébrés), aucune extrapolation n’était requise pour représenter les variations entre les espèces. Un autre facteur d’évaluation de 2 est utilisé pour tenir compte des incertitudes quant au mode d’action des amines aliphatiques. Par conséquent, en divisant la VCT de 0,43 µg/L par le facteur d’évaluation de 2, on obtient une CESE aquatique de 0,22 μg/L (ou 220 ng/L). Cette valeur de CESE aquatique, qui est semblable à la CESE de 260 ng/L calculée dans l’évaluation européenne des risques associés aux alkylamines primaires (CE 2008), servira à la caractérisation des risques associés à toutes les amines aliphatiques à chaîne(s) longue(s).
La VCT utilisée pour calculer la CESE dans la présente évaluation est étayée par d’autres études de toxicité fiables réalisées avec des concentrations mesurées. Ces études comprennent une étude de toxicité chronique fiable effectuée sur les algues avec une CE10 corrigée (biomasse) de 0,79 μg/L pour la décyldiméthylamine (ECHA c2007-2018c) et une étude de létalité aiguë sur les daphnies avec une CE50 corrigée de 9 μg/L pour la cis-9-octadécènamine (ECHA c2007-2018d). Elle est également étayée par plusieurs études fondées sur des concentrations nominales qui indiquent une toxicité élevée (0,2 à 2,3 μg/L) (ECHA c2007-2018c; US EPA 2003b), car les concentrations mesurées devraient être encore plus faibles. Toutes les VCT auraient des valeurs faibles semblables à celles des CESE après l’application d’un facteur d’évaluation pour tenir compte de l’extrapolation de la toxicité aiguë à la toxicité chronique (s’il y a lieu) et des incertitudes relatives au mode d’action.
7.1.3 Effets sur les organismes vivant dans les sédiments
Des données expérimentales sur la toxicité pour les organismes vivant dans les sédiments ont été trouvées pour six amines aliphatiques à chaîne(s) longue(s) et un analogueNote de bas de page 13.
| Nom commun, no CAS | Organisme à l’essai | Critère d’évaluation | Valeur (mg/kg p.s.) |
|---|---|---|---|
| DMAa en C12-14 | Nématode (Caenorhabditis elegans) | CSENO 72 h reproduction, croissance | 1 620 (nominale) |
| Acétate d’alcanamine en C16-18 (nombre pair), 1273322-45-4b | Moucheron (Chironomus riparius) | CSENO 28 j émergence, développement | 188 (mesurée)c |
| N-(Alkyl en C16 ou C18)propane-1,3-diamines,133779-11-0d | Lombric (Lumbriculus variegatus) | EC10 28 jreproduction | 86 (nominale)c |
| N-(Alkyl de suif hydrogéné)propane-1,3-diamine, 68603-64-5d | Nématode (Caenorhabditis elegans) | CSENO 96 h reproduction, croissance | 1 000e |
| N-(Alkyl de suif hydrogéné)propane-1,3-diamine, 68603-64-5d | Lombric (Lumbriculus variegatus) | EC10 28 j reproduction | 11 (nominale) |
| Acétate de N-[3-(alkyl ramifié en C11-14 riche en C13)oxy)propyl]propane-1,3‑diamine, CE 931-295-2f | Lombric (Lumbriculus variegatus) | CSENO 28 jreproduction, biomasse | 134e |
| N-(Alkyl en C16 ou C18)propane-1,3-diamines, CE 696-364-9f | Lombric (Lumbriculus variegatus) | CSENO 28 j reproduction, biomasse | 68e |
| ATMA en C20/22, chlorure de N,N-diméthyl-N‑nonadécyl-1-docosanaminium, 68607-24-9g | Nématode (Caenorhabditis elegans) | CSENO 96 hreproduction, croissance | 250 (nominale) |
| ATMA en C20/22, 68607-24-9g | Worm (Lumbriculus variegatus) | CSENO 28 j reproduction, biomasse | 62,5 (nominale)c |
| Alcanamine de suif, 61790-33-8a,b | Nématode (Caenorhabditis elegans) | CSENO 72 h reproduction, croissance | ≥ 2 030 (nominale) |
Abréviations : DMA = diméthylamine.
a ECHA c2007-2018c, no CAS 112-69-6.
b ECHA c2007-2018d, no CAS 124-30-1.
c Les résultats d’analyse indiquent une perte mineure (20 % ou moins) au court de l’essai, donc la valeur nominale est proche de la valeur mesurée.
d ECHA c2007-2018i, no CAS 1219010-04-4.
e On ignore si la valeur est nominale ou mesurée.
f ECHA c2007-2018g, CE 931-295-2.
g Composés d’ammonium quaternaire utilisés comme analogue de l’hexadécyldiméthylamine (no CAS 112-69-6).
Les valeurs de toxicité chronique sans effet dans les sédiments pour les amines aliphatiques à chaîne(s) longue(s) varient de 11 à plus de 2 030 mg/kg en poids sec (p.s.) (ECHA c2007-2018c, c2007-2018d, c2007-2018g, c2007-2018i; tableau 7-2). Trois essais réalisés avec Caenorhabditis elegans ont donné des CSENO élevées indiquant une faible toxicité. Cependant, deux de ces études avaient une composition très différente en sédiments artificiels que dans les autres études (44 % de sable, par comparaison avec au moins 70 % de sable dans les autres études), ce qui peut expliquer les résultats différents, car la composition des sédiments peut influer sur la sorption et, par conséquent, la biodisponibilité de la substance d’essai. Les valeurs de toxicité des autres études (avec C. elegans, Chironomus riparius et L. variegatus) étaient plus faibles et plus comparables (11 à 250 mg/kg p.s.).
7.1.3.1 Calcul d’une concentration estimée sans effet dans les sédiments
La valeur nominale de CE10 de 11 mg/kg p.s. établie d’après les effets sur la reproduction et la biomasse avec L. variegatus exposé au N-(alkyl de suif hydrogéné)propane-1,3-diamine est la valeur de toxicité calculée statistiquement la plus faible dans l’ensemble de données sur la toxicité dans les sédiments en ce qui concerne les amines aliphatiques à chaîne(s) longue(s) provenant d’une étude fiable. Par conséquent, cette valeur est retenue comme VCT.
Comme la VCT représente une valeur de toxicité sublétale à long terme entraînant un effet faible, aucun facteur d’évaluation n’est nécessaire pour tenir compte de l’extrapolation de la toxicité aiguë à la toxicité chronique. Cependant, puisque l’ensemble de données ne représente que trois espèces d’une seule catégorie d’organismes (invertébrés), un facteur d’évaluation de 20 est utilisé pour tenir compte des variations entre les espèces. En outre, un facteur d’évaluation de 2 est utilisé pour tenir compte des incertitudes dans le mode d’action de ces substances. Par conséquent, le facteur d’évaluation global est de 40 et la CESE pour les sédiments est calculée comme suit :
CESE = 11 mg/kg ÷ (20 × 2) = 0,275 mg/kg p.s.
La CESE est fondée sur une valeur de toxicité nominale. Cependant, trois études indiquent que les concentrations mesurées étaient proches des concentrations nominales (p. ex., environ 80 % ou plus) (ECHA c2007-2018c, c2007-2018d, c2007‑2018i). Par conséquent, on a supposé qu’une perte faible similaire s’est produite avec les autres substances à l’essai, dans les sédiments, et que les concentrations nominales sont une bonne approximation des concentrations d’exposition réelles.
7.1.4 Effets sur les organismes vivant dans le sol
Les données d’études décrivant la toxicité des amines aliphatiques à chaîne(s) longue(s) pour les lombrics et les végétaux sont présentées au tableau 7-3. Toutes les concentrations sont les concentrations nominales en poids sec. Une substance à l’essai figure sous son abréviation, DMA en C12-14, ce qui entraîne des incertitudes quant à l’identité précise de ce produit chimique. D’après une étude examinant les effets d’une amine aliphatique à chaîne(s) longue(s) différente sur des algues (ECHA c2007-2018j), l’abréviation DMA se rapporte probablement aux diméthylamines.
| Nom commun, no CAS | Organisme d’essai | Critère d’évaluation | Valeur de toxicité (mg/kg p.s. nominale) |
|---|---|---|---|
| DMA en C12-14a | Lombric (Eisenia andrei) | CSENO 14 j mortalité, biomasse, comportement | ≥ 1 000b |
| Alkylamines de suif hydrogénées, 61788-45-2c | Lombric (Eisenia fetida) | CSENO 56 j reproduction | 200 |
| Chlorure de N-(2-hydroxyéthyl)-N,N-diméthylalcane-1-aminium en C12 ou C14, 1125503-33-4d | Lombric (Eisenia fetida) | CSENO 56 j reproduction | 125 |
| Alkylamines de suif, 61790-33-8c | Lombric (Eisenia fetida) | CL10 14 j | > 1 000 |
| DMA en C12-14a | Colza (Brassica napa) | CE25 21 j, hauteur des pousses | 52 |
| DMA en C12-14a | Avoine (Avena sativa) | CE25 21 j, hauteur des pousses | 473 |
| Alkylamines de suif, 61790-33-8c | Avoine (Avena sativa) | CSENO 20 j émergence, biomasse | ≥ 10b |
| Alkylamines de suif, 61790-33-8c | Radis (Raphanus sativus) | CSENO 20 j émergence, biomasse | ≥ 100b |
| Alkylamines de suif, 61790-33-8c | Trèfle des prés (Trifolium pratense) | CSENO 20 j émergence, biomasse | ≥ 100b |
a DMA = Diméthylamine, utilisée pour extrapolation avec l’amine aliphatique tertiaire hexadécyldiméthylamine (ECHA c2007-2018c, no CAS 112-69-6).
b Non limitée.
c Analogue pour l’amine aliphatique primaire octadécanamine (ECHA c2007-2018d, no CAS 124-30-1).
d Composé d’ammonium quaternaire (ECHA c2007-2018k, no CAS 1125503-33-4) utilisé comme analogue pour l’amine aliphatique tertiaire hexadécyldiméthylamine (ECHA c2007-2018c, no CAS 112-69-6).
En général, les amines aliphatiques à chaîne(s) longue(s) semblent avoir une toxicité faible pour les lombrics, au moins en ce qui concerne la toxicité aiguë. Par exemple, une CSENO illimitée (pour la mortalité, le comportement et la biomasse) de 1 000 mg/kg p.s. et une CL10 supérieure à 1 000 mg/kg p.s. ont été rapportées pour Eisenia andrei (ECHA c2007-2018c, c2007-2018d). Cependant, des études de toxicité chronique indiquent que les amines aliphatiques peuvent influer de façon importante sur la reproduction des lombrics à des concentrations inférieures à 1 000 mg/kg p.s. Par exemple, deux études ayant examiné l’effet des amines aliphatiques à chaîne(s) longue(s) sur la reproduction avec Eisenia fetida a permis de déterminer les valeurs de CSENO de 125 mg/kg et de 200 mg/kg p.s. (tableau 7-3). Il existe certaines incertitudes dans les résultats de l’étude avec les amines de suif hydrogénées en raison d’erreur de déclaration dans le résumé de l’étude (ECHA c2007-2018d). Cependant, les résultats sont semblables à ceux observés dans une étude sur la reproduction du lombric à long terme faisant appel à un CAQ dans laquelle une CSENO de 56 jours de 125 mg/kg a été rapportée. Par conséquent, il semble que les CAQ et les amines aliphatiques à chaîne(s) longue(s) ont une toxicité similaire chez les lombrics. En outre, l’étude réalisée avec le CAQ a obtenu des résultats semblables à ceux trouvés dans l’étude effectuée avec la DMA en C12-14 pour le comportement, la biomasse et la survie chez les lombrics adultes, car ces critères d’évaluation n’ont pas varié de façon importante par le CAQ pendant l’exposition de 28 jours (des organismes adultes) jusqu’à la concentration nominale de 1 000 mg/kg p.s.
En ce qui concerne les végétaux terrestres, seuls les résultats des études à court terme (20 ou 21 jours) ont été trouvés (ECHA c2007-2018c, 2007-2018d). Une étude portait sur les alkylamines de suif, mais seulement à des concentrations allant jusqu’à 100 mg/kg p.s. Aucun effet important n’a été constaté sur l’émergence et la biomasse végétale jusqu’à la concentration à l’essai la plus élevée (ECHA c2007-2018d). Une autre étude réalisée avec la DMA en C12-14 a rapporté des valeurs de CE25 à 21 jours de 52 mg/kg p.s. pour le colza (longueur des pousses) et de 473 mg/kg p.s. pour l’avoine (pousses, poids frais) (ECHA c2007-2018c). La valeur de CE25 pour l’avoine (473 mg/kg p.s.) concorde avec la CSENO illimitée supérieure ou égale à 100 mg/kg p.s. pour l’avoine avec l’alkylamine de suif. Il est également indiqué que les concentrations entraînant un effet nul ou faible (c.-à-d., CE25) chez les végétaux sont semblables aux CSENO déterminées pour la reproduction chez les lombrics (tableau 7-3).
7.1.4.1 Calcul de la concentration estimée sans effet dans le sol
La valeur de CE25 de 52 mg/kg p.s. pour le colza (longueur des pousses) est la valeur de toxicité calculée statistiquement la plus faible de l’ensemble de données sur la toxicité des amines aliphatiques à chaîne(s) longue(s) dans le sol provenant d’une étude fiable. Cette valeur est donc celle qui a été retenue comme VCT.
Puisque la VCT représente une exposition aiguë (courte durée) pour les végétaux, on a appliqué un facteur de 5 pour extrapoler à une valeur de toxicité à long terme (chronique). En outre, une extrapolation visant à tenir compte de la variation entre les espèces est nécessaire. Comme il existe une quantité modérée de données sur la toxicité, représentant six espèces de deux catégories d’organismes (producteurs primaires et invertébrés), un facteur de variation interspécifique de 5 a été utilisé. De plus, un facteur d’évaluation de 2 a été appliqué pour tenir compte des incertitudes relatives au mode d’action de ces substances. Par conséquent, la CESE pour la toxicité dans le sol se calcule comme suit :
CESEsol = 52 mg/kg ÷ (5 × 5 × 2) = 1 mg/kg p.s.
Cette valeur de CESE a été utilisée dans la caractérisation des risques associés aux amines aliphatiques à chaîne(s) longue(s) pour les organismes vivant dans le sol, puisque les données de toxicité d’un éventail d’amines aliphatiques à chaîne(s) longue(s) et d’analogues, décrits ci-dessus, indiquent une toxicité similaire pour toutes amines aliphatiques à chaîne(s) longue(s) visées par la présente évaluation.
7.2 Évaluation de l’exposition de l’environnement
Les amines aliphatiques à chaîne(s) longue(s) pourraient être interchangeables dans certains procédés industriels. De plus, plusieurs amines aliphatiques à chaîne(s) longue(s) peuvent être utilisées et rejetées d’un même site dans le même environnement. Par conséquent, les scénarios d’exposition de l’environnement tiennent compte des amines aliphatiques à chaîne(s) longue(s) en tant que groupe, et les scénarios sont fondés sur les capacités des sites industriels relatives aux substances. Les scénarios qui ont été pris en compte sont ceux qui devraient avoir un potentiel élevé de rejet dans l’environnement et pour lesquels il existe suffisamment de données pour l’élaboration d’un scénario d’exposition. Ces scénarios comprennent les rejets dans des systèmes aquatiques et terrestres, certains d’entre eux étant évalués quantitativement et d’autres, qualitativement. Les scénarios considérés dans la présente évaluation comprennent la production d’amines aliphatiques à chaîne(s) longue(s), la transformation d’amines aliphatiques à chaîne(s) longue(s) en intermédiaires dans la production d’autres produits chimiques, la production de mousse de polyuréthane, le rejet de produits nettoyants contenant des résidus n’ayant pas réagi, le traitement de flottation dans l’extraction de minerais, les émulsions d’asphalte, l’épandage et la formulation d’engrais et l’épandage de boues d’épuration sur les sols agricoles. Chacun de ces scénarios est décrit avec plus de précisions ci-dessous. Il n’y a aucun résultat de surveillance dans la présente section, car il n’existe actuellement aucune donnée sur les concentrations d’amines aliphatiques à chaîne(s) longue(s) dans l’environnement au Canada.
7.2.1 Calcul des CEE et hypothèses générales
Les expositions de l’environnement sont estimées et présentées sous forme de concentrations estimées dans l’environnement (CEE) et étaient généralement calculées selon l’équation suivante :
Q = quantité utilisée par site par jour (kg/jour)
L = pertes dans les eaux usées (fraction)
R = efficacité d’élimination de l’usine de traitement des eaux usées (fraction)
D = volume de dilution quotidien (L/jour)
fdissoute = fraction dissoute libre
L’efficacité d’élimination de l’usine de traitement des eaux usées (R) a été déterminée à l’aide des résultats des tests effectués en continu sur les boues d’épuration activées faisant appel à des eaux usées industrielles ou municipales et à des boues d’épuration issues du traitement des eaux usées (Akzo Nobel 1998, 2002 a, 2002b), comme décrit dans l’évaluation de l’Union européenne sur les risques associés aux amines primaires (CE 2008). Dans ces tests, l’élimination des amines de suif ou des amines alkyles de coco dans les eaux usées a été quantifiée pour les eaux usées dopées et non dopées avec des amines aliphatiques. L’efficacité d’élimination des amines aliphatiques dans les eaux usées varierait de 96 % à 99,98 %. Cependant, un test effectué en continu sur des boues d’épuration activées (Akzo Nobel 1998) s’est écarté des lignes directrices de l’OCDE (2001) sur au moins un aspect, car l’unité du test était beaucoup plus petite que l’unité du test recommandée dans les lignes directrices. Aucune donnée n’a été fournie par la Commission européenne (CE 2008) sur la grandeur de l’unité de test utilisée dans les autres études (Akzo Nobel 2002a, 2002b), mais comme les tests semblent similaires et ont été réalisés par la même entreprise, on peut supposer que tous les tests ont été faits avec le même appareil. Cela accroît les incertitudes dans les taux d’élimination. Aucune étude n’a été trouvée pour l’examen par ECCC pour la présente évaluation et on ignore si les tests respectaient les recommandations en matière de qualité des données. En outre, les eaux usées ont été dopées avec 50 ou 57 mg/L d’amines de suif ou d’amines alkyles de coco (Akzo Nobel 1998, 2002 a, 2002b). Ces concentrations sont réputées toxiques pour les microorganismes et entraîneraient une inhibition de la respiration de plus de 50 % (Hoechst AG 1989a, 1989b, 1992), et pourraient donc influer sur l’élimination dans les eaux usées. En raison de ces incertitudes, l’efficacité d’élimination la plus faible rapportée parmi toutes les études, c.‑à‑d., 96 % (ou R = 0,96), est retenue comme efficacité d’élimination dans les eaux usées pour les scénarios d’exposition de la présente évaluation en fonction des différents types de traitements.
On obtient les volumes quotidiens de dilution en multipliant le débit des effluents de l’UTEU ou de l’installation de traitement des eaux usées déversant ses eaux usées dans un plan d’eau récepteur par le facteur de dilution du plan d’eau récepteur. Dans tous les cas, les CEE aquatiques ont été calculées à l’aide d’un facteur de dilution fondé sur le débit faible au 10e centile du plan d’eau récepteur et limité à un facteur de dilution maximal de 10.
On calcule la CEE aquatique par la fraction des amines aliphatiques à chaîne(s) longue(s) dissoutes libres en incorporant la fraction dissoute libre (fdissoute) dans le calcul en supposant une concentration de carbone organique total (COT) de 13,05 mg/L (voir le tableau 6-1, section 6.1). On a utilisé le point milieu de la fdissoute pour convertir toutes les CEE aquatiques calculées en concentration dissoute libre.
La CEE aquatique représente les concentrations potentielles des substances dans le plan d’eau récepteur situé près du point de rejet d’une UTEU. La CEE du sol représente la concentration possible dans ce milieu sur lequel des biosolides peuvent être épandus. Les valeurs de CEE sont présentées pour chaque scénario d’exposition, tandis que les principales hypothèses sont résumées dans le document d’ECCC (2021). En outre, certaines valeurs de CEE ont aussi été converties en CEE dissoutes libres pour chaque catégorie de longueur de chaîne alkyle des monoamines et de diamines pour la caractérisation des risques. Ces valeurs de CEE converties sont présentées à la section 7.3.1. Les rejets possibles lors du nettoyage des contenants et du transport, y compris lors du chargement et du déchargement, n’ont pas été pris en compte dans la présente évaluation.
Étant donné la quantité limitée de données sur les sédiments, les CEE dans les sédiments n’ont pas été calculées pour les amines aliphatiques à chaîne(s) longue(s). De plus, il n’est pas possible actuellement de modéliser leur répartition et leurs concentrations résultantes dans les sédiments en raison des propriétés uniques des surfactants. Cependant, les amines aliphatiques à chaîne(s) longue(s) pourraient s’accumuler dans les sédiments étant donné leur persistance élevée dans les sédiments, en anaérobie, et leur grande affinité de sorption (sections 3.2.2 et 6.1). Même s’il manque des données sur les amines aliphatiques à chaîne(s) longue(s), les concentrations totales des (alkyl en C16‑22)triméthylammoniums, qui sont des analogues des monoamines aliphatiques à chaîne(s) longue(s), augmentent dans les sédiments de surface anoxiques à Jamaica Bay, New York, de 1998 à 2008, les concentrations variant de 1 600 à 6 750 ng/g en 2008 (Lara-Martin et coll. 2010).
7.2.2 Scénario d’exposition 1 – Production
Ce scénario portait sur le rejet d’amines aliphatiques à chaîne(s) longue(s) par les installations où elles étaient produites. Les installations de production d’amines aliphatiques peuvent utiliser de l’eau dans le procédé. Les déchets aqueux des procédés de production passent, comme les eaux usées, dans un dégraisseur central (CE 2008). Pour ce scénario, on suppose que les effluents sont rejetés dans une UTEU secondaire. Deux CEE ont été calculées dans ce scénario : l’une pour les installations de production et l’autre pour les installations où l’on produit et transforme des amines aliphatiques pour former d’autres produits chimiques.
La CEE aquatique pour une installation de production représentative a été calculée à l’aide de données provenant de différentes sources. La taille des lots de production et la durée des campagnes de production ont été fournies pour un des fabricants d’amines aliphatiques et de leurs dérivés en Amérique du Nord au Programme des substances nouvelles d’Environnement et Changement climatique Canada (ECCC). Veuillez consulter le document d’ECCC (2021) pour le résumé des hypothèses. Comme il n’existait aucune donnée sur la capacité des sites canadiens, on a utilisé la capacité et la taille des lots de fabrication d’un site similaire aux États‑Unis. La CEE non convertie pour la production des amines aliphatiques est de 0,34 µg/L.
Puisque les amines aliphatiques peuvent être transformées au même site de fabrication, une deuxième CEE aquatique a été calculée pour ce scénario. Les hypothèses sur l’exposition demeurent les mêmes que pour le scénario de production ci-dessus, sauf en ce qui concerne le facteur d’émission, qui comprenait un autre facteur pour les rejets provenant de la partie transformation des exploitations. La CEE non convertie pour ce scénario est de 1,12 µg/L.
7.2.3 Scénario d’exposition 2 – Transformation
Ce scénario portait sur l’utilisation d’amines aliphatiques à chaîne(s) longue(s), comme les éthoxylates, les diamines et les amides, comme intermédiaires dans l’industrie chimique pour la production d’autres substances par transformation chimique. Aucune précision n’était donnée sur les sites canadiens de transformation des amines aliphatiques à chaîne(s) longue(s). Le scénario est axé sur la transformation d’amines aliphatiques primaires en éthoxylate d’amine.
Les amines aliphatiques sont presque entièrement transformées en éthoxylates d’amine aliphatique pendant le processus d’éthoxylation, ne laissant qu’une petite quantité d’amines primaires dans le produit final. Bien que la réaction d’éthoxylation ne produise pas d’eaux usées, les amines aliphatiques qui n’ont pas réagi peuvent pénétrer dans les eaux usées lors du nettoyage des réacteurs. On suppose que les réacteurs de transformation sont généralement nettoyés une seule fois par année à des fins d’entretien. Cependant, il a été rapporté que l’un des quatre sites de production d’éthoxylate d’amine examiné par la CE (2008) procédait à un nettoyage plus continu, tout au long de l’année. On suppose alors le scénario le plus défavorable, soit le nettoyage plus continu des réacteurs d’éthoxylation. La quantité transformée de 203 t/an repose sur le scénario employé dans le document de la CE (2008). Comme le produit final devrait contenir jusqu’à 2,2 % de résidus n’ayant pas réagi (CE 2008), on a utilisé 4 466 kg/an pour le calcul des rejets d’amines primaires lors du nettoyage des réacteurs de transformation. On a appliqué un coefficient d’émission de 2 % pour tenir compte des rejets provenant du nettoyage des réacteurs (CE 2003). La distribution du volume de dilution quotidien pour le secteur de la fabrication de produits chimiques a été calculée et la valeur au 10e centile a été retenue comme valeur représentative. Un résumé des principales hypothèses est présenté dans le document d’ECCC (2021). La CEE non convertie pour ce scénario est de 1,30 µg/L.
7.2.4 Scénario d’exposition 3 – Production de mousse de polyuréthane
Ce scénario portait sur la production de mousse de polyuréthane souple. On a calculé deux CEE pour le milieu aquatique, l’une pour la formulation d’un mélange de polyalcools (un des composants nécessaires à la production de mousse de polyuréthane, qui peut contenir de 1 % à 5 % d’un catalyseur de type amine) et l’autre pour la production de mousse de polyuréthane souple en tant que telle.
Les données d’une usine de mélange chimique de polyuréthane ont été compilées pour calculer la CEE pour la formulation d’un mélange de polyalcools, notamment les données sur les quantités importées connues du site. La principale hypothèse, le nombre de jours de rejet, a été déterminée à l’aide de la capacité de production annuelle d’une installation représentative et du nombre correspondant de jours d’activité. On a extrapolé ce nombre pour obtenir la capacité de production annuelle de mélange de polyalcools fondée spécifiquement sur la quantité d’amines aliphatiques achetée par l’installation et l’hypothèse d’une teneur de 1 % en catalyseur de type amine dans le mélange de polyalcools. La quantité employée par année reposait également sur la quantité achetée par l’installation. Le coefficient d’émission a été estimé à l’aide des tableaux du Technical Guidance Document (TGD) de la CE (2003).
Des données pour une installation de production de polyuréthane ont été trouvées, dont la quantité de substance utilisée. La quantité de polyuréthane formulé a été estimée d’après la quantité utilisée, la concentration d’amines aliphatiques dans le mélange de polyalcools et le ratio du mélange de polyalcools par rapport à d’autres composants utilisés dans la production de polyuréthane (1:2). On a déterminé les principaux paramètres, comme le nombre de jours de transformation par année et le coefficient d’émission, à l’aide des tableaux du TGD de la CE (2003) établis d’après la quantité estimée de polyuréthane produit. La distribution du volume de dilution quotidien pour le secteur de la fabrication de polyuréthane a été calculée et la valeur au 10e centile a été retenue comme valeur représentative. Les principales hypothèses sont fournies dans le document d’ECCC (2021). La CEE non convertie pour la formulation du mélange de polyalcools est de 0,55 μg/L, tandis que celle de la production de mousse de polyuréthane souple est de 0,001 9 μg/L.
7.2.5 Scénario d’exposition 4 – Rejet à l’égout de dérivés d’amines
Selon les renseignements présentés dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE, l’hexadécyldiméthylamine (no CAS 112‑69‑6) serait un résidu parmi les dérivés d’amines qui sont utilisés dans la fabrication de divers produits commerciaux et produits disponibles pour les consommateurs. L’utilisation de ces produits devrait entraîner le rejet dans les UTEU. La CEE est estimée à l’aide du modèle maison de rejet de produits de consommation dans le milieu aquatique d’ECCC (Consumer Release Aquatic Model ou CRAM). Le modèle CRAM est un modèle probabiliste fondé sur la population reposant sur des paramètres canadiens. On l’utilise pour estimer l’exposition de l’environnement découlant des rejets, par les UTEU, de produits chimiques présents dans des produits disponibles pour les consommateurs et rejetés à l’égout. Le modèle fait appel aux données de distribution visant à établir les facteurs de dilution (à partir du débit au 10e centile des plans d’eau récepteurs), le type de traitement des UTEU et les taux d’évacuation des eaux par habitant qui sont pertinents au Canada.
On n’a pu trouver de données complètes sur la quantité d’amines aliphatiques à chaîne(s) longue(s) présentes au Canada en tant que résidus n’ayant pas réagi dans les produits. Les données disponibles sur la quantité de ces types de produits étaient celles de la consommation en Amérique du Nord des principaux surfactants dans les détergents domestiques. La consommation aux États‑Unis et au Canada des intermédiaires cationiques alkylméthylamines et diméthylamines (ADMA) dans les détergents domestiques était de 45 millions de kg en 2018 (Bland et coll. 2018). On suppose que la consommation de détergents est proportionnelle à la taille de la population. Étant donné qu’en 2018 la population des États‑Unis était de 327,2 millions, et en utilisant la population canadienne de 37 millions d’habitants, on estime la consommation totale annuelle au Canada des intermédiaires amines ADMA à 4,6 millions de kilogrammes. La concentration des amines aliphatiques n’ayant pas réagi dans les dérivés d’amines est censée être au plus 2 %, d’après les communications de suivi avec une entreprise qui importe des dérivés d’amines. Par conséquent, la masse d’amines aliphatiques à chaîne(s) longue(s) n’ayant pas réagi dans les détergents domestiques au Canada est aussi élevée que 92 000 kg/an. Le modèle a calculé la distribution de la quantité résultante rejetée dans les plans d’eau récepteurs près du point de rejet. La CEE non convertie correspondant au 90e centile de la distribution de la CEE est de 0,12 μg/L.
L’hypothèse appliquée en matière de volume n’englobe que les détergents domestiques. Bien que ces produits représentent la plus grande catégorie générale pour la consommation de surfactants, la catégorie exclut tous les savons de toilette, les surfactants pour l’assouplissement des tissus, les shampoings et les cosmétiques connexes. Les nettoyants industriels et institutionnels sont d’autres sources de dérivés d’amines. Par conséquent, les CEE sous-estiment probablement les concentrations dans l’environnement découlant de cette utilisation.
7.2.6 Scénario d’exposition 5 – Traitement de flottation dans l’extraction de minerais
Les amines aliphatiques à chaîne(s) longue(s) et leurs sels peuvent être utilisés comme agents hydrophobes dans le traitement de flottation pendant l’extraction de différents minéraux (p. ex., potasse, fer, zinc). Même si cette utilisation représente l’utilisation directe la plus répandue des amines aliphatiques primaires à chaîne(s) longue(s), d’autres amines aliphatiques à chaîne(s) longue(s) (p. ex., diamines) et amines grasses (p. ex., composés quaternaires) sont également utilisées dans l’extraction minière (Roose et coll. 2015). Selon les données présentées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), les produits à base d’amines aliphatiques à longue(s) chaîne(s) sont importés au Canada pour la flottation des minéraux.
Extraction de minerai de fer
L’utilisation de collecteurs d’amines cationiques pour la flottation dans l’extraction de minerai de fer au Canada est confirmée par les données présentées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013). Par conséquent, on a élaboré un scénario quantitatif pour le secteur de l’extraction de minerai de fer fondé sur un site représentatif, en supposant que le collecteur d’amines est continuellement en activité. Les caractéristiques des sites d’extraction de métaux sont habituellement plutôt variables et propres à chaque site. D’après une hypothèse principale du scénario, l’efficacité d’adsorption du collecteur d’amines par la silice pendant la flottation du minerai de fer, ce qui a été surestimé à 99 %, laissant par conséquent 1 % d’amines aliphatiques non liées présentes dans les effluents de résidus de silice. Les principaux paramètres utilisés dans les calculs, dont la capacité de transformation, le taux d’application des collecteurs d’amines et le débit des effluents au point de rejet, ont été fondés sur des données confidentielles fournies par l’entreprise. La CEE non convertie pour la flottation du minerai de fer est de 0,248 μg/L.
Les concentrations d’amines aliphatiques en milieu aquatique découlant de ce scénario peuvent être significativement supérieures étant donné qu’une efficacité d’adsorption inférieure à 99 % est prévue dans le collecteur, que la désorption des amines aliphatiques de la silice peut se produire lors de leur rejet dans un milieu naturel et que les débits des effluents utilisés dans les calculs se trouvaient à l’extrémité la plus élevée de la fourchette.
Extraction de potasse
Les amines aliphatiques à chaîne(s) longue(s) sont utilisées dans l’extraction de potasse (CE 2008; Strathdee et coll. 1982; Reid 1984), mais puisque l’évaporation naturelle et l’injection en puits profond sont utilisées pour l’élimination des effluents d’extraction de potasse en Saskatchewan (Reid 1984), aucune CEE n’a été calculée pour ce scénario. Pour de plus amples renseignements, veuillez consulter le document d’ECCC (2021).
7.2.7 Scénario d’exposition 6 – Formulation et utilisation d’émulsions d’asphalte
Selon les données présentées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE et des déclarations volontaires, les diamines à longue(s) chaîne(s) sont principalement utilisées comme additif dans les applications liées à l’asphaltage et le revêtement de routes. Plus particulièrement, ces diamines agissent comme émulsifiants pour les émulsions cationiques d’asphalte à prise lente, modérée et rapide qui sont utilisées dans les applications d’asphalte enrobé à froid pour le revêtement et la réparation de routes, ainsi que pour les couches d’accrochage et d’apprêt entre les couches d’asphalte malaxé à chaud. Des émulsifiants cationiques sont utilisés à concentration faible dans les émulsions d’asphalte et contribuent à l’adhérence de l’asphalte aux agrégats.
Formulation d’émulsions d’asphalte
On produit les émulsions d’asphalte par un procédé discontinu mélangeant de l’asphalte chaud et une solution aqueuse d’émulsifiant dans un moulin à colloïdes. Ce scénario englobe la formulation d’une solution émulsifiante. D’après les données fournies pour des substances similaires au Programme des substances nouvelles d’Environnement et Changement climatique Canada, et une hypothèse principale, 114 kg de la substance peuvent être utilisés quotidiennement pour formuler la solution émulsifiante, selon le volume quotidien de solution émulsifiante produite et la concentration des amines aliphatiques dans la solution. On suppose également que les effluents d’eaux usées du site industriel sont rejetés dans des UTEU secondaires ou tertiaires. Un résumé des principales hypothèses est fourni dans le document d’ECCC (2021). La CEE non convertie pour ce scénario est de 0,59 µg/L.
Utilisation d’émulsions d’asphalte
Ces substances peuvent être utilisées comme émulsifiants pour les émulsions d’asphalte servant dans la construction ou le resurfaçage de routes, pouvant mener à des rejets de ces substances dans l’environnement par lessivage de l’asphalte des routes. Cependant, la quantification de tels rejets et de leurs concentrations résultantes dans l’environnement est difficile en raison du manque de données sur plusieurs facteurs (voir ECCC 2021). Étant donné ces incertitudes, la CEE issue de l’utilisation d’amines aliphatiques dans les émulsions d’asphalte n’a pas été calculée.
7.2.8 Scénario d’exposition 7 – Formulation et épandage d’engrais
Formulation
Ce scénario prend en compte l’utilisation d’amines aliphatiques comme agents antimottants dans la formulation d’engrais. Il existe différentes méthodes d’ajout pour l’antimottant, mais en ce qui concerne les amines aliphatiques, elles sont habituellement chauffées à une température d’environ 70 °C et évaporées ou distillées sur les matières en vrac à un point du processus de production où le mélange est homogénéisé (BUA 1994). Selon les données présentées dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE, les amines aliphatiques à chaîne(s) longue(s) peuvent être employées comme composant des antimottants qui sont appliqués aux granules de nitrile d’ammonium. Les amines aliphatiques à chaîne(s) longue(s), seules ou dans une dispersion d’huile ou de glycol, peuvent également être ajoutées à des cristaux de potasse dans des moulins de potasse pour réduire l’agglutination de la potasse (Strathdee et coll. 1982). Même s’il existe plusieurs grades de potasse produite, seule celle produite au moyen de la compaction demande l’application d’amines.
Pour un scénario d’exposition d’un site représentatif, les données de l’évaluation des risques associés aux alkylamines primaires de l’Union européenne (EU Risk Assessment of Primary Alkyl Amines) ont été utilisées. Ces données comprennent la quantité transformée d’amines primaires à une installation européenne de production d’engrais inorganique (116 000 kg/an) ainsi que la concentration d’amines dans les engrais (0,004 % à 0,01 %), donnant une production totale estimée d’engrais de 1 160 à 2 900 mégatonnes (Mt) par année. Cette dernière valeur est utilisée pour estimer le coefficient d’émission et les jours d’activité à l’aide d’hypothèses génériques pour ce type d’industrie (CE 2003, TGD tableaux A2.1 et B2.1). On suppose que les effluents d’eaux usées des sites industriels sont rejetés dans des usines de traitement des eaux usées secondaires ou tertiaires. Un résumé des principales hypothèses est présenté dans le document d’ECCC (2021). La CEE non convertie pour ce scénario est de 2,01 µg/L.
Utilisation d’engrais
En plus de servir d’antimottants dans les engrais, les amines aliphatiques à chaîne(s) longue(s) peuvent se retrouver dans des engrais lorsqu’elles sont utilisées comme agents de flottation dans l’extraction minérale (c.-à-d., minerai de potasse) où elles sont adsorbées à la surface des cristaux de minéraux ou des particules de minerai. Même si des amines devraient être rejetées dans le sol lors de l’épandage d’engrais agricole, aucune donnée n’a été trouvée pour quantifier les rejets de cette utilisation et, donc, aucun scénario d’exposition n’a pu en découler.
7.2.9 Scénario d’exposition 8 – Épandage de biosolides sur les terres
Ce scénario prend en compte l’épandage d’amines aliphatiques à chaîne(s) longue(s) sur le sol sous la forme de biosolides. On a calculé la CEE dans le sol comme une prolongation des scénarios décrits ci-dessus, en admettant que certaines des amines aliphatiques qui pénètrent dans une UTEU soient adsorbées par les boues d’épuration, lesquelles pourraient alors être traitées pour produire des biosolides pour l’épandage comme amendement de sols agricoles. Comme scénario le plus défavorable, la CEE sol a été fondée sur le scénario d’exposition dont le rejet quotidien d’amines aliphatiques dans une UTEU est le plus élevé, ce qui correspond au scénario d’exposition 2, transformation (section 7.2.3).
La CEE sol après l’épandage de biosolides pendant 10 ans et compte tenu de la biodégradation comme mécanisme de perte, est calculée en itérant les équations ci‑dessous. Les concentrations ont été déterminées annuellement, immédiatement après l’épandage et à la fin de l’année (après la dégradation, mais avant l’application suivante) sur une période de 10 ans.
Au début de l’année (directement après l’application) :
À la fin de l’année (après dégradation) :
Où :
CEEdébut = CEE dans le sol au début de l’année après l’épandage de biosolides (avant la dégradation) (mg/kg)
CEEfin = CEE dans le sol à la fin de l’année (après la dégradation), avant l’épandage de biosolides suivant (mg/kg)
t = années (a) d’épandage de biosolides sur des terres, variant de 1 à 10 ans
Biodég = valeur de demi-vie de biodégradation dans le sol (jours)
Cs = concentration de la substance dans les biosolides (mg/kg en poids sec)
A = taux annuel d’épandage de biosolides sur les terres (kg/m2-a)
= profondeur de mélange dans le sol (m)
ρ = densité du sol à l’état sec (kg/m3)
Les demi-vies de 16 à 150 jours ont été obtenues par modélisation pour les amines aliphatiques (section 6.2.2). Dans le calcul, on a utilisé la demi-vie de 150 jours. Étant donné cette demi-vie, les amines aliphatiques dans le sol ne se sont pas beaucoup accumulées pendant la période de 10 ans et la concentration dans le sol était maximale après l’épandage (diminuant de façon importante après au cours de l’année). La CEE calculée au début de la 10e année, après l’épandage de biosolides, est de 0,46 mg/kg p.s. Comme la CESE est déterminée à partir d’une concentration nominale (c.-à-d., concentration totale), aucune transformation de la CEE n’est nécessaire pour la sorption. Un résumé des hypothèses est présenté dans le document d’ECCC (2021).
7.3 Caractérisation des risques pour l’environnement
L’approche suivie dans la présente évaluation préalable des risques pour l’environnement était d’examiner les données d’évaluation et de formuler des propositions de conclusions à l’aide d’une méthode de pondération des données probantes et du principe de prudence, comme l’exige la LCPE. On a réuni les données probantes pour déterminer le potentiel des amines aliphatiques à chaîne(s) longue(s) à causer des effets nocifs pour l’environnement au Canada. Les données probantes prises en compte comprennent celles qui étayent directement la caractérisation des risques pour l’environnement (p. ex., critères d’évaluation ou propriétés mesurés), ainsi que celles qui les étayent indirectement (p. ex., classification du danger ou caractéristiques du devenir par d’autres organismes de réglementation).
7.3.1 Analyse du quotient de risque
On a analysé les quotients de risque (QR) en intégrant des estimations de l’exposition (CEE; voir la section 7.2) aux données de toxicité pour l’environnement (CESE; voir la section 7.1) pour déterminer s’il y a un potentiel de causer des effets nocifs au Canada. Dans le cas de la CEE aquatique, les QR ont été transformés pour obtenir les concentrations dissoutes libres. On a calculé les QR en divisant la CEE (convertie) par la CESE pour les milieux environnementaux pertinents et les scénarios d’exposition connexes. Les QR aquatiques pour différentes longueurs de chaînes et différents scénarios de rejets sont présentés au tableau 7-4 pour les monoamines et au tableau 7‑5 pour les diamines, tandis que des précisions sont fournies à l’annexe F.
Les QR calculés aux tableaux 7-4 et 7-5 supposent que la quantité totale rejetée ne se trouve que dans les limites de la fourchette de la longueur des chaînes alkyles prises en compte (p. ex., le QR pour les monoamines en C19-C22 suppose que la quantité totale d’amines aliphatiques rejetée est uniquement des monoamines dont les chaînes alkyles sont en C19-C22). Ce peut être le cas dans certains scénarios, mais ce n’est probablement pas le cas dans d’autres.
Les QR aquatiques pour les monoamines allant jusqu’à C22 et les diamines allant jusqu’à C18 étaient supérieurs à 1 pour bon nombre des scénarios d’exposition. Les monoamines allant jusqu’à C24 ont au moins un scénario d’exposition dont le QR est d’au moins 0,5. Compte tenu de la forte toxicité des amines aliphatiques à chaîne(s) longue(s), leur courbe dose-réponse prononcée et les incertitudes relatives aux CEE, ces scénarios pourraient toujours poser un risque pour l’environnement. Par conséquent, les QR de 0,5 ou plus sont considérés comme préoccupants. Le seul scénario d’exposition aquatique qui indiquait une faible probabilité de poser un risque relativement à toute amine aliphatique à chaîne(s) longue(s) était la production de mousse de polyuréthane souple.
Pour le scénario dans le sol sur l’épandage de biosolides, on a établi un QR de 0,46 à l’aide de la CEE de 0,46 mg/kg p.s. et de la CESE de 1,0 mg/kg p.s. Il n’a pas été possible de calculer le QR dans les sédiments, faute de données sur les concentrations dans les sédiments.
| Scénario | QR (C8-C14) | QR (C15-C18) | QR (C19-C22) | QR (C24) | QR (C26) | QR (C28) | QR (C36) |
|---|---|---|---|---|---|---|---|
| Production | 1,4 | 1,1 | 0,47 | 0,15 | 0,057 | 0,022 | < 0,001 |
| Production et transformation | 4,8 | 3,5 | 1,6 | 0,48 | 0,19 | 0,071 | 0,002 |
| Transformation | 5,5 | 4,1 | 1,8 | 0,56 | 0,22 | 0,083 | 0,002 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 2,3 | 1,7 | 0,77 | 0,24 | 0,093 | 0,035 | 0,001 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | < 0,01 | < 0,01 | < 0,01 | < 0,01 | < 0,01 | < 0,01 | < 0,001 |
| Rejet à l’égout de dérivés d’amines | 0,51 | 0,38 | 0,17 | 0,052 | 0,020 | 0,007 6 | < 0,001 |
| Extraction de minerai de fer | 1,1 | 0,78 | 0,34 | 0,11 | 0,042 | 0,016 | < 0,001 |
| Formulation d’émulsions d’asphalte | 2,5 | 1,8 | 0,82 | 0,25 | 0,10 | 0,038 | 0,001 |
| Formulation d’engrais | 8,6 | 6,3 | 2,8 | 0,87 | 0,34 | 0,13 | 0,003 |
Abréviations : QR, quotient de risque
a Pour les dialkylamines, la somme des atomes de carbones des deux chaînes d’alkyle est utilisée pour le classement dans les catégories de longueur des chaînes alkyles (p. ex., une amine aliphatique 2 × C12 appartient à la catégorie des chaînes de longueur C24).
| Scénario | QR (C8-C14) | QR (C15-C18) | QR (C19-C22) |
|---|---|---|---|
| Production | 1,1 | 0,40 | 0,079 |
| Production et transformation | 3,6 | 1,3 | 0,26 |
| Transformation | 4,2 | 1,5 | 0,3 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 1,8 | 0,64 | 0,13 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | < 0,01 | < 0,01 | < 0,01 |
| Rejet à l’égout de dérivés d’amines | 0,39 | 0,14 | 0,028 |
| Extraction de minerai de fer | 0,80 | 0,29 | 0,057 |
| Formulation d’émulsions d’asphalte | 1,9 | 0,69 | 0,14 |
| Formulation d’engrais | 6,5 | 2,3 | 0,47 |
Abréviation : QR : quotient de risque
7.3.2 Considération des données probantes
Pour caractériser les risques pour l’environnement associés aux amines aliphatiques à chaîne(s) longue(s), on a pris en compte les données techniques pour différentes données probantes (comme mentionné dans les sections pertinentes du présent rapport) et on les a pondérées qualitativement. Les principales données probantes pondérées prises en compte pour déterminer le potentiel des amines aliphatiques à chaîne(s) longue(s) à causer des effets nocifs pour l’environnement au Canada sont présentées à la section 7.3.3 et sont résumées à l’annexe G.
7.3.3 Pondération des données probantes pour déterminer le potentiel de causer des effets nocifs à l’environnement au Canada
Le sous-groupe des amines aliphatiques à chaîne(s) longue(s) englobe les structures variant en poids moléculaire, en longueur et en nombre de chaînes alkyles, en nombre de groupes fonctionnels amines, en présence ou en l’absence d’un groupe fonctionnel éther et en degré de saturation. Même si ces propriétés ne se sont pas révélé avoir d’incidence sur le devenir dans l’environnement ou l’écotoxicité dans l’ensemble du groupe selon l’American Chemistry Council (ACC) (US EPA 2003c, 2003 d), le nombre de groupes amine (p. ex., monoamine ou diamine) et la longueur de la chaîne alkyleont un effet sur les coefficients de distribution déterminés par modélisation. Pour la présente évaluation, on a classé plus finement les amines aliphatiques à chaîne(s) longue(s) par le nombre d’amines présentes et la longueur de la ou des chaînes alkyles pour tenir compte du devenir et de l’exposition. Cependant, à l’instar de la conclusion formulée par l’ACC, l’écotoxicité des amines aliphatiques à chaîne(s) longue(s) a été comparable dans le sous-groupe entier, particulièrement chez les espèces d’algues les plus sensibles. Par conséquent, une CESE est utilisée pour décrire le danger associé au sous-groupe entier des amines aliphatiques à chaîne(s) longue(s), et une conclusion pour la catégorie a été proposée pour les amines aliphatiques à chaîne(s) longue(s), catégorie comprenant les substances des nos CAS 112-90-3 et 68955-53-3, qui ont été traitées séparément antérieurement.
Les analogues utilisés dans la partie sur l’évaluation des substances dans l’environnement étaient des composés d’ammonium quaternaire de longueurs de chaînes alkyles similaires, qui étaient des substances tensioactives cationiques très semblables aux amines aliphatiques à chaîne(s) longue(s), sauf qu’elles sont chargées en permanence. Le degré de confiance est élevé pour l’extrapolation de ces analogues aux amines aliphatiques à chaîne(s) longue(s) pour la plupart des paramètres, bien que d’après les résultats préliminaires d’une étude sur la bioaccumulation, il existe des incertitudes quant à savoir si les composés d’ammonium quaternaire s’accumulent dans les poissons de la même manière que les amines aliphatiques.
Les amines aliphatiques à chaîne(s) longue(s) sont fabriquées ou importées au Canada en volumes importants d’après les données recueillies pour les neuf amines aliphatiques à chaîne(s) longue(s) de la présente évaluation. Les amines aliphatiques à chaîne(s) longue(s) sont largement utilisées dans plusieurs secteurs au Canada, de telle sorte qu’il est très probable que ces substances soient rejetées dans l’environnement au Canada, surtout dans l’eau. En outre, les amines aliphatiques à chaîne(s) longue(s) similaires de nos CAS différents pourraient être interchangeables. En raison de leur utilisation répandue et variée et des caractéristiques UVCB de bon nombre de ces substances, il est très probable que plusieurs amines aliphatiques à chaîne(s) longue(s) soient présentes simultanément dans le milieu récepteur où elles contribueraient collectivement aux risques. Cependant, on n’a trouvé aucune donnée de surveillance sur la concentration de ces substances dans l’environnement au Canada.
En raison de leur nature cationique, les amines aliphatiques à chaîne(s) longue(s) peuvent interagir à la fois de façon ionique et non ionique avec la matière organique et la matière minérale (argile) dans l’environnement, étant sorbées par ces matières. Les coefficients de distribution solides-eau, carbone organique-eau et argile de ces cations augmentent avec l’augmentation de la longueur de la chaîne alkyle et du nombre d’amines présentes.
Les amines aliphatiques à chaîne(s) longue(s) se répartissent également dans les membranes cellulaires par des interactions ioniques et non ioniques, décrites par les coefficients de distribution membranes-eau modélisés et mesurés. Ces coefficients augmentent avec l’augmentation de la longueur de la chaîne alkyle, à l’exception des dialkylamines aliphatiques à chaînes longues, dont les coefficients de distribution sont plus faibles que la somme des longueurs des chaînes alkyles le laisserait penser, en raison des effets stériques (Droge et coll. 2016; Timmer et Droge 2017).
Le poids des données probantes indique que ces substances, une fois dans l’environnement, se dégraderaient relativement rapidement (en quelques jours ou mois) dans un milieu aérobie. Cependant, certaines études sur la dégradation ont révélé des taux de dégradation beaucoup plus faibles, réduisant le degré de confiance sur la persistance faible de ces substances.
Le poids des données probantes indique que certaines monoalkylamines à chaîne longue ont un potentiel de bioaccumulation élevé. Il existe des incertitudes quant à savoir si les dialkylamines à chaînes longues ont un potentiel de bioaccumulation aussi élevé. Compte tenu des données et avec l’application du principe de prudence lorsque les données sont manquantes ou incertaines, il est proposé de conclure que les amines aliphatiques à chaîne(s) longue(s) dont les chaînes alkyles sont plus courtes que C14 ont un potentiel faible à modéré de bioaccumulation dans les organismes aquatiques et que celle dont les chaînes alkyles sont de C14 et plus ont un potentiel élevé de se bioaccumuler. Cependant, en raison de leur propension à être sorbées par les membranes biologiques, on suppose que même ces amines aliphatiques dont le potentiel de bioaccumulation est faible à modéré peut donner lieu à des concentrations élevées localisées d’amines aliphatiques à chaîne(s) longue(s) dans les tissus de surface (p. ex., les branchies chez les poissons) pouvant entraîner des effets toxiques sans que la concentration totale dans l’organisme devienne élevée.
Les organismes dont le ratio surface-poids corporel plus élevé, comme les petits invertébrés (p. ex., D. magna) et les algues unicellulaires, sont davantage touchés par la sorption par les tissus de surface, entraînant une plus grande sensibilité aux amines aliphatiques à chaîne(s) longue(s) par comparaison avec les poissons, une toxicité étant observée de l’ordre de valeurs inférieures au microgramme par litre pour les invertébrés et les algues. Il existe moins de données pour les organismes vivant dans les sédiments ou le sol, bien que les amines aliphatiques à chaîne(s) longue(s) soient quand même relativement toxiques dans ces milieux aussi. En raison de la sorption des amines aliphatiques à chaîne(s) longue(s) par la matière organique et les récipients d’essai lors des essais de toxicité, la quantité de substance biodisponible dans l’essai sera inférieure que la concentration nominale ajoutée. Cela est d’autant plus vrai dans les systèmes d’essais statiques et semi-statiques. Par conséquent, les valeurs de toxicité ont été transformées en concentration mesurée si nécessaire et si possible, et une plus grande valeur a été accordée aux valeurs mesurées.
La sorption influerait également sur la quantité d’amines aliphatiques à chaîne(s) longue(s) biodisponibles dans l’environnement. Les CEE aquatiques ont été converties en concentrations dissoutes libres, représentant ainsi la sorption des amines aliphatiques en COT et permettant une comparaison directe entre les valeurs de la CESE et celles de la CEE lors de l’analyse des risques. Comme les CESE dans sédiments et le sol sont fondées sur les concentrations dans une matrice solide sèche et non sur des concentrations dans de l’eau interstitielle, et comme les concentrations mesurées ne diffèrent pas grandement des concentrations nominales, aucune transformation de ces CEE n’a été nécessaire pour représenter la biodisponibilité dans l’eau interstitielle.
Dans certains scénarios d’exposition, on a supposé des durées de rejets plus courtes, comme lors de la fabrication et la transformation, lesquels sont basés sur des rejets par lot, et cette hypothèse pourrait sous-estimer les rejets annuels. Il est probable que plus d’un lot soit fabriqué ou transformé de façon simultanée ou consécutive pendant l’année, augmentant la quantité totale rejetée, la durée de l’exposition ou les deux.
Une valeur modérée-élevée à élevée est attribuée à tous les QR aquatiques, d’après le degré de confiance dans la valeur et sa pertinence dans l’évaluation (annexe G). Les valeurs estimatives de CEE des amines aliphatiques à chaîne(s) longue(s) dissoutes libres dans les eaux réceptrices sont plus élevées que les CESE pour plusieurs scénarios en milieu aquatique pour les monoamines et les diamines. Même si l’ampleur de la valeur du QR diminue avec l’augmentation de la longueur de la chaîne alkyle, un QR proche (entre 0,5 et 1) ou supérieur à un est constaté dans certains scénarios pour les monoamines allant jusqu’en C24 et les diamines allant jusqu’en C18. D’après les données sur l’utilisation (voir section 4.2), les monoamines allant jusqu’en C18 sont utilisées dans l’extraction de minéraux ainsi que dans la formulation d’engrais, tandis que les monoamines en C16 le sont dans la production de mélanges de polyalcools. Des risques pour l’environnement sont identifiés pour ces longueurs de chaînes alkyles et ces scénarios. D’après les données sur l’utilisation encore, les diamines en C15-C18 sont utilisées dans l’extraction de minéraux et le QR pour cette catégorie de longueurs de chaînes alkyles et ce scénario est de 0,29. Cependant, comme certains paramètres utilisés dans ce scénario entraînent une sous-estimation de la CEE, le QR est probablement plus élevé. Il faut d’autres données pour mieux évaluer les risques associés aux diamines en C15-C18 diamines de ce scénario.
Les QR calculés pour le rejet à l’égout de dérivés d’amines étaient généralement faibles. Bien que le QR calculé du sous-groupe des monoamines en C8-C14 soit de 0,51, cette valeur est considérée comme suffisamment élevée pour indiquer un risque potentiel associé à ces substances, étant donné que l’évaluation de l’exposition n’a tenu compte que d’une fraction des rejets possibles de dérivés d’amines. De même, étant donné que les quantités rejetées et les QR résultants sont sous-estimés, il est reconnu qu’il pourrait également y avoir des préoccupations relativement aux longueurs des chaînes alkyles, bien qu’on ignore la mesure dans laquelle ces QR sont sous-estimés. Le degré de confiance dans les valeurs de QR pour le rejet à l’égout est modéré vu le degré de confiance faible dans la CEE, mais le degré de confiance élevé dans la CESE (annexe G).
Bien que les N-alkylalcanamines de chaînes alkyles plus longues (p. ex., 2 × C13 et plus, correspondant aux catégories de chaînes alkyles en C26 et plus) posent probablement peu de risques en tant que tels, elles peuvent être présentes dans l’environnement avec d’autres amines aliphatiques à chaîne(s) longue(s). Par conséquent, elles pourraient contribuer aux risques globaux en s’ajoutant à la quantité totale d’amines aliphatiques à chaîne(s) longue(s) auxquelles les organismes sont exposés.
Le caractère interchangeable des amines aliphatiques à chaîne(s) longue(s) est préoccupant. Par exemple, même si l’on gère les utilisations d’alcanemonoamines, il pourrait quand même y avoir des effets nocifs pour l’environnement si les N-alkylalcanamines servent de solution de rechange.
Dans la présente évaluation, les activités prises en compte entraînaient principalement une exposition continue, entraînant ainsi une exposition à long terme et un risque accru dans le champ proche (p. ex., près du point de rejet) malgré le caractère biodégradable de ces substances dans l’eau. De plus, les phénomènes de biodégradation et de dilution réduiraient la concentration dans l’eau, diminuant ainsi les risques. Par conséquent, le potentiel de transport à grande distance et les risques en champ lointain devraient être faibles.
Pour déterminer les QR de chaque catégorie de longueur de chaîne alkyle des tableaux 7-4 et 7-5, on a supposé que la quantité totale rejetée ne représentait les amines aliphatiques que d’une catégorie. En réalité, les amines aliphatiques rejetées englobent probablement un grand nombre de catégories de longueurs de chaînes alkyles. Par conséquent, lorsqu’une proportion de la concentration totale d’amines aliphatiques comprend celles de chaînes alkyles plus longues, les risques peuvent diminuer. Cependant, les QR pour les catégories des monoamines en C8-C22 et des diamines en C8-C18 sont suffisamment élevés pour qu’une diminution de la concentration totale pour une catégorie n’annule probablement pas les risques. Il est également peu probable que tous les scénarios soient uniquement constitués de rejets d’amines aliphatiques ayant des chaînes alkyles très longues (p. ex., monoamines en C26 ou plus ou diamines en C19 ou plus). Par conséquent, les risques faibles observés avec l’utilisation d’amines aliphatiques de chaînes alkyles plus longues seulement ne devraient pas se produire dans la plupart des scénarios. Comme on prévoit que les amines aliphatiques à chaîne(s) longue(s) auront une toxicité similaire sur une base d’ions dissous libres, une quantité totale d’amines aliphatiques à chaîne(s) longue(s) dissoutes libres proche de la CESE ou supérieure à celle-ci indiquerait un risque.
En milieu aquatique, les amines aliphatiques à chaîne(s) longue(s) se répartiront dans la matière organique dissoute ou particulaire et les minéraux de la colonne d’eau qui se déposeront sur les sédiments, et seraient sorbées par les sédiments en tant que tels. Même si les amines aliphatiques à chaîne(s) longue(s) devraient se dégrader plutôt rapidement dans les sédiments en aérobie, il ne devrait pas en être ainsi dans les sédiments en anaérobie. Les amines aliphatiques à chaîne(s) longue(s) devraient s’accumuler dans les sédiments anoxiques, surtout près des points de rejets continus. Ces substances pourraient également s’accumuler dans des sédiments aérobies près des points de rejets continus, malgré leur taux de biodégradation élevé, si l’ajout aux sédiments est plus rapide que l’élimination par biodégradation. Cela pourrait être le cas pour les amines aliphatiques dont les chaînes alkyles sont plus longues et qui devraient être sorbées plus solidement par les sédiments, surtout par ceux dont la CEC et la teneur en carbone organique sont plus élevées. Même si les amines aliphatiques présentant des chaînes alkyles très longues peuvent poser un risque plus faible pour le milieu aquatique que celles dotées de chaînes alkyles plus courtes, leur accumulation dans les sédiments peut accroître le risque pour les organismes vivant dans les sédiments. Cependant, à l’heure actuelle, les données sur les concentrations dans les sédiments sont insuffisantes pour permettre de déterminer le niveau de risque que les amines aliphatiques à chaîne(s) longue(s) posent aux organismes vivant dans les sédiments.
Les amines aliphatiques à chaîne(s) longue(s) posent un risque faible aux organismes vivant dans le sol, en raison des faibles concentrations ajoutées aux sols, qui ont été calculées pour le présent scénario d’exposition, et étant donné leur taux de dégradation.
Ces données indiquent que les amines aliphatiques à chaîne(s) longue(s) ont le potentiel de causer des effets nocifs pour l’environnement au Canada.
7.3.4 Sensibilité de la conclusion à l’égard des principales incertitudes
Étant des surfactants cationiques, les amines aliphatiques à chaîne(s) longue(s) sont des substances difficiles à étudier en raison de leur tendance à se concentrer aux interfaces et à être sorbées par des surfaces chargées négativement. Bon nombre des rapports d’études de toxicité en milieu aquatique portant sur ces substances ne fournissent pas de descriptions suffisantes de leurs méthodes d’essai et d’analyse permettant d’évaluer la fiabilité des résultats et, dans la plupart des cas, les données de toxicité ont été fondées sur les concentrations nominales provenant d’essais statiques ou semi-statiques (renouvellement). Les études dans lesquelles les concentrations ont été mesurées dans des récipients d’essai ont indiqué une perte considérable des amines aliphatiques pendant la période d’essai ou la période de renouvellement dans l’eau. Cela était supposé être dû à la sorption par les récipients et la matière organique, ce qui semble indiquer que les résultats fondés sur les concentrations nominales sous‑estimeraient de façon importante la toxicité. Par conséquent, aux fins de la présente évaluation, les données fondées sur les concentrations nominales ont été converties à l’aide des taux de récupération déterminés par analyse, le cas échéant. Il existe des incertitudes dans ces valeurs converties, car les taux de récupération déterminés par analyse pour la série de concentrations n’étaient pas toujours linéaires, mais la concentration entraînant un effet a été calculée suivant l’hypothèse qu’il était linéaire (c.-à-d., en transformation les concentrations nominales en taux de récupérations moyens). Bien que la direction de cette incertitude ne soit pas connue, en raison de la courbe dose-réponse marquée pour ces substances, les valeurs estimatives converties se situent probablement à l’intérieur des limites de l’erreur expérimentale.
Aucune donnée de toxicité en milieu aquatique n’a été trouvée pour toutes les amines aliphatiques à chaîne(s) longue(s) du groupe des amines aliphatiques ni pour toutes les amines aliphatiques n’appartenant pas au groupe des amines aliphatiques qui répondent à la définition d’amine aliphatique à chaîne(s) longue(s). Des valeurs de toxicité ont été trouvées pour un large éventail d’amines aliphatiques à chaîne(s) longue(s) (C8-C18 pour les chaînes alkyles simples, et 2 × C8 à 2 × C17 pour les chaînes dialkyles). Malgré la variabilité élevée entre les essais, les données indiquent que toutes les amines aliphatiques à chaîne(s) longue(s) ont des valeurs de toxicité similaires, surtout pour le groupe taxonomique le plus sensible, les algues. Certains types d’amines aliphatiques sont fortement représentées dans l’ensemble de données, tandis que d’autres ont des points de données très rares pouvant varier largement. Même si d’autres données pourraient apporter des éclaircissements sur la toxicité des amines aliphatiques sous-représentées, il est peu probable qu’elles changeraient la conclusion proposée.
D’après les données sur la bioaccumulation concernant les monoalkylamines aliphatiques, certaines amines aliphatiques se sont révélées avoir une propension très élevée à s’accumuler. Cependant, aucune étude n’a été effectuée sur les dialkylamines aliphatiques. Les études réalisées avec les CAQ dialkyles semblent indiquer que les dialkylamines aliphatiques ont un potentiel de bioaccumulation faible. Cependant, il existe des incertitudes quant à la mesure à laquelle les données de bioaccumulation des CAQ peuvent être extrapolées aux amines aliphatiques, car une étude préliminaire portant sur uniquement deux CAQ semble indiquer que les CAQ s’accumulent différemment des amines aliphatiques dotées de chaînes alkyles de mêmes longueurs.
Il existe des incertitudes quant à la biodisponibilité des amines aliphatiques à chaîne(s) longue(s) dans l’environnement et au degré auquel elle est affectée par la sorption par le carbone organique particulaire et dissous et les sédiments en suspension et de fond. La sorption par le carbone organique a été estimée à l’aide de la concentration médiane de COT, et la CEE aquatique a été convertie en conséquence. Cependant, une estimation similaire dans les sédiments n’a pu être réalisée en raison du degré élevé de variabilité dans les sédiments et des incertitudes associées. Dans certaines situations (p. ex., sédiments présentant des quantités élevées d’argile et de carbone organique), la sorption par les sédiments peut être élevée, entraînant des concentrations plus faibles d’ions dissous libres dans l’eau, tandis que dans d’autres situations (p. ex., les sédiments riches en sable ou en gravier avec peu de carbone organique), la sorption peut être minime. Cependant, il existe également des données probantes que la sorption des amines aliphatiques est réversible, et qu’une désorption est possible dans une certaine mesure. Des données de surveillance dans l’environnement, ainsi que les études sur le terrain visant à examiner la sorption et la répartition des amines aliphatiques à chaîne(s) longue(s) dans les milieux environnementaux, pourraient être utiles pour atténuer ces incertitudes.
Les scénarios d’exposition élaborés pour les substances du groupe des amines aliphatiques l’ont été à partir de données obtenues dans le cadre d’enquêtes réalisées en vertu de l’article 71 de la LCPE, de suivis avec les intervenants et de données provenant de publications scientifiques. Les utilisations de certaines amines aliphatiques à chaîne(s) longue(s) peuvent manquer. Faute de données particulières, on a formulé des hypothèses réalistes afin d’estimer la CEE. Une incertitude importante pour plusieurs des scénarios d’exposition est le degré d’élimination des amines aliphatiques par les UTEU. On a supposé un taux d’élimination de 96 % d’après les études sur les amines aliphatiques primaires résumées dans le document de la CE (2008). Cependant, il existe certaines incertitudes concernant les méthodes utilisées dans ces études. S’il y avait d’autres données sur les taux d’élimination dans les UTEU, elles pourraient entraîner des modifications à la CEE et, peut-être, aux QR déterminés pour les scénarios faisant appel au traitement des eaux usées, dont l’incidence sur les risques n’est pas connue.
Plusieurs scénarios d’exposition ont probablement sous-estimé les concentrations des amines aliphatiques à chaîne(s) longue(s) dans l’environnement. Le scénario de production (scénario d’exposition 1) a pris en compte la concentration des amines aliphatiques dans les eaux réceptrices, depuis les installations où elles sont produites, plus particulièrement pour la campagne de production d’un produit chimique. Les rejets seraient plus importants si plusieurs campagnes avaient lieu simultanément et/ou successivement afin de produire plus de produits chimiques. La CEE et le risque global dans ce scénario sont, par conséquent, probablement sous-estimés. En ce qui concerne le scénario de rejet à l’égout de dérivés d’amines (scénario d’exposition 4), le volume supposé n’englobe que les détergents domestiques et exclut les savons de toilette, les surfactants pour assouplissants, les shampoings et les cosmétiques connexes, ainsi que les nettoyants industriels et institutionnels. Par conséquent, la CEE et le risque global pour ce scénario sont sous-estimés. En ce qui concerne le traitement par flottation du scénario d’extraction de minéraux (scénario d’exposition 5), l’efficacité d’adsorption du collecteur d’amines par la silice a été surestimée, car la désorption à 99 % des amines aliphatiques de la silice en milieu naturel n’a pas été prise en compte, et les débits des effluents utilisés dans le calcul se situaient à l’extrémité supérieure de la fourchette. Les concentrations d’amines aliphatiques en milieu aquatique dans ce scénario pourraient donc être beaucoup plus élevées que la CEE, de telle sorte que le risque global dans ce scénario est probablement sous-évalué. L’exposition des organismes vivant dans les sédiments n’a pu être estimée, car il n’est pas possible actuellement de modéliser la distribution des amines aliphatiques à chaîne(s) longue(s) dans les sédiments. Par conséquent, un prélèvement d’échantillons dans les sédiments est nécessaire pour quantifier le niveau de risque.
En ce qui concerne certaines utilisations ou sources potentielles de rejet, les données ou les outils pour estimer étaient insuffisants pour qu’on puisse élaborer des scénarios d’exposition quantitatifs. Il existe également des incertitudes quant à savoir si l’utilisation d’engrais peut être une source de rejet. L’utilisation d’amines aliphatiques en tant qu’antimottants dans les engrais a été trouvée en Europe, comme utilisation importante, mais on ignore dans quelle mesure elles sont utilisées à cette fin au Canada. D’autres données sur ces sources de rejet possibles pourraient éclairer sur l’attribution des sources, mais n’entraîneraient aucune modification de la conclusion proposée, car il existe plusieurs autres scénarios indiquant un risque.
8. Potentiel de causer des effets nocifs pour la santé humaine
8.1 Benzyldiméthylamine
8.1.1 Évaluation de l’exposition
Milieu environnemental
La benzyldiméthylamine a une pression de vapeur et une solubilité dans l’eau élevées. Aucune donnée de surveillance canadienne sur la présence de benzyldiméthylamine dans l’air in ambiant ou dans l’eau potable n’a été trouvée.
La présence de benzyldiméthylamine dans l’air intérieur a été associée à l’utilisation de mousse de polyuréthane (MPU). Dans un rapport préparé pour la California Environmental Protection Agency, la benzyldiméthylamine a été détectée sous forme de composé organique volatil émis par les thibaudes de mousse de polyuréthane fraîchement installées, où les mesures ont été prises dans une grande cloche à air après l’installation des thibaudes (Hodgson 1999). La benzyldiméthylamine a également été décelée dans l’air après l’application de MPU isolante par pulvérisation dans un vide sanitaire, mais n’a pas été détectée dans la salle de séjour au-dessus du vide sanitaire 144 heures après l’application (Havermans et Houtzager 2014). Les résultats de cette étude étaient limités, car aucune concentration de benzyldiméthylamine dans l’air n’a été trouvée pour la période suivant immédiatement l’application, ou avant les 144 heures suivant l’application. D’après les résultats disponibles et les procédures de réintroduction associées à l’application professionnelle de MPU (non disponible pour les consommateurs) par pulvérisateur, les expositions associées à cette utilisation ont été considérées comme transitoires et minimes, car les concentrations dans l’air devraient diminuer après l’application de MPU par pulvérisateur.
La concentration maximale de benzyldiméthylamine dans un échantillon d’air prélevé à l’intérieur de l’habitacle d’une voiture a été mesurée et était de 6,1 µg/m3 après un prélèvement d’une heure (Rampfl et coll. 2008). L’exposition quotidienne de nourrissons (0 à 5 mois) dans une voiture a été estimée à 4,48 × 10-4 mg/kg p.c./jour, à l’aide de la concentration maximale dans l’air prélevé pendant une heure et en supposant leur présence à trois heures dans la voiture. Pour des précisions sur la méthode et les paramètres utilisés pour calculer ces expositions estimatives, veuillez consulter l’annexe H.
On a utilisé l’outil de modélisation SCREEN3 de l’US EPA (SCREEN3 2011) pour estimer les concentrations de benzyldiméthylamine dans l’air ambiant au Canada, faute de concentrations mesurées dans l’air ambiant, d’après le volume d’importation le plus élevé de l’unique grand importateur de benzyldiméthylamine (Environnement Canada 2013). On a estimé la concentration quotidienne dans l’air à une distance de 1 000 m de l’installation source (représentant la distance avec les zones résidentielles) à 2,68 × 10-3 mg/m3. À l’aide des concentrations quotidiennes estimatives dans l’air, un apport quotidien de 2,0 x 10-4 mg/kg p.c./jour a été estimé pour les nourrissons de 0 à 5 mois nourris aux préparations pour nourrissons. Pour des précisions sur les paramètres et les méthodes utilisées pour calculer les concentrations dans l’air, veuillez consulter l’annexe I.
Les concentrations dans l’eau de surface ont été estimées à l’aide des Drinking Water Spreadsheets de l’Environmental Assessment Unit (EAU) du New Substances Assessment and Control Bureau (NSACB) et du scénario de rejet industriel (Santé Canada 2015a). Pour des précisions sur les paramètres de modélisation, veuillez consulter l’annexe J. À l’aide des volumes d’importation totaux de benzyldiméthylamine au Canada (Environnement Canada, rapport de 2013), le modèle a estimé au 50e centile de la concentration maximale dans l’eau de surface à 5,4 × 10-3 mg/L chez dix plans d’eau récepteurs. On a utilisé cette concentration modélisée dans l’eau de surface pour calculer l’apport quotidien estimatif par l’eau potable; l’exposition la plus élevée par poids unitaire des nourrissons de 0 à 5 mois nourris par préparations pour nourrissons était de 7,1 × 10-4 mg/kg p.c./jour. La concentration dans l’eau de surface obtenue par modélisation à l’aide des volumes d’importation totaux de benzyldiméthylamine en vue d’estimer l’apport quotidien par l’eau potable est considérée comme prudente.
Produits disponibles pour les consommateurs
De la benzyldiméthylamine a été rapportée dans un produit adhésif à l’époxy en deux composants à usage marin au Canada à une concentration maximale de 10 % (SDS 2014d). L’exposition par inhalation et l’exposition par voie cutanée associées au mélange et à l’application de ce produit ont été estimées à l’aide de ConsExpo Web (ConsExpo Web 2017); les paramètres utilisés pour estimer l’exposition sont présentés à l’annexe H. Puisque des volumes égaux des deux composants sont mélangés, la concentration de la benzyldiméthylamine pendant l’application est la moitié de ce qui est présent dans le produit original. Pour des précisions sur l’exposition par voie cutanée et l’exposition par inhalation chez les adultes utilisant ce produit, veuillez consulter le tableau 8-1.
| Scénario d’exposition | Concentration maximalea | Exposition cutanée (mg/kg p.c. par exposition) | Exposition par inhalation (mg/kg p.c. par exposition) | Exposition totale (mg/kg p.c. par exposition) |
|---|---|---|---|---|
| Mélange et application de produit adhésif à l’époxy en deux composants à usage marin | 10 % (mélange) 5 % (application) | 0,135 | 0,169 | 0,304 |
aSDS 2014d
8.1.2 Évaluation des effets sur la santé
Toxicité à doses répétées
Des rapports d’études de détermination de la plage de toxicité dans lesquelles on a administré de la benzyldiméthylamine (dans de l’huile de maïs), par gavage, pendant une période allant jusqu’à sept jours, chez des rats, ont été trouvés dans un dossier d’homologation de REACH (Hazelton UK pour BG Chemie 1990, mentionné dans ECHA 2018a). Bien qu’un nombre limité de doses a été mis à l’essai, la dose maximale tolérée prise en compte varie de 200 à 250 mg/kg p.c./jour d’après les auteurs. Les doses les plus élevées étaient associées à des signes cliniques (p. ex., tremblements, respiration laborieuse, spasmes musculaires, activité réduite), à une toxicité générale comme une perte de poids corporel, et à la mortalité.
Dans le rapport d’une étude à court terme du dossier d’homologation de REACH, des rats Crl:CD(SD)BR (n = 5/sexe/dose) ont reçu 0, 6, 30 ou 150 mg/kg p.c./jour de benzyldiméthylamine (dans de l’huile de maïs), par gavage, pendant 28 jours (BG Chemie 1988, mentionné dans ECHA 2018a). À la dose la plus élevée, les poids absolus et relatifs des testicules étaient légèrement plus élevés que dans le groupe témoin (on ignore si c’est statistiquement significatif), mais ils n’ont pas été considérés comme des effets nocifs en raison de l’absence de corrélation avec des résultats histopathologiques. Les auteurs ont établi une DSENO à 150 mg/kg p.c./jour (dose à l’essai la plus élevée).
Dans une autre étude de 28 jours, des rats Crl:CD(SD) (n = 5/sexe/dose) ont reçu par gavage des doses de 0, 50, 100, 200 ou 400 mg/kg p.c./jour de benzyldiméthylamine (dans de l’huile de maïs), puis les groupes ayant reçu les deux doses les plus élevées ont eu une période de récupération de 14 jours (MHLW 1997; ECHA 2018a). Aux doses égales ou supérieures à 100 mg/kg p.c./jour, on a observé un myosis (dilatation de la pupille) chez les animaux. À 200 mg/kg p.c./jour, d’autres signes cliniques ont été constatés (salivation), accompagnés de changements sur le plan des paramètres hématologiques, de la biochimie clinique et du poids des organes. À l’exception de l’augmentation du poids relatif de la rate et des surrénales, aucun des effets déjà mentionnés n’a montré de relation liée à la dose ou n’a été détecté pendant la période de récupération. La dose la plus élevée a été associée à une réduction importante du poids corporel (lequel est retourné à la normale pendant la période de récupération) et à une forte incidence de mortalité (80 % chez les mâles, 100 % chez les femelles) commençant deux semaines après le traitement. Les auteurs ont établi une DSENO de 50 mg/kg p.c./jour, d’après un myosis observé à 100 mg/kg p.c./jour. Cependant, en raison de l’absence de myosis pendant la période de récupération (ce qui semble indiquer que cet effet est réversible), une DSENO de 100 mg/kg p.c./jour déterminée d’après une toxicité générale (c.-à-d., salivation, anomalies sur le plan hématologique, de la biochimie clinique et variations du poids des organes) est considérée comme appropriée pour la caractérisation des risques.
Des rapports d’études d’exposition par inhalation à court terme (5 à 8 jours) ont été trouvés dans le dossier d’homologation de REACH, dans lesquelles des chats, des lapins, des cobayes, des rats et des souris ont été exposés, intégralement, à des doses allant jusqu’à 0,989 mg/L de benzyldiméthylamine (équivalant à environ 989 mg/m3) (anonyme 1956, mentionné dans ECHA 2018a; anonyme 1957, mentionné dans ECHA 2018a). Des signes cliniques et de la mortalité ont été observés. Une étude d’exposition subchronique par inhalation a également été trouvée, où des rats été exposés à 100 à 200 mg/m3 de benzyldiméthylamine pendant 2 heures chaque jour pour une période de 3 mois ont présenté des signes d’irritation respiratoire locale et de toxicité générale (c.‑à‑d., des effets sur les reins, le foie, la rate et les poumons) (Stasenkova et coll. 1963, mentionné dans ECHA 2018a). L’exposition à des doses plus faibles (c.‑à‑d., 30 à 40 mg/m3) pendant une plus longue période (c.-à-d., 6 mois) a entraîné des effets similaires. Toutefois, en raison de l’absence de groupes témoin, ces études ont été d’une utilité limitée pour la caractérisation des risques.
Toxicité pour le développement et la reproduction
Dans une étude de toxicité sur le développement prénatal réalisée conformément à l’essai no 414 des Lignes directrices de l’OCDE, des rates Sprague-Dawley en gestation (n = 24/dose) ont reçu 0, 35, 75 ou 150 mg/kg p.c./jour de benzyldiméthylamine (dans de l’huile d’arachide), par gavage, du jour gestationnel (JG) 5 au JG 19 (soit pendant 14 jours) (Présentation d’étude 2013). À la dose la plus élevée de 150 mg/kg p.c./jour, on a rapporté une réduction prononcée de la prise de poids corporel (- 41 %), accompagnée d’une réduction de la consommation d’aliments (- 13 %). Aucun autre effet lié au traitement sur la reproduction (indice de fertilité, indice de gestation) ou sur le fœtus en développement (viabilité du fœtus, poids du fœtus, rapport de masculinité, croissance, développement, anomalies et malformations externes, du squelette et des viscères) n’a été rapporté aux doses allant jusqu’à 150 mg/kg p.c./jour. La DSENO pour la toxicité maternelle a été déterminée par les auteurs à 75 mg/kg p.c./jour d’après la toxicité générale (diminution du poids corporel). Aucun effet sur la reproduction ou le développement n’a été observé jusqu’à la dose à l’essai la plus élevée (c.‑à‑d., 150 mg/kg p.c./jour).
Génotoxicité et cancérogénicité
La benzyldiméthylamine ne devrait pas être génotoxique, étant donné les données provenant d’essais du pouvoir mutagène sur bactéries, d’un essai de mutation génique sur cellules de mammifères et d’un test du micronoyau in vivo (ECHA 2018a). En ce qui concerne la cancérogénicité, aucune tumeur n’a été observée dans une étude de 100 jours réalisée sur des lapins auxquels on a administré environ 1060 mg/kg p.c./jour de benzyldiméthylamine dans de l’eau potable (Schneider et coll. 1977) ni alerte structurale liée au cancer n’a été signalée par un logiciel de modélisation (Boîte à outils QSAR de l’OCDE 2017).
8.1.3 Caractérisation des risques pour la santé humaine
L’étude de toxicité pour le développement prénatal (Présentation d’étude 2013) a été utilisée pour la caractérisation des risques après des expositions intermittentes et chroniques à la benzyldiméthylamine, car elle montrait l’effet sur la santé le plus sensible de l’ensemble de données disponible. La toxicité générale (c.-à-d., diminution importante du poids corporel) s’est révélée être l’effet critique de la benzyldiméthylamine et une DSENO maternelle de 75 mg/kg p.c./jour a été trouvée. Cette concentration d’effet ne cause aucun autre effet général (p. ex., un myosis) observé dans les études à long terme connues sur cette substance.
Le tableau 8-2 présente l’exposition estimative, les concentrations d’effets critiques et les marges d’exposition résultantes pertinentes pour la caractérisation des risques pour la santé humaine associés à la benzyldiméthylamine provenant de produits disponibles pour les consommateurs (y compris la MPU de l’habitacle des voitures) et du milieu environnemental (air extérieur et eau potable).
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration de l’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Produit adhésif à l’époxy en deux composants à usage marin; inhalation et voie cutanée; intermittente | Adulte | 0,304 | 75 | 247 |
| MPU de l’habitacle d’une voiture; inhalation; quotidienne | 0-5 mois | 4,48 × 10-4 | 75 | 167 410 |
| Milieu environnemental; voie orale et inhalation; chronique | 0-5 mois | 9,1 × 10-4 | 75 | 82 418 |
a DSENO de 75 mg/kg p.c./jour établie d’après la présence d’une toxicité générale (c.-à-d., diminution du poids corporel chez les mères) observée à la concentration de dose suivante de 150 mg/kg p.c./jour, provenant d’une étude sur le développement prénatal réalisée chez le rat.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.1.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau 8-3 ci‑dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Aucune étude d’exposition par voie cutanée n’a été réalisée sur la benzyldiméthylamine tandis que les études réalisées par inhalation ont été considérées comme limitées. Une extrapolation d’une voie d’exposition à une autre provenant d’études d’exposition par voie orale a été appliquée pour la caractérisation des risques après expositions par ces voies. L’absorption par la voie cutanée et par inhalation a été considérée comme équivalente à l’absorption par la voie orale. | +/- |
| Aucune étude de toxicité chronique par voie orale n’a été trouvée pour la benzyldiméthylamine. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous-estimation du risque.
8.2 Éthylènediamine
8.3.1 Évaluation de l’exposition
Milieu environnemental
L’éthylènediamine a une pression de vapeur élevée et une solubilité dans l’eau très élevée. Aucune information sur les valeurs mesurées dans l’environnement au Canada n’a été trouvée pour l’éthylènediamine. L’utilisation de l’éthylènediamine comme intermédiaire réactionnel pourrait entraîner le rejet d’émissions dans l’air et les eaux usées (PubChem 2004-2020).
Les concentrations estimatives dans l’eau de surface ont été calculées à l’aide des Drinking Water Spreadsheets de l’EAU du NSACB et du scénario de rejet industriel (Santé Canada 2015a) avec les volumes importés totaux déclarés d’éthylènediamine au Canada (Environnement Canada 2013). La concentration modélisée résultante au 50e centile dans l’eau de surface parmi les 10 plans d’eau récepteurs de 1,7 × 10-3 mg/L entraîne l’apport quotidien estimatif le plus élevé par poids unitaire de 6,0 × 10-5 mg/kg p.c./jour chez les enfants d’un an. Pour des précisions sur les paramètres du modèle, veuillez consulter l’annexe J. L’utilisation d’une concentration modélisée dans l’eau de surface faisant appel au volume importé total déclaré au Canada est considérée comme prudente.
On a utilisé l’outil de modélisation SCREEN3 de l’US EPA pour estimer les concentrations d’éthylènediamine dans l’air ambiant au Canada d’après le volume importé le plus élevé du plus important importateur d’éthylènediamine (Environnement Canada 2013). Une concentration quotidienne dans l’air à une distance de 500 m de l’installation source par rapport aux zones résidentielles a été estimée à 0,20 mg/m3. Ces résultats de l’apport quotidien estimatif le plus élevé par poids unitaire par l’air ambiant de 2,42 × 10-2 mg/kg p.c./jour chez les enfants d’un an. Pour des précisions sur les paramètres utilisés pour calculer les concentrations dans l’air, veuillez consulter l’annexe I.
Aliments
L’éthylènediamine peut être utilisée comme agent antimicrobien dans la fabrication du papier servant à des applications d’emballage alimentaire comme du papier ou du carton, et comme composant dans la fabrication d’encres et d’adhésifs destinés aux matériaux d’emballage d’aliments. Cependant, une exposition par voie alimentaire découlant de ces utilisations est négligeable ou nulle, soit parce que la substance n’est pas présente, soit elle est présente en quantités négligeables dans le matériau d’emballage fini, ou parce que le composant contenant de l’éthylènediamine n’a aucun contact direct avec les aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 10 janvier 2017; sans référence).
L’éthylènediamine est un produit de formulation de produits antiparasitaires homologués au Canada. L’ACIA surveille divers produits chimiques, dont les résidus et les métabolites de pesticides, dans un grand éventail de produits agricoles, ainsi que dans certains aliments transformés (ACIA 2019). Il existait dix ans de données sur la présence de cette substance recueillies par l’ACIA pour l’éthylènediamine dans les aliments (ACIA 2019) pour l’évaluation de l’exposition par voie alimentaire. Les taux de détection positifs (c.-à-d., échantillons dans lesquels se trouvaient des concentrations d’éthylènediamine supérieures au seuil de détection [SD; fourchette de 0,008 à 0,08 µg/g]) variaient de 2 % à 31 %, selon la catégorie d’aliments. Les concentrations moyennes d’éthylènediamine dans chacune des catégories ont été estimées. Les catégories dans lesquelles les concentrations déclarées des échantillons étaient inférieures à leur SD, ont été prudemment établies en fonction de leur SD respectif (annexe J). Ces concentrations moyennes ont servi à estimer l’exposition par voie alimentaire.
Les concentrations moyennes d’éthylènediamine pour une catégorie d’aliments donnée variaient de 0,029 µg/g dans les noix à 0,096 µg/g dans les produits céréaliers (annexe K).
Les expositions à l’éthylènediamine par voie alimentaire estimées pour « toutes les personnes » à l’aide de la méthode décrite à l’annexe K, sont présentées au tableau 8‑4. La catégorie d’aliments « produits céréaliers » a contribué le plus à l’exposition à l’éthylènediamine par voie alimentaire. L’apport alimentaire quotidien le plus élevé par poids unitaire chez les nourrissons d’un an au 90e centile est de 5,9 × 10-3 mg/kg p.c./jour.
| Groupe d’âge, de sexe masculin et féminin (ans) | Moyenne (mg/kg p.c./jour) | 90e centile (mg/kg p.c./jour) |
|---|---|---|
| 1 | 2,6 × 10-3 | 5,9 × 10-3 |
| 2 à 3 | 2,7 × 10-3 | 5,7 × 10-3 |
| 4 à 8 | 2,0 × 10-3 | 4,2 × 10-3 |
| 9 à 13 | 1,2 × 10-3 | 2,6 × 10-3 |
| 14 à 18 | 8,0 × 10-4 | 2,0 × 10-3 |
| 19 et plus | 7,0 × 10-4 | 1,6 × 10-3 |
Produits disponibles pour les consommateurs
La présence d’éthylènediamine a été déclarée en concentrations faibles (0,25 %) dans du cirage (ECCC 2016b) et l’exposition par voie cutanée résultante associée à l’utilisation de ce produit a été estimée à 3,4 × 10-3 mg/kg p.c./jour chez les adultes. Les expositions estimatives par voie cutanée pour ce scénario ont été calculées à l’aide de ConsExpo Web (2017) (voir l’annexe H). L’éthylènediamine est utilisé dans d’autres types de produits (adhésifs et enduits, détergents à lessive et à vaisselle, et peintures et enduits). Cependant, selon le suivi auprès des intervenants, on a déterminé que ces produits n’étaient pas offerts aux consommateurs, ou que l’exposition estimative à ces produits était inférieure à celle du cirage, qui a été considéré comme un scénario sentinelle.
8.2.2 Évaluation des effets sur la santé
L’éthylènediamine a été examinée à l’étranger par l’OCDE dans son rapport d’évaluation initial (Initial Assessment Report [SIAR]) du Screening Information DataSet (SIDS) (OCDE 2004) et par l’Organisation mondiale de la Santé (OMS) dans un résumé succinct international sur l’évaluation des risques chimiques (CICAD) (OMS 1999). Les données toxicologiques de ces évaluations ont été prises en compte dans la caractérisation des effets de l’éthylènediamine sur la santé. Une recherche documentaire a été menée et aucune étude sur les effets sur la santé, ayant pu avoir une incidence sur l’évaluation des effets sur la santé (c.-à-d., entraîner des différences sur les critères d’effets critiques ou abaisser les points de départ par rapport à ceux déterminés dans le SIAR ou le CICAD de l’OCDE), n’a été trouvée.
Dans ces évaluations, les critères d’évaluation dotés de données limitées ont été traités grâce aux données du dichlorhydrate d’éthylènediamine, car l’éthylènediamine devrait être transformée en sel en raison de la présence naturelle d’acide chlorhydrique dans l’estomac (OCDE 2004). Yang et coll. (1983) ont également montré que l’éthylènediamine et ses sels présentaient une toxicité par voie orale similaire par comparaison avec les concentrations entraînant un effet des études de toxicité aiguë de 7 jours et de 90 jours, lorsque modifiées pour tenir compte du poids moléculaire.
Toxicité à doses répétées
Les effets de l’éthylènediamine après une exposition à court terme par inhalation ont été étudiés par Pozzani et Carpenter (1954). Dans cette étude, des rats de lignée Sherman (n = 15/sexe/groupe) ont été exposés à 0, 59, 132, 225 et 484 ppm d’éthylènediamine (équivalant à environ 0, 145, 324, 553 et 1190 mg/m3, respectivement) pendant 30 jours. Les animaux ont ensuite été sacrifiés et un examen histopathologique des poumons, du cœur, du foie, des reins, des surrénales et de la rate a été effectué. À la concentration la plus faible (145 mg/m3), aucun effet nocif lié au traitement n’a été observé. À 324 mg/m3, aucun dommage important aux tissus n’a été constaté, sauf un léger effet dépilatoire. Aux concentrations les plus élevées, le traitement a causé de la mortalité, une « dégénérescence albumineuse » du foie, une « dégénérescence albumineuse » et une dégénérescence des tubules rénaux, une congestion des poumons et une congestion du cortex surrénalien. Les auteurs ont indiqué que le traitement à 324 mg/m3 n’a produit aucun effet toxique détectable sur les rats, dose qui a été considérée comme une CSENO.
L’OCDE (2004) a trouvé une étude d’exposition à court terme par voie alimentaire, où des rats F344 et des souris B6C3F1 (n = 5/sexe/groupe) ont reçu du dichlorhydrate d’éthylènediamine par gavage pendant environ 2 semaines (Peters 1982, mentionné dans OCDE 2004). Les rats ont reçu l’équivalent de 0, 100, 200, 400, 800 ou 1600 mg/kg p.c./jour d’éthylènediamine (base) tandis que les souris ont été exposées à l’équivalent de 0, 50, 100, 200, 400 ou 600 mg/kg p.c./jour d’éthylènediamine (base). Chez les rats, les deux doses les plus élevées ont été associées à de la mortalité, à des signes cliniques, à des lésions aux reins et à une déplétion ou nécrose lymphoïde. L’OCDE (2004) a trouvé une DSENO à 100 mg/kg p.c./jour chez les rats (aucune justification fournie). Des effets similaires ont été observés chez les souris.
Dans une étude de 13 semaines, on a administré à des rats F344 (n = 10/sexe/groupe) 0, 100, 200, 400, 600 ou 800 mg/kg d’éthylènediamine par gavage (sous forme de dichlorhydrate d’éthylènediamine dans de l’eau distillée) (Peters 1982, mentionné dans OCDE 2004; NTP 1982a, mentionné dans OMS 1999). À 600 et à 800 mg/kg p.c./jour, des signes cliniques (respiration haletante, éternuements et plissement des yeux) ont été notés. En outre, il y a eu des lésions des tubules rénaux, des lésions utérines et une diminution de la prise de poids corporel. Pour bon nombre des organes examinés, les poids relatifs étaient soit les mêmes soit liés à des poids corporels plus faibles. Quelle que soit la dose, des changements histopathologiques ont été observés dans les yeux. L’OCDE a trouvé une DMENO de 100 mg/kg p.c./jour d’éthylènediamine.
L’OCDE a également rapporté les résultats d’une étude similaire de 13 semaines réalisée sur des souris B6C3F1 (n = 10/sexe/groupe), où 0, 25, 50, 100, 200 ou 400 mg/kg p.c./jour d’éthylènediamine ont été administrés par gavage (sous forme de dichlorhydrate d’éthylènediamine dans de l’eau de laboratoire) (Peters 1982, mentionné dans OCDE 2004). La dose la plus élevée a été associée à des changements histopathologiques dans les reins (dégénérescence légère à modérée et/ou nécrose de l’épithélium des tubules rénaux). Une souris ayant reçu une dose élevée est morte, tandis qu’une autre a eu une cataracte dans un œil, ce qui pourrait ou pas avoir de lien avec le traitement. L’OCDE a trouvé une DSEO de 200 mg/kg p.c./jour d’éthylènediamine.
Yang et coll. (1983) ont également mené une étude d’exposition subchronique par voie alimentaire où des rats F344 (n = 10/sexe/groupe) ont reçu 0, 50, 250 ou 1 000 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine dans leur alimentation pendant 3 mois, ce qui était équivalent à environ 0, 22,5, 112,5 et 450 mg/kg p.c./jour d’éthylènediamine. À la dose la plus faible, seulement une légère réduction de la consommation d’eau a été observée chez les rates. À la dose intermédiaire, une augmentation de l’alanine aminotransférase a été observée. À la dose la plus élevée, la prise de poids corporel était réduite de façon importante tout au long de l’étude, réduction qui était accompagnée par une diminution de la consommation de nourriture et d’eau chez les femelles. En ce qui concerne la chimie clinique, une importante diminution du glucose sérique et une augmentation des concentrations d’enzymes (phosphatase alcaline, aspartate aminotransférase et alanine aminotransférase), qui semblent indiquer des dommages au foie, ont été observées chez les animaux traités à une dose élevée également. Les changements histologiques les plus importants, appelés « pléomorphismes des cellules hépatiques », étaient dans le foie, et consistaient en une augmentation de la taille des hépatocytes et des noyaux des hépatocytes, une augmentation de la variation de la taille et de la forme du noyau et une augmentation du nombre d’hépatocytes multinucléés. Une dégénérescence occasionnelle des hépatocytes a également été observée. L’OCDE (2004) a trouvé une DSENO de 50 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine (équivalant à environ 22,5 mg/kg p.c./jour d’éthylènediamine), établie apparemment à partir de l’augmentation des concentrations d’alanine aminotransférase à la dose suivante (250 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine ou 112,5 mg/kg p.c./jour d’éthylènediamine).
Les effets de l’éthylènediamine suivant une exposition chronique ont été étudiés dans une étude où des rats F344 (n = 100-120/sexe/groupe) ont reçu 0, 20, 100 et 350 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine pendant 24 mois (Hermansky et coll. 1999), ce qui était équivalent à environ 0, 9, 45 et 158 mg/kg p.c./jour d’éthylènediamine. À la dose la plus élevée, une mortalité significativement plus élevée a été observée. En outre, il y a eu des diminutions de la prise de poids corporel (jusqu’à 23 %) et des effets hématologiques comme une diminution légère du nombre de globules rouges, de l’hémoglobine et de l’hématocrite (analyses statistiques non réalisées). Une réduction légère du poids absolu du foie et des reins a été observée chez les mâles, mais ce changement n’était pas évident pour le poids corporel. Chez les rats femelles, les poids absolu et relatif du foie et des reins ont augmenté. La principale lésion observée chez les animaux des groupes ayant reçu la dose intermédiaire et la dose élevée a été un pléomorphisme des cellules hépatiques. L’incidence des lésions inflammatoires des voies respiratoires supérieures a également augmenté. À la dose intermédiaire, on a observé également une augmentation significative de la mortalité. Une augmentation du poids absolu du foie et des reins a été constatée chez les femelles, accompagnée d’un pléomorphisme des cellules hépatiques. Les auteurs ont trouvé une DSEO de 20 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine (équivalant à 9 mg/kg p.c./jour d’éthylènediamine).
Toxicité pour le développement et la reproduction
Dans une étude de toxicité pour le développement dans laquelle on a administré à des lapines en gestation du dichlorhydrate d’éthylènediamine par gavage à des doses allant jusqu’à 178 mg/kg p.c./jour (équivalant à 80 mg/kg p.c./jour d’éthylènediamine), aucun effet lié au traitement n’a été observé chez les mères et les fœtus (NTP 1993).
Dans une autre étude de toxicité pour le développement, des rates F344 en gestation (n = 20 femelles/groupe) ont reçu 0, 50, 250 et 1 000 mg/kg/jour de dichlorhydrate d’éthylènediamine par voie alimentaire du JG 6 au JG 15 (DePass et coll. 1987a), ce qui est équivalent à environ 0, 27, 140 et 470 mg/kg p.c./jour d’éthylènediamine. Les mères des groupes ayant reçu la dose intermédiaire et la dose élevée ont connu une diminution significative de la prise de poids et une diminution de la consommation de nourriture par rapport aux sujets des groupes témoin. Les fœtus du groupe ayant reçu la dose élevée ont montré une réduction significative du poids des fœtus et de la longueur vertex-coccyx. Parmi les autres résultats, on compte une augmentation significative du pourcentage des portées avec résorptions, des fœtus présentant des variations squelettiques et des fœtus dont le tronc artériel brachiocéphalique est manquant ou raccourci.
Pour distinguer l’effet du traitement de celui de la diminution de la consommation de nourriture, on a mené une expérience animal-témoin nourris ensemble. Des rates en gestation ont été placées dans un groupe de traitement (1 000 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine équivalant à 470 mg/kg p.c./jour d’éthylènediamine), dans un groupe de sujets non traités avec nourriture à volonté et dans un groupe animal-témoin nourris ensemble avec une quantité de nourriture comparable à celle des sujets du groupe de traitement. Lorsque comparé aux groupes non traités et aux groupes animal-témoin nourris ensemble, le groupe de traitement a présenté une réduction du poids corporel des fœtus, de la longueur vertex-coccyx et de la longueur du tronc artériel brachiocéphalique. Les auteurs ont indiqué qu’un tronc artériel brachiocéphalique raccourci n’est pas considéré comme un « effet tératologique », puisqu’il ne découlerait pas d’une déficience fonctionnelle et serait peut-être réversible. L’OCDE (2004) a trouvé une DSEO de 50 mg/kg p.c./jour établie d’après la toxicité maternelle et une DSEO de 250 mg/kg p.c./jour établie d’après la toxicité pour les fœtus aux doses suivantes, ce qui correspond à environ 27 et 140 mg/kg p.c./jour d’éthylènediamine, respectivement.
Aucun effet n’a été déclaré dans une étude de toxicité pour la reproduction sur deux générations, où des rats Fischer 344 (n = 25-26/sexe/groupe) ont reçu jusqu’à 500 mg/kg p.c./jour de dichlorhydrate d’éthylènediamine dans l’alimentation (équivalant à environ 226 mg/kg p.c./jour d’éthylènediamine) (Yang et coll. 1984).
Génotoxicité et cancérogénicité
L’éthylènediamine ne devrait pas être génotoxique d’après les données d’essais sur la mutagénicité et la clastogénicité (OCDE 2004; Domoradzki 1979, mentionné dans OCDE 2004; Gee et coll. 1998; Guzzie et Slesinski 1987; Hedenstedt 1978; Haworth et coll. 1983; Leung 1994; Mueller et Dabney 1979; NTP 1983, 1984a, 1984b, 1985, 1986; Slesinski et coll. 1983; Zimmering et coll. 1985). En ce qui concerne la cancérogénicité, l’éthylènediamine appartient actuellement au classement D (non classifiable quant à sa cancérogénicité pour l’être humain). Chez les rats, aucune augmentation liée au traitement de l’incidence des tumeurs n’a été observée dans une étude de toxicité chronique (Hermansky et coll. 1999) ou dans une étude de badigeonnage de la peau tout au long de la vie (DePass et coll. 1984).
Sensibilisation
L’éthylènediamine entraînerait une sensibilisation des voies respiratoires en raison de l’induction de symptômes respiratoires en contexte professionnel (OCDE 2004). Des symptômes tels que de la toux, des éternuements, des rhinites, une respiration sifflante, une dyspnée ont été déclarés dans des études épidémiologiques (Pozzani et Carpenter 1954; Nakazawa et Matsui 1990; Ng et coll. 1991; Ng et coll. 1995; Villar-Gomez et coll. 2009; Lewinsohn et Ott 1991; Hagmar et coll. 1982; Aldrich et coll. 1987; Lam et Chan-Yeung 1980; Gelfand 1963). La concentration la plus faible qui serait associée à une sensibilisation était de 1 ppm (équivalant à environ 2,5 mg/m3), bien qu’il existe des incertitudes associées à cette concentration, puisque les concentrations dans l’air déterminées par analyse n’ont pas été fournie provided (Aldrich et coll. 1987). D’après ces données, un point de départ fiable n’a pu être déterminé aux fins de l’évaluation des risques.
8.2.3 Caractérisation des risques pour la santé humaine
Bien qu’aucune étude menée à l’aide de l’éthylènediamine n’a pu être trouvée, les données pour le dichlorhydrate d’éthylènediamine ont été utilisées pour éclairer l’évaluation pour ces voies étant donné leurs profils de toxicité similaires et la transformation prévues en chlorhydrate dans des conditions physiologiques. L’étude de 3 mois réalisée par Yang et coll. (1983) à l’aide de dichlorhydrate d’éthylènediamine a servi à la caractérisation des risques après des expositions intermittentes. Une DSENO de 22,5 mg/kg p.c./jour d’éthylènediamine a été établie d’après l’augmentation de la concentration d’alanine aminotransférase à la dose suivante (112,5 mg/kg p.c./jour).
En ce qui concerne les scénarios de toxicité chronique par les voies orale et cutanée, l’étude d’exposition par voie alimentaire de 2 ans menée par Hermansky et coll. (1999) à l’aide du dichlorhydrate d’éthylènediamine a servi à la caractérisation des risques. Une DSENO de 9 mg/kg p.c./jour d’éthylènediamine a été établie d’après des effets sur le foie (pléomorphisme des cellules hépatiques), sur les voies respiratoires supérieures (inflammation) et la mortalité à la dose suivante (45 mg/kg p.c./jour).
En ce qui concerne l’exposition par inhalation, l’étude de 30 jours menée par Pozzani et Carpenter (1954) a été utilisée pour la caractérisation des risques. Une CSENO de 324 mg/m3 a été établie d’après des effets sur le foie, les reins, les poumons, les surrénales et la mortalité à la dose suivante (553 mg/m3). Le tableau 8-5 présente toutes les expositions estimatives pertinentes, les concentrations entraînant un effet critique et les marges d’exposition résultantes pour la caractérisation des risques pour la santé humaine associés à l’éthylènediamine.
| Scénario d’exposition | Population | Exposition estimative | Concentration d’effet critique | ME |
|---|---|---|---|---|
| Cirage, cutanée, intermittente | Adulte | 3,4 × 10-3 mg/kg p.c./jour | 22,5 mg/kg p.c./joura | 6 618 |
| Apport d’aliments et d’eau potable, orale, chronique | 1 an | 5,96 × 10-3 mg/kg p.c./jour | 9 mg/kg p.c./jourb | 1 510 |
| Air ambiant au voisinage d’une installation industrielle; par inhalation, chronique | 1 an | 0,20 mg/m3 | 324 mg/m3c | 1 620 |
a Une DSENO de 22,5 mg/kg p.c./jour d’éthylènediamine a été établie d’après une augmentation de la concentration d’alanine aminotransférase à la dose suivante (112,5 mg/kg p.c./jour) provenant d’une étude d’exposition par l’alimentation de 3 mois menée chez les rats.
b Une DSENO de 9 mg/kg p.c./jour d’éthylènediamine a été établie d’après des effets sur le foie (pléomorphisme des cellules hépatiques), sur les voies respiratoires supérieures (inflammation) et sur la mortalité à la dose suivante (45 mg/kg p.c./jour), provenant d’une étude d’exposition par les aliments de 2 ans menée chez les rats.
c Une CSENO de 324 mg/m3 a été établie d’après des effets sur le foie, les reins, les poumons, les surrénales et la mortalité à la dose suivante (553 mg/m3), provenant d’une étude de 30 jours menée chez les rats.
Ces ME sont considérées comme suffisantes pour tenir compte des incertitudes relatives aux effets sur la santé et aux bases de données sur l’exposition.
Bien que l’éthylènediamine soit associée à une sensibilisation des voies respiratoires (OCDE 2004), il n’existe actuellement aucune source d’exposition par inhalation associée à l’utilisation de la substance ou à l’air intérieur. L’exposition par inhalation la plus élevée à cette substance est par l’air extérieur (estimation par modélisation à l’aide d’hypothèses prudentes), ce qui est plus de 10 fois plus faible que la concentration minimale entraînant un effet rapportée être associée à l’induction de symptômes (moins de 1 ppm, équivalant à 2,5 mg/m3) (Aldrich et coll. 1987). Par conséquent, la sensibilisation des voies respiratoires ne devrait pas être préoccupante aux concentrations d’exposition actuelles.
8.2.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Des SD pour une catégorie d’aliments donnée ont été utilisés lorsque la concentration déclarée dans les échantillons était inférieure au SD. | + |
| L’extrapolation d’une voie à une autre des études d’exposition par voie orale a été appliquée pour la caractérisation des risques après une exposition cutanée. L’absorption par la voie cutanée a été considérée comme équivalente à l’absorption par la voie orale. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.3 2,2’-Iminodi(éthylamine)
8.3.1 Évaluation de l’exposition
Milieu environnemental
La 2,2’-iminodi(éthylamine) a une pression de vapeur modérée et est « miscible » dans l’eau. Aucune donnée canadienne sur les concentrations dans l’air intérieur et extérieur de la 2,2’-Iminodi(éthylamine) n’a été trouvée.
Comme la 2,2’-iminodi(éthylamine) est miscible dans l’eau, les concentrations dans l’eau de surface ont été calculées à l’aide du scénario de rejet industriel (Santé Canada 2015a) (précisions sur les paramètres de la modélisation à l’annexe J). La concentration maximale dans l’eau de surface au 50e centile modélisée résultante parmi les 10 plans d’eau récepteurs de 5,2 × 10-3 mg/L repose sur les volumes importés totaux déclarés dans le cadre d’une enquête réalisée en vertu de l’article 71 de la LCPE (Environnement Canada 2013), ce qui correspond à l’apport quotidien estimatif le plus élevé (par poids unitaire) de 6,8 × 10-4 mg/kg p.c./jour pour les nourrissons de 0 à 5 mois nourris par préparations pour nourrissons. L’utilisation d’une concentration dans l’eau de surface, modélisée à l’aide du volume d’importation total de 2,2’‑Iminodi(éthylamine) au Canada pour estimer l’apport par l’eau potable, est considérée comme prudente.
Aliments
La 2,2’-iminodi(éthylamine) peut être utilisée comme composant dans la fabrication de matériaux d’emballage d’aliments, comme matière première dans un agent de rétention pour la fabrication d’emballages pour aliments en papier pouvant être en contact direct avec les aliments. L’exposition découlant de cette utilisation est considérée comme négligeable. La substance peut également être utilisée comme composant dans les produits destinés à la formulation d’encres à appliquer sur les surfaces extérieures de matériaux pour des applications d’emballage d’aliments et comme composant dans des produits destinés à la formulation d’adhésifs à appliquer sur les couches du centre des matériaux d’emballage d’aliments, auxquels aucune exposition n’est prévue puisqu’il n’y a aucun contact avec des aliments (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 10 janvier 2017; sans référence).
Produits disponibles pour les consommateurs
La 2,2’-iminodi(éthylamine) a été isolée dans deux produits à l’époxy en deux composants, qui consiste en une colle époxy et un agent de remplissage à l’époxy à usage marin, jusqu’à 1 % (SDS 2015; 2018b). La colle époxy en deux composants est conçue pour être utilisée dans de petits projets de bricolage, comme coller les pièces d’un vase brisé, tandis que l’agent de remplissage à l’époxy en deux composants à usage marin est utilisé pour remplir les trous dans des applications résistantes à l’eau, comme réparer les trous dans un bateau. Pour connaître l’exposition estimative par voie cutanée et par inhalation des adultes qui mélangent et appliquent ces deux produits, veuillez consulter le tableau 8-7 (précisions à l’annexe H).
| Scénario d’exposition | Concentration maximale | Exposition cutanée (mg/kg p.c. par exposition) | Exposition par inhalation (mg/kg p.c. par exposition) | Exposition totale (mg/kg p.c. par exposition) |
|---|---|---|---|---|
| Mélange et application de colle à l’époxy en deux composants | 1 %a 0,5 %b | 2,0 × 10-2 | 0,1 | 0,13 |
| Mélange et application d’un agent de remplissage à l’époxy en deux composants à usage marin | 1 %c 0,5 %d | 1,6 × 10-2 | 2,0 × 10-4 | 1,6 × 10-2 |
a SDS 2015; concentration déclarée dans l’un des deux composants à mélanger.
b Concentration après le mélange des deux composants.
c SDS 2018b; concentration déclarée dans l’un des deux composants à mélanger.
d TDS 2018, d’après le ratio du mélange énoncé de 1:1 en volume.
8.3.2 Évaluation des effets sur la santé
L’ensemble de données sur les dangers associés à la 2,2’‑iminodi(éthylamine) a été considéré comme limité. Cependant, puisque la 2,2’-iminodi(éthylamine) devrait se transformer en chlorhydrate dans des conditions physiologiques, les données sur les effets sur la santé relatives au dichlorhydrate de 2,2’-iminodi(éthylamine) ont également été utilisées pour éclairer l’évaluation.
Toxicité à doses répétées
Dans le rapport d’une étude non publiée de 7jours menée sur des rats Harlan-Wistar (n = 5/sexe/dose) dont les femelles ont reçu des concentrations de 240, 620 et 1 580 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) et les mâles 240, 600 et 1 350 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine). Une diminution du poids corporel chez les animaux ayant reçu la dose intermédiaire et la dose élevée et une diminution du poids du foie chez les mâles ayant reçu la dose élevée ont été observées (Anonyme, BGC 1994, mentionné dans HCNL 2005).
Une étude à court terme a été trouvée pour l’exposition par inhalation, dans laquelle des rats Alderly Park exempts d’organismes pathogènes spécifiques (n = 2/sexe/dose) ont été exposés (intégralement) à 550 mg/m3 de vapeur saturée de 2,2’‑iminodi(éthylamine) pendant 6 heures par jour pour une période de 15 jours. Aucun effet n’a été trouvé dans l’analyse d’urine, les paramètres hématologiques, à l’examen pathologique macroscopique et à l’examen histopathologique des poumons, du foie, des reins, de la rate, des surrénales, du cœur, du jéjunum, de l’iléon et du thymus (Gage 1970).
Dans une étude de toxicité par voie orale menée conformément à l’essai no 409 des Lignes directrices de l’OCDE, des rats Fischer 344 (n = 20-30/sexe/dose) ont reçu 0, 1 000, 7 500 et 15 000 ppm de dichlorhydrate de 2,2’-iminodi(éthylamine) dans leur alimentation pendant 90 jours suivis de 4 semaines de récupération pour 10 autres animaux du groupe témoin et du groupe de traitement à la dose élevée (Leung et van Miller 1997), ce qui est équivalent à environ 0, 41, 311 et 621 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) pour les mâles et à environ 0, 47, 363, 709 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) pour les femelles. Aux doses intermédiaire et élevée, des changements statistiquement significatifs dans les mesures en pathologie clinique ont été observés chez les mâles, comme une augmentation du volume globulaire moyen et de la teneur globulaire moyenne en hémoglobine accompagnée d’une diminution statistiquement significative de la concentration sérique de glucose chez les femelles, tous ayant persisté après la période de récupération de 4 semaines. De plus, le pH urinaire avait augmenté de façon significative chez les femelles à la fin du traitement, mais l’augmentation n’était plus observée après la période de récupération. Aussi à ces doses, des augmentations significatives liées au traitement du poids relatif des reins, du foie et des surrénales se sont produites chez les femelles, augmentations qui ont persisté jusque dans la période de récupération. À la dose la plus élevée, des augmentations significatives du poids relatif des reins et des testicules ont été constatées chez les mâles, poids relatifs qui sont demeurés élevés après la période de récupération. Une DSENO de 1 000 ppm a été déterminée par les auteurs d’après la toxicité générale aux doses les plus élevées. Cette concentration est équivalente à environ 41 et 47 mg/kg p.c./jour de 2,2’-iminodi(éthylamine) chez les mâles et les femelles, respectivement.
Une étude d’exposition chronique par voie cutanée a été menée sur des groupes de rats Wistar (n = 5/sexe/dose) où une 0,4 mL d’une solution diluée de 2,2’‑iminodi(éthylamine) a été badigeonnées sur une superficie de 6 cm2 de l’omoplate aux deux jours jusqu’à la mort. La dose quotidienne moyenne a été estimée à 114 mg/kg pour les mâles et à 160 mg/kg pour les femelles. Le temps de survie moyen était d’environ 407 jours dans le groupe de traitement par rapport à 581 jours dans le groupe témoin. Chez tous les animaux traités, des changements histologiques ont été observés principalement dans les reins et le foie, accompagnés d’une pneumonie et de lésions à la rate et aux surrénales (Fujino 1970, mentionné dans HCNL 2005).
Dans une étude de toxicité cutanée non publiée, de la 2,2’‑iminodi(éthylamine) a été appliquée à des doses de 0, 38 ou 780 mg/kg p.c./jour sur la peau rasée du dos de lapins néo-zélandais blancs (n = 10 animaux/sexe/dose) pendant 4 semaines (Anonyme 1994, mentionné dans HCNL 2005). L’administration de la dose élevée a été arrêtée après 8 jours en raison d’effets locaux graves liés au traitement. La dose faible était associée à une diminution du poids corporel (9 % à 15 % plus faible que les témoins), à une augmentation de l’activité de l’alanine aminotransférase (ALAT), de l’aspartate aminotransférase (ASAT) et de la lactate-déshydrogénase (LDH), à une diminution du poids des testicules et des épididymes et à des lésions cutanées.
Toxicité pour la reproduction et le développement
Dans le rapport d’un test de détection de toxicité pour la reproduction et le développement (mené conformément à l’essai no 421 des Lignes directrices de l’OCDE), des rats Wistar (n = 48/sexe/dose) ont reçu 0, 30, 100 ou 300 mg/kg p.c./jour de 2,2’-iminodi(éthylamine) (dans de l’eau filtrée d’une pureté de 99,4 %), par gavage, pendant la période de 2 semaines précédant l’accouplement et pendant la période d’accouplement, la gestation et jusqu’au jour postnatal (JPN) 4 (Anonyme 1993, mentionné dans ECHA 2018b). La durée totale du traitement a été entre 29 et 54 jours. À la dose de 300 mg/kg p.c./jour, la prise de poids corporel a été significativement réduite chez les animaux parents tout au long de l’étude. Aux doses égales ou supérieures à 100 mg/kg p.c./jour, le rendement de reproduction féminine a été affecté, car il y a eu une augmentation de la période de gestation et de l’incidence de pertes post-implantatoires, entraînant une diminution de la taille des portées. En ce qui concerne les rejetons, aucun effet nocif relatif à la santé générale et au poids corporel des petits n’a été trouvé. Le dossier d’homologation de REACH a rapporté une DSENO de 100 mg/kg p.c./jour établie d’après une diminution de la prise de poids corporel et de la consommation de nourriture observée chez les animaux parents à la dose suivante (300 mg/kg p.c./jour). Une DSENO de 30 mg/kg p.c./jour a été trouvée pour la toxicité pour la reproduction d’après une augmentation de la durée de la gestation et une augmentation des pertes post-implantatoires.
Dans une étude de toxicité pour le développement prénatal mené conformément à l’essai no 414 des Lignes directrices de l’OCDE, des rates Sprague-Dawley en gestation (n = 24/dose) ont reçu 0, 25, 100 ou 250 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) (dans l’eau, pureté de 98,9 %), par gavage, du JG 6 au JG 19 (présentation d’étude 2018; Anonyme, mentionné dans ECHA 2018b). Un autre groupe (n = 5) a reçu 250 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) dans son alimentation enrichie de cuivre (150 ppm). L’administration de 250 mg/kg p.c./jour de 2,2’‑iminodi(éthylamine) (sans supplément de cuivre) a été associée à une diminution significative de la prise de poids corporel (- 11 %) tout au long de l’étude, par comparaison avec les sujets du groupe témoin. Une réduction similaire a également été observée avec le supplément de cuivre, mais elle était transitoire et ne s’est produite que pendant les premiers jours de l’administration. Aucun effet lié au traitement n’a été observé à l’examen pathologique macroscopique ou sur les paramètres de rendement de reproduction féminine (p. ex., corps jaune, pertes post-implantatoires, résorptions). En ce qui concerne l’examen des fœtus, une augmentation de l’incidence d’os non ossifiés (métacarpes, sternèbres, phalanges) et une diminution du poids corporel (sans mention de la signification statistique) ont été observées à la dose la plus élevée (250 mg/kg p.c./jour), avec et sans supplément de cuivre. Cependant, ces effets n’étaient pas associés à des anomalies ou des malformations fœtales majeures ou mineures et se sont produits en présence de toxicité maternelle. Par conséquent, ils n’ont pas été considérés comme nocifs. Le dossier d’homologation de REACH contenait une DSENO de 250 mg/kg p.c./jour pour la toxicité pour le développement, représentant la dose la plus élevée à l’essai. Une DSENO de 100 mg/kg p.c./jour a également été trouvée pour la toxicité maternelle d’après la diminution de la prise de poids observée à la dose suivante (250 mg/kg p.c./jour).
Génotoxicité et cancérogénicité
La 2,2’-iminodi(éthylamine) ne devrait pas être génotoxique d’après les données d’essais sur la mutagénicité et la clastogénicité (MHLW 2000; Zieger et coll. 1987; Leung 1994; Hulla et coll. 1981; Gollapudi et coll. 1989; Takahashi et Ohno 1993; Hedenstedt 1978; ECHA 2018b; OCDE 1994; Slesinski 1984). En ce qui concerne la cancérogénicité, aucune incidence de tumeur liée au traitement n’a été observée dans une étude de badigeonnage cutané pour la durée de la vie (DePass et coll. 1987b), ni alerte structurale liée au cancer n’a été issue de la modélisation (Boîte à outils QSAR de l’OCDE 2017).
Sensibilisation
La sensibilisation des voies respiratoires a été étudiée chez les rats exposés à 300 ppm (1 248 mg/m3) de 2,2’‑iminodi(éthylamine), mais aucun effet n’a été rapporté (Savitt 1955, mentionné dans HCNL 2005).
8.3.3 Caractérisation des risques pour la santé humaine
Le test de détection de la toxicité pour la reproduction et le développement résumé dans un dossier d’homologation de REACH (Anonyme 1993, mentionné dans ECHA 2018b) a été utilisé pour la caractérisation des risques suivant des expositions intermittentes et chroniques à la 2,2’‑iminodi(éthylamine). Une DSENO de 30 mg/kg p.c./jour a été trouvée pour la toxicité pour la reproduction d’après l’augmentation de la durée de la gestation et des pertes post-implantatoires à la dose suivante de 100 mg/kg p.c./jour.
Le tableau 8-8 présente les expositions estimatives pertinentes, les concentrations entraînant un effet critique et les marges d’exposition résultantes pour la caractérisation des risques pour la santé humaine associés à la 2,2’‑iminodi(éthylamine).
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Colle à l’époxy en deux composants (1 %); par inhalation et par voie cutanée, intermittente | Adulte | 0,13 | 30 | 231 |
| Agent de remplissage à l’époxy en deux composants à usage marin (1 %); par inhalation et par voie cutanée, intermittente | Adulte | 1,6 × 10-2 | 30 | 1 875 |
| Eau potable; par voie orale, chronique | Nourrisson | 6,8 × 10-4 | 30 | 44 118 |
a Une DSENO de 30 mg/kg p.c./jour a été trouvée d’après une augmentation de la durée de gestation et des pertes post-implantatoires à la dose suivante de 100 mg/kg p.c./jour, provenant d’un test de détection de la toxicité pour la reproduction et le développement chez le rat.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.3.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitude | Impact |
|---|---|
| Une extrapolation d’une voie à une autre d’une étude d’exposition par voie orale a été appliquée pour la caractérisation des risques après une exposition par voie cutanée et par inhalation. L’absorption par la voie cutanée et par inhalation a été considérée comme équivalente à l’absorption par la voie orale. | + |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous-estimation du risque.
8.4 Diméthylamine
8.4.1 Évaluation de l’exposition
Milieu environnemental
La diméthylamine existe sous forme de gaz et a une pression de vapeur et une solubilité dans l’eau très élevées.
D’après l’Inventaire national des rejets de polluants (INRP), la diméthylamine serait rejetée dans l’air par une installation au Canada, à hauteur de 1,6 tonne en 2017 (INRP 2018). L’outil de modélisation SCREEN3 de l’US EPA (SCREEN3 2011) a été utilisé pour estimer les concentrations de diméthylamine dans l’air ambiant au Canada d’après les rejets déclarés à l’INRP et les renseignements sur l’installation. À une distance de 3 000 m (représentant la distance entre l’installation source et les zones résidentielles), la concentration quotidienne (24 heures) dans l’air était de 1,11 x 10-3 mg/m3. Pour des précisions sur le modèle SCREEN3 et les paramètres utilisés pour calculer cette concentration, veuillez consulter l’annexe I.
D’après la valeur de pKa de 10,73, la diméthylamine devrait se trouver sous forme de proton dans l’eau à un pH normal dans l’environnement. La substance ne devrait pas se volatiliser de la surface de l’eau (PubChem 2004-2020). Une valeur de Kco de 508 indique que la diméthylamine devrait être adsorbée par du sol et des sédiments en suspension dans les eaux usées (PubChem 2004-2020). Il n’existe aucune concentration mesurée de diméthylamine dans l’eau au Canada, mais il y a différentes sources provenant des États‑Unis et de l’étranger. Wu et coll. (2015) ont mesuré la concentration maximale de diméthylamine à 25,4 µg/L dans l’eau prête au débit provenant d’une usine de traitement de l’eau potable au Missouri. Cette valeur a donné lieu à un apport quotidien par l’eau potable de 8,3 x 10-4 mg/kg p.c./jour en 1 an.
Aliments
La source la plus abondante de l’exposition alimentaire à la diméthylamine devrait découler de sa présence naturelle dans des aliments. La diméthylamine est naturellement présente dans différents types d’aliments, dont des fromages, de la laitue, du chou frisé (kale), du maïs et du soja (VCF 2018). Cette substance s’est révélée être la plus abondante dans les poissons préparés de différentes façons, c.‑à‑d., sous forme fraîche, fumée, surgelée et en conserve. Elle a été détectée et mesurée dans 264 échantillons d’aliments et boissons en Allemagne (Pfundstein et coll. 1991).
Le résumé des données sur la présence de diméthylamine dans les aliments, trouvé dans la documentation scientifique et la base de données sur les composés volatils dans les aliments (Volatile Compounds in Food) (VCF 2018), peut être consulté à l’annexe K. La catégorie d’aliments contribuant le plus significativement à l’exposition alimentaire à la diméthylamine était le « lait », qui comprenait le lait de vache entier, à 2 % et à 1 % de matières grasses et entièrement écrémé. Cette catégorie représentait 72 % de l’exposition alimentaire totale à la diméthylamine chez les enfants de 1 à 3 ans et 35 % de l’exposition alimentaire totale chez les personnes de tous les groupes d’âge combinés. Les valeurs maximales de concentration déclarées provenant de la base de données VCF et les valeurs trouvées dans les publications scientifiques ont servi à estimer les expositions potentielles moyennes et au 90e centile à la diméthylamine dans les aliments pour la population générale du Canada, donnant lieu à des expositions estimatives prudentes. Les valeurs d’apport pour « toutes les personnes » sont présentées dans le tableau 8-10 ci-dessous. On obtient les valeurs estimatives d’exposition de toutes les personnes en prenant le nombre total de répondants à l’enquête en question. Les enfants de 1 à 3 ans ont eu la valeur estimée la plus élevée pour l’apport par poids unitaire (0,3 et 0,57 mg/kg p.c./jour pour l’apport quotidien moyen et au 90e centile, respectivement).
| Groupe d’âge | Apport quotidien moyen(mg/kg p.c./jour) | Apport quotidien au 90e centile (mg/kg p.c./jour) |
|---|---|---|
| 1-3 ans | 0,297 | 0,569 |
| 4-8 ans | 0,156 | 0,301 |
| 9-13 ans | 0,088 | 0,175 |
| 14-18 ans | 0,064 | 0,124 |
| 19-30 ans | 0,067 | 0,124 |
| 31-50 ans | 0,063 | 0,118 |
| 51-70 ans | 0,067 | 0,129 |
| 70 ans et plus | 0,062 | 0,113 |
Surveillance biologique
Deux études mesurant les produits de la diméthylamine dans l’urine humaine ont été trouvées. Mitchell et coll. (2008) ont mesuré les concentrations de diméthylamine dans l’urine humaine recueillie de sujets volontaires (n = 6) 8 heures après la consommation de 46 différents types d’aliments, notamment des fruits, des légumes, de la viande, du poisson et des produits laitiers. Ils ont constaté que les échantillons d’urine des témoins contenaient une moyenne de 6,67 ± 1,75 mg de diméthylène recueillie 8 heures après la consommation, tandis que la quantité la plus élevée de diméthylamine recueillie dans l’urine était de 48,62 ± 12,61 mg 8 heures après la consommation de calmar (Mitchell et coll. 2008). Zhang et coll. (1995) ont recueilli des échantillons d’urine humaine de 102 personnes de sexe masculin et de 101 personnes de sexe féminin pendant 24 heures. La quantité quotidienne moyenne de diméthylamine dans l’urine de tous les volontaires était de 17,43 ± 11,80 mg/jour (Zhang et coll. 1995). La toxicocinétique de la diméthylamine semble indiquer que celle-ci est excrétée telle quelle dans l’urine humaine.
8.4.2 Évaluation des effets sur la santé
La diméthylamine a été ajoutée dans la catégorie des amines aliphatiques secondaires par le programme Screening Information Dataset (SIDS) de l’Organisation de coopération et de développement économiques (OCDE) et un rapport Initial Assessment Profile (SIAP) (OCDE 2013) du SIDS a été publié. Cependant, le rapport suivant n’est pas accessible au public. Comme la diméthylamine devrait être transformée en chlorhydrate dans les conditions physiologiques, on a traité les critères d’évaluation dont les données sont limitées au moyen des données sur le chlorhydrate de diméthylamine, dans la mesure du possible.
Toxicité à doses répétées
Puisque la diméthylamine est un gaz incolore, bon nombre d’études de toxicité par inhalation ont été menées. Une étude de toxicité subchronique par inhalation de 90 jours a révélé que 9 mg/m3 de diméthylamine ont causé de légers changements inflammatoires dans les poumons de rats, de cobayes, de lapins, de chiens et de singes (Coon et coll. 1970). Cependant, cette étude a examiné un nombre limité d’effets sur la santé et de tissus lors de l’histopathologie, limitant son utilité pour la caractérisation des risques.
Les effets de la diméthylamine après une exposition chronique par inhalation (exposition intégrale) ont été étudiés chez des rats F344 et des souris B6C3F1 (n = 95/sexe/groupe/espèce) aux concentrations de 0, 10, 50 ou 175 ppm (équivalant à 0, 18,4, 92 ou 322 mg/m3) pendant 6 heures/jour, 5 jours/semaine, pour 12 mois (Buckley et coll. 1985). Chez les rats, des lésions liées au traitement dans les voies nasales ont été observées, dont la gravité augmentait avec l’augmentation de la concentration. On a constaté une destruction focale du cornet antérieur du nez ou de la cloison nasale, une inflammation locale et une métaplasie pavimenteuse focale de l’épithélium des voies respiratoires, tandis que l’épithélium nasal présentait une perte de cellules sensorielles et de nerfs olfactifs, une hypertrophie des glandes de Bowman et une distension des conduits par les débris sérocellulaires dans les régions proximales. Des effets généraux ont été causés à la dose la plus élevée (322 mg/m3), qui comprennent une diminution significative de la prise de poids corporel (environ 90 % de celle des sujets témoins) commençant la troisième semaine de traitement. En outre, il y a eu d’importants changements sur le plan hématologique (une diminution du nombre de plaquettes, une augmentation des lymphocytes atypiques, une diminution du volume moyen des globules chez les femelles), et de la biochimie clinique (diminution des protéines, augmentation de la phosphatase alcaline chez les femelles). Bien que des effets locaux et généraux similaires aient été observés chez la souris, les dommages aux régions responsables de l’olfaction ont été considérés comme moins répandus que chez le rat. Une CMENO de 10 ppm (18,4 mg/m3) sur des effets locaux a été établie d’après les lésions nasales. Une CSENO de 50 ppm (92 mg/m3) a été établie d’après la diminution du poids corporel observé à la dose suivante chez le rat (175 ppm, équivalant à 322 mg/m3).
Dans une étude de toxicité par inhalation similaire, des rats F344 et des souris B6C3F1 (n = 95/sexe/groupe/espèce) ont été exposés aux mêmes concentrations que l’étude précédente, mais pour une période de 24 mois (CIIT 1990). Par comparaison avec l’étude précédente, des effets similaires ont été observés chez les deux espèces, qui comprenaient des lésions liées au traitement dans les voies nasales, lésions qui s’aggravaient avec l’augmentation de la concentration, et une diminution significative du poids corporel à la dose la plus élevée. Cependant, il y a également eu d’autres effets sur le poids des organes. Chez le rat, on a constaté une diminution significative du poids du foie, une diminution du poids des reins et une augmentation du poids relatif de l’encéphale à la dose la plus élevée. Aucune différence sur le plan hématologique n’a été détectée entre les groupes, mais les résultats sur la chimie sérique indiquent que les rats femelles exposés à la dose la plus élevée ont connu une augmentation significative de la concentration de phosphatase alcaline et de l’aspartate transaminase, ce qui semble indiquer des dommages possibles au foie. Chez la souris, des effets similaires sur le foie, les reins et l’encéphale ont été observés à la dose la plus élevée. Il y a eu aussi une diminution de la concentration des thrombocytes, de l’albumine, du calcium, du glucose et des protéines totales à la concentration la plus élevée. Dans l’ensemble, une CSENO de 92 mg/m3 a été établie d’après la toxicité générale (c.‑à‑d., une diminution du poids corporel et des effets sur le foie et les reins) à la dose suivante.
Gross et coll. (1987) ont également examiné les effets d’une exposition chronique par inhalation de rats F344 mâles à la diméthylamine pour une période allant jusqu’à 2 ans. Cependant, cette étude ne portait que sur une dose (c.-à-d., 175 ppm, équivalant à environ 332 mg/m3) et n’examinait que les effets sur les cavités nasales, les muqueuses, la fonction mucociliaire et le débit d’écoulement de mucus. Aucun autre effet général potentiel n’a été évalué.
En ce qui concerne la voie d’administration orale, l’ensemble de données sur les dangers a été considéré comme limité. Dans une étude à court terme examinant la toxicité de la diméthylamine, des rats Wistar (n = 30 mâles/groupe) ont reçu 0 ou 0,2 % de diméthylamine dans de l’eau potable (équivalant à environ 0,28 mg/kg p.c./jour) sur une période de 9 mois (Darad et coll. 1983). Une augmentation de la peroxydation des microsomes, de la phosphatase acide et de l’activité de la cathepsine a été observée dans le foie. Aucune autre mesure de la toxicité n’a été prise.
Toxicité pour le développement et la reproduction
Le potentiel de la diméthylamine à causer une toxicité pour le développement a été examiné dans deux études de toxicité pour le développement prénatal (menées conformément à l’essai no 414 des Lignes directrices de l’OCDE). Dans la première étude, on a administré 0, 100, 300 et 1 000 mg/kg p.c./jour de chlorhydrate de diméthylamine (pureté de 99,6 %, dans de l’eau), par gavage, à des rats Wistar (n = 25 femelles/groupe) du JG 6 au JG 19 (Présentation d’étude 2009; BASF 2009, mentionné dans ECHA 2018c), ce qui était équivalent à environ 0, 55, 166 et 553 mg/kg p.c./jour de diméthylamine. À la dose la plus élevée, il y a eu une diminution significative de la consommation d’aliments et des signes cliniques comme la salivation et une urine jaunâtre ont été observés. Aucun effet lié au traitement n’a été détecté sur le taux de conception, le nombre moyen de corps jaunes, les sites d’implantation, les pertes post-implantatoires et les résorptions. En ce qui concerne les données sur les fœtus, aucun effet nocif lié au traitement n’a été constaté. Les auteurs ont établi une DSENO à 300 mg/kg p.c./jour (équivalant à 166 mg/kg p.c./jour de diméthylamine) pour la toxicité maternelle d’après la diminution de la consommation d’aliments et la salivation après le traitement à la dose suivante.
Dans la deuxième étude, des lapins néo-zélandais blancs (n = 24 femelles/groupe) ont été exposés intégralement à 0, 50, 100 et 250 ppm de diméthylamine (équivalant à environ 0, 92, 184 et 461 mg/m3) pendant 6 heures par jour du JG 7 au JG 28 (Présentation d’étude 2015; WIL Research 2016, mentionné dans ECHA 2018c). À la dose la plus élevée, des signes cliniques nocifs (râles, matière claire autour de la gueule, du museau et des yeux), une diminution de la consommation d’aliments et une diminution de la prise de poids corporel ont été observés chez les mères. Cependant, aucun effet sur la survie, les pertes post-implantatoires, la taille de la portée, le poids corporel des fœtus et le rapport de masculinité chez les fœtus n’a été constaté. Bien que des malformations externes et viscérales aient été observées chez les fœtus, elles n’étaient pas statistiquement significatives, n’étaient pas liées à la dose et ne se trouvaient pas à l’intérieur des limites historiques des fourchettes des groupes témoin. Le dossier d’homologation de REACH a rapporté une CSENO de 184 mg/m3 établie d’après la toxicité maternelle (signes cliniques nocifs, diminution de la prise de poids corporel, diminution de la consommation d’aliments) à la concentration suivante (461 mg/m3). Une CSENO de 461 mg/m3 a été établie pour la toxicité pour le développement, la concentration représentant la concentration la plus élevée à l’essai.
Aucune étude examinant spécifiquement le potentiel de la diméthylamine de causer une toxicité pour la reproduction n’a été trouvée dans la documentation scientifique. Cependant, aucun effet lié au traitement sur les organes reproducteurs n’a été identifié dans toutes les études de toxicité à doses répétées comprenant un examen histopathologique complet des gonades chez les animaux exposés jusqu’à 322 mg/m3 de diméthylamine par inhalation (Buckley et coll. 1985; CIIT 1990). En outre, aucun effet lié au traitement sur les pertes post-implantatoires, la taille des portées, le poids corporel moyen des fœtus ou le rapport de masculinité des fœtus n’a été rapporté dans les études de toxicité pour le développement chez des rats femelles auxquelles on avait administré jusqu’à 1 000 mg/kg p.c./jour de diméthylamine, par gavage, du JG 6 au JG 19 et des lapins femelles exposés jusqu’à 461 mg/m3, par inhalation, du JG 7 au JG 28 (BASF 2009, mentionné dans ECHA 2018c; WIL Research 2016, mentionné dans ECHA 2018c).
Génotoxicité et cancérogénicité
La diméthylamine ne devrait pas être génotoxique d’après les données d’études sur la mutagénicité et la clastogénicité (Zeiger et coll. 1987; Green et Savage 1978; Hsie et coll. 1987; Ishidate et Odashima 1977; Abe et Sasaki 1977; Martelli et coll. 1983; Isakova et coll. 1971). En ce qui concerne la cancérogénicité, il n’avait pas d’augmentation liée au traitement de l’incidence des tumeurs dans les études de toxicité chronique par inhalation (Buckley et coll. 1985; CIIT 1990; Gross et coll. 1987). L’administration alimentaire sous forme de sel n’a pas entraîné la formation de tumeurs (Greenblatt et coll. 1971).
8.4.3 Caractérisation des risques pour la santé humaine
Aucune étude examinant les effets de la diméthylamine après une exposition chronique n’a été trouvée. Par conséquent, la toxicité pour le développement prénatal par voie orale (Présentation d’étude 2009) a été utilisée pour la caractérisation des risques après l’exposition chronique par voie orale à la diméthylamine. Une DSENO de 166 mg/kg p.c./jour a été établie d’après une diminution de la consommation d’aliments et de la salivation à la dose suivante de 553 mg/kg p.c./jour.
En ce qui concerne l’exposition par inhalation, l’étude de 2 ans menée par le Chemical Industry Institute of Toxicology (CIIT 1990) a été utilisée pour la caractérisation des risques après l’exposition chronique par inhalation à la diméthylamine. Une CSENO de 92 mg/m3 a été établie d’après la toxicité générale (c.-à-d., une diminution du poids corporel et des effets sur le foie et les reins) à la dose suivante (322 mg/m3).
Le tableau 8-11 présente l’exposition estimative, la concentration entraînant un effet critique et les marges d’exposition résultantes utiles pour la caractérisation des risques pour la santé humaine associés à la diméthylamine provenant du milieu environnemental et des aliments.
| Scénario d’exposition | Population | Exposition estimative | Concentration d’effet critique | ME |
|---|---|---|---|---|
| Eau potable, aliments (90e centile); orale, chronique | 1 an | 0,57 mg/kg p.c./jour | 166 mg/kg p.c./joura | 291 |
| Air extérieur; inhalation, chronique | Toutes les populations | 1,1 x 10-3 mg/m3 | 92 mg/m3b | 83 636 |
a Une DSENO de 166 mg/kg p.c./jour a été établie à partir d’une étude de toxicité pour le développement prénatal d’après la diminution de la consommation d’aliments et de la salivation à la dose suivante de 553 mg/kg p.c./jour.
b Une CSENO de 92 mg/m3 a été établie d’après la toxicité générale (c.-à-d., diminution du poids corporel et effets sur le foie et les reins) à la dose suivante (322 mg/m3), observée dans une étude qui s’est déroulée sur 2 ans.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.4.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Aucune étude de toxicité par voie orale examinant les effets de la diméthylamine après une exposition chronique n’a été trouvée. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.5 Hexadécyldiméthylamine
8.5.1 Évaluation de l’exposition
Milieu environnemental
L’hexadécyldiméthylamine a une pression de vapeur faible à modérée et une solubilité dans l’eau modérée. Il n’existe aucune donnée sur la concentration d’hexadécyldiméthylamine mesurée dans l’air ambiant ou intérieur au Canada. Cependant, l’hexadécyldiméthylamine est une amine aliphatique à chaîne(s) longue(s) et, en raison de sa taille et de sa pression de vapeur, aucune exposition par l’air ambiant ou intérieur n’est prévue.
Une CEE pour l’hexadécyldiméthylamine a été estimée à 0,55 µg/L pour la préparation d’un mélange de polyalcools à une usine de mélange de polyuréthanes (section 7.2.4) d’après la principale utilisation de l’hexadécyldiméthylamine dans la production de MPU (Environnement Canada 2013). En outre, la CEE estimée pour le rejet à l’égout de dérivés d’amines, ce qui peut comprendre l’hexadécyldiméthylamine, était de 0,12 µg/L. Ces valeurs de CEE représentent la CEE totale avant la transformation de la concentration de carbone organique dissous en concentration de la substance sous forme dissoute libre; l’utilisation de la CEE la plus élevée pour estimer l’absorption d’eau potable est considérée comme prudente. L’absorption totale estimée la plus élevée par poids unitaire d’après la formulation d’un mélange de polyalcools pour les nourrissons de 0 à 5 mois nourris aux préparations pour nourrissons est de 7,2 × 10-5 mg/kg p.c./jour (annexe J, tableau J-2).
Produits disponibles pour les consommateurs
L’hexadécyldiméthylamine est présente dans deux nettoyants faciaux à rincer pour le traitement de l’acné, homologués comme produits de santé naturels au Canada à la concentration de 0,13 %. L’utilisation de ces deux produits est recommandée deux fois par jour (communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 16 décembre 2016; sans référence). L’exposition estimée la plus élevée à ces produits est de 1,4 × 10-3 mg/kg p.c./jour pour les enfants de 9 à 13 ans. D’après les déclarations présentées en vertu de l’article 71 de la LCPE, l’hexadécyldiméthylamine serait une impureté dans la formulation de produits disponibles pour les consommateurs, comme les cosmétiques (Environnement Canada 2013). Ces autres scénarios d’utilisations potentielles par des cosmétiques ont été examinés, mais ont donné des expositions estimatives plus faibles que celle du nettoyant facial à rincer (tableau 8-13).
L’Environmental Protection Agency (EPA) du Danemark a trouvé de l’hexadécyldiméthylamine dans le tissu synthétique extérieur de manteaux destinés aux enfants, au Danemark (Tønning et coll. 2009). Cette utilisation concorde avec l’utilisation de l’hexadécyldiméthylamine dans les tissus, les textiles et les produits en cuir au Canada (Environnement Canada 2013). Dans cette étude, de l’hexadécyldiméthylamine a été détectée dans l’un des cinq manteaux examinés à une concentration de 96 µg/g dans le liquide de diffusion (seuil de détection < 1-10 µg/g). Les expositions par voie orale étaient estimées pour un enfant de 2 ou 3 ans mâchonnant le tissu externe du manteau et les expositions par voie cutanée, par le port du manteau. L’exposition totale par les deux voies est présentée dans le tableau 8-13. Pour des précisions sur la méthode et les paramètres utilisés pour calculer ces estimations, veuillez consulter l’annexe H.
D’après les données présentées dans le cadre d’une enquête réalisée conformément à un avis émis en vertu de l’article 71 de la LCPE (Environnement Canada 2013), l’hexadécyldiméthylamine aurait également une utilisation commerciale dans les sièges et les produits de literie en mousse. Bien qu’aucune utilisation par les consommateurs n’ait été trouvée, on prévoit que ces produits peuvent être utilisés par des consommateurs. Aucune donnée n’a été trouvée sur l’hexadécyldiméthylamine dans les produits finis en mousse de polyuréthane. Faute de données, on a supposé que le scénario des manteaux peut être considéré comme sans danger d’exposition par les voies cutanée et orale associé à la mousse de polyuréthane. Bien que les profils de contact cutané et de mâchonnement du matériel de manteaux et d’autres produits en mousse puissent être différents, une méthode faisant appel à des hypothèses normales pour le domaine des textiles mâchonnés et la superficie du corps en contact avec la surface a été utilisée, en raison des données limitées. Toutes les différences possibles entre ces deux scénarios ne sont pas considérées comme significatives.
| Scénario d’exposition | Voie d’exposition | Concentration maximale | Exposition (mg/kg p.c./jour ou par exposition) |
|---|---|---|---|
| Nettoyant facial (9-13 ans) | Cutanée | 0,13 %a | 1,4 × 10-3 |
| Matériel externe du manteau | Orale et cutanée combinées | 96 µg/g | 1,9 × 10-3 |
a Communication personnelle, courriels de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 6 juin 2017, sans référence.
8.5.2 Évaluation des effets sur la santé
L’ensemble de données sur les dangers associés à l’hexadécyldiméthylamine a été considéré comme limité. Pour déterminer les critères d’évaluation lorsque les données sont limitées, on applique une méthode d’extrapolation pour éclairer l’évaluation avec deux analogues présentant des données pertinentes sur les effets sur la santé : la dodécyldiméthylamine (no CAS 112-18-5) et la N,N-diméthyl-1-docosanamine (no CAS 21542-96-1). Ces analogues sont tous deux des amines tertiaires substituées par deux groupes méthyles et une chaîne alkyle qui est similaire par la structure à la colonne vertébrale de l’hexadécyldiméthylamine. En ce qui concerne la longueur de la chaîne alkyle, la dodécyldiméthylamine contient une chaîne en C12, la N,N‑diméthyl-1‑docosanamine contient une chaîne en C22, et l’hexadécyldiméthylamine contient une chaîne en C16. En plus d’être similaires sur le plan de la structure, ces substances devraient également présenter des profils de réactivité similaires et passer par des voies de métabolisation similaires (c.-à-d., oxydation de la chaîne alkyle, N-oxydation, N-désalkylation) d’après les simulations faites par modélisation (Boîte à outils QSAR de l’OCDE 2017).
Toxicité à doses répétées
Les données trouvées sur les dangers associés à l’hexadécyldiméthylamine sur la toxicité à doses répétées étaient limitées à celles d’une étude de toxicité par voie alimentaire à court terme dans laquelle des rats Sprague-Dawley (n = 12 mâles/groupe) ont reçu 1 000 ppm d’hexadécyldiméthylamine (équivalant à environ 50 mg/kg p.c./jour) (Svoboda et coll. 1977). La prise de poids corporel moyenne sur 3 semaines a été significativement réduite, et cette réduction était accompagnée d’une diminution significative de la consommation d’aliments, du poids absolu des graisses des épididymes et des concentrations plasmatiques de stérol total. Cependant, puisqu’une seule dose a été examinée, l’utilité de cette étude pour la caractérisation des risques est limitée.
Des études à court terme ont été menées sur l’analogue dodécyldiméthylamine. Dans une étude de toxicité par voie orale (gavage) de 28 jours, des rats Crj:CD(SD)IGS (n = 6/sexe/groupe) ont reçu 0, 4, 20 et 100 mg/kg p.c./jour de dodécyldiméthylamine (dans 0,1 % de Tween80 ajouté à une concentration de 0,5 % critique pour la formation de micelles-Na) (Mitsubishi Chemical Safety Institute Ltd. 2003). D’autres animaux satellites (groupe témoin et groupe de traitement à dose élevée) ont été surveillés pendant 14 jours de plus après le traitement, pour l’examen des animaux pendant une période de récupération. Le poids corporel, la consommation de nourriture, des paramètres hématologiques et biochimiques, le poids des organes, la batterie d’observations fonctionnelle, les analyses d’urine et les observations histopathologiques ont été enregistrés conformément à l’essai no 407 des Lignes directrices de l’OCDE. Aux doses supérieures ou égales à 20 mg/kg p.c./jour, on a détecté une dégénérescence du myocarde et une fibrose du cœur (de gravité légère à modérée chez les animaux mâles. À 100 mg/kg p.c./jour, on a également constaté un épaississement de la paroi et une érosion du préestomac, accompagnés d’œdème, d’hyperplasie et d’infiltration de cellules inflammatoires. Les auteurs ont établi une DSENO de 4 mg/kg p.c./jour d’après des effets sur le cœur à la dose suivante de 20 mg/kg p.c./jour.
Le résumé d’une étude sur la dodécyldiméthylamine est également accessible dans un dossier d’homologation de REACH. Dans une étude de toxicité par voie orale (gavage) de 28 jours, des rats Sprague-Dawley (n = 5/sexe/groupe) ont reçu 0, 50, 150 ou 300 mg/kg p.c./jour de dodécyldiméthylamine (dans de l’huile de sésame) (Anonyme 1995, mentionné dans ECHA 2018d). À 150 mg/kg p.c./jour, une légère toxicité (frottement du museau dans la litière), qui a été transitoire sans présenter aucune indication de toxicité générale. À la dose la plus élevée, de la mortalité a été observée, accompagnée d’observations macroscopiques dans la paroi gastrique et l’estomac. Une DSEO de 50 mg/kg/p.c./jour était indiquée dans le dossier d’homologation de REACH.
Des études à court terme ont également été menées sur l’analogue N,N-diméthyl-1‑docosanamine. Dans une étude de détermination de dose de 14 jours dans laquelle des rats Crl:CD(SD) ont reçu par gavage 7,5, 25, 75 ou 200 mg/kg p.c./jour de N,N‑diméthyl-1‑docosanamine (pureté de 93 %, dans de l’huile d’olive), des cellules d’aspect mousseux ont été observées dans les ganglions mésentériques à toutes les doses (J-CHECK 2010-). Les doses plus élevées ont été associées à d’autres effets tels qu’une diminution du poids corporel, une hypertrophie du foie et l’apparition de cellules d’aspect mousseux dans d’autres organes (duodénum, jéjunum).
Dans le rapport d’une étude combinée de toxicité à doses répétées et de dépistage de la toxicité pour la reproduction et le développement (essai no 422 des Lignes directrices de l’OCDE), des rats Sprague-Dawley (n = 12/sexe/dose) ont reçu 0, 0,5, 5 ou 50 mg/kg p.c./jour de N,N-diméthyl-1-docosanamine (dans de l’huile d’olive), par gavage, pendant 42 jours pour les mâles, ou pendant 42 à 54 jours pour les femelles (depuis 14 jours avant la période d’accouplement jusqu’au jour de lactation 4) (CERI Japon 2012; J‑CHECK 2010-). D’autres animaux satellites ont reçu la dose témoin et le traitement à dose élevée et ont ensuite été examinés pendant la période de récupération de 14 jours. À 5 mg/kg p.c./jour, les auteurs ont noté une agrégation de cellules d’aspect mousseux dans les ganglions mésentériques chez les animaux mâles. À 50 mg/kg p.c./jour (la dose la plus élevée), le poids corporel et la consommation de nourriture ont diminué, bien qu’aucune analyse statistique n’ait été rapportée. Chez les mâles, cette dose était également associée à une augmentation significative de l’aspartate transaminase (AST), de l’alanine transaminase (ALT), de l’albumine et du rapport albumine/globine, ainsi qu’une diminution significative de la phosphatase alcaline. On a noté une hypertrophie et un blanchissement des ganglions mésentériques, accompagnés de l’agrégation de cellules d’aspect mousseux, d’une dilatation des vaisseaux lymphatiques et des sinus médullaires, une nécrose focale des ganglions mésentériques. Des cellules d’aspect mousseux ont également été observées dans l’iléum et le jéjunum. Chez les femelles, la dose élevée a été associée à des résultats similaires dans les ganglions mésentériques ainsi qu’à un épaississement des parois, à une hyperplasie pavimenteuse et à une ulcération du préestomac. À l’exception de la présence de cellules d’aspect mousseux dans les ganglions mésentériques et le jéjunum, toutes les autres observations ont été considérées comme « réversibles à la récupération », car elles n’étaient plus présentes à la fin de la période de récupération. Les auteurs ont indiqué ceci : « la DSENO et la DSEO étaient de 0,5 mg/kg/jour chez les mâles et de 5 mg/kg/jour chez les femelles, puisqu’une agrégation des cellules d’aspect mousseux dans les ganglions mésentériques a été observée chez les mâles à qui on avait administré au moins 5 mg/kg et chez les femelles à qui on avait administré 50 mg/kg ». La DSENO de 0,5 mg/kg p.c./jour a été prise en compte pour la présente évaluation préalable.
Toxicité pour la reproduction et le développement
Aucune étude portant sur la toxicité de l’hexadécyldiméthylamine pour la reproduction et le développement n’a été trouvée. Les données sur les dangers associés aux analogues dodécyldiméthylamine et N,N-diméthyl-1-docosanamine ont été prises en compte, s’il y avait lieu.
Dans l’étude combinée de toxicité à doses répétées et de dépistage de la toxicité pour la reproduction et le développement mentionnée précédemment (CERI Japon 2012; J‑CHECK 2010-), des rats Sprague-Dawley (n = 5/sexe/dose) ont reçu 0, 0,5, 5 ou 50 mg/kg p.c./jour de N,N-diméthyl-1-docosanamine, par gavage, pendant 42 jours pour les mâles et 42 à 54 jours pour les femelles. Aucune anomalie liée au traitement n’a été détectée, quel que soit le paramètre d’essai examiné (cycle œstral, indice de copulation, indice de conception, indice de mise bas des mères). De plus, il n’y a eu aucune anomalie en ce qui concerne l’apparence externe, le poids corporel, l’indice de viabilité et le rapport de masculinité chez les rejetons en développement.
Dans un test de dépistage de la toxicité pour la reproduction et le développement, on a administré l’analogue dodécyldiméthylamine (dans de l’huile de sésame) à des rats Sprague-Dawley (n = 10/sexe/dose), par gavage, des doses de 0, 50, 150, 300 ou 450 mg/kg p.c./jour pendant 28 jours pour les mâles et 54 jours pour les femelles (Hoechst AG 1995, mentionné dans ECHA 2018d). Aucun effet lié au traitement n’a été observé sur l’intervalle précoïtal, la durée de la gestation, les pertes post-implantatoires, l’indice de viabilité et le développement des petits. À 150 mg/kg p.c./jour, deux mères sont mortes avant la fin de l’étude, tandis que deux autres mères ont été incapables de mettre bas. Il y a également eu une diminution significative du nombre de petits vivants à la naissance et de l’indice de viabilité moyen (36,9 %), tandis que le nombre de mortinaissances et la moyenne de pertes post-implantatoires (50,4 %) ont augmenté de façon significative. Aux doses plus élevées, une seule mère a donné naissance à un petit. La DSENO de 50 mg/kg p.c./jour a été établie d’après les effets observés sur le développement et la reproduction à la dose suivante de 150 mg/kg p.c./jour. Ces effets se sont produits en présence de toxicité maternelle, la mortalité chez les mères ayant été constatée à 150 mg/kg p.c./jour.
Génotoxicité et cancérogénicité
Les données des études de mutagénicité et de clastogénicité sur l’hexadécyldiméthylamine ou ses analogues indiquent qu’il est improbable que la substance soit génotoxique (Szybalski 1958; ECHA 2018d). En ce qui concerne la cancérogénicité, aucun effet néoplasique n’a été constaté à la dose d’environ 100 mg/kg p.c./jour dans une étude de 80 semaines menée sur l’analogue dodécyldiméthylamine (Lijinsky et Taylor 1977).
8.5.3 Caractérisation des risques pour la santé humaine
Puisque l’ensemble de données sur les dangers associés à l’hexadécyldiméthylamine était limité, une méthode d’extrapolation a été appliquée, dans laquelle on a utilisé les données des analogues pour éclairer l’évaluation. En ce qui concerne les scénarios d’exposition intermittente et chronique, l’étude de toxicité à doses répétées et de toxicité combinée pour la reproduction et le développement menée sur la N,N-diméthyl-1‑docosanamine (CERI Japon 2012) s’est révélée être l’étude la plus utile pour la caractérisation des risques. Une DSENO de 0,5 mg/kg p.c./jour a été établie d’après l’agrégation de cellules d’aspect mousseux dans les ganglions mésentériques observée à la dose suivante (5 mg/kg p.c./jour).
Le tableau 8‑14 présente les expositions estimatives, les concentrations entraînant un effet critique et les marges d’exposition résultantes utiles pour la caractérisation des risques pour la santé humaine associés à l’hexadécyldiméthylamine.
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Nettoyant facial à rincer; cutanée, chronique | 9 à 13 ans | 1,4 × 10-3 | 0,5 | 357 |
| Eau potable; orale, chronique | 0 à 5 mois | 7,2 × 10-5 | 0,5 | 6 944 |
| Matériel contenant de l’hexadécyl-diméthylamine; orale (mâchonnement) et cutanée; intermittente | 2 à 3 ans | 1,9 × 10-3 | 0,5 | 263 |
a Une DSENO de 0,5 mg/kg p.c./jour a été établie d’après l’agrégation de cellules d’aspect mousseux dans les ganglions mésentériques observée à la dose suivante (5 mg/kg p.c./jour), dans une étude de toxicité à doses répétées et de toxicité combinée pour la reproduction et le développement.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.5.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Une extrapolation d’une voie à une autre d’une étude de toxicité par voie orale a été appliquée pour la caractérisation des risques après une exposition par voie cutanée. L’absorption par la voie cutanée a été considérée comme équivalente à l’absorption par la voie orale. | + |
| Aucune donnée n’a été trouvée sur l’hexadécyldiméthylamine dans les produits d’ameublement contenant de la mousse de polyuréthane. Faute de données, on a supposé que le scénario des manteaux est sans danger dans les scénarios d’exposition par les voies orale et cutanée à la mousse de polyuréthane contenant de l’hexadécyldiméthylamine (p. ex., meubles). | +/- |
| Aucune étude de toxicité chronique par exposition par voie orale ou par voie cutanée n’a été trouvée. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.6 Octadécylamine
8.6.1 Évaluation de l’exposition
Milieu environnemental
L’octadécylamine a une pression de vapeur et une solubilité dans l’eau faibles. Il n’existe aucune donnée sur les concentrations mesurées d’octadécylamine dans l’air intérieur ou ambiant au Canada. Étant donné sa valeur élevée de pKa de 10,6, l’octadécylamine devrait exister sous forme de protons si elle est rejetée dans l’eau à un pH normal dans l’environnement. Elle ne devrait pas se volatiliser à partir de l’eau (PubChem 2004-2020).
Aucune concentration mesurée d’octadécylamine dans l’eau de surface au Canada n’a été trouvée. Une CEE pour l’octadécylamine a été estimée à 1,3 µg/L pour les intermédiaires de transformation des amines primaires dans un site de transformation (section 7.2.3), d’après le volume d’importation d’octadécylamine comme intermédiaire réactionnel (Environnement Canada 2013). Cette valeur de CEE représente la CEE totale avant la transformation de la concentration de carbone organique dissous en concentration sous la forme dissoute libre. Cette valeur de CEE pour estimer l’apport par l’eau potable est considérée comme prudente. La valeur de l’apport quotidien par poids unitaire pour 1 an est de 4,0 × 10-5 mg/kg p.c./jour (annexe J, tableau J-2).
Aliments
L’octadécylamine peut être présente dans les aliments étant donné son utilisation possible comme composant dans un additif indirect. Plus particulièrement, elle est utilisée comme additif pour l’eau de chaudière et, par conséquent, elle peut être présente dans la vapeur qui pourrait être en contact direct avec un nombre limité d’aliments, à l’exclusion du lait et des produits laitiers. En supposant un scénario défavorable, c.-à-d., que 100 % de l’octadécylamine reste dans les aliments qui peuvent être en contact avec la vapeur, l’apport quotidien probable d’octadécylamine estimé d’après son utilisation comme additif indirect est de 1,7 × 10-3 mg/kg p.c./jour. Cette estimation est prise en compte pour représenter l’exposition de la population générale âgée de 12 mois et plus (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 6 mars 2019; sans référence).
Produits disponibles pour les consommateurs
Cosmétiques
On a rapporté que l’octadécylamine pouvait fonctionner comme agent antistatique dans les cosmétiques (CE 2017). L’exposition estimative par voie cutanée à l’octadécylamine dans la crème à raser est présentée dans le tableau 8-16. Pour des précisions sur la méthode et les paramètres utilisés pour déterminer l’exposition par voie cutanée à l’octadécylamine, veuillez consulter l’annexe H.
Le rapport d’évaluation des risques de l’Union européenne (European Union Risk Assessment Report ou EU RAR) a présenté une valeur d’absorption cutanée de 60 % qui pourrait être appliquée au calcul de l’exposition estimative aux amines primaires, dont l’octadécylamine et les amines alkyles de coco (CE 2008). Cette valeur est fondée sur le résultat d’une étude examinant l’absorption cutanée de la 1-dodécanamine (C12; radiomarquée) dans trois différents solvants (scalène, huile de ricin et citrate d’éthyle) en quatre concentrations différentes (50 %, 5 %, 0,5 % et 0,05 %), appliquée sur la peau de souris (Iwata et coll. 1987). Cette valeur a été utilisée dans le calcul de l’exposition estimative présentée au tableau 8-16.
| Scénario d’exposition | Concentration maximale | Exposition généralisée (mg/kg p.c. par exposition)a |
|---|---|---|
| Produit de rasage pour le corps (9 à 13 ans) | 0,1 %b | 1,4 × 10-3 |
a Comprenant une absorption cutanée de 60 %.
b Communication personnelle, courriels de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 14 décembre 2016; sans référence.
Autres produits
L’octadécylamine a été rapportée comme une impureté dans un additif lubrifiant conçu pour le liquide à transmission pour automobiles, où la concentration maximale de la substance dans le liquide à transmission final devrait être de 1,0 × 10-3 % (communication personnelle, collecte de données volontaire sur les amines aliphatiques, Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, 2017; sans référence). L’exposition des consommateurs devrait être non nulle pour les personnes qui font l’entretien de leur propre véhicule. L’exposition générale par contact cutané, à une absorption cutanée de 60 %, est estimée à 4,5 × 10-4 mg/kg p.c./jour chez les adultes. Pour des précisions sur la méthode et les paramètres utilisés pour déterminer l’exposition estimative par voie cutanée à l’octadécylamine, veuillez consulter l’annexe H.
8.6.2 Évaluation des effets sur la santé
L’Allemagne a rédigé un rapport d’évaluation des risques de l’Union européenne (CE 2008) dans lequel étaient examinées cinq alkylamines primaires, soit l’octadécylamine (no CAS 124-30-1), les alkylamines de suif (no CAS 61790-33-8), la (9Z)-9-octadécén-1‑amine (no CAS 112-90-3), les alkylamines de suif hydrogénées (no CAS 61788-45-2), et les amines alkyles de coco (no CAS 61788-46-3). Ces amines ont été évaluées ensemble dans une approche d’extrapolation en fonction de 1) le groupe amine primaire commun et 2) les voies de métabolisation et de dégradation prédites communes. Une recherche dans la documentation scientifique a été menée pour l’octadécylamine et aucune étude de toxicité pour la santé, qui pourrait avoir une incidence sur l’évaluation des effets sur la santé (c.-à-d., entraîner des critères d’effets critiques différents ou des points de départ plus faibles que ceux trouvés par la CE), n’a été trouvée. En outre, une approche d’extrapolation supplémentaire a été effectuée conformément aux Lignes directrices internationales (OCDE 2014a) et a permis de trouver un autre analogue (alkylamines en C16-22, no CAS 68037-92-3). Les analogues (9Z)-9-octadécén-1-amine, alkylamines en C16-22 et alkylamines de suif se sont révélés être les analogues les plus appropriés dotés de données pour éclairer les critères d’évaluation dont les données sont limitées. Pour une comparaison des propriétés physico-chimiques entre ces analogues, veuillez consulter l’annexe D.
La DSENO la plus faible trouvée dans l’ensemble de données sur les dangers pour tous les analogues était de 3 mg/kg p.c./jour, donnée provenant d’une étude de toxicité pour le développement conforme aux lignes directrices réalisée sur des lapins néo‑zélandais femelles (n = 22/groupe) (Springborn Laboratories Inc. 1989a, mentionné dans CE 2008). Dans cette étude, les animaux ont reçu 0, 3, 10 ou 30 mg/kg p.c./jour de (9Z)-9-octadécén-1-amine (dans de l’huile de maïs), par gavage, du JG 6 au JG 18. Une césarienne a été pratiquée au JG 29. Aux doses supérieures à 10 mg/kg p.c./jour, des signes cliniques évidents ont été observés (p. ex., râles, respiration laborieuse, aucune selle, émaciation, irritation de la gueule), et deux femelles sont mortes à la dose la plus élevée. De plus, les animaux de ces groupes de traitement ont également présenté une diminution de la prise de poids et de la consommation de nourriture. Une DSENO de 3 mg/kg p.c./jour concorde avec la concentration minimale entraînant un effet trouvé dans l’ensemble de données sur les dangers pour l’octadécylamine, qui est composé des données d’études subchroniques et chroniques réalisées avant l’établissement de lignes directrices sur les essais acceptées internationalement (Deichmann et coll. 1958; MacDonald et coll. 1962; Griffin et coll. 1991). Dans l’ensemble de données sur les dangers pour l’octadécylamine, une DSENO de 3 mg/kg p.c./jour a été trouvée d’après les constations faites dans le tube digestif (ganglions mésentériques, intestin grêle) à la dose suivante de 15 mg/kg p.c./jour, provenant d’une étude de toxicité chronique d’un an réalisée chez le chien (Deichmann et coll. 1958).
Aucune étude examinant le potentiel de toxicité pour la reproduction et le développement d’une exposition à l’octadécylamine n’a été trouvée. Cependant, des données sur des analogues indiquent que des effets sur la reproduction et le développement ont été soit absents, soit observés seulement en présence de toxicité générale chez les animaux parents (CE 2008; ECHA 2018e). D’après ces données, l’octadécylamine ne devrait pas être une substance toxique pour la reproduction ou le développement.
L’octadécylamine ne devrait pas être génotoxique d’après les données obtenues d’études de mutagénicité et de clastogénicité in vitro (Zeiger et coll. 1988; Hoechst AG 1988a). En ce qui concerne la cancérogénicité, les études de toxicité chronique sur 2 ans n’ont révélé aucun effet cancérogène (Deichmann et coll. 1958; MacDonald et coll. 1962).
8.6.3 Caractérisation des risques pour la santé humaine
Une étude sur la toxicité pour le développement prénatal retenue par la CE (2008) a été utilisée pour la caractérisation des risques après une exposition à court terme et une exposition chronique. Dans cette étude, une DSENO de 3 mg/kg p.c./jour d’un analogue, la (9Z)-9-octadécén-1-amine, a été établie d’après la toxicité générale (signes cliniques, diminution du poids corporel et de la consommation de nourriture) à la dose suivante de 10 mg/kg p.c./jour. Cette DSENO concorde avec celle trouvée dans une étude d’exposition par voie orale d’un an réalisée sur l’octadécylamine par Deichmann et coll. (1958) chez des chiens bâtards, qui a été déterminé d’après les résultats dans le tube digestif (ganglions mésentériques, intestin grêle) à la dose suivante de 15 mg/kg p.c./jour.
Le tableau 8-17 présente les expositions estimatives pertinentes, les concentrations entraînant un effet critique et les marges d’exposition résultantes pour la caractérisation des risques associés à l’octadécylamine provenant de disponibles pour les consommateurs pour la santé humaine et le milieu environnemental.
| Scénario d’exposition | Population | Exposition générale (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Crème à raser (corps, 0,1 %); cutanée, chronique | 9 à 13 ans | 1,4 x 10-3 | 3 | 2 143 |
| Lubrifiant additif dans le liquide à transmission pour automobiles (0,001 %); cutanée, intermittente | Adultes | 4,54 x 10-4 | 3 | 6 608 |
| Eau potable et additif indirect;orale, chronique | 1 an | 1,7 x 10-3 | 3 | 1 765 |
a Une DSENO de 3 mg/kg p.c./jour a été établie d’après la toxicité générale (p. ex., des signes cliniques, une diminution du poids corporel et de la consommation de nourriture) à la dose suivante de 10 mg/kg p.c./jour, selon une étude de toxicité pour le développement prénatal pour un analogue, la (9Z)-9-octadécén-1-amine. Cette DSENO concorde avec celle établie dans une étude de toxicité par voie orale de 1 an sur l’octadécylamine menée par Deichmann et coll. (1958) chez des chiens bâtards, laquelle a été déterminée d’après les constatations dans le tube digestif (ganglions mésentériques, intestin grêle) à la dose suivante de 15 mg/kg p.c./jour.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.6.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Une extrapolation d’une voie à une autre des études d’exposition par voie orale a été appliquée pour la caractérisation des risques après une exposition cutanée. Une valeur d’absorption cutanée a été appliquée pour l’estimation de l’exposition générale. | +/- |
| Aucune étude sur la toxicité pour la reproduction et le développement. Des données sur les dangers associés aux analogues ont été utilisées pour éclairer l’évaluation. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.7 Amines alkyles de coco
8.7.1 Évaluation de l’exposition
Milieu environnemental
Les amines alkyles de coco sont un liquide dont la pression de vapeur est faible. L’ébauche d’un rapport d’évaluation des risques de l’Union européenne (EU RAR) pour les alkylamines primaires indique qu’aucun rejet d’amines alkyles de coco dans l’atmosphère n’est prévu pendant la production et la transformation. Aussi, la volatilisation depuis un milieu aqueux est négligeable (CE 2008). Par conséquent, aucune exposition des humains depuis une source atmosphérique n’est attendue.
Aucune donnée mesurant les amines alkyles de coco dans l’eau de surface au Canada n’a été trouvée.
Une CEE pour les amines alkyles de coco a été estimée à 1,12 µg/L pour la production et la transformation d’amines aliphatiques à une installation industrielle (section 7.2.2) d’après la production et l’importation d’amines alkyles de coco comme intermédiaires réactionnels (Environnement Canada 2013). Cette valeur de CEE représente la CEE totale avant la transformation de la CEE pour le carbone organique dissous en concentration de la substance dissoute libre. L’utilisation de cette CEE pour estimer l’apport dans l’eau potable est jugée prudente. Cette estimation donne lieu à la valeur d’apport la plus élevée par poids unitaire de 1,5 x 10-4 mg/kg p.c./jour chez les nourrissons de 0 à 5 mois nourris aux préparations pour nourrissons (annexe J, tableau J-2).
Aliments
Les amines alkyles de coco peuvent être présentes comme additif indirect dans des aliments d’après son utilisation possible dans les nettoyants employés sur les surfaces en contact avec des aliments qui sont ensuite rincés à l’eau potable avant la consommation, et comme lubrifiant ayant un contact accidentel ou aucun contact avec des aliments. L’exposition découlant de ces utilisations est négligeable (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 10 janvier 2017; sans référence).
Produits disponibles pour les consommateurs
Cosmétiques
Les amines alkyles de coco auraient des fonctions cosmétiques comme émulsifiant et agent antistatique (CE 2017) et est présent dans un nombre limité de produits revitalisants pour cheveux à rincer au Canada à une concentration de 0,5 % (communication personnelle, courriel de la Direction de la sécurité des produits de consommation et des produits dangereux de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 6 juin 2018; sans référence). Une valeur d’absorption cutanée de 60 % (voir la section 8.6.1) est intégrée dans la valeur estimative de l’exposition apr voie cutanée pour calculer la valeur estimative d’exposition générale associée à l’utilisation de produits revitalisants pour les cheveux. L’exposition est la plus élevée pour les enfants de 2 et 3 ans à 1,04 × 10-2 mg/kg p.c./jour. Pour des précisions sur la méthode et les paramètres utilisés pour calculer l’exposition estimative aux amines alkyles de coco, veuillez consulter l’annexe H.
8.7.2 Évaluation des effets sur la santé
Toxicité à doses répétées
Les effets à court terme des amines alkyles de coco ont été consignés dans le rapport d’une étude de détermination de doses dans laquelle des rats ont reçu 0, 10, 40 ou 160 mg/kg p.c./jour d’amines alkyles de coco (pureté de 100,4 %) par voie orale (gavage) (lignée non connue, n = 3/sexe/dose) pendant au moins 9 jours (durée exacte non précisée dans le rapport) (Exponent 2007). À la dose la plus élevée, un male a été trouvé mort au jour 8 de l’étude et les deux autres mâles ont été sacrifiés à cause d’une toxicité excessive le jour 9. Les animaux présentaient également une diminution du poids corporel. La nécropsie a révélé que tous les lobes du poumon étaient spongieux et tachetés de rouge ou de rouge foncé, mais tous les autres tissus paraissaient normaux. Les femelles du groupe de traitement à la dose la plus élevée ont poursuivi le traitement et se sont accouplées avec des mâles non traités. Deux des femelles ont été sacrifiées avant la fin de l’échéancier, au JG 14 en raison de signes cliniques nocifs et d’une diminution du poids corporel.
D’après les résultats d’une étude de détermination de doses, une étude de toxicité à doses répétées et de toxicité combinée pour la reproduction et le développement (OCDE TG 422) a été menée sur des rats Sprague-Dawley (Crl:CD) (n = 10/sexe/dose) à qui on a administré 0, 5, 20, 40 et 80 mg/kg p.c./jour d’amines alkyles de coco (dans de l’eau désionisée/de l’acide acétique) par gavage pendant les 14 jours précédant l’accouplement jusqu’au jour précédant le sacrifice. Les résultats de cette étude n’étaient accessibles que dans le rapport d’évaluation des risques pour la santé humaine intitulé N-Alkyl (C8-C18) Primary Amines and Acetate Salts (NAPAAS) Inert Ingredients Human Health Risk Assessment (US EPA 2009). Dans ce rapport, il est indiqué que les rats mâles ont été traités pendant au moins 46 jours et les femelles jusqu’au jour de lactation (JL) 4 (traitement pendant environ 38 à 42 jours). De plus, cinq animaux/sexe/groupe ont été soumis à une batterie d’observations fonctionnelles, puis à un essai sur l’activité motrice le jour prévu du sacrifice. À 20 mg/kg p.c./jour, des lésions microscopiques ont été rapportées dans l’estomac (érosions, hyperplasie/hyperkératose, nécrose), le jéjunum (infiltration de macrophages chez les mâles), le thymus (atrophie du thymus chez les femelles) et les ganglions mésentériques (infiltration de macrophages chez les mâles). Dans les ganglions lymphatiques et le foie des animaux touchés, les macrophages se sont agglutinés pour former des microgranulomes. À des doses plus élevées, l’incidence et la gravité de ces lésions ont augmenté proportionnellement à la dose et ces lésions affectaient souvent les deux sexes. À 40 et à 80 mg/kg p.c./jour, des effets cliniques ont été observés, ainsi qu’une diminution de la prise de poids corporel et de la consommation de nourriture. La dose la plus élevée a été également associée à une diminution significative du poids corporel à la fin du traitement et une diminution des poids absolus et relatifs du foie, des reins et du cœur chez les mâles, ainsi qu’à une diminution significative du poids relatif des testicules, de l’encéphale et des surrénales. Deux des rats ayant reçu la dose élevée ont été sacrifiés à cause d’une toxicité grave. Une DSENO générale de 5 mg/kg p.c./jour a été établie par l’US EPA d’après les lésions observées dans l’estomac, le jéjunum, le thymus et les ganglions lymphatiques à la dose suivante (20 mg/kg p.c./jour).
Toxicité pour la reproduction et le développement
Dans l’étude de toxicité à doses répétées et de dépistage de toxicité combinée pour la reproduction et le développement mentionnée plus haut (JITF CST 25 2008, mentionné dans US EPA 2009), aucun effet sur la reproduction ou la fertilité n’a été observé. En ce concerne la toxicité pour le développement, une diminution significative du poids corporel des petits a été observée dans les groupes ayant reçu les doses de 40 et de 80 mg/kg p.c./jour, qui peut être liée à la toxicité maternelle, puisqu’une diminution du poids corporel et de la consommation de nourriture a été observée chez les mères à ces doses. L’US EPA (2009) a établi une DSENO de 20 mg/kg p.c./jour pour la toxicité pour le développement d’après une diminution du poids corporel et de la prise de poids corporel chez les rejetons à la dose suivante (40 mg/kg p.c./jour).
Génotoxicité et cancérogénicité
Les amines alkyles de coco ne devraient pas être génotoxiques d’après les données d’études de mutagénicité bactérienne (Hoechst AG 1988b, comme il est mentionné dans CE 2008). En ce qui concerne la cancérogénicité, aucune étude chronique sur les amines alkyles de coco n’a été trouvée. Aucun effet cancérogène n’a été observé dans le groupe des amines aliphatiques en général et il n’y a eu aucune alerte structurale liée au cancer produite par la modélisation (Boîte à outils QSAR de l’OCDE 2017).
8.7.3 Caractérisation des risques pour la santé humaine
L’étude de toxicité à doses répétées et de dépistage de toxicité combinée pour la reproduction et le développement rapportée par l’US EPA (2009) a été utilisée pour la caractérisation des risques après une exposition chronique par voies cutanée et orale aux amines alkyles de coco. Une DSENO de 5 mg/kg p.c./jour a été établie d’après des lésions histopathologiques observées dans le thymus, l’estomac, le jéjunum et les ganglions mésentériques à la dose suivante (20 mg/kg p.c./jour). L’US EPA a également trouvé la même étude et le même critère d’effet critique pour l’évaluation des risques pour la santé humaine intitulée NAPAAS Human Health Risk Assessment (US EPA 2009).
Le tableau 8‑19 présente les expositions estimatives pertinentes, les concentrations entraînant un effet critique et les marges d’exposition résultantes pour la caractérisation des risques associés aux amines alkyles de coco dans les revitalisants capillaires à rincer, risques pour la santé humaine et le milieu environnemental.
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Revitalisant capillaire à rincer (0,5 %); cutanée, chronique | 2 à 3 ans | 1,04 × 10-2 | 5 | 481 |
| Eau potable; orale, chronique | Nourrissons | 1,5 × 10-4 | 5 | 33 333 |
a Une DSENO de 5 mg/kg p.c./jour a été établie d’après les résultats histologiques dans le tube digestif (estomac, intestin, ganglions mésentériques), le thymus et le foie observés à la dose suivante de 20 mg/kg p.c./jour.
Ces ME sont considérées comme suffisantes pour prendre en compte les incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.7.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Aucune étude de toxicité par voie cutanée n’a été menée sur les amines alkyles de coco. L’extrapolation d’une voie à une autre des études par voie orale a été appliquée pour la caractérisation des risques après une exposition par voie cutanée. Une valeur d’absorption cutanée a été appliquée pour l’estimation de l’exposition générale. | +/- |
| Aucune étude de toxicité chronique sur les amines alkyles de coco n’a été trouvée. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.8 Amines, bis(alkyle de suif hydrogéné) (NASAS)
8.8.1 Évaluation de l’exposition
Milieu environnemental
Les NASAS sont un solide qui est non soluble dans l’eau. Aucune donnée de quantification des concentrations de cette substance dans le milieu environnemental n’a été trouvée.
Les NASAS (no CAS 61789-79-5) sont des UVCB dont la longueur de la chaîne carbonée varie de C14-C18, la plus abondante ayant une chaîne en C18 saturée (US EPA 2010). Les NASAS sont également appelées « N-(alkyl en C16-18)alcane-1-amine en C16-C18 » et « N-(alkyl en C16 ou C18)alcane-1-amine en C16 ou C18 » (no CAS 308062-60-4) dans un dossier d’homologation de REACH et par l’OCDE (2014b). La N-(C16-C18)alkyl(C16-C18)alkane-1-amine est un solide qui a une pression de vapeur faible (2,0 × 10-3 Pa) et n’est pas soluble dans l’eau (ECHA 2018f).
La CEE des NASAS a été estimée à 1,12 µg/L pour la fabrication et la transformation des amines aliphatiques dans une installation industrielle (section 7.2.2) d’après les volumes fabriqués et importés de NASAS comme intermédiaire réactionnel. Cette valeur de CEE représente la CEE totale avant sa conversion pour le carbone organique dissous en concentration de la forme dissoute libre. L’utilisation de cette CEE pour estimer l’apport par l’eau potable intake est jugée prudente. Cette estimation donne lieu à une valeur d’apport chez l’adulte de 2,0 × 10-5 mg/kg p.c./jour (annexe J, tableau J-2).
Aliments
Les NASAS peuvent être utilisées comme stabilisant dans la fabrication des matières plastiques en polypropylène utilisées pour la production de matériaux d’emballage d’aliments, pouvant avoir un contact direct avec les aliments. La dose journalière probable de NASAS par son utilisation dans des applications d’emballage d’aliments est de 1,2 × 10-3 mg/kg p.c./jour pour la population générale âgée de 12 mois et plus (communication personnelle, courriel de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 10 janvier 2017; sans référence).
8.8.2 Évaluation des effets sur la santé
Comme mentionné dans la section 8.8.1, les NASAS sont également appelées « N‑(alkyl en C16-18)alcane-1-amine en C16-C18 » et « N-(alkyl en C16 ou C18)alcane-1‑amine en C16 ou C18 » (no CAS 308062-60-4) dans un dossier d’homologation de REACH et par l’OCDE (2014b). Par conséquent, les données sur les dangers trouvés pour ces synonymes ont également été pris en considération dans la présente évaluation préalable.
Toxicité à doses répétées
Les effets à court terme de la « N-(alkyl en C16 ou C18)alcane-1-amine en C16 ou C18 » (no CAS 308062‑60‑4) ont été examinés dans une étude de 28 jours, dans laquelle des rats Wistar (n = 5-10/sexe/groupe) ont reçu 0, 50, 200 ou 1000 mg/kg p.c./jour de la substance à l’essai (dans de l’huile de maïs), par gavage (anonyme 2010, mentionné dans ECHA 2018f). Les rats du groupe témoin et du groupe de traitement à dose élevée ont également été soumis à une période de récupération de 14 jours. Aux doses égales ou supérieures à 50 mg/kg p.c./jour, une augmentation significative des poids absolu et relatif du foie a été observée. Des changements histopathologiques ont également été constatés dans les ganglions mésentériques (inflammation granulomateuse), effet qui semble être irréversible car un épaississement des ganglions mésentériques a été noté chez les femelles pendant la période de récupération. À la dose la plus élevée (1 000 mg/kg p.c./jour), les effets dans les ganglions mésentériques se sont aggravés et ont persisté durant la période de récupération. Une inflammation granulomateuse a également été observée dans le foie et les poumons des animaux traités, tout au long de l’étude et pendant la période de récupération. En outre, le poids (absolu/relatif) de la rate a augmenté de manière significative chez les femelles, augmentation accompagnée d’une agrégation des macrophages. Parmi les autres effets liés au traitement à cette dose, notons des changements hématologiques dans le nombre total et différentiel des leucocytes, une diminution du poids des testicules et une diminution du poids du thymus. Puisque bon nombre des effets observés ont persisté pendant la période de récupération de deux semaines et montraient un lien avec la dose (c.-à-d., inflammation des ganglions mésentériques), les auteurs ont conclu qu’il n’était pas possible d’établir une DSENO. Pour la présente évaluation, une DMENO de 50 mg/kg p.c./jour a été prise en compte d’après les effets sur les ganglions mésentériques et le foie causés à cette dose.
Dans le rapport d’une étude de toxicité subchronique, des Wistar (n = 10/sexe/groupe) ont reçu 0, 5, 15 ou 50 mg/kg/jour d’« N-(alkyl en C16 ou C18)alcane-1-amine en C16 ou C18 » (dans de l’huile de maïs), par gavage, pendant 92 ou 93 jours (anonyme 2014, mentionné dans ECHA 2018f). On a ajouté 5 animaux par sexe dans le groupe de traitement à la dose élevée qui a été suivi pendant une période de récupération de 42 jours. Les principaux effets liés au traitement rapportés étaient des foyers granulomateux dans les ganglions mésentériques et une hyperplasie des cellules lymphoïdes. Ces effets se sont produits dans tous les groupes et se sont aggravés avec l’augmentation des doses, et ils ont persisté après la période de récupération chez les animaux ayant reçu la dose élevée. Parmi les autres effets liés au traitement à la dose la plus élevée (c.‑à‑d., 50 mg/kg p.c./jour), notons une augmentation significative de la concentration moyenne des neutrophiles et une diminution du nombre absolu moyen de lymphocytes. Après la période de récupération, il y a eu une diminution du nombre absolu et relatif des réticulocytes et une évolution dans la maturité des réticulocytes passant d’un signal fluorescent fort à un signal fluorescent faible. Le rapport indique que les « granulomes dans les ganglions mésentériques sont généralement considérés comme non nocifs (…) ». Cependant, puisque des effets sur les ganglions mésentériques ont été observés pour d’autres amines aliphatiques de ce groupe et peuvent évoluer vers les formes les plus graves de toxicité générale (p. ex., foyers granulomateux), une DMENO de 5 mg/kg p.c./jour a été prise en compte pour la présente évaluation préalable.
Toxicité pour la reproduction et le développement
Aucune étude examinant la toxicité possible pour la reproduction des NASAS n’a été trouvée. Aucun effet sur les organes reproducteurs, le cycle œstral ou la spermatogénèse n’a été observé dans l’étude de toxicité subchronique réalisée sur des rats Wistar ayant reçu jusqu’à 50 mg/kg p.c./jour de N-(alkyl en C16 ou C18)alcane-1‑amine en C16 ou C18, par gavage, pendant 92 ou 93 jours (anonyme 2014, mentionné dans ECHA 2018f). En ce qui concerne la toxicité pour le développement, aucun effet sur les fœtus n’a été trouvé dans le rapport d’une étude de toxicité sur le développement prénatal dans laquelle des rates Wistar en gestation (n = 22/dose) ont reçu jusqu’à 1 000 mg/kg p.c./jour de « N-(alkyl en C16 ou C18)alcane-1-amine en C16 ou C18 » dans de l’huile de maïs, par gavage, du JG 6 au JG 20 (anonyme 2014, mentionné dans ECHA 2018f).
Génotoxicité et cancérogénicité
Les NASAS ne devraient pas être génotoxiques d’après les données provenant d’études de mutagénicité et de clastogénicité in vitro (ECHA 2018f). En ce qui concerne la cancérogénicité, aucun effet cancérogène n’a été observé dans le groupe des amines aliphatiques en général de même qu’aucune alerte structurale liée au cancer de la modélisation n’a été signalée (Boîte à outils QSAR de l’OCDE 2017).
8.8.3 Caractérisation des risques pour la santé humaine
Une étude de toxicité subchronique rapportée dans un dossier d’homologation de REACH (anonyme 2014, mentionné dans ECHA 2018f) a été utilisée pour la caractérisation des risques après une exposition chronique par voie orale aux NASAS. Une DMENO de 5 mg/kg p.c./jour a été établie d’après des effets histopathologiques observés dans les ganglions mésentériques (c.-à-d., foyers granulomateux et hyperplasie).
Le tableau 8‑21 présente l’exposition estimative, la concentration entraînant un effet critique et la marge d’exposition résultante pour la caractérisation des risques associés aux NASAS des emballages pour aliments et de l’eau potable pour la santé humaine.
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour)a | ME |
|---|---|---|---|---|
| Emballages pour aliments, eau potable;orale, chronique | Adulte | 1,35 × 10-3 | 5 | 3 704 |
a Une DMENO de 5 mg/kg p.c./jour a été établie d’après des effets histopathologiques dans les ganglions mésentériques (c.-à-d., foyers et hyperplasie granulomateux), d’une étude de toxicité subchronique chez les rats.
Cette ME est considérée comme suffisante pour tenir compte des incertitudes quant aux effets sur la santé et les bases de données sur les expositions.
8.8.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Aucune étude de toxicité chronique n’a été trouvée pour les NASAS ou ses synonymes. | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
8.9 N-[3-(Tridécyloxy)propyl]propane-1,3-diamine ramifiée (TDPDA)
8.9.1 Évaluation de l’exposition
Milieu environnemental
La TDPDA est un solide ayant une pression de vapeur et une solubilité dans l’eau faibles. Aucune TDPDA n’a été trouvée ni mesurée dans le milieu environnemental au Canadian ou à l’étranger.
Une CEE pour la TDPDA a été estimée à 0,248 µg/L pour le rejet par sa principale utilisation dans la flottation de minerai de fer (section 7.2.6). Cette valeur de CEE représente la CEE totale avant transformation de la concentration de carbone organique dissous en concentration sous forme dissoute libre. L’utilisation de cette CEE pour l’estimation de l’apport par l’eau potable est considérée comme prudente. Cette estimation donne lieu à une valeur d’apport par poids unitaire chez les nourrissons de 0 à 5 mois nourris par des préparations pour nourrissons de 3,0 × 10-5 mg/kg p.c./jour (annexe J, tableau J-2).
Produits disponibles pour les consommateurs
De la TDPDA a été trouvée dans un produit adhésif à l’époxy en deux composants à usage marin au Canada à une concentration de 5 % à 10 % (SDS 2018a). La principale voie d’exposition est cutanée en raison de la pression de vapeur faible de la substance. Les expositions par voie cutanée associées au mélange et à l’application de ce produit ont été estimées à l’aide de ConsExpo Web (ConsExpo Web 2017). Pour des précisions sur les paramètres utilisés pour estimer l’exposition, veuillez consulter l’annexe H. Parce que les deux composants en volumes égaux sont mélangés, la concentration de la TDPDA pendant l’application est la moitié de celle présente dans le produit original (c.-à-d., 2,5 % à 5 %). L’exposition unique découlant du mélange et de l’application de la colle à l’époxy en deux composants varie de 0,07 à 0,14 mg/kg p.c./jour (pour les produits à 5 % ou à 10 %, respectivement). L’exposition unique estimative est établie d’après l’hypothèse que l’absorption cutanée est équivalente à l’absorption suivant l’apport par voie orale.
8.9.2 Évaluation des effets sur la santé
L’ensemble de données sur les dangers associés à cette substance a été considéré comme limité et une approche d’extrapolation a été appliquée pour éclairer l’évaluation des effets sur la santé. L’acétate de N-[3-(alkyl ramifié en C11-14 riche en C13)oxy)propyl]propane-1,3-diamine (no CAS inconnu; no CE 931-295-2) a été trouvée comme analogue et il s’agit d’un mélange d’UVCB contenant la TDPDA, son acétate et d’autres constituants similaires de longueur de chaîne carbonée variable (C11-C14) (ECHA 2018g). Les structures représentatives de l’analogue et de la TDPDA sont similaires, car ils sont tous deux des diamines, ils possèdent une liaison éther et contiennent une chaîne carbonée d’environ 13 atomes de carbone. De plus, ils ont des propriétés physico-chimiques similaires, comme l’état physique et les points d’ébullition (ECHA 2018g,h). Bien qu’aucune donnée toxicokinétique n’ait été trouvée, la modélisation prédit que l’analogue et la TDPDA passeront par des voies métaboliques similaires (p. ex., ajout de groupes alcool et carboxyle, hydrolyse) (Boîte à outils QSAR de l’OCDE 2017).
Toxicité à doses répétées
Les effets à court terme de l’analogue acétate de N-[3-(alkyl ramifié en C11-14 riche en C13)oxy)propyl]propane-1,3-diamine ont été examinés dans trois études résumées dans un dossier d’homologation de REACH, dont deux sont des études de détermination de la plage de toxicité de durées de 10 et de 14 jours (anonyme 2010, mentionné dans ECHA 2018g). Dans l’étude de 10 jours, des rats Wistar (n = 3/sexe/dose) ont reçu 0, 30, 100 et 300 mg/kg p.c./jour de la substance (dans de l’huile de maïs), par gavage. À la dose faible, on a observé de la dyspnée, une diminution de la prise de poids, une diminution du nombre de lymphocytes (coïncidant avec une variation du poids du thymus), une augmentation du nombre de neutrophiles et de monocytes (dommages aux tissus et inflammation des tissus), une augmentation du nombre de plaquettes, une diminution de l’albumine (dommages au foie), une diminution des acides biliaires et une augmentation des triglycérides. À des doses plus élevées, des signes cliniques plus graves ont été constatés, avec une diminution du poids corporel. En outre, des observations macroscopiques de rétraction de la muqueuse de l’estomac, un changement de coloration du pancréas, une réduction de la taille de la rate et une dilatation du bassinet du rein ont été rapportés. Vers la fin de l’étude, tous les animaux des groupes ayant reçu une dose intermédiaire ou élevée soit étaient morts, soit ont été sacrifiés in extremis. Une DMENO de 30 mg/kg p.c./jour a été établie d’après une diminution de la prise de poids, des effets sur le thymus, des variations hématologiques et des observations en chimie clinique.
Dans une étude similaire dans laquelle des rats Wistar (n = 3/sexe/dose) ont reçu 0, 3, 10 ou 30 mg/kg p.c./jour de l’analogue (dans de l’huile de maïs), par gavage, pendant 14 jours, les effets observés à la dose la plus élevée (30 mg/kg p.c./jour) étaient semblables à ceux observés dans l’étude précédente (c.-à-d., signes cliniques, diminution du poids corporel, diminution du nombre de lymphocytes, diminution du poids du thymus, augmentation des neutrophiles et des monocytes, diminution de l’albumine, augmentation des globulines, augmentation du poids de la rate et du foie) (anonyme 2010, mentionné dans ECHA 2018g). Bien que certains de ces effets aient également été observés aux doses plus faibles (3 et 10 mg/kg p.c./jour), le dossier d’homologation de REACH indique qu’« une DSENO pouvait être considérée comme étant de 10 mg/kg p.c./jour, car les légers changements constatés à cette dose sur les leucocytes (augmentation du nombre chez les mâles), le poids du foie (mâles) et le poids de la rate ne montrent pas une relation avec la dose complète… et ne sont pas observés à la dose la plus élevée dans la précédente étude de détermination des doses ».
Lorsque des rats Wistar (n = 5/sexe/dose) ont reçu 0, 3, 9 et 25 mg/kg p.c./jour de l’analogue (dans de l’huile de maïs), par gavage, pendant 28 jours, des effets similaires ont été observés à toutes les doses comme dans les études précédentes (anonyme 2015, mentionné dans ECHA 2018g). À la dose la plus faible, les effets statistiquement significatifs ayant dépassé les plages de valeurs historiques des groupes témoin comprenaient une augmentation des réticulocytes, une augmentation du nombre absolu et relatif des neutrophiles, une diminution du nombre de lymphocytes, une augmentation du nombre de monocytes et une diminution de l’albumine chez les mâles. Chez les femelles, il y a eu une augmentation du nombre relatif des neutrophiles et une diminution du nombre de lymphocytes. De plus, certains animaux présentaient des ganglions mésentériques nodulaires et/ou rougeâtres accompagnés de nécrose et d’inflammation granulomateuse, ainsi que d’un nombre minime de granulomes au foie, de l’inflammation et/ou d’histiocytes submuqueux d’aspect mousseux dans l’intestin grêle. À des doses plus élevées, on a également noté des effets sur la rate (hématopoïèse extramédullaire) et le thymus (atrophie, coloration rougeâtre), des lésions dans différentes articulations (chevilles, os tarsiens et/ou genoux), et des effets sur les organes reproducteurs (poids de l’utérus, de la prostate et des glandes vésiculeuses), accompagnés de signes cliniques (posture voûtée, fourrure ébouriffée et dyspnée), d’une diminution de la consommation de nourriture, d’une diminution du poids corporel et de mortalité. Les observations histopathologiques dans les ganglions mésentériques et la rate ont persisté tout au long d’une période de récupération de 14 jours qui a été donnée aux animaux ayant reçu la dose intermédiaire. Le dossier d’homologation de REACH indique que la nécrose et/ou les processus inflammatoires observés dans l’estomac, l’intestin grêle, les ganglions mésentériques, le foie, le thymus, le cœur et les articulations ont été considérés comme nocifs. Une DMENO DE 3 mg/kg p.c./jour a été établie.
Dans le rapport d’une étude de toxicité subchronique de 90 jours menée conformément à l’essai no 408 des Lignes directrices de l’OCDE, des rats Wistar (n = 10/sexe/dose) ont reçu l’analogue acétate de N-(3-(tridécyloxy ramifié)propyl)propane-1,3-diamine (dans du propylèneglycol), par gavage, aux doses de 0, 0,5, 2,2 ou 8,8 mg/kg p.c./jour (anonyme 2015, mentionné dans ECHA 2018g). Des signes cliniques (enflure et hypotonie des pattes postérieures, des talons, des pattes ou de la queue, démarche anormale) et de la mortalité ont été observés à toutes les doses, plus fréquemment aux doses élevées. À la dose d’essai la plus faible, il y a eu des effets hématologiques statistiquement significatifs (c.‑à‑d., une augmentation du nombre de leucocytes, de neutrophiles et de monocytes, une diminution de l’hémoglobine, une diminution de l’hématocrite, une diminution du volume globulaire moyen, une diminution de la teneur globulaire moyenne en hémoglobine) et des variations dans la chimie clinique (diminution de l’albumine, du glucose et du calcium). À la nécropsie, des lésions aux poumons ont été observées, avec des organes hypertrophiés (foie, rate, ganglions mésentériques, ganglions lymphatiques pelviens), un épaississement d’appendices (pieds postérieurs, queue, genoux), une diminution des muscles de la cuisse et des effets sur l’appareil reproducteur des femelles (col de l’utérus et vagin). Ces observations ont été étayées par des examens histopathologiques qui ont révélé une augmentation de l’inflammation dans les poumons, la présence de granulomes dans le foie et les ganglions mésentériques, une atrophie des cellules acineuses du pancréas, de l’arthrite (articulations du tarse, vertèbres de la queue) et une hyperplasie myéloïde de la moelle osseuse du sternum. À des doses plus élevées, des effets similaires ont été observés, mais à une incidence et à une gravité plus importante. De plus, certains des effets inflammatoires étendus à d’autres organes comme la rate, les ganglions lymphatiques poplités, les ganglions lymphatiques pelviens, les ganglions lymphatiques rénaux, le thymus et la cavité abdominale. Ces doses ont également été associées à une diminution du poids corporel et de la consommation de nourriture, et à la mortalité. À la dose la plus élevée, certains des animaux ont été sacrifiés in extremis en raison de la présence d’enflure aux tarses et aux métatarses, d’enflure aux pattes postérieures et/ou d’une démarche anormale. Le dossier d’homologation de REACH indique qu’une DSENO n’a pu être établie et qu’une DMENO de 0,5 mg/kg p.c./jour a donc été établie d’après les effets inflammatoires observés dans l’intestin grêle, les ganglions mésentériques, le foie, les poumons, la rate et les pattes postérieures.
Toxicité pour le développement et la reproduction
Dans le rapport d’une étude de toxicité pour le développement prénatal menée conformément à l’essai no 414 des Lignes directrices de l’OCDE, des rates Wistar en gestation (n = 22 femelles/dose) ont reçu 0, 3, 7 ou 15 mg/kg p.c./jour de l’analogue acétate de N-(3-(tridécyloxy ramifié)propyl)propane-1,3-diamine (dans du propylèneglycol), par gavage, du JG 6 au JG 20 (15 jours) (anonyme 2015, mentionné dans ECHA 2018g). À la dose la plus élevée, des signes de toxicité maternelle entraînant la mort ont été observés (léthargie, posture voûtée, horripilation, diminution du poids corporel, mortalité). Des effets macroscopiques sur les ganglions mésentériques (p. ex., hypertrophie) et le tube digestif (p. ex., épaississement de l’iléum) ont été observés à toutes les doses à l’essai. Ces effets ont été accompagnés d’observations histopathologiques comme la présence de macrophages d’aspect mousseux et d’une inflammation granulocytaire (nécrosante). Aucun effet lié au traitement n’a été trouvé sur le nombre de corps jaune ou de sites d’implantation. De plus, il n’y a eu aucun effet lié au traitement sur le nombre de fœtus viables, la taille de la portée, le rapport de masculinité, les résorptions précoces ou tardives ou les pertes post-implantatoires. Aux doses de 7 et de 15 mg/kg p.c./jour, une tendance s’est dégagée vers une augmentation du nombre de sternèbres non ossifiés. À la dose la plus élevée, une diminution significative du poids corporel des fœtus a été décelée, et une DSENO de 3 mg/kg p.c./jour a été trouvée dans le dossier d’homologation de REACH. Ces effets se sont produits en présence de toxicité maternelle.
Aucune étude de toxicité pour la reproduction n’a été trouvée pour la TDPDA ou son analogue. Aucun effet sur le nombre de corps jaunes, de sites d’implantation ou de pertes post-implantatoires n’a été rapporté dans l’étude de toxicité pour le développement prénatal mentionnée précédemment (anonyme 2015, mentionné dans ECHA 2018g). Dans l’étude sur la toxicité subchronique par voie orale (gavage) présentée plus haut (se reporter à la section intitulée Toxicité à doses répétées), des effets ont été notés sur l’appareil reproducteur féminin. Cependant, aucun changement sur le cycle œstral n’a été détecté. Dans le dossier d’homologation de REACH, on semble indiquer que ces effets étaient dus au mauvais état de santé des animaux (anonyme 2015, mentionné dans ECHA 2018g).
Génotoxicité et cancérogénicité
La TDPDA ne devrait pas être génotoxique d’après les données provenant d’études de mutagénicité et de clastogénicité in vitro menées sur l’analogue (ECHA 2018g). En ce qui concerne la cancérogénicité, aucun effet cancérogène n’a été observé pour le groupe des amines aliphatiques, en général, et aucune alerte structurale liée au cancer n’a été détectée lors de la modélisation (Boîte à outils QSAR de l’OCDE 2017).
8.9.3 Caractérisation des risques pour la santé humaine
Puisque l’ensemble de données sur les dangers pour la TDPDA était limité, une approche d’extrapolation a été appliquée, d’où l’utilisation de données sur des analogues pour éclairer l’évaluation. Pour les scénarios d’exposition intermittente et chronique, l’étude subchronique résumée dans un dossier d’homologation de REACH pour un analogue (anonyme 2015, mentionné dans ECHA 2018g) a été utilisée pour la caractérisation des risques associés à la TDPDA, car elle a montré l’effet le plus sensible sur la santé de l’ensemble de données. Une DMENO de 0,5 mg/kg p.c./jour a été établie d’après les effets inflammatoires observés à la dose faible dans l’intestin grêle, les ganglions mésentériques, le foie et les poumons, en plus de la rate et des pattes postérieures aux doses plus élevées.
Le tableau 8‑23 présente toutes les expositions estimatives, les concentrations entraînant un effet critique et les marges d’exposition résultantes pour la caractérisation des risques associés à la TDPDA provenant des produits à l’époxy disponibles pour les consommateurs pour la santé humaine et le milieu environnemental.
| Scénario d’exposition | Population | Exposition estimative (mg/kg p.c./jour) | Concentration d’effet critique (mg/kg p.c./jour) | ME |
|---|---|---|---|---|
| Mélange et application de produit à l’époxy (5 %-10 %) pour utilisation marine; cutanée; par exposition | Adulte | 0,07 à 0,14 | 0,5a | 4 à 7 |
| Apport par l’eau potable; orale, chronique | 0 à 5 mois | 3,3 × 10-5 | 0,5a | 15 377 |
a Une DMENO de 0,5 mg/kg p.c./jour a été établie au moyen d’une étude de toxicité subchronique d’après les effets inflammatoires observés à la dose faible dans l’intestin grêle, les ganglions mésentériques, le foie et les poumons, en plus de la rate et des pattes postérieures aux doses plus élevées.
En ce qui concerne per-event dermal and exposition par inhalation to la TDPDA in a marine epoxy product, la ME de 4 à 7 est considérée comme potentiellement insuffisante pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
En ce qui concerne l’exposition chronique par voie orale à la TDPDA par l’eau potable, la ME de 15 377 est considérée comme suffisante pour tenir compte des incertitudes dans les effets sur la santé et les bases de données sur l’exposition.
8.9.4 Incertitudes dans l’évaluation des risques pour la santé humaine
Les principales sources d’incertitudes sont présentées dans le tableau ci-dessous.
| Principale source d’incertitudes | Impact |
|---|---|
| Aucune étude de toxicité par voie cutanée et par inhalation n’a été trouvée. L’extrapolation d’une voie à une autre depuis des études de toxicité par voie orale a été appliquée pour la caractérisation des risques après des expositions par ces voies. L’absorption par la voie cutanée et par inhalation a été considérée comme équivalente à l’absorption par la voie orale. | +/- |
| Aucune étude de toxicité chronique n’a été trouvée pour les voies d’exposition pertinentes (voies orale et cutanée, et inhalation). | +/- |
+ = incertitude pouvant entraîner une surestimation de l’exposition/du risque; - = incertitude pouvant entraîner une sous-estimation de l’exposition/du risque; +/- = potentiel inconnu d’entraîner une surestimation ou une sous‑estimation du risque.
9. Conclusion
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les amines aliphatiques à chaîne(s) longue(s) présentent un risque d’effets nocifs pour l’environnement. Il est proposé de conclure que les amines aliphatiques à chaîne(s) longue(s), comprenant les neuf amines aliphatiques à chaîne(s) longue(s) visées dans la présente évaluation, satisfont au critère de l’alinéa 64a) de la LCPE, car elles peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. Toutefois, il est proposé de conclure que les amines aliphatiques à chaîne(s) longue(s), comprenant les neuf amines aliphatiques à chaîne(s) longue(s) visées dans cette évaluation, ne satisfont pas au critère de l’alinéa 64b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à mettre en danger l’environnement essentiel pour la vie.
Compte tenu de tous les éléments de preuve contenus dans la présente ébauche d’évaluation préalable, les quatre amines aliphatiques à chaîne(s) courte(s) [benzyldiméthylamine, 2,2’-iminodi(éthylamine), diméthylamine et éthylènediamine] présentent un risque faible de causer des effets nocifs pour l’environnement. Il est proposé de conclure que la benzyldiméthylamine, la 2,2’-iminodi(éthylamine), la diméthylamine et l’éthylènediamine ne satisfont pas aux critères des alinéas 64a) et b) de la LCPE, car elles ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, et à mettre en danger l’environnement essentiel pour la vie.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la TDPDA satisfait au critère énoncé à l’alinéa 64c) de la LCPE, car elle pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des renseignements contenus dans la présente ébauche d’évaluation préalable, il est proposé de conclure que la benzyldiméthylamine, l’éthylènediamine, la 2,2’-iminodi(éthylamine), la diméthylamine, l’hexadécyldiméthylamine, l’octadécylamine, les amines alkyles de coco, la NASAS, l’AAASH, l’AAAS, l’ASPDA, l’ASTMPDA ne satisfont pas au critère de l’alinéa 64c) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que toutes les amines aliphatiques à chaîne(s) longue(s), comprenant l’hexadécyldiméthylamine, l’octadécylamine, les amines alkyles de coco, la NASAS, l’AAASH, l’AAAS, l’ASPDA, la TDPDA et l’ASTMPDA, satisfont à un ou à plusieurs des critères énoncés à l’article 64 de la LCPE, et que la benzyldiméthylamine, l’éthylènediamine, la 2,2’-iminodi(éthylamine) et la diméthylamine ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
Il est également proposé de conclure que les amines aliphatiques à chaîne(s) longue(s) en C14 ou plus longue(s) répondent au critère de bioaccumulation énoncé dans le Règlement sur la persistance et la bioaccumulation de la LCPE, mais celles dont les chaînes alkyles sont plus courtes qu’en C14, ainsi que les amines aliphatiques à chaîne(s) longue(s) ne répondent pas au critère de la persistance énoncé dans le Règlement sur la persistance et la bioaccumulation de la LCPE.
Références
Abe S, Sasaki M. 1977. Chromosome aberrations and sister chromatid exchanges in Chinese hamster cells exposed to various chemicals. J Natl Cancer Inst. 58(6):1635-1641. [Disponible en anglais seulement]
ACD/Percepta [prediction module]. c1997-2012. Toronto (Ont.): Advanced Chemistry Development, Inc. [Disponible en anglais seulement]
[ACIA] Agence canadienne d’inspection des aliments. 2019. Résidus chimiques dans les aliments. Ottawa, Ont. Canada.
Akzo Nobel. 1998. Biodegradation and environmental fate of tallow amine. Final Research Report. Arnhem (NL): Akzo Research Laboratories. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Akzo Nobel. 2002a. Determination of the removal of cocoamine in a simulation test of an activated sludge plant treating domestic wastewater. Final Research Report. Arnhem (NL): Akzo Research Laboratories. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Akzo Nobel. 2002b. Determination of the removal of cocoamine in a simulation test of an activated sludge plant treating industrial wastewater. Final Research Report. Arnhem (NL): Akzo Research Laboratories. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Akzo Nobel. 2006. Bioconcentration of 1-Hexadecylamine (C16 primary amine) in the carp, Cyprinus carpio, under flow-through conditions. Arnhem (NL): Akzo Research Laboratories. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Akzo Nobel. 2010. Surface chemistry: general catalog [PDF]. Chicago (IL): Akzo Nobel Surface Chemistry LLC. [Consulté le 14 juin 2018]. [Disponible en anglais seulement]
Aldrich FD, Stange AW, Geesaman RE. 1987. Smoking and ethylene diamine sensitization in an industrial population. J Occup Med. 29(4):311-314. . [Disponible en anglais seulement]
[ASTER] Assessment Tools for the Evaluation of Risk. 1999. Duluth (MN): US Environmental Protection Agency, Mid-Continent Ecology Division. [Accès restreint]. [Disponible en anglais seulement]
Barron MG, Lilavois CR, Martin TM. 2015. MOAtox: A comprehensive mode of action and acute aquatic toxicity database for predictive model development. Aquat Toxicol. 161:102-107. [Disponible en anglais seulement]
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [base de données]. [Modifié le 22 février 2019]. Ottawa (Ont.) : gouvernement du Canada. [Mis à jour le 1er novembre 2016; consulté le 4 octobre 2018].
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [Modifié le 17 juillet 2015]. Ottawa (Ont.) : gouvernement du Canada. [Consulté le 4 octobre 2018].
[BDPSNH] Base de données sur les produits de santé naturels homologués; [modifiée le 6 février 2018]; Ottawa (ON) : Santé Canada.
Bernhard MJ, Dyer SD. 2005. Fish critical cellular residues for surfactants and surfactant mixtures. Environ Toxicol Chem. 24:1738‐1744. [Disponible en anglais seulement]
Biesterbos JH, Dudzina T, Delmaar CJ, Bakker MI, Russel FG, von Goetz N, Scheepers PT, Roeleveld N. 2013. Usage patterns of personal care products: Important factors for exposure assessment. Food Chem Toxicol. 55:8-17. [Disponible en anglais seulement]
Bittermann K, Spycher S, Endo S, Pohler L, Huniar U, Goss K-U, Klamt A. 2014. Prediction of phospholipid-water partition coefficients of ionic organic chemicals using the mechanistic model COSMOmic. J Phys Chem. 118(51):14833-14842. [Disponible en anglais seulement]
Bittermann K, Spycher S, Goss K-U. 2016. Comparison of different models predicting the phospholipid-membrane water partition coefficients of charged compounds. Chemosphere. 144:382-391. [Disponible en anglais seulement]
Bland A, Greiner E, Zhang E, Kumamoto T. 2018. Surfactants. London (UK): IHS Markit, Specialty Chemicals Update Program. 260 p. [Disponible en anglais seulement]
Boethling RS, Howard PH, Beauman JA, Larosch ME. 1995. Factors for intermedia extrapolation in biodegradability assessment. Chemosphere. 30(4):741-752. [Disponible en anglais seulement]
Bohaty R, Eckel W, Shamim M, Spatz D, White K, Young D. 2015. Standard Operating Procedure for using the NAFTA guidance to calculate representative half-life values and characterizing pesticide degradation. Washington (DC): US Environmental Protection Agency. 29 p. [Disponible en anglais seulement]
Brust K. 2001. Toxicity of aliphatic amines on the embryos of zebrafish Danio rerio - experimental studies and QSAR [dissertation]. Dresden (DE): Technische Universitat Dresden. [Disponible en anglais seulement]
[BUA] Beratergremium fur Umweltrelevante Altstoffe. 1994. Primary Fatty Amines. German Chemical Society- Advisory Committee on Existing Chemicals of Environmental Relevance, editors. Frankfurt (DE): S. Hirzel, Wissenschaftliche Verlagsgesellschaft Stuttgart. Report No. 177. [Disponible en anglais seulement]
Buckley LA, Morgan KT, Swenberg JA, James RA, Hamm TE, Barrow CS. 1985. The toxicity of dimethylamine in F-344 rats and B6C3F1 mice following a 1-year inhalation exposure. Fundam Appl Toxicol. 5(2):341-352. [Disponible en anglais seulement]
Canada; 1999; Loi canadienne sur la protection de l’environnement, 1999; L.C. 1999, ch. 33; Gazette du Canada, Partie III, vol. 22, no 3.
Canada, ministère de l’Environnement. 2012. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances de la Liste intérieure [PDF]. Gazette du Canada, Partie I, vol. 146, no 48, Supplement.
Castell CH, Smith B, Neal W. 1971. Production of dimethylamine in muscle of several species of gadoid fish during frozen storage, especially in relation to presence of dark muscle. J Fish Res Bd Can. 28(1):1‑5. [Disponible en anglais seulement]
CATALOGIC [environmental fate and ecotoxicity model]. 2014. Ver. 5.11.15. Bourgas (BG): University “Prof. Dr. Assen Zlatarov”, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
[CE] Commission européenne. 1996. Technical guidance document in support of Commission Directive 93/67/EEC on risk assessment for new notified substances and Commission Regulation (EC) No 1488/94 on risk assessment for existing substances. Part IV. Luxembourg: Office for Official Publications of the European Communities. [Disponible en anglais seulement]
[CE] Commission européenne. 2002. European Union risk assessment report: dimethyldioctadecylammonium chloride (DODMAC) [PDF]. Luxembourg: Office for Official Publications of the European Communities. [Consulté le 2019 Feb]. [Disponible en anglais seulement]
[CE] Commission européenne. 2003. Technical guidance document in support of Commission Directive 93/67/EEC on risk assessment for new notified substances and Commission Regulation (EC) No 1488/94 on risk assessment for existing substances. Part II. Luxembourg: Office for Official Publications of the European Communities. [Disponible en anglais seulement]
[CE] Commission européenne. 2008. European Union draft risk assessment report: Primary alkyl amines [PDF]. Luxembourg: Office for Official Publications of the European Communities. [Consulté le 2018 Oct]. [Disponible en anglais seulement]
[CE] Commission européenne. 2017. Cosmetic Ingredients and Substances (CosIng) Simple Search Database [Internet] [Disponible en anglais seulement]
CERI Japan. 2012. Combined repeated dose and reproductive/developmental toxicity screening test of N,N-dimethyldocosylamine by oral administration in rats. Japan: Japan CHEmicals Collaborative Knowledge database. [Disponible en anglais seulement]
ChemIDplus [database]. 1993-2017. Bethesda (MD): US National Library of Medicine. [Consulté le 4 octobre 2018]. [Disponible en anglais seulement]
Chen Y, Geurts M, Sjollema SB, Kramer NI, Hermens JL, Droge ST. 2014. Acute toxicity of the cationic surfactant C12-benzalkonium in different bioassays: how test design affects bioavailability and effect concentrations. Environ Toxicol Chem. 33(3):606-615. [Disponible en anglais seulement]
Chen Y, Hermens JL, Jonker MT, Arnot JA, Armitage JM, Brown T, Nichols JW, Fay KA, Droge ST. 2016. Which molecular features affect the intrinsic hepatic clearance rate of ionizable organic chemicals in fish? Environ Sci Technol. 50(23):12722-12731. [Disponible en anglais seulement]
Christie AO, Crisp DJ. 1967. Activity coefficients of the n‐primary, secondary and tertiary aliphatic amines in aqueous solution. J Appl Chem. 17:11-4. [Mentionné dans EPISUITE c2000-2012]. [Disponible en anglais seulement]
[CIIT] Chemical Industry Institute of Toxicology. 1990. Twenty four month final report. Inhalation toxicity of dimethylamine in F-344 rats and B6C3F1 mice and third party audit summary. Research Triangle Park (NC): Chemical Industry Institute of Toxicology. 862 p. [Disponible en anglais seulement]
Comber SD, Rule KL, Conrad AU, Höss SO, Webb SF, Marshall S. 2008. Bioaccumulation and toxicity of a cationic surfactant (DODMAC) in sediment dwelling freshwater invertebrates. Environ Pollut. 153(1):184-191. [Disponible en anglais seulement]
[ConsExpo Web] Consumer Exposure Web Model. 2017. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement].
Coon RA, Jones RA, Jenkins LJ, Siegel J. 1970. Animal inhalation studies on ammonia, ethylene glycol, formaldehyde, dimethylamine, and ethanol. Toxicol Appl Pharmacol. 16(3):646-655. [Disponible en anglais seulement]
COSMOmic [prediction model]. c2015-2018. Leverkusen (DE): COSMOlogic GmbH and Co KG. [Disponible en anglais seulement]
Curry P, Kramer G, Newhook R, Sitwell J, Somers D, Tracy B, Oostdam JV. 1993. Reference values for Canadian populations. Prepared by the Environmental Health Directorate Working Group on reference values. Ottawa (Ont.) : Santé Canada. [Mise à jour de la version 1988] [Disponible en anglais seulement]
Darad R, De AK, Aiyar AS. 1983. Toxicity of nitrite and dimethylamine in rats. Toxicol Lett. 17(1‑2):125‑130. [Disponible en anglais seulement]
Deichmann WB, Radomski JL, MacDonald WE, Kascht RL, Erdmann RL. 1958. The chronic toxicity of octadecylamine. AMA Arch Ind Health. 18(6):483-487. [Disponible en anglais seulement]
DePass LR, Fowler EH, Yang RS. 1984. Dermal oncogenicity studies on ethylenediamine in male C3H mice. Fundam Appl Toxicol. 4(4):641-645. [Disponible en anglais seulement]
DePass LR, Yang RS, Woodside MD. 1987a. Evaluation of the teratogenicity of ethylenediamine dihydrochloride in Fischer 344 rats by conventional and pair-feeding studies. Fundam. Appl.Toxicol. 9: 687-697. [Disponible en anglais seulement]
DePass LR, Fowler EH, Weil CS. 1987b. Dermal oncogenicity studies on various ethyleneamines in male C3H mice. Fundam Appl Toxicol. 9(4):807-811. [Disponible en anglais seulement]
Dimitrov SD, Mekenyan OG, Sinks GD, Schultz TW. 2003. Global modeling of narcotic chemicals: ciliate and fish toxicity. J. Mol. Structr. 622(1-2): 62-70. [Disponible en anglais seulement]
Domoradzki JY. 1979. Mutagenicity evaluation of ethylenediamine and triethylenetramine in the Ames’ Salmonella/mammalian-microsome mutagenicity test. Rapport inédit de Dow Chemical Co. [Disponible en anglais seulement]
Driver J, Ross J, Mihlan G, Lunchick C, Landenberger B. 2007. Derivation of single layer clothing penetration factors from the pesticide handlers exposure database. Regul Toxicol Pharmacol. 49(2):125-137. [Disponible en anglais seulement]
Droge ST, Goss KU. 2013a. Ion-exchange affinity of organic cations to natural organic matter: influence of amine type and nonionic interactions at two different pHs. Environ Sci Tech. 47:798-806. [Disponible en anglais seulement]
Droge ST, Goss KU. 2013b. Development and evaluation of a new sorption model for organic cations in soil: Contributions from organic matter and clay minerals. Environ Sci Tech. 47(24):14233-14241. [Disponible en anglais seulement]
Droge ST, Goss KU. 2013c. Sorption of organic cations to phyllosilicate clay minerals: CEC-normalization, salt dependency, and the role of electrostatic and hydrophobic effects. Environ Sci Technol. 47:14224-14232. [Disponible en anglais seulement]
Droge ST, Hermens JL, Rabone J, Gutsell S, Hodges G. 2016. Phopholipophilicity of CxHyN+ amines: chromatographic descriptors and molecular simulations for understanding partitioning into membranes. Environ Sci Process Impacts. 18:1011-1023. [Mentionné dans Timmer et Droge 2017]. [Disponible en anglais seulement]
Droge ST. 2017. Derivation and evaluation of partitioning properties for the bioaccumulation assessment of CMP priority ionogenic substances. Final report for ECCC. Amsterdam (NL), Institute for Biodiversity and Ecosystem Dynamics, University of Amsterdam. Contract No.: 3000628362. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l'approche scientifique : Classification du risque écologique des substances organiques. Ottawa (Ont.) : gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Data collected from a targeted information gathering initiative for assessments under the Chemicals Management Plan (Fall 2016). Données préparées par ECCC, Santé Canada; Programme des substances existantes. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016c. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (QC). Accessible sur demande à : substances@ec.gc.ca. [Disponible en anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2021. Supporting documentation: du groupe des amines aliphatiques. Gatineau (QC): ECCC. Information in support of the screening assessment for the du groupe des amines aliphatiques. Accessible sur demande à : substances@ec.gc.ca. [Disponible en anglais seulement]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [Modifié le 12 mars 2017]. Catégorisation. Ottawa (Ont.) : gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018a. Évaluation préalable rapide des substances pour lesquelles l'exposition de la population générale est limitée. Ottawa (Ont.) : gouvernement du Canada.
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018b. Évaluation préalable substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT). Ottawa (Ont.) : ECCC, SC.
[ECETOC] European Centre for Ecotoxicology and Toxicology of Chemicals. 2003. Environmental risk assessment of difficult substances [PDF]. Report No.: 88. Brussels (BE): ECETOC. 109 p. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018a. Registered substances database; search results for CAS RN 103-83-3 [database]. Helsinki (FI): ECHA. [Mis à jour le 15 août 2018; consulté le 4 octobre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018b. Registered substances database; search results for CAS RN 111-40-0 [database]. Helsinki (FI): ECHA. [Mis à jour le 15 août 2018; consulté le 4 octobre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018c. Registered substances database; search results for CAS RN 112-69-6. Helsinki (FI): ECHA. [Mis à jour le 2015 Apr 13; Consulté le 2018 Oct]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018d. Registered substances database; search results for CAS RN 124-30-1. Helsinki (FI): ECHA. [Mis à jour le 10 janvier 2018; consulté en octobre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018e. Registered substances database; search results for CAS RN 111-86-4 [database]. Helsinki (FI): ECHA. [Mis à jour le 30 novembre 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018f. Registered substances database; search results for CAS RN 1273322-47-6. Helsinki (FI): ECHA. [Mis à jour le 16 juin 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018g. Registered substances database; search results for EC 931-295-2. Helsinki (FI): ECHA. [Mis à jour le 9 novembre 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018h. Registered substances database; search results for CAS RN 72162-46-0 [database]. Helsinki (FI): ECHA. [Mis à jour le 14 novembre 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018i. Registered substances database; search results for CAS RN 1219010-04-4 [database]. Helsinki (FI): ECHA. [Mis à jour le 16 novembre 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018j. Registered substances database; search results for CAS RN 112-18-5 [database]. Helsinki (FI): ECHA. [Mis à jour le 16 novembre 2018; consulté le 22 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. c2007-2018k. Registered substances database; search results for CAS RN 1125503-33-4. Helsinki (FI): ECHA. [Mis à jour le 14 octobre 2018; consulté le 30 octobre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2011. Annex 1: Background Document to the Opinion proposing harmonised classification and labelling at Community level of (Z)-octadec-9-enylamine; CAS 112-90-3 [pdf]. Helsinki (FI): ECHA. ECHA/RAC/CLH-O-0000002197-73-01/A1. [Adopté le 2 décembre 2011]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2017. Guidance on information requirements and chemical safety assessment [PDF]. Helsinki (FI): ECHA. p. 609. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018a. Guidance on the safe use of the substance: Benzyldimethylamine; CAS RN 103-83-3. Helsinki (FI): ECHA. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018b. Guidance on the safe use of the substance: 2,2’-iminodi(ethylamine); CAS RN 111-40-0. Helsinki (FI): ECHA. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018c. Guidance on the safe use of the substance: Dimethylamine; CAS RN 124-40-3. Helsinki (FI): ECHA. [Mis à jour le 2018 Sept 5]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018d. Guidance on the safe use of the substance: Dodecyldimethylamine; CAS RN 112-18-5. Helsinki (FI): ECHA. [Mis à jour le 8 août 2017]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018e. Guidance on the safe use of the substance: Amines, C16-22-alkyl; CAS RN 68037-92-3. Helsinki (FI): ECHA. [Mis à jour le 8 août 2017]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018f. Guidance on the safe use of the substance: N-(C16-C18)alkyl(C16-C18)alkane-1-amine; CAS RN 308062-60-4. Helsinki (FI): ECHA. [Mis à jour le 8 août 2017]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018g. Guidance on the safe use of the substance: 1,3-Propanediamine, N-[3-((C11-14, C13-rich)oxy)propyl]- branched acetate; EC: 931-295-2. Helsinki (FI): ECHA. [Mis à jour le 9 novembre 2018]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018h. Guidance on the safe use of the substance: 1,3-Propanediamine, N-[3-(tridecyloxy)propyl]-, branched; CAS RN 68479-04-9. Helsinki (FI): ECHA. [Mis à jour le 9 novembre 2018] [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018i. Guidance on the safe use of the substance: Hexadecyldimethylamine; CAS RN: 112-69-6. Helsinki (FI): ECHA. [Mis à jour le 9 février 2019]. [Disponible en anglais seulement]
[ECHA] European Chemicals Agency. 2018j. Guidance on the safe use of the substance: N,N-dimethyldocosylamine; CAS RN 21542-96-1. Helsinki (FI): ECHA. [Mis à jour le 14 novembre 2018]. [Disponible en anglais seulement]
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu de l’article 71 de la Loi canadienne sur la protection de l’environnement, 1999 : Avis concernant certaines substances de la Liste intérieure. Données préparées par : Environnement Canada, Santé Canada; Programme des substances existantes.
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [Disponible en anglais seulement]
Evonik. 2019. Tomamine DA-17. Essen (DE): Evonik Industries. [Consulté le 2019 Nov 1] [Disponible en anglais seulement]
Exponent. 2007. FYI Notification: C8-C18 Fatty Amines and Amine Acetate Salts CAS #61788-46-3. Washington (DC). Letter dated December 18, 2007. [Disponible en anglais seulement]
Fernández-Salguero J, Mackie IM. 1987. Comparative rates of spoilage of fillets and whole fish during storage of haddock (Melanogrammus aeglefinus) and herring (Clupea harengus) as determined by the formation of non-volatile and volatile amines. Int J Food Sci Tech. 22:385-390. [Disponible en anglais seulement]
Ficheux AS, Wesolek N, Chevillotte G, Roudot AC, 2015. Consumption of cosmetic products by the French population. First part: Frequency data. Food Chem Toxicol. 78:159-169. [Disponible en anglais seulement]
Ficheux AS, Chevillotte G, Wesolek N, Morisset T, Dornic N, Bernard A, Bertho A, Romanet A, Leroy L, Mercat AC, Creusot T, Simon E, Roudot AC. 2016. Consumption of cosmetic products by the French population second part: Amount data. Food Chem Toxicol. 90:130-141. [Disponible en anglais seulement]
[FOCUS] FOrum for the Co-ordination of pesticide fate models and their USe. 2006. Guidance document on estimating persistence and degradation kinetics from environmental fate studies on pesticides in EU registration. Brussels (BE): Commission européenne. 434 p. [Disponible en anglais seulement]
Gage JC. 1970. The subacute inhalation toxicity of 109 industrial chemicals. Br J Ind Med. 27(1):1-18. [Disponible en anglais seulement]
Garcia-Hidalgo, Sottas V, von Goetz N, Hauri U, Bogdal C, Hungerbühler K. 2017. Occurrence and concentrations of isothiazolinones in detergents and cosmetics in Switzerland. Contact Dermatitis. 76(2):96-106. [Disponible en anglais seulement]
Gecol H. 2006. The basic theory. In: Farn RJ. Chemistry and technology of surfactants. Oxford (UK): Blackwell Publishing Ltd. Chapter 2. p. 24-45. [Disponible en anglais seulement]
Gee P, Sommers CH, Melick AS, Gidrol XM, Todd MD, Burris RB, Nelson ME, Klemm RC, Zeiger E. 1998. Comparison of responses of base-specific Salmonella tester strains with the traditional strains for identifying mutagens: the results of a validation study. Mutat Res. 412(2):115-130. [Disponible en anglais seulement]
Gelfand HH. 1963. Respiratory allergy due to chemical compounds encountered in the rubber, lacquer, shellac, and beauty culture industries. J Allergy. 34(4):374-381. [Disponible en anglais seulement]
Gollapudi BB, Linscombe VA, Sinha AK. 1989. Evaluation of the clastogenic and mutagenic potential of diethylenetriamine (DETA). Environ Mol Mutagen. 14:71 (résumé). [Disponible en anglais seulement]
Gorilla Glue Inc. [Modifié en 2019]. Gorilla epoxy. [Consulté le 2 mai 2019]. [Disponible en anglais seulement]
Green NR, Savage JR. 1978. Screening of safrole, eugenol, their ninhydrin positive metabolites and selected secondary amines for potential mutagenicity. Mutat Res. 57(2):115-121. [Disponible en anglais seulement]
Greenblatt M, Mirvish S, So BT. 1971. Nitrosamine studies: induction of lung adenomas by concurrent administration of sodium nitrite and secondaryin Swiss mice. J Natl Cancer Inst. 46(5):1029-1034. [Disponible en anglais seulement]
Griffin TS, Docks El, Brotherton RJ, Hall IH. 1991. The hypolipidemic activity of alkylamines and their borane derivatives: structure-activity relationships in rodents. Eur J Med Chem. 26(5):517-527. [Disponible en anglais seulement]
Gross EA, Patterson DL, Morgan KT. 1987. Effects of acute and chronic dimethylamine exposure on the nasal mucociliary apparatus of F-344 rats. Toxicol Appl Pharmacol. 90(3):359-376. [Disponible en anglais seulement]
Guzzie PJ, Slesinski RS. 1987. Ethylenediamine Salmonella/Microsome (Ames) bacterial mutagenicity study. Rapport inédit du Bushy Run Research Center, Union Carbide Corp. [Disponible en anglais seulement]
Hagmar L, Bellander, Bergöö B, Simonsson BG. 1982. Piperazine-induced occupational asthma. J Occup Med. 24(3):193-197. [Disponible en anglais seulement]
Havermans JB, Houtzager MM. 2014. Emission of volatiles from spray polyurethane (SPF) insulated crawl spaces. Department Applied Environmental Chemistry, The Netherlands Organization of Applied Scientific Research, Utrecht, The Netherlands. [Disponible en anglais seulement]
Haworth S, Lawlor T, Mortelmans, Speck W, Zeiger E. 1983. Salmonella mutagenicity test results for 250 chemicals. Environ Mutagen. 5 Suppl 1:1-142. [Disponible en anglais seulement]
[HCNL] Health Council of the Netherlands. 2005. 2,2’-Iminodi(ethylamine) (CAS No: 111-40-0) Health-based reassessment of administrative occupational exposure limits. The Hague: Health Council of the Netherlands. [Disponible en anglais seulement]
Hedenstedt A. 1978. Mutagenicity screening of industrial chemicals: seven aliphatic amines and one amide tested in the Salmonella/microsomal assay. Mutat Res. 53(2):198-199. [Disponible en anglais seulement]
Hermansky SJ, Yang RSH, Garman RH, Leung HW. 1999. Chronic toxicity and carcinogenicity studies of ethylenediamine dihydrocloride by dietary incorporation in Fischer 344 rats. Food Chem Toxicol. 37(7):765-776. [Disponible en anglais seulement]
Hodgson AT. 1999. Common Indoor Sources of Volatile Organic Compounds: Emission Rates and Techniques for Reducing Consumer Exposures. Contract Number 95-302. Prepared for the California Environmental Protection Agency. [Disponible en anglais seulement]
Hoechst AG. 1988a. Genamin 18 R 100 D. Study of the mutagenic potential in strains of Salmonella typhimurium (Ames Test) and Escherichia coli. Frankfurt/Main (DE): Hoechst Aktiengesellschaft. Report No.: 88.0407. Study No.: 88.0089. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Hoechst AG. 1988b. Genamin CC 100 D. Study of the mutagenic potential in strains of Salmonella typhimurium (Ames text) and Escherichia coli. Frankfurt/Main (DE): Hoechst Aktiengesellschaft. Report No.: 88.0193. Study No.: 88.0092. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Hoechst AG. 1989a. Genamin-Marken – Fettamin-Oxethylate. Frankfurt/Main (DE): Hoechst Aktiengesellschaft. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Hoechst AG. 1989b. Prüfung auf Bakterientoxizität nach OECD 209. Journal-Nr 8.696, 24.0101989. Frankfurt/Main (DE): Hoechst Aktiengesellschaft. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Hoechst AG. 1992. Kurzbericht über die Prüfung der toxischen Wirkung von Genamin CC 100 (D) auf Bakterien, "Bakterientoxizität". Frankfurt/Main (DE): Hoechst Aktiengesellschaft. Report-No.: 92-0098-01. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
Hoerr CW, Ralston AW. 1943. Studies on high molecular weight aliphatic amines and their salts. XI. Transference numbers of some primary amine hydrochlorides in aqueous solution and their significance in the interpretation of the micelle theory. J Am Chem. 65(5):976-983. [Mentionné dans Timmer et Droge 2017]. [Disponible en anglais seulement]
Hoffman EJ, Boyd GE, Ralston AW. 1942. Studies on high molecular weight aliphatic amines and their salts. V. Soluble and insoluble films of the amine hydrochlorides. J Am Chem Soc. 64(3):498-503. [Mentionné dans Timmer et Droge 2017]. [Disponible en anglais seulement]
Hsie AW, San Sebastian JR, Perdue SW, Schenley RL, Waters MD. 1987. Multiple-endpoint mutagenesis with Chinese hamster ovary (CHO) cells: evaluation with eight carcinogenic and non-carcinogenic compounds. Mol Toxicol. 1(2-3):217-234. [Disponible en anglais seulement]
Hulla JE, Rogers SJ, Warren GR. 1981. Mutagenicity of a series of polyamines. Environ Mutagen. 3:332-333. [Disponible en anglais seulement]
[ICSC] Fiches internationales de sécurité chimique [base de données]. c1996-2011. Genève (Suisse) : Organisation internationale du Travail. [Mis à jour en avril 2004; consulté le 21 avril 2017].
[INRP] Inventaire national des rejets de polluants [base de données]; 1993-2013; Gatineau (QC) : Environnement Canada [consulté le 4 octobre 2018]
Isakova GK, Ekshtat BY, Kerkis YY. 1971. On studies of the mutagenic properties of chemical substances in the establishment of hygienic standards. Hyg Sanit. 36:178-184. [Disponible en anglais seulement]
Ishidate M, Odashima S. 1977. Chromosome tests with 134 compounds on Chinese hamster cells in vitro – a screening for chemical carcinogens. Mutat Res. 48(3-4):337-354. [Disponible en anglais seulement]
Ismail ZZ, Tezel U, Pavlostathis SG. 2010. Sorption of quaternary ammonium compounds to municipal sludge. Water Res. 44(7):2303-2313. [Disponible en anglais seulement]
Iwata Y, Moriya Y, Kobayashi T. 1987. Percutaneous Absorption of Aliphatic Compounds. Cosmet Toiletries. 102(2):53-68. [Disponible en anglais seulement]
[J-CHECK] Japan CHEmicals Collaborative Knowledge database [database]. c2010-2018. Tokyo (JP): National Institute of Technology and Evaluation (NITE). [Consulté le 29 mars 2016]. [Disponible en anglais seulement]
Karsa DR. 2006. What are surfactants? In: Farn RJ. 2006. Chemistry and technology of surfactants. Oxford (UK): Blackwell Publishing. p. 1-23. [Disponible en anglais seulement]
Kataoka H, Shindoh S, Makita M. 1995. Determination of secondary amines in various foods by gas chromatography with flame photometric detection. J Chromatogr A. 695(1):142-148. [Disponible en anglais seulement]
Krop H, de Voogt P. 2007. Bioconcentration factors of surfactants in seawater. Amsterdam (NL): IVAM UvA BV. [Disponible en anglais seulement]
Lam S, Chan-Yeung M. 1980. Ethylenediamine-induced asthma. Am Rev Respir Dis. 121(1):151-155. [Disponible en anglais seulement]
Lara-Martin PA, Li X, Bopp RF, Brownawell BJ. 2010. Occurrence of alkyltrimethylammonium compounds in urban estuarine sediments: Behentrimonium as a new emerging contaminant. Environ Sci Technol. 44(19):7569-7575. [Disponible en anglais seulement]
Leung HW. 1994. Evaluation of the genotoxic potential of alkyleneamines. Mutat Res. 320(1-2):31-43. [Disponible en anglais seulement]
Leung HW, van Miller JP. 1997. Effects of diethylenetriamine dihydrochloride following 13 weeks of dietary dosing in Fischer 344 rats. Food Chem Toxicol. 35(5):481-487. [Disponible en anglais seulement]
Lewinsohn HC, Ott MG. 1991. A review of medical surveillance records of employees exposed to ethyleneamines. J Occup Med. 33(2):148-154. [Disponible en anglais seulement]
Lide DR, Frederikse HPR. 1996. CRC handbook of chemistry and physics. 76th ed. Boca Raton (FL): CRC Press. [Disponible en anglais seulement]
Lijinsky W, Taylor HW. 1977. Feeding tests in rats on mixtures of nitrite with secondary and tertiary amines of environmental importance. Food Cosmet Toxicol. 15(4):269-274. [Disponible en anglais seulement]
Lin JK, Lai CC. 1980. High performance liquid chromatographic determination of naturally occurring primary and secondary amines with dabsyl chloride. Anal Chem. 52:630-635. [Disponible en anglais seulement]
Loretz LJ, Api AM, Babcock L, Barraj LM, Burdick J, Cater KC, Jarrett G, Mann S, Pan YH, Re TA, Renskers KJ, Scrafford CG. 2008. Exposure data for cosmetic products: facial cleanser, hair conditioner, and eye shadow. Food Chem Toxicol. 46(5):1516-1524. [Disponible en anglais seulement]
LUFA Speyer. 2018. Chemical and physical characteristics of standard soils according to GLP. Speyer (DE): LUFA Speyer. Version 1 D12-18. [Document créé le 15 mars 2018; consulté le 1er avril 2019] [Disponible en anglais seulement]
MacDonald WE, Deichmann WB, Radomski JL, Austin BS. 1962. The chronic toxicity of octadecylamine in the rat—a supplemental report. Toxicol Appl Pharmacol. 4:610-612. [Disponible en anglais seulement]
Mackay D, Arnot JA, Webster E, Reid L. 2009. The evolution and future of environmental fugacity models. In: Devillers J, editor. Ecotoxicology modeling. Boston (MA): Springer. p. 355–375. [Disponible en anglais seulement]
Martelli A, Fugassa E, Voci A, Brambilla G. 1983. Unscheduled DNA synthesis induced by nitrosated ranitidine in primary cultures of rat hepatocytes. Mutat Res. 122(3-4):373-376. [Disponible en anglais seulement]
McLachlan M. 2018. CEFIC ECO37 D-BASS: Development of a bioaccumulation assessment strategy for surfactants. Deliverable D8: Report on tissue-distribution for 2 surfactant mixtures. Stockholm (SE): Stockholm University, Department of Environmental Science and Analytical Chemistry (ACES). 17 p. [Disponible en anglais seulement]
McLachlan M, Kierkgaard A, Strandell M, Yuan B, Chen C, Armitage J, Arnot J, Droge S. 2019. Bioconcentration of cationic surfactants in rainbow trout [presentation]. Society of Environmental Toxicology and Chemistry (SETAC) North America 40th Annual Meeting; 2019 November 3-7; Toronto, Ontario. [Disponible en anglais seulement]
Menkveld HWH, Boelee NC, Smith GOJ, Christian S. 2016. Fat recovery from dissolved air flotation sludge. In: Proceeding of the Water Environment Federation, WEFTEC 2016: Session 400 through Session 409. p. 3543-3551. [Disponible en anglais seulement]
[MHLW] Ministry of Health, Labour and Welfare, Japan. 1997. N,N-dimethybenzylamine (103-83-3). Repeated dose 28-day oral toxicity study (in Japanese). Tokyo (JP): Japan CHEmicals Collaborative Knowledge database. [Disponible en anglais seulement]
[MHLW] Ministry of Health, Labour and Welfare, Japan. 2000. ISHA: Mutagenicity Test Results for Chemical Substances. Tokyo (JP): Japan CHEmicals Collaborative Knowledge database. [Disponible en anglais seulement]
Miller DJ, McWilliams P. 2010. Octanol-water partition coefficients of surfactants: Slow stirring/surface tension method. Tenside Surfact Det. 47:28-33. [Disponible en anglais seulement]
Miller DJ, McWilliams P. 2012. Nonionic surfactants: Octanol-water partition coefficients with the slow stirring/surface tension method. Tenside Surfact Det. 49:124-128. [Disponible en anglais seulement]
Mitchell SC, Zhang AQ, Smith RL. 2008. Dimethylamine and diet. Food Chem Toxicol. 46(2008):1734–1738. [Disponible en anglais seulement]
Mitsubishi Chemical Safety Institute Ltd. (Japan). 2003. Repeated dose toxicity study on dodecyldimethylamine (CAS No. 112-18-5). Tokyo (JP): Japan CHEmicals Collaborative Knowledge database. [Disponible en anglais seulement]
Mueller AM, Dabney BJ. 1979. Comparison of various Dow and Union Carbide ethyleneamine samples in the Ames Salmonella test. Unpublished Dow Chemical Co. report. [Disponible en anglais seulement]
Nakazawa T, Matsui S. 1990. Ethylenediamine-induced late asthmatic responses. J Asthma. 27(4):207-212. [Disponible en anglais seulement]
Neurath GB, Dünger M, Pein FG, Ambrosius D, Schreiber O. 1977. Primary and secondary amines in the human environment. Food Cosmet Toxicol. 15:275-282. [Disponible en anglais seulement]
Ng TP, Lee HS, Lee FY, Wang YT, Tay VL, Tan KT. 1991. Occupational asthma due to ethylene diamine. Ann Acad Med Singapore. 20(3):399-402. [Disponible en anglais seulement]
Ng TP, Lee HS, Malik MA, Chee CB, Cheong TH, Wang YT. 1995. Asthma in chemical workers exposed to aliphatic polyamines. Occup Med. 45(1):45-48. [Disponible en anglais seulement]
Nouryon. 2019. Mining chemical solutions [pdf]. Chicago (IL): Nouryon. [Consulté le 26 avril 2019]. [Disponible en anglais seulement]
Nouryon. c2019. Nouryon surface chemistry. Amsterdam (NL): Nouryon. [Consulté le 26 avril 2019]. Notes: select “Our Products”, then filter by Function: corrosion inhibitor, then by Regional Availability: North America. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1983. Study information: Ethylenediamine – Genetic Toxicology – Bacterial Mutagenicity. NTP Study ID 942194. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1984a. Study information: Ethylenediamine – Genetic Toxicology – Bacterial Mutagenicity. NTP Study ID 414798. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1984b. Study information: Ethylenediamine – Genetic Toxicology – Bacterial Mutagenicity. NTP Study ID 572096. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1985. Study information: Ethylenediamine – Genetic Toxicology – Bacterial Mutagenicity. NTP Study ID 756389. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1986. Study information: Ethylenediamine – Genetic Toxicology – Bacterial Mutagenicity. NTP Study ID 477362. [Disponible en anglais seulement]
[NTP] National Toxicology Program. 1993. Final report on the developmental toxicity of ethylenediamine (CAS No. 107-15-3) in New Zealand White rabbits. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. Accesssion Number PB93190056. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 1994. Screening Information Data Set (SIDS) of OECD High Production Volume Chemicals Programme. CAS Number: 111-40-0 [PDF]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2000. Essai n° 106: Adsorption/désorption selon une méthode d'équilibres successifs [PDF]. Paris (FR): OCDE, Lignes directrices de l'OCDE pour les essais de produits chimiques, Section 1. p. 44.
[OCDE] Organisation de coopération et de développement économiques. 2001. Essai n° 303: Essai de simulation - Traitement aérobie des eaux usées - A: Unités de traitement par boues; B: Biofilms. Paris (FR): OCDE, Guidelines for the Testing of Chemicals, Section 2. p.25.
[OCDE] Organisation de coopération et de développement économiques. 2004. SIDS Initial assessment report: ethylenediamine: CAS No. 107-15-3 [PDF]. SIAM [SIDS Initial Assessment Meeting] 13; 2001 June; Paris, France. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2013. SIDS Initial Assessment Profile (SIAP): Aliphatic secondary amines. CoCAM [Cooperative Chemicals Assessment Meeting] 4, 2013 April 16-18 [PDF]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2014a. OCDE Guidance for characterising oleochemical substances for assessment purposes. Paris (FR): OCDE, Environment Directorate. Series on Testing and Assessment No. 193; Report No.: ENV/JM/MONO(2014)6. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2014b. Guidance on grouping of chemicals, second edition [PDF]. Paris (FR): OCDE, Environment Directorate. (Series on Testing and Assessment No. 194; Report No.: ENV/JM/MONO(2014)4. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. 2019. Guidance document on aqueous-phase aquatic toxicity testing of difficult test chemicals [PDF]. 2nd ed. Paris (FR): OCDE, Environment Directorate. Report No.: 23. p. 88. [Consulté le 2018 Jul 6]. [Disponible en anglais seulement]
[OCDE] Organisation de coopération et de développement économiques. Boîte à outils QSAR de l’OCDE [outil d’extrapolation]. 2017. Ver. 4.1. Paris (FR): Organisation for Economic Co-operation and Development, Laboratory of Mathematical Chemistry. [Disponible en anglais seulement]
Olsvik PA, Urke HA, Nilsen TO, Ulvund JB, Kristensen T. 2015. Effects of mining chemicals on fish: exposure to tailings containing Lilaflot D817M induces CYP1A transcription in Atlantic salmon smolt. BMC Res Notes. 8:389. [Disponible en anglais seulement]
[OMS] Organisation mondiale de la Santé. 1999. Concise International Chemical Assessment Document 15. 1,2-Diaminoethane (ethylenediamine). Genève : Suisse. Organisation mondiale de la Santé. [Disponible en anglais seulement]
Patterson RLS, Mottram DS. 1974. The occurrence of volatile amines in uncured and cured pork meat and their possible role in nitrosamine formation in bacon. J Sci Food Agric. 25(11):1419-1425. [Disponible en anglais seulement]
Perez Martin RI, Franco JM, Molist P, Gallardo JM. 1987. Gas chromatographic method for the determination of volatile amines in seafoods. Int J Food Sci Technol. 22(5):509-514. [Disponible en anglais seulement]
Pfundstein B, Tricker AR, Theobald E, Spiegelhalder B, Preussmann R. 1991. Mean daily intake of primary and secondary amines from foods and beverages in West Germany in 1989-1990. Food Chem Toxicol. 29(11):733-739. [Disponible en anglais seulement]
[PhysProp] Interactive PhysProp Database [database]. c2013. Syracuse (NY): SRC, Inc. [Mis à jour le 2013; Consulté le 2017 Oct 3]. [Disponible en anglais seulement]
Pozzani UC and Carpenter CP. 1954. Response of rats to repeated inhalation of ethylenediamine vapors. AMA Arch Ind Hyg Occup Med. 9(3):223-226. [Disponible en anglais seulement]
Présentation d’étude. 2009. Étude confidentielle non publiée présentée à Environnement et Changement climatique Canada (ECCC) dans le cadre du Plan de gestion des produits chimiques. Gatineau (QC) : ECCC, Division de la mobilisation et de l’élaboration de programmes. Présentation reçue le 9 octobre 2018. [Disponible en anglais seulement]
Présentation d’étude. 2013. Étude confidentielle non publiée présentée à Environnement et Changement climatique Canada (ECCC) dans le cadre du Plan de gestion des produits chimiques. Gatineau (QC) : ECCC, Division de la mobilisation et de l’élaboration de programmes. Présentation reçue le 18 octobre 2018. [Disponible en anglais seulement]
Présentation d’étude. 2015. Étude confidentielle non publiée présentée à Environnement et Changement climatique Canada (ECCC) dans le cadre du Plan de gestion des produits chimiques. Gatineau (QC) : ECCC, Division de la mobilisation et de l’élaboration de programmes. Présentation reçue le 9 octobre 2018. [Disponible en anglais seulement]
Présentation d’étude. 2017. Étude confidentielle non publiée présentée à Environnement et Changement climatique Canada (ECCC) dans le cadre du Plan de gestion des produits chimiques. Gatineau (QC) : ECCC, Division de la mobilisation et de l’élaboration de programmes. Présentation reçue le 27 octobre 2017. [Disponible en anglais seulement]
Présentation d’étude. 2018. Étude confidentielle non publiée présentée à Environnement et Changement climatique Canada (ECCC) dans le cadre du Plan de gestion des produits chimiques. Gatineau (QC) : ECCC, Division de la mobilisation et de l’élaboration de programmes. Présentation reçue le 9 octobre 2018. [Disponible en anglais seulement]
PubChem [database]. 2004-2020. Bethesda (MD): US National Library of Medicine, National Center for Biotechnology Information. [Mis à jour le 10 octobre 2018; consulté le 24 août 2020]. [Disponible en anglais seulement]
Rampfl M, Mair S, Mayer F, Sedlbauer K, Breuer K, Niessner R. 2008. Determination of primary, secondary, and tertiary amines in air by direct or diffusion sampling followed by determination with liquid chromatography and tandem mass spectrometry. Environ Sci Technol. 42:5217-5222. [Disponible en anglais seulement]
Ratledge C. 1994. Biodegradation of oils, fats and fatty acids. In: Ratledge C, editor. Biochemistry of microbial degradation. London (UK): Kluwer Academic Publishers. p. 89-141. [Mentionné dans CE 2008] [Disponible en anglais seulement]
Reid KW. 1984. Water use in Saskatchewan’s potash industry and opportunities for water recycling/conservation. Can Water Resour J. 9(1):21-26. [Disponible en anglais seulement]
Rieb MH, Grimme LH. 1993. Studies on surfactant toxicity to the freshwater alga Chlorella fusca: a common mode of action? Sci Total Environ. 134:551-558. [Disponible en anglais seulement]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement (NL)]. 2002. Children’s toys fact sheet. Bilthoven (NL): RIVM. Report No.: 612810012/2002. [Consulté le 4 octobre 2018].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2007. Do-it-yourself products fact sheet: to assess the risks for the consumer. Bilthoven (NL): RIVM. Report No.: 320104007/2007. [Consulté le 4 octobre 2018].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [Institut national pour la santé publique et l’environnement]. 2018. Cleaning products fact sheet: default parameters for estimating consumer exposure – Mis à jour le version 2018. Bilthoven (NL): RIVM. Report No.: 2016-0179. [Consulté le 4 octobre 2018].
Roose P, Eller K, Henkes E, Rossbacher R, Höke H. 2015. Amines, Aliphatic. In Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim (DE): Wiley-VCH. [Disponible en anglais seulement]
Rosen MJ, Kunjappu JT. 2012. Surfactants and interfacial phenomena. 4th ed. Hoboken (NJ): John Wiley & Sons. p. 616. [Disponible en anglais seulement]
Santé Canada. 2010. Directives relatives aux demandes d'autorisation concernant les additifs indirects - Directive nº 4. Ottawa (Ont.) : gouvernement du Canada.
Santé Canada. 2015a. Environmental Assessment Unit Drinking Water Spreadsheets [Excel format]. Ottawa (Ont.) : Santé Canada. [Consulté le 8 avril 2016]. [Disponible en anglais seulement]
Santé Canada. 2015b. Tableau de la consommation des aliments fondé sur l’Enquête sur la santé dans les collectivités canadiennes, cycle 2.2, Nutrition (2004) réalisée par Statistique Canada, fichier partagé. Ottawa (Ont.) : Santé Canada.
Santé Canada. 2016. Document sur l'approche scientifique : Approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances. Ottawa (Ont.) : gouvernement du Canada.
Santé Canada. [Modifié le 14 juin 2018]. Liste critique des ingrédients de cosmétiques : Liste des ingrédients dont l'usage est interdit dans les cosmétiques. Ottawa (Ont.) : gouvernement du Canada. [Consulté le 4 octobre 2018].
Santé Canada. 2018. Draft backgrounder document on total body surface area. Rapport inédit. Ottawa (Ont.) : gouvernement du Canada. [Disponible en anglais seulement]
Schlechtriem C, Nendza M, Hahn S, Zwintscher A, Schüürmann G, Kühne R. 2014. Contribution of non-lipid based processes to the bioaccumulation of chemicals. Dessau-Roßlau (DE): Environmental Research of the Federal Ministry for the Environment, Nature Conservation and Nuclear Safety. Report No.: UBA-FB 00. 92 p. [Disponible en anglais seulement]
Schneider J, Warzok E, Osske G, Potzsch HD. 1977. Fehlender kanzerogener Effekt nach Gabe von Aminen bzw. Amiden und Nitrit an Kaninchen. Experimentelle Pathologie. 13(1):78-80. [Disponible en anglais seulement]
SCREEN3 [computer model]. 2011. Ver. 3.5.0. Research Triangle Park (NC): US Environmental Protection Agency, Office of Air Quality Planning and Standards, Emissions, Monitoring, and Analysis Division. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2014a. N,N-Dimethylhexadecylamine 95%. Waterbury (CT): Pfaltz & Bauer, Inc. [Mis à jour le 2014 May 8, Consulté le 10 janvier 201x]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2014b. C16-18-(even numbered)-alkylamines acetates. Frankfurt (DE): Clariant Produkte. [Consulté le 25 mai 2018]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2014c. Tallow amine acetate [PDF]. West Chester (PA): Chem Service, Inc. [Consulté le 14 juin 2018]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2014d. Marine Epoxy Resin – Syringe; MarineWeld™ Syringe. The J-B Weld Company. Sulphur Springs (TX): J-B Weld. [Consulté le 18 juin 2017]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2015. Gorilla Epoxy - Hardener. The Gorilla Glue Company. Cincinnati (OH) The Gorilla Glue Company. [Consulté le 26 octobre 2017]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2017a. Armac HT. Chicago (IL): Akzo Nobel Surface Chemistry LLC. [Consulté le 12 juin 2018]. [Disponible en anglais seulement]
[SDS] Safety Data Sheet. 2017b. Tomamine DA-17 Surfactant. Parsippany (NJ): Evonik Industries. [Mis à jour le 13 janvier 2017, consulté le 14 juin 2018]. [Disponible en anglais seulement]
[SDS] Fiche de données de sécurité. 2018a. LePage Marine Epoxy Hardener. Mississauga (ON): Henkel Canada Corporation. [Consulté le 4 octobre 2018].
[FS] Fiche signalétique. 2018b. Amazing GOOP Marine Epoxy Paste Hardener (US and Canada) [PDF]. Eugene (OR): Eclectic Products, Inc.
[SDS] Safety Data Sheet. 2019. Armeen CD Primary amine [PDF]. Chicago (US): Nouryon. [Consulté le 27 mars 2019]. [Disponible en anglais seulement]
Singer GM. Lijinsky W. 1976. Naturally occurring nitrosatable compounds. I. Secondary amines in foodstuffs. J Agric Food Chem. 24(3):550-553. [Disponible en anglais seulement]
Slesinski RS, Guzzie PJ, Hengler WC, Watanabe PG, Woodside MD, Yang RS. 1983. Assessment of genotoxic potential of ethylenediamine: In vitro and in vivo studies. Mutat Res. 124(3-4):299-314. [Disponible en anglais seulement]
Slesinski RS. 1984. In vitro genotoxicity of commercial and purified ethyleneamines. The Toxicologist. 4: 35 (résumé). [Mentionné dans OECD/SIDS 1994]. [Disponible en anglais seulement]
Statistique Canada. 2004. Enquête sur la santé dans les collectivités canadiennes (ESCC) – Nutrition. Information détaillée pour 2004 (cycle 2.2). Ottawa (Ont.) : gouvernement du Canada.
Strathdee GG, Haryett CR, Douglas CA, Senior MV, Mitchell J. 1982. The processing of potash ore by PCS. Toronto (ON): XIV International Mineral Processing Congress. p. 12.1-12.20. [Disponible en anglais seulement]
Svoboda JA, Wrenn TR, Thompson MJ, Weyant JR, Wood DL, Bitman J. 1977. Reduction of blood and liver cholesterol in the rat by straight and branched chain alkyl amines. Lipids. 12(9):691-697. [Disponible en anglais seulement]
Szybalski W. 1958. Special microbiological systems. II. Observations on chemical mutagenesis in microorganisms. Ann N Y Acad Sci. 76(3):475-489. [Disponible en anglais seulement]
Takahashi A, Ohno S. 1993. Mutagenicity assessment in 44 epoxy resin hardeners in Salmonella typhimurium tester strains. Chem Express. 8(9):785-788. [Disponible en anglais seulement]
[TDS] Fiche technique. 2014. Fiche technique Lepage Marine époxy. Mississauga (Ont.) : Henkel Canada Corporation. [Consulté le 25 octobre 2017].
[TDS] Technical Data Sheet. 2018. Amazing Goop Marine Epoxy Paste. Eugene (OR): Eclectic Products, Inc. [Consulté le 16 octobre 2018]. [Disponible en anglais seulement]
[TEST] Toxicity Estimation Software Tool. 2016. Ver. 4.2. Washington (DC): US Environmental Protection Agency. [Disponible en anglais seulement]
Tezel U, Pierson JA, Pavlostathis SG. 2006. Fate and effect of quaternary ammonium compounds on a mixed methanogenic culture. Water Res. 40(19):3660-3668. [Disponible en anglais seulement]
Thorsteinsdóttir M, Beijersten I, Westerlund D. 1995. Capillary electroseparations of enkephalin‐related peptides and protein kinase A peptide substrates. Electrophoresis. 16(4):564-573. [Mentionné dans Timmer et Droge 2017]. [Disponible en anglais seulement]
Timmer N, Droge ST. 2017. Sorption of cationic surfactants to artificial cell membranes: Comparing phospholipid bilayers with monolayer coatings and molecular simulations. Environ Sci Technol. 51(5):2890-2898. [Disponible en anglais seulement]
Timmer N, Gore D, Sanders D, Gouin T, Droge ST. 2019. Toxicity mitigation and bioaccessibility of the cationic surfactant cetyltrimethylammonium bromide in a sorbent-modified biodegradation study. Chemosphere. 222:461-468. [Disponible en anglais seulement]
Tønning K, Jacobsen E, Pedersen E, Strange M, Poulsen PB, Møller L, Boyd HB. 2009. Survey and health assessment of the exposure of 2 year-olds to chemical substances in consumer products [PDF]. Survey of Chemical Substances in Consumer Products, No. 102 2009. Odense (DK): Danish Environmental Protection Agency [Disponible en anglais seulement]
Trapp S, Franco A, Mackay D. 2010. Activity-based concept for transport and partitioning of ionizing organics. Environ Sci Technol. 44 (16):6123-6129. [Disponible en anglais seulement]
[US EPA] United States Environmental Protection Agency. 1992. Screening procedures for estimating the air quality impact of stationary sources, revised. Washington (DC): US EPA, Office of Air Quality. p. 102. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2003a. Appendix A- Robust Summaries for Reliable Studies, FND Amines category HPV Chemicals Challenge. Washington (DC): US EPA, Toxicology/ Regulatory Services, Inc. Docket No.: 201-14978 [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2003b. Appendix A- Robust Summaries for Reliable Studies, FND Ether Amines category HPV Chemicals Challenge. Washington (DC): US EPA, Toxicology/ Regulatory Services, Inc. Docket No.: 201-14978. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2003c.Fatty Nitrogen Derived Amines Category High Production Volume (HPV) Chemicals Challenge, Assessment of Data Availability and Test Plan. Washington (DC): US EPA, Toxicology/ Regulatory Services, Inc. Docket No.: 201-14978. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2003d. Fatty Nitrogen Derived Ether Amines Category High Production Volume (HPV) Chemicals Challenge, Assessment of Data Availability and Test Plan. Washington (DC): US EPA, Toxicology/ Regulatory Services, Inc. Docket No.: 201-14978. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2009. Memorandum. N-alkyl (C8-C18) primary amines and acetate salts (NAPASS-JITF CST 25 inert ingredients). Human health risk assessment to support proposed exemption from the requirement of a tolerance when used as inert ingredients in pesticide formulations. Washington (DC): US EPA, Office of Pollution Prevention and Toxics. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2010. Screening-level hazard characterization: Fatty Nitrogen Derived amines category. Washington (DC): US EPA, Office of Pollution Prevention and Toxics. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2011. Chapter 6: Inhalation Rates. Exposure Factors Handbook 2011 Edition (Final). U.S. Environmental Protection Agency: Washington, DC. EPA/600/R-09/052F. [Disponible en anglais seulement]
[US EPA] US Environmental Protection Agency. 2012. Standard operating procedures for residential pesticide exposure assessment. Washington (DC): US EPA, Office of Pesticide Programs, Health Effects Division. [Disponible en anglais seulement]
van Ginkel CG. 1996. Complete degradation of xenobiotic surfactants by consortia of aerobic microorganisms. Biodegradation. 7(2):151-164. [Mentionné dans CE 2008]. [Disponible en anglais seulement]
van Wijk D, Gyimesi-van den Bos M, Garttener-Arends I, Geurts M, Kamstra J, Thomas P. 2009. Bioavailability and detoxification of cationics: I. algal toxicity of alkyltrimethyl ammonium salts in the presence of suspended sediment and humic acid. Chemosphere. 75(3):303-309. [Disponible en anglais seulement]
[VCF] Volatile Compounds in Food [database]. 2018. Nijssen, L.M.; Ingen-Visscher, C.A. van; Donders, J.J.H. Version 16.5. Zeist, The Netherlands: Triskelion B.V., 1963-2018. [Accès restreint] (Disponible en anglais seulement)
Verhaar HJM, van Leeuwen CJ, Hermens JLM. 1992. Classifying environmental pollutants. 1: Structure-activity relationships for prediction of aquatic toxicity. Chemosphere. 25(4):471-491. [Disponible en anglais seulement]
Versar, Inc. 1986. Standard scenarios for estimating exposure to chemical substances during use of consumer products. Vol. II. Consumer use of used motor oil. Springfield (VA): Versar, Inc. Prepared for US Environmental Protection Agency. [Disponible en anglais seulement]
Versteeg DJ, Shorter SJ. 1992. Effect of organic carbon on the uptake and toxicity of quaternary ammonium compounds to the fathead minnow, Pimephales promelas. Cincinnati (OH): The Procter & Gamble Company, Environmental Safety Department. [Disponible en anglais seulement]
Villar-Gómez A, Muñoz X, Culebras M, Morell F, Cruz MJ. 2009. Occupational asthma caused by inhalation of surfactant composed of amines. Scand J Work Environ Health. 35(6):475-478. [Disponible en anglais seulement]
Vitzthum OG, Werkhoff P, Hubert P. 1975. New volatile constituents of black tea aroma. J Agric Food Chem. 23(1975):999-1003. [Disponible en anglais seulement]
Wood AW, Johnston BD, Farrell AP, Kennedy CJ. 1996. Effects of didecyldimethylammonium chloride (DDAC) on the swimming performance, gill morphology, disease resistance, and biochemistry of rainbow trout (Oncorhynchus mykiss). Can J Fish Aquat Sci. 53 (11):2424-2432. [Disponible en anglais seulement]
Wu X, Bennett DH, Ritz B, Cassady DL, Lee K, Hertz-Picciotto I. Usage pattern of personal care products in California households. Food Chem Toxicol. 48(11):3109-3119. [Disponible en anglais seulement]
Wu Q, Shi H, Ma Y, Adams C, Eichholz T, Timmons T, Jiang H. 2015. Determination of secondary and tertiary amines as N-nitrosamine precursors in drinking water system using ultra-fast liquid chromatography–tandem mass spectrometry. Talanta. 131:736–741. [Disponible en anglais seulement]
Yang RS, Garman RH, Maronpot RR, McKelvy JA, Weil CS, Woodside MD. 1983. Acute and subchronic toxicity of ethylenediamine in laborator animals. Fundam Appl Toxicol. 3(6):512-520. [Disponible en anglais seulement]
Yang RS, Garman RH, Weaver EV, Woodside MD. 1984. Two-generation reproduction study of ethylenediamine in Fischer 344 rats. Fundam Appl Toxicol. 4(4):539-546. [Disponible en anglais seulement]
Yoshimura K, Machida S, Masuda F. 1980. Biodegradation of long chain alkylamines. J Am Oil Chem Soc. 57(7):238-241. [Disponible en anglais seulement]
Zeiger E, Anderson B, Haworth S, Lawlor T, Mortelmans K. 1988. Salmonella mutagenicity test: IV. Results from the testing of 300 chemicals. Environ Mol Mutagen. 11 Suppl 12:1-158. [Disponible en anglais seulement]
Zeisel SH, DaCosta KA. 1986. Increase in human exposure to methylamine precursors of N-nitrosamines after eating fish. Cancer Res. 46(12 Pt. 1):6136-6138. [Disponible en anglais seulement]
Zhang AQ, Mitchell SC, Smith RL. 1995. Dimethylamine in human urine. Clin Chim Acta. 233(1-2):81-88. [Disponible en anglais seulement]
Zhang C, Cui F, Zeng GM, Jiang M, Yang ZZ, Yu ZG, Zhu MY, Shen LQ. 2015. Quaternary ammonium compounds (QACs): a review on occurrence, fate and toxicity in the environment. Sci Total Environ. 518-519: 352-362. [Disponible en anglais seulement]
Zimmering S, Mason JM, Valencia R, Woodruff RC. 1985. Chemical mutagenesis testing in Drosophila. II. Results of 20 coded compounds tested for the National Toxicology Program. Environ Mutagen. 7(1):87‑100. [Disponible en anglais seulement]
Annexe A. Classification du risque écologique des substances organiques (CRE)
Les risques pour l’environnement associés aux quatre amines aliphatiques à chaîne(s) courte(s) [benzyldiméthylamine, éthylènediamine, 2,2’-iminodi(éthylamine), diméthylamine] dans la présente évaluation ont été caractérisés à l’aide de la Classification du risque écologique des substances organiques (CRE) (ECCC 2016a). La CRE est une approche fondée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition et qui pondère plusieurs données probantes pour obtenir un classement du risque. Les diverses données probantes sont réunies pour que l’on puisse distinguer les substances présentant une puissance faible ou élevée et un potentiel d’exposition faible ou élevé dans divers milieux. Une telle approche permet de réduire l’incertitude globale de la caractérisation du risque comparativement à une approche qui reposerait sur un paramètre unique dans un seul milieu (p. ex., la concentration létale médiane [CL50]) pour la caractérisation.
Les données sur les propriétés physicochimiques, le devenir (demi-vies chimiques dans divers milieux et biotes, coefficients de partage et bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et les volumes de produits chimiques importés ou fabriqués au Canada proviennent de publications scientifiques, de bases de données empiriques (p. ex., Boîte à outils QSAR de l’OCDE 2017), et des réponses fournies aux enquêtes menées conformément à l’avis émis en vertu de l’article 71 de la LCPE, ou sont des données produites par modélisation de la relation (quantitative) structure‑activité (QSAR), du devenir du bilan massique ou de la bioaccumulation. Ces données ont servi à alimenter d’autres modèles de bilan massique ou à remplir les profils de danger et d’exposition des substances.
Les profils de danger reposent principalement sur des paramètres tels que le mode d’action toxique, la réactivité chimique, les seuils de toxicité interne dérivés du réseau trophique, la biodisponibilité et l’activité chimique et biologique. Les profils d’exposition ont aussi été élaborés à partir de plusieurs paramètres dont les taux d’émission potentiels, la persistance globale et le potentiel de transport à grande distance. On a comparé les profils de danger et d’exposition aux critères de décision afin de classer les potentiels de danger et d’exposition de chaque substance organique comme faibles, modérés ou élevés. On a appliqué d’autres règles (p. ex., cohérence de la classification, marge d’exposition) pour préciser les classements préliminaires de danger et d’exposition.
Une matrice de risques a permis d’attribuer à chaque substance un risque potentiel faible, modéré ou élevé, en fonction du classement de son danger et de son exposition. On a vérifié le classement du risque potentiel établi au moyen de la CRE en suivant une approche en deux étapes. La première étape consistait à faire passer le classement des risques de moyen ou élevé à faible dans le cas des substances dont le taux d’émission estimé dans l’eau est faible après traitement des eaux usées, représentant un potentiel d’exposition faible. La deuxième étape consistait à réévaluer le classement du potentiel de risque faible à l’aide de scénarios de risque relativement prudents à échelle locale (c.-à-d., la zone entourant directement la source ponctuelle de rejet) conçus pour ne pas nuire à l’environnement, afin de déterminer si le classement du risque potentiel devrait être revu à la hausse.
La CRE est une approche pondérée qui vise à réduire au minimum le risque d’un surclassement ou d’un sous-classement du danger, de l’exposition et des risques subséquents. Une description détaillée des approches équilibrées de traitement des incertitudes est présentée dans ECCC 2016a. Voici une description de deux des domaines d’incertitude les plus importants. Des valeurs de toxicité aiguë empiriques ou modélisées erronées pourraient entraîner des modifications du classement du danger, en particulier dans le cas des paramètres liés à des valeurs de résidus dans les tissus (c.-à-d., mode d’action toxique), dont bon nombre sont des valeurs prédites à l’aide de modèles QSAR (Boîte à outils QSAR de l’OCDE 2017). Cependant, l’impact de ce type d’erreur est atténué par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (sans danger) de résidus dans les tissus utilisée pour l’analyse des résidus corporels critique (RCC). Une erreur due à une sous-estimation de la toxicité aiguë sera atténuée par le recours à d’autres paramètres de danger, tels que le profilage structurel du mode d’action, de la réactivité et/ou de l’affinité de liaison à l’œstrogène. Les changements ou les erreurs touchant les quantités chimiques pourraient donner lieu à un classement de l’exposition différent, les classements de l’exposition et du risque étant très sensibles aux taux d’émission et aux quantités utilisées. Les classements obtenus au moyen de la CRE représentent donc l’exposition et le risque au Canada d’après les quantités qu’on considère être utilisées actuellement et pourraient ne pas rendre compte des tendances futures.
Les données critiques et les facteurs à considérer, utilisés pour élaborer les profils spécifiques de ces substances, ainsi que les résultats de la classification du danger, de l’exposition et du risque sont présentés dans ECCC (2016c).
Les classements du danger et de l’exposition des quatre amines aliphatiques à chaîne(s) courte(s) sont résumés dans le tableau A-1.
| Substance | Classsement du danger selon la CRE | Classement de l’exposition selon la CRE | Classement du risque selon la CRE |
|---|---|---|---|
| Benzyldiméthylamine | faible | faible | faible |
| Éthylènediamine | faible | faible | faible |
| 2,2’-Iminodi(éthylamine | faible | faible | faible |
| Diméthylamine | faible | faible | faible |
Compte tenu des classements faibles pour le danger et l’exposition d’après les données prises en compte dans la CRE, les potentiels de la benzyldiméthylamine, de l’éthylènediamine, de la 2,2’-iminodi(éthylamine) et de la diméthylamine ont été classés faibles en ce qui concerne le risque pour l’environnement. Il est donc peu probable que ces substances entraînent des préoccupations pour l’environnement au Canada.
Annexe B. Information sur l’identité de la substance
Les amines aliphatiques peuvent être définies par le nombre de groupes fonctionnels amine. Les monoamines ont une amine dans la molécule, les diamines en ont deux et les triamines en ont trois. Dans le tableau B-1, sont décrites les substances du groupe des amines aliphatiques selon qu’elles soient des monoamines, des diamines ou des triamines. Les amines aliphatiques peuvent également décrites comme amines primaires, secondaires ou tertiaires, d’après le nombre de substituants organiques associés à l’amine, comme on le décrit dans le tableau B-2. Lorsque les substituants organiques sont des groupes alkyles, l’amine peut être décrite comme une amine monoalkyle, dialkyle ou trialkyle selon le nombre de groupes alkyle (tableau B-2). Un groupe fonctionnel éther peut également être présent sur la chaîne alkyle. Les substances possédant ce groupe fonctionnel sont aussi appelées « éther-amines ». Certaines des amines aliphatiques sont des UVCB, lesquelles ont été qualifiées de primaires, secondaires ou tertiaires d’après leur structure représentative.
| Catégorie | Amines aliphatiques qui appartiennent à une catégorie donnée |
|---|---|
| Monoamines | Benzyldiméthylamine, hexadécyldiméthylamine, diméthylamine, octadécylamine, amines alkyles de coco, NASAS, AAASH, AAAS |
| Diamines | Éthylènediamine, ASPDA, TDPDA, ASTMPDA |
| Triamines | 2,2’-Iminodi(éthylamine |
| Category | General structurea | Les amines aliphatiques that fit given categoryb |
|---|---|---|
| Amine primairec |  | Éthylènediamine, octadécylamine,amines alkyles de coco, AAASH, AAAS, |
| Amine secondaired |  | Diméthylamine, NASAS, |
| Amine tertiairee |  | Benzyldiméthylamine, hexadécyldiméthylamine, ASTMPDA |
a R= chaîne alkyle; un groupe fonctionnel aryle peut être lié à la chaîne alkyle, mais le groupe aryle ne peut être lié directement à l’atome d’azote.
b Certains diamines et triamines n’ont pas été comprises dans cette colonne, car elles conviennent à plus d’une catégorie.
c Lorsque R représente une chaîne alkyle, on peut appeler cette substance une monoalkylamine.
d Lorsque R représente deux chaînes alkyles, on peut appeler cette substance une dialkylamine.
e Lorsque R représente trois chaînes alkyles, on peut appeler cette substance une trialkylamine.
Amines aliphatiques à chaîne(s) longue(s) définies par leur formule chimique
R1N(R2)R3 (monoamines)
Où :
R1 = H or CH3
R2 = H ou CH3 ou chaîne alkyle en C8-C22 linéaire ou ramifiée, saturée ou insaturée
R3 = chaîne alkyle en C8-C22 linéaire ou ramifiée, saturée ou insaturée
OU
R1N(R2)(CH2)3OR4 (éthers-monoamines) ou
R1N(R2)(CH2)3N(R3)R4 (diamines) ou
R1N(R2)(CH2)3N(R3)(CH2)3OR4 (éthers-diamines)
Où :
R1, R2, R3 = H ou CH3
R4 = chaîne alkyle en C8-22, linéaire ou ramifiée, saturée ou insaturée
La description ci-dessus comprend les amines aliphatiques seules ou dans un sel.
Annexe C. Liste non exhaustive des amines aliphatiques à chaîne(s) longue(s)
L’approche prise dans l’évaluation de la toxicité pour l’environnement est d’examiner toutes les amines aliphatiques à chaîne(s) longue(s) qui répondent à la définition du groupe, comprenant, sans y être limités, les substances des neuf nos CAS du groupe des amines aliphatiques. Les amines aliphatiques à chaîne(s) longue(s), visées par la définition de la catégorie des amines aliphatiques à chaîne(s) longue(s) de la section intitulée Identité des substances, sont évaluées en tant que catégorie, car elles présentent des propriétés, un devenir et un danger pour l’environnement similaires. Les amines aliphatiques à chaîne(s) longue(s) inscrites sur la Liste intérieure des substances (LIS), autres que celles appartenant déjà au groupe des amines aliphatiques, figurent dans le tableau C-1.
| No CAS | Nom sur la LIS |
|---|---|
| 111-86-4 | Octylamine |
| 112-18-5 | Dodécyldiméthylamine |
| 112-75-4 | Diméthyl(tétradécyl)amine |
| 112-90-3 | (Z)-Octadéc-9-énylamine |
| 112-99-2 | Dioctadécylamine |
| 124-22-1 | Dodécylamine |
| 124-28-7 | Dimantine |
| 143-27-1 | Hexadécylamine |
| 929-73-7 | Chlorure de dodécylammonium |
| 1120-24-7 | Décyldiméthylamine |
| 1613-17-8 | N,N-Diméthyloctadécylamine, chlorhydrate |
| 1838-08-0 | Octadécylamine, chlorhydrate |
| 1920-05-4 | Acétate de dodécyldiméthylammonium |
| 2016-56-0 | Acétate de dodécylammonium |
| 2016-57-1 | Décylamine |
| 2190-04-7 | Acétate d’octadécylammonium |
| 3007-31-6 | Didodécylamine |
| 4455-26-9 | Méthyldioctylamine |
| 5538-95-4 | N-Dodécylpropane-1,3-diamine |
| 7173-62-8 | (Z)-N-9-Octadécénylpropane-1,3-diamine |
| 7378-99-6 | Diméthyl(octyl)amine |
| 7396-58-9 | N-Méthyldidécylamine |
| 10460-00-1 | Acétate de (Z)-octadéc-9-énylammonium |
| 13281-06-6 | N-(2-Éthylhexyl)propane-1,3-diamine |
| 14676-61-0 | 3-(Tridécyloxy)propylamine |
| 19855-61-9 | Acétate de diméthyl(octadécyl)ammonium |
| 22020-14-0 | N-Méthyl-N-octyldécylamine |
| 22023-23-0 | N-[3-(Tridécyloxy)propyl]propane-1,3-diamine |
| 24287-35-2 | Acétate de diméthyltétradécylammonium |
| 25324-14-5 | Acétate d’hexadécyldiméthylammonium |
| 28061-69-0 | N,N-Diméthyloctadécénylamine |
| 28701-67-9 | Acétate de 3-(isodécyloxy)propylammonium |
| 29317-52-0 | 3-(Isononyloxy)propylamine |
| 30113-45-2 | 3-(Isodécyloxy)propylamine |
| 40165-68-2 | Dioléylamine |
| 50291-24-2 | Dodécan-1-amine, sulfate |
| 61788-45-2 | Amines alkyles de suif hydrogéné |
| 61788-62-3 | Amines, bis(alkyle de coco)méthyles |
| 61788-63-4 | Amines, bis(alkyle de suif hydrogéné)méthyles |
| 61788-91-8 | Amines, alkyle de soja diméthyles |
| 61788-93-0 | Amines, alkyle de coco diméthyles |
| 61788-95-2 | Amines, (alkyle de suif hydrogéné)diméthyles |
| 61789-76-2 | Amines dialkyles de coco |
| 61790-18-9 | Amines alkyles de soja |
| 61790-33-8 | Amines alkyles de suif |
| 61790-57-6 | Amines alkyles de coco, acétates |
| 65059-85-0 | Acétate d’heptadécyldiméthylammonium |
| 67700-98-5 | Amines, alkyle en C10-16 C10-16 diméthyles |
| 67700-99-6 | Amines, dialkyle en C14-18 méthyles |
| 68037-91-2 | Amines alkyles en C14-18 |
| 68037-92-3 | Amines alkyles en C16-22 |
| 68037-95-6 | Amines alkyles en C16-18 et insaturées en C18 |
| 68037-98-9 | Amines dialkyles en C14-18 |
| 68130-68-7 | Propane-1,3-diamine, dérivés N-[3-(C12‑18‑alkyloxy)propylés] |
| 68155-38-4 | Amines, alkyles en C14-18 et insaturés en C16-18 |
| 68439-70-3 | Amines, alkyle en C12-16 diméthyles |
| 68513-50-8 | N-Tridécyltridécan-1-amine ramifiée |
| 68603-64-5 | Amines, N-(alkyle de suif hydrogéné)triméthylènedi- |
| 68603-65-6 | Amines, méthyldisuif alkyles |
| 68610-26-4 | Propan-1-amine, dérivés 3-alkyloxylés en C12-15 |
| 68610-68-4 | Propan-1-amine, dérivés 3-alkyloxylés en C8-10, acétates |
| 68783-23-3 | Amines dialkyles de soja |
| 68783-24-4 | Amines dialkyles de suif |
| 68784-38-3 | Propan-1-amine, dérivés 3-alkyloxylés en C8-10 |
| 68814-69-7 | Amines, diméthylsuif alkyles |
| 68855-63-0 | Amines, alkyles en C16 et insaturés en C18 |
| 68909-95-5 | 3-(Tridécyloxy)propylamine ramifiée et linéaire |
| 68955-53-3 | Amines tert-alkyles en C12-14 |
| 68955-54-4 | Amines tert-alkyles en C16-22 |
| 71011-01-3 | Acétates de bis(alkyl de suif hydrogéné)amines |
| 71011-03-5 | Acétates de dialkyl(de suif)amines |
| 75444-69-8 | Alkyl(en C16-22)diméthylamines |
| 125328-36-1 | Amines en C20-22, acétates |
| 125328-37-2 | Alkylamines en C20-22 |
| 125328-38-3 | Alkylamines d’huile de canola |
| 125328-39-4 | N-Alkyl(triméthylènediamines) d’huile de canola |
| 125328-41-8 | Alkylamines dérivés de l’huile de canola hydrogénée |
| 125328-42-9 | Alkylamines d’huile de canola diméthylées |
| 125328-43-0 | Alkylamines d’huile de colza hydrogénée |
| 125328-44-1 | Alkylamines d’huile de colza hydrogénée, acétates |
| 125328-45-2 | Alkylamines de suif hydrogéné, résidus de distillation |
| 125328-46-3 | Alkylamines d’huile de colza |
| 1078712-76-1 | 2-Éthylhexyl(alkyl de suif hydrogéné)méthanamines |
Annexe D. Approche d’extrapolation pour l’évaluation des risques pour la santé humaine
| Substance (no CAS) | Considérations |
|---|---|
| Hexadécyldiméthylamine (112-69-6) |
|
| Octadécylamine (124-30-1) |
|
| TDPDA (68479-04-9) |
|
Annexe E. Propriétés physico-chimique d’analogues pour l’évaluation des risques pour la santé humaine
| Dodécyldiméthylamine (No CAS 112-18-5) | Hexadécyldiméthylamine (No CAS 112-69-6) | N,N-diméthyl-1‑docosanamine (No CAS 21542-96-1) | |
|---|---|---|---|
| Poids moléculaire (g/mol) | 213,4a | 269,5d | 353,7 |
| État physique | Liquideb | Liquidee | Solidei |
| Point de fusion (°C) | -11 à -33b | -11d,e | 41i |
| Point d’ébullition (°C) | 237 à > 300 | > 300d,f | > 350i |
| Pression de vapeur (Pa) | 0,009 à 6,4b | 0,038f | 0i |
| Solubilité dans l’eau (mg/L) | 8,6c | 5,1 à 18g,h | 0,001i |
| pKa | 9,8c | 9,9 à 10,1g | 8,8i |
Abréviation : s.o., sans objet
Références : aChemID 1993-2017; bECHA 2018d (données d’extrapolation); cPrésentation d’étude 2017; dECHA c2007-2018c et ECHA 2018i; eSDS 2014a; fvaleur obtenue par modélisation; gACD/Percepta c1997-2012; hECHA c2007-2018c (réalisé à pH 7,1); iECHA 2018j
| Amines alkyles de suif (No CAS 61790-33-8) | (9Z)-9-Octadécén-1‑amine (No CAS 112-90-3) | Octadécylamine (No CAS 124-30-1) | Amines alkyles en C16-22 (No CAS 68037-92-3) | |
|---|---|---|---|---|
| Poids moléculaire (g/mol) | 267 | 267,5 | 269,5 | 283,5 |
| État physique | Solidea | Solidea | Solideb | Solideg |
| Point de fusion (°C) | 32 à 40a | 15 à 30a | 52,9 à 56c | 38g |
| Point d’ébullition (°C) | 200 à 230a | 128 à 355a | 346,8 à 348,5c,d,e | 350g |
| Pression de vapeur (Pa) | s.o. | 0,5a | 0,012d | 0,022 à 0,036g |
| Masse volumique (g/cm3) | 0,79a | 0,8a | 0,9 | 0,95 |
| Solubilité dans l’eau (mg/L) | 0,12a | 0,08a | 1,6f | 0,4g |
| pKa | s.o. | s.o. | 10,6f | 10,4g |
Abréviations : s.o., sans objet
Références : aEU 2008; bSDS 2019; c Lide et Frederikse 1996; dValeur modélisée pour la substance neutre dans EPI Suite (c2000-2012) à l’aide des structures représentatives pour des UVCB; eECHA c2007-2018d; fACD/Percepta c1997-2012; gECHA 2018e
| TDPDA (No CAS 68479-04-9) | 1,3-Propanediamine, N‑[3‑(tridécyloxy)propyl]-, ramifié acétate (No CAS inconnu; no CE 931-295-2) | |
|---|---|---|
| Poids moléculaire (g/mol) | 315 | Non précisé |
| État physique | Liquidea | Liquidee |
| Point de fusion (°C) | -34,4a | < -30e |
| Point d’ébullition (°C) | 359 à 380b | 300e |
| Pression de vapeur (Pa) | 10-3b | 0,003 à 0,005 e |
| Solubilité dans l’eau (mg/L) | 1 300 à 19 000c,d | 1 300e |
| pKa | s.o. | 7,6e |
Abréviations : s.o., sans objet
Références :
aSDS 2017b;
bValeur modélisée pour la substance neutre dans EPI Suite (c2000-2012) à l’aide des structures représentatives pour les UVCB;
cECHA c2007-2018g (réalisé à pH 7);
dACD/Percepta c1997-2012 (modélisation avec les structures représentatives à pH 8);
eECHA 2018g
Annexe F. Résumé détaillé des quotients de risque pour les amines aliphatiques à chaîne(s) longue(s) dans des scénarios d’exposition en milieu aquatique
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,32 | 0,22 | 1,4 |
| Production et transformation | 1,1 | 1,1 | 0,22 | 4,8 |
| Transformation | 1,3 | 1,2 | 0,22 | 5,5 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,52 | 0,22 | 2,3 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,001 8 | 0,22 | 0,008 1 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,11 | 0,22 | 0,51 |
| Flottation de minerai de fer | 0,25 | 0,23 | 0,22 | 1,1 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,552 | 0,22 | 2,5 |
| Formulation d’engrais | 2,0 | 1,89 | 0,22 | 8,6 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,23 | 0,22 | 1,1 |
| Production et transformation | 1,1 | 0,77 | 0,22 | 3,5 |
| Transformation | 1,3 | 0,89 | 0,22 | 4,1 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,38 | 0,22 | 1,7 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,001 3 | 0,22 | 0,005 9 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,08 | 0,22 | 0,38 |
| Flottation de minerai de fer | 0,25 | 0,17 | 0,2 | 0,78 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,41 | 0,22 | 1,8 |
| Formulation d’engrais | 2,0 | 1,4 | 0,22 | 6,3 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,10 | 0,22 | 0,47 |
| Production et transformation | 1,1 | 0,34 | 0,22 | 1,6 |
| Transformation | 1,3 | 0,40 | 0,22 | 1,8 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,17 | 0,22 | 0,77 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 58 | 0,22 | 0,002 6 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,037 | 0,22 | 0,17 |
| Flottation de minerai de fer | 0,25 | 0,076 | 0,2 | 0,34 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,18 | 0,22 | 0,82 |
| Formulation d’engrais | 2,0 | 0,62 | 0,22 | 2,8 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,032 | 0,22 | 0,15 |
| Production et transformation | 1,1 | 0,11 | 0,22 | 0,48 |
| Transformation | 1,3 | 0,12 | 0,22 | 0,56 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,052 | 0,22 | 0,24 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 18 | 0,22 | 0,000 82 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,011 | 0,22 | 0,052 |
| Flottation de minerai de fer | 0,25 | 0,024 | 0,2 | 0,11 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,056 | 0,22 | 0,25 |
| Formulation d’engrais | 2,0 | 0,19 | 0,22 | 0,87 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,013 | 0,22 | 0,057 |
| Production et transformation | 1,1 | 0,041 | 0,22 | 0,19 |
| Transformation | 1,3 | 0,048 | 0,22 | 0,22 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,020 | 0,22 | 0,093 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 070 | 0,22 | 0,000 32 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,004 4 | 0,22 | 0,020 |
| Flottation de minerai de fer | 0,25 | 0,009 2 | 0,2 | 0,042 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,022 | 0,22 | 0,10 |
| Formulation d’engrais | 2,0 | 0,074 | 0,22 | 0,34 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,004 8 | 0,22 | 0,022 |
| Production et transformation | 1,1 | 0,016 | 0,22 | 0,071 |
| Transformation | 1,3 | 0,018 | 0,22 | 0,083 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,007 7 | 0,22 | 0,035 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 027 | 0,22 | 0,000 12 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,001 7 | 0,22 | 0,007 6 |
| Flottation de minerai de fer | 0,25 | 0,003 5 | 0,2 | 0,016 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,008 3 | 0,22 | 0,038 |
| Formulation d’engrais | 2,0 | 0,028 | 0,22 | 0,13 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,000 1 | 0,22 | < 0,001 |
| Production et transformation | 1,1 | 0,000 3 | 0,22 | 0,002 |
| Transformation | 1,3 | 0,000 4 | 0,22 | 0,002 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,000 2 | 0,22 | 0,001 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 001 | 0,22 | < 0,001 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,000 04 | 0,22 | < 0,001 |
| Flottation de minerai de fer | 0,25 | 0,000 1 | 0,2 | < 0,001 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,000 2 | 0,22 | 0,001 |
| Formulation d’engrais | 2,0 | 0,000 6 | 0,22 | 0,003 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,24 | 0,22 | 1,1 |
| Production et transformation | 1,1 | 0,79 | 0,22 | 3,6 |
| Transformation | 1,3 | 0,92 | 0,22 | 4,2 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,39 | 0,22 | 1,8 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,001 3 | 0,22 | 0,006 1 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,085 | 0,22 | 0,39 |
| Flottation de minerai de fer | 0,25 | 0,18 | 0,2 | 0,80 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,42 | 0,22 | 1,9 |
| Formulation d’engrais | 2,0 | 1,4 | 0,22 | 6,5 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,087 | 0,22 | 0,40 |
| Production et transformation | 1,1 | 0,29 | 0,22 | 1,3 |
| Transformation | 1,3 | 0,33 | 0,22 | 1,5 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,14 | 0,22 | 0,64 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 49 | 0,22 | 0,002 2 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,031 | 0,22 | 0,14 |
| Flottation de minerai de fer | 0,25 | 0,063 | 0,2 | 0,29 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,15 | 0,22 | 0,69 |
| Formulation d’engrais | 2,0 | 0,51 | 0,22 | 2,3 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
| Scénario | CEE non convertie (µg/L) | CEE dissoute libre à COT médian (µg/L) | CESE (µg/L) | QR (dissoute libre) |
|---|---|---|---|---|
| Production | 0,34 | 0,017 | 0,22 | 0,079 |
| Production et transformation | 1,1 | 0,057 | 0,22 | 0,26 |
| Transformation | 1,3 | 0,066 | 0,22 | 0,3 |
| Production de mousse de polyuréthane (mélange de polyalcools) | 0,55 | 0,028 | 0,22 | 0,13 |
| Production de mousse de polyuréthane (mousse de polyuréthane souple) | 0,001 9 | 0,000 10 | 0,22 | 0,000 44 |
| Rejet à l’égout de dérivés d’amines | 0,12 | 0,006 1 | 0,22 | 0,028 |
| Flottation de minerai de fer | 0,25 | 0,013 | 0,2 | 0,057 |
| Formulation d’émulsions d’asphalte | 0,59 | 0,030 | 0,22 | 0,14 |
| Formulation d’engrais | 2,0 | 0,10 | 0,22 | 0,47 |
Abréviations : CESE, concentration estimée sans effet; CEE, concentration estimée de l’exposition; QR, quotient de risque; COT, carbone organique total
Annexe G. Résumé des données probantes fiables
Le niveau de confiance renvoie à l’influence combinée de la qualité et de la variabilité des données, des lacunes dans les données, de la causalité, de la plausibilité et de toute extrapolation requise pour la source de donnée. La pertinence désigne l’effet d’une donnée probante lorsqu’on détermine le potentiel de causer des effets nocifs pour l’environnement au Canada. Pour l’analyse, nous avons qualifié les potentiels comme étant de faibles à élevés, et attribué cinq résultats possibles pour la pondération.
| Données probantes | Niveau de confiance | Pertinence pour l’évaluationb | Poids attribuéc |
|---|---|---|---|
| Similitude dans la structure chimique aux fins de l’extrapolation | élevé | modérée | modéré-élevé |
| Devenir et comportement dans l’environnement (nature ionique) | modéré | élevé | modéré-élevé |
| Persistance dans l’environnement | modéré | modérée | modéré |
| Bioaccumulation dans les organismes aquatiques | modéré | modérée | modéré |
| Mode d’action et/ou autres données non observables | faible | élevé | modéré |
| CESE pour les organismes aquatiques | modéré | élevé | modéré-élevé |
| CESE pour les organismes benthiques | modéré | faible | faible-modéré |
| CESE pour les organismes vivant dans le sol | modéré | modérée | modéré |
| CEE dans l’eau - production | élevéd | élevé | élevé |
| CEE dans l’eau - production et transformation | élevéd | élevé | élevé |
| CEE dans l’eau - transformation | modéré | élevé | modéré-élevé |
| CEE dans l’eau - production de mousse de polyuréthane (mélange de polyalcools) | élevé | élevé | élevé |
| CEE dans l’eau - production de mousse de polyuréthane (mousse de polyuréthane souple) | élevé | élevé | élevé |
| CEE dans l’eau - rejet à l’égout de dérivés d’amines | faiblee | élevé | modéré |
| CEE dans l’eau – extraction de minerai de fer | modéréd | élevé | modéré-élevé |
| CEE dans l’eau - formulation d’émulsions d’asphalte | élevé | élevé | élevé |
| CEE dans l’eau - formulation d’engrais | modéré | modérée | modéré |
| CEE dans le sol | modéré | modérée | modéré |
| QR pour l’eau - production | élevéd | élevé | élevé |
| QR pour l’eau - production et transformation | élevéd | élevé | élevé |
| QR pour l’eau - transformation | modéré | élevé | modéré-élevé |
| QR pour l’eau - production de mousse de polyuréthane (mélange de polyalcools) | élevé | élevé | élevé |
| QR pour l’eau - production de mousse de polyuréthane (mousse de polyuréthane souple) | élevé | élevé | élevé |
| QR pour l’eau - rejet à l’égout de dérivés d’amines | modérée | élevé | modéré-élevé |
| QR pour l’eau - minerai de fer extraction | modéréd | élevé | modéré-élevé |
| QR pour l’eau - formulation d’émulsions d’asphalte | élevé | élevé | élevé |
| QR pour l’eau - formulation d’engrais | modéré | modérée | modéré |
| QR pour le sol | modéré | modérée | modéré |
a Le niveau de confiance est déterminé en fonction de la qualité des données, de la variabilité des données, des lacunes dans les données et de leur adéquation.
b La pertinence renvoie à l’impact de la donnée probante sur l’évaluation.
c Un poids est attribué à chaque donnée en fonction du niveau de confiance et de la pertinence combinées dans l’évaluation.
d Bien que les CEE sont considérées comme sous-estimées dans ces scénarios, il existe une confiance élevée dans le résultat global puisqu’un risque a été établi pour ces scénarios pour certaines catégories de longueurs de chaîne malgré l’utilisation d’hypothèses non prudentes. On sait que certaines catégories de chaînes alkyles à QR faibles pourraient en réalité poser un risque si des CEE plus prudentes étaient utilisées.
e Comme la CEE est considérée comme sous-estimée par rapport à la concentration réelle dans l’environnement, les QR sont sous-estimés. Par conséquent, le risque réel pour l’environnement découlant de rejets à l’égout est plus élevé que celui calculé ici, et certaines catégories de chaînes alkyles pourraient en réalité poser un risque pour l’environnement.
Annexe H. Paramètres pour estimer l’exposition à des produits disponibles pour les consommateurs au Canada
Les valeurs estimatives de l’exposition ont été calculées à l’aide des poids corporels par défaut de 74 kg pour les personnes de 19 ans et plus, de 62 kg pour les jeunes de 14 à 18 ans, de 42 kg pour les adolescents de 9 à 13 ans, de 23 kg pour les enfants de 4 à 8 ans, de 15 kg pour les tout-petits de 2 à 3 ans, de 11 kg pour les bébés de 1 an, de 9,1 kg pour les nourrissons de 6 à 11 mois, et de 6,3 kg pour les nouveau-nés de 0 à 5 mois (Santé Canada 2015b). Les paramètres d’exposition par inhalation et par voie cutanée pour les produits cosmétiques et d’autres produits disponibles pour les consommateurs sont décrits aux tableaux H-1 et H-2, respectivement.
| Produit (substance) | Hypothèses |
|---|---|
| Nettoyant facial (PSN) (hexadécyl-diméthylamine) | Concentration de l’hexadécyldiméthylamine : 0,13 % Fréquence d’utilisation : deux fois par jour pour les adultes et les adolescents, comme indiqué dans le mode d’emploib Cutané – Contact direct, application instantanée Quantité de produit : 1,6 g (19 ans et plus) (Loretz et coll. 2008), et 1,2 g (14 à 18 ans et 9 à 13 ans) (Ficheux et coll. 2015) Facteur de rétention : 0,01 |
| Crème à raser – corps (octadécylamine) | Concentration d’octadécylamine : 0,1 % Facteur de rétention : 0,01 Crème à raser Fréquence d’utilisation : 0,29 par jour (19 ans et plus, 14 à 18 ans et 9 à 13 ans) (Biesterbos et coll. 2013) Cutané Quantité de produit : 12,7 g (19 ans et plus et 14 à 18 ans) (Ficheux et coll. 2016), 9,9 g (9 à 13 ans) (ajustement de la superficie) |
| Revitalisant capillaire à rincer (amines alkyles de coco) | Concentration des amines alkyles de coco : 0,5 % Fréquence d’utilisation : 1,1 par jour (19 ans et plus) (Loretz et coll. 2008), 0,7 par jour (14 à 18 ans et 9 à 13 ans), 0,5 par jour (4 à 8 ans) et 0,45 par jour (2 à 3 ans) (Wu et coll. 2010) Cutané Quantité de produit : 13,1 g (19 ans et plus) (Loretz et coll. 2008), 10 g (14 à 18 ans), 7,8 g (9 à 13 ans et 4 à 8 ans) (Ficheux et coll. 2016) et 5,2 g (2 à 3 ans) (Garcia-Hidalgo et coll. 2017) Facteur de rétention : 0,01 |
a À moins d’indication autre, on suppose que le facteur de rétention est 1.
b Communication personnelle, courriel de la Direction des produits de santé naturels et sans ordonnance de Santé Canada au Bureau de l’évaluation des risques pour les substances existantes de Santé Canada, daté du 16 décembre 2018; sans référence.
| Scénario d’exposition | Hypothèses |
|---|---|
Dégazage après application de produits en MPU dans l’habitacle d’une voiture (benzyldiméthylamine) | Exposition quotidienne totale : C × ([FA × T × I] ÷ p.c. C : concentration de benzyldiméthylamine dans l’air : 6,1 × 10-3 mg/m3 (Rampfl et coll. 2008)b |
Mélange et application d’un produit adhésif à l’époxy en deux composants à usage marin (benzyldiméthylamine; | Concentration de benzyldiméthylamine dans un composant du produit : 10 % Concentration de TDPDA dans un composant du produit : 5 % à 10 % Scénario : mélange, chargement et application d’une colle en deux composants conformément à la fiche d’information d’articles de bricolage (RIVM 2007). Mélange Cutané – contact direct, application instantanée Application Cutané – contact direct, application instantanée |
Cirage (éthylènediamine) | Concentration d’éthylènediamine : 0,25 % Cutané – contact direct, application instantanée |
Mélange et application de colle en deux composants pour de petits projets de bricolage [2,2’-iminodi(éthylamine)] | Concentration dans un composant : 1 % Application Cutané – contact direct, application instantanée |
Mélange et application des deux composants d’un agent de remplissage à l’époxy à usage marin [2,2’-iminodi(éthylamine)] | Concentration dans un composant : 1 % Mélange Cutané – contact direct, application instantanée Application Cutané – contact direct, application instantanée |
Matériel externe d’un manteau (hexadécyldiméthylamine) | Concentration estimative de l’hexadécyldiméthylamine dans le matériel externe d’un manteau : 96 µg/g de produit (Tønning et coll. 2009) S (superficie)d = 2 770 cm2 pendant 2 à 3 ans (Santé Canada 2018) Orale (mâchonnement du matériel du manteau) : |
Additif de liquide à transmission pour automobiles (octadécylamine) | Scénario de produit : application de lubrifiant – huile à moteur (Versar inc. 1986) |
a D’après la concentration dans l’air 144 heures après l’application d’un traitement dans un vide sanitaire.
b D’après la concentration dans l’air pendant 1 heure.
c Volume de la pièce et taux de renouvellement de l’air pour un garage standard.
d Superficie totale du tronc et des bras.
e La masse surfacique du textile peut varier considérablement selon le type de matériel. Une masse surfacique de 1 mg/cm2 pour les textiles synthétiques est recommandée par l’US EPA dans les Standard Operating Procedures for Residential Pesticide Exposure Assessment.
f Driver et coll. 2007
Annexe I. SCREEN3 : Modèle et intrants
SCREEN3 est un modèle de dispersion est un modèle préliminaire de dispersion gaussienne dans l’air, reposant sur le modèle Industrial Source Complex (ISC) (qui permet d’évaluer les concentrations de polluants provenant de diverses sources dans un complexe industriel) (SCREEN3 2011). Le principal paramètre du modèle SCREEN3 pour la dispersion dans l’air est le vent. La concentration d’exposition maximale calculée est choisie en fonction de la matrice de données météorologiques intégrée de différentes combinaisons de conditions météorologiques, y compris la vitesse du vent, la turbulence et l’humidité. Ce modèle prédit directement les concentrations attribuables aux rejets d’une source ponctuelle, diffuse ou liée à un volume. SCREEN3 donne les concentrations maximales d’une substance à une hauteur choisie des points de réception et à diverses distances d’une source de rejet en aval du vent dominant, une heure après un rejet donné. Au cours d’une période de 24 heures, en ce qui concerne les émissions provenant de sources ponctuelles, la concentration maximale pendant une heure (évaluée par la version 3 de l’ISC) est multipliée par un facteur de 0,4 pour tenir compte des directions variables du vent. Il en ressort une estimation de la concentration dans l’air pour une exposition pendant 24 heures (US EPA 1992; SCREEN3 2011). De même, pour une exposition se produisant sur une période de un an, on peut s’attendre à ce que la direction des vents dominants soit plus variable et sans aucune corrélation avec la direction du vent lors d’un événement ponctuel; par conséquent, la concentration d’exposition maximale répartie sur une année est calculée en multipliant la concentration maximale d’une heure d’exposition par un facteur de 0,08 (US EPA 1992; SCREEN3 2011). Les paramètres utilisés pour estimer les concentrations dans l’air ambiant à l’aide du modèle SCREEN3 sont présentés dans le tableau I-1 ci-dessous.
| Substance | Benzyldiméthylamine | Éthylènediamine | Diméthylamine |
|---|---|---|---|
| Type de source | Superficie | Superficie | Superficie |
| Aire de captation des émissionsa | 500 m × 500 m | 100 m × 100 m | 100 m × 100 m |
| Hauteur du récepteurb | 1,74 m | 1.74 m | 1.74 m |
| Hauteur de la source d’émissionsa | 30 m | 5 m | 5 m |
| Facteur d’ajustementc | 0,4 | 0,4 | 0,4 |
| Option zone urbaine/zone rurale | Urbaine | Urbaine | Urbaine |
| Météorologied | 1 (données météorologiques complètes) | 1 (données météorologiques complètes) | 1 (données météorologiques complètes) |
| Distance minimale et maximale | 0-3 000 m | 0-3 000 m | 0-3 000 m |
| Distance de l’installation source aux zones résidentiellesa | 1 000 m | 500 m | 3 000 m |
a Propre au lieu; d’après l’analyse d’une photo aérienne et le jugement d’un professionnel
b Poids moyen d’un adulte (Curry et coll. 1993)
c Facteur pour tenir compte de la direction variable du vent sur une période de 24 heures (US EPA 1992).
d Valeur par défaut dans SCREEN3.
Annexe J. Paramètres pour estimer l’exposition par l’eau potable
| Substance | Benzyldiméthylamine | Éthylènediamine | 2,2’-Iminodi-(éthylamine) |
|---|---|---|---|
| Scénario | Rejets industriels | Rejets industriels | Rejets industriels |
| Taux d’élimination de l’usine de traitement des eaux usées (UTEU) (%)a | 19,4 | 85 | 82,7 |
| Nombre de sites industrielsb | 1 | 1 | 1 |
| Jours de rejet (par année)b | 250 | 250 | 250 |
| Rejets quotidiens dans les eaux usées (%) | 4c | 4c | 4c |
| Plan d’eau récepteurb | Rivière Thames, London (Ontario) | Rivière Thames, London (Ontario) | Rivière Thames, London (Ontario) |
a ECCC 2016a
b Valeur par défaut du Drinking Water Workbook de l’EAU du NSACB.
c D’après 3 % de résidus dans les contenants et 1 % comme résidus de conduites de transferts ou de cuves de traitement pour une substance liquide.
| Groupe d’âge | Hexadécyl-diméthyl-aminec | Octadécyl-diméthyl-amined | Amines alkyles de cocod | NASASf | DPDABg |
|---|---|---|---|---|---|
| 0 à 5 mois (lait maternel)h,i | s.o. | s.o. | s.o. | s.o. | s.o. |
| 0 à 5 mois (préparation pour nourrissons)h,j | 7,0 × 10-5 | 1,7 × 10-4 | 1,5 × 10-4 | 1,5 × 10-4 | 3,0 × 10-5 |
| 6 à 11 moisk | 5,0 × 10-5 | 1,1 × 10-4 | 9,0 × 10-5 | 9,0 × 10-5 | 2,0 × 10-5 |
| 1 anl | 2,0 × 10-5 | 4,0 × 10-5 | 4,0 × 10-5 | 4,0 × 10-5 | 8,12 × 10-6 |
| 2 à 3 ansm | 2,0 × 10-5 | 4,0 × 10-5 | 3,0 × 10-5 | 3,0 × 10-5 | 7,11 × 10-6 |
| 4 à 8 ansn | 1,0 × 10-5 | 3,0 × 10-5 | 3,0 × 10-5 | 3,0 × 10-5 | 5,71 × 10-6 |
| 9 à 13 anso | 9,69 × 10-6 | 2,0 × 10-5 | 2,0 × 10-5 | 2,0 × 10-5 | 4,37 × 10-6 |
| 14 à 18 ansp | 9,67 × 10-6 | 2,0 × 10-5 | 2,0 × 10-5 | 2,0 × 10-5 | 4,36 × 10-6 |
| 19 ans et plusq | 1,0 × 10-5 | 3,0 × 10-5 | 2,0 × 10-5 | 2,0 × 10-5 | 5,13 × 10-6 |
Abréviation : s.o., sans objet
a D’après une concentration estimative dans l’eau de surface, tel que modélisé à partir de la Drinking Water Spreadsheet de l’EAU à l’aide des paramètre du tableau J-1.
b L’utilisation d’une concentration modélisée dans l’eau de surface pour estimer l’apport dans l’eau potable peut être prudente, car un traitement de l’eau se fait probablement avant la distribution pour la consommation.
c CEE=0,55 µg/L (section 7.2.4)
d CEE=1,3 µg/L (section 7.2.3)
e CEE=1,12 µg/L (section 7.2.2)
f CEE=1,12 µg/L (section 7.2.2)
g CEE=0,248 µg/L (section 7.2.6)
h Supposés peser 6,3 kg (Santé Canada 2015b)
i Exclusivement pour les nourrissons nourris au lait maternel, supposés consommer 0,744 L de lait maternel par jour (Santé Canada 2018), et le lait maternel est supposé être la seule source alimentaire.
j Exclusivement pour les nourrissons nourris aux préparations pour nourrissons, supposés boire 0,826 L d’eau par jour (Santé Canada 2018), où l’eau est utilisée pour reconstituer la préparation.
k Supposés peser 9,1 kg (Santé Canada 2015b). Pour les nourrissons nourris au lait maternel, supposés consommer 0,632 L de lait maternel par jour (Santé Canada 2018). Pour les nourrissons nourris aux préparations pour nourrissons, supposés boire 0,764 L d’eau par jour (Santé Canada 2018), où l’eau est utilisée pour reconstituer les préparations pour nourrissons.
l Supposés peser 11,0 kg (Santé Canada 2015b), et boire 0,36 L d’eau par jour (Santé Canada 2017).
m Supposés peser 15 kg (Santé Canada 2015b), et boire 0,43 L d’eau par jour (Santé Canada 2017).
n Supposés peser 23 kg (Santé Canada 2015b), et boire 0,53 L d’eau par jour (Santé Canada 2017).
o Supposés peser 42 kg (Santé Canada 2015b) et boire 0,74 L d’eau par jour (Santé Canada 2017).
p Supposés peser 62 kg (Santé Canada 2015b), et boire 1,09 L d’eau par jour (Santé Canada 2017).
q Supposés peser 74 kg (Santé Canada 2015b), et boire 1,53 L d’eau par jour (Santé Canada 2017).
Annexe K. Concentrations d’amines aliphatiques dans les aliments
On a estimé l’exposition par voie alimentaire à l’éthylènediamine en multipliant la concentration moyenne d’éthylènediamine pour chaque catégorie d’aliments avec chaque quantité moyenne et quantité au 90e centile consommée pour toutes les personnes en une seule journée pour chaque grand groupe d’aliments de l’Enquête sur la santé dans les collectivités canadiennes (Statistique Canada 2004). On a estimé les expositions de toutes les personnes en tenant compte du nombre total de répondants à l’enquête. On a ensuite fait la somme des expositions estimatives pour chaque catégorie d’aliments pour obtenir une valeur estimative de l’exposition totale par voie alimentaire pour divers groupes d’âge. Comme les catégories d’aliments pour lesquelles il existe des données sur la présence d’éthylènediamine forment une partie régulière de l’alimentation des Canadiens, les chiffres de consommation de toutes les personnes ont été considérés comme adéquats pour l’évaluation. Les concentrations d’éthylènediamine pour les catégories d’aliments dans l’évaluation de l’exposition par voie alimentaire sont résumées dans le tableau K-1 ci-dessous.
| Catégorie d’aliment | Nombre total d’échantillons | Nombre d’échantillons positifs (%) | Plageb (µg/g) | Moyennec (µg/g) |
|---|---|---|---|---|
| Fruits | 14 775 | 2 513 (17) | 0,0049-14,1 | 0,055 |
| Produits céréaliers | 62 | 19 (31) | 0,040-2,1 | 0,096 |
| Miel | 2 645 | 55 (2) | 0,019-1,1 | 0,036 |
| Jus de fruit | 37 | 2 (5) | 0,040-0,16 | 0,043 |
| Noix | 9 | 1 (11) | 0,0080-0,065 | 0,029 |
| Légumes | 13 775 | 2 104 (15) | 0,0080-12,7 | 0,058 |
a Agence canadienne d’inspection des aliments. Programme national de surveillance des résidus chimiques. Enquêtes 2009-2018.
b La valeur minimale est le seuil de détection (SD) déclaré le plus faible.
c Les concentrations calculées où les échantillons ayant des concentrations d’éthylènediamines déclarées inférieures à leur SD ont été fixées à leur SD respectif (plage de SD : 0,004 9 à 0,08 µg/g)
| Catégorie d’aliment utilisée dans l’évaluation de l’exposition par voie alimentaire | Type d’aliment | Concentration maximale de DMA (ppm) | Aliments ayant la concentration maximale | Référence |
|---|---|---|---|---|
| Bananea | Fruits et légumes | 0,225 | Banane | Kataoka et coll. 1995 |
| Chou | Fruits et légumes | 2,8 | Chou rouge | Neurath et coll. 1977 [VCF]‡ |
| Chou-fleur et brocoli | Fruits et légumes | 14 | Chou-fleur | Neurath et coll. 1977 [VCF]‡ |
| Céleri | Fruits et légumes | 5,1 | Céleri | Neurath et coll. 1977 [VCF]‡ |
| Champignons secs | Fruits et légumes | 9,99 | Champignons secs | Kataoka et coll. 1995 |
| Ail | Fruits et légumes | 4,46 | Ail | Kataoka et coll. 1995 |
| Chou frisé | Fruits et légumes | 5,5 | Chou frisé | Neurath et coll. 1977 [VCF]‡ |
| Haricots | Fruits et légumes | 0,6 | Haricots | Neurath et coll. 1977 [VCF]‡ |
| Laitue (verdures) | Fruits et légumes | 7,2 | Salade verte | Neurath et coll.1977 [VCF]‡ |
| Oignon | Fruits et légumes | 0,46 | Oignon | Kataoka et coll. 1995 |
| Pois | Fruits et légumes | 2,2 | Pois écossés | Neurath et coll.1977 [VCF]‡ |
| Radis | Fruits et légumes | 1,1 | Radis | Neurath et coll.1977 [VCF]‡ |
| Poivron rouge | Fruits et légumes | 2,04 | Poivron rouge | Kataoka et coll. 1995 |
| Tomate | Fruits et légumes | 0,01 | Tomate fraîche | [VCF]‡ |
| Jus de tomate | Fruits et légumes | 0,01 | Tomate fraîche | [VCF]‡ |
| Bière | Boissons (non laitières) | 3,16 | Beer | Kataoka et coll. 1995 |
| Café | Boissons (non laitières) | 4 | Café | [VCF]‡ |
| Spiritueux, liqueurs et panachés | Boissons (non laitières) | 0,1 | Spiritueux et liqueurs | Pfundstein et coll. 1991 |
| Thé | Boissons (non laitières) | 0,1 | Thé | Pfundstein et coll. 1991 |
| Vin | Boissons (non laitières) | 1,2 | Vin | Kataoka et coll. 1995 |
| Fromage | Produits laitiers | 1,47 | Fromage | Kataoka et coll. 1995 |
| Lait | Produits laitiers | 6,93 | Lait de vache | Kataoka et coll. 1995 |
| Lait évaporé | Produits laitiers | 3,15 | Lait évaporé | Singer et Lijinsky 1976. [VCF]‡ |
| Autres produits laitiers | Produits laitiers | 2,6 | Produits laitiers | Pfundstein 1991 |
| Jaune d’œuf | Œuf | 5,04 | Jaune d’œuf | Kataoka et coll. 1995 |
| Œufs entiers | Œuf | 1,66 | Jaune d’œuf | Kataoka et coll. 1995 |
| Thon blanc, cru | Viandes, poissons et fruits de mer | 3,6 | Thon blanc, cru | Perez Martin et coll. 1987 [VCF]‡ |
| Anchois, en conserve | Viandes, poissons et fruits de mer | 173 | Anchois, en conserve | Lin et Lai 1980 |
| Bœuf | Viandes, poissons et fruits de mer | 1,21 | Bœuf | Kataoka et coll. 1995 |
| Thon en conserve | Viandes, poissons et fruits de mer | 23 | Thon en conserve | Singer et Lijinsky 1976 [VCF]‡ |
| Caviar | Viandes, poissons et fruits de mer | 97 | Caviar | Kataoka et coll. 1995 |
| Poulet | Viandes, poissons et fruits de mer | 3,6 | Poulet | Pfundstein et coll. 1991 |
| Morue, cuite | Viandes, poissons et fruits de mer | 19 | Morue, cuite | Singer et Lijinsky 1976 [VCF]‡ |
| Morue, séchée salée | Viandes, poissons et fruits de mer | 48,6 | Morue, salée | Kataoka et coll. 1995 |
| Morue, crue | Viandes, poissons et fruits de mer | 92 | Morue, crue | Singer et Lijinsky 1976 [VCF]‡ |
| Bacon salé | Viandes, poissons et fruits de mer | 0,2 | Bacon salé | Patterson et Mottram 1974 [VCF]‡ |
| Aiglefin | Viandes, poissons et fruits de mer | 48,8 | Aiglefin | Fernández-Salguero et Mackie 1987 [VCF]‡ |
| Merluche | Viandes, poissons et fruits de mer | 152 | Filet de merluche, cuit | Castell et coll. 1971 |
| Jambon | Viandes, poissons et fruits de mer | 3,01 | Steak de jambon | Zeisel et DaCosta 1986 |
| Hareng (cuit, mariné, salé) | Viandes, poissons et fruits de mer | 7,8 | Hareng, salé | Neurath et coll. 1977 [VCF]‡ |
| Hareng, cru | Viandes, poissons et fruits de mer | 5,6 | Hareng, cru comestible | Fernández-Salguero et DaCosta 1987 [VCF]‡ |
| Maquereau | Viandes, poissons et fruits de mer | 113,4 | Maquereau tacheté | Kataoka et coll. 1995 |
| Huître | Viandes, poissons et fruits de mer | 1,86 | Huître | Kataoka et coll. 1995 |
| Saumon | Viandes, poissons et fruits de mer | 82 | Saumon, cru | Singer et Lijinsky 1976 [VCF]‡ |
| Sardines, en conserve | Viandes, poissons et fruits de mer | 16,4 | Sardines, en conserve | Lin et Lai 1980 |
| Saucisses | Viandes, poissons et fruits de mer | 5,2 | Saucisses | Pfundstein et coll. 1991 |
| Calmar | Viandes, poissons et fruits de mer | 38,3 | Calmar, cru | Perez Martin et coll.1987 [VCF]‡ |
| Truite | Viandes, poissons et fruits de mer | 6,75 | Truite, crue | Singer et Lijinsky 1976 [VCF]‡ |
| Truite, en conserve | Viandes, poissons et fruits de mer | 24,1 | Truite, en conserve | Lin et Lai 1980 |
| Orge | Grains et légumineuses | 9,4 | Orge | [VCF]‡ |
| Pain | Grains et légumineuses | 5,3 | Pain | Pfundstein et coll. 1991 [VCF]‡ |
| Maïs | Grains et légumineuses | 3,5 | Grains de maïs | Neurath et coll. 1977 [VCF]‡ |
| Fèves de soja | Grains et légumineuses | 0,4 | Fève de soja, crue | [VCF]‡ |
| Amande | Noix | 1,76 | Amande | Kataoka et coll. 1995 |
| Cornichons | Divers | 1,4 | Concombres marinés | Neurath et coll. 1977 [VCF]‡ |
| Paprika | Divers | 1 | Paprika rouge | Neurath et coll. 1977 [VCF]‡ |
| Confiseries | Divers | 0,7 | Confiseries | Pfundstein et coll. 1991 |
| Poivre noir | Divers | 7,97 | Poivre noir | Kataoka et coll. 1995 |
| Soupes | Divers | 4,8 | Soupe | Pfundstein et coll. 1991 |
| Graisses animales | Corps gras | 3,4 | Graisses animales | Pfundstein et coll. 1991 |
| Graisses végétales | Corps gras | 0,1 | Graisses végétales | Pfundstein et coll. 1991 |
Détails de la page
- Date de modification :
