Recommandations pour les programmes de santé publique concernant l’utilisation de vaccins contre le pneumocoque chez les enfants, y compris l’utilisation des vaccins conjugués 15-valent et 20-valent
Télécharger en format PDF
(1,89 Mo, 68 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 2024-03-11
Cat. : HP5-239/1-2024F-PDF
ISBN : 978-0-660-70390-9
Pub. : 230766
Sur cette page
- Préambule
- Sommaire des renseignements contenus dans la présente déclaration du CCNI
- Introduction
- Méthodologie
- Vaccin
- Résumé des données probantes
- Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité
- Économie
- Recommandations
- Priorités en matière de recherche et de surveillance
- Liste des abréviations
- Remerciements
- Annexe : Tableaux
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) est un organisme consultatif externe qui fournit à l'Agence de la santé publique du Canada (ASPC) des conseils indépendants, continus et à jour dans le domaine de la médecine, des sciences et de la santé publique liés aux questions de l'ASPC concernant l'immunisation.
En plus de la prise en compte du fardeau associé aux maladies et des caractéristiques vaccinales, l'ASPC a élargi le mandat du CCNI de façon à lui permettre d'inclure l'étude systématique des facteurs liés aux programmes dans la formulation de ses recommandations axées sur des données probantes. Cette initiative devrait aider le CCNI à prendre des décisions en temps opportun en ce qui a trait aux programmes de vaccination à fonds publics à échelle provinciale et territoriale.
Les facteurs supplémentaires à prendre systématiquement en considération par le CCNI sont l'économie, l'éthique, l'équité, la faisabilité et l'acceptabilité. Les déclarations du CCNI ne nécessitent pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Bien qu'une étude systématique des facteurs programmatiques soit effectuée à l'aide d'outils fondés sur des données probantes pour déterminer les questions distinctes susceptibles d'avoir une incidence sur la prise de décision en vue de l'élaboration de recommandations, seules les questions distinctes considérées comme étant propres au vaccin ou à la maladie évitable par la vaccination seront prises en compte.
Cette déclaration contient les conseils et les recommandations indépendants du CCNI, qui reposent sur les meilleures connaissances scientifiques disponibles à ce jour. Ce document est diffusé à titre d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie du produit concerné. Les recommandations d'utilisation et autres renseignements figurant dans le présent document peuvent différer du contenu de la monographie des fabricants canadiens des vaccins. Les fabricants ont fait autoriser les vaccins et ont démontré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Sommaire des renseignements contenus dans la présente déclaration du CCNI
Les principaux renseignements suivants sont destinés aux vaccinateurs. Voir le reste de la déclaration pour plus de détails.
Quoi
La bactérie Streptococcus pneumoniae peut être à l'origine d'une infection invasive à pneumocoques (IIP), une maladie transmissible grave, et d'autres infections telles que la pneumonie communautaire et l'otite moyenne aiguë. Il existe actuellement plus de 100 sérotypes connus de S. pneumoniae. La majorité des infections à pneumocoque sont causées par un petit nombre de ces sérotypes.
Santé Canada a récemment autorisé 2 nouveaux vaccins contre le pneumocoque conjugués (PNEU-C) pour nourrissons, enfants et adolescents de 6 semaines à 17 ans :
- Le PNEU-C-15 (15-valent) est autorisé avec une indication pour la prévention de l'IIP causée par 15 sérotypes de S. pneumoniae.
- Le PNEU-C-20 (20-valent) est autorisé avec une indication pour la prévention de l'IIP causée par 20 sérotypes de S. pneumoniae.
Qui
L'IIP s'observe le plus souvent chez les jeunes enfants, les personnes âgées et les groupes à haut risque en raison de pathologies ou de conditions environnementales ou de vie (voir le Tableau 1). Le CCNI recommande que tous les programmes de vaccination systématique des nourrissons au Canada incluent un vaccin contre le pneumocoque conjugué.
Pour les programmes de vaccination systématique chez les enfants de moins de 5 ans qui ne présentent pas de haut risque d'IIP :
- Le CCNI recommande l'utilisation du PNEU-C-15 ou du PNEU-C-20 comme produits courants pour les enfants de moins de 5 ans dans les programmes de vaccination systématique.
Pour les enfants présentant un haut risque d'IIP en raison de pathologies ou de conditions environnementales ou de vie (Tableau 1) :
- Le CCNI recommande l'utilisation du PNEU-C-20 pour enfants et adolescents de 2 mois à moins de 18 ans qui présentent des pathologies entraînant un haut risque d'IIP. Ceux qui ont commencé leur série de vaccins contre le pneumocoque avec le PNEU-C-13 ou le PNEU-C-15 termineront leur série avec le PNEU-C-20.
- Le CCNI recommande que les enfants et adolescents de moins de 18 ans qui présentent un haut risque d'IIP en raison de pathologies ou de conditions environnementales ou de vie et qui ont terminé leur calendrier d'immunisation recommandé avec le PNEU-C-13 ou le PNEU-C-15 reçoivent une (1) dose de rattrapage (supplémentaire) de PNEU-C-20.
- Le CCNI recommande que le PNEU-C-20 soit proposé aux enfants et adolescents de moins de 18 ans ayant reçu une greffe de cellules souches hématopoïétiques (GCSH) après consultation de leur spécialiste de la transplantation.
Pour des renseignements supplémentaires, y compris les données probantes à l'appui et la justification de ces recommandations, voir la Recommandations.
Tableau 1 : Pathologies à risque entraînant un haut risque d'IIP
Pathologies à risque
- Fuite chronique de liquide céphalorachidien (LCR)
- Implants cochléaires, y compris les personnes devant recevoir des implants. Le risque le plus élevé se situe dans les semaines qui suivent l'implantation. Il est préférable d'administrer le vaccin avant l'implantation, mais l'opération ne doit pas être retardée pour cette raison. Administrer le vaccin dès que possible.
- Néphropathie chronique, en particulier les personnes atteintes du syndrome néphrotique, sous dialyse ou ayant subi une transplantation rénale
- Maladie hépatique chronique, y compris la cirrhose hépatique et l'atrésie des voies biliaires
- Affection neurologique chronique susceptible d'entraver l'évacuation des sécrétions orales
- Asplénie fonctionnelle ou anatomique (y compris drépanocytose et autres hémoglobinopathies, asplénie congénitale ou acquise, ou dysfonctionnement splénique)
- Diabète sucré
- Maladie cardiaque chronique (y compris les maladies cardiaques congénitales et les maladies cardiaques cyanogènes)
- Maladie pulmonaire chronique, y compris l'asthme nécessitant des soins médicaux aigus au cours des 12 mois précédents
- Déficit immunitaire congénital de tout type, y compris l'immunité humorale des lymphocytes B, l'immunité à médiation cellulaire des lymphocytes T, le système du complément (déficit en properdine ou en facteur D)
- Traitement immunodépresseur, y compris l'usage prolongé de corticostéroïdes, de chimiothérapie, de radiothérapie et de traitements postérieurs à une greffe d'organe
- Infection par le virus de l'immunodéficience humaine (VIH)
- Greffe de cellules souches hématopoïétiques (receveur)* voir recommandation distincte
- Néoplasmes malins, y compris leucémie et lymphome
- Transplantation d'organes solides
Conditions environnementales ou de vie des personnes
- qui vivent dans des communautés ou des milieux connaissant des taux élevés et durables d'IIP
- qui sont mal logées ou en situation d'itinérance
- qui sont placées en institution pour enfants ayant des besoins médicaux complexes
Comment
Le PNEU-C-15 et le PNEU-C-20 sont administrés par voie intramusculaire à l'aide d'une seringue préremplie à dose unique. Une (1) dose unique de PNEU-C-15 et PNEU-C-20 contient 0,5 ml.
Le PNEU-C-15 et le PNEU-C-20 sont administrés selon un calendrier à 3 doses (2+1) à l'âge de 2 mois, 4 mois et 12 mois ou d'un calendrier à 4 doses (3+1) à l'âge de 2 mois, 4 mois et 6 mois, suivi d'une (1) dose à l'âge de 12 à 15 mois. Pour des renseignements supplémentaires sur les calendriers de vaccination, y compris pour les enfants présentant un haut risque d'IIP et en fonction des antécédents vaccinaux, voir le chapitre sur les vaccins contre le pneumocoque du Guide canadien d'immunisation et les Recommandations (Tableau 7).
Les contre-indications à l'administration du PNEU-C-15 ou du PNEU-C-20 comprennent l'hypersensibilité (p. ex., l'anaphylaxie) au vaccin ou à l'un (1) de ses composants. Les vaccins contre le pneumocoque peuvent être administrés en même temps que d'autres vaccins, à l'exception d'une autre formulation du vaccin contre le pneumocoque (p. ex., ne pas administrer de façon concomitante un conjugué et un polysaccharidique).
Pourquoi
Les maladies pneumococciques peuvent entraîner des complications durables, ainsi qu'une morbidité et une mortalité importantes, en particulier chez les jeunes enfants et autres enfants présentant un haut risque d'IIP. La vaccination est le moyen le plus efficace de prévenir ces infections. Le PNEU-C-15 et le PNEU-C-20 sont conçus pour prévenir l'infection par un plus grand nombre de sérotypes que les vaccins contre le pneumocoque précédents.
Introduction
Objectif des directives
L'autorisation de nouvelles indications pédiatriques pour 2 vaccins contre le pneumocoque conjugués (PNEU-C) a rendu nécessaire la mise à jour des directives du Comité consultatif national de l'immunisation (CCNI) sur le programme de vaccination contre le pneumocoque pédiatrique. Le 8 juillet 2022, Santé Canada a autorisé l'utilisation d'un vaccin contre le pneumocoque conjugué 15-valent (PNEU-C-15, VaxneuvanceMD) pour l'immunisation active des enfant de 6 semaines à 17 ans en vue de la prévention des infections invasives à pneumocoques (IIP) causées par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F de la bactérie Streptococcus pneumoniae. Le 21 juillet 2023, Santé Canada a autorisé l'utilisation d'un vaccin contre le pneumocoque conjugué 20-valent (PNEU-C-20, Prevnar 20MC) pour la prévention de l'IIP causée par les sérotypes 1, 3, 4, 5, 6A, 6B, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de S. pneumoniae chez les enfants de 6 semaines à 17 ans.
Note : Aux fins du présent document, le terme « enfants » désigne les nourrissons, les enfants et les adolescents de moins de 18 ans.
Le 4 octobre 2022, le CCNI a publié des directives provisoires sur l'utilisation du vaccin PNEU-C-15, recommandant qu'il puisse être utilisé de manière interchangeable avec le PNEU-C-13 chez les enfants de 6 semaines à 17 ans. Par suite de l'approbation de l'utilisation du PNEU-C-20 chez les enfants, les provinces et les territoires ont demandé des conseils supplémentaires sur l'utilisation de ces vaccins dans les programmes d'immunisation pédiatrique systématique au Canada.
Les principaux objectifs de cette déclaration sont les suivants :
- Examiner les données probantes sur les avantages potentiels (immunogénicité), les risques (immunité), l'impact modélisé et le rapport coût/efficacité des programmes de vaccination contre le pneumocoque pédiatrique utilisant le PNEU-C-15 ou le PNEU-C-20 sur la réduction du fardeau de cette maladie au Canada.
- Fournir des recommandations pour l'utilisation des vaccins PNEU-C-15 et PNEU-C-20 dans les programmes pédiatriques systématiques au Canada et pour les enfants présentant un haut risque d'IIP.
Contexte des vaccins contre le pneumocoque, des programmes de vaccination et des recommandations pour les enfants au Canada
Au Canada, les programmes de vaccination systématique des nourrissons contre les maladies infectieuses comprennent l'utilisation des vaccins PNEU-C, administrés selon un calendrier de 3 doses (2+1) à l'âge de 2 mois, 4 mois et 12 mois ou d'un calendrier de 4 doses (3+1) à l'âge de 2 mois, 4 mois et 6 mois, suivi d'une (1) dose à l'âge de 12 à 15 mois. Le calendrier à 4 doses du vaccin PNEU-C-13, ainsi qu'une (1) dose du vaccin PNEU-P-23 à l'âge de 24 mois, au moins 8 semaines après le vaccin PNEU-C-13, a déjà été recommandé aux nourrissons présentant un haut risque d'IIP en raison d'une affection médicale sous-jacente, afin d'accroître la protection contre d'autres sérotypes de S. pneumoniae non présents dans le PNEU-C-13. Il a également été recommandé aux enfants présentant certaines pathologies de recevoir une (1) dose de rappel supplémentaire du vaccin PNEU-P-23 au moins 5 ans après toute dose précédente du vaccin PNEU-P-23.
En 2021, on estime que 85,1 % (intervalle de confiance [IC] à 95 % : 83,1 % à 87,0 %) des enfants de 2 ans au Canada ont reçu au moins 3 doses du vaccin contre le pneumocoqueNote de bas de page 1. L'objectif national actuel de couverture vaccinale d'ici 2025 est d'immuniser 95 % des enfants de 2 ans avec au moins 3 doses du vaccin contre le pneumocoque recommandéNote de bas de page 2.
Méthodologie
En bref, voici les étapes de la préparation d'une déclaration du CCNI :
- Synthèse des connaissances : récupération et résumé des études individuelles, évaluation du risque de biais (RB) des études incluses
- Sommaire des données probantes sur les vaccins : avantages (p. ex. : immunogénicité, profils d'efficacité potentielle [EP] et d'efficacité réelle [ER] par rapport aux vaccins existants) et préjudices potentiels (innocuité par rapport aux vaccins existants), compte tenu du degré de certitude des données probantes synthétisées et, le cas échéant, de l'ampleur des effets observés dans l'ensemble des études
- Évaluation systématique des considérations liées à l'éthique, à l'équité, à la faisabilité et à l'acceptabilité (EEFA) du programme
- Évaluation économique, y compris un examen systématique des évaluations économiques et de la modélisation économique
- Utilisation de toutes les données probantes à jour pour éclairer les recommandations
Le CCNI a examiné les données disponibles sur l'immunogénicité et l'innocuité du PNEU-C-15 et du PNEU-C-20, le fardeau du pneumocoque, le rapport coût/efficacité et les considérations relatives à l'EEFA lors de réunions tenues les 12 juin, 7 juillet et 27 septembre 2023. Par suite de ces discussions, il a examiné des données probantes supplémentaires sur le risque d'IIP chez les enfants présentant des facteurs de risque le 16 novembre 2023. Les recommandations sur l'utilisation des vaccins contre le pneumocoque dans les populations pédiatriques ont été approuvées le 5 décembre 2023.
Des renseignements supplémentaires sur le processus et les procédures du CCNI sont disponibles ailleursNote de bas de page 3. Des recommandations complètes du CCNI concernant l'utilisation des vaccins contre le pneumocoque au Canada figurent dans le chapitre sur les vaccins contre le pneumocoque du Guide canadien d'immunisation (GCI).
Fardeau de l'infection invasive à pneumocoque
Au Canada, l'IIP est une maladie à déclaration obligatoire au Système canadien de surveillance des maladies à déclaration obligatoire (SCSMDO) depuis 2000, toutes les administrations provinciales et territoriales signalant les cas correspondant à la définition nationale de cas. Pour la présente déclaration, les données de la liste d'attente du SCSMDO utilisées pour évaluer le fardeau de l'IIP dans les différents groupes d'âge pédiatriques provenaient des 10 provinces et du programme de Surveillance circumpolaire internationale (SCI) pour les 3 territoires. Outre les territoires, les régions du Canada prises en compte dans le programme SCI comprennent également le Nord du Labrador et le Nord du Québec. L'incidence de l'IIP dans ces régions a été comparée à celle des autres provinces et territoires au moyen des données agrégées du SCSMDO. Tous les cas ont été présumés répondre à la définition nationale de cas d'IIP. De plus amples renseignements sur les données du SCSMDO sont disponibles sur le site Web des maladies à déclaration obligatoire en direct, y compris les limitations des données du SCSMDO.
Le Laboratoire national de microbiologie (LNM) collabore avec les laboratoires de santé publique pour effectuer une surveillance passive en laboratoire de l'IIP au Canada et publie des rapports réguliersNote de bas de page 4. Tous les isolats d'IIP provenant des laboratoires de santé publique sont sérotypés par le LNM, bien que la collecte d'échantillons puisse être limitée par des normes régionales variables, la nature préliminaire de certaines données et la disponibilité d'isolats bactériens aux fins d'analyse. Les données sur les sérotypes peuvent également être biaisées par une surreprésentation des sérotypes les plus virulents pour lesquels un traitement médical est recherché, et des échantillons cliniques sont prélevés. Des données sur la répartition des sérotypes sont fournies pour 80 à 98 % de tous les cas d'IIP signalés au SCSMDO.
Pour la déclaration des sérotypes dans cette déclaration, le sérotype 6C a été inclus avec les sérotypes du PNEU-C-13 en raison de la protection croisée avec le 6A. Les sérotypes 15B et 15C ont été regroupés sous l'appellation 15B/C en raison du passage réversible entre les 2 types de sérotypes rapportés in vivo au cours de l'infection, ce qui rend difficile la différenciation précise des 2 types.
Des renseignements supplémentaires sur les complications de l'infection à pneumocoque ont été recueillis par le biais du réseau de surveillance pédiatrique en milieu hospitalier IMPACT (Immunization Monitoring Program, ACTive), qui couvre 90 % des lits pédiatriques de soins tertiaires au Canada.
données spécifiques sont actuellement disponibles au Canada sur l'infection à pneumocoque chez les enfants présentant des affections médicales à risque. Le CCNI a examiné les données sur la maladie dans cette population en se basant sur les données d'une étude récente menée pour orienter l'Advisory Committee on Immunization Practices des États-Unis (É.-U.)Note de bas de page 5.
Revue de la littérature des études sur le PNEU-C-15 et le PNEU-C-20
La question de recherche primordiale à l'appui de l'examen des données probantes est la suivante. Quelles sont l'EP, l'ER, l'immunogénicité et l'innocuité du PNEU-C-15 et du PNEU-C-20 par rapport au PNEU-C-13, lorsqu'ils sont utilisés pour réduire le risque d'IIP chez les enfants de moins de 18 ans?
Population : Enfants de 6 semaines à moins de 18 ans, présentant ou non des facteurs de risque supplémentaires d'IIP (Tableau 1), qui n'ont jamais été vaccinés, dont la série de vaccins est incomplète ou qui ont terminé leur série de vaccins (pour les doses de rattrapage ou additionnelles).
Intervention : Le PNEU-C-15 ou le PNEU-C-20 (seul ou en série mixte).
Comparateur : Calendrier de vaccination contre le pneumocoque adapté à l'âge et aux facteurs de risque actuellement recommandé.
Résultats : Mortalité attribuable aux sérotypes de S. pneumoniae inclus dans le vaccin (c.-à-d. le sérotype du vaccin), IIP attribuable aux sérotypes du vaccin, otite moyenne aiguë (OMA) ou pneumonie extrahospitalière (PEH) à pneumocoque attribuable aux sérotypes du vaccin, et événements indésirables graves (ÉIG) suivant l'administration du vaccin.
Les données sur l'EP, l'ER et l'innocuité n'ayant pas été publiées au moment de l'examen initial des données probantes, le CCNI a évalué les données sur l'innocuité et l'immunogénicité dans la soumission réglementaire à Santé Canada ou présentées au CCNI par le fabricant.
Les points de données sur l'immunogénicité qui ont été examinés par le CCNI comprenaient la moyenne géométrique des titres (MGT) de l'activité opsonophagocytaires (AOP), les concentrations moyennes géométriques (CMG) d'IgG et le pourcentage de sérorépondeurs (définis selon la norme de l'Organisation mondiale de la santé, soit une augmentation d'au moins 4 fois des rapports CMG/MGT avant la vaccination, soit des valeurs CMG de 0,35 µg/mL ou plus)Note de bas de page 6. Les données ont été extraites des études admissibles concernant le plan de l'étude, la population, l'intervention, le comparateur et les résultats d'intérêt. Le RB de chaque étude a été évalué à l'aide du Cochrane Risk of Bias Tool. Le cadre GRADE (Grading of Recommendations, Assessment, Development and Evaluations) a été utilisé pour évaluer la certitude des données probantes, lorsque cela était possible, en fonction de la disponibilité des données sur les résultats. Les résultats d'immunogénicité (ratios/différences) avec le PNEU-C-15 ou le PNEU-C-20 par rapport au PNEU-C-13 ont été considérés comme numériquement inférieurs ou supérieurs lorsque toutes les valeurs de l'IC dans toutes les études étaient, respectivement, de moins de 1,00 ou de plus de 1,00. Les sérotypes pour lesquels ces valeurs n'ont pu être déterminées étaient ceux pour lesquels les IC étaient non inclusifs (c.-à-d. compris dans 1,00) ou ceux pour lesquels les résultats étaient divergents d'une étude à l'autre. Les tableaux de données GRADE pour les études analysées sont disponibles à l'Annexe A.
Revue de la littérature sur le rapport coût/efficacité du PNEU-C-15 et du PNEU-C-20
Un examen systématique du rapport coût/efficacité des vaccins PNEU-C-15 et PNEU-C-20 pour prévenir l'IIP chez les nourrissons et les enfants a inclus des études publiées d'évaluations économiques menées dans des populations âgées de moins de 18 ans, comparant les vaccins actuellement utilisés pour prévenir l'IIP avec le PNEU-C-15 ou le PNEU-C-20 et des mesures de résultats économiques (coût différentiel par année de vie ajustée par la qualité [AVAQ], coût par année de vie, etc.). Une recherche systématique d'études en anglais et en français a été effectuée dans 6 bases de données électroniques : Embase, Ovid Medline, International Pharmaceutical Abstracts, EBM Reviews, SCOPUS et Econlit. La recherche a été limitée aux documents publiés entre le 1er janvier 2018 et le 7 mars 2023. Tous les coûts ont été ajustés en dollars canadiens de 2022 et sont présentés comme tels. Des détails supplémentaires sur la revue de la littérature économique sont fournis dans un résumé supplémentaire des données probantes économiques.
Analyse coût/utilité du CCNI
Une analyse coût/utilité fondée sur un modèle a été réalisée des points de vue du système de santé et de la société. Un modèle de cohorte statique multi-âge a été utilisé pour comparer les avantages (en AVAQ) et les coûts (en dollars canadiens de 2022) associés à l'utilisation du PNEU-C-15 ou du PNEU-C-20 par rapport au PNEU-C-13 chez les nourrissons non vaccinés et admissibles à la vaccination systématique contre le pneumocoque. L'analyse a utilisé un horizon de 10 ans et un taux d'actualisation de 1,5 % des coûts et des conséquences de l'infection à pneumocoque sur l'ensemble de la vie, et tous les coûts ont été ajustés en dollars canadiens de 2022. Les détails de l'analyse coût/utilité sont présentés dans un résumé supplémentaire des données probantes économiques.
Vaccin
Il existe actuellement au Canada 5 vaccins dont l'utilisation est autorisée chez les enfants de moins de 18 ans :
- PNEU-P-23 (PneumovaxMD 23) est une solution stérile de 23 polysaccharides capsulaires hautement purifiésNote de bas de page 7.
- PNEU-C-10 (SynflorixMD) est une suspension stérile de saccharides des antigènes capsulaires de 10 sérotypes de S. pneumoniae conjugués à la protéine D de l'Haemophilus influenza non typable, à l'anatoxine diphtérique ou tétaniqueNote de bas de page 8.
- PNEU-C-13 (PrevnarMD 13) est une solution stérile d'antigène capsulaire polysaccharidique de 13 sérotypes de S. pneumoniae. Chaque antigène est conjugué séparément à une protéine diphtérique porteuse Corynebacterium diphtheriae (CRM)197Note de bas de page 9.
- PNEU-C-15 (VaxneuvanceMD) est une suspension stérile de polysaccharides capsulaires purifiés provenant de 15 sérotypes de S. pneumoniae. Chaque antigène est conjugué séparément à une protéine diphtérique porteuse CRM197Note de bas de page 10.
- PNEU-C-20 (Prevnar 20MC) est une suspension stérile de saccharides des antigènes capsulaires de 20 sérotypes de S. pneumoniae. Chaque antigène est conjugué séparément à une protéine diphtérique CRM197Note de bas de page 11.
Des renseignements supplémentaires sur la composition de ces vaccins sont disponibles dans le Tableau 2.
| Nom du vaccin | PNEUMOVAXMD 23 (PNEU-P-23) |
SYNFLORIXMD (PNEU-C-10) |
PREVNARMD13 (PNEU-C-13) |
VAXNEUVANCEMD (PNEU-C-15) |
PREVNAR 20MC (PNEU-C-20) |
|---|---|---|---|---|---|
| Fabricant | Merck | GSK | Pfizer | Merck | Pfizer |
Date de l'autorisation initiale au Canada/âge pédiatrique de l'autorisation |
23 décembre 1983/ |
11 décembre 2008/ |
21 décembre 2009/ |
8 juillet 2022/ |
9 mai 2022 (adultes) |
| Type vaccinal | Polysaccharide | Conjugué | Conjugué | Conjugué | Conjugué |
| Composition du vaccin | 25 µg de polysaccharides capsulaires de chacun dessérotypes 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F et 33F de S. pneumoniae, chlorure de sodium 0,9 % p/p, phénol 0,25 % p/p et eau pour injection. | 1 mcg de chaque saccharide pour les sérotypes 1, 5, 6B, 7F, 9V, 14 et 23F de S. pneumoniae, et 3 mcg de saccharide pour les sérotypes 4, 18C et 19F, Haemophilus influenzae non typable |
2,2 mcg de chaque saccharide pour les sérotypes 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F et 23F de S. pneumoniae, 4,4 mcg de saccharide pour le sérotype 6B, 34 mcg de protéine porteuse CRM197, 4,25 mg de chlorure de sodium, 100 mcg de polysorbate 80, 295 mcg d'acide succinique et 125 mcg d'aluminium de phosphate d'aluminium à titre d'adjuvant et eau pour injection. |
32 mcg de polysaccharide pneumococcique total (2,0 mcg de chacun des polysaccharides de sérotype 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F, 22F, 23F et 33F, et 4,0 mcg de polysaccharide de sérotype 6B) conjugué à 30 mcg de protéine porteuse CRM197, 125 mcg d'aluminium (phosphate d'aluminium à titre d'adjuvant), 20 mM de L-histidine, 1 mg de polysorbate 20,150 mM de chlorure de sodium et eau pour injection. |
2,2 mcg de chacun des sérotypes 1, 3, 4, 5, 6A, 7F, 8, 9V, 10A, 11A, 12F, 14, 15B, 18C, 19A, 19F, 22F, 23F et 33F de S. pneumoniae, 4,4 mcg de saccharide 6B, 51 mcg de protéine porteuse CRM197, 100 mcg de polysorbate 80, 295 mcg d'acide succinique, 4,4 mg de chlorure de sodium et 125 mcg d'aluminium de phosphate d'aluminium à titre d'adjuvant et eau pour injection. |
| Voie d'administration | Injection intramusculaire ou sous-cutanée | Injection intramusculaire | Injection intramusculaire | Injection intramusculaire | Injection intramusculaire |
| Conditions d'entreposage | Flacon multidose. Réfrigérer entre 2 °C et 8 °C. Jeter le flacon ouvert après 48 heures. |
Seringue préremplie à dose unique. Réfrigérer entre 2 °C et 8 °C. Ne pas congeler. Conserver dans l'emballage d'origine. | Seringue préremplie à dose unique. Réfrigérer entre 2 °C et 8 °C. Ne pas congeler. Conserver dans l'emballage d'origine. | Seringue préremplie à dose unique. Réfrigérer entre 2 °C et 8 °C. Ne pas congeler. Protéger de la lumière. Administrer dès que possible après la sortie du réfrigérateur. | Seringue préremplie à dose unique. Réfrigérer entre 2 °C et 8 °C. Ne pas congeler. Conserver horizontalement dans l'emballage d'origine. |
Le Tableau 3 présente une comparaison des sérotypes inclus dans les formulations vaccinales actuellement autorisées.
| Vaccin | Sérotypes dans les vaccins contre la pneumocoque | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 4 | 6B | 9V | 14 | 18C | 19F | 23F | 5 | 7F | 3 | 6A | 19A | 22F | 33F | 8 | 10A | 11A | 12F | 15B | 2 | 9N | 17F | 20 | |
| PNEU-C-10 | O | O | O | O | O | O | O | O | O | O | N | N | N | N | N | N | N | N | N | N | N | N | N | N |
| PNEU-C-13 | O | O | O | O | O | O | O | O | O | O | O | O | O | N | N | N | N | N | N | N | N | N | N | N |
| PNEU-C-15 | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | N | N | N | N | N | N | N | N | N |
| PNEU-C-20 | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | O | N | N | N | N |
| PNEU-C-23 | O | O | O | O | O | O | O | O | O | O | O | N | O | O | O | O | O | O | O | O | O | O | O | O |
| Abréviations : O : Oui; N : Non | ||||||||||||||||||||||||
Résumé des données probantes
Fardeau de l'infection
Taux d'incidence de l'IIP par groupe d'âge
Par suite de la mise en œuvre des programmes PNEU-C au Canada, entre 2001 et 2021, une réduction d'environ 65 % de l'incidence globale de l'IIP chez les enfants de moins de 5 ans a été observée. Bien que le vaccin PNEU-C-7 ait eu l'impact le plus important sur l'incidence de l'IIP dans le groupe des moins de 5 ans, de nouvelles diminutions dans ce groupe d'âge ont été observées avec le passage au PNEU-C-13 en 2010. Depuis 2015, lorsque le taux d'incidence (TI) de l'IIP chez les enfants de moins de 5 ans a atteint 10,7 (IC à 95 % : 9,3 à 12,2 %) cas pour 100 000 habitants, l'IIP dans ce groupe d'âge est restée stable, à l'exception d'une diminution du TI en 2020 (TI : 6,1, IC à 95 % : 5,0 à 7,3 %) au cours de la première année de la pandémie de COVID-19. En revanche, depuis l'introduction des programmes PNEU-C, l'incidence de l'IIP chez les personnes de 5 à 19 ans est restée faible et relativement stable (Figure 1). Entre 2014 et 2021, 214 cas d'IIP ont été signalés en moyenne chaque année chez les enfants de moins de 5 ans (164 cas par an dans la tranche d'âge de 1 à 4 ans), et 108 cas par an dans la tranche d'âge de 5 à 19 ans.
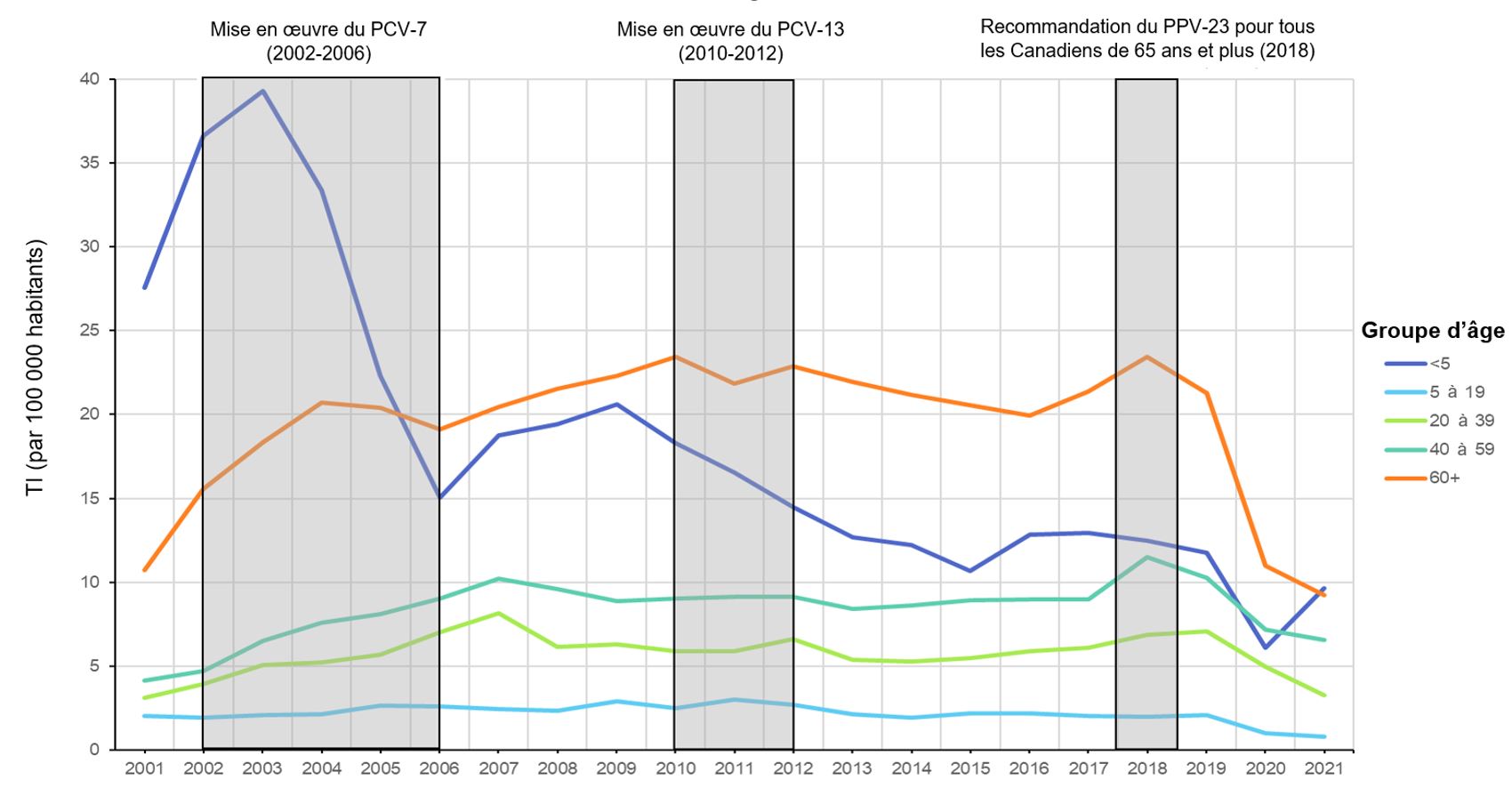
Figure 1 : Équivalent textuel
Un graphique linéaire affichant le taux d'incidence de la maladie pneumococcique invasive chaque année de 2001 à 2021, pour différents groupes d'âge, y compris moins de 5 ans, de 5 à 19 ans, de 20 à 39 ans, de 40 à 59 ans et 60 ans et plus, en mettant en évidence les dates de mise en œuvre du Pneu-C-7, du Pneu-C-13 et du Pneu-P-23 au Canada.
| Année | Moins de 1 | 1 à 4 | 5 à 9 | 10 à 14 | 15 à 19 | 20 à 24 | 25 à 29 | 30 à 39 | 40 à 59 | 60 et plus |
|---|---|---|---|---|---|---|---|---|---|---|
| 2001 | 37,8 | 25,2 | 3,6 | 1,1 | 1,5 | 1,6 | 1,8 | 2,5 | 4,1 | 10,8 |
| 2002 | 50,0 | 33,5 | 3,2 | 1,6 | 1,2 | 1,6 | 2,1 | 3,5 | 4,7 | 15,6 |
| 2003 | 54,5 | 35,6 | 4,4 | 1,2 | 1,0 | 1,4 | 3,0 | 4,7 | 6,5 | 18,3 |
| 2004 | 42,9 | 31,0 | 4,3 | 1,2 | 1,3 | 1,6 | 2,8 | 4,9 | 7,6 | 20,7 |
| 2005 | 25,9 | 21,4 | 5,3 | 1,8 | 1,3 | 2,6 | 3,2 | 5,0 | 8,1 | 20,4 |
| 2006 | 20,3 | 13,7 | 4,6 | 1,8 | 1,8 | 2,0 | 3,8 | 6,8 | 9,0 | 19,1 |
| 2007 | 30,3 | 15,8 | 3,4 | 1,9 | 2,1 | 3,4 | 4,5 | 7,1 | 10,2 | 20,5 |
| 2008 | 29,8 | 16,7 | 4,6 | 1,4 | 1,4 | 2,7 | 3,5 | 5,2 | 9,6 | 21,6 |
| 2009 | 27,8 | 18,7 | 5,8 | 1,6 | 1,8 | 2,4 | 3,5 | 5,5 | 8,9 | 22,3 |
| 2010 | 25,1 | 16,5 | 4,8 | 1,8 | 1,3 | 1,9 | 3,1 | 5,2 | 9,0 | 23,4 |
| 2011 | 20,7 | 15,5 | 5,3 | 2,5 | 1,7 | 1,4 | 3,1 | 5,4 | 9,2 | 21,8 |
| 2012 | 18,3 | 13,6 | 4,3 | 2,5 | 1,6 | 2,5 | 4,0 | 5,1 | 9,2 | 22,9 |
| 2013 | 18,7 | 11,2 | 3,8 | 1,5 | 1,3 | 1,5 | 2,8 | 4,6 | 8,4 | 21,9 |
| 2014 | 17,6 | 10,9 | 3,7 | 1,1 | 1,0 | 1,7 | 2,6 | 4,4 | 8,6 | 21,2 |
| 2015 | 14,4 | 9,8 | 3,9 | 1,2 | 1,5 | 1,9 | 2,8 | 4,5 | 8,9 | 20,6 |
| 2016 | 15,7 | 12,1 | 3,6 | 1,3 | 1,7 | 2,3 | 2,6 | 4,8 | 9,0 | 20,0 |
| 2017 | 15,6 | 12,3 | 3,5 | 1,2 | 1,4 | 1,5 | 2,8 | 5,3 | 9,0 | 21,4 |
| 2018 | 12,0 | 12,6 | 3,7 | 1,2 | 1,2 | 1,6 | 3,6 | 5,7 | 11,5 | 23,4 |
| 2019 | 13,4 | 11,3 | 3,8 | 1,2 | 1,3 | 2,1 | 2,8 | 6,0 | 10,3 | 21,3 |
| 2020 | 6,0 | 6,1 | 1,7 | 0,5 | 0,8 | 1,5 | 2,5 | 3,9 | 7,2 | 11,0 |
| 2021 | 10,3 | 9,5 | 1,5 | 0,4 | 0,6 | 2,0 | 2,5 | 4,2 | 6,6 | 9,3 |
Source de données : SCSMDO
Taux d'incidence de l'IIP par région géographique
Des différences dans les TI de l'IIP sont également observées sur le plan géographique. Comparés à ceux rapportés pour le reste du Canada, les TI de l'IIP dans le Nord du Canada ont été plus élevés dans tous les groupes d'âge, et en particulier chez les enfants de moins de (1) an (rapport des TI de 5,9 [IC à 95 % : 4,7 à 7,5 %]). En dehors du Nord du Canada, le TI pour les groupes de 5 à 19 ans est resté constamment inférieur à 5 cas pour 100 000 habitants entre 2001 et 2021 (Tableau 4).
| Groupe d'âge (années) | TI Nord du Canada | TI Reste du Canada | RTI (IC à 95 %) |
|---|---|---|---|
| Inférieur à 1 | 133,0 | 22,6 | 5,9 (4,7-7,5) |
| 1-4 | 36,7 | 16,0 | 2,3 (1,8-2,9) |
| 5-9 | 10,9 | 3,9 | 2,8 (1,9-4,0) |
| 10-14 | 2,8 | 1,4 | 1,9 (0,9-4,1)Note de bas de page b |
| 15-19 | 6,1 | 1,4 | 4,4 (2,6-7,3) |
|
|||
Déclaration de l'IIP en fonction des sérotypes de vaccins
En excluant une légère augmentation en 2022, le nombre d'isolats causés par les sérotypes du vaccin PNEU-C-7 est resté relativement stable après l'introduction du PNEU-C-13 dans les programmes pédiatriques systématiques, malgré les CMG d'IgG inférieures d'environ 25 % qui ont été rapportées dans les essais cliniques PNEU-C-7/PNEU-C-13 pour les antigènes partagés (bien que le pourcentage de sérorépondeurs ait été semblable) [Figure 2]Note de bas de page 9.

Figure 2 : Équivalent textuel
Un graphique linéaire affichant le nombre d'isolats de Streptococcus pneumoniae collectés chaque année de 2011 à 2022, pour les sérotypes Pneu-C-7 et les sérotypes Pneu-C-13/non-Pneu-C-7.
| Année | Nombre d'isolats de : | |
|---|---|---|
| Sérotypes Pneu-C-7 | Sérotypes Pneu-C-13/non-Pneu-C-7 | |
| 2011 | 15 | 281 |
| 2012 | 14 | 182 |
| 2013 | 14 | 107 |
| 2014 | 8 | 75 |
| 2015 | 10 | 80 |
| 2016 | 18 | 75 |
| 2017 | 18 | 68 |
| 2018 | 15 | 65 |
| 2019 | 27 | 59 |
| 2020 | 12 | 38 |
| 2021 | 22 | 39 |
| 2022 | 48 | 85 |
Source de données : Surveillance nationale en laboratoire de la DPI au Canada (eSTREP); Laboratoire national de microbiologie. Données préliminaires pour 2021 et 2022.
Par suite de l'introduction du vaccin PNEU-C-13 dans les programmes de vaccination pédiatrique systématique, on observe une tendance générale à la baisse de la proportion d'isolats d'IIP pédiatriques dus à des sérotypes vaccinaux, passant d'environ 58 % en 2011 à 31 % en 2022. Cependant, la proportion de sérotypes vaccinaux non PNEU-C-13 a augmenté entre 2011 et 2022. Chez les enfants de moins de 18 ans, les augmentations les plus importantes des sérotypes vaccinaux ont été observées pour les sérotypes PNEU-C-20/non PNEU-C-15 (de 15,1 % à 22,8 %), suivis par les sérotypes PNEU-C-15/non PNEU-C-13 (de 8,3 % à 14,9 %) et les sérotypes PNEU-P-23/non PNEU-C-20 (de 1,8 % à 4,4 %). La proportion d'isolats d'IIP causés par des sérotypes de type non vaccinal (TNV) a augmenté d'environ 17 à 28 %. La Figure 3 fournit des données par groupe d'âge.

Figure 3 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres sérotypes non vaccinaux) en 2011 comparé à 2022, pour différents groupes d'âge pédiatriques : <2 ans, 2-4 ans et 5-17 ans.
| Groupe d'âge | Année | Vaccin (%, N) | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-15/ non-PNEU-C-13 |
PNEU-C-20/ non-PNEU-C-15 |
PNEU-P-23/ non-PNEU-C-20 |
TNV | ||||||||
| Moins de 2 ans | 2011 | 46,8% | (89) | 7,9% | (15) | 17,9% | (34) | 2,6% | (5) | 24,7% | (47) | 190 |
| 2022 | 24,2% | (39) | 13,0% | (21) | 24,2% | (39) | 6,2% | (10) | 32,3% | (52) | 161 | |
| 2 à 4 ans | 2011 | 70,6% | (108) | 11,8% | (18) | 9,2% | (14) | 0,7% | (1) | 7,8% | (12) | 153 |
| 2022 | 28,2% | (33) | 16,2% | (19) | 22,2% | (26) | 2,6% | (3) | 30,8% | (36) | 117 | |
| 5 à 17 ans | 2011 | 59,6% | (99) | 5,4% | (9) | 17,5% | (29) | 1,8% | (3) | 15,7% | (26) | 166 |
| 2022 | 40,1% | (61) | 15,8% | (24) | 21,7% | (33) | 2,0% | (3) | 20,4% | (31) | 154 | |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
Chez les enfants de moins de 2 ans, hormis une légère augmentation des isolats de sérotype 19F et 19A, on observe une diminution globale de la proportion d'isolats causés par les sérotypes PNEU-C-13 de 2011 à 2014, après quoi la proportion s'est stabilisée (Figure 4).

Figure 4 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres sérotypes non vaccinaux), pour les enfants de moins de 2 ans de 2011 à 2022.
| Année | Vaccin (%, N) | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-15/ non-PNEU-C-13 |
PNEU-C-20/ non-PNEU-C-15 |
PNEU-P-23/ non-PNEU-C-20 |
TNV | |||||||
| 2011 | 46,8% | (89) | 7,9% | (15) | 17,9% | (34) | 2,6% | (5) | 24,7% | (47) | 190 |
| 2012 | 37,5% | (60) | 13,1% | (21) | 23,1% | (37) | 1,9% | (3) | 24,4% | (39) | 160 |
| 2013 | 19,8% | (34) | 24,4% | (42) | 24,4% | (42) | 1,7% | (3) | 29,7% | (51) | 172 |
| 2014 | 6,8% | (10) | 21,6% | (32) | 32,4% | (48) | 7,4% | (11) | 31,8% | (47) | 148 |
| 2015 | 15,4% | (22) | 25,2% | (36) | 23,1% | (33) | 2,8% | (4) | 33,6% | (48) | 143 |
| 2016 | 20,7% | (34) | 18,9% | (31) | 29,9% | (49) | 1,8% | (3) | 28,7% | (47) | 164 |
| 2017 | 11,9% | (18) | 22,5% | (34) | 27,8% | (42) | 8,6% | (13) | 29,1% | (44) | 151 |
| 2018 | 13,2% | (15) | 16,7% | (19) | 32,5% | (37) | 4,4% | (5) | 33,3% | (38) | 114 |
| 2019 | 16,8% | (23) | 20,4% | (28) | 19,0% | (26) | 5,8% | (8) | 38,0% | (52) | 137 |
| 2020 | 25,9% | (22) | 16,5% | (14) | 28,2% | (24) | 5,9% | (5) | 23,5% | (20) | 85 |
| 2021 | 31,1% | (37) | 15,1% | (18) | 21,0% | (25) | 4,2% | (5) | 28,6% | (34) | 119 |
| 2022 | 24,2% | (39) | 13,0% | (21) | 24,2% | (39) | 6,2% | (10) | 32,3% | (52) | 161 |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
En revanche, la proportion de sérotypes uniques de PNEU-C-20 a augmenté chez les enfants de moins de 2 ans, passant de 25,8 % en 2011 à 37,3 % en 2022. En 2022, les 2 sérotypes supplémentaires contenus dans le PNEU-C-15 auraient potentiellement permis d'éviter 13 % de cas supplémentaires d'IIP chez les enfants de moins de 2 ans, tandis que les 7 sérotypes supplémentaires contenus dans le PNEU-C-20 auraient potentiellement permis d'éviter environ 37 % de cas supplémentaires d'IIP dans ce groupe d'âge (Figure 5).
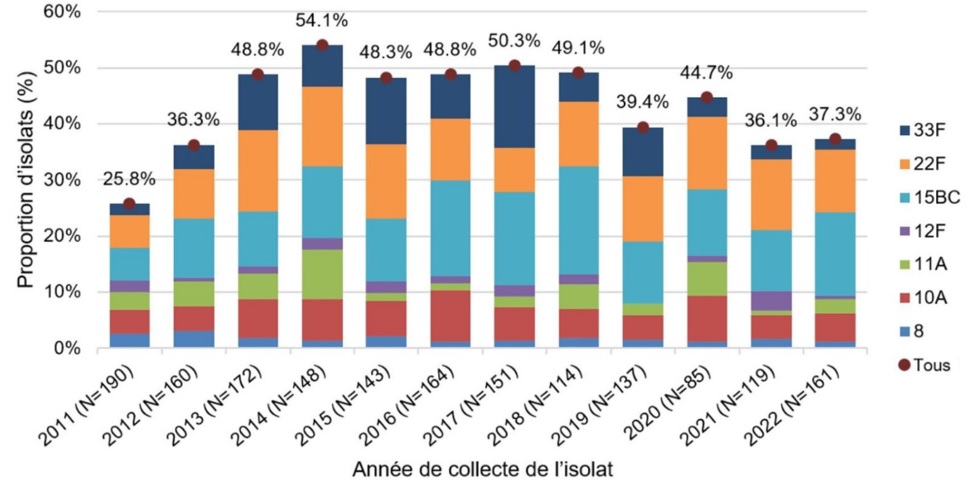
Figure 5 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés pour chaque sérotype Pneu-C-15/non-Pneu-C-13 (22F et 33F) et Pneu-C-20/non-Pneu-C-15 (8, 10A, 11A, 12F et 15B/C), incluant un pourcentage total combiné de ces sept sérotypes, pour les enfants de moins de 2 ans de 2011 à 2022.
| Année(n) | Sérotype(%, n) | Total combiné (%,n) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-15/non-PNEU-C-13 | PNEU-C-20/non-PNEU-C-15 | ||||||||||||||
| 22F | 33F | 8 | 10A | 11A | 12F | 15BC | |||||||||
| 2011 (190) | 5,8% | (11) | 2,1% | (4) | 2,6% | (5) | 4,2% | (8) | 3,2% | (6) | 2,1% | (4) | 5,8% | (11) | 25,8% (49) |
| 2012 (160) | 8,8% | (14) | 4,4% | (7) | 3,1% | (5) | 4,4% | (7) | 4,4% | (7) | 0,6% | (1) | 10,6% | (17) | 36,3% (58) |
| 2013 (172) | 14,5% | (25) | 9,9% | (17) | 1,7% | (3) | 7,0% | (12) | 4,7% | (8) | 1,2% | (2) | 9,9% | (17) | 48,8% (84) |
| 2014 (148) | 14,2% | (21) | 7,4% | (11) | 1,4% | (2) | 7,4% | (11) | 8,8% | (13) | 2,0% | (3) | 12,8% | (19) | 54,1% (80) |
| 2015 (143) | 13,3% | (19) | 11,9% | (17) | 2,1% | (3) | 6,3% | (9) | 1,4% | (2) | 2,1% | (3) | 11,2% | (16) | 48,3% (69) |
| 2016 (164) | 11,0% | (18) | 7,9% | (13) | 1,2% | (2) | 9,1% | (15) | 1,2% | (2) | 1,2% | (2) | 17,1% | (28) | 48,8% (80) |
| 2017 (151) | 7,9% | (12) | 14,6% | (22) | 1,3% | (2) | 6,0% | (9) | 2,0% | (3) | 2,0% | (3) | 16,6% | (25) | 50,3% (76) |
| 2018 (114) | 11,4% | (13) | 5,3% | (6) | 1,8% | (2) | 5,3% | (6) | 4,4% | (5) | 1,8% | (2) | 19,3% | (22) | 49,1% (56) |
| 2019 (137) | 11,7% | (16) | 8,8% | (12) | 1,5% | (2) | 4,4% | (6) | 2,2% | (3) | 0,0% | (0) | 10,9% | (15) | 39,4% (54) |
| 2020 (85) | 12,9% | (11) | 3,5% | (3) | 1,2% | (1) | 8,2% | (7) | 5,9% | (5) | 1,2% | (1) | 11,8% | (10) | 44,7% (38) |
| 2021 (119) | 12,6% | (15) | 2,5% | (3) | 1,7% | (2) | 4,2% | (5) | 0,8% | (1) | 3,4% | (4) | 10,9% | (13) | 36,1% (43) |
| 2022 (161) | 11,2% | (18) | 1,9% | (3) | 1,2% | (2) | 5,0% | (8) | 2,5% | (4) | 0,6% | (1) | 14,9% | (24) | 37,3% (60) |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
Tous/Total combiné fait référence au pourcentage total combiné de tous les sérotypes PNEU-C-15/non PNEU-C-13 (22F et 33F) et PNEU-C-20/non PNEU-C-15 (8, 10A, 11A, 12F et 15B/C).
Chez les enfants de 2 à 4 ans, la proportion d'isolats dus aux sérotypes du vaccin PNEU-C-13 a diminué depuis 2011, passant de 70,6 à 28,2 % en 2022. De même, pour le groupe des moins de 2 ans, une diminution plus rapide a été observée entre 2011 et 2014/2015, après quoi le changement de proportion s'est stabilisé. Au cours de la même période, une augmentation a été observée pour les sérotypes PNEU-C-15/non PNEU-C-13 et PNEU-C-20/non PNEU-15 (de 11,8 % à 16,2 %, et de 9,2 % à 22,2 %, respectivement) [Figure 6 ].

Figure 6 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres sérotypes non vaccinaux), pour les enfants de 2 à 4 ans de 2011 à 2022.
| Année | Vaccin (%, N) | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-15/ non-PNEU-C-13 |
PNEU-C-20/ non-PNEU-C-15 |
PNEU-P-23/ non-PNEU-C-20 |
TNV | |||||||
| 2011 | 70,6% | (108) | 11,8% | (18) | 9,2% | (14) | 0,7% | (1) | 7,8% | (12) | 153 |
| 2012 | 47,8% | (66) | 13,8% | (19) | 13,8% | (19) | 0,7% | (1) | 23,9% | (33) | 138 |
| 2013 | 39,4% | (37) | 12,8% | (12) | 25,5% | (24) | 2,1% | (2) | 20,2% | (19) | 94 |
| 2014 | 39,6% | (40) | 12,9% | (13) | 15,8% | (16) | 4,0% | (4) | 27,7% | (28) | 101 |
| 2015 | 23,0% | (17) | 17,6% | (13) | 27,0% | (20) | 4,1% | (3) | 28,4% | (21) | 74 |
| 2016 | 21,6% | (22) | 16,7% | (17) | 21,6% | (22) | 2,0% | (2) | 38,2% | (39) | 102 |
| 2017 | 26,6% | (33) | 12,1% | (15) | 18,5% | (23) | 0,0% | (0) | 42,7% | (53) | 124 |
| 2018 | 26,8% | (26) | 20,6% | (20) | 24,7% | (24) | 0,0% | (0) | 27,8% | (27) | 97 |
| 2019 | 27,9% | (29) | 16,3% | (17) | 24,0% | (25) | 1,0% | (1) | 30,8% | (32) | 104 |
| 2020 | 22,7% | (10) | 18,2% | (8) | 18,2% | (8) | 4,5% | (2) | 36,4% | (16) | 44 |
| 2021 | 19,4% | (14) | 8,3% | (6) | 36,1% | (26) | 1,4% | (1) | 34,7% | (25) | 72 |
| 2022 | 28,2% | (33) | 16,2% | (19) | 22,2% | (26) | 2,6% | (3) | 30,8% | (36) | 117 |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
En 2022, les 2 sérotypes supplémentaires contenus dans le PNEU-C-15 auraient potentiellement permis d'éviter environ 16 % de cas supplémentaires d'IIP chez les enfants de 2 à 4 ans, tandis que les 7 sérotypes supplémentaires contenus dans le PNEU-C-20 auraient potentiellement permis d'éviter environ 39 % de cas supplémentaires d'IIP dans ce groupe d'âge (Figure 7).

Figure 7 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés pour chaque sérotype Pneu-C-15/non-Pneu-C-13 (22F et 33F) et Pneu-C-20/non-Pneu-C-15 (8, 10A, 11A, 12F et 15B/C), incluant un pourcentage total combiné de ces sept sérotypes, pour les enfants de 2 à 4 ans de 2011 à 2022.
| Année (n) | Sérotype (%, N) | Total combiné (%, N) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-15/non-PNEU-C-13 | PNEU-C-20/non-PNEU-C-15 | ||||||||||||||
| 22F | 33F | 8 | 10A | 11A | 12F | 15BC | |||||||||
| 2011 (153) | 9,2% | (14) | 2,6% | (4) | 0,7% | (1) | 0,7% | (1) | 0,7% | (1) | 1,3% | (2) | 5,9% | (9) | 20,9% (32) |
| 2012 (138) | 11,6% | (16) | 2,2% | (3) | 0,7% | (1) | 4,3% | (6) | 3,6% | (5) | 0,7% | (1) | 4,3% | (6) | 27,5% (38) |
| 2013 (94) | 9,6% | (9) | 3,2% | (3) | 0,0% | (0) | 6,4% | (6) | 1,1% | (1) | 1,1% | (1) | 17,0% | (16) | 38,3% (36) |
| 2014 (101) | 11,9% | (12) | 1,0% | (1) | 0,0% | (0) | 1,0% | (1) | 3,0% | (3) | 0,0% | (0) | 11,9% | (12) | 28,7% (29) |
| 2015 (74) | 14,9% | (11) | 2,7% | (2) | 2,7% | (2) | 8,1% | (6) | 0,0% | (0) | 0,0% | (0) | 16,2% | (12) | 44,6% (33) |
| 2016 (102) | 12,7% | (13) | 3,9% | (4) | 3,9% | (4) | 1,0% | (1) | 2,0% | (2) | 1,0% | (1) | 13,7% | (14) | 38,2% (39) |
| 2017 (124) | 10,5% | (13) | 1,6% | (2) | 1,6% | (2) | 3,2% | (4) | 4,0% | (5) | 0,0% | (0) | 9,7% | (12) | 30,6% (38) |
| 2018 (97) | 13,4% | (13) | 7,2% | (7) | 2,1% | (2) | 4,1% | (4) | 2,1% | (2) | 0,0% | (0) | 16,5% | (16) | 45,4% (44) |
| 2019 (104) | 10,6% | (11) | 5,8% | (6) | 0,0% | (0) | 0,0% | (0) | 8,7% | (9) | 1,0% | (1) | 14,4% | (15) | 40,4% (42) |
| 2020 (44) | 9,1% | (4) | 9,1% | (4) | 2,3% | (1) | 11,4% | (5) | 0,0% | (0) | 0,0% | (0) | 4,5% | (2) | 36,4% (16) |
| 2021 (72) | 5,6% | (4) | 2,8% | (2) | 4,2% | (3) | 1,4% | (1) | 4,2% | (3) | 0,0% | (0) | 26,4% | (19) | 44,4% (32) |
| 2022 (117) | 14,5% | (17) | 1,7% | (2) | 0,9% | (1) | 2,6% | (3) | 2,6% | (3) | 0,0% | (0) | 16,2% | (19) | 38,5% (45) |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
Tous/Total combiné fait référence au pourcentage total combiné de tous les sérotypes PNEU-C-15/non PNEU-C-13 (22F et 33F) et PNEU-C-20/non PNEU-C-15 (8, 10A, 11A, 12F et 15B/C).
Une tendance semblable a également été observée dans la tranche d'âge des 5 à 17 ans. En 2022, les sérotypes PNEU-C-15/non PNEU-C-13 et du PNEU-C-20/non PNEU-15 ont contribué à environ 16 et 22 % des isolats, respectivement (Figure 8).
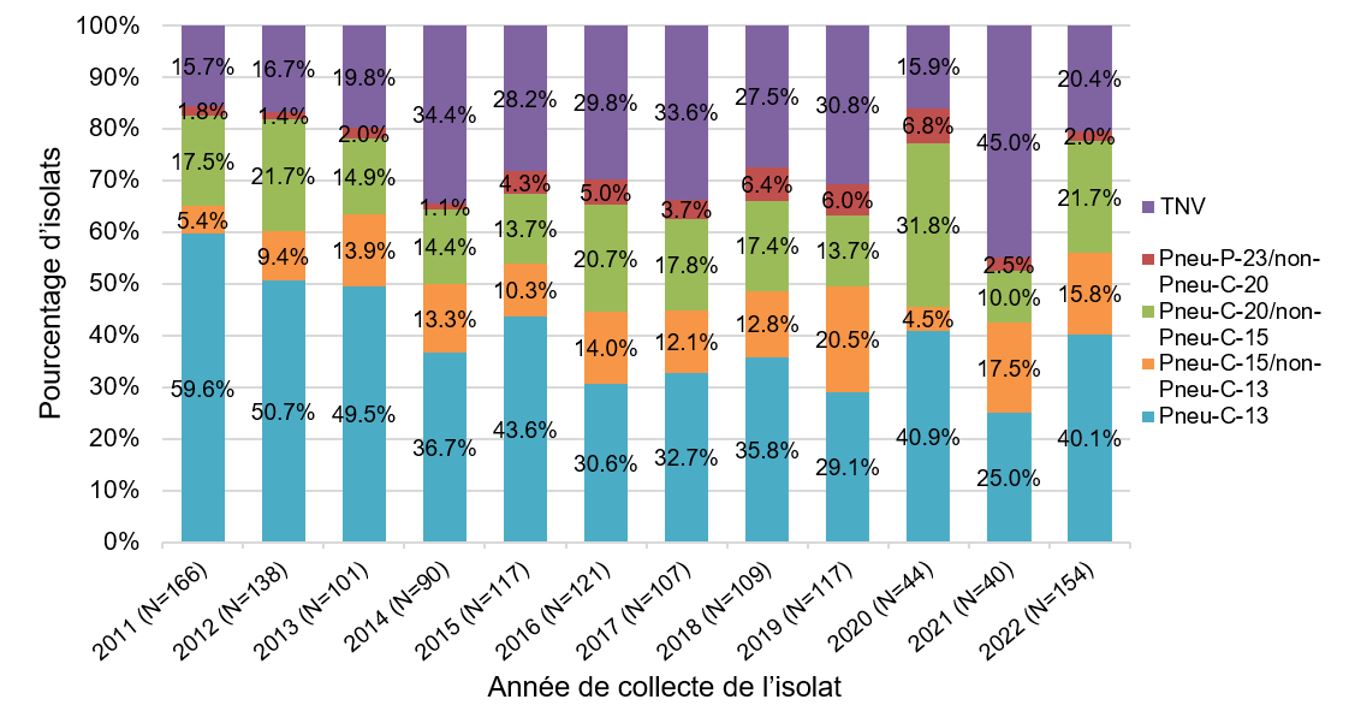
Figure 8 : Équivalent textuel
Un graphique à barres empilées affichant le pourcentage d'isolats de Streptococcus pneumoniae collectés dans chaque catégorie de vaccin (PNEU-C-13, PNEU-C-15/non-PNEU-C-13, PNEU-C-20/non-PNEU-C-15, PNEU-P-23/non-PNEU-C-20 et autres sérotypes non vaccinaux), pour les enfants de 5 à 17 ans de 2011 à 2022.
| Année | Vaccin (%, N) | Total | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| PNEU-C-13 | PNEU-C-15/ non-PNEU-C-13 |
PNEU-C-20/ non-PNEU-C-15 |
PNEU-P-23/ non-PNEU-C-20 |
TNV | |||||||
| 2011 | 59,6% | (99) | 5,4% | (9) | 17,5% | (29) | 1,8% | (3) | 15,7% | (26) | 166 |
| 2012 | 50,7% | (70) | 9,4% | (13) | 21,7% | (30) | 1,4% | (2) | 16,7% | (23) | 138 |
| 2013 | 49,5% | (50) | 13,9% | (14) | 14,9% | (15) | 2,0% | (2) | 19,8% | (20) | 101 |
| 2014 | 36,7% | (33) | 13,3% | (12) | 14,4% | (13) | 1,1% | (1) | 34,4% | (31) | 90 |
| 2015 | 43,6% | (51) | 10,3% | (12) | 13,7% | (16) | 4,3% | (5) | 28,2% | (33) | 117 |
| 2016 | 30,6% | (37) | 14,0% | (17) | 20,7% | (25) | 5,0% | (6) | 29,8% | (36) | 121 |
| 2017 | 32,7% | (35) | 12,1% | (13) | 17,8% | (19) | 3,7% | (4) | 33,6% | (36) | 107 |
| 2018 | 35,8% | (39) | 12,8% | (14) | 17,4% | (19) | 6,4% | (7) | 27,5% | (30) | 109 |
| 2019 | 29,1% | (34) | 20,5% | (24) | 13,7% | (16) | 6,0% | (7) | 30,8% | (36) | 117 |
| 2020 | 40,9% | (18) | 4,5% | (2) | 31,8% | (14) | 6,8% | (3) | 15,9% | (7) | 44 |
| 2021 | 25,0% | (10) | 17,5% | (7) | 10,0% | (4) | 2,5% | (1) | 45,0% | (18) | 40 |
| 2022 | 40,1% | (61) | 15,8% | (24) | 21,7% | (33) | 2,0% | (3) | 20,4% | (31) | 154 |
Source de données : Surveillance nationale en laboratoire de l'IIP au Canada (eSTREP); LNM. Données préliminaires pour 2021 et 2022.
Entre 2018 et 2022, les sérotypes conjugués au vaccin qui étaient la cause la plus fréquente d'IIP chez les enfants étaient ST22F, ST15B/C, ST19A et 3 qui représentaient, en moyenne, environ 12 %, 12 %, 9 % et 8 % de tous les isolats collectés par an, respectivement (Surveillance nationale en laboratoire de l'IIP au Canada [eSTREP]; LNM).
Incidence de l'IIP chez les enfants présentant un haut risque d'IIP en raison de pathologies sous-jacentes
Des données sur le risque d'infection à pneumocoque dans la population pédiatrique à l'ère du vaccin conjugué contre le pneumocoque sont disponibles aux É.-U. Même avec l'utilisation généralisée de tels vaccins, entre 2007 et 2010, les enfants présentant certaines pathologies sous-jacentes ont continué à présenter une charge accrue d'infection à pneumocoqueNote de bas de page 12, y compris l'IIP, la pneumonie à pneumocoque et la pneumonie toutes causes confondues. En 2018-2019, environ 25 % des IIP chez les enfants de 5 à 18 ans sont survenues chez des patients présentant un état d'immunodépression, des implants cochléaires ou des fuites de liquide céphalorachidienNote de bas de page 13.
Fardeau de l'infection non invasive à pneumocoque
Il n'existe pas de données de surveillance nationale sur l'OMA et la PEH au Canada, et les estimations du fardeau sont basées sur les données administratives provinciales de la Colombie-Britannique (C.-B.) et de l'Ontario (ON). Les TI estimés de la PEH après la mise en œuvre du programme de vaccination avec le PNEU-C-13 chez les enfants de moins de 5 ans allaient de 2 500 pour 100 000 (C.-B.) à 5 000 pour 100 000 (ON). Parmi les enfants de 5 à 17 ans, l'incidence de la PEH variait de 950 pour 100 000 (C.-B.) à 1 250 pour 100 000 (ON)Note de bas de page 14. Les TI estimés de l'OMA après la mise en œuvre du programme de vaccination avec le PNEU-C-13 chez les enfants de moins de 5 ans allaient de 14 000 pour 100 000 (C.-B.) à 25 000 pour 100 000 (ON). Parmi les enfants de 5 à 17 ans, l'incidence de l'OMA variait de 6 200 pour 100 000 (C.-B.) à 7 200 pour 100 000 (ON)Note de bas de page 14 (Figure 9). Dans l'ensemble, par suite de la mise en œuvre du programme de vaccination PNEU-C-13, les données disponibles suggèrent des changements limités au niveau du fardeau non IIP, avec une légère diminution de l'incidence de l'OMA chez les enfants plus jeunesNote de bas de page 14.
Des études internationales montrent que la proportion des cas de PEH attribuables à S. pneumoniae a été estimée à 6 % chez les nourrissons de moins de 1 an et à 12 % chez les enfants de 1 à 15 ansNote de bas de page 15Note de bas de page 16. La proportion des cas d'OMA attribuables à S. pneumoniae a été estimée à 17 % chez les enfantsNote de bas de page 15Note de bas de page 17. Compte tenu de la dépendance à l'égard des données administratives et du nombre limité d'études évaluant la proportion de PEH et d'OMA non invasives par étiologie, il existe une incertitude considérable quant à la proportion de ces infections dues à S. pneumoniae ainsi qu'à la répartition des sérotypes pertinents chez les enfants atteints lorsqu'elles sont causées par S. pneumoniae.
a. Pneumonie extrahospitalière

Figure 9a : Équivalent textuel
Incidence de la PEH par groupe d'âge (a)
Un graphique à barres affichant le taux d'incidence de la pneumonie extrahospitalière (PEH) en Colombie-Britannique (tout à gauche), et en Ontario (à gauche), avant la période de PNEU-C-13 en bleu et suivant l'introduction de la période de PNEU-C-13 en orange pour les enfants de 4 ans et moins en Colombie-Britannique (à droite) et en Ontario (tout à droite) pour la période avant PNEU-C-13 en bleu et suivant l'introduction de la période de PNEU-C-13 pour les enfants de 5 à 17 ans.
| Groupe d'âge | Province | Période | Incidence par 100 000 habitants |
|---|---|---|---|
| 0 à 4 ans | Colombie-Britannique | Période pré-PNEU-C-13 | 18 639,80 |
| 0 à 4 ans | Colombie-Britannique | Période PNEU-C-13 | 13 603,80 |
| 0 à 4 ans | Ontario | Période pré-PNEU-C-13 | 28 937,90 |
| 0 à 4 ans | Ontario | Période PNEU-C-13 | 25 467,60 |
| 5 à 17 ans | Colombie-Britannique | Période pré-PNEU-C-13 | 7 648,40 |
| 5 à 17 ans | Colombie-Britannique | Période PNEU-C-13 | 6 205,70 |
| 5 à 17 ans | Ontario | Période pré-PNEU-C-13 | 7 998,60 |
| 5 à 17 ans | Ontario | Période PNEU-C-13 | 7 225,90 |
b. Otite moyenne aiguë

Figure 9b : Équivalent textuel
Incidence de l'OMA par groupe d'âge (b)
Un graphique à barres affichant le taux d'incidence de l'otite moyenne aiguë (OMA) en Colombie-Britannique (à l'extrême gauche) et en Ontario (à gauche), avant l'introduction de PNEU-C-13 en bleu, et après l'introduction de la période de PNEU-C-13 en orange pour les enfants de 4 ans et moins en Colombie-Britannique (à droite) et en Ontario (à l'extrême droite), pour la période avant PNEU-C-13 en bleu et après l'introduction de la période de PNEU-C-13 pour les enfants de 5 à 17 ans.
| Groupe d'âge | Province | Période | Incidence par 100 000 habitants |
|---|---|---|---|
| 0 à 4 ans | Colombie-Britannique | Période pré-PNEU-C-13 | 2 671,60 |
| 0 à 4 ans | Colombie-Britannique | Période PNEU-C-13 | 2 464,10 |
| 0 à 4 ans | Ontario | Période pré-PNEU-C-13 | 4 854,20 |
| 0 à 4 ans | Ontario | Période PNEU-C-13 | 4 991,10 |
| 5 à 17 ans | Colombie-Britannique | Période pré-PNEU-C-13 | 957,60 |
| 5 à 17 ans | Colombie-Britannique | Période PNEU-C-13 | 945,20 |
| 5 à 17 ans | Ontario | Période pré-PNEU-C-13 | 1 289,80 |
| 5 à 17 ans | Ontario | Période PNEU-C-13 | 1 249,00 |
Figures adaptés de Nasreen S et al., 2022Note de bas de page 14.
Immunogénicité, efficacité potentielle/réelle et innocuité du PNEU-C-15 et du PNEU-C-20 dans les populations pédiatriques
Il n'existe actuellement aucune donnée sur l'EP ou l'ER des vaccins PNEU-C-15 ou PNEU-C-20 pour quelque indication pédiatrique que ce soit. Le CCNI a examiné les données relatives à l'innocuité et à l'immunogénicité du vaccin PNEU-C-15 issues de 8 essais cliniques de phase 2/3 portant sur un éventail de populations pédiatriques et utilisant différents calendriers de vaccination. Un essai supplémentaire, V114-022, a fourni des renseignements sur l'immunogénicité et l'innocuité après l'immunisation de 14 participants à une greffe de cellules souches hématopoïétiques (GCSH) âgés de 3 à 17 ans (dont 8 ont reçu le PNEU-C-15)Note de bas de page 18. Pour le vaccin PNEU-C-20, les données relatives à l'innocuité et à l'immunogénicité proviennent de 5 essais cliniques de phase 2/3. Le Tableau 8 résume les principaux renseignements sur les essais cliniques qui ont été examinés par le CCNI.
Dans l'ensemble, une analyse comparative des données rapportées dans les études V114-008, V114-025, V114-027 et V114-029 sur le PNEU-C-15Note de bas de page 19Footnote 20Footnote 21Note de bas de page 22, et dans les études B7471003, B7471011, B747B1012, et B7471013 sur le PNEU-C-20Note de bas de page 23Footnote 24Footnote 25Note de bas de page 26 ont montré des profils de réponse immunitaire congruents après la vaccination en utilisant un calendrier d'immunisation 2+1 ou 3+1 chez des nourrissons en bonne santé n'ayant jamais été vaccinés (Tableaux 9, Tableaux 10, Tableaux 11, Tableaux 12 et Tableaux 13). De plus, aucune différence n'a été constatée en ce qui concerne les événements indésirables (ÉI) signalés et les profils d'innocuité généraux des vaccins à valent plus élevé par rapport au PNEU-C-13 (Tableaux 13, Tableaux 14 et Tableaux 15).
Immunogénicité
Le CCNI a examiné les données disponibles sur l'immunogénicité des vaccins PNEU-C-15 et PNEU-C-20 dans le contexte des programmes de vaccination pédiatrique systématique ainsi que des calendriers de rattrapage et de réimmunisation. Les programmes pour nourrissons utilisés dans les études comprenaient une série de 2 doses (administrées à l'âge de 2 et 4 mois) ou de 3 doses (administrées à l'âge de 2, 4 et 6 mois), suivie d'une (1) dose supplémentaire à l'âge de 11 à 15 mois. Les études qui ont évalué l'immunogénicité du PNEU-C-15 chez les nourrissons prématurés ont également utilisé un autre calendrier dans lequel le vaccin a été administré à 2, 3 et 4 mois ainsi qu'entre 11 et 15 mois. L'immunogénicité a été mesurée 1 mois après l'administration de la dose et évaluée après les doses 2 (PD2), 3 (PD3) et 4 (PD4) [PD : (post dose) après la dose]. Dans toutes les études portant sur les nourrissons, les vaccins PNEU-C ont été administrés en même temps que les autres vaccins pédiatriques recommandés.
Immunogénicité du PNEU-C-15 dans les populations pédiatriques
L'immunogénicité après l'immunisation avec le PNEU-C-15 a été rapportée dans 7 essais cliniques de phase 2/3 qui comprenaient des enfants en bonne santé (5 études), des enfants atteints de drépanocytose (une [1] étude) et des enfants infectés par le VIH (une [1] étude) [Tableau 8].
Dans l'essai clinique pivot à double insu V114-025Note de bas de page 20 qui utilisait un calendrier de vaccination 2+1, l'immunogénicité a été mesurée chez des nourrissons en bonne santé âgés de 2 à 15 mois qui ont été vaccinés avec le PNEU-C-13 (N=593) ou le PNEU-C-15 (N=591). Lorsqu'ils sont analysés en fonction des différences relatives dans les concentrations d'anticorps, des rapports CMG plus faibles ont été observés après la dose 2 (PD2) et la dose 3 (PD3) du vaccin PNEU-C-15 pour la majorité des sérotypes (9/13 et 11/13, respectivement). Chez les receveurs du PNEU-C-15, les titres les plus faibles ont été rapportés pour les sérotypes 1, 5 et 6A, PD3.
De même, lors de l'évaluation par MGT de l'AOP, les anticorps fonctionnels étaient plus faibles pour 11/13 sérotypes PD3 chez les receveurs du PNEU-C-15 que chez les receveurs du PNEU-C-13. Cependant, les différences entre ces vaccins étaient moins prononcées lorsque l'immunogénicité était rapportée sous forme de différences de taux de sérorépondeurs, avec des valeurs plus faibles mesurées pour 3/13 et 6/13 sérotypes partagés PD2 et PD3, respectivement. Dans cette étude, les profils de réponses immunitaires d'IgG entre les doses étaient généralement comparables entre les groupes d'intervention, démontrant une diminution significative des anticorps avant l'administration de la dose de rappel, ainsi qu'un renforcement rapide après la réception de cette dose, ce qui confirmait la présence d'une mémoire immunitaire. Un résumé des données probantes GRADE est fourni dans le Tableau 9.
Dans 3 essais cliniques qui ont utilisé un calendrier de vaccination 3+1 (V114-008, V114-027, V114-029)Note de bas de page 19Note de bas de page 21Note de bas de page 22 l'immunogénicité a été évaluée chez près de 1 400 nourrissons en bonne santé ayant reçu le PNEU-C-15. Des concentrations d'anticorps plus faibles ont été systématiquement signalées après l'administration du PNEU-C-15 pour 5/13 sérotypes partagés PD3 (synthèse de 2 essais) et PD4 (synthèse de 3 essais). Par rapport au PNEU-C-13, les ratios MGT de l'AOP étaient numériquement plus faibles pour les sérotypes 4, 6A, 19A et 23F PD3 ainsi que pour les sérotypes 1, 3, 5, 6B, 7F et 9V PD4 chez les receveurs du PNEU-C-15 (synthèse de 2 essais). Des incertitudes notables ont été relevées en ce qui concerne les différences de taux de sérorépondeurs entre les groupes PD3 et PD4. Semblable à ce qui a été observé après un calendrier primaire à 2 doses, le profil de diminution des anticorps après la réception de la série primaire était comparable et significatif à PD3, tandis que les réponses immunitaires de l'administration de PD4 présentaient un profil concluant à l'établissement d'une mémoire immunitaire. Un résumé des données d'immunogénicité rapportées dans les études V114-008, V114-025, V114-027 et V114-029 ainsi qu'un résumé des données probantes GRADE sont fournis dans le Tableau 10.
Calendriers mixtes
L'essai V114-027Note de bas de page 21 est le seul ayant évalué l'immunogénicité des calendriers mixtes. Dans cette étude, 900 participants en bonne santé âgés de 40 à 90 jours ont été répartis au hasard dans l'un (1) des 5 groupes (N=180 par groupe) pour recevoir une série complète de 4 doses de PNEU-C-13 ou de PNEU-C-15, ou un calendrier mixte commençant par une (1), 2 ou 3 doses de PNEU-C-13 et se poursuivant avec le PNEU-C-15.
Lorsque l'on évalue les taux de sérorépondeurs spécifiques à un sérotype, un calendrier mixte composé de 2 ou 3 doses de PNEU-C-15 provoque des réponses immunitaires PD3 généralement comparables à celles observées après l'administration du PNEU-C-13 uniquement. Des ratios CMG semblables entre un calendrier de PNEU-C-13 uniquement et un calendrier mixte utilisant 2 doses de PNEU-C-15 ont également été observés pour PD3 et PD4. Dans un calendrier mixte avec 3 doses de PNEU-C-15, des ratios CMG plus faibles ont été observés pour 4/13 sérotypes partagés à la fois pour PD3 et PD4.
À l'image des calendriers utilisant uniquement le vaccin PNEU-C-13 ou PNEU-C-15, une diminution significative des anticorps a été observée dans tous les groupes d'intervention mixtes PD3, alors que la quatrième dose a conduit à une forte augmentation des concentrations d'anticorps qui étaient comparables ou supérieures à celles observées pour PD3.
Vaccination de rattrapage : enfants n'ayant jamais été vaccinés et enfants dont la série de vaccinations contre le pneumocoque est incomplète
Dans l'essai clinique à double insu V114-024Note de bas de page 27, 602 enfants en bonne santé n'ayant jamais reçu de vaccin contre le pneumocoque ou ayant déjà reçu une série partielle d'un vaccin contre le pneumocoque conjugué autorisé (PNEU-C-7, PNEU-C-10 ou PNEU-C-13) ont été répartis au hasard pour recevoir un calendrier adapté à leur âge comprenant une (1) à 3 doses de rattrapage du vaccin PNEU-C-13 ou PNEU-C-15. L'étude a réparti les enfants en 5 groupes en fonction de leur âge (7 à 11 mois, 12 à 23 mois, 2 ans à moins de 6 ans, et 6 ans à 17 ans), tous les participants âgés de moins de 2 ans n'ayant jamais été vaccinés contre le pneumocoque. Dans tous les groupes d'âge, les concentrations d'anticorps spécifiques au sérotype et les taux de sérorépondeurs 30 jours après la dernière dose étaient généralement comparables entre les groupes d'intervention pour tous les sérotypes communs du vaccin et significativement plus élevées pour les sérotypes uniques du PNEU-C-15.
Revaccination : enfants présentant un haut risque d'IIP et ayant terminé la série PNEU-C-13
Dans l'essai V114-023Note de bas de page 28, 99 enfants de 5 à 17 ans atteints de drépanocytose ont été répartis au hasard dans un rapport 2 :1 pour recevoir une (1) dose unique de PNEU-C-15 ou de PNEU-C-13. Lors de l'évaluation des CMG d'IgG spécifiques au sérotype 30 jours après la vaccination PNEU-C, les réponses immunitaires étaient généralement semblables entre les groupes pour les sérotypes partagés et plus élevées pour les sérotypes uniques du PNEU-C-15. Plus de 75 % des personnes ayant reçu le PNEU-C-15 ont obtenu une augmentation d'au moins 4 fois des concentrations d'anticorps pour les 2 sérotypes uniques, alors que seulement 42 et 58 % des personnes ayant reçu le vaccin ont obtenu une augmentation d'au moins 4 fois des MGT de l'AOP pour les sérotypes 33F et 22F, respectivement.
Dans l'étude V114-030Note de bas de page 29, 400 enfants de 6 à 17 ans atteints du VIH ont été répartis au hasard dans un rapport 1 :1 pour recevoir une (1) dose unique de vaccin PNEU-C-15 ou PNEU-C-13 suivie du PNEU-P-23 à la semaine 8 après l'immunisation. Trente (30) jours après l'administration du PNEU-C-15, les CMG d'IgG étaient numériquement semblables pour les 13 sérotypes partagés et plus élevés pour les 2 sérotypes uniques. Un (1) mois après l'administration du PNEU-P-23, les concentrations d'anticorps étaient généralement semblables entre les groupes, bien que numériquement plus faibles pour tous les sérotypes par rapport à celles observées 1 mois auparavant, après l'administration du PNEU-C.
Nourrissons prématurés
Une analyse intégrée de plus de 350 nourrissons prématurés participants aux études V114-025, V114-027, V114-029 et V114-031Note de bas de page 20Footnote 21Note de bas de page 22Note de bas de page 30 a démontré que, dans l'ensemble, les réponses immunitaires après la vaccination par le PNEU-C-15 étaient généralement comparables à celles observées chez les nourrissons prématurés ayant reçu le PNEU-C-13 pour les sérotypes partagés et conformes à celles observées chez les nourrissons à terme ayant reçu 4 doses de vaccin PNEU-C-15 (y compris les CMG d'IgG et les MGT de l'AOP). Plus de 85 et 96 % des nourrissons prématurés ayant reçu le PNEU-C-15 ont atteint des concentrations d'IgG séroprotectrices d'au moins 0,35 mcg/ml pour chacun des sérotypes PD3 et PD4 du vaccin, respectivement.
Immunogénicité du PNEU-C-20 dans les populations pédiatriques
Une étude clinique pivot B7471012Note de bas de page 25 a mesuré les réponses immunitaires chez des nourrissons suivant un calendrier d'immunisation 2+1. Les concentrations d'anticorps d'IgG PD2 et PD3 observées étaient plus faibles pour tous les sérotypes communs chez les receveurs du PNEU-C-20 que chez les receveurs du PNEU-C-13. Alors qu'une séroréponse plus faible a été signalée pour 9/13 sérotypes partagés PD2, la séroréponse PD3 n'était plus faible que pour ST3; et pour la majorité des autres sérotypes partagés (12/13), elle était incertaine en raison de l'inclusion d'une réponse nulle. Les MGT de l'AOP étaient généralement plus faibles en tout temps pour les sérotypes partagés, à l'exception de ST19A, PD3. Un résumé de l'évaluation GRADE est présenté dans le Tableau 11.
Deux (2) essais cliniques ont mesuré les réponses immunitaires en utilisant un calendrier de 3+1 pour les nourrissons. Dans l'étude pivot B7471011Note de bas de page 24, les concentrations d'anticorps étaient plus faibles pour tous les sérotypes partagés PD3 et pour 12/13 sérotypes PD4 par rapport aux receveurs du PNEU-C-13. Par ailleurs, alors que des taux de séroréponse plus faibles ont été observés pour la majorité des sérotypes partagés PD3 (8/13), seulement 2 sérotypes partagés (ST1 et ST3) présentaient des taux de séroréponse plus faibles rapportés pour PD4. De façon générale, les MGT de l'AOP étaient également plus faibles pour la majorité des sérotypes partagés PD3 et PD4. Un schéma très semblable de CMG d'IgG, de taux de séroréponse et de MGT de l'AOP a également été rapporté pour PD3 et PD4 dans le second essai, plus petit, intitulé B7471003Note de bas de page 23. Un résumé de l'évaluation GRADE est présenté dans le Tableau 12.
Dans toutes les études sur les nourrissons, une congruence dans les schémas de réponse immunitaire entre les groupes d'intervention a été observée, indépendamment du calendrier utilisé. Une diminution des anticorps a également été observée (tant pour les anticorps totaux que pour les anticorps fonctionnels) après l'achèvement de la série primaire, ainsi qu'une augmentation significative des anticorps après l'administration de la dose supplémentaire. Dans toutes les études, 1 mois après la dose supplémentaire, les taux d'anticorps dépassaient ceux observés après l'achèvement de la série primaire, ce qui démontrait l'établissement d'une mémoire immunitaire chez tous les vaccinés.
Revaccination : enfants ayant reçu une série de vaccinations systématiques PNEU-C-13
Chez les enfants de 5 à 17 ans, la vaccination a entraîné une augmentation des MGT de l'AOP pour tous les sérotypes du vaccin, l'augmentation pré/post des MGT de l'AOP pour les 7 sérotypes non contenus dans le PNEU-C-13 allant de 11,5 à 499 fois. Les données sur l'immunogénicité chez les personnes ayant déjà été vaccinées n'étaient disponibles que dans une (1) seule étude (B7471014)Note de bas de page 31. Dans cette étude, 425 enfants de moins de 5 ans préalablement immunisés avec 3 doses ou plus de PNEU-C-13 et 406 enfants de 5 à 17 ans (quel que soit leur statut vaccinal contre le pneumocoque antérieur) ont reçu une (1) dose de PNEU-C-20. Parmi les participants à l'étude âgés de moins de 5 ans, des augmentations des concentrations d'IgG ont été observées pour les 20 sérotypes contenus dans le vaccin, avec au moins 83 % atteignant les concentrations d'IgG prédéfinies pour les 7 sérotypes supplémentaires, à l'exception du sérotype 12F (40,0 %).
Immunogénicité des vaccins pédiatriques systématiques lorsqu'ils sont administrés en même temps que le PNEU-C-15 ou le PNEU-C-20
L'administration simultanée du PNEU-C-15 ou du PNEU-C-20 avec d'autres vaccins pédiatriques couramment administrés a été évaluée dans tous les essais cliniques sur les nourrissons. Outre les vaccins contre le pneumocoque, les participants ont reçu des vaccins contre la diphtérie, le tétanos, la coqueluche, la poliomyélite (sérotypes 1, 2 et 3), l'hépatite A, l'hépatite B, Haemophilus influenzae de type b, la rougeole, les oreillons, la rubéole, la varicelle et les rotavirus, sous forme de vaccins monovalents ou de vaccins combinés. Les réponses immunitaires à tous les antigènes administrés en même temps que le PNEU-C-15 ou le PNEU-C-20 étaient semblables à celles observées chez les receveurs du PNEU-C-13, comme l'ont montré les taux de réponse spécifiques à chaque antigène (pour les vaccins combinés et monovalents) ou les MGT (vaccin antirotavirus) 30 jours après la fin de la série primaire et la réception de la dose supplémentaire, à la fois dans le calendrier d'immunisation 2+1 et 3+1.
Données relatives à l'innocuité
Le CCNI a examiné les données disponibles sur l'innocuité des vaccins PNEU-C-15 et PNEU-C-20 dans le contexte des programmes de vaccination pédiatrique systématique ainsi que des calendriers de rattrapage et de réimmunisation. Des données sur l'innocuité ont été obtenues à partir d'essais cliniques impliquant des enfants recevant une (1) ou plusieurs doses de vaccin PNEU-C-15 ou PNEU-C-20 et, dans la plupart des essais, une (1) ou plusieurs doses de vaccin PNEU-C-13.
Données probantes sur l'innocuité du PNEU-C-15 dans les populations pédiatriques
Des ÉI consécutifs à l'immunisation par le vaccin PNEU-C-15 ont été rapportés dans 8 essais cliniques. Au total, 5 399 enfants ont reçu une (1) ou plusieurs doses de PNEU-C-15 et 3 280 enfants ont reçu une (1) ou plusieurs doses de PNEU-C-13. Les paramètres d'innocuité mesurés comprenaient la proportion de participants présentant des ÉI locaux et systémiques sollicités 1 à 14 jours après la vaccination, des mesures de la température corporelle maximale 1 à 7 jours après la vaccination et des ÉIG, jusqu'à 6 mois après la vaccination.
Une évaluation GRADE des études qui ont rapporté des issues d'innocuité pour 3 résultats d'intérêt (ÉIG totaux, ÉIG liés au vaccin et décès) en utilisant les calendriers 2+1 et 3+1, a conclu que chez les nourrissons n'ayant jamais reçu de vaccin, des données probantes de certitude modérée à élevée indiquaient peu ou pas de différence entre les groupes PNEU-C-13 et PNEU-C-15 (et des données probantes de certitude faible à modérée de peu ou pas de différence pour les nourrissons immunocompromis en raison de la petite taille de l'échantillon) [Tableau 13].
Une évaluation GRADE des études qui ont rapporté les résultats d'innocuité de doses de vaccin supplémentaires chez des enfants ayant déjà été vaccinés a conclu qu'il y avait des données probantes de certitude modérée de peu ou pas de différence entre les vaccins pour tous les résultats d'innocuité mesurés (Tableau 14).
Une analyse intégrée distincte de la base de données finale sur l'innocuité (données des études V114-025, -027, -029 et -031 dont le plan d'étude et la population étaient semblables) comprenait les données de 3 589 nourrissons en bonne santé ayant reçu au moins une (1) dose de PNEU-C-15 et de 2 058 nourrissons ayant reçu au moins une (1) dose de PNEU-C-13. Les ÉI sollicités ont représenté la majorité des événements d'innocuité signalés et ont été pour la plupart de courte durée (3 jours ou moins) et d'intensité légère à modérée. Les proportions de participants présentant des ÉI locaux et systémiques (sollicités et non sollicités) après chaque dose de la série primaire, après la dose de rappel et après n'importe quelle dose étaient semblables dans les 2 groupes d'intervention. Chez les nourrissons, les ÉI les plus fréquemment rapportés après toute dose de PNEU-C-15 concernaient l'irritabilité (intervalle : 47 % à 55,1 %), la somnolence (22,8 % à 40,7 %), la douleur au point d'injection (19,1 % à 27,1 %), la baisse d'appétit et d'autres réactions au point d'injection (moins de 20 %). Chez les enfants âgés de 11 à 15 mois, les ÉI les plus fréquemment rapportés concernaient l'irritabilité (45,7 %), la somnolence (21,8 %), la douleur au point d'injection (21 %), la baisse d'appétit (19,4 %) et d'autres réactions au point d'injection (érythème, gonflement, induration; toutes inférieures à 22 %).
Pour la majorité des participants ayant reçu le PNEU-C-15, les chercheurs ont rapporté des mesures de température corporelle maximale inférieures à 38,0 °C, avec une répartition de température comparable entre les groupes d'intervention. Parmi les participants dont la température corporelle maximale était supérieure à 38,0 °C, aucune différence significative n'a été observée entre les personnes ayant reçu le vaccin PNEU-C-13 et celles ayant reçu le vaccin PNEU-C-15, quelle que soit la dose de vaccin. Des ÉIG ont été signalés chez 10 % (N=358) des patients ayant reçu le PNEU-C-15 et 10,5 % (N=217) des patients ayant reçu le PNEU-C-13. Bien que la majorité des ÉIG aient été considérés comme non liés au vaccin, 3 ÉIG liés au vaccin ont été signalés chez 2 participants du groupe PNEU-C-15 et 1 participant du groupe PNEU-C-13 (tous étaient des cas de pyrexie nécessitant une hospitalisation). Quatre (4) décès ont été observés (2 chez les receveurs du PNEU-C-13 et 2 chez les receveurs du PNEU-C-15), dont aucun n'a été considéré comme lié à l'un ou l'autre des vaccins.
Nourrissons prématurés
L'innocuité du PNEU-C-15 a été évaluée chez plus de 170 nourrissons prématurés (âge gestationnel de moins de 37 semaines) qui ont été vaccinés selon un calendrier à 4 doses. L'innocuité après la vaccination avec le PNEU-C-15 était semblable à celle observée chez les nourrissons nés à terme. La fréquence des ÉIG était semblable entre les groupes (14,9 % pour PNEU-C-15 et 14,4 % pour PNEU-C-13). Aucun ÉIG ou décès lié au vaccin n'a été signalé dans ce petit groupe de nourrissons prématurés.
Données probantes sur l'innocuité du PNEU-C-20 dans les populations pédiatriques
Les données d'innocuité après l'immunisation avec le vaccin PNEU-C-20 étaient disponibles dans 5 essais cliniques (B7471003, B7471011, B7471012, B7471013 et B7471014)Note de bas de page 23Footnote 24Footnote 25Note de bas de page 26Note de bas de page 31. Un d'entre eux (B7471014) était un essai à groupe unique (N=839) avec des enfants ayant déjà été vaccinés et a été évalué séparémentNote de bas de page 31. En tout, sur les 4 essais évalués (B7471003, B7471011, B7471012, B7471013)Note de bas de page 23Footnote 24Footnote 25Note de bas de page 26, 2 833 nourrissons ont reçu une (1) ou plusieurs doses de PNEU-C-20 et 2 320 nourrissons ont reçu une (1) ou plusieurs doses de PNEU-C-13. De plus, 831 enfants de 15 mois à 17 ans ont reçu au moins une (1) dose de PNEU-C-20. Les paramètres d'innocuité mesurés comprenaient la proportion de participants présentant des ÉI locaux et systémiques sollicités 1 à 7 jours après la vaccination (y compris les ÉI immédiats survenant dans les 30 minutes suivant la vaccination), des ÉI 1 mois après chaque dose et des ÉIG jusqu'à 6 mois après la vaccination. Une analyse GRADE des études qui ont rapporté des résultats d'innocuité en utilisant les calendriers 2+1 et 3+1 a conclu qu'il y avait des données probantes de certitude faible à modérée de peu ou pas de différence entre les vaccins pour tous les résultats d'innocuité mesurés (très faible à faible parmi les groupes immunodéprimés, Tableau 15).
Une analyse d'innocuité intégrée distincte (données provenant des études B7471003, B7471011, B7471012 et B7471013 dont le plan d'étude et la population étaient semblables) comprenait des données de 2 812 nourrissons en bonne santé ayant reçu au moins une (1) dose de PNEU-C-20 et de 2 299 ayant reçu au moins une (1) dose de PNEU-C-13Note de bas de page 23Footnote 24Footnote 25Note de bas de page 26. Les taux de réactions locales et d'événements systémiques chez les nourrissons recevant le PNEU-C-20 et le PNEU-C-13 après n'importe quelle dose étaient semblables, les ÉI les plus fréquemment signalés chez les receveurs du PNEU-C-20 étant l'irritabilité (intervalle de 59,1 % à 71,3 %), la somnolence (37,0 % à 66,5 %), la douleur au point d'injection (33,5 % à 46,3 %), la baisse d'appétit (22,7 % à 26,0 %) et d'autres réactions au point d'injection (15,1 % à 24,7 %). Chez les enfants âgés de 11 à 15 mois, les ÉI les plus fréquemment rapportés dans l'étude à 3 doses (B7471012)Note de bas de page 25 et les études à 4 doses (B7471003, B7471011, B7471013)Note de bas de page 23Note de bas de page 24Note de bas de page 26 étaient l'irritabilité (58,5 % et 71 %, respectivement), la somnolence (37,7 % et 50,9 %), la douleur au point d'injection (33,4 % et 42,4 %), la baisse d'appétit (26,4 % et 39,3 %) et autres réactions au point d'injection (rougeur ou gonflement) [15,1 % et 36,9 %].
Pour la majorité des participants ayant reçu le PNEU-C-20, les chercheurs ont rapporté des mesures de température corporelle maximale inférieures à 38,0 °C, avec une répartition de température comparable entre les groupes d'intervention. Parmi les participants dont la température corporelle maximale était supérieure à 38,0 °C, aucune différence significative n'a été observée entre les personnes ayant reçu le vaccin PNEU-C-13 et celles ayant reçu le vaccin PNEU-C-20, quelle que soit la dose de vaccin. Des ÉIG ont été signalés chez 4,8 % des patients ayant reçu le PNEU-C-20 et 4,5 % des patients ayant reçu le PNEU-C-13. Bien que la majorité des ÉIG aient été jugés non liés au vaccin, 1 ÉIG survenu 7 jours après la première dose de vaccin a été jugé possiblement lié au PNEU-C-20 ou à l'un (1) des vaccins concomitants reçus. La personne en cause a été hospitalisée pour de la fièvre, un gonflement douloureux de l'aine droite et une hernie inguinale droite. Les examens de laboratoire ont révélé des marqueurs inflammatoires élevés (protéine C-réactive et procalcitonine) et une hémoculture négative. L'intéressé a été traité avec des antibiotiques à l'hôpital et l'événement s'est résolu. Aucun décès n'a été signalé dans les essais pédiatriques du PNEU-C-20.
Nourrissons prématurés
L'innocuité du PNEU-C-20 a été évaluée chez 110 nourrissons prématurés (âge gestationnel de 34 à moins de 37 semaines) qui ont été vaccinés selon un calendrier à 4 doses (à 2, 4, 6 et de 12 à 15 mois). L'innocuité du PNEU-C-20 et du PNEU-C-13 était semblable à celle observée chez les nourrissons à terme, y compris les réactions locales et les événements systémiques après chaque dose. La fréquence des ÉI signalés jusqu'à 1 mois après la troisième dose était de 31,2 % pour le PNEU-C-20 et de 23,5 % pour le PNEU-C-13. La fréquence des ÉI signalés jusqu'à 1 mois après la quatrième dose était semblable pour les groupes (14,3 % pour le PNEU-C-20 et 17,2 % pour le PNEU-C-13). Les pourcentages de participants ayant eu des ÉIG entre la dose 1 et 6 mois après la dose 4 étaient également semblables entre les 2 groupes (4,4 % et 5,6 % pour les groupes PNEU-C-20 et PNEU-C-13, respectivement).
Facteurs d'éthique, d'équité, de faisabilité et d'acceptabilité
Le CCNI utilise un cadre publié et revu par des pairs ainsi que des outils fondés sur des données probantes pour s'assurer que les questions liées à l'EEFA sont systématiquement évaluées et intégrées dans ses directivesNote de bas de page 32.
Les nourrissons et les enfants de moins de 5 ans présentent un risque plus élevé d'IIP que les enfants de 5 ans et plus et bénéficient d'un programme de vaccination systématique contre le pneumocoque. La vaccination de la jeune population pédiatrique offre une protection directe et indirecte à d'autres populations vulnérables (p. ex., les adultes plus âgés). Les recommandations précédentes sur l'utilisation des vaccins contre le pneumocoque chez les enfants ont également reconnu que certains groupes ont besoin de doses supplémentaires pour obtenir une protection optimale (c.-à-d. le calendrier vaccinal 3+1, la dose supplémentaire avec le PNEU-P-23), en particulier pour les personnes dont la réponse immunitaire peut être diminuée en raison d'une pathologie sous-jacente. Le maintien des recommandations vaccinales en fonction de l'âge et du risque favorise un accès équitable à la vaccination contre le pneumocoque pour les personnes qui ont le plus besoin d'être protégées.
Les enfants présentant des facteurs de risque médicaux ont été désignés comme présentant un haut risque d'IIP. Les conditions sociales, environnementales ou de vie peuvent également augmenter le risque de maladie sévère et doivent être prises en compte. Le fardeau de la maladie plus élevé observé dans le Nord du Canada peut être attribué à divers facteurs qui se recoupent, notamment ceux liés à l'environnement et au mode de vie (p. ex., la promiscuité), la population plus jeune que celle du Canada en général et l'accès réduit aux soins de santé. Par conséquent, le fait de vivre dans des communautés ou des environnements connaissant des niveaux élevés et durables d'IIP, ou d'être soumis à un risque permanent d'IIP en raison d'autres conditions environnementales ou de vie (c.-à-d. itinérance, absence de soins résidentiels) devrait être établi comme des facteurs qui entraînent un haut risque d'IIP. Dans le cas des communautés autochtones, des décisions autonomes doivent être prises par les peuples autochtones eux-mêmes avec le soutien des partenaires de santé et de la santé publique, conformément à la Déclaration des Nations unies sur les droits des peuples autochtonesNote de bas de page 33.
Les nouveaux vaccins contre le pneumocoque conjugués et à valent plus élevé offrent la possibilité de protéger les enfants contre des sérotypes supplémentaires par rapport au PNEU-C-13, et de réduire encore le fardeau de l'IIP. La couverture vaccinale des vaccins contre le pneumocoque pédiatrique est élevée dans la population canadienne (avec une couverture estimée à 85,1 % en 2021) et, comme un programme de vaccination systématique est déjà en place, l'adoption des nouveaux vaccins conjugués à valent plus élevé ne devrait pas nuire à leur acceptation.
Les vaccins conjugués induisent la formation de cellules mémoires à long terme, assurent une protection de plus longue durée, réduisent le portage des bactéries par les muqueuses et provoquent une réponse anamnestique, contrairement aux vaccins polysaccharidiques. Par conséquent, même si le PNEU-C-20 ne contient pas autant de sérotypes que le PNEU-P-23, les avantages d'un vaccin conjugué l'emportent sur l'étendue légèrement réduite de la couverture par les sérotypes. Ces avantages ont été jugés suffisants pour éliminer la nécessité de PNEU-P-23 et contribueraient à simplifier le calendrier des vaccins pédiatriques, améliorant ainsi la faisabilité du programme.
Les provinces et les territoires sont déjà passés du PNEU-C-7 au PNEU-C-13 dans les programmes pédiatriques de vaccination contre le pneumocoque et ont démontré qu'il était possible d'adopter de nouveaux produits vaccinaux. Des défis semblables se poseront, notamment la nécessité d'actualiser les communications (protocoles et formation, messages publics), de réduire grandement le gaspillage de vaccins et de mettre en œuvre des lignes directrices sur les vaccins de rattrapage pour des cohortes particulières. Le coût des nouveaux vaccins devrait constituer un obstacle important à la transition vers l'utilisation de vaccins contre le pneumocoque à valent plus élevé, et il pourrait y avoir des variations dans la manière ou le moment où chaque administration sera en mesure d'adopter de nouvelles recommandations sur l'utilisation de ces vaccins. Certaines administrations peuvent choisir de proposer d'abord les nouveaux produits à certaines populations présentant un haut risque d'IIP, alors que d'autres peuvent également tenir compte de l'épidémiologie locale des sérotypes dans leur choix de produit. L'utilisation d'un seul produit dans les programmes systématiques et à haut risque pour enfants et adultes réduirait la complexité du programme et le risque d'administrer un vaccin différent de celui prévu.
Économie
Un examen systématique et une évaluation économique fondée sur un modèle de novo ont été utilisés comme données probantes économiques pour soutenir la prise de décision concernant l'utilisation du PNEU-C-15 et du PNEU-C-20 dans la population pédiatrique. Les détails complets de ces analyses, y compris les hypothèses et les limites, sont fournis dans un résumé supplémentaire des données probantes économiques.
Examen systématique
Une recherche systématique de la littérature évaluée par les pairs et de la littérature grise a permis de recenser 2 évaluations économiques basées sur des modèles comparant le PNEU-C-15 au PNEU-C-13 dans des populations pédiatriques. Ces études ont évalué les programmes systématiques pour nourrissons, mais n'ont pas évalué les stratégies de vaccination pour les groupes présentant un haut risque d'IIP. Aucune étude portant sur le PNEU-C-20 n'a été identifiée en date du 7 mars 2023. Les études, qui étaient des analyses coût/utilité, menées aux É.-U., utilisaient une perspective sociétaleNote de bas de page 34Note de bas de page 35. Une (1) des études a été parrainée par l'industrieNote de bas de page 35. Les 2 modèles étaient statiques et n'incluaient pas la dynamique de la transmission. Les effets de protection indirecte ont été inclus en tant que pourcentage de réduction de l'IIP ou de l'infection à pneumocoque chez les individus n'ayant pas reçu le vaccin PNEU-C-15Note de bas de page 34Note de bas de page 35. Les 2 modèles ont utilisé une approche semblable pour modéliser le risque d'infection à pneumocoque, y compris l'IIP, la pneumonie à pneumocoque non bactériémique, l'OMA pneumococcique et les séquelles post-méningite à long terme en tant que résultats de santé.
Malgré les différences dans la perspective utilisée, le type de modèle et l'horizon temporel, les 2 études ont conclu que l'utilisation du PNEU-C-15 était associée à des coûts inférieurs et à des résultats de santé améliorés, dominant le PNEU-C-13. Cependant, ces analyses ont supposé que le PNEU-C-15 et le PNEU-C-13 étaient tarifés de manière équivalente dans le scénario de référenceNote de bas de page 34Note de bas de page 35. Dans les analyses de sensibilité, les résultats étaient robustes aux différentes hypothèses concernant l'ER du vaccin, la couverture et les effets indirects, le PNEU-C-15 restant la stratégie dominante lorsque le PNEU-C-15 et le PNEU-C-13 présentaient un coût équivalentNote de bas de page 34Note de bas de page 35. Dans une analyse de seuil, le PNEU-C-15 s'est avéré rester la stratégie dominante jusqu'à un coût maximum de 18 % plus élevé que le PNEU-C-13 par doseNote de bas de page 35. Une campagne de rattrapage utilisant le PNEU-C-15 pour tous les enfants de 2 à 5 ans ayant déjà reçu une série complète de PNEU-C-13 n'était probablement pas rentable, avec des rapports coût/efficacité différentiels (RCED) dépassant 3,5 millions de dollars par AVAQ gagnéeNote de bas de page 34.
Analyse coût/utilité
Un modèle statique coût/utilité développé par le CCNI a évalué le rapport coût/efficacité de l'utilisation du PNEU-C-15 et du PNEU-C-20 par rapport au PNEU-C-13 chez les nourrissons canadiens n'ayant jamais reçu de vaccin et admissibles à la vaccination systématique contre le pneumocoque. L'analyse ne comportait pas d'évaluation des stratégies de vaccination pour les personnes présentant un haut risque d'IIP. Tant le PNEU-C-15 que le PNEU-C-20 devraient améliorer les résultats de santé par rapport au PNEU-C-13, le PNEU-C-20 permettant d'éviter 2 fois plus de cas d'IIP que le PNEU-C-15 sur la période de 10 ans couverte par le modèle (estimation médiane de 468 contre 221 cas évités). Dans l'analyse séquentielle du scénario de référence, qui comparait toutes les stratégies de vaccination possibles, les RCED pour le PNEU-C-15 et le PNEU-C-20 étaient respectivement de 58 800 $ (par rapport au PNEU-C-13) et de 135 200 $ (par rapport au PNEU-C-15) par AVAQ gagnée, du point de vue du système de santé.
Du point de vue sociétal, les RCED séquentiels étaient de 18 300 $ (par rapport au PNEU-C-13) et de 93 400 $ (par rapport au PNEU-C-15) par AVAQ gagnée pour le PNEU-C-15 et le PNEU-C-20, respectivement. Les résultats étaient très sensibles au prix supposé du vaccin. Les valeurs du scénario de référence étaient respectivement de 71, 78 et 90 $ par dose pour le PNEU-C-13, le PNEU-C-15 et le PNEU-C-20. Des prix de vaccins supposés plus bas pour le PNEU-C-15 et le PNEU-C-20 ont augmenté leur rapport coût/efficacité. L'analyse du scénario de référence excluait les effets de protection indirects. Si l'utilisation du PNEU-C-15 ou du PNEU-C-20 dans la population pédiatrique entraînait une diminution de l'incidence de l'infection à pneumocoque dans le reste de la population en raison d'effets de protection indirects, les RCED seraient considérablement réduits. Le remplacement des sérotypes n'a pas été évalué dans l'analyse. Dans un contexte où le fardeau du pneumocoque et les coûts médicaux sont plus élevés, l'utilisation du PNEU-C-20 était une stratégie dominante (moins coûteuse et plus efficace) par rapport au PNEU-C-13 et au PNEU-C-15, tant du point de vue du système de santé que du point de vue sociétal. Les résultats de la modélisation économique de la santé sont soumis à des limitations liées à la simplification des hypothèses et à l'incertitude des données, qui sont fournis dans un résumé supplémentaire des données probantes économiques.
Données probantes économiques supplémentaires
Deux (2) autres évaluations économiques portant à la fois sur le PNEU-C-15 et le PNEU-C-20 ont été rendues disponibles après l'achèvement de l'examen systématique et ont également été examinées. Une (1) des évaluations présentait une comparaison de 3 analyses coût/utilité (dont 2 financées par l'industrie) réalisées aux É.-U.Note de bas de page 36 et la seconde, une analyse coût/utilité réalisée au QuébecNote de bas de page 37. L'analyse américaine a comparé l'utilisation du PNEU-C-20 à celle du PNEU-C-13 ou du PNEU-C-15, selon un calendrier 3+1 chez les enfants de moins de 2 ans. L'analyse du Québec a comparé l'utilisation d'un calendrier 2+1 du PNEU-C-15 ou du PNEU-C-20 à un calendrier de 2 doses de PNEU-C-10 plus une (1) dose de PNEU-C-13 (le calendrier de vaccination contre le pneumocoque actuellement utilisé au Québec). Tous les modèles étaient statiques, mais différaient par leur structure, le cadre temporel de l'analyse, les hypothèses sur les effets indirects de la protection, le prix du vaccin et d'autres paramètres. Aucune des 2 évaluations n'a effectué d'analyse séquentielle comparant les 3 calendriers de vaccination. Une comparaison formelle entre les modèles n'a pas été effectuée.
Les 2 évaluations ont montré que le PNEU-C-20 devrait améliorer les résultats de santé par rapport à d'autres options de vaccination. Pour l'analyse américaine, qui a utilisé une perspective sociétale, les résultats varient d'un modèle à l'autre, les RCED pour le PNEU-C-20 allant d'une valeur dominante à 74 200 $ par AVAQ par rapport au PNEU-C-13, et d'une valeur dominante à 162 700 $ par AVAQ par rapport au PNEU-C-15. Les RCED les plus élevés ont été observés avec le modèle non financé par l'industrie. Pour l'analyse du Québec, le PNEU-C-15 et le PNEU-C-20, comparés à la norme de soins actuelle, présentent des RCED supérieurs aux seuils de coût/efficacité couramment utilisés, dans la perspective du système de santé. Lorsque le PNEU-C-20 est comparé au PNEU-C-15, le RCED est inférieur aux seuils couramment utilisés pour le système de santé, et le PNEU-C-20 domine le PNEU-C-15 dans la perspective sociétale. Ces évaluations économiques supplémentaires démontrent que le rapport coût/efficacité estimé du PNEU-C-15 et du PNEU-C-20 est sensible aux hypothèses du modèle et aux paramètres d'entrée.
Recommandations
À la suite de la revue des données probantes disponibles résumées ci-dessus, le CCNI recommande que tous les programmes de vaccination systématique des nourrissons au Canada incluent un vaccin contre le pneumocoque conjugué. Il formule en outre les recommandations suivantes pour la prise de décision concernant les programmes de santé publique (voir le Tableau 6 pour obtenir une explication plus détaillée de la force des recommandations du CCNI et de l'évaluation GRADE de l'ensemble des données probantes). Comme il a déjà été mentionné, dans cette déclaration, la référence aux « enfants » inclut nourrissons, enfants et adolescents.
Recommandations pour les programmes de vaccination systématique chez les enfants de moins de 5 ans qui ne présentent pas de haut risque d'IIP
- Le CCNI recommande l'utilisation du PNEU-C-15 ou du PNEU-C-20 pour les enfants de moins de 5 ans dans les programmes de vaccination systématique. (Forte recommandation du CCNI)
- Le PNEU-C-15 ou le PNEU-C-20 devraient être les produits de choix à proposer aux enfants selon les calendriers systématiques recommandés antérieurement pour le PNEU-C-13 (voir le chapitre sur les vaccins contre le pneumocoque du Guide canadien d'immunisation).
- Le PNEU-C-20 devrait être le produit de choix à proposer pour les enfants présentant un haut risque d'IIP (voir les recommandations 2 à 4).
Le tableau des options de gestion (Tableau 5) résume les avantages relatifs de chaque vaccin conjugué contre le pneumocoque en vue de son utilisation dans les programmes systématiques, y compris les considérations relatives à l'EEFA.
Sommaire des données probantes, justification et autres considérations
- L'ER vaccinale et la durée de protection du PNEU-C-15 et du PNEU-C-20 sont actuellement inconnues. Tant l'un que l'autre sont immunogènes dans les populations pédiatriques et offrent une couverture par les sérotypes supplémentaire par rapport au PNEU-C-13. Les réponses immunitaires sont plus faibles après le PNEU-C-15 et le PNEU-C-20 qu'après le PNEU-C-13 pour plusieurs sérotypes communs. Leurs répercussions sur l'ER du vaccin, la durée de la protection, le portage et l'immunité collective sont inconnues. Une surveillance continue et renforcée de l'infection à pneumocoque au Canada est recommandée.
- Aucun signal d'innocuité lié à l'un ou l'autre des vaccins PNEU-C n'a été identifié à ce jour (Tableau 13).
- Les nouveaux vaccins contre le pneumocoque conjugués à valent plus élevé offrent la possibilité de protéger les enfants contre des sérotypes supplémentaires par rapport au PNEU-C-13 et devraient réduire encore le fardeau de l'IIP. Avec 5 sérotypes supplémentaires par rapport au PNEU-C-15, le PNEU-C-20 devrait avoir un impact plus important sur l'IIP. L'inclusion du PNEU-C-20 dans les programmes systématiques pour tous les enfants peut simplifier les programmes de vaccination et apporter le plus de bénéfices indirects à d'autres populations.
- Dans l'analyse coût/efficacité du scénario de référence réalisée par le CCNI, le PNEU-C-15 est plus susceptible d'être une option rentable que le PNEU-C-20. Cependant, ces 2 vaccins peuvent être rentables en fonction du prix par dose de chacun ou si les impacts plus vastes de la vaccination sont pris en compte dans une perspective sociétale ou l'inclusion des effets indirects potentiels.
- Le PNEU-C-13 uniquement ou un programme mixte de PNEU-C-10/PNEU-C-13 peut être utilisé si le PNEU-C-15 ou le PNEU-C-20 sont indisponibles ou inaccessibles.
- Conformément aux directives précédentes, le CCNI recommande que tous les vaccins contre le pneumocoque puissent être administrés en même temps que d'autres vaccins, à l'exception du PNEU-P-23. Aucun vaccin contre le pneumocoque conjugué ne doit être administré en même temps que le PNEU-P-23.
Recommandations sur l'utilisation des vaccins contre le pneumocoque pour les enfants présentant des pathologies ou des conditions environnementales ou de vie qui les exposent à un haut risque d'IIP
Le Tableau 1 présente les facteurs de risque médicaux et les conditions environnementales ou de vie qui augmentent le risque d'IIP chez les enfants.
- Le CCNI recommande d'utiliser le PNEU-C-20 pour les nourrissons et les enfants à haut risque d'IIP qui commencent leur série de vaccins contre le pneumocoque, et pour compléter la série de ceux qui ont commencé leur série de vaccins avec le PNEU-C-13 ou le PNEU-C-15. (Forte recommandation du CCNI)
- Les nourrissons présentant un haut risque d'IIP devraient être vaccinés avec le PNEU-C-20 selon un calendrier de 4 doses (3+1) à 2 mois, 4 mois, 6 mois et une (1) dose à 12 ou 15 mois.
- Les nourrissons et les enfants qui n'ont pas commencé leur calendrier de vaccination à l'âge de 7 mois devraient être vaccinés selon le calendrier fourni dans le Tableau 7.
- Les enfants de 2 ans et plus qui présentent un haut risque d'IIP et qui n'ont jamais été vaccinés contre le pneumocoque devraient recevoir une (1) dose de PNEU-C-20.
- Il est recommandé de compléter une série de vaccins commencée avec le PNEU-C-13 ou le PNEU-C-15 avec le PNEU-C-20 selon le calendrier recommandé dans le Tableau 7.
- Les enfants présentant un haut risque d'IIP qui ont terminé une série de vaccins adaptée à leur âge et comprenant au moins une (1) dose de PNEU-C-20 n'ont pas besoin de recevoir d'autres doses pour l'instant.
Sommaire des données probantes, justification et autres considérations
- Le PNEU-C-20 s'est révélé sûr et immunogène dans les études menées auprès de populations pédiatriques présentant un haut risque d'IIP.
- L'utilisation du PNEU-C-20 chez les enfants présentant un haut risque d'IIP offre une protection contre un plus grand nombre de sérotypes que les autres vaccins conjugués.
- Les enfants présentant un haut risque d'IIP et ayant reçu au moins une (1) dose de PNEU-C-20 n'ont pas besoin du PNEU-P-23.
- On ignore si des doses supplémentaires de PNEU-C-20 apporteraient un bénéfice accru, c'est pourquoi elles ne sont pas recommandées pour le moment. Le CCNI évaluera les données probantes au fur et à mesure qu'elles seront disponibles.
- Une analyse coût/efficacité pour les populations présentant un haut risque d'IIP n'a pas été réalisée en raison du manque de données pour ces populations.
Recommandations sur les doses de rattrapage pour les enfants présentant des pathologies ou des conditions environnementales ou de vie qui les exposent à un haut risque d'IIP
- a) Le CCNI recommande que les enfants de moins de 18 ans qui présentent des facteurs de risque médicaux et qui ont terminé leur calendrier d'immunisation recommandé avec le PNEU-C-13 ou le PNEU-C-15, reçoivent une (1) dose de rattrapage (supplémentaire) de PNEU-C-20. (Forte recommandation du CCNI)
- Les personnes présentant des facteurs de risque médicaux et ayant déjà reçu le PNEU-P-23 devraient recevoir une (1) dose de PNEU-C-20 à 1 an d'intervalle suivant la dernière dose de PNEU-P-23.
- b) Le CCNI recommande que les enfants de moins de 18 ans présentant des conditions environnementales ou de vie qui entraînent un haut risque d'IIP, et qui ont terminé leur calendrier d'immunisation recommandé avec le PNEU-C-13 ou le PNEU-C-15, reçoivent une (1) dose de rattrapage (supplémentaire) de PNEU-C-20. (Forte recommandation du CCNI)
- Dans les communautés et les milieux où le taux d'IIP est constamment élevé, une évaluation des tendances épidémiologiques locales devrait être utilisée afin d'orienter les personnes concernées des programmes de vaccination.
- Dans les communautés des Premières Nations, des Métis ou des Inuits, les décisions autonomes devraient être prises par les peuples autochtones, mais avec le soutien des partenaires de santé et de la santé publique, conformément à la Déclaration des Nations unies sur les droits des peuples autochtones.
Sommaire des données probantes, justification et autres considérations
- Une (1) dose de rattrapage avec le PNEU-C-20 pour les enfants présentant un haut risque d'IIP (pathologies ou conditions environnementales et de vie) et qui ont terminé leur calendrier de vaccination recommandé offrira une protection plus large contre les sérotypes, ainsi que les avantages immunitaires des vaccins conjugués.
- Pour les enfants qui ne sont pas exposés à un haut risque d'IIP en raison de pathologies ou de conditions environnementales et de vie et qui ont terminé la série de vaccinations recommandée avec le PNEU-C-13, il n'est pas recommandé de leur administrer une (1) dose de rattrapage (supplémentaire) de PNEU-C-15 ou de PNEU-C-20.
- Une analyse coût/efficacité des programmes de rattrapage n'a pas été réalisée en raison du manque de données sur ces populations.
Recommandations pour les receveurs de greffes de cellules souches hématopoïétiques
- Le CCNI recommande que le vaccin conjugué PNEU-C-20 contre le pneumocoque soit proposé aux enfants de moins de 18 ans qui ont reçu une greffe de cellules souches hématopoïétiques après consultation de leur spécialiste de la transplantation. (Forte recommandation du CCNI)
- Administrer une première série de 3 doses de PNEU-C-20 débutant 3 à 9 mois après la transplantation à au moins 4 semaines d'intervalle, suivie d'une (1) dose supplémentaire de PNEU-C-20 12 à 18 mois après la transplantation (6 à 12 mois après la dernière dose de PNEU-C-20).
- Déterminer le moment recommandé pour l'administration du PNEU-C-20 aux receveurs d'une GCSH en consultation avec le spécialiste de la transplantation.
Sommaire des données probantes, justification et autres considérations
- Le vaccin PNEU-C-20 offre à ces personnes une protection contre des sérotypes supplémentaires, ainsi que les avantages immunitaires des vaccins conjugués. Le PNEU-P-23 n'est plus recommandé dans la série de vaccins pour cette population.
| Vaccin | Facteurs à prendre en considération | Points de décision |
|---|---|---|
| PNEU-C-15 | Épidémiologie En 2022, 13 % (inférieur à 2 ans) et 16 % (2 à 4 et 5 à 17 ans) des isolats provenant de cas d'IIP étaient dus aux 2 sérotypes uniques (22F et 33F) contenus dans le PNEU-C-15. Immunogénicité Innocuité Analyse économique |
Épidémiologie
Immunogénicité
Efficacité réelle
Innocuité
Économie
Faisabilité, acceptabilité et équité
|
| PNEU-C-20 | Épidémiologie En 2022, 37 % (inférieur à 2 ans) et 38 % (2 à 4 et 5 à 17 ans) des cas d'IIP ont été causés par les 7 sérotypes (8, 10A, 11A, 12F, 15B/C, 22F et 33F) contenus dans le PNEU-C-20 et non dans le PNEU-C-13. Immunogénicité Innocuité Analyse économique |
|
| PNEU-C-13 | Épidémiologie Faisabilité |
| Force de recommandation | Forte | Discrétionnaire |
|---|---|---|
| Libellé | « devrait/ne devrait pas être proposé » | « peut/peut ne pas être proposé » |
| Justification | Les avantages connus/prévus l'emportent sur les inconvénients connus/prévus (« devrait »), OU Les inconvénients connus/prévus l'emportent sur les avantages connus/prévus (« ne devrait pas »). |
Les avantages connus/prévus sont à peu près équivalents aux inconvénients connus/prévus, OU Les données probantes n'indiquent pas avec certitude les avantages et des inconvénients. |
| Implications | Une recommandation forte s'applique à la majeure partie des populations/personnes et doit être suivie, à moins qu'il n'existe une justification claire et convaincante d'utiliser une autre approche. | Une recommandation discrétionnaire peut être proposée pour certaines populations/personnes dans certaines circonstances. D'autres approches peuvent être acceptables. |
| Âge au moment de la présentation pour la vaccination | Nombre de doses de PNEU-C reçues précédemment | Calendrier recommandé pour le PNEU-C-20Note de bas de page b |
|---|---|---|
| 2 mois à moins de 7 mois | 0 dose | 3 doses + 1 dose à 12 à 15 mois |
| 1 dose | 2 doses + 1 dose à 12 à 15 mois | |
| 2 doses | 1 dose + 1 dose à 12 à 15 mois | |
| 7 mois à moins de 12 mois | 0 doses | 2 doses + 1 dose à 12 à 15 mois |
| 1 dose | 1 dose entre 7 et moins de 12 mois + 1 dose à 12 à 15 mois | |
| 2 doses | 1 dose à 12 à 15 mois | |
| 12 mois à moins de 24 mois | 0 dose | 2 doses |
| 1 dose à moins de 12 mois | ||
| 2 doses ou plus à moins de 12 mois | 1 dose | |
| 0 ou 1 dose à moins de 12 mois ET 1 dose à 12 mois ou plus | ||
| 24 mois à moins de 60 mois (5 ans) |
0 dose de PNEU-C-20 | 1 dose |
| 5 ans à moins de 18 ans | 0 dose de PNEU-C-20 | 1 dose seulement pour les enfants à haut risque |
|
||
Priorités en matière de recherche et de surveillance
- Déterminer l'impact direct (enfants vaccinés) et indirect (enfants et adultes non vaccinés) des programmes PNEU-C-15 et PNEU-C-20 sur le fardeau de la maladie (OMA, PEH, IIP) chez les personnes présentant ou non des facteurs de risque d'infection invasive
- Déterminer les corrélats immunologiques de la protection contre les différentes conséquences de la maladie (sévérité et manifestations de la maladie)
- Déterminer la durée de l'immunité et la nécessité d'administrer des doses supplémentaires pour les différents calendriers du PNEU-C-15 et du PNEU-C-20, y compris les programmes à calendrier mixte
- Déterminer l'impact de la vaccination avec le PNEU-C-15 et le PNEU-C-20 sur le portage et le changement de sérotype
- Déterminer les ÉI rares et très rares qui n'ont peut-être pas été signalés en raison de la taille limitée de l'échantillon dans les essais cliniques
- Améliorer la surveillance continue de l'infection à pneumocoque, y compris l'infection à pneumocoque non IIP et le portage de S. pneumoniae
Liste des abréviations
- AOP
- Activité opsonophagocytaire
- ASPC
- Agence de la santé publique du Canada
- AVAI
- Année de vie ajustée en fonction de l'incapacité
- AVAQ
- Année de vie ajustée par la qualité
- CCI
- Comité canadien d'immunisation
- GCI
- Guide canadien d'immunisation
- CCNI
- Comité consultatif national de l'immunisation
- CD
- Cadre décisionnel
- CIQ
- Comité d'immunisation du Québec
- CMG
- Concentration moyenne géométrique
- CRM197
- Corynebacterium diphtheriae
- DR
- Différence de risque
- EEFA
- Éthique, équité, faisabilité, acceptabilité
- ÉI
- Événement indésirable
- ÉIG
- Événement indésirable grave
- EP
- Efficacité potentielle
- ER
- Efficacité réelle
- ESSI
- Effets secondaires suivant l'immunisation
- eSTREP
- Surveillance nationale en laboratoire de la maladie invasive due au streptocoque
- É.-U.
- États-Unis
- GCSH
- Greffe de cellules souches hématopoïétiques
- GRADE
- Grading of Recommendations, Assessment, Development and Evaluation
- IC
- Intervalle de confiance
- IgG
- Immunoglobuline G
- IIP
- Infection invasive à pneumocoque
- IMPACT
- Programme canadien de surveillance active de l'immunisation
- LNM
- Laboratoire national de microbiologie
- MGT
- Moyenne géométrique des titres
- OMA
- Otite moyenne aiguë
- PD (post dose)
- Après la dose
- PD2
- Après la dose 2
- PD3
- Après la dose 3
- PD4
- Après la dose 4
- PEH
- Pneumonie extrahospitalière
- PEHP
- Pneumonie extrahospitalière à pneumocoque
- PI
- Personne immunodéprimée
- PNEU-C
- Vaccin contre le pneumocoque conjugué
- PNEU-C-10
- Vaccin contre le pneumocoque conjugué 10-valent
- PNEU-C-13
- Vaccin contre le pneumocoque conjugué 13-valent
- PNEU-C-15
- Vaccin contre le pneumocoque conjugué 15-valent
- PNEU-C-20
- Vaccin contre le pneumocoque conjugué 20-valent
- PNEU-P
- Vaccin contre le pneumocoque polysaccharidique
- PNEU-P-23
- Vaccin contre le pneumocoque polysaccharidique 23-valent
- PP
- Pneumonie à pneumocoque
- RB
- Risque de biais
- RC
- Rapport de cotes
- RCED
- Rapport coût/efficacité différentiel
- RR
- Risque relatif
- SCI
- Surveillance circumpolaire internationale
- SCSMDO
- Système canadien de surveillance des maladies à déclaration obligatoire
- SSÉ
- Statut socio-économique
- ST
- Sérotype
- ST3
- Sérotype 3
- TI
- Taux d'incidence
- T.N.-O.
- Territoires du Nord-Ouest
- TNV
- Type non vaccinal
- VIH
- Virus de l'immunodéficience humaine
Remerciements
La présente déclaration a été préparée par : A Wierzbowski, M Salvadori, O Baclic, E Wong, A Tuite, N Islam, G Gebretekle, R Pless, A Howarth, M Hersi, A Stevens, K Young et K Hildebrand au nom du CCNI.
Le CCNI tient à remercier pour leur contribution : C Tremblay, M Tunis, F Khan, R Yorke, J Montroy, A Haynes ainsi que A Golden, I Martin, K Franklin, C Primeau, M Laverty, G Metz et d'autres membres du Laboratoire national de microbiologie (LNM) de l'ASPC et des équipes de la Surveillance des maladies évitables par la vaccination (SMÉV).
Groupe de travail du CCNI sur le pneumocoque
Membres du Groupe de travail du CCNI sur le pneumocoque : K Hildebrand (présidente), J Papenburg, P De Wals, N Brousseau, J Bettinger, D Fisman, J Kellner, S Rechner, G Tyrrell, A McGeer, S Nasreen et M Kobayashi (Centers for Disease Control and Prevention, É.-U.).
Représentants d'office : M Knight (Direction générale de la santé des Premières Nations et des Inuits, Services aux Autochtones Canada [SAC] Santé Canada [SC]), G Coleman (Direction des médicaments biologiques et radiopharmaceutiques, SC)), K Franklin (SMÉV), C Primeau (SMÉV), I Martin (LNM]), A Golden (LNM) et G Metz (Innocuité des vaccins).
Participants de l'ASPC : E Wong, A Wierzbowski, R Pless, O Baclic, M Tunis, A Stevens, G Gebretekle, N Islam, J Montroy, A Tuite, F Crane, F Khan, M Hersi, A Simmons et C Tremblay.
CCNI
Membres du CCNI : S Deeks (présidente), R Harrison (vice-présidente), M Andrew, J Bettinger, N Brousseau, H Decaluwe, P De Wals, E Dubé, V Dubey, K Hildebrand, K Klein, M O'Driscoll, J Papenburg, A Pham-Huy, B Sander et S Wilson.
Représentants de liaison : L Bill/M Nowgesic (Canadian Indigenous Nurses Association), LM Bucci (Association canadienne de santé publique), S Buchan (Association canadienne pour la recherche, l'évaluation et l'éducation en immunisation), E Castillo (Société des obstétriciens et gynécologues du Canada), J Comeau (Association pour la microbiologie médicale et l'infectiologie Canada), J MacNeil (Center for Disease control and Prevention, É.-U.), M Osmack (Indigenous Physicians Association of Canada), J Potter (Collège des médecins de famille du Canada), M Lavoie (Conseil des médecins hygiénistes en chef), D Moore (Société canadienne de pédiatrie), M Naus (Comité canadien d'immunisation) et A Ung (Association des pharmaciens du Canada).
Représentants d'office : V Beswick-Escanlar (Défense nationale et Forces armées canadiennes), E Henry (Centre des programmes de l'immunisation [CIP], ASPC), M Lacroix (Groupe consultatif en matière d'éthique en santé publique, ASPC), C Pham (Direction des médicaments biologiques et radiopharmaceutiques, SC), S Ogunnaike-Cooke (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), P Fandja (Direction des produits de santé commercialisés, SC), M Routledge (LNM, ASPC) et T Wong (Direction générale de la santé des Premières Nations et des Inuits, SAC).
Annexe : Tableaux
| Étude | Comparaisons | Plan de l'étude | Participants |
|---|---|---|---|
V114-008 : Une étude visant à évaluer l'innocuité, la tolérabilité et l'immunogénicité de 2 lots de V114 chez des nourrissons en bonne santéNote de bas de page 19 |
Lot 1 du PNEU-C-15 Série de 4 doses par groupe |
Phase 2, randomisée à PNEU-C-15 Lot 1 (N=351), PNEU-C-15 Lot 2 (N=350) ou PNEU-C-13 (N=350) |
Nourrissons de 42 à 90 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Sexe (étude totale) : 49,8 % de femmes Les auteurs affirment que les caractéristiques démographiques des participants étaient semblables entre les groupes. |
V114-023 : Une étude visant à évaluer l'innocuité, la tolérabilité et l'immunogénicité du V114 chez les enfants atteints de drépanocytoseNote de bas de page 28. |
PNEU-C-15 c. |
Phase 3, randomisée à une (1) dose unique de PNEU-C-15 (N=70) ou de PNEU-C-13 (N=34) |
Enfants de 5 à 17 ans, atteints de drépanocytose et n'ayant jamais reçu de vaccin contre le pneumocoque (selon la définition de l'essai : n'ayant pas reçu de vaccin dans les 3 ans précédant l'entrée dans l'étude). Sexe (étude totale) : 45,6 % de femmes Le rapport de l'étude clinique indique que les données démographiques des participants étaient semblables dans les 2 groupes. |
V114-024 : Innocuité et immunogénicité des régimes de vaccination de rattrapage du V114Note de bas de page 27 |
PNEU-C-15 c. PNEU-C-13 7 à 11 mois : Série de 3 doses par groupe |
Phase 3, |
Enfants de 7 à 11 mois ou de 12 à 23 mois en bonne santé n'ayant jamais reçu de vaccin. Enfants de 2 à 17 ans en bonne santé, n'ayant jamais reçu de vaccin contre le pneumocoque ou ayant déjà été vaccinés. |
V114-025 : Innocuité, tolérabilité et immunogénicité du V114 chez des nourrissons en bonne santéNote de bas de page 20 |
PNEU-C-15 c. PNEU-C-13 Nourrissons à terme (supérieur ou égal à 37 semaines d'âge gestationnel à la naissance) : série de 3 doses par groupe Nourrissons prématurés (inférieur à 37 semaines d'âge gestationnel) : série de 4 doses par groupe |
Phase 3, randomisé à PNEU-C-15 (N=591) ou PNEU-C-13 (N=593) |
Nourrissons de 42 à 90 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque. Sexe (étude totale) : 48,2 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
V114-027 : Une étude visant à évaluer l'interchangeabilité du V114 et du Prevnar13MD chez des nourrissons en bonne santéNote de bas de page 21 |
PNEU-C-15 (4 doses) |
Phase 3, randomisé à PNEU-C-15 (4 doses; N=180) ou Total randomisé : 900 |
Nourrissons de 42 à 90 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque. |
V114-029 : Innocuité, tolérabilité et immunogénicité du V114 chez des nourrissons en bonne santéNote de bas de page 22 |
PNEU-C-15 c. PNEU-C-13 Série de 4 doses par groupe |
Phase 3, randomisé pour le PNEU-C-15 (N=860) ou le PNEU-C-13 (N=860) |
Nourrissons de 42 à 90 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque. Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
V114-030 : Innocuité et immunogénicité du V114 chez les enfants infectés par le virus de l'immunodéficience humaineNote de bas de page 29 |
PNEU-C-15 + PNEU-P-23 c. PNEU-C-13 + PNEU-P-23 Série de 2 doses par groupe (première dose = vaccin PNEU-C; deuxième dose = vaccin PNEU-23) |
Phase 3, randomisé à PNEU-C-15 + PNEU-P-23 (N=203) ou PNEU-C-13 + PNEU-P-23 (N=204) Total randomisé = 407 |
Enfants de 6 à 17 ans, porteurs du virus de l'immunodéficience humaine et n'ayant jamais été vaccinés, précédemment vaccinés avec le PNEU-C inférieur à 13-valent, partiellement vaccinés avec le PNEU-C-13, ou ayant des antécédents de vaccination avec le PNEU-C-13 supérieur ou égal à 3 ans avant la visite 2 (jour 1). Sexe (étude totale) : 47,9 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
V114-031 : Une étude visant à évaluer l'innocuité et la tolérabilité du V114 et du Prevnar13MD chez des nourrissons en bonne santéNote de bas de page 30. |
PNEU-C-15 c. PNEU-C-13 |
Phase 3, randomisé à PNEU-C-15 (N=1972) ou PNEU-C-13 (N=437) |
Nourrissons de 42 à 90 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
B7471003 : Essai d'évaluation de l'innocuité et de l'immunogénicité d'un vaccin contre le pneumocoque multivalent chez des nourrissons en bonne santéNote de bas de page 23 |
PNEU-C-20 c. PNEU-C-13 Série de 4 doses par groupe |
Phase 2, randomisé à PNEU-C-20 (N=232) ou PNEU-C-13 (N=228) Total randomisé = 460 |
Nourrissons de 42 à 98 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Sexe (étude totale) : 49,3 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
B7471011 : Étude d'innocuité et d'immunogénicité d'une série de 4 doses de vaccin contre le pneumocoque conjugué 20-valent chez des nourrissons en bonne santéNote de bas de page 24 |
PNEU-C-20 c. PNEU-C-13 Série de 4 doses par groupe |
Phase 3, randomisé à PNEU-C-20 (N=1004) ou PNEU-C-13 (N=993) Total randomisé = 1997 |
Nourrissons de 42 à 98 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Sexe (étude totale) : 48,5 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
B7471012 : Étude d'innocuité et d'immunogénicité d'une série de 3 doses de vaccin contre le pneumocoque conjugué 20-valent chez des nourrissons en bonne santéNote de bas de page 25 |
PNEU-C-20 c. PNEU-C-13 Série de 3 doses par groupe |
Phase 3, randomisé à PNEU-C-20 (N=603) ou PNEU-C-13 (N=604) Total randomisé = 1 207 |
Nourrissons de 42 à 112 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Sexe (étude totale) : 49,3 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
B7471013 : Étude d'innocuité du vaccin contre le pneumocoque conjugué 20-valent chez des nourrissons en bonne santéNote de bas de page 26 |
PNEU-C-20 c. PNEU-C-13 Série de 4 doses par groupe |
Phase 3, randomisé à PNEU-C-20 (N=1006) ou PNEU-C-13 (N=505) Total randomisé = 1511 |
Nourrissons de 42 à 98 jours inclusivement, en bonne santé et n'ayant jamais reçu de vaccin contre le pneumocoque Sexe (étude totale) : 49,4 % de femmes Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. |
B7471014 : Étude d'innocuité et d'immunogénicité du PNEU-C 20-valent chez des enfants en bonne santé de 15 mois à 17 ansNote de bas de page 31 |
PNEU-C-20 (avant et après la vaccination) Une (1) dose par groupe |
Phase 3, supérieur ou égal à 15 à inférieur à 24 mois : PNEU-C-20 (N=210) Total randomisé = 839 |
Cohorte 1 et 2 : enfants de supérieur ou égal à 15 mois à inférieur à 5 ans, en bonne santé, ayant déjà reçu au moins 3 doses de PNEU-C-13, la dernière dose ayant été administrée supérieur à 2 mois avant l'inscription à l'étude. Exclu si le participant a déjà reçu un vaccin contre le pneumocoque expérimental ou le vaccin PNEU-P-23 Cohorte 3 et 4 : enfants de supérieur ou égal à 5 ans à inférieur à 18 ans, en bonne santé. Exclu si le participant a déjà reçu un vaccin contre le pneumocoque expérimental ou le vaccin PNEU-P-23 Sexe (étude totale) : Le rapport de l'étude clinique indique que les caractéristiques démographiques des participants étaient semblables dans les 2 groupes. Il y avait un taux légèrement plus élevé de participants masculins dans chaque cohorte d'âges, à l'exception des participants de supérieur ou égal à 2 à inférieur à 5 ans (Cohorte 2, dont la répartition était à peu près égale). |
| Résultat mesuré | Enfants en bonne santé |
|---|---|
Ratios de MGT de l'AOP |
Aucune donnée n'a été rapportée après la dose 2. Plus faibles pour 11/13 sérotypes partagés après la dose 3, plus élevés pour ST3 et ST14 après la dose 3. Plus élevés pour les 2 sérotypes uniques |
Ratios de CMG d'IgG |
Diminution pour 9/13 sérotypes partagés, 11/13 après les doses 2 et 3, respectivement; augmentation pour ST23F après la dose 2, et pour ST3 après les doses 2 et 3; résultats divergents ou non concluants pour les autres sérotypes. Plus élevée pour les 2 sérotypes uniques après les doses 2 et 3 |
% de sérorépondeurs : sérotypes partagés |
Diminution pour 3/13 et 6/13 sérotypes partagés après les doses 2 et 3, respectivement; augmentation pour ST23F après la dose 2, et pour ST3 après les doses 2 et 3; résultats non concluants pour les autres sérotypes |
% de sérorépondeurs : sérotypes uniques |
Plus élevée pour les sérotypes uniques après les doses 2 et 3 |
ÉIG liés au vaccin |
PNEU-C-15, N= 0/587 |
Nombre total d'ÉIG |
PNEU-C-15, N= 57/587 |
Décès |
Aucun décès n'a été observé. |
| Résultat mesuré | Enfants en bonne santé et enfants immunocompétents à haut risque | Enfants immunodéprimés |
|---|---|---|
| Ratios de MGT de l'AOP | Déclassement pour 4/13 et 10/13 sérotypes partagés après les doses 3 et 4, respectivement; augmentation pour ST3 après la dose 3, mais diminution après la dose 4; résultats divergents pour les autres sérotypes. Plus élevés pour les 2 sérotypes uniques après les doses 3 et 4. | |
| Aucune évaluation GRADE | ||
| Ratios de CMG d'IgG | Plus faibles pour 5/13 sérotypes partagés après les doses 3 et 4; plus élevés pour ST3 après les doses 3 et 4; résultats divergents ou non concluants pour les autres sérotypes. Plus élevés pour les 2 sérotypes uniques après les doses 3 et 4. | |
| Degré de certitude modérée des données probantes (les 2 doses) | Certitude faible des données probantes (pour les 2 doses) | |
| % de sérorépondeurs : sérotypes partagés | Résultats divergents ou non concluants pour 12/13 sérotypes partagés après les doses 3 et 4; plus élevés pour ST3 après les doses 3 et 4. | |
| Certitude modérée des données probantes (dose 3), faible certitude des données probantes (dose 4) | Certitude faible des données probantes (dose 3), certitude très faible des données probantes (dose 4) | |
| % de sérorépondeurs : sérotypes uniques | Plus élevés pour les sérotypes uniques après les doses 3 et 4. | |
| Degré de certitude modérée des données probantes (les 2 doses) | Certitude faible des données probantes (pour les 2 doses) | |
| ÉIG liés au vaccin à 6 mois | PNEU-C-15, N= 4/3699 |
|
| Degré de certitude élevée des données probantes | Degré de certitude modérée des données probantes | |
| Nombre total d'ÉIG à 6 mois | PNEU-C-15, N= 338/3699 |
|
| Degré de certitude modérée des données probantes | Faible certitude des données probantes | |
| Décès à 6 mois | PNEU-C-15, N= 3/3699 |
|
| Degré de certitude élevée des données probantes | Degré de certitude modérée des données probantes | |
| Résultat mesuré | Enfants en bonne santé |
|---|---|
| Ratios de MGT de l'AOP Aucune évaluation GRADE |
Plus faibles pour 13/13 et 12/13 sérotypes partagés après les doses 2 et 3, respectivement; plus élevés pour ST19A après la dose 3. Plus élevés pour tous les sérotypes uniques après les doses 2 et 3. |
| Ratios de CMG d'IgG Degré de certitude modérée des données probantes (les 2 doses) |
Plus faible pour 13/13 sérotypes partagés après les doses 2 et 3; plus élevée pour tous les sérotypes uniques après les doses 2 et 3. |
| % de sérorépondeurs : sérotypes partagés Certitude modérée des données probantes (dose 2), faible certitude des données probantes (dose 3) |
Plus faible pour 9/13 et 1/13 (ST3) sérotypes partagés après les doses 2 et 3, respectivement; résultats non concluants pour les sérotypes restants. |
| % de sérorépondeurs : sérotypes uniques Degré de certitude modérée des données probantes (les 2 doses) |
Plus élevée pour tous les sérotypes uniques après les doses 2 et 3. |
| ÉI liés au vaccin Degré de certitude modérée des données probantes |
PNEU-C-20, N= 1/601 |
| Nombre total d'ÉIG Faible certitude des données probantes |
PNEU-C-20, N= 34/601 |
Décès |
Aucun décès n'a été observé. |
| Résultat mesuré | Enfants en bonne santé et enfants immunocompétents à haut risque | Enfants immunodéprimés |
|---|---|---|
| Ratios de MGT de l'AOP | Plus faibles pour 8/13 et 12/13 sérotypes partagés après les doses 3 et 4, respectivement. Plus élevés pour les 2 sérotypes uniques après les doses 3 et 4. | |
| Aucune évaluation GRADE | ||
| Ratios de CMG d'IgG | Plus faibles pour 13/13 et 12/13 sérotypes partagés après les doses 3 et 4, respectivement; plus élevés pour ST14 après la dose 4. Plus élevés pour les 2 sérotypes uniques après les doses 3 et 4. | |
| Degré de certitude modérée des données probantes (les 2 doses) | Certitude faible des données probantes (pour les 2 doses) | |
| % de sérorépondeurs : sérotypes partagés | Résultats divergents ou non concluants pour 8/13 et 2/13 sérotypes partagés après les doses 3 et 4, respectivement; résultats non concluants pour les autres sérotypes. | |
| Certitude modérée des données probantes (dose 3), faible certitude des données probantes (dose 4) | Certitude faible des données probantes (dose 3), certitude très faible des données probantes (dose 4) | |
| % de sérorépondeurs : sérotypes uniques | Plus élevés pour les sérotypes uniques après les doses 3 et 4. | |
| Degré de certitude modérée des données probantes (les 2 doses) | Certitude faible des données probantes (pour les 2 doses) | |
| ÉIG liés au vaccin à 6 mois | Aucun effet lié au vaccin n'a été observé. | |
| Degré de certitude modérée des données probantes | Faible certitude des données probantes | |
| Nombre total d'ÉIG à 6 mois | PNEU-C-20, N= 101/2232 |
|
| Faible certitude des données probantes | Très faible certitude des données probantes | |
| Décès à 6 mois | Aucun décès n'a été observé. | |
| Degré de certitude modérée des données probantes | Faible certitude des données probantes | |
| Résultats | Résumé des résultats | Commentaires/résumé | ||||
|---|---|---|---|---|---|---|
| Numéro d'étude, Plan de l'étude |
PNEU-C-15 | PNEU-C-13 | Répercussion - quantitative ou narrative | Certitude des données probantes | ||
| Jusqu'à 6 mois après le vaccin, analyse par protocole : Calendrier de 2+1 | ||||||
| ÉIG liés au vaccin | Évaluation (Év.) GRADE : 1 ECR (V114-025)Note de bas de page 20 |
N=0/587 | N=1/591 | Effets relatifs : RC de Peto : 0,14 (0,00 à 6,87) |
ModéréeNote de bas de page a |
Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. |
| Total d'ÉIG | Év. GRADE : 1 ECR (V114-025)Note de bas de page 20 |
N=57/587 | N=70/591 | Effets relatifs : RR 0,82 (0,59 à 1,14) |
ModéréeNote de bas de page b | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. |
| Décès | Év. GRADE : |
N=0/587 | N=0/591 | Aucun décès n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. |
| Jusqu'à 6 mois après le vaccin, analyse par protocole : Calendrier de 3+1 | ||||||
| ÉIG liés au vaccin | Év. GRADE : |
N=4/3 699 | N=0/1 814 | Effets relatifs : RC de Peto : 4,01 (0,41 à 39,22) Effets absolus : 0 pour 1 000 (0 à 0) |
Élevée | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. |
| ModéréeNote de bas de page d pour une personnes immunodéprimée (PI) | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. | |||||
| Total d'ÉIG | Év. GRADE : |
N=338/3 699 | N=162/1 814 | Effets relatifs : RR 1,03 (0,86 à 1,24) Effets absolus : 3 de moins pour 1 000 (13 de moins à 21 de plus) |
ModéréeNote de bas de page c | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. |
| FaibleNote de bas de page cNote de bas de page d pour une PI | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. | |||||
| Décès | Év. GRADE : |
N=3/3 699 | N=2/1 814 | Effets relatifs : RC de Peto : 0,74 (0,11 à 5,15) Effets absolus : 0 pour 1 000 (1 de moins à 5 de plus) |
Élevée | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. |
| ModéréeNote de bas de page d pour une PI | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. | |||||
|
||||||
| Résultats | Résumé des résultats | Commentaires/résumé | ||||
|---|---|---|---|---|---|---|
| Numéro d'étude, Plan de l'étude |
PNEU-C-15 | PNEU-C-13 | Répercussion - quantitative ou narrative | Certitude des données probantes | ||
| Jusqu'à 6 mois après le vaccin, analyse par protocole | ||||||
| ÉIG liés au vaccin | Évaluation (Év.) GRADE : 2 ECR (V114-023, V114-030)Note de bas de page 28Note de bas de page 29 |
N=0/272 | N=0/238 | Aucun effet lié au vaccin n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. |
| Total d'ÉIG | Év. GRADE : 2 ECR (V114-023, V114-030)Note de bas de page 28Note de bas de page 29 |
N=14/272 | N=9/238 | Effets relatifs : RR 0,81 (0,38 à 1,72) |
ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. |
| Décès | Év. GRADE : 2 ECR (V114-023, V114-030)Note de bas de page 28Note de bas de page 29 |
N=0/272 | N=0/238 | Aucun décès n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. |
|
||||||
| Résultats | Résumé des résultats | Commentaires/résumé | ||||
|---|---|---|---|---|---|---|
| Numéro d'étude, Plan de l'étude |
PNEU-C-20 | PNEU-C-13 | Répercussion - quantitative ou narrative | Certitude des données probantes | ||
| Jusqu'à 6 mois après le vaccin, analyse par protocole : Calendrier de 2+1 | ||||||
| ÉIG liés au vaccin | Évaluation (Év.) GRADE : 1 ECR (B7471012)Note de bas de page 25 |
N=1/601 | N=0/603 | Effets relatifs : RC de Peto 7,41 (0,15 à 373,63) Effets absolus : 0 pour 1 000 (0 de moins à 10 de plus) |
ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. |
| Total d'ÉIG | Év. GRADE : 1 ECR (B7471012)Note de bas de page 25 |
N=34/601 | N=40/603 | Effets relatifs : RR 0,85 (0,55 à 1,33) Effets absolus : 10 de moins pour 1 000 (30 de moins à 22 de plus) |
FaibleNote de bas de page b | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. |
| Décès | Év. GRADE : 1 ECR (B7471012)Note de bas de page 25 |
N=0/601 | N=0/603 | Aucun décès n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. |
| Jusqu'à 6 mois après le vaccin, analyse par protocole : Calendrier de 3+1 | ||||||
| ÉIG liés au vaccin | Év. GRADE : 3 ECR (B474-1003, B7471011, B7471013)Note de bas de page 23Note de bas de page 24Note de bas de page 26 |
N=0/2 232 | N=0/1 717 | Aucun effet lié au vaccin n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. |
| Faible pour une PINote de bas de page aNote de bas de page c | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG liés aux vaccins. | |||||
| Total d'ÉIG | Év. GRADE : 3 ECR (B474-1003, B7471011, B7471013)Note de bas de page 23Note de bas de page 24Note de bas de page 26 |
N=101/2 232 | N=64/1 717 | Effets relatifs : RR 1,24 (0,71 à 2,15) Effets absolus : 9 de plus pour 1 000 (11 de moins à 43 de plus) |
FaibleNote de bas de page dNote de bas de page e | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG. |
| Très faible pour une PINote de bas de page cNote de bas de page dNote de bas de page e | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les ÉIG, mais les données probantes sont très incertaines. | |||||
| Décès | Év. GRADE : 3 ECR (B474-1003, B7471011, B7471013)Note de bas de page 23Note de bas de page 24Note de bas de page 26 |
N=0/2 232 | N=0/1 717 | Aucun décès n'a été observé | ModéréeNote de bas de page a | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. |
| Faible pour une PINote de bas de page aNote de bas de page c | Il se peut qu'il y ait peu ou aucune différence entre les vaccins en ce qui concerne les décès. | |||||
|
||||||
| Mesure de l'immunogénicité | Résultats PNEU-C-15 | Résultats PNEU-C-20 |
|---|---|---|
| Ratios de CMG d'IgG |
|
|
| % de sérorépondeurs Sérotypes partagés |
|
|
| % de sérorépondeurs Sérotypes uniques |
|
|
| Ratios de MGT de l'AOPNote de bas de page a |
|
|
|
||
Références
- Note de bas de page 1
-
Statistique Canada. Enquête nationale sur la couverture vaccinale des enfants, 2021 [Internet]. Ottawa (ON) : Gouvernement du Canada; 12 juin 2023 [cité le 19 juin 2023]. Disponible à : https://www150.statcan.gc.ca/n1/daily-quotidien/230612/dq230612b-fra.htm.
- Note de bas de page 2
-
Agence de la santé publique du Canada (ASPC). Objectifs nationaux de couverture vaccinale et cibles nationales de réduction des maladies évitables par la vaccination d'ici 2025 [Internet]. Ottawa (ON) : Gouvernement du Canada; 26 août 2022 [cité le 26 juin 2023]. Disponible à : https://www.canada.ca/fr/sante-publique/services/priorites-immunization-et-vaccins/strategie-nationale-immunisation/vaccination-objectifs-nationaux-couverture-vaccinale-cibles-nationales-reduction-maladies-evitables-2025.html.
- Note de bas de page 3
-
Comité consultatif national de l'immunisation (CCNI). Comité consultatif national de l'immunisation (CCNI) : Méthodes et processus [Internet]. Ottawa (ON) : Gouvernement du Canada; 12 avril 2023 [cité le 26 juin 2023]. Disponible à : https://www.canada.ca/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/methodes-processus.html.
- Note de bas de page 4
-
Golden A, Griffith A, Demczuk W, Lefebvre B, McGeer A, Tyrrell G, et al. Maladies invasives à pneumocoques au Canada, 2020 Relevé des maladies transmissibles au Canada. Sept. 2022;48(9) :396-406. https://www.canada.ca/content/dam/phac-aspc/documents/services/reports-publications/canada-communicable-disease-report-ccdr/monthly-issue/2022-48/issue-9-september-2022/ccdrv48i09a04f-fra.pdf.
- Note de bas de page 5
-
ACIP Updates: Recommendations for Use of 20-Valent Pneumococcal Conjugate Vaccine in Children – É.-U., 2023. (en anglais uniquement) MMWR Morb Mortal Wkly Rep. 29 sept. 2023;72(39) :1 072. https://doi.org/10.15585/mmwr.mm7239a5.
- Note de bas de page 6
-
Expert Committee on Biological Standardization. Recommendations for the production and control of pneumococcal conjugate vaccines [Internet]. (en anglais uniquement) Genève (CH) : Organisation mondiale de la santé; 2009 [cité le 23 juin 2023]. Disponible à : https://www.who.int/docs/default-source/biologicals/vaccine-quality/48-pneumo-final-23april-2010.pdf?sfvrsn=6f700ed5_1.
- Note de bas de page 7
-
Merck Canada Inc. Monographie de produit : Pneumovax23 (vaccin polyvalent antipneumococcique, norme de MSD) [Internet]. Kirkland (QC) : Merck Canada Inc; 15 avril 2016 [cité le 26 juin 2023]. Disponible à : https://www.merck.ca/fr/wp-content/uploads/sites/83/2021/04/PNEUMOVAX-PM_F.pdf.
- Note de bas de page 8
-
GlaxoSmithKline Inc. Monographie de produit : Vaccin antipneumococcique conjugué Synflorix (polysaccharides conjugués à une protéine D dérivée d'une souche non typable de Haemophilus influenzae, à l'anatoxine diphtérique ou à l'anatoxine tétanique) adsorbé [Internet]. Mississauga (ON) : GlaxoSmithKline Inc; 13 nov. 2019 [cité le 26 juin 2023]. Disponible à : https ://ca.gsk.com/media/6466/synflorix.pdf.
- Note de bas de page 9
-
Pfizer Canada ULC. Monographie du produit : Prevnar13 Vaccin antipneumococcique triskaïdécavalent conjugué (protéine diphtérique CRM197) [Internet]. Kirkland (QC) : Pfizer Canada ULC; 8 août 2019 [cité le 26 juin 2023]. Disponible à : https ://webfiles.pfizer.com/file/96374aec-10ae-4d05-85c5-65697c679702?referrer=ccb731e5-4f2d-4f4a-b2dc-e5e912145fc6.
- Note de bas de page 10
-
Merck Canada Inc. Monographie de produit : Vaxneuvance (vaccin antipneumococcique 15-valent conjugué [protéine CRM197], absorbé) [Internet]. Kirkland (QC) : Merck Canada Inc; 8 juil. 2022 [cité le 26 juin 2023]. Disponible à : https://www.merck.ca/fr/wp-content/uploads/sites/83/2022/10/VAXNEUVANCE-PM_F.pdf.
- Note de bas de page 11
-
Pfizer Canada ULC. Monographie du produit : Prevnar20 Vaccin antipneumococcique triskaïdécavalent conjugué (protéine diphtérique CRM197) [Internet]. Kirkland (QC) : Pfizer Canada ULC; 9 mai 2022 [cité le 26 juin 2023]. Disponible à : https://webfiles.pfizer.com/file/4e2b41d3-808c-400e-bb3f-92774f08a235?referrer=ccb731e5-4f2d-4f4a-b2dc-e5e912145fc6.
- Note de bas de page 12
-
Pelton SI, Weycker D, Farkouh RA, Strutton DR, Shea KM, Edelsberg J. Risk of pneumococcal disease in children with chronic medical conditions in the era of pneumococcal conjugate vaccine. Clin Infect Dis. 1er sept. 2014;59(5) :615-23. https://doi.org/10.1093/cid/ciu348.
- Note de bas de page 13
-
National Center for Immunization and Respiratory Diseases. EtR framework for PCV20 use in children aged 2–18 years with certain underlying conditions that increase the risk of pneumococcal disease [Internet]. (en anglais uniquement) Atlanta (GA) : Centers for Disease Control and Prevention; 12 sept. 2023 [cité le 23 nov. 2023]. Disponible à : https://www.cdc.gov/vaccines/acip/recs/grade/PCV20-child-risk-based-etr.html.
- Note de bas de page 14
-
Nasreen S, Wang J, Sadarangani M, Kwong JC, Quach C, Crowcroft NS et al. Estimating population-based incidence of community-acquired pneumonia and acute otitis media in children and adults in Ontario and British Columbia using health administrative data, 2005-2018: a Canadian Immunisation Research Network (CIRN) study. (en anglais uniquement) BMJ Open Respir Res. Juin 2022;9(1) :e001218. https://doi.org/10.1136/bmjresp-2022-001218.
- Note de bas de page 15
-
King L. Pediatric outpatient ARI visits and antibiotic use attributable to serotypes in higher valency PCVs [slides presented at Advisory Committee on Immunization Practices (ACIP) meeting Feb. 22, 2023]. [Internet]. (en anglais uniquement) Atlanta (GA) : Centers for Disease Control and Prevention (CDC); 22 févr. 2023 [cité le 12 septembre 2023]. Disponible à : https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2023-02/slides-02-22/Pneumococcal-03-King-508.pdf.
- Note de bas de page 16
-
LeBlanc JJ, ElSherif M, Ye L, MacKinnon-Cameron D, Ambrose A, Hatchette TF et al. Recalibrated estimates of non-bacteremic and bacteremic pneumococcal community acquired pneumonia in hospitalized Canadian adults from 2010 to 2017 with addition of an extended spectrum serotype-specific urine antigen detection assay. (en anglais uniquement) Vaccine. 20 avril 2022;40(18) :2635-46. https://doi.org/10.1016/j.vaccine.2022.02.081.
- Note de bas de page 17
-
Kim SH, Jeon EJ, Hong SM, Bae CH, Lee HY, Park MK et al. Bacterial Species and Antibiotic Sensitivity in Korean Patients Diagnosed with Acute Otitis Media and Otitis Media with Effusion. (en anglais uniquement) J Korean Med Sci. Avril 2017;32(4) :672-8. https://doi.org/10.3346/jkms.2017.32.4.672.
- Note de bas de page 18
-
Merck Sharp & Dohme LLC. A Study to Evaluate the Safety, Tolerability, and Immunogenicity of V114 in Allogeneic Hematopoietic Stem Cell Transplant Recipients (V114-022/PNEU-STEM) [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 2022 [cité le 26 juin 2023]. Disponible à : https://clinicaltrials.gov/ct2/show/study/NCT03565900.
- Note de bas de page 19
-
Platt HL, Greenberg D, Tapiero B, Clifford RA, Klein NP, Hurley DC et al. A Phase II Trial of Safety, Tolerability and Immunogenicity of V114, a 15-Valent Pneumococcal Conjugate Vaccine, Compared With 13-Valent Pneumococcal Conjugate Vaccine in Healthy Infants. (en anglais uniquement) Pediatr Infect Dis J. août 2020;39(8) :763-70. https://doi.org/10.1097/INF.0000000000002765.
- Note de bas de page 20
-
Martinon-Torres F, Wysocki J, Szenborn L, Carmona-Martinez A, Poder A, Dagan R et al. A Phase III, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of V114 compared with PCV13 in healthy infants (PNEU-PED-EU-1). (en anglais uniquement) Vaccine. 16 mai 2023;41(21) :3387-98. https://doi.org/10.1016/j.vaccine.2023.04.036.
- Note de bas de page 21
-
Bili A, Dobson S, Quinones J, Phongsamart W, Oberdorfer P, Kosalaraksa P et al. A phase 3, multicenter, randomized, double-blind study to evaluate the interchangeability of V114, a 15-valent pneumococcal conjugate vaccine, and PCV13 with respect to safety, tolerability, and immunogenicity in healthy infants (PNEU-DIRECTION). (en anglais uniquement) Vaccine. 16 janvier 2023;41(3) :657-65. https://doi.org/10.1016/j.vaccine.2022.10.072.
- Note de bas de page 22
-
Lupinacci R, Rupp R, Wittawatmongkol O, Jones J, Quinones J, Ulukol B et al. A phase 3, multicenter, randomized, double-blind, active-comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of a 4-dose regimen of V114, a 15-valent pneumococcal conjugate vaccine, in healthy infants (PNEU-PED). (en anglais uniquement) Vaccine. 27 janv. 2023;41(5) :1142-52. https://doi.org/10.1016/j.vaccine.2022.12.054.
- Note de bas de page 23
-
Senders S, Klein NP, Lamberth E, Thompson A, Drozd J, Trammel J et al. Safety and Immunogenicity of a 20-valent Pneumococcal Conjugate Vaccine in Healthy Infants in the United States. (en anglais uniquement) Pediatr Infect Dis J. 1er oct. 2021;40(10) :944-51. https://doi.org/10.1097/INF.0000000000003277.
- Note de bas de page 24
-
Pfizer. 20-valent Pneumococcal Conjugate Vaccine Safety and Immunogenicity Study of a 4-Dose Series in Healthy Infants [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 3 nov. 2022 [cité le 26 juin 2023]. Disponible à : https ://clinicaltrials.gov/study/NCT04382326.
- Note de bas de page 25
-
Pfizer. 20-valent Pneumococcal Conjugate Vaccine Safety and Immunogenicity Study of a 3-Dose Series in Healthy Infants [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 5 juin 2023 [cité le 26 juin 2023]. Disponible à : https://clinicaltrials.gov/ct2/show/study/NCT04546425.
- Note de bas de page 26
-
Pfizer. 20-valent Pneumococcal Conjugate Vaccine Safety Study in Healthy Infants [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 13 juin 2023 [cité le 26 juin 2023]. Disponible à : https://clinicaltrials.gov/study/NCT04379713.
- Note de bas de page 27
-
Banniettis N, Wysocki J, Szenborn L, Phongsamart W, Pitisuttithum P, Rämet M et al. A phase III, multicenter, randomized, double-blind, active comparator-controlled study to evaluate the safety, tolerability, and immunogenicity of catch-up vaccination regimens of V114, a 15-valent pneumococcal conjugate vaccine, in healthy infants, children, and adolescents (PNEU-PLAN). (en anglais uniquement) Vaccine. 19 octobre 2022;40(44) :6315-25. https://doi.org/10.1016/j.vaccine.2022.09.003.
- Note de bas de page 28
-
Quinn CT, Wiedmann RT, Jarovsky D, Lopez-Medina E, Rodriguez HM, Papa M et al. Safety and immunogenicity of V114, a 15-valent pneumococcal conjugate vaccine, in children with SCD: a V114-023 (PNEU-SICKLE) study. (en anglais uniquement) Blood Adv. 14 févr. 2023;7(3) :414-21. https://doi.org/10.1182/bloodadvances.2022008037.
- Note de bas de page 29
-
Wilck M, Barnabas S, Chokephaibulkit K, Violari A, Kosalaraksa P, Yesypenko S et al. A phase 3 study of safety and immunogenicity of V114, a 15-valent PCV, followed by PPSV23, in children living with HIV. (en anglais uniquement) AIDS. 20 mars 2023;37(8) :1227-37. https://doi.org/10.1097/QAD.0000000000003551.
- Note de bas de page 30
-
Merck Sharp & Dohme LLC. A Study to Evaluate the Safety and Tolerability of V114 and Prevnar 13™ in Healthy Infants (V114-031/PNEU-LINK) [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 2022 [cité le 26 juin 2023]. Disponible à : https://clinicaltrials.gov/ct2/show/study/NCT03692871.
- Note de bas de page 31
-
Pfizer. Safety and Immunogenicity Study of 20vPnC in Healthy Children 15 Months Through 17 Years of Age [Internet]. (en anglais uniquement) Bethesda (MD) : ClinicalTrials.gov; 26 avril 2023 [cité le 26 juin 2023]. Disponible à : https ://clinicaltrials.gov/study/NCT04642079.
- Note de bas de page 32
-
Ismail SJ, Hardy K, Tunis MC, Young K, Sicard N, Quach C. A framework for the systematic consideration of ethics, equity, feasibility, and acceptability in vaccine program recommendations. (en anglais uniquement) Vaccine. 10 août 2020;38(36) :5 861,587 6. https://doi.org/10.1016/j.vaccine.2020.05.051.
- Note de bas de page 33
-
Haut-Commissariat des Nations unies aux droits de l'homme. Déclaration des Nations unies sur les droits des peuples autochtones [Internet]. Genève (CH) : Nations unies;13 septembre 2007 [cité le 23 juin 2023]. Disponible à : https://www.ohchr.org/fr/indigenous-peoples/un-declaration-rights-indigenous-peoples.
- Note de bas de page 34
-
Prasad N, Stoecker C, Xing W, Cho B, Leidner AJ, Kobayashi M. Public health impact and cost-effectiveness of 15-valent pneumococcal conjugate vaccine use among the pediatric population of the United States. (en anglais uniquement) Vaccine. 2 mai 2023;41(18) :2914-21. https://doi.org/10.1016/j.vaccine.2023.03.045.
- Note de bas de page 35
-
Huang M, Hu T, Weaver J, Owusu-Edusei K, Elbasha E. Cost-Effectiveness Analysis of Routine Use of 15-Valent Pneumococcal Conjugate Vaccine in the US Pediatric Population. (en anglais uniquement) Vaccines (Basel). 6 janv. 2023;11(1) :135. https ://doi.org/10.3390/vaccines11010135.
- Note de bas de page 36
-
Ayabina D. Y. Summary of three economic analyses of the use of 20-valent pneumococcal conjugate vaccine (PCV20) in children in the United States [diapositives présentées lors de la réunion du Advisory Committee on Immunization Practices (ACIP) le 22 juin 2023] [Internet]. (en anglais uniquement) Atlanta (GA) : Centers for Disease Control and Prevention (CDC); 22 juin 2023 [cité le 24 nov. 2023]. Disponible à : https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2023-06-21-23/03-Pneumococcal-Ayabina-508.pdf.
- Note de bas de page 37
-
De Wals P. Communication personnelle. 2023.
Détails de la page
- Date de modification :
