Comment effectuer un test de détection du fer ou du nickel – Notes de l’Institut canadien de conservation (ICC) 17/4
- Introduction
- Procédure : comment effectuer un essai ponctuel au papier réactif à l'aide de l'électrolyse
- Aspects scientifiques de l'électrolyse et des papiers réactifs servant à détecter les métaux
- Remerciements
- Fournisseurs
- Références
Introduction
Le fer et le nickel sont des métaux industriels. Comme ce sont tous les deux des métaux blancs magnétiques, il est impossible de les distinguer par un simple test à l'aimant. Le fer est beaucoup plus sensible à la corrosion; c'est pourquoi il est important de le détecter. Le nickel est souvent utilisé dans des alliages ou comme couche de placage. Par exemple le maillechort, un alliage métallique composé de cuivre, de nickel et de zinc, peut être détecté grâce à un test de détection du nickel. Des exemples d'objets contenant ces deux métaux sont présentés aux sections Objets contenant du fer et Objets contenant du nickel.
Les essais ponctuels utilisés pour la détection de certains métaux (comme le cuivre et le plomb) consistent simplement à toucher l'objet avec un morceau de papier réactif mouillé. Pour le fer et le nickel, les essais ponctuels sont plus compliqués parce que l'eau seule ne permet pas de dissoudre suffisamment d'ions fer ou nickel dans la solution pour que ces ions puissent être détectés. Pour les tests décrits dans la présente procédure, une pile et un processus d'électrolyse sont utilisés pour forcer la dissolution des ions métalliques dans la solution, où ils pourront être mis en évidence par un changement de couleur du papier réactif. Aucun échantillon n'est prélevé sur l'objet et aucun acide fort n'est utilisé.
L'essai ponctuel est l'une des techniques analytiques les plus simples utilisées pour détecter les métaux. La présente Note de l'ICC décrit la procédure et le matériel requis pour détecter le fer et le nickel dans les métaux, au moyen d'essais ponctuels au papier réactif commercial. La première étape consiste à effectuer un essai avec des échantillons dont on sait qu'ils contiennent du fer ou du nickel afin de s'entraîner à utiliser l'électrolyse et les papiers réactifs et de confirmer que les papiers réactifs fonctionnent correctement. On peut ensuite tester les métaux inconnus. Pour en apprendre davantage sur l'électrolyse et les essais ponctuels dans le domaine de la conservation, consulter la section Aspects scientifiques de l'électrolyse et des papiers réactifs servant à détecter les métaux.
Procédure : comment effectuer un essai ponctuel au papier réactif à l'aide de l'électrolyse
Équipement et matériel requis pour effectuer un essai ponctuel afin de détecter la présence de fer ou de nickel
- Papiers réactifs commerciaux fabriqués par Macherey-Nagel (consulter la section Fournisseurs pour savoir comment se procurer ces papiers réactifs)
- Fer (papier réactif au dipyridyle 90725)
- Nickel (Nickel 90730)
- Objet ou coupon en fer
- Objet ou coupon en nickel
- Pile de 9 volts
- Câbles d'électrolyse artisanaux fabriqués avec des pincettes en acier inoxydable et une pince crocodile; pour connaître les détails de la fabrication, voir Câbles d'électrolyse artisanaux
- Solution mère saturée de chlorure de sodium, voir Préparation de la solution mère saturée de chlorure de sodium (NaCl)
- Eau (déionisée ou distillée)
- Pincettes en plastique
- Ciseaux
- Pipettes (Pasteur ou plastique) ou compte-gouttes
- Petits récipients (par exemple, béchers jetables de 10 mL)
- Marqueur pour étiqueter les récipients
- Papier d'aluminium (facultatif)
Conseils généraux
- Porter des gants jetables afin d'éviter de toucher le papier réactif et les métaux à mains nues.
- Choisir une partie peu visible de l'objet pour effectuer le test, au cas où ce dernier y laisserait une marque.
- Découper des petits morceaux de forme triangulaire dans une feuille de papier réactif. Les triangles doivent avoir une pointe aiguë afin que les marques dues au test soient le moins visibles possible.
- À l'aide d'une pipette ou d'un compte-gouttes, mouiller entièrement le papier réactif avec de l'eau. Éviter toutefois de mettre trop d'eau, car cela pourrait faire partir tout le réactif présent dans le papier.
- Utiliser des pincettes en plastique (et non en métal) pour manipuler le papier réactif, sauf pendant l'étape de l'électrolyse.
- Rincer les pincettes avec de l'eau après chaque emploi pour éviter toute contamination.
- Il pourrait être nécessaire de dégraisser la surface du métal avant d'effectuer le test, car la présence de saletés pourrait interférer avec le test. Pour ce faire, utiliser de l'eau savonneuse ou de l'acétone. Le test ne fonctionnera pas si l'objet est recouvert d'un enduit, comme de la cire ou de la laque.
- Facultatif : utiliser un microscope pour vérifier si le papier réactif change de couleur. Cela permet de faire le test sur une plus petite surface.
- Pour effectuer un test sur un objet constitué d'un métal non identifié, tester d'abord des échantillons dont on sait qu'ils contiennent du fer ou du nickel pour savoir à quoi doit ressembler la réaction et pour s'assurer que le papier réactif fonctionne encore. Conserver les échantillons de métal connu avec les papiers réactifs utilisés à cette fin.
- Facultatif : utiliser du papier d'aluminium (plié plusieurs fois, au besoin) pour empêcher que l'objet soit abîmé par les dents des pinces crocodile du fil d'électrolyse. Il est également possible de limer les dents des pinces afin d'éviter d'endommager l'objet.
Schéma du câblage pour l'électrolyse
La figure 1 ci-dessous montre le schéma du câblage qui doit être réalisé pour effectuer l'essai ponctuel à l'aide d'une pile. Seul le papier réactif doit toucher la surface du métal. L'extrémité des pincettes ne doit jamais toucher la surface métallique ou la pince crocodile. Il faut également s'assurer que le papier réactif placé entre les pincettes est complètement imbibé. Si une partie du papier est sèche, le circuit ne sera pas complet, le courant ne circulera pas et le métal ne sera pas corrodé.
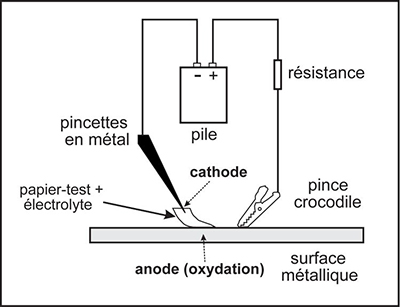
© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0427
Figure 1 : Schéma du câblage utilisé avec une pile pour forcer la corrosion de la surface métallique et la formation d'ions métalliques en solution, qui réagiront avec le papier réactif.
Procédure
- Prélever quelques millilitres de solution mère de chlorure de sodium et les verser dans un petit récipient.
- Étiqueter le récipient.
- Mettre en place la pile et les câbles d'électrolyse.
- Appliquer la pince crocodile directement sur le fer ou le nickel et la maintenir en place pour éviter de rayer l'objet. On peut également mettre du papier d'aluminium autour du morceau de fer ou de nickel et le maintenir en place avec la pince crocodile. Il faut toutefois s'assurer de mettre suffisamment de papier d'aluminium pour empêcher la pince crocodile de le perforer.
- Tenir le morceau de papier réactif servant à détecter le fer ou le nickel (en orientant la pointe aiguë vers l'extérieur) avec des pincettes en acier inoxydable.
- Imbiber le papier réactif avec quelques gouttes de solution de chlorure de sodium saturée à l'aide d'une pipette ou d'un compte-gouttes.
- Mettre le papier réactif en contact avec la surface métallique.
- Maintenir le papier en contact avec la surface pendant 5 secondes afin que l'électrolyse puisse s'effectuer.
- Si des ions fer sont présents, le papier réactif servant à détecter le fer changera de couleur : il deviendra rose en présence d'ions ferreux (Fe2+) et jaune en présence d'ions ferriques (Fe3+). Si des ions nickel sont présents, le papier réactif servant à détecter le nickel prendra une teinte allant du rose au rouge selon la concentration en ions nickel.
- Le papier réactif peut laisser une marque rose ou rouge sur l'objet. Après le test, rincer la surface du métal à l'eau claire afin d'éliminer tout résidu de solution saline, puis la sécher immédiatement.
- Rincer les pincettes à l'eau claire après chaque utilisation.
Résultats du test
Le papier réactif commercial utilisé pour détecter le fer est montré à la figure 2 et celui utilisé pour le nickel, à la figure 3.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0234
Figure 2 : Papier réactif commercial servant à détecter le fer (papier réactif au dipyridyle 90725) produit par Macherey-Nagel. La photo montre la boîte et un papier réactif.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0240
Figure 3 : Papier réactif commercial servant à détecter le nickel (papier réactif nickel 90730) produit par Macherey-Nagel. La photo montre la boîte et un papier réactif.
La figure 4 montre un morceau triangulaire de papier réactif servant à détecter le fer appuyé sur un morceau de fer, avant que la couleur change. Du papier d'aluminium a été utilisé pour empêcher que les dents de la pince crocodile abîment le fer. La figure 5 montre le papier réactif pour le fer après qu'il a réagi avec le morceau de fer et viré au rose.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0235
Figure 4 : Dispositif d'électrolyse servant à effectuer un test ponctuel de détection du fer avec du papier au dipyridyle, avant que la réaction se produise.
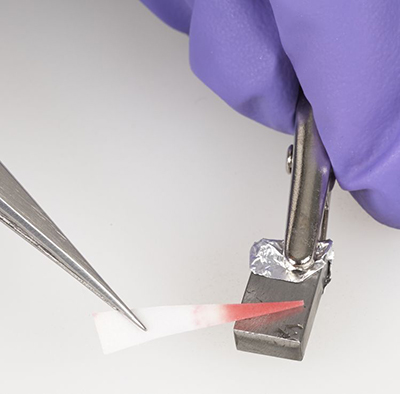
© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0237
Figure 5 : Vue rapprochée du papier réactif au dipyridyle servant à détecter le fer, après qu'il a réagi et viré au rose.
La figure 6 montre le papier réactif servant à détecter le nickel après qu'il a réagi avec un morceau de nickel et viré au rose. On a appuyé la pince crocodile contre le métal plutôt que de la fixer sur celui-ci, sans utiliser de papier d'aluminium.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0243
Figure 6 : Détail du papier réactif servant à détecter le nickel, après que la réaction s'est produite et que le papier a viré au rose.
Renseignements supplémentaires
Objets contenant du fer
Le fer est le métal industriel le plus largement utilisé de nos jours et il se retrouve dans toutes les collections muséales : équipement lourd dans les collections industrielles, armes et matériel de guerre dans les collections militaires, camions et automobiles. Il constitue une très grande partie des collections archéologiques et pose souvent des problèmes de conservation : canons et boulets de canon, clous, chaînes, etc. Le fer est également présent dans les sculptures extérieures et dans les édifices patrimoniaux, sous diverses formes, comme le fer forgé, la fonte, l'acier patinable et l'acier inoxydable. Les objets en fer sont souvent plaqués avec divers métaux : aluminium, cadmium, chrome, cuivre, nickel, argent, alliages plomb-étain, étain et zinc. Il est parfois difficile de déterminer si un objet contient du fer s'il est plaqué avec un autre métal mais, si le placage est altéré, le fer peut rouiller.
Il est facile de trouver des objets en fer pour les soumettre à un test. On peut commencer par un objet courant qui contient du fer. Des exemples d'objets donnant un résultat positif au test de détection du fer sont présentés aux figures 7 et 8.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0417
Figure 7 : Clous ordinaires.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0238
Figure 8 : Agrafes ordinaires pour pistolet agrafeur.
Objets contenant du nickel
Le nickel est plus coûteux que le fer et moins fréquent dans les collections. Il est employé dans les alliages résistant à la corrosion, tel le Monel (un alliage de cuivre et de nickel contenant environ 66 % de nickel). On le retrouve dans certaines pièces de monnaie et dans la plupart des météorites. Il est utilisé en joaillerie, bien que certaines personnes y soient allergiques. Le maillechort est un alliage blanc riche en cuivre qui contient du nickel. Le nickel est plaqué sur des alliages à base de fer ou de nickel. Il est difficile de plaquer directement du nickel sur du fer. C'est pourquoi le fer est généralement plaqué avec du cuivre, lequel est ensuite plaqué avec du nickel.
Les figures 9 à 12 montrent des exemples d'objets qui donnent un résultat positif au test de détection du nickel.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0245
Figure 9 : Porte-clés (le métal blanc sur le rectangle a donné un résultat positif au test).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0244
Figure 10 : Ampoule d'extérieur (la base en métal blanc a donné un résultat positif au test).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0354
Figure 11 : Fourchette en maillechort électroplaquée avec de l'argent. Les endroits où le placage a disparu ont donné un résultat positif au test de détection du nickel. (Le papier est devenu rose, mais un précipité jaune s'est également formé, probablement en raison d'une interférence causée par le cuivre.)

© Gouvernement du Canada, Institut canadien de conservation. ICC 87306-0032
Figure 12 : Pièce de cinq cents canadienne constituée d'un alliage contenant 75 % de cuivre et 25 % de nickel. Le papier réactif a viré au rose et au jaune (probablement en raison d'une interférence causée par le cuivre).
Sensibilité et interférences
Le papier réactif servant à détecter le fer peut détecter des concentrations supérieures ou égales à 2 mg/L (2 parties par million) d'ions Fe2+ en solution. Le papier réactif utilisé pour détecter le nickel peut détecter des concentrations supérieures ou égales à 10 mg/L (10 parties par million) d'ions nickel en solution.
Idéalement, lors d'un essai ponctuel, un seul élément métallique provoque un changement de couleur. Toutefois, en général, d'autres éléments peuvent également causer un changement de couleur similaire. Ce phénomène est appelé « interférence » et, lorsqu'il se produit, le papier réactif peut donner un résultat positif, même si le métal recherché n'est pas présent. Par exemple, le mode d'emploi du papier réactif utilisé pour détecter le nickel précise que le fer peut causer une interférence en présence d'ammoniac et que le cuivre et le cobalt peuvent causer une interférence s'ils sont présents en forte concentration. Le mode d'emploi du papier réactif servant à détecter le fer ne mentionne aucun élément susceptible de causer une interférence, mais il précise que les ions Fe3+ produisent une couleur jaune qui peut masquer le rouge indiquant la présence d'ions Fe2+.Entreposage
Les papiers réactifs doivent être conservés à une température inférieure à 30 °C, dans un endroit sec et à l'abri de la lumière du soleil. Ces papiers durent plusieurs années s'ils sont entreposés de façon adéquate. Cependant, il est important de s'assurer régulièrement qu'ils fonctionnent toujours en effectuant un test avec des échantillons de fer ou de nickel.
Essais ponctuels dans le domaine de la conservation
Lors d'un essai ponctuel, on laisse tomber une petite goutte d'eau qui réagit avec le métal en produisant un changement de couleur. L'essai peut laisser une légère marque sur l'objet, mais comme la quantité de métal qui se dissout est très faible, on peut généralement effectuer cet essai sur une partie peu visible de l'objet.
Il existe de nombreux types de tests ponctuels de détection des métaux, comme cela est expliqué dans l'ouvrage de Feigl et Anger (1972). Pour obtenir des renseignements détaillés sur l'utilisation des tests ponctuels de détection des métaux utilisés dans le domaine de la conservation (ainsi que sur les limites de détection et les interférences), consulter les ouvrages de Laver (1978), de Townsend (1988) et d'Odegaard et al. (2005).
Procédures supplémentaires
Préparation de la solution mère saturée de chlorure de sodium (NaCl)
La procédure ci-dessous peut être utilisée pour préparer 100 mL de solution de chlorure de sodium saturée. La solubilité du chlorure de sodium dans l'eau à 20 °C est de 35,9 g dans 100 mL d'eau.
Équipement et matériel
- Chlorure de sodium (NaCl)
- Spatule
- Balance
- Eau (distillée ou déionisée)
- Bécher (100 mL)
- Récipient pour conserver la solution
Procédure
- À l'aide d'une spatule et d'une balance, peser environ 37 g de chlorure de sodium.
- Mettre environ 100 mL d'eau dans un bécher de 100 mL.
- Verser le chlorure de sodium dans l'eau et mélanger en tournant pour le dissoudre.
- Si tout le chlorure de sodium se dissout, en ajouter un peu plus.
- Si des cristaux de chlorure de sodium non dissous apparaissent sur le fond du bécher, cela signifie que la solution est saturée. Il peut s'écouler plusieurs jours avant que la saturation soit atteinte.
- Transférer la solution dans un récipient pour pouvoir l'entreposer à long terme.
- Étiqueter le contenant.
Câbles d'électrolyse artisanaux
Ci-dessous figure un exemple de la façon d'obtenir des câbles d'électrolyse qui sont reliés à une pile de 9 volts (figure 13).

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0246
Figure 13 : Câbles d'électrolyse artisanaux, reliés à une pile de 9 volts. Les câbles sont obtenus en utilisant un connecteur pour pile de 9 volts, des pincettes en acier inoxydable, une résistance (de 300 à 360 ohms), une pince crocodile et une gaine thermorétractable.
Équipement et matériel
- Pile de 9 volts
- Connecteur pour pile de 9 volts (figure 14)
- Gaine thermorétractable (par exemple, 3/32 po et 3/16 po)
- Pistolet à air chaud ou sèche-cheveux
- Pincettes en acier inoxydable (le sel contenu dans l'électrolyte altère les autres types de pincettes en métal)
- Matériel pour fixer le fil aux pincettes (par exemple, foret approprié, vis de 3 mm de diamètre, rondelle plate pour vis de 3 mm, rondelle à dents intérieures pour vis de 3 mm, cosse circulaire percée d'un trou de 3 mm de diamètre). La figure 15 montre un exemple de cosse circulaire.
- Fil à gaine isolante rouge (par exemple, fil multibrin de calibre 22)
- Résistance (de 300 à 360 ohms, 1/4 watt, figure 16)
- Pince crocodile (les pinces crocodiles subminiatures conviennent bien aux petits objets)

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0247
Figure 14 : Connecteur pour pile de 9 volts.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0248
Figure 15 : Cosse circulaire (non isolée); aussi appelée « connecteur à œillet ».

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0249
Figure 16 : Résistance de 360 ohms. La valeur de la résistance est indiquée par les trois traits de gauche (orange, bleu, brun). L'anneau rouge, à droite, indique la tolérance (2 %). Les autres valeurs de résistance acceptables sont 330 ohms (orange, orange, brun) et 300 ohms (orange, noir, brun).
Procédure pour le fil noir du connecteur pour pile
- Couper un morceau de gaine thermorétractable assez long pour recouvrir le joint entre la cosse circulaire et le fil (voir les étapes suivantes).
- Enfiler la gaine thermorétractable sur le fil noir du connecteur pour pile de 9 volts et la faire glisser jusqu'au bord du connecteur.
- Fixer la cosse circulaire à l'extrémité du fil noir (par exemple, par soudage ou sertissage).
- Enfiler la gaine thermorétractable, de manière qu'elle recouvre le joint entre la cosse circulaire et le fil.
- Chauffer la gaine pour la faire rétrécir et l'immobiliser.
- Percer un trou taraudé dans les pincettes en acier inoxydable pour y insérer une vis de 3 mm (ou percer un simple trou non taraudé et utiliser un écrou).
- Fixer la cosse circulaire aux pincettes à l'aide des rondelles et de la vis de 3 mm de diamètre (figure 17) : enfiler la rondelle plate sur la vis, insérer la vis dans le trou de la cosse circulaire, ajouter la rondelle à dents intérieures et insérer la vis dans le trou taraudé des pincettes.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0250
Figure 17 : Les différentes pièces servant à fixer la cosse circulaire au trou taraudé des pincettes, présentées dans l'ordre.
Procédure pour le fil rouge du connecteur pour pile
- Couper un morceau de gaine thermorétractable assez long pour recouvrir la résistance et les soudures situées aux deux extrémités de la résistance (voir les étapes suivantes).
- Enfiler la gaine thermorétractable sur le fil rouge du connecteur pour pile de 9 volts et la faire glisser jusqu'au bord du connecteur.
- Souder une des extrémités de la résistance (de 300 à 360 ohms) au fil rouge du connecteur pour pile.
- Couper un morceau de fil isolé (par exemple, fil rouge de calibre 22) assez long pour que la manipulation de la pince et des pincettes soit facilitée pendant le test.
- Souder une extrémité du fil coupé à l'autre extrémité de la résistance.
- Enfiler la gaine thermorétractable de manière qu'elle recouvre la résistance et les deux soudures.
- Chauffer la gaine pour la faire rétrécir et l'immobiliser.
- Couper un morceau de gaine thermorétractable assez long pour recouvrir la soudure unissant la pince crocodile au fil (voir les étapes suivantes).
- Enfiler la gaine thermorétractable sur le fil rouge et la faire glisser plus loin sur le fil si l'on prévoit souder la pince crocodile.
- Fixer la pince crocodile au fil rouge (par exemple, par soudage ou sertissage).
- Glisser la gaine thermorétractable de façon qu'elle recouvre le joint.
- Chauffer la gaine pour la faire rétrécir et l'immobiliser.
Lorsque les fils sont prêts, brancher le connecteur aux bornes de la pile de 9 volts.
Vérifier les composants
Vérifier les différents composants des câbles d'électrolyse artisanaux à l'aide d'un multimètre.
- Tension : vérifier que la tension de la pile est d'environ 9 volts.
- Résistance électrique : vérifier la résistance électrique des deux fils reliés au connecteur pour pile.
- La valeur de la résistance du fil rouge entre la plus grosse des bornes du connecteur pour pile et la pince crocodile devrait être la même que celle de la résistance (par exemple, de 300 ohms à 360 ohms).
- La résistance électrique du fil noir entre la plus petite des bornes du connecteur pour pile et les pincettes devrait être quasi nulle (à moins que le fil ou un contact ne soit rompu).
- Courant : brancher le connecteur à la pile et mesurer l'intensité du courant dans le circuit. Celle-ci devrait avoisiner 30 mA (si la résistance est égale à 300 ohms), 27 mA (si la résistance est égale à 330 ohms) ou 25 mA (si la résistance est égale à 360 ohms). Si l'intensité mesurée est proche de la valeur prévue, alors la pile est encore bonne et peut être utilisée pour l'essai ponctuel.
Résistances
La résistance sert à limiter le courant provenant de la pile. Les valeurs de la résistance (exprimée en ohms) et de la tolérance sont indiquées par les bandes colorées tracées sur la résistance. La résistance peut être mesurée à l'aide d'un multimètre. Dans les câbles d'électrolyse, la valeur de résistance devrait être comprise entre 300 ohms et 360 ohms.
La puissance nominale des résistances vendues sur le marché est variable, bien qu'elle ne soit pas toujours indiquée sur la résistance elle-même. Dans le cas des câbles reliés à la pile de 9 volts, la puissance nominale des résistances utilisées est égale à 1/4 watt (0,25 watt). Lorsque cette valeur est dépassée, la résistance peut chauffer et éventuellement griller. La puissance associée à une résistance peut être calculée à partir de la tension à ses bornes ou de l'intensité du courant qui la traverse, à l'aide de l'équation suivante :
P = I2 R = I V = V2/R
Dans cette formule, P représente la puissance (en watts), I l'intensité du courant (en ampères), R la résistance (en ohms) et V la tension (en volts) (avec V = I.R). Si la tension totale fournie par la pile de 9 volts était appliquée aux bornes de la résistance, la puissance serait égale à 0,27 watt pour une résistance de 300 ohms, de 0,25 watt pour une résistance de 330 ohms et de 0,23 watt pour une résistance de 360 ohms. Cependant, la valeur calculée de la puissance pendant l'électrolyse est surestimée, car seule une fraction de la tension de 9 volts fournie par la pile est appliquée aux bornes de la résistance. La fraction restante de cette tension est appliquée aux pincettes et au métal soumis au test. En outre, le circuit n'est utilisé que pendant quelques secondes. Par conséquent, la puissance nominale de 1/4 watt des résistances utilisées dans le cadre de cette procédure est acceptable.
Aspects scientifiques de l'électrolyse et des papiers réactifs servant à détecter les métaux
Fonctionnement des papiers réactifs
Les papiers réactifs commerciaux contiennent un indicateur chimique qui change de couleur lorsqu'il est exposé à un ion métallique précis dans une solution. Pour que ces tests fonctionnent, l'ion métallique doit être présent dans la solution. Les papiers réactifs commerciaux qui servent à détecter le plomb ou le cuivre fonctionnent bien parce que ces deux métaux se corrodent rapidement lorsqu'ils sont exposés à l'eau. Une fois que ces derniers se sont dissous sous la forme d'ions métalliques en solution, ils réagissent rapidement avec l'indicateur chimique présent dans le papier. Le fer et le nickel, malheureusement, ne réagissent pas aussi rapidement. D'après le mode d'emploi des papiers réactifs utilisés dans la présente procédure, un acide doit être employé pour forcer la corrosion des métaux. On peut toutefois procéder à une électrolyse pour éviter d'avoir à manipuler des acides.
Électrolyse
Une électrolyse se produit lorsqu'un courant électrique entraîne une réaction chimique. L'électrolyse a lieu dans une cellule électrolytique composée de deux électrodes métalliques immergées dans un électrolyte (c.-à-d. un sel dissous dans un solvant, généralement de l'eau). Dans la présente procédure, l'électrolyte est la solution saline utilisée pour mouiller le papier réactif. Les deux électrodes sont l'objet en métal soumis au test et les pincettes métalliques. Les deux électrodes doivent être en contact avec l'électrolyte pour que le circuit soit fermé. C'est pourquoi il est indispensable que le papier réactif, positionné entre l'objet métallique et les pincettes, soit complètement imbibé.
Lorsque le circuit est fermé, la pile reliée aux électrodes fait circuler un courant électrique. Dans le circuit externe, le courant électrique est transporté par les électrons. Dans l'électrolyte (c.-à-d. dans le papier mouillé), il est transporté par les ions présents dans la solution saline saturée. Une réaction doit se produire à l'interface entre chaque électrode et l'électrolyte pour fournir ou consommer des électrons.
Lorsque l'électrode positive est un objet en fer, l'électrolyse provoque la corrosion du fer (Fe) sous forme d'ions Fe2+, libérant ainsi des électrons.
Fe → Fe2+ + 2e-
À l'électrode négative (les pincettes), des électrons sont consommés lors de la réaction ci-dessous.
O2 + 2 H2O + 4 e- → 4 OH-
Le réactif contenu dans le papier réagit alors avec les ions fer en solution, ce qui provoque un changement de couleur.
Changement de couleur
Le fabricant ne précise pas le nom du réactif présent dans les papiers réactifs servant à détecter le nickel. Le papier réactif utilisé pour détecter le fer contient du dipyridyle, aussi appelé « 2,2'-bipyridine », de formule C6H8N2. Chaque molécule de bipyridine contient deux atomes d'azote. Les atomes d'azote de trois molécules se lient à un ion fer pour former un ion moléculaire Fe(C6H8N2)32+ (figure 18), lequel produit une couleur rouge vif.

© Gouvernement du Canada, Institut canadien de conservation. ICC 120260-0300
Figure 18 : Ion bipyridine-fer, Fe(C6H8N2)32+, ion de couleur rouge qui se forme lors de l'essai de détection du fer au papier réactif.
Remerciements
Merci tout spécialement à Avital Lang, à Ute Werner et à Lucy 't Hart, anciennes stagiaires à l'ICC, d'avoir contribué à l'élaboration de la présente Note.
Fournisseurs
Remarque : Les renseignements qui suivent visent uniquement à informer le lecteur. Le fait qu'une entreprise figure dans la présente liste ne signifie pas pour autant qu'elle est approuvée par l'Institut canadien de conservation.
Papiers réactifs de Macherey-Nagel
Les papiers réactifs commerciaux utilisés pour détecter le fer (90725, Dipyridyle) ou le nickel (90730, Nickel) sont fabriqués en Allemagne par Macherey-Nagel. (Remarque : Macherey-Nagel fabrique également un autre type de papier réactif servant à détecter le fer, appelé « Iron Test Paper », mais celui-ci ne convient pas au test par électrolyse.) Chaque boîte de papier réactif contient 200 papiers de 20 mm × 70 mm. Parmi les distributeurs de ces papiers réactifs, mentionnons Aldert Chemicals, au Canada, et CTL Scientific Supply, aux États-Unis.
- Macherey-Nagel (en anglais seulement)
- Aldert Chemicals (en anglais seulement)
- CTL Scientific Supply (en anglais seulement)
Matériel nécessaire pour fabriquer les câbles d'électrolyse artisanaux
La vis de 3 mm de diamètre et les rondelles adaptées, le connecteur pour pile de 9 volts, la pince crocodile, les fils et les résistances peuvent être achetés dans des magasins d'électronique.
Pincettes en acier inoxydable
Ce type de pincettes est très répandu sur le marché. Celles utilisées dans la présente procédure sont vendues par la société Canemco – Marivac (en anglais seulement).
Références
FEIGL, F., et V. ANGER. Spot Tests in Inorganic Analysis, New York (New York), Elsevier, 1972.
LAVER, M. E. « Spot Tests in Conservation: Metals and Alloys », dans ICOM Committee for Conservation, 5th Triennial Meeting, Zagreb, Paris (France), International Council of Museums, 1978, p. 78/23/8/1-11.
ODEGAARD, N., S. CARROLL et W. S. ZIMMT. Material Characterization Tests for Objects of Art and Archaeology, 2e éd., Londres (Royaume-Uni), Archetype Publications, 2005.
TOWNSEND, J. H. « The Identification of Metals: Chemical Spot Tests », dans Modern Metals in Museums (sous la direction de R. E. Child and J. M. Townsend), Londres (Royaume-Uni), Institute of Archaeology, 1988, p. 15-22.
Rédigé par Lyndsie Selwyn
© Gouvernement du Canada, Institut canadien de conservation, 2016
ISSN 1928-5272
Détails de la page
- Date de modification :