Médicaments onéreux pour les maladies rares : Tendances canadiennes et comparaisons internationales, 2011–2020

Janvier 2022
ISBN : 978-0-660-41136-1
No de catalogue : H82-53/2022F-PDF
Table des matières
Remerciements
Cette analyse a été préparée par le Conseil d’examen du prix des médicaments brevetés (CEPMB) dans le cadre du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), et a été réalisée à la demande du Comité consultatif du SNIUMP et en consultation avec les membres de celui‑ci.
Nous remercions Brian O’Shea et Caroline Peterson d’avoir dirigé ce projet d’analyse, ainsi que Tanya Potashnik, Jeffrey Menzies et Elena Lungu pour leur supervision dans le développement de l’analyse.
Le CEPMB tient également à souligner les contributions des analystes Jun Yu, Jared Berger et Yvonne Zhang, ainsi que celles de Sarah Parker, Shirin Paynter et Laura Fortune, membres de l’équipe de rédaction.
Avis de non‑responsabilité
Le SNIUMP fonctionne indépendamment des activités réglementaires du Conseil du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne représentent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Bien que ces renseignements soient fondés en partie sur les données tirées de la base de données du SNIUMP de l’Institut canadien d’information sur la santé (ICIS) et, sous licence, sur la base de données MIDASMD et la base de données sur les régimes privés d’assurance‑médicaments à paiement direct appartenant à IQVIA Solutions Canada Inc. ou à ses sociétés affiliées (« IQVIA ») et de GlobalData, les déclarations, les constatations, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne sont pas attribuables à l’ICIS, à IQVIA ou à GlobalData.
Contact Information
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
C.P. L40
333, avenue Laurier Ouest, bureau 1400
Ottawa (Ontario) K1P 1C1
Tél. : 1‑877‑861‑2350
ATS : 613‑288‑9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Site Web : https://www.canada.ca/fr/examen-prix-medicaments-brevetes.html
Introduction
Au cours de la dernière décennie, le marché pharmaceutique canadien a connu une hausse rapide du nombre de nouvelles approbations pour les médicaments « orphelins » utilisés pour traiter des maladies et des affections rares. Les médicaments orphelins les plus onéreux — ceux dont les coûts de traitement dépassent 100 000 $ par année ou 7 500 $ par cycle de 28 jours pour l’oncologie — représentent un segment de plus en plus important du marché classé dans la présente analyse comme « médicaments onéreux pour maladies rares (MOMR) ».
Les ventes de MOMR au Canada ont atteint 3,1 milliards de dollars en 2020, soit plus de 11 fois le total de 2011. Compte tenu de ce rythme de croissance, il faut mieux comprendre l’incidence de ces médicaments sur les budgets des régimes d’assurance‑médicaments au Canada et ailleurs dans le monde.
Le recueil de graphiques donne un aperçu du marché des MOMR et traite des politiques actuelles au Canada et dans les pays de comparaison. La première section résume les 104 MOMR actuellement vendus au Canada, y compris les résultats des évaluations effectuées par les organismes de santé canadiens; la deuxième examine l’incidence de ces MOMR sur le marché canadien et la façon dont les niveaux de prix se comparent à l’échelle internationale; la dernière section porte sur les MOMR récemment approuvés et compare les approbations obtenues au Canada à celles obtenues dans les pays de comparaison du CEPMB et au sein de l’Organisation de coopération et de développement économiques (OCDE) dans son ensemble.
Résumé des constatations
Le rythme d’approbation des MOMR au Canada a augmenté au cours de la dernière décennie, la majorité des MOMR actuellement sur le marché ayant été approuvés après 2015. À la fin de 2020, 104 MOMR avaient été approuvés au total au Canada.
Les ventes de MOMR ont augmenté à un taux annuel moyen de presque 32 % depuis 2011, atteignant 3,1 milliards de dollars en 2020, soit 10,4 % du marché pharmaceutique canadien.
Les médicaments oncologiques représentent 54 % des MOMR approuvés au Canada, soit 76 % des ventes de MOMR en 2020.
La plupart des MOMR ont fait l’objet d’une recommandation de remboursement de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) avec comme critère un prix réduit, et environ la moitié ont fait l’objet d’une négociation fructueuse avec l’Alliance pancanadienne pharmaceutique (APP) pour une indication orpheline.
Les prix catalogue canadiens pour les MOMR brevetés sont plus près de la médiane de l’OCDE que pour les médicaments brevetés en général, mais ces résultats ne reflètent pas les rabais confidentiels négociés dans chaque pays.
Les MOMR représentent un segment important des approbations internationales récentes, et le Canada affiche un taux de lancement proportionnel à celui du CEPMB11 pour les MOMR approuvés à l’échelle internationale de 2015 à 2019.
Politiques nationales et internationales sur les médicaments orphelins
Médicaments orphelins
La Food and Drug Administration (FDA) des États‑Unis et l’Agence européenne des médicaments (EMA) attribuent une désignation orpheline aux médicaments utilisés pour traiter des maladies ou des problèmes médicaux rares. Les taux de prévalence utilisés pour définir le terme « maladie rare » varient : aux États‑Unis, il s'agit d'une maladie qui touche moins de 200 000 Américains, tandis qu’au sein de l'Union européenne, une maladie est définie comme rare lorsqu'elle touche moins de 1 personne sur 2 000Note de bas de page 1.
Politiques sur les médicaments orphelins
Les gouvernements du monde entier ont mis en place diverses politiques qui encouragent le développement de médicaments ayant le statut d’orphelin.
Pour améliorer l’accès des Canadiens aux médicaments pour les maladies rares, le gouvernement canadien a sollicité l’avis du public sur l’élaboration d’une stratégie nationale sur les médicaments pour les maladies rares et prévoit mettre en œuvre une initiative visant à améliorer l’accès aux traitements à compter de 2022Note de bas de page 2.
- Stratégie nationale du Canada sur les médicaments onéreux pour le traitement des maladies rares : 1 G$ sur deux ans pour 2022‑2023, jusqu’à 500 M$ par la suite.
- Programme de l’Australie sur les médicaments orphelins (1997; modifications en 2017) : dispense des frais d’évaluation, examen prioritaire.
- Règlement de l’Union européenne sur les médicaments orphelins (2000) : cible les médicaments utilisés pour traiter moins de 5 personnes sur 10 000.
- Loi sur les affaires pharmaceutiques du Japon (modifiée en 1993) : Critères de désignation orpheline, approbation prioritaire, mesures incitatives et subventions.
- Stratégie du Royaume‑Uni sur les maladies rares (2013); le programme technologique hautement spécialisé (HST) de l’Angleterre permet d’établir les priorités.
- Loi des États‑Unis sur les médicaments orphelins (1983); Office of Orphan Products Development (OOPD); programme de subventions pour les médicaments orphelins; plan de modernisation des médicaments orphelins (2017).
Méthodes
Sélection des médicaments
Les MOMR ont été définis comme des médicaments ayant au moins une indication désignée orpheline par l’intermédiaire de la FDA ou l’EMA, et dont les coûts de traitement estimés dépassaient 100 000 $ par année pour les médicaments non oncologiques ou 7 500 $ par 28 jours pour les médicaments oncologiques.
À partir de cette définition, 104 médicaments ou combinaisons de médicaments approuvés au Canada ont été identifiés aux fins de la présente analyse.
Pour la section 3, les nouveaux MOMR sur les marchés internationaux ont été désignés comme des médicaments orphelins répondant au seuil de coût des MOMR qui avaient été approuvés pour la première fois par Santé Canada, la FDA des États‑Unis ou l’EMA de 2015 à 2019. Il se peut que certains des MOMR figurant sur cette liste ne soient pas encore vendus au Canada.
Approche
Les marchés internationaux examinés comprennent les pays de l’Organisation de coopération et de développement économiques (OCDE), en particulier l’Australie, la Belgique, la France, l’Allemagne, l’Italie, le Japon, la Norvège, l’Espagne, la Suède et le Royaume‑Uni, qui, avec les Pays-Bas, constitueront les 11 pays de comparaison du CEPMB (« CEPMB11 ») précisés dans la version modifiée du Règlement sur les médicaments brevetés, qui devrait entrer en vigueur le 1er juillet 2022.
Les Pays‑Bas ont été exclus de la présente analyse en raison d’incohérences dans les données disponibles. La Suisse et les États‑Unis (É.‑U.) sont également présentés à des fins de comparaison, ainsi que la médiane des sept pays en annexe dont le CEPMB tient actuellement compte (« CEPMB7 » : France, Allemagne, Italie, Suède, Suisse, Royaume‑Uni et États-Unis).
Les ratios moyens des prix pratiqués dans les pays de comparaison étrangers par rapport aux prix pratiqués au Canada en ce qui a trait aux médicaments sélectionnés ont été calculés pour diverses mesures bilatérales et multilatérales. Les ratios bilatéraux des prix comparent les niveaux de prix d’un pays individuel à ceux du Canada, pondérés à l’aide de la valeur des ventes au Canada, tandis que les ratios multilatéraux comparent les prix de groupes de pays (CEPMB11 et OCDE) à ceux du Canada.
Sources de données
Les données sur les indications orphelines proviennent de la base de données de la FDA des États‑Unis sur les médicaments orphelins, et du registre communautaire des médicaments orphelins de la Commission européenne.
Les données sur les coûts de traitement proviennent des rapports de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) ou ceux‑ci sont calculés à partir de la posologie indiquée dans les monographies de produit et des prix catalogue publics, le cas échéant.
Les résultats relatifs au marché national canadien, ainsi que les comparaisons internationales, sont fondés sur les données saisies dans la base de données MIDASMD d’IQVIA (tous droits réservés). On prévoyait des ventes de médicaments canadiens pour lesquels il n’y avait pas de données de la base MIDAS.
La base de données sur les soins de santé de GlobalData a été utilisée pour l’analyse de la part des médicaments en cours de développement ayant une désignation orpheline.
Les données démographiques pour les calculs par habitant proviennent de la Banque mondiale.
Pour plus d’informations sur les sources de données utilisées, ainsi que sur le calcul des ratios des prix pratiqués dans les pays étrangers par rapport aux prix pratiqués au Canada, consulter le site Web du CEPMB.
Limites
Le présent rapport vise à donner un aperçu du marché des MOMR au Canada, y compris les ventes totales et les comparaisons internationales des prix. Il ne vise pas à évaluer la pertinence de ces niveaux.
Les données disponibles sur les ventes ne font pas de distinction entre les indications. Les montants déclarés ici comprennent la consommation des MOMR dans le cadre de toutes les indications approuvées, tant orphelines que non orphelines.
Les données sur les ventes canadiennes et internationales ainsi que les prix catalogue disponibles dans la base de données MIDASMD d’IQVIA sont les estimations des prix catalogue départ-usine du fabricant et ne tiennent pas compte des rabais et remises accordés sur une base confidentielle, des ententes de gestion de lancement, ou des programmes d’accès destinés aux patients.
1. Approbations des MOMR au Canada
La présente section donne un aperçu des 104 MOMR dont la vente a été approuvée au Canada avant 2020.
Le rythme d’approbation des MOMR au Canada a augmenté au cours de la dernière décennie
Jusqu’en 2010, peu de médicaments au Canada répondaient aux critères requis pour être considérés comme des MOMR. Toutefois, au cours de la dernière décennie, le nombre de MOMR ayant fait l’objet d’une autorisation de mise en marché a augmenté considérablement. Le nombre total de MOMR a plus que doublé entre 2011 et 2015 et a doublé de nouveau de 2016 à 2020 pour atteindre 104.
Le grand nombre de MOMR, en particulier les médicaments oncologiques qui ont été lancés sur le marché au cours des dernières années, a grandement contribué à la croissance globale des ventes de MOMR.
Figure 1.1 Approbations des MOMR oncologiques et non oncologiques au Canada selon l’année de l’avis de conformité, à compter de 2020

Description longue
Un graphique à barres indique le nombre de nouveaux médicaments onéreux pour maladies rares (MOMR) approuvés au Canada par année où ils ont fait l’objet d’un avis de conformité. Les résultats sont présentés pour les MOMR oncologiques et pour les MOMR non oncologiques. Le nombre cumulatif de MOMR pour chaque période est indiqué dans un tableau sous le graphique.
| Nombre de MOMR oncologiques approuvés | Nombre de MOMR non oncologiques approuvés | Nombre cumulatif de MOMR oncologiques approuvés | Nombre cumulatif de MOMR non oncologiques approuvés | Nombre cumulatif total de MOMR approuvés | |
|---|---|---|---|---|---|
Avant 2006 |
2 |
7 |
2 |
7 |
9 |
2006‑2010 |
5 |
7 |
7 |
14 |
21 |
2011‑2015 |
16 |
11 |
23 |
25 |
48 |
2016‑2020 |
33 |
23 |
56 |
48 |
104 |
Sources des données : Base de données sur les produits pharmaceutiques de Santé Canada.
Les nouveaux MOMR oncologiques ont des coûts de traitement modérément plus élevés
À l’exception du traitement de deux valeurs aberrantes, la fourchette des coûts de traitement de 28 jours pour les MOMR oncologiques n’a pas augmenté de façon substantielle au cours des cinq dernières années. Toutefois, le coût médian de traitement a augmenté pour les MOMR oncologiques approuvés depuis 2016, même si ces nouvelles entrées ont dépassé le nombre de MOMR existants.
Figure 1.2 Coûts du traitement de 28 jours au moyen de MOMR oncologiques au Canada selon l’année de mise en vigueur de l’avis de conformité, de 1997 à 2020

Description longue
Un diagramme de dispersion montre la fourchette des coûts de traitement de 28 jours pour les MOMR oncologiques au Canada selon l’année où ils ont fait l’objet d’un avis de conformité. Les années sont réparties en trois périodes : 1997 à 2010, 2011 à 2015, et 2016 à 2020. Les coûts de traitement médians pour chaque période sont indiqués dans un tableau sous le graphique, tout comme le nombre de MOMR oncologiques approuvés pendant ces périodes.
| Année de l’avis de conformité | Coût d’un traitement de 28 jours | Coût médian de traitement, en milliers de dollars | Nombre de MOMR | |
|---|---|---|---|---|
1997 |
1997 |
14 203 $ |
10,4 $ |
7 |
2005 |
8 400 $ |
|||
2007 |
20 827 $ |
|||
2008 |
10 108 $ |
|||
2009 |
8 456 $ |
|||
2009 |
43 659 $ |
|||
2010 |
10 408 $ |
|||
2011 à 2015 |
2012 |
8 213 $ |
10,8 $ |
16 |
2012 |
10 425 $ |
|||
2012 |
32 480 $ |
|||
2013 |
8 120 $ |
|||
2013 |
11 130 $ |
|||
2013 |
18 425 $ |
|||
2013 |
19 360 $ |
|||
2014 |
7 615 $ |
|||
2014 |
10 500 $ |
|||
2015 |
8 213 $ |
|||
2015 |
9 445 $ |
|||
2015 |
10 186 $ |
|||
2015 |
11 733 $ |
|||
2015 |
11 870 $ |
|||
2015 |
15 213 $ |
|||
2015 |
55 594 $ |
|||
2016 à 2020 |
2016 |
7 500 $ |
13,3 $ |
33 |
2016 |
7 567 $ |
|||
2016 |
7 615 $ |
|||
2016 |
8 251 $ |
|||
2016 |
8 894 $ |
|||
2016 |
9 445 $ |
|||
2016 |
9 807 $ |
|||
2016 |
12 696 $ |
|||
2016 |
14 954 $ |
|||
2016 |
16 252 $ |
|||
2017 |
9 275 $ |
|||
2017 |
11 614 $ |
|||
2017 |
12 536 $ |
|||
2018 |
15 700 $ |
|||
2018 |
16 486 $ |
|||
2018 |
33 410 $ |
|||
2018 |
57 623 $ |
|||
2018 |
482 549 $* |
|||
2019 |
8 213 $ |
|||
2019 |
8 832 $ |
|||
2019 |
8 958 $ |
|||
2019 |
13 300 $ |
|||
2019 |
16 700 $ |
|||
2019 |
17 967 $ |
|||
2019 |
34 048 $ |
|||
2019 |
35 000 $ |
|||
2019 |
48 350 $ |
|||
2019 |
432 013 $* |
|||
2020 |
8 008 $ |
|||
2020 |
10 611 $ |
|||
2020 |
16 039 $ |
|||
2020 |
16 650 $ |
|||
2020 |
20 748 $ |
|||
* Traitement unique
Sources des données : ACMTS; Base de données sur les produits pharmaceutiques de Santé Canada; monographies de produit.
Des MOMR non oncologiques comportant des coûts de traitement de plusieurs millions de dollars ont été approuvés au cours de la dernière décennie
Depuis le début de la décennie, une cohorte de nouveaux médicaments dont les coûts annuels par patient s’élèvent à plusieurs millions de dollars a fait l’objet d’une autorisation de mise en marché. Malgré cela, de nombreux lancements se situant entre 100 000 $ et 500 000 $ ont donné lieu à une médiane moins élevée pour les nouveaux lancements que lors des périodes précédentes.
Figure 1.3 Coûts annuels de traitement au moyen de MOMR non oncologiques au Canada selon l’année de mise en vigueur de l’avis de conformité, de 1997 à 2020

Description longue
Un diagramme de dispersion montre la fourchette des coûts annuels de traitement pour les MOMR non oncologiques au Canada selon l’année où ils ont fait l’objet d’un avis de conformité. Les années sont réparties en trois périodes : 1997 à 2010, 2011 à 2015, et 2016 à 2020. Les coûts médians de traitement pour chaque période sont indiqués dans un tableau sous le graphique, tout comme le nombre de MOMR non oncologiques approuvés pendant ces périodes.
| Année de l’avis de conformité | Coût annuel de traitement | Coût médian de traitement, en milliers de dollars | Nombre de MOMR | |
|---|---|---|---|---|
1997 à 2010 |
1997 |
671 580 $ |
353 $ |
14 |
2002 |
132 452 $ |
|||
2004 |
118 700 $ |
|||
2004 |
239 200 $ |
|||
2004 |
290 599 $ |
|||
2004 |
760 760 $ |
|||
2005 |
100 424 $ |
|||
2006 |
611 746 $ |
|||
2007 |
1 278 550 $ |
|||
2009 |
137 696 $ |
|||
2009 |
525 876 $ |
|||
2010 |
173 971 $ |
|||
2010 |
416 000 $ |
|||
2010 |
533 715 $ |
|||
2011 à 2015 |
2012 |
257 782 $ |
354 $ |
11 |
2012 |
306 600 $ |
|||
2013 |
750 308 $ |
|||
2014 |
259 200 $ |
|||
2014 |
354 005 $ |
|||
2014 |
379 600 $ |
|||
2014 |
1 745 744 $ |
|||
2015 |
140 087 $ |
|||
2015 |
230 972 $ |
|||
2015 |
1 370 119 $ |
|||
2015 |
2 227 680 $ |
|||
2016 à 2020 |
2016 |
236 088 $ |
321 $ |
23 |
2016 |
246 979 $ |
|||
2016 |
248 988 $ |
|||
2016 |
449 500 $ |
|||
2017 |
130 089 $ |
|||
2017 |
310 250 $ |
|||
2017 |
321 000 $ |
|||
2017 |
354 000 $ |
|||
2017 |
507 350 $ |
|||
2017 |
4 900 000 $ |
|||
2018 |
183 232 $ |
|||
2018 |
185 182 $ |
|||
2018 |
420 000 $ |
|||
2018 |
484 120 $ |
|||
2018 |
533 988 $ |
|||
2018 |
844 202 $ |
|||
2019 |
274 092 $ |
|||
2019 |
677 145 $ |
|||
2020 |
122 850 $ |
|||
2020 |
195 012 $ |
|||
2020 |
236 840 $ |
|||
2020 |
1 031 500 $* |
|||
2020 |
2 910 500 $* |
|||
* Traitement unique.
Sources des données : ACMTS; Base de données sur les produits pharmaceutiques de Santé Canada; monographies de produit.
Les MOMR appartiennent à une vaste gamme de catégories thérapeutiques
La catégorie de MOMR non oncologiques la plus courante est « autres produits liés au tractus digestif et au métabolisme », qui comprend l’enzymothérapie substitutive utilisée pour traiter la maladie de Gaucher, entre autres indications.
Les autres MOMR non oncologiques sont répartis entre 11 autres catégories ATC.
Figure 1.4 Répartition des MOMR au Canada selon la classification anatomique, thérapeutique et chimique (ATC)*

Description longue
Un graphique à barres horizontales indique la répartition des MOMR approuvés au Canada selon leur catégorie thérapeutique. La catégorie thérapeutique est fondée sur le niveau 2 du Système de classification anatomique, thérapeutique, chimique (ATC) établi par l’Organisation mondiale de la Santé (OMS).
| Catégorie thérapeutique | Nombre de MOMR |
|---|---|
L01 Agents antinéoplasiques (oncologie) |
53 |
A16 Autres produits liés au tractus digestif |
23 |
L04 Immunosuppresseurs |
5 |
N07 Autres médicaments en relation avec le système nerveux |
4 |
B02 Antihémorragiques |
4 |
R07 Autres produits pour l’appareil respiratoire |
3 |
B06 Autres médicaments utilisés en hématologie |
3 |
B01 Antithrombotiques |
3 |
M09 Autres médicaments pour les troubles |
2 |
V10 Radiopharmaceutiques à usage thérapeutique |
1 |
S01 Médicaments ophtalmologiques |
1 |
M05 Médicaments utilisés dans le traitement des maladies osseuses |
1 |
C10 Médicaments modificateurs des lipides |
1 |
* La catégorie thérapeutique est indiquée en fonction du niveau 2 du Système de classification anatomique, thérapeutique et chimique (ATC) établi par l’Organisation mondiale de la Santé (OMS).
Sources des données : Base de données sur les produits pharmaceutiques de Santé Canada; Centre collaborateur de l'OMS pour la méthodologie sur l'établissement des statistiques concernant les produits médicamenteux.
Les examens des remboursements de l’ACMTS pour les MOMR recommandent habituellement une réduction de prix
Bien que la majorité des MOMR oncologiques et non oncologiques aient fait l’objet d’au moins une recommandation positive de remboursement de la part de l’ACMTS, celle‑ci est presque toujours conditionnelle à une amélioration de la rentabilité par rapport au prix proposé par le fabricant.
Les médicaments moins courants sont ceux qui ont fait l’objet à la fois de recommandations positives et de recommandations négatives pour différentes indications, ou uniquement de recommandations négatives indiquant de ne pas rembourser.
Figure 1.5 Recommandations de remboursement* de l’ACMTS pour les MOMR oncologiques et non oncologiques, en mars 2021

Description longue
Deux diagrammes circulaires montrent la répartition des MOMR oncologiques et non oncologiques approuvés au Canada selon la recommandation de remboursement reçue par l’Agence canadienne des médicaments et des technologies de la santé (ACMTS). Les résultats sont présentés à la fois sous forme de nombre de médicaments et de part du nombre total de médicaments oncologiques (49 médicaments), et de médicaments non oncologiques (41 médicaments). Chaque MOMR est compté une fois et classé selon les résultats de l’examen dont il a fait l’objet de la part de l’ACMTS. Les recommandations sont regroupées en fonction de trois segments : tous les examens positifs, mélange d’examens positifs et négatifs, et tous les examens négatifs. Les recommandations positives comprennent « Rembourser », « Remboursement sous critères cliniques et/ou conditions », « Ajouter à la liste de médicaments couverts », « Ajouter à la liste de médicaments couverts sous certains critères cliniques et/ou conditions ». Les recommandations négatives comprennent « Ne pas rembourser » et « Ne pas ajouter à la liste de médicaments couverts ».
Seulement quatre MOMR oncologiques et un MOMR non oncologique ont fait l’objet d’une recommandation positive de remboursement sans critère ni condition.
| Tous les examens positifs | Mélanges d’examens positifs et négatifs | Tous les examens négatifs | Total | |
|---|---|---|---|---|
Nombre de MOMR oncologiques |
31 |
11 |
7 |
49 |
Part des MOMR oncologiques |
63 % |
22 % |
14 % |
100 % |
Nombre de MOMR non oncologiques |
26 |
5 |
10 |
41 |
Part des MOMR non oncologiques |
63 % |
12 % |
24 % |
100 % |
* Les recommandations positives comprennent « Rembourser », « Remboursement sous critères cliniques ou conditions », « Ajouter à la liste de médicaments couverts », « Ajouter à la liste de médicaments couverts sous certains critères cliniques et/ou conditions ». Les recommandations négatives comprennent « Ne pas rembourser » et « Ne pas ajouter à la liste de médicaments couverts ».
Remarque : Au moment de l’analyse, aucune recommandation finale de l’ACMTS n’était disponible pour sept MOMR oncologiques et sept MOMR non oncologiques.
Sources des données : ACMTS.
Seulement la moitié des MOMR examinés par le CEPMB offrent une amélioration thérapeutique par rapport aux comparateurs
Parmi les 49 MOMR ayant fait l’objet d’un examen ou en attente d’un examen en vertu des lignes directrices actuelles du CEPMB, 24 (49 %) ont été reconnus par le Groupe consultatif sur les médicaments pour usage humain (GCMUH) comme offrant une amélioration thérapeutique modérée ou supérieure à celle des comparateurs nationaux. Pour tous les médicaments examinés depuis l’entrée en vigueur des lignes directrices actuelles du CEPMB en 2010, la proportion comparable était de 17 %.
Figure 1.6 Niveau d’amélioration thérapeutique des MOMR au Canada évalué par le CEPMB, en 2019

Description longue
Deux diagrammes circulaires présentent la répartition des médicaments selon leur niveau d’amélioration thérapeutique par rapport aux produits de comparaison, tel qu’évalué par le Conseil d’examen du prix des médicaments brevetés (CEPMB) de 2010 à 2019. Le premier porte sur la distribution des MOMR examinés par le CEPMB tandis que le deuxième présente la répartition correspondante pour tous les médicaments brevetés. Les résultats pour chaque diagramme sont présentés sous forme de nombre de médicaments ainsi qu’en tant que part de tous les médicaments examinés.
MOMR examinés de 2010 à 2019
| Niveau d’amélioration thérapeutique | Nombre de MOMR | Part des MOMR |
|---|---|---|
Découverte |
5 |
10 % |
Amélioration substantielle |
5 |
10 % |
Amélioration modeste |
14 |
29 % |
Amélioration minime ou nulle |
22 |
45 % |
En attente d’examen |
3 |
6 % |
Tous les médicaments brevetés examinés de 2010 à 2019
| Niveau d’amélioration thérapeutique | Nombre de médicaments | Part des médicaments |
|---|---|---|
Découverte |
20 |
2 % |
Amélioration substantielle |
22 |
3 % |
Amélioration modeste |
106 |
12 % |
Amélioration minime ou nulle |
701 |
83 % |
En attente d’examen |
0 |
0 % |
Remarque : Les examens scientifiques effectués par le Groupe consultatif sur les médicaments pour usage humain (GCMUH) sont fondés sur l’indication principale d’un nouveau médicament, qui peut être une indication non orpheline. Les résultats de ces examens sont publiés dans le rapport annuel du CEPMB.
Sources des données : CEPMB.
L’APP a terminé les négociations concernant une indication orpheline pour la moitié des MOMR au Canada
L’Alliance pancanadienne pharmaceutique (APP) a conclu avec succès des négociations avec les fabricants de 55 MOMR pour une indication orpheline et elle tient actuellement ou envisage de tenir des négociations concernant 11 autres MOMR.
Ces résultats indiquent une harmonisation avec la recommandation récurrente de l’ACMTS de rembourser les MOMR à condition d’améliorer la rentabilité.
Figure 1.7 État d’avancement des négociations de l’APP concernant les MOMR, en juin 2021

Description longue
Un graphique à barres horizontales indique le statut actuel des MOMR ayant fait l’objet de négociations par l’intermédiaire de l’Alliance pancanadienne pharmaceutique (APP). Ceux qui ont un statut positif, notamment une négociation fructueuses pour une indication orpheline, sont affichés en vert, tandis que les négociations actives ainsi que ceux qui sont à l’étude sont affichés en gris, et ceux qui ont un statut négatif, y compris ceux ayant fait l’objet de négociations qui n’ont pas débouché sur une entente, ceux ayant fait l’objet de négociations qui ont pris fin pour des indications non orphelines et ceux pour lesquels il n’y pas de dossier de l’APP sont affichés en rouge. Les MOMR ayant fait l’objet de négociations plus d’une fois ne sont comptés qu’une seule fois selon la catégorie de négociation la plus pertinente.
| État d’avancement des négociations | Nombre de MOMR |
|---|---|
Lettre d’intention signée pour une indication orpheline |
55 |
Négociation active pour une indication orpheline |
5 |
À l’étude pour une indication orpheline |
6 |
Négociations terminées sans entente |
12 |
Lettre d’intention signée pour une indication non orpheline |
3 |
Aucun dossier de l’APP |
23 |
Remarque : Les MOMR ayant fait l’objet de négociations plus d’une fois ne sont comptés qu’une seule fois selon la catégorie de négociations la plus pertinente.
Source des données : Aperçu des activités de l’APP (consulté en juin 2021).
2. Marché canadien des MOMR
La présente section porte sur les 104 MOMR approuvés au Canada et examine les tendances dans l’ensemble du marché pharmaceutique en effectuant une comparaison internationale des prix.
Les ventes de MOMR au Canada ont augmenté rapidement depuis 2016
En raison des nouvelles entrées sur le marché et de la croissance des médicaments existants, les ventes de MOMR ont augmenté à un taux de croissance annuel composé de 31,6 % entre 2011 et 2020, dépassant largement le marché pharmaceutique global.
Au cours de la deuxième moitié de la décennie, la croissance annuelle composée s’est établie à 32,1 %, ce qui a entraîné des ventes de 3,1 milliards de dollars en 2020, soit plus du dixième du marché total.
Figure 2.1 Ventes de MOMR au Canada, 2011 à 2020

Description longue
Un graphique à barres indique les ventes de MOMR au Canada de 2011 à 2020 en milliards de dollars. Le taux de croissance annuel et la part que les MOMR occupent sur le marché canadien des produits pharmaceutiques ainsi que les ventes canadiennes de médicaments brevetés au cours de chaque année sont présentés dans un tableau sous le graphique. Le taux de croissance annuel composé pour toute la période était de 31,6 % pour les MOMR et de 5,2 % pour l’ensemble des médicaments. Entre 2015 et 2020, le taux de croissance annuel composé était de 32,1 % pour les MOMR et de 6,3 % pour l’ensemble des médicaments.
| 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|---|---|---|---|---|
Ventes de MOMR en milliards de dollars |
0,3 $ |
0,3 $ |
0,4 $ |
0,6 $ |
0,8 $ |
1,0 $ |
1,4 $ |
1,8 $ |
2,5 $ |
3,1 $ |
Taux de croissance annuel |
– |
28,1 % |
29,5 % |
30,6 % |
36,1 % |
25,3 % |
38,5 % |
35,3 % |
38,8 % |
23,2 % |
Part du marché canadien des produits pharmaceutiques occupée par les MOMR |
1,4 % |
1,7 % |
2,2 % |
2,8 % |
3,5 % |
4,2 % |
5,4 % |
7,0 % |
9,1 % |
10,4 % |
Part des ventes de médicaments brevetés représentée par les MOMR |
2,2 % |
2,8 % |
3,4 % |
4,0 % |
5,2 % |
6,3 % |
7,8 % |
11,7 % |
15,1 % |
17,4 % |
* Taux de croissance annuel composé.
Sources des données : CEPMB; Base de données MIDASMD d’IQVIA, de 2011 à 2020 (tous droits réservés).
Les dix MOMR les plus vendus représentaient 71 % des ventes en 2020
Près des trois quarts des ventes de MOMR en 2020 au Canada peuvent être attribués à seulement 10 médicaments, dont la majorité est utilisée pour des indications oncologiques. Les données sur les ventes ont été enregistrées pour un total de 81 MOMR.
Plus de la moitié des ventes provenaient de médicaments ayant fait l’objet d’un avis de conformité de 2014 à 2016, tandis que la cohorte élargie de 2017 à 2020 est susceptible de contribuer à la croissance des ventes au cours des prochaines années.
Figure 2.2 Ventes de MOMR au Canada, selon le classement des ventes et l’année de l’AC, 2020
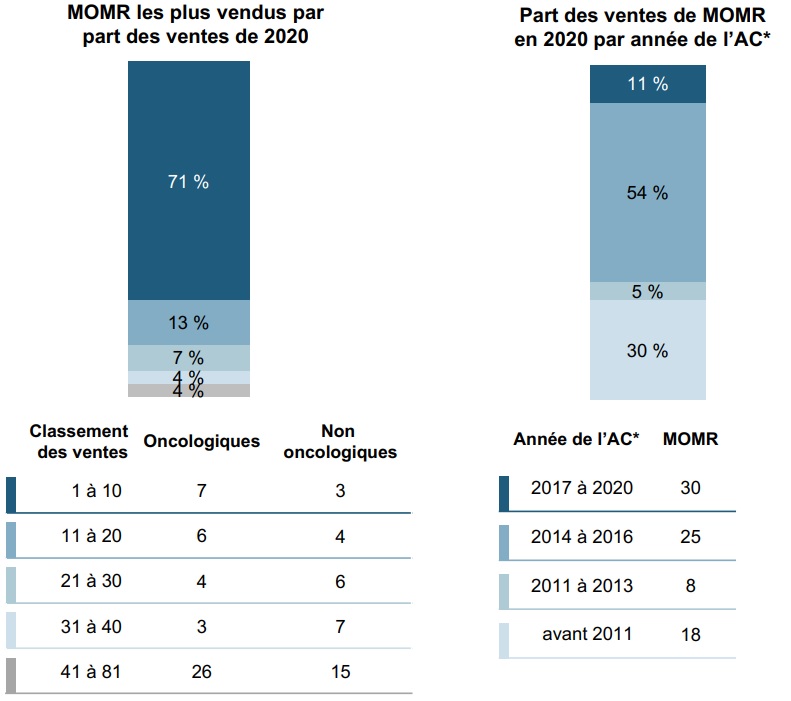
Description longue
Deux barres empilées indiquent la répartition des ventes de MOMR au Canada par a) ventes et b) année de l’avis de conformité. Les résultats sont donnés en part de l’ensemble des ventes de MOMR en 2020 ainsi que selon le nombre de MOMR oncologiques et non oncologiques dans chaque catégorie, comme le montre un tableau sous les barres.
a) MOMR les plus vendus selon la part des ventes de 2020
| Classement des ventes | Part des ventes de MOMR | Nombre de MOMR oncologiques | Nombre de MOMR non oncologiques |
|---|---|---|---|
1 à 10 |
71 % |
7 |
3 |
11 à 20 |
13 % |
6 |
4 |
21 à 30 |
7 % |
4 |
6 |
31 à 40 |
4 % |
3 |
7 |
41 à 81 |
4 % |
26 |
15 |
b) Part des ventes de MOMR en 2020 selon l’année de l’avis de conformité
| Année de l’avis de conformité | Part des ventes de MOMR | Nombre de MOMR |
|---|---|---|
2017 à 2020 |
11 % |
30 |
2014 à 2016 |
54 % |
25 |
2011 à 2013 |
5 % |
8 |
avant 2011 |
30 % |
18 |
* Avis de conformité (AC).
Sources des données : CEPMB; Base de données MIDASMD d’IQVIA, 2020 (tous droits réservés), Base de données sur les produits pharmaceutiques de Santé Canada.
Les MOMR biologiques représentent près de la moitié de toutes les ventes canadiennes de MOMR
Bien que la hausse du nombre de MOMR non biologiques ait dépassé celle des produits biologiques depuis le début de la décennie, leurs parts respectives des ventes sont demeurées relativement stables, à 53 % et 47 % en 2020.
Figure 2.3 Part des ventes de MOMR biologiques et non biologiques, Canada, de 2011 à 2020

Description longue
Un diagramme à barres empilées montre la répartition des ventes de MOMR au Canada par médicaments biologiques et non biologiques de 2011 à 2020. Les ventes sont exprimées en milliards de dollars. Le nombre de MOMR biologiques et non biologiques vendus est indiqué dans un tableau sous le graphique. Le taux de croissance annuel composé pour la période était de 31,4 % pour les MOMR biologiques et de 31,8 % pour les MOMR non biologiques. Entre 2015 et 2020, le taux de croissance annuel composé était de 31,9 % pour les MOMR biologiques et de 32,2 % pour les MOMR non biologiques.
| 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|---|---|---|---|---|
Ventes de MOMR biologiques, en milliards de dollars |
0,13 $ |
0,16 $ |
0,22 $ |
0,29 $ |
0,37 $ |
0,41 $ |
0,60 $ |
0,85 $ |
1,21 $ |
1,47 $ |
Nombre de MOMR biologiques vendus |
9 |
9 |
12 |
16 |
21 |
22 |
25 |
29 |
32 |
35 |
Part des MOMR biologiques parmi les ventes totales de MOMR |
48 % |
47 % |
49 % |
51 % |
47 % |
41 % |
45 % |
46 % |
47 % |
47 % |
Ventes de MOMR non biologiques, en milliards de dollars |
0,14 $ |
0,18 $ |
0,22 $ |
0,28 $ |
0,41 $ |
0,57 $ |
0,75 $ |
0,98 $ |
1,34 $ |
1,66 $ |
Nombre de MOMR non biologiques vendus |
9 |
12 |
14 |
19 |
20 |
27 |
30 |
35 |
39 |
46 |
Part des MOMR non biologiques parmi les ventes de MOMR |
52 % |
53 % |
51 % |
49 % |
53 % |
59 % |
55 % |
54 % |
53 % |
53 % |
Ventes totales de MOMR, en milliards de dollars |
0,26 $ |
0,34 $ |
0,44 $ |
0,57 $ |
0,78 $ |
0,98 $ |
1,36 $ |
1,83 $ |
2,55 $ |
3,14 $ |
* Taux de croissance annuel composé.
Sources des données : CEPMB; Base de données MIDASMD d’IQVIA, de 2011 à 2020 (tous droits réservés).
Les MOMR oncologiques représentent la majorité des ventes, avec une croissance beaucoup plus rapide depuis 2015
Bien que la proportion des ventes de MOMR que représentent les MOMR non oncologiques ait augmenté plus rapidement au cours de la dernière décennie, les cinq dernières années ont été caractérisées par une croissance plus rapide des ventes de MOMR oncologiques.
Santé Canada a approuvé en moyenne 2,4 indications pour les MOMR oncologiques, tandis que la moyenne pour les MOMR non oncologiques est de 1,3, ce qui indique un éventail généralement plus large d’utilisations des médicaments oncologiques.
Figure 2.4 Part des ventes de MOMR oncologiques et non oncologiques, Canada, de 2011 à 2020

Description longue
Un diagramme à barres empilées montre la répartition des ventes de MOMR au Canada de 2011 à 2020 par médicaments oncologiques et non oncologiques. Les ventes sont exprimées en milliards de dollars. Le nombre de MOMR oncologiques et non oncologiques vendus est indiqué dans un tableau sous le graphique. Le taux de croissance annuel composé pour la période était de 30,7 % pour les MOMR oncologiques et de 34,9 % pour les MOMR non oncologiques Entre 2015 et 2020, le taux de croissance annuel composé était de 35,6 % pour les MOMR oncologiques et de 23,6 % pour l’es MOMR non oncologiques.
| 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|---|---|---|---|---|
Ventes de MOMR oncologiques, en milliards de dollars |
0,21 $ |
0,26 $ |
0,33 $ |
0,39 $ |
0,52 $ |
0,68 $ |
1,00 $ |
1,40 $ |
1,92 $ |
2,38 $ |
Nombre de MOMR oncologiques vendus |
7 |
9 |
12 |
15 |
20 |
27 |
32 |
36 |
38 |
46 |
Part des MOMR oncologiques parmi les ventes totales de MOMR |
81 % |
76 % |
75 % |
68 % |
66 % |
69 % |
74 % |
76 % |
75 % |
76 % |
Ventes de MOMR non oncologiques, en milliards de dollars |
0,05 $ |
0,08 $ |
0,11 $ |
0,18 $ |
0,26 $ |
0,30 $ |
0,36 $ |
0,43 $ |
0,63 $ |
0,76 $ |
Nombre de MOMR non oncologiques vendus |
11 |
12 |
14 |
20 |
21 |
22 |
23 |
28 |
33 |
35 |
Part des MOMR non oncologiques parmi les ventes de MOMR |
19 % |
24 % |
25 % |
32 % |
34 % |
31 % |
26 % |
24 % |
25 % |
24 % |
Ventes totales de MOMR, en milliards de dollars |
0,26 $ |
0,34 $ |
0,44 $ |
0,57 $ |
0,78 $ |
0,98 $ |
1,36 $ |
1,83 $ |
2,55 $ |
3,14 $ |
* Taux de croissance annuel composé.
Sources des données : Base de données sur les produits pharmaceutiques de Santé Canada; CEPMB; Base de données MIDASMD d’IQVIA, 2011 à 2020 (tous droits réservés).
Les prix catalogue canadiens pour les MOMR brevetés sont plus près de la médiane de l’OCDE que pour les médicaments brevetés en général
Les niveaux des prix canadiens des médicaments brevetés étaient les quatrièmes plus élevés de l’OCDE en 2019, tandis que les niveaux de prix des MOMR brevetés étaient les neuvièmes plus élevés en 2020 et se rapprochaient de la médiane de l’OCDE pour les médicaments.
L’harmonisation des prix catalogue des MOMR brevetés ne tient pas compte des réductions de prix confidentielles négociées au Canada ou dans d’autres pays. Le niveau de réduction offert par rapport au prix catalogue varie d’un pays à l’autre et constitue un aspect de plus en plus courant du remboursement des nouveaux médicaments.
Figure 2.5 Ratios des prix étrangers par rapport aux prix canadiens des médicaments brevetés et des MOMR brevetés, OCDE

Description longue
Tous les médicaments brevetés, 2019
Un graphique à barres indique les ratios moyens des prix pratiqués à l’étranger par rapport aux prix en vigueur au Canada en 2019 pour les médicaments brevetés pour chaque pays membre de l’Organisation de coopération et de développement économiques. Les résultats sont présentés sous forme de ratio des prix pratiqués à l’étranger par rapport aux prix en vigueur au Canada, les prix canadiens étant fixés à 1,00. Le ratio médian des prix pour les pays présentés était de 0,81, et était calculé au niveau des médicaments pour les médicaments dont les prix sont disponibles sur au moins trois marchés étrangers.
| Pays | Ratio moyen des prix étrangers par rapport aux prix canadiens |
|---|---|
États‑Unis |
3,49 |
Allemagne |
1,02 |
Suisse |
1,02 |
Canada |
1,00 |
Mexique |
0,95 |
Autriche |
0,94 |
Irlande |
0,94 |
Japon |
0,93 |
Italie |
0,91 |
Nouvelle‑Zélande |
0,90 |
Finlande |
0,89 |
Espagne |
0,89 |
Norvège |
0,88 |
Suède |
0,87 |
Hongrie |
0,84 |
Belgique |
0,83 |
Chili |
0,82 |
Royaume‑Uni |
0,82 |
République tchèque |
0,80 |
Luxembourg |
0,79 |
Pologne |
0,78 |
France |
0,73 |
Portugal |
0,72 |
Slovaquie |
0,71 |
Australie |
0,70 |
Grèce |
0,67 |
Slovénie |
0,66 |
Estonie |
0,62 |
Corée du Sud |
0,56 |
Turquie |
0,29 |
MOMR brevetés, 2020
Un graphique à barres indique les ratios moyens des prix étrangers par rapport aux prix canadiens en 2020 pour les MOMR brevetés pour chaque pays membre de l’Organisation de coopération et de développement économiques. Les résultats sont présentés sous forme de ratio des prix pratiqués à l’étranger par rapport aux prix en vigueur au Canada, les prix canadiens étant fixés à 1,00. Le ratio médian des prix pour les pays présentés était de 0,94, et était calculé au niveau des médicaments pour les médicaments dont les prix sont disponibles sur au moins trois marchés étrangers.
| Pays | Ratio moyen des prix étrangers par rapport aux prix canadiens |
|---|---|
États‑Unis |
1,55 |
Espagne |
1,19 |
Autriche |
1,13 |
Belgique |
1,10 |
Italie |
1,08 |
Finlande |
1,06 |
Irlande |
1,06 |
Nouvelle‑Zélande |
1,05 |
Canada |
1,00 |
Suisse |
0,99 |
Pologne |
0,97 |
Suède |
0,96 |
Portugal |
0,94 |
République tchèque |
0,93 |
Grèce |
0,92 |
Allemagne |
0,91 |
Hongrie |
0,91 |
Royaume‑Uni |
0,90 |
Slovaquie |
0,89 |
Australie |
0,88 |
France |
0,88 |
Japon |
0,88 |
Norvège |
0,88 |
Mexique |
0,85 |
Luxembourg |
0,85 |
Slovénie |
0,83 |
Chili |
0,78 |
Estonie |
0,72 |
Corée du Sud |
0,64 |
Turquie |
0,40 |
* Médiane de l’OCDE calculée en fonction des prix des médicaments disponibles dans au moins trois marchés étrangers.
Sources des données : Rapport annuel 2019 du CEPMB; Base de données MIDASMD d’IQVIA, 2019 à 2020 (tous droits réservés).
3. Nouveaux MOMR au Canada et sur les marchés internationaux
Cette section examine les médicaments orphelins comme part de la filière mondiale de développement et donne un aperçu des coûts de traitement et de la disponibilité des nouveaux MOMR approuvés par la FDA des États‑Unis, l’EMA ou Santé Canada entre 2015 et 2019.
Les médicaments orphelins représentent une part importante de la filière de développement mondiale
Une proportion importante de médicaments en cours de développement est indiquée pour traiter des maladies et des affections rares. Cela est particulièrement vrai pour la phase III et le préenregistrement, où un tiers des médicaments sont désignés comme orphelins.
Figure 3.1 Répartition des médicaments en développement selon la désignation d’orphelin, Canada, États‑Unis et Europe, en mars 2021

Description longue
Un graphique à barres empilées horizontal montre la répartition des médicaments en cours de développement au Canada, aux États‑Unis et en Europe selon qu’ils ont ou non une désignation orpheline. Les parts sont indiquées pour chaque phase de développement : phase I, phase II, phase III et préenregistrement. Cette analyse donne un instantané de la filière de développement en mars 2021. Les médicaments en cours de développement en Russie et en Turquie sont exclus tandis que ceux dont la région géographique n’est pas précisée sont inclus.
| Phase I | Phase II | Phase III | Préenregistrement | |
|---|---|---|---|---|
Nombre total de médicaments |
3 209 |
3 621 |
974 |
136 |
Médicaments désignés comme orphelins |
8 % |
20 % |
33 % |
33 % |
Médicaments non désignés comme orphelins |
92 % |
80 % |
67 % |
67 % |
Remarque : La répartition géographique des médicaments exclut la Russie et la Turquie et inclut les médicaments en développement dont la région géographique n’est pas précisée.
Sources des données : Base de données sur les soins de santé GlobalData, mars 2021.
Les MOMR représentent un segment important des approbations internationales récentes
Parmi les nouveaux médicaments approuvés de 2015 à 2019 par la FDA des États‑Unis, l’EMA ou Santé Canada, 62 avaient à la fois une désignation d’orphelin et un coût de traitement qui respectait le seuil requis pour un MOMR.
Ces 62 médicaments représentent 28 % des nouvelles approbations pour la période, ce qui indique que le rythme rapide des lancements de MOMR au Canada a également été observé dans d’autres pays.
Figure 3.2 MOMR et médicaments orphelins, en part des nouveaux médicaments approuvés par la FDA des États‑Unis, l’EMA ou Santé Canada, de 2015 à 2019

Description longue
Un diagramme à barres empilées montre la répartition des nouveaux médicaments approuvés par la Food and Drug Administration des États-Unis, l’Agence européenne des médicaments ou Santé Canada entre 2015 et 2019 par médicaments non orphelins, médicaments orphelins autres que les MOMR et MOMR. Les résultats sont donnés à la fois en nombre de médicaments et en part de tous les nouveaux médicaments approuvés chaque année.
| 2015 | 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|---|
Nombre de nouveaux médicaments non orphelins |
23 |
18 |
28 |
20 |
28 |
Part des nouveaux médicaments non orphelins |
56 % |
58 % |
54 % |
39% |
60 % |
Nombre de nouveaux médicaments orphelins autres que les MOMR |
9 |
7 |
8 |
10 |
9 |
Part des nouveaux médicaments orphelins autres que les MOMR |
22 % |
23 % |
15 % |
20 % |
19 % |
Nombre de nouveaux MOMR |
9 |
6 |
16 |
21 |
10 |
Part des nouveaux médicaments que représentent les MOMR |
22 % |
19 % |
31 % |
41 % |
21 % |
Nombre total de nouveaux médicaments |
41 |
31 |
52 |
51 |
47 |
Sources des données : Bases de données de la FDA des États‑Unis, de l’EMA et de Santé Canada.
Les coûts de traitement liés aux MOMR approuvés de 2015 à 2019 varient considérablement
Les MOMR oncologiques et non oncologiques approuvés de 2015 à 2019 par la FDA des États‑Unis, l’EMA ou Santé Canada comportaient une vaste gamme de coûts de traitement, les niveaux les plus élevés ayant été observés parmi les approbations de 2018.
Bien que certains des MOMR visés par cette analyse n’avaient pas été lancés au Canada à la fin de 2019, ces résultats indiquent que d’autres pays ont également vu un certain nombre de nouveaux MOMR approuvés au cours des dernières années, avec des coûts de traitement de plusieurs millions de dollars.
Figure 3.3 Coûts de traitement liés aux nouveaux MOMR approuvés par la FDA des États‑Unis, l’EMA ou Santé Canada, de 2015 à 2019

Description longue
Deux diagrammes de dispersion montrent l’éventail des coûts de traitement pour a) les MOMR oncologiques et b) les MOMR non oncologiques au Canada selon l’année de la première approbation par la Food and Drug Administration des États‑Unis, l’Agence européenne des médicaments et/ou Santé Canada, de 2015 à 2019. Les coûts de traitement liés aux MOMR oncologiques sont fondés sur un cycle de traitement de 28 jours, tandis que les coûts de traitement liés aux MOMR non oncologiques sont annuels. Le nombre de MOMR approuvés chaque année est indiqué dans un tableau sous le graphique. Pour la période d’approbation de 2015 à 2019, le coût médian de traitement lié aux MOMR oncologiques était de 17 400 $, tandis que le coût médian de traitement lié aux MOMR non oncologiques était de 510 000 $.
a) MOMR oncologiques
| Année de la première approbation | Coût d’un traitement de 28 jours | Nombre de MOMR |
|---|---|---|
2015 |
8 403 $ |
6 |
8 893 $ |
||
9 146 $ |
||
9 807 $ |
||
12 054 $ |
||
43 576 $ |
||
2016 |
11 600 $ |
2 |
13 500 $ |
||
2017 |
9 270 $ |
11 |
9 435 $ |
||
9 738 $ |
||
13 300 $ |
||
15 840 $ |
||
16 200 $ |
||
17 500 $ |
||
27 227 $ |
||
40 375 $ |
||
432 013 $ |
||
482 549 $ |
||
2018 |
8 275 $ |
9 |
13 887 $ |
||
19 436 $ |
||
21 259 $ |
||
23 956 $ |
||
27 642 $ |
||
32 104 $ |
||
88 958 $ |
||
557 885 $ |
||
2019 |
13 741 $ |
6 |
17 294 $ |
||
19 575 $ |
||
21 152 $ |
||
22 914 $ |
||
25 470 $ |
b) MOMR non oncologiques
| Année de la première approbation | Coût annuel de traitement | Nombre de MOMR |
|---|---|---|
2015 |
248 988 $ |
3 |
1 102 433 $ |
||
1 590 792 $ |
||
2016 |
310 300 $ |
4 |
354 000 $ |
||
449 500 $ |
||
638 800 $ |
||
2017 |
185 182 $ |
5 |
635 000 $ |
||
683 900 $ |
||
841 900 $ |
||
1 031 500 $ |
||
2018 |
156 403 $ |
12 |
206 911 $ |
||
236 840 $ |
||
336 734 $ |
||
420 000 $ |
||
486 477 $ |
||
533 988 $ |
||
536 767 $ |
||
584 098 $ |
||
677 145 $ |
||
2 493 892 $ |
||
5 034 964 $ |
||
2019 |
143 272 $ |
4 |
217 633 $ |
||
336 734 $ |
||
773 452 $ |
Remarque : Les données sur les médicaments ayant différentes durées de traitement ont été ajustées, et les schémas posologiques d’entretien ont été privilégiés par rapport aux schémas posologiques à dose d’attaque.
Sources des données : Bases de données de la FDA des États‑Unis, de l’EMA et de Santé Canada; ACMTS.
Les nouveaux MOMR sont lancés au Canada à un rythme semblable à celui des pays de comparaison
Sur les 62 nouveaux MOMR approuvés de 2015 à 2019 par la FDA des États‑Unis, l’EMA ou Santé Canada, 42 % avaient enregistré des ventes au Canada à la fin de 2019, soit un taux légèrement plus élevé que la médiane du CEPMB11 de 34 %.
Les médicaments approuvés et vendus au Canada représentaient 83 % des ventes générées par les 62 nouveaux MOMR au sein de l’OCDE en 2019, soit presque exactement la médiane du CEPMB11 de 82 %.
Ces résultats sont semblables aux parts des 160 médicaments autres que les MOMR ayant été approuvés de 2015 à 2019. De ce nombre, 62 (39 %) avaient enregistré des ventes au Canada à la fin de 2019, ce qui se compare avantageusement aux médianes de l’OCDE (35 %) et du CEPMB11 (38 %).
Figure 3.4 Part des MOMR approuvés par la FDA des États‑Unis, l’EMA ou Santé Canada entre 2015 et 2019 et ayant enregistré des ventes, et leur part respective des ventes par pays de l’OCDE, 2019

Description longue
Il s’agit d’un graphique à barres fractionnées. La partie gauche indique le nombre et la part des 62 nouveaux MOMR qui avaient été approuvés au Canada et dans les 11 pays de comparaison utilisés par le CEPMB (CEPMB11) à la fin de 2019. La partie droite montre la part respective de ces médicaments dans l’ensemble des ventes de l’Organisation de coopération et de développement économiques pour les nouveaux MOMR en 2019. Les résultats pour les États‑Unis et la Suisse sont également indiqués, et les médianes sont présentées pour les pays du CEPMB11, du CEPMB7 et de l’Organisation de coopération et de développement économiques. Les nouveaux MOMR sont ceux qui ont été approuvés pour la première fois par la Food and Drug Administration des États‑Unis, l’Agence européenne des médicaments ou Santé Canada de 2015 à 2019.
| Pays | Nombre de nouveaux MOMR vendus | Part des nouveaux MOMR vendus | Part des ventes totales de nouveaux MOMR au sein de l’Organisation de coopération et de développement économiques |
|---|---|---|---|
Allemagne |
35 |
59 % |
93 % |
Royaume‑Uni |
27 |
46 % |
91 % |
France |
25 |
42 % |
87 % |
Canada |
25 |
42 % |
83 % |
Japon |
21 |
36 % |
79 % |
Italie |
20 |
34 % |
84 % |
Suède |
20 |
34 % |
82 % |
Norvège |
19 |
32 % |
83 % |
Espagne |
18 |
31 % |
81 % |
Belgique |
16 |
27 % |
74 % |
Australie |
10 |
17 % |
72 % |
Médiane du CEPMB11 |
20 |
34 % |
82 % |
États‑Unis |
55 |
93 % |
99 % |
Suisse |
14 |
24 % |
78 % |
Médiane du CEPMB7 |
25 |
42 % |
87 % |
Médiane de l’OCDE |
16 |
27 % |
78 % |
Sources des données : CEPMB; Base de données MIDASMD d’IQVIA, 2015 à 2019 (tous droits réservés).
Détails de la page
- Date de modification :